人肝再生增强因子突变体、基因及应用的制作方法
本发明涉及生物医药技术领域,特别是涉及一种人肝再生增强因子突变体、基因及应用。
背景技术:
以HBV感染为代表的各种慢性肝病,难以有效彻底的治愈,导致各种肝纤维化、肝损伤、肝硬化和肝癌等,是长期以来我国人民健康的沉重负担。
多种动物来源的“促肝细胞生成素”,现在临床上仍然在使用;这类药物,纯度低,杂质多,有效成分不明,临床副反应大。寻求一种能够有效促进肝再生的药物,很有意义。
1994年,Hagiya等人(Hagiya M.et al.,1994,PNAS,91:8142-8146)首先发现了大鼠ALR(肝脏再生增强因子augmenter of liver regeneration)基因。大鼠体内的的ALR,是由两条125个氨基酸多肽链组成的同源二聚体,分子量约30KD。在埃克瘘模型中,大鼠ALR能在体内发挥显著的生物学作用,但在体外不能刺激肝源细胞的增殖。Giorda等人(Giorda R,et al,1996,Mol Med,2:97-108)于1996年克隆了人肝再生增强因子(human augmenter of liver regeneration,hALR)的基因,并发现hLAR在睾丸和肝脏中表达丰度最高。其后,大量的研究表明,体外重组表达的重组人肝脏再生增强因子(recombinant human augmenter of liver regeneration,简称rhALR)的生物活性研究结果表明,rhALR对大鼠实验性肝损伤与肝纤维化有明显的治疗作用。
ALR是一种进化过程中高度保守的蛋白,hALR和酿酒酵母的ERV1有46%的氨基酸序列同源性,而ERV1是一种以FAD为辅基、定位于线粒体内膜空间的氧化还原酶,与线粒体的生成、细胞分裂周期的调节有关。
hALR同样也是一种含FAD的氧化还原酶,其巯基氧化活性与肝脏再生相关。天然的hALR是同源二聚体蛋白,有两种形式:单链125个氨基酸的截短型,定位于细胞核;单链205的氨基酸的全长型,定位于线粒体和胞浆。很多研究结果表明,截短型的hALR(125aa)重组蛋白,即具有显著的促肝细胞生长和肝再生活性。
采用基因工程技术,研制重组人肝脏再生增强因子(recombinant human augmenter of liver regeneration,简称rhALR),则正是一种很有希望的候选药物。
现有技术中,按表达体系分类,rhALR主要是毕赤酵母和大肠杆菌两种表达体系。但大肠杆菌表达体系由于是原核表达系统,在表达真核细胞的蛋白时,在蛋白折叠和翻译后修饰等方面存在缺陷,最终表达的rhALR活性较差。而毕赤酵母表达的rhALR产量低,且不均一,大部分蛋白发生了降解,使N端7个氨基酸残基被切掉了。
授权公告号为CN100339478C的中国发明专利公开了一种肝再生增强因子及其突变体,为同源二聚体蛋白,该蛋白的组成亚基是截短行的hALR(125aa)去除了N端前7个氨基酸残基,即剩下118个氨基酸长度。活性检测发现,该突变体与另一种只在N端7~12个氨基酸残基部分有明显差异的人ALR蛋白(GenBank XM_034465)及该人ALR蛋白第12位精氨酸缺失的突变体,三者的酵母来源产物活性无显著差异。
技术实现要素:
本发明提供了一种人肝再生增强因子突变体,表达时均一性更好,活性显著提高。
人肝再生增强因子突变体,氨基酸序列如SEQ ID No.1所示。
毕赤酵母分泌表达重组蛋白至细胞外,是依赖Kex2酶识别切割KR↓(赖氨酸-精氨酸)序列。所以毕赤酵母表达125aa的截短型hALR时,会造成表达产物不均一,其中大部分被酶切掉了N端的7个氨基酸。而研究发现缺失前7位氨基酸对其活性没有影响。所以现有技术中已经有报道缺失前7位氨基酸的突变体。
考虑到第71位和第72位氨基酸残基也为KR序列,有可能也存在被毕赤酵母中Kex2酶识别切割的可能,所以,本发明中将第71赖氨酸突变成精氨酸(K71R),第72位精氨酸突变为赖氨酸(R72K)。
天然hALR二聚体是通过C15-C124两对二硫键反向组合而成的同源二聚体,同源二聚体活性的产生有可能是两个亚基合作完成,也有可能是两个亚基各有一个独立的活性区域。将hALR(SEQ ID No.4)氨基酸序列中的C15和C124位半胱氨酸均突变为丝氨酸,以消除天然hALR二聚体中的链间二硫键,使获得的重组蛋白能够以单体形式稳定存在。
所以本发明将hALR的N端前7个氨基酸残基删除后,再进行了4个单点突变(C15S、K71R、R72K、C124S)获得一种新的突变体,命名为hALRs,氨基酸序列如SEQ ID No.1所示。经毕赤酵母重组表达获得的该突变体蛋白命名为rhALRs。
本发明又提供了人肝再生增强因子突变体基因,核苷酸序列如SEQ ID No.2所示。
本发明又提供了包含所述人肝再生增强因子突变体基因的重组表达载体。所述重组表达载体的原始载体可以是适合大肠杆菌表达的质粒,也可以是适合真核细胞(如酵母、昆虫细胞、哺乳动物细胞)表达的载体。
本发明又提供了包含所述重组表达载体的宿主生物体。所述重组表达载体的原始载体种类决定了所适用的宿主生物体,可以是原核表达的大肠杆菌,也可以是真核细胞(如酵母、昆虫细胞、哺乳动物细胞)。
优选的,所述宿主生物体为酵母。
更优选的,所述宿主生物体为毕赤酵母。
本发明还提供了所述的宿主生物体在生产重组人肝再生增强因子突变体中的应用。
本发明还提供了一种重组人肝再生增强因子突变体的生产方法,包括以下步骤:
(1)培养所述宿主生物体以表达重组人肝再生增强因子突变体;
(2)培养产物分离纯化获得纯度为医学上可接受的重组人肝再生增强因子突变体,
所述重组人肝再生增强因子突变体为单体形式。
本发明还提供了所述的人肝再生增强因子突变体基因在生产重组人肝再生增强因子突变体中的应用。
本发明还提供了所述人肝再生增强因子突变体在制备预防或治疗肝损伤、肝纤维化、肝衰竭或肝坏死的药物中的应用。
本发明人肝再生增强因子突变体通过将N端7个氨基酸残基删除,然后再进行了4个单点突变(C15S、K71R、R72K、C124S)获得一种新的突变体,该突变体的基因在毕赤酵母中表达获得的突变体蛋白为单体形式存在,更有利于活性中心(C62-C65)和结合在附近的FAD的暴露,实验结果表明其巯基氧化活性提高了20%以上,体外促肝细胞增殖能力和体内四氯化碳肝损伤的保护效果也有所提高,且潜在酶切位点突变掉后,所得产物更加均一,为后续的提取纯化的规模化可操作性提供保障,为开发临床应用提供了可靠基础。
附图说明
图1为实施例1中酵母表达产物初步纯化后电泳图,其中泳道1为样品,泳道2位分子量标记。
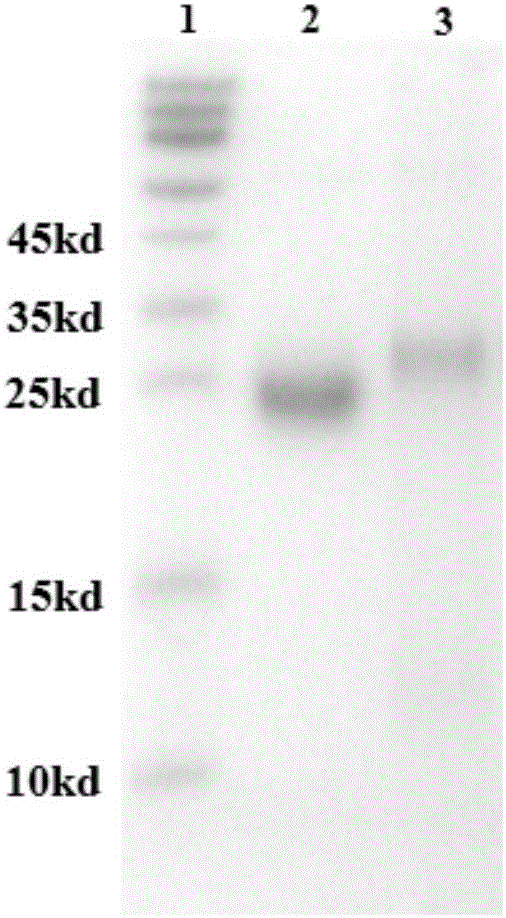
图2为实施例1中纯化后的rhALR和rhALR(Δ1-7)电泳图,其中泳道1为分子量标记,泳道2为rhALR,泳道3为rhALR(Δ1-7)。
图3为实施例2中rhALRs发酵上清液电泳图,其中泳道1为样品,泳道2为分子量标记。
图4为实施例2中rhALRs纯化结果电泳图,其中泳道1为分子量标记,泳道2为离子交换洗脱峰,泳道3为分子筛洗脱峰。
图5为实施例3中氧化还原酶活性测定结果图。
具体实施方式
本发明中所涉及基因合成、克隆、表达、发酵、蛋白提取纯化等实验技术,均可参见科学出版社2002年版、萨姆布洛克等人编著的“分子生物学实验指南”中译本、Invitrogen公司的“毕赤酵母多拷贝表达载体试剂盒”说明书。
实施例1
参照Genebank中CAB87993(http://www.ncbi.nlm.nih.gov/protein/cab87993)所载氨基酸序列(81-205位氨基酸,共125个氨基酸),优化密码子,委托生工生物工程上海公司合成适合于毕赤酵母系统表达的hALR基因(SEQ ID No.3),克隆至pPICZα,构建表达质粒pPICZα-hALR;表达质粒线性化后,电转化毕赤酵母X33,加压后挑取高抗转化子,试管表达筛选获得表达菌株。
采用BSM培养基发酵,OD至6以上开始甲醇诱导,诱导72~96小时后放罐,离心收集上清液。
酵母表达的rhALR,在表达过程中即嵌合了FAD分子,表达产物为天然二聚体,纯化后的蛋白溶液呈透明黄色,说明发酵表达过程中,已经形成了稳定的蛋白-FAD复合体。
但是,酵母表达产物经超滤浓缩和硫铵沉淀初纯后,在SDS-GAGE上呈两个条带(图1),大部分表达蛋白的分子量略低于理论分子量,只有极少量表达产物位于正确的30KD分子量位置。
继续采用阴离子交换层析柱(MonoQ)纯化,先后分别用含300mM盐的PB(pH7.5)和含600mM盐的PB(pH7.5)洗脱,得组分1和组分2;两个组分再分别经HIC疏水层析(Phenyl HIC)和分子筛(Sepharcryl S100)进一步纯化可得两种单一条带的ALR样品(图2)。洗脱产物加入5%甘露醇,BCA法定量后存放于4℃,用于后续实验。
氨基端测序(N端测序)证明,占极少量、位于正确分子量位置的表达产物,氨基末端序列为MRTQQKRDTK,为天然正确序列,命名为rhALR;占大部分、分子量较小、前7个氨基酸缺失的表达产物氨基末端序列为DTKFREDCPP,将这一缺失了前7个氨基酸的重组人肝再生增强因子突变体,命名为rhALR(Δ1-7)。
实施例2
毕赤酵母分泌表达重组蛋白至细胞外,是依赖Kex2酶识别切割KR↓(赖氨酸-精氨酸)序列。所以毕赤酵母表达125aa的截短型hALR时,会造成表达产物不均一,其中大部分被酶切掉了N端的7个氨基酸。而研究发现缺失前7位氨基酸对其活性没有影响。所以现有技术中已经有报道缺失前7位氨基酸的突变体。
考虑到第71位和第72位氨基酸残基也为KR序列,有可能也存在被毕赤酵母中Kex2酶识别切割的可能,所以,本发明中将第71赖氨酸突变成精氨酸(K71R),第72位精氨酸突变为赖氨酸(R72K)。
天然hALR二聚体是通过C15-C124两对二硫键反向组合而成的同源二聚体,同源二聚体活性的产生有可能是两个亚基合作完成,也有可能是两个亚基各有一个独立的活性区域。将hALR(SEQ ID No.4)氨基酸序列中的C15和C124位半胱氨酸均突变为丝氨酸,以消除天然hALR二聚体中的链间二硫键,使获得的重组蛋白能够以单体形式稳定存在。
所以本发明将hALR的N端前7个氨基酸残基删除后,再进行了4个单点突变(C15S、K71R、R72K、C124S)获得一种新的突变体,命名为hALRs,氨基酸序列如SEQ ID No.1所示。对应的基因序列参照Genebank中CAB87993所载氨基酸序列(81-205位氨基酸,共125个氨基酸),进行优化密码子,委托生工生物工程上海公司合成适合于毕赤酵母系统表达的hALRs基因(序列如SEQ ID No.2所示),克隆至pPICZα,构建表达质粒pPICZα-hALRs;表达质粒线性化后,电转化毕赤酵母X33,加压后挑取高抗转化子,试管表达筛选获得表达菌株。采用BSM培养基发酵,OD至6以上开始甲醇诱导,诱导72-96小时后放罐,离心收集上清液;SDS-PAGE显示表达条带均实清晰,表明表达产物结构均一(图3)。
超滤浓缩后硫铵沉淀,沉淀用PB(pH7.5)溶解并透析,得粗提液。
粗提液上阴离子交换层析柱(MonoQ,GE公司),先后分别用含200mM盐的PB(pH7.5)洗涤后,再用含600mM盐的PB(pH7.5)洗脱,得重组表达的hALRs蛋白,命名为rhALRs;再经分子筛(填料Sepharcryl S100)进一步纯化可得单一条带纯蛋白(图4)。
洗脱产物加入5%甘露醇,Bradford法定量后存放于4℃,用于后续实验。
纯化后的蛋白溶液呈透明黄色,说明发酵表达过程中,已经形成了稳定的蛋白-FAD复合体。
实施例3
氧化还原酶活性检测。按文献(Lisowsky T.et al,Digest Liver Dis.,2001,33:173)方法进行。
精确称取谷胱甘肽(GSH)用20mM PB(pH7.5)配制成10mM的GSH母液,精确称取DTNB(5,5'-二硫代双(2-硝基苯甲酸))用水配制成10mM的溶液;酵母表达纯化的rhALR、rhALR(Δ1-7)(实施例1中制备)和rhALRs(实施例2中制备),同样用20mM PB(pH7.5)稀释至1mg/mL。
按表1配制反应体系。
表1 ALR巯基氧化酶活性反应测定
30℃静置反应6小时,加入DTNB 20μL至终浓度20μM,充分混匀,30℃继续反应5分钟,测定412nm下的吸光度。巯基含量按公式计算:巯基(μM)=OD412/13.6。
ALR活性定义:在30℃反应6小时能使GSH巯基含量降低一半(50%),此时每毫升样品中的ALR酶活性为1单位(U)。比活性计算公式为:1/C1/2,单位是U/mg。
结果如图5所示,横坐标为酶(ALR)的浓度,纵坐标为残余巯基数,使用指数拟合曲线,得到rhALR:y=34.035e-48.44x,R2=0.9965;
rhALR(Δ1-7):y=35.943e-48.67x,R2=0.9979;
rhALRs:y=35.843e-64.77x,R2=0.9935。
结果表明:rhALR、rhALR(Δ1-7)和rhALRs氧化50%GSH巯基的浓度分别为0.0160mg/mL、0.0164mg/mL和0.0132mg/mL,比活性分别为62.5U/mg、60.97U/mg、75.8U/mg;相较于rhALR和rhALR(Δ1-7),rhALRs的比活性分别提高了21.3%((75.8-62.5)/62.5)和24.3%((75.8-60.97)/60.97)。
实施例4
体外促肝细胞生长活性。
人肝细胞LH7702,DMEM培养基传代生长,每孔5000细胞种板,24h后换液给药。组别设置为:正常对照组(C+):培养基含10%胎牛血清;营养缺乏组(C-):培养基含5%胎牛血清;各给药组:在含5%胎牛血清的培养基中加入不同浓度(10、1、0.1、0.01、0.001μg/ml)的rhALR、rhALR(Δ1-7)(实施例1中制备)和rhALRs(实施例2中制备),继续培养48小时,MTT染色,测定细胞生长状况。结果如表2所示。
表2:重组人ALR对人肝细胞的生长促进作用(X=Mean±SD,n=8)
注:*表示与C-比较,差异显著(p<0.05);**表示与C-比较,差异极显著(p<0.01)。
结果表明:1)rhALR和rhALRs在试验浓度范围内均能显著促进人肝细胞的增殖,抵御营养胁迫造成的细胞损伤;2)rhALRs的促生长作用稍强于rhALR和rhALR(Δ1-7);3)值得注意,在高浓度下(10μg/mL),反而活性未显示,提示高浓度情况下也许存在细胞毒作用。
实施例5
体内肝损伤修复试验。
供试动物为体重大约25g的Baclb/c小鼠,每组5只。动物腹腔注射10%的CCl410mL/kg制备模型,造模4h后,随即分组开始治疗试验。供试样品为rhALR、rhALR(Δ1-7)(实施例1中制备)和rhALRs(实施例2中制备),剂量设置为100μg/kg、10μg/kg和1μg/kg,每12小时腹腔注射一次,共4次;同时设立腹腔注射生理盐水作为正常对照组。完成治疗后24h处死动物取血,统一用全自动生化仪对血清中的ALT/AST水平进行检测。结果如下表3所示。
表3:重组人ALR对CCl4损伤模型的肝脏保护(ALT/AST,U/L,n=5)
注:*表示与模型组比较,差异显著(p<0.05);**表示与模型组比较,差异极显著(p<0.01)。
结果表明:1)ALR对于CCl4导致的肝脏损伤具有确切的保护作用,与模型组相比较,治疗组ALT和AST的水平大幅显著下降;2)10μg/kg剂量治疗效果已经很显著,再提高治疗剂量(100μg/kg),不再呈现量效关系;3)rhALRs的治疗效果略好于rhALR和rhALR(Δ1-7)。
SEQUENCE LISTING
<110> 安徽新星生物工程有限公司
<120> 人肝再生增强因子突变体、基因及应用
<130>
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 118
<212> PRT
<213> 人工序列
<400> 1
Asp Thr Lys Phe Arg Glu Asp Ser Pro Pro Asp Arg Glu Glu Leu Gly
1 5 10 15
Arg His Ser Trp Ala Val Leu His Thr Leu Ala Ala Tyr Tyr Pro Asp
20 25 30
Leu Pro Thr Pro Glu Gln Gln Gln Asp Met Ala Gln Phe Ile His Leu
35 40 45
Phe Ser Lys Phe Tyr Pro Cys Glu Glu Cys Ala Glu Asp Leu Arg Arg
50 55 60
Lys Leu Cys Arg Asn His Pro Asp Thr Arg Thr Arg Ala Cys Phe Thr
65 70 75 80
Gln Trp Leu Cys His Leu His Asn Glu Val Asn Arg Lys Leu Gly Lys
85 90 95
Pro Asp Phe Asp Cys Ser Lys Val Asp Glu Arg Trp Arg Asp Gly Trp
100 105 110
Lys Asp Gly Ser Ser Asp
115
<210> 2
<211> 357
<212> DNA
<213> 人工序列
<400> 2
gacactaagt tcagagaaga ctctccacca gacagagaag aattgggtag acactcttgg 60
gctgttttgc acactttggc tgcttactac ccagacttgc caactccaga acaacaacaa 120
gacatggctc aattcatcca cttgttctct aagttctacc catgtgaaga atgtgctgaa 180
gacttgagaa gaaaattgtg tagaaaccac ccagacacta gaactagagc ttgtttcact 240
caatggttgt gtcacttgca caacgaagtt aacagaaagt tgggtaagcc agacttcgac 300
tgttctaagg ttgacgaaag atggagagac ggttggaagg acggttcttc tgactaa 357
<210> 3
<211> 378
<212> DNA
<213> 人工序列
<400> 3
atgcggactc agcagaagcg ggacaccaag tttagggagg actgcccgcc ggatcgcgag 60
gaactgggcc gccacagctg ggctgttctt cacaccctgg ccgcctacta ccccgacctg 120
cccaccccag aacagcagca ggacatggcc cagttcatac atttattttc taagttttac 180
ccctgtgagg agtgtgctga agacctaagg aagaggttgt gcaggaacca cccagacacc 240
cgcacccggg catgcttcac gcagtggctg tgccacctgc acaatgaagt gaaccgcaag 300
ctgggcaagc ctgacttcga ctgctcaaag gtggatgagc gctggcgcga cggctggaag 360
gatggctcct gtgactaa 378
<210> 4
<211> 125
<212> PRT
<213> Homo sapiens
<400> 4
Met Arg Thr Gln Gln Lys Arg Asp Thr Lys Phe Arg Glu Asp Cys Pro
1 5 10 15
Pro Asp Arg Glu Glu Leu Gly Arg His Ser Trp Ala Val Leu His Thr
20 25 30
Leu Ala Ala Tyr Tyr Pro Asp Leu Pro Thr Pro Glu Gln Gln Gln Asp
35 40 45
Met Ala Gln Phe Ile His Leu Phe Ser Lys Phe Tyr Pro Cys Glu Glu
50 55 60
Cys Ala Glu Asp Leu Arg Lys Arg Leu Cys Arg Asn His Pro Asp Thr
65 70 75 80
Arg Thr Arg Ala Cys Phe Thr Gln Trp Leu Cys His Leu His Asn Glu
85 90 95
Val Asn Arg Lys Leu Gly Lys Pro Asp Phe Asp Cys Ser Lys Val Asp
100 105 110
Glu Arg Trp Arg Asp Gly Trp Lys Asp Gly Ser Cys Asp
115 120 125
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆威廉姆斯82中NAC膜结合转录因子基因GmNTL1及其应用的制作方法与工艺
- 一种锌指蛋白转录因子基因RkMSN4及其应用的制作方法与工艺
- 三七MYB转录因子基因PnMYB2及其应用的制作方法与工艺
- WRKY转录因子在制备抗逆转基因甜橙中的应用的制造方法与工艺
- 能够提供热耐受性的转录调节因子的表达的制造方法与工艺
- 具有用于舒适性、空间调节和个性化舒适性基因的辅助空气源的空气悬浮座椅的制造方法与工艺
- 一种大豆转录因子GmDISS1及其编码基因与应用的制造方法与工艺
- 一种与棉纤维发育相关的WRKY转录因子基因及其应用的制造方法与工艺
- 一个棉花产量性状关联的乙烯响应转录因子基因的制造方法与工艺
- 一种NF‑Y类核转录因子基因ZmNF‑YA13、其编码的蛋白及其应用的制造方法与工艺