以幽门螺旋杆菌23SrRNA基因的2142位点有突变为模板的阳性质控品的制作方法
本发明涉及分子生物学技术领域,具体涉及一种以幽门螺旋杆菌23S rRNA基因的2142位点有突变为模板的阳性质控品,该阳性质控品用于验证幽门螺旋杆菌耐药基因检测试剂盒在应用于样本检测时样本是否为阳性的辅助判断。
背景技术:
质控品是指用于体外诊断的质量控制物质,其具有已知浓度含量的目标检测物,为使人们确信某一产品或服务质量能满足规定的质量要求所必须的产品。质控品的使用目的是为了验证整个PCR反应过程具有准确性、有效性和特异性,并监控检测系统的状态。仪器在正式投入使用后,应定期对其校准,避免由于仪器原因导致的实验偏差。再次,在收到每批新试剂后,应首先对其进行预实验,确证新试剂质量后,再用于对临床标本的检测。
但是据申请人了解,目前在检测突变型幽门螺杆菌23S rRNA基因质量控制方面没有阳性质控品。
技术实现要素:
本发明旨在提供一种以幽门螺旋杆菌23S rRNA基因的2142位点有突变为模板的阳性质控品,用于验证被检样本中幽门螺杆菌23S rRNA基因2142位点是否突变这一检测结果是否准确,解决了幽门螺杆菌23S rRNA基因的质量检测问题。
为达到上述目的,本发明采用的技术方案是:一种以幽门螺旋杆菌23S rRNA基因的2142位点有突变为模板的阳性质控品,该阳性质控品是一种以碱基序列为主要成分的试剂,该碱基序列包含幽门螺旋杆菌的23S rRNA基因2142位点有突变的基因片段,该基因片段为5’-GTCGGTTAAATACCGACCTGCATGAATGGCGTAACGAGATGGGAGCTGTCTCAACCAGAGATTCAGTGAAATTGTAGTGGAGGTGAAAATTCCTCCTACCCGCGGCAAGACGGGAAGACCCCGTGGACCTTTACTACAACTTAGCACTGCTAATGGGAATATCATGCGCAGGATAGGTGGGAGGCTTTGAAGTAAGGGCTTTGGCTCTTATGGAGCCATCCTTGAGATACCACCCTTGAT-3’,其中,带有下划线的碱基位点是幽门螺旋杆菌的23S rRNA基因的2142位点,用于表征2142变异型的幽门螺旋杆菌的23S rRNA基因的位点。
上述技术方案中的有关内容解释如下:
1、上述方案中,所述阳性质控品中还含有缓冲试剂,该缓冲试剂为pH 为7.6的Tris-Hcl缓冲液、纯化水以及pH 为8.0的TE缓冲液中的任意一种。
2、上述方案中,所述阳性质控品中含有的幽门螺旋杆菌23S rRNA基因2142位点有突变的基因序列是构建到质粒载体上保存,根据现有技术即可得到,质粒构建过程如下:
引物设计——pcr扩增——割胶回收DNA片段——构建载体——转化培养——阳性克隆鉴定——37℃摇床培养——质粒抽提——测序确认碱基序列。
抽提后的质粒再配制成所述阳性质控品,配制方法如下:
(1)配制稀释液:加入50%配方量的纯化水→加入Tris-Hcl缓冲液(pH7.6)→加入剩余的纯化水(涡旋震荡3次,每次5秒)→得0.002mol/L的Tris-HCl(pH 7.6)稀释液;
(2)HP质粒(2142位点突变)预稀释:加入50%配方量的稀释液→加入HP质粒(2142位点突变)溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到X拷贝/微升HP质粒(2142位点突变)溶液;
(3)得到阳性质控品:加入50%配方量的稀释液→加入X拷贝/微升HP质粒(2142位点突变)溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到阳性质控品。
本发明的特点以及有益效果是:所述阳性质控品实质是事先设计好的、当做已知浓度及碱基序列的样本,和其他被检样本(例如胃粘膜组织、胃液或牙菌斑)一起利用相关的幽门螺旋杆菌23S rRNA基因检测试剂盒进行检测,从而验证被检样本检测结果的准确性。也就是说,在利用幽门螺旋杆菌23S rRNA基因检测试剂盒检测被检样本时,本发明的阳性质控品相当于是一种已知浓度的阳性样本,用于验证幽门螺旋杆菌23S rRNA基因检测试剂盒的检测结果(即幽门螺杆菌23S rRNA基因上第2142位点变异这一检测结果)是否真实、有效,解决了幽门螺杆菌23S rRNA基因的质量检测问题。
附图说明
附图1为幽门螺旋杆菌菌群阳性及23S rRNA基因2142和2143位点无突变时的荧光定量PCR扩增熔解曲线图;
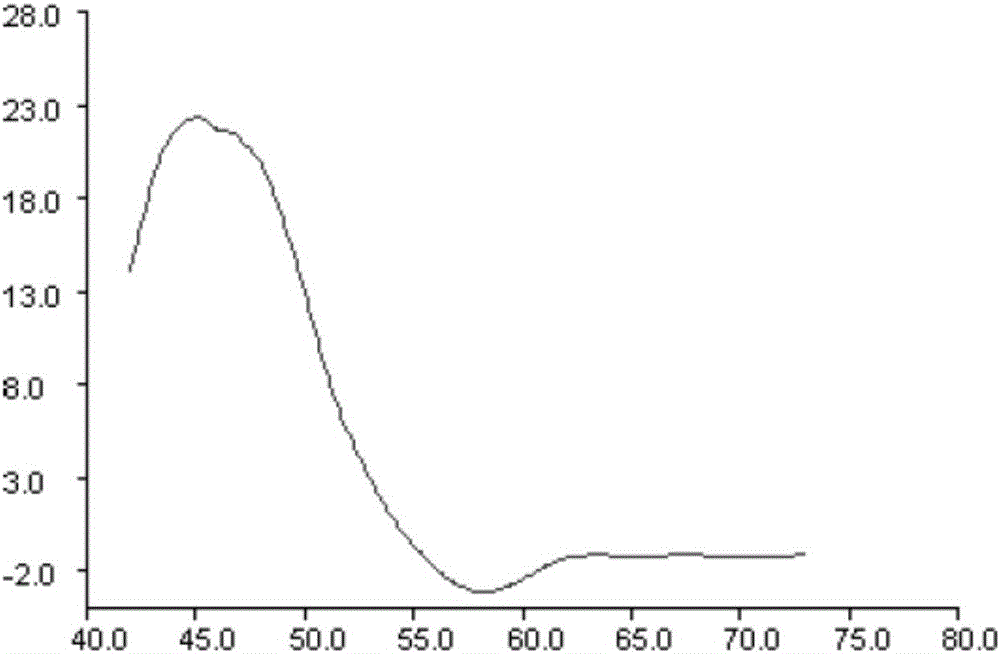
附图2为幽门螺旋杆菌菌群阳性及23S rRNA基因2142位点有突变时的荧光定量PCR扩增熔解曲线图;
附图3为幽门螺旋杆菌菌群阳性及23S rRNA基因2143位点有突变时的荧光定量PCR扩增熔解曲线图;
附图4为幽门螺旋杆菌菌群阴性时的荧光定量PCR扩增熔解曲线图;
附图5为内部质控品的荧光定量PCR扩增熔解曲线图。
具体实施方式
下面结合附图及实施例对本发明作进一步描述:
实施例:一种以幽门螺旋杆菌23S rRNA基因的2142位点有突变为模板的阳性质控品
阳性质控品1是一种以碱基序列为主要成分的试剂,该碱基序列包含野生型幽门螺旋杆菌的23S rRNA基因片段,所述野生型幽门螺旋杆菌的23S rRNA基因片段为5’-GTCGGTTAAATACCGACCTGCATGAATGGCGTAACGAGATGGGAGCTGTCTCAACCAGAGATTCAGTGAAATTGTAGTGGAGGTGAAAATTCCTCCTACCCGCGGCAAGACGGAAAGACCCCGTGGACCTTTACTACAACTTAGCACTGCTAATGGGAATATCATGCGCAGGATAGGTGGGAGGCTTTGAAGTAAGGGCTTTGGCTCTTATGGAGCCATCCTTGAGATACCACCCTTGAT-3’(如SEQ NO:4所示),其中,带有下划线的碱基位点从左到右分别是野生型幽门螺旋杆菌的23S rRNA基因的2142和2143位点,所述2142或/和2143位点用于表征野生型幽门螺旋杆菌的23S rRNA基因可突变为变异型幽门螺旋杆菌的23S rRNA基因的位点。所述阳性质控品1中还含有缓冲试剂,该缓冲试剂为pH 为7.6的Tris-HCl缓冲液。
阳性质控品2是一种以碱基序列为主要成分的试剂,该碱基序列包含幽门螺旋杆菌的23S rRNA基因2142位点有突变的基因片段,该基因片段为5’-GTCGGTTAAATACCGACCTGCATGAATGGCGTAACGAGATGGGAGCTGTCTCAACCAGAGATTCAGTGAAATTGTAGTGGAGGTGAAAATTCCTCCTACCCGCGGCAAGACGGGAAGACCCCGTGGACCTTTACTACAACTTAGCACTGCTAATGGGAATATCATGCGCAGGATAGGTGGGAGGCTTTGAAGTAAGGGCTTTGGCTCTTATGGAGCCATCCTTGAGATACCACCCTTGAT-3’(如SEQ NO:5所示),其中,带有下划线的碱基位点是幽门螺旋杆菌的23S rRNA基因的2142位点,用于表征2142变异型的幽门螺旋杆菌的23S rRNA基因的位点。所述阳性质控品2中还含有缓冲试剂,该缓冲试剂为pH 为7.6的Tris-HCl缓冲液。
阳性质控品3是一种以碱基序列为主要成分的试剂,该碱基序列包含幽门螺旋杆菌的23S rRNA基因2143位点有突变的基因片段,该基因片段为5’-GTCGGTTAAATACCGACCTGCATGAATGGCGTAACGAGATGGGAGCTGTCTCAACCAGAGATTCAGTGAAATTGTAGTGGAGGTGAAAATTCCTCCTACCCGCGGCAAGACGGAGAGACCCCGTGGACCTTTACTACAACTTAGCACTGCTAATGGGAATATCATGCGCAGGATAGGTGGGAGGCTTTGAAGTAAGGGCTTTGGCTCTTATGGAGCCATCCTTGAGATACCACCCTTGAT-3’(如SEQ NO:6所示),其中,带有下划线的碱基位点是幽门螺旋杆菌的23S rRNA基因的2143位点,用于表征2143变异型的幽门螺旋杆菌的23S rRNA基因的位点。所述阳性质控品3中还含有缓冲试剂,该缓冲试剂为pH 为7.6的Tris-HCl缓冲液。
所述阳性质控品1、阳性质控品2、阳性质控品3作为幽门螺旋杆菌23S rRNA基因检测试剂盒中的一部分。
在本实施例中,幽门螺旋杆菌及其耐药基因突变检测试剂盒包括KOD DNA 聚合酶、引物HPC-F、引物HPC-R、特异性靶向荧光探针、所述阳性质控品1、阳性质控品2以及阳性质控品3;
所述引物HPC-F为针对幽门螺旋杆菌23S rRNA基因设计的正向引物,该正向引物的序列为5’-GTGGAGGTGAAAATTCCTCCTACCC-3’(如SEQ NO:1所示);
所述引物HPC-R为针对幽门螺旋杆菌23S rRNA基因设计的反向引物,该反向引物的序列为5’-GGCTCCATAAGAGCCAAAGCCCTTAC-3’(如SEQ NO:2所示);
所述特异性靶向荧光探针是以幽门螺旋杆菌23S rRNA野生型基因组为模板设计的探针,其碱基序列为5’- CAAGACGGAAAGACCC -3’ (如SEQ NO:3所示),荧光染料为氟硼二吡咯;
所述试剂盒还包括内部质控引物IC-F、内部质控引物IC-R、内部质控探针以及内部质控模板;
所述内部质控引物IC-F是针对Lagarosiphon madagascariensis的matK基因设计的正向引物,该正向引物的序列为5’-CCCGGTTATTGTAGAAATTCCTTTCTCCCGTC-3’ (如SEQ NO:7所示);
所述内部质控引物IC-R是针对Lagarosiphon madagascariensis的matK基因设计的反向引物,该反向引物的序列为5’-CCCCATCCAGGATTGTAGAATTTGAATCAAG-3’(如SEQ NO:8所示);
所述内部质控探针是以Lagarosiphon madagascariensis的matK基因为模板而设计的探针,该探针的序列为5’-GATCTATTCATTCGATATTCC-3’(如SEQ NO:9所示);
所述内部质控模板为Lagarosiphon madagascariensis的matK基因的一个片段,内部质控模板的序列为5’-GCGGTTATTGTAGAAATTCCTTTCTCCCGTCCATTTTTTCTTGAAGAAAAAAAAGAAATACCAAAATATCAAAATTTACGATCTATTCATTCGATATTCCCTTTTTTAGAGGACAAATTTTTACATTTAAATTATGTGTCTGATATAGTAATACCTTATCCTATTCATCTCGAAATCTTGATTCAAATTCTACAATCCTGGAT-3’(如SEQ NO:10所示)。
所述内部质控引物IC-F、内部质控引物IC-R、内部质控探针以及内部质控模板用于验证所述试剂盒在检测幽门螺旋杆菌耐药基因突变时是否真实、有效,参见附图5所示。
在实际生产中,所述幽门螺旋杆菌及其耐药基因突变检测试剂盒可以做成包含下列组分的试剂盒:
(1)聚合酶试剂 [ KOD Mix ]:由KOD DNA 聚合酶和dNTP组成,规格为140μL×1支、140μL×2支、140μL×3支或140μL×6支;
(2)引物・探针试剂 [ HPC Mix ]:即由引物HPC-F、引物HPC-R以及特异性靶向荧光探针组成的混合试剂,规格为140μL×1支、140μL×2支、140μL×3支或140μL×6支;
(3)阳性质控品1 [ HPC PC1 ]:规格为300μL×1支;
(4)阳性质控品2 [ HPC PC2 ]:规格为300μL×1支;
(5)阳性质控品3[ HPC PC2 ]:规格为300μL×1支;
(6)阴性质控品[ HPC NC ]:即为不含有DNA的缓冲液,规格为300μL×1支;
阳性质控品1、阳性质控品2、阳性质控品3中含有的基因序列均是构建到载体质粒上保存。质粒构建过程如下:
引物设计——pcr扩增——割胶回收DNA片段——构建载体——转化培养——阳性克隆鉴定——37℃摇床培养——质粒抽提——测序确认碱基序列。
抽提后的质粒再配制成所述阳性质控品1,配制方法如下:
(1)配制稀释液:加入50%配方量的纯化水→加入Tris-Hcl缓冲液(pH7.6)→加入剩余的纯化水(涡旋震荡3次,每次5秒)→得0.002mol/L的Tris-HCl(pH 7.6)稀释液;
(2)HP野生型质粒预稀释:加入50%配方量的所述稀释液→加入HP野生型质粒溶液→加入剩余的所述稀释液(涡旋震荡3次,每次5秒)→得到X拷贝/微升HP野生型质粒溶液(X代表什么);
(3)得到阳性质控品1:加入50%配方量的稀释液→加入X拷贝/微升HP野生型质粒溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到阳性质控品。
抽提后的质粒再配制成所述阳性质控品2,配制方法如下:
(1)配制稀释液:加入50%配方量的纯化水→加入Tris-Hcl缓冲液(pH7.6)→加入剩余的纯化水(涡旋震荡3次,每次5秒)→得0.002mol/L的Tris-HCl(pH 7.6)稀释液;
(2)HP质粒(2142位点突变)预稀释:加入50%配方量的稀释液→加入HP质粒(2142位点突变)溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到X拷贝/微升HP质粒(2142位点突变)溶液;
(3)得到阳性质控品2:加入50%配方量的稀释液→加入X拷贝/微升HP质粒(2142位点突变)溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到阳性质控品2。
抽提后的质粒再配制成所述阳性质控品3,配制方法如下:
(1)配制稀释液:加入50%配方量的纯化水→加入Tris-Hcl缓冲液(pH7.6)→加入剩余的纯化水(涡旋震荡3次,每次5秒)→得0.002mol/L的Tris-HCl(pH 7.6)稀释液;
(2)HP质粒(2143位点突变)预稀释:加入50%配方量的稀释液→加入HP质粒(2143位点突变)溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到X拷贝/微升HP质粒(2143位点突变)溶液;
(3)得到阳性质控品3:加入50%配方量的稀释液→加入X拷贝/微升HP质粒(2143位点突变)溶液→加入剩余的稀释液(涡旋震荡3次,每次5秒)→得到阳性质控品3。
检测方法包括以下步骤:
第一步,准备目标物,以目标物作为检测的对象,目标物为不经任何处理的被检样本或者为从被检样本中提取的幽门螺旋杆菌核酸,所述被检样本为人的胃粘膜组织,被检样本可直接上机进行检测。直接使用胃粘膜组织时,避免使用含血多的样本。如果使用血液成分含量多,或者肝素含量多的样本,请注意充分去除血液以及肝素成分。血液成分或肝素残存的情况下,会对PCR扩增反应有影响,不能正常检测。需要保存样本时,请保存在-80℃以下。使用长期冻存的样本时,务必恢复到室温后再使用。
第二步,以所述被检样本为模板基因链,利用所述试剂盒进行荧光定量PCR扩增反应,荧光定量PCR扩增反应的13.2μL反应体系为:
引物HPC-F 0.1umol/L,0.52μl;
引物HPC-R 0.1umol/L,0.52μl;
特异性靶向荧光探针 0.1umol/L,0.4μl;
内部质控引物IC-F 0.1umol/L,0.52μl;
内部质控引物IC-R 0.1umol/L,0.52μl;
内部质控探针 0.1umol/L,0.4μl;
内部质控模板 4ng/ul,1.8μl;
MgCl2*6H2O 0.35g/L,0.52μL;
dNTPs 0.02mM,0.4μL;
KOD DNA 聚合酶 0.02U/ul,0.4μl;
KOD buffer 3.2μl;
模板 4μl;
所述荧光定量PCR扩增反应的反应过程包括:
(1)94.0℃预变性30.0秒,
(2)97.0℃变性1.0秒,
(3)60.0 ℃退火3.0秒,
(4)63.0 ℃延伸 5.0秒,其中,步骤(2)~(4)循环50次。
第三步,用高分辨率熔解曲线法进行检出,检出条件依次为:
(1)94.0 ℃,30.0秒,
(2)39.0 ℃,30.0秒,
(3)40.0~75.0℃,0.09℃/秒;
整个荧光定量PCR扩增反应直接在全自动基因分析仪GENECUBE(生产商为TOYOBO)上进行。具体步骤为:将被检样本4μL、聚合酶试剂[KOD Mix]4μL、引物・探针试剂[HPC Mix]5.2μL混合后,调制成反应液。专用吸管吸取反应液到专用塑料毛细管中。进行扩增反应。进行检出,测定波长为510nm~550nm以及573nm~613nm的荧光值。测定的荧光值由专用分析软件解析,转换成表示荧光变化量的荧光微分值。解析荧光微分值,在显示屏上显示测定结果。
第四步,检出结果通过阳性判断值来判断,阳性判断值的三种结果的判断依据为:
(1)幽门螺旋杆菌菌群阳性及23S rRNA基因2142和2143位点无突变:荧光微分值≥10,并且熔解曲线峰值所在的熔解温度在50℃~60℃之间,参见附图1所示;
(2)幽门螺旋杆菌菌群阳性及23S rRNA基因2142或2143位点有突变:荧光微分值≥10,并且熔解曲线峰值所在的熔解温度在42℃~50℃之间,参见附图2和附图3所示;
(3)幽门螺旋杆菌菌群阴性:无荧光微分值,内部质控荧光微分值≥1.0,且其熔解曲线峰值所在的熔解温度在42℃~68℃之间,参见附图4所示;
所述荧光微分值是指对检测到的目标物的荧光强度随温度变化的值做微分求导,得到荧光微分值。
只有当附图5的熔解曲线中内部质控荧光微分值≥1.0,且其熔解曲线峰值所在的熔解温度在42℃~68℃之间时,表明整个检测系统是正常、有效的,特别对于判断结果为阴性时尤其重要。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
SEQUENCE LISTING
<110> 踏石生物科技(苏州)有限公司
<120> 幽门螺旋杆菌耐药基因突变检测试剂盒及其检测方法
<130>
<160> 10
<170> PATENTIN VERSION 3.5
<210> 1
<211> 25
<212> DNA
<213> 人工序列
<400> 1
gtggaggtgaaaattcctcctaccc 25
<210> 2
<211> 26
<212> DNA
<213> 人工序列
<400> 2
ggctccataagagccaaagcccttac 26
<210> 3
<211> 16
<212> DNA
<213> 人工序列
<400> 3
caagacggaaagaccc 16
<210> 4
<211> 240
<212> DNA
<213> 人工序列
<400> 4
gtcggttaaataccgacctgcatgaatggcgtaacgagatgggagctgtctcaaccagagattcagtgaaattgtagtggaggtgaaaattcctcctacccgcggcaagacggaaagaccccgtggacctttactacaacttagcactgctaatgggaatatcatgcgcaggataggtgggaggctttgaagtaagggctttggctcttatggagccatccttgagataccacccttgat
240
<210> 5
<211> 240
<212> DNA
<213> 人工序列
<400> 5
gtcggttaaataccgacctgcatgaatggcgtaacgagatgggagctgtctcaaccagagattcagtgaaattgtagtggaggtgaaaattcctcctacccgcggcaagacgggaagaccccgtggacctttactacaacttagcactgctaatgggaatatcatgcgcaggataggtgggaggctttgaagtaagggctttggctcttatggagccatccttgagataccacccttgat
240
<210> 6
<211> 240
<212> DNA
<213> 人工序列
<400> 6
gtcggttaaataccgacctgcatgaatggcgtaacgagatgggagctgtctcaaccagagattcagtgaaattgtagtggaggtgaaaattcctcctacccgcggcaagacggagagaccccgtggacctttactacaacttagcactgctaatgggaatatcatgcgcaggataggtgggaggctttgaagtaagggctttggctcttatggagccatccttgagataccacccttgat
240
<210> 7
<211> 32
<212> DNA
<213> 人工序列
<400> 7
cccggttattgtagaaattcctttctcccgtc 32
<210> 8
<211> 31
<212> DNA
<213> 人工序列
<400> 8
ccccatccaggattgtagaatttgaatcaag 31
<210> 9
<211> 21
<212> DNA
<213> 人工序列
<400> 9
gatctattcattcgatattcc 21
<210> 10
<211> 203
<212> DNA
<213> 人工序列
<400> 10
gcggttattgtagaaattcctttctcccgtccattttttcttgaagaaaaaaaagaaataccaaaatatcaaaatttacgatctattcattcgatattcccttttttagaggacaaatttttacatttaaattatgtgtctgatatagtaataccttatcctattcatctcgaaatcttgattcaaattctacaatcctggat 203
- 还没有人留言评论。精彩留言会获得点赞!