一种抗衰老液的制备方法及其应用与流程
本发明属于干细胞抗衰老领域,涉及一种间充质干细胞条件培养基抗衰老液的制备方法及其应用。
背景技术:
随着人口老龄化问题的日益突出,抗衰老领域成为全球关注的焦点。皮肤是人体最大的器官,担负着保护、感觉、调节体温、分泌、排泄和免疫等诸多方面的作用,但随着年龄的增长,皮肤会发生退行性变,皮肤变薄、含水量减少、弹性消退、萎缩、起皱。皱纹、老年斑等临床症状的出现,使人意识到自己开始衰老,这对人们的生活、工作有着复杂的心理与生理影响,它可以引发焦虑、抑郁、自卑等一系列的心理问题。因此,抗衰老治疗,尤其是对皮肤的抗衰老治疗成为研究的焦点之一,人们希望通过抗衰老治疗来改善和提高生活质量。
皮肤衰老是一个漫长而复杂的演变过程。内在因素表现为,例如随着年龄增加细胞端粒逐渐缩短,而有氧细胞代谢所引起的氧化损伤却逐渐增多。具体表现为皮肤表皮层和真皮层变薄、血管壁变薄、真皮层成纤维细胞数量减少和功能紊乱、胶原纤维合成速度逐渐减慢。外在因素包括生活方式、营养状况、环境因素等。其中,日光中紫外线所引起的光损伤(photodamage)是导致皮肤衰老的主要环境因素。随着生活水平的提高,和现代生物及医学的飞速发展,尤其是干细胞技术的出现,通过活化皮肤细胞、促进皮肤干细胞增殖、分化,修复或替代衰老的皮肤细胞,最终从根本上改变皮肤的生理机能变为可能。
在当前的护肤美容行业中,传统的化学美容、物理美容已经不能满足需求,细胞因子美容以其功效显著、效果持久受到越来越多的关注。间充质干细胞(mesenchymalstemcell,mscs)是干细胞家族的重要成员,因其具有多向分化潜能、自我更新能力,以及分泌多种因子参与损伤的组织与器官的修复与再生而被广泛应用于多种疾病的治疗。间充质干细胞在生长过程中能产生各种生物活性物质,如神经生长因子、基质红细胞源性生长因子、血管内皮细胞生长因子、表皮生因子、白细胞介素-6、白细胞介素-7、巨核细胞集落刺激因子、肿瘤坏死因子、干扰素等。目前的研究认为,这些生物活性物质使间充质干细胞具有免疫调节、降低炎症的功能,从而对受体组织和器官进行调节控制,并达到对其进行生理性修复和再生等作用。干细胞分泌的这些细胞生长因子能激活机体整体上处于休眠状态下的各种细胞群,以替代更新原有的因衰老或病理性等因素所造成组织细胞的衰退和老化,达到组织器官功能的恢复,增强组织器官的活性和原有的抗耐受力,改善因衰老等因素所造成的细胞与细胞间、细胞与细胞外基质间的信息传递,增强和加快各组织细胞的新老更替等作用。脐带来源的msc(uc-msc),是非侵入性收获程序所需的,满足msc的标准,并且表现出比来自其他来源的msc更显著的细胞因子分泌概况。ucmscs效能的治疗机制主要取决于它们的旁分泌活性,所有的msc分泌物中的生物活性因子和细胞因子可以在条件培养基中收集。累积的证据表明msc条件培养基具有与msc相似的治疗效果。
本发明进行深入研究,对mscs进行处理,得到一种高糖负反馈调节激活了的间充质干细胞条件培养基,用来治疗细胞的衰老和氧化。
技术实现要素:
针对现有的msc-cm延缓衰老效果不是很好的问题,本发明提供了一种抗衰老液的制备方法及其应用。
为实现上述发明目的,本发明采用下述技术方案予以实现:
一种抗衰老液,其为高浓度葡萄糖溶液激活的间充质干细胞条件培养基。
进一步的,所述葡萄糖终浓度为20~50mmol/l。
所述间充质干细胞为脐带间充质干细胞。
一种抗衰老液的制备方法,其包括的步骤为a)将分离提取的间充质干细胞在无血清培养基中培养至融合达40~50%的单层细胞;b)在步骤a)所述的单层细胞中加入终浓度20~50mmol/l的葡萄糖溶液;c)继续培养48±2小时后,收集所述间充质干细胞条件培养基,并浓缩纯化而制成。
进一步的,所述步骤c)中,2000rpm离心5分钟收集所述间充质干细胞条件培养基,然后使用截留分子量为5kda的超滤膜将所述条件培养基浓缩10倍。
所述间充质干细胞为脐带间充质干细胞。
本发明中任一抗衰老液可用于治疗细胞衰老和抗氧化。
本发明中任一抗衰老液可用于皮肤修复。所述抗衰老液可作为活性成分添加到护肤品或化妆品中。
本发明的有益效果:
本发明的优点和积极效果是:间充质干细胞条件培养基含有大量细胞所需的生长因子,本发明的高浓度葡萄糖溶液激活的间充质条件培养基能够有效的降低细胞中ros的产生,延缓细胞的衰老。本发明的高糖激活的间充质干细胞条件培养基免疫原性低,无需匹配供体和受体之间的白细胞抗原,且可以制成冻干粉,更易于大量生产和保存。
详细描述:
皮肤是人体最大的器官,是机体最外观的表现。皮肤是由三部分组成:表皮层、真皮层以及角质层组成,而表皮层和真皮层是由结缔组织细胞---成纤维细胞构成。成纤维细胞的衰老会使表皮和真皮的功能紊乱,从而导致色斑以及皱纹的产生。本发明中,采用成纤维细胞作为试验细胞,验证本发明的抗衰老液对皮肤的主要组成部分---成纤维细胞的效应。
糖代谢调节障碍和血糖升高是糖尿病的主要病因。大量的证据表明高糖诱导的氧化应激形成与各种细胞的衰老密切相关,如角质形成细胞,内皮细胞和成纤维细胞。例如,高血糖诱导的活性氧(ros)的产生加速了内皮细胞端粒长度的缩短。来自糖尿病受试者的皮肤成纤维细胞的复制寿命减少。氧化应激和衰老与慢性伤口的发展病理性相关。本发明采用高浓度葡糖糖刺激成纤维细胞模拟衰老细胞。
活性氧(ros)的检测方法
增加的ros产生是糖尿病的标志(lamersml,almeidame,vicente-manzanaresm,horwitzaf,santosmf.highglucose-mediatedoxidativestressimpairscellmigration.plosone2011;6:e22865.)。本试验中ros的产生采用活性氧检测试剂盒(reactiveoxygenspeciesassaykit),它是一种基于荧光染料dcfh-da(2,7-dichlorodi–hydrofluoresceindiacetate)的荧光强度变化,定量检测细胞内活性氧水平的最常用方法。
dcfh-da本身没有荧光,可以自由穿过细胞膜。进入细胞内后,可以被细胞内的酯酶水解生成dcfh。而dcfh不会通透细胞膜,因此探针很容易被积聚在细胞内。细胞内的活性氧能够氧化无荧光的dcfh生成有荧光的dcf。绿色荧光强度与活性氧的水平成正比。在最大激发波长480nm,最大发射波长525nm处,使用荧光显微镜,流式细胞仪或激光共聚焦显微镜等检测荧光信号。dcfh阳性细胞越多,说明细胞内活性氧水平越高。
衰老细胞的检测方法
细胞衰老与细胞周期蛋白依赖性激酶抑制剂(p16和p21)的上调以及sa-β-gal活性的出现相关[hayflickl.livingforeveranddyingintheattempt.expgerontol2003;38:1231–41.]。本试验中采用β-半乳糖苷酶染色试剂盒(senescenceβ-galactosidasestainingkit),其是一种基于衰老时sa-β-gal(senescence-associatedβ-galactosidase)活性水平上调而对衰老细胞或组织进行染色检测的试剂盒。β-半乳糖苷酶染色试剂盒以x-gal为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物,光学显微镜下很容易观察到变成蓝色的表达β-半乳糖苷酶的细胞或组织。在普通的光学显微镜下就可以观测到细胞或组织的衰老情况。
绝大多数正常细胞被认为仅有有限的分裂能力,在不能分裂后就进入衰老(senescence)状态。此时细胞仍然是存活的,但细胞的基因和蛋白的表达谱发生了很大改变。衰老的细胞不能在一些常规的刺激下再诱导细胞分裂,并且衰老细胞的细胞周期分布也比较特殊,不同于一些损伤诱导的细胞休眠,也不同于细胞生长接触抑制的情况。衰老细胞通常体积变大,表达ph6.0时有高酶活性的β-半乳糖苷酶。
附图说明:
图1.为dcfh-da荧光染色显微检测的高糖溶液处理的成纤维细胞的结果。a.显微镜检测的dcfh阳性细胞的照片,b.dcfh阳性细胞率;con表示对照,hg1-3d表示26mmol/l葡萄糖处理3天,hg2-3d表示30mmol/l葡萄糖处理3天。
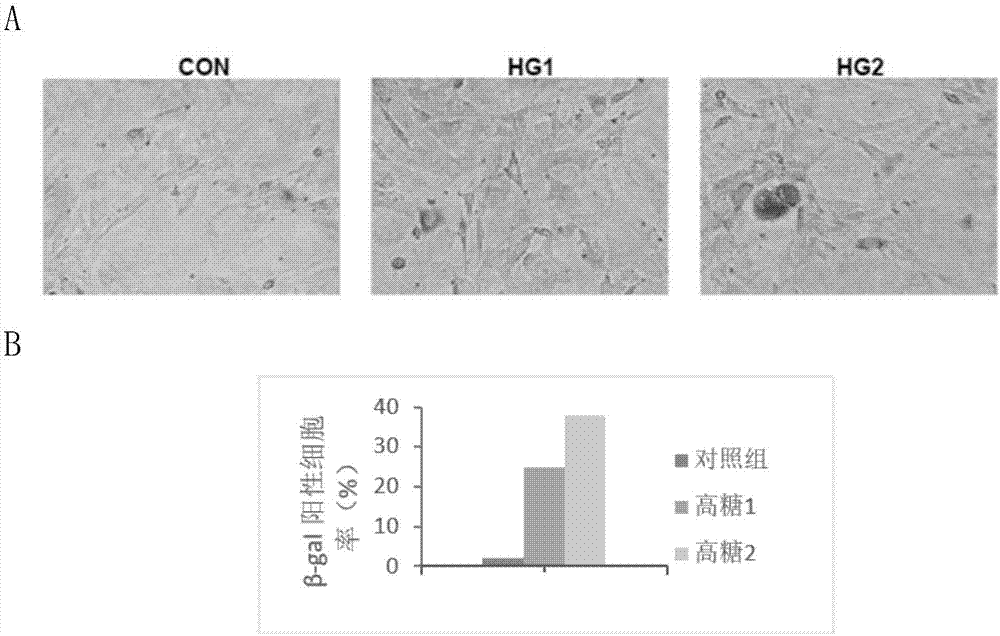
图2.为sa-β-gal试剂盒检测的高糖溶液处理的成纤维细胞内sa-β-gal的活性结果。a.显微镜检测的染色照片,b.β-gal阳性细胞率;con表示对照,hg1表示26mmol/l葡萄糖处理组,hg2表示30mmol/l葡萄糖处理组。
图3.为免疫印迹法分析的高糖溶液处理的成纤维细胞内p53、p21和p16的表达水平。
图4.为dcfh-da荧光染色显微检测的抗衰老液预处理的成纤维细胞结果。a.显微镜检测的dcfh阳性细胞的照片,b.dcfh阳性细胞率;cm1表示1%的脐带间充质干细胞条件培养基,cm2表示5%的脐带间充质干细胞条件培养基,cm0为5%的未处理过的脐带间充质干细胞条件培养基,“--”表示没有添加。
图5.为sa-β-gal试剂盒检测的抗衰老液预处理的成纤维细胞内sa-β-gal的活性结果。a.显微镜检测的染色照片,b.β-gal阳性细胞率。
图6.为免疫印迹法分析的抗衰老液预处理的成纤维细胞内p53、p21和p16的表达水平。
具体实施方式
下面以具体实施方式对发明作进一步详细说明
本发明参照特定的实施例进行了描述,但是,很显然仍可以做出各种修改和变换而不违背本发明的精神和范围。因此,本发明的说明书和附图应该认为是说明性的而非限制性的。
实施例1.间充质干细胞的制备
脐带间充质干细胞的制备:
在超净工作台中进行操作,取新鲜足月健康胎儿脐带,用含2倍100u/ml青霉素和链霉素的生理盐水冲洗去除血渍,将华尔通氏胶剥离,剪成1立方毫米以下块状,均匀涂布,缓慢加入10ml无血清培养基,置37℃、体积分数为5%的二氧化碳、饱和湿度培养箱中培养。将原代细胞培养7天后,更换无血清培养液,培养至细胞达到70%的融合,移去无血清培养液,添加浓度分别为0.25%和0.1%的胰蛋白酶-乙二胺四乙酸钠(edta)消化1min,脐带msc收缩脱离瓶壁,此时加入先前移去的培养上清液,中和胰蛋白酶-edta溶液,并使用移液管轻轻吹打,将脐带msc悬液移入50ml离心管。1000rpm离心8min,去除上清液;重新加入无血清完全培养基将msc重悬,并计数。按照1传1.5接种10cm培养皿。msc培养融合70%左右时参照上述方法传代培养。
实施例2.抗衰老液即高糖激活的间充质干细胞条件培养基的制备
将实施例1制备的脐带msc的第3代细胞在含有10%fbs的dmem/f12中培养至40~50%单层细胞时,加入葡萄糖溶液,葡萄糖终浓度为20~50mmol/l,然后继续在含有10%fbs的dmem/f12中连续培养48±2小时。2000rpm离心5分钟收集培养上清液即条件培养基,作为脐带msc-cm(uc-msc-cm),使用截留分子量为5kda的超滤膜将所述条件培养基进一步浓缩10倍,得到高糖激活的间充质干细胞条件培养基,即抗衰老液。
将浓缩的抗衰老液通过0.2μm过滤器过滤并储存在-80℃直至使用。
实施例3.成纤维细胞的培养
通过常规包皮环切术收集包皮(ff)样本。收集的包皮样品用补充有1%青霉素-链霉素溶液(ps)的磷酸盐缓冲盐水(pbs)洗涤。然后将所有样品切成小块,并在i型胶原酶(sigma)中在37℃温育1小时。终止消化,收集上清液用于离心。将细胞沉淀轻轻地重悬浮于含有10%胎牛血清(fbs)的dmem中,每两天释放培养基。
实施例4.抗衰老液即高糖激活的间充质干细胞条件培养基的功能验证
一、成纤维细胞的处理:
皮下组织中的葡萄糖浓度与血浆中的葡萄糖浓度相似,约为6mmol/l。许多研究采用26mmol/l葡萄糖模拟高糖条件。本实验中,以正常葡萄糖(6mmol/l)培养的成纤维细胞作为对照,以26mmol/l(hg1)和30mmol/l(hg2)的葡萄糖模拟高糖条件培养成纤维细胞作为试验细胞,分别用两种浓度1%[cm1]或5%[cm2]的uc-msc-cm添加到培养基中预处理成纤维细胞12小时,用5%的未被高糖激活的msc-cm[cm0]处理同样的时间作为对照。然后在高糖条件下(hg1和hg2)培养三天。所有实验进行三次,结果报告为平均值±se。
二、试验结果:
1.持续的高糖刺激时,ros显著增加
两种浓度(hg1和hg2)的高糖处理成纤维细胞3天后,通过dcfh-da荧光测定成纤维细胞的细胞内ros产生。结果表明,高糖处理3天后,dcfh阳性细胞显著增加,表明细胞内ros产生逐渐增加,且葡萄糖浓度高的处理组细胞内ros水平更高;高葡萄糖处理组细胞的荧光强度比对照组细胞更高(图1)。这些数据表明高糖以剂量依赖的方式诱导细胞内ros的产生。
2.长期高糖刺激通过上调p16和p21的表达加速成纤维细胞的衰老
细胞衰老与细胞周期蛋白依赖性激酶抑制剂(p16和p21)的上调表达以及sa-β-gal活性的增加相关(hayflickl.livingforeveranddyingintheattempt.expgerontol2003;38:1231–41.)。本试验的结果表明,成纤维细胞中p53,p21和p16的表达水平显著高于对照组细胞,且高葡萄糖浓度的成纤维细胞中p53,p21和p16的表达水平更高,表明p53,p21和p16的表达水平通过高剂量依赖性方式随葡萄糖浓度(hg1和hg2)增高而增加(图3)。与对照组相比,sa-β-gal阳性细胞在用hg1和hg2处理后显著增加(图2)。这些数据表明成纤维细胞表现出在慢性高血糖条件下的衰老行为,并且该衰老可以通过p53、p21和p16的表达量的变化调节。
3.uc-msc-cm降低高糖诱导的氧化应激反应和成纤维细胞的衰老
当成纤维细胞在用uc-msc-cm预处理12h后,再分别在hg1和hg2的高糖条件下一起培养3天,以没有uc-msc-cm预处理也没有高糖培养的成纤维细胞作为对照,如图3所示,对照细胞中检测到较少量的dcfh阳性细胞,没有uc-msc-cm预处理但在高糖条件下培养的成纤维细胞中检测到较多的dcfh阳性细胞,而uc-msc-cm预处理12h后,再分别在hg1和hg2的高糖条件下培养的成纤维细胞中dcfh阳性细胞数明显降低,试验结果表明用高糖激活的msc-cm预处理抑制了高糖诱导的细胞内ros的产生(图4)。如图5所示,在用uc-msc-cm预处理成纤维细胞后,sa-β-gal阳性细胞率较没有采用uc-msc-cm预处理或用未被处理过的uc-msc-cm预处理的成纤维细胞中显著降低,图6表明在用uc-msc-cm预处理成纤维细胞后,p53,p21和p16的表达水平与没有用uc-msc-cm预处理或用未被处理过的uc-msc-cm预处理的成纤维细胞显著降低。
- 还没有人留言评论。精彩留言会获得点赞!