水稻穗长主效QTLPL6‑5的定位及与主效QTLPL6‑5连锁的分子标记的制作方法
本发明属于分子生物学及遗传育种技术领域,具体涉及一种水稻穗长主效QTLPL6-5的定位以及与水稻穗长主效QTLPL6-5连锁的分子标记。
背景技术:
稻穗的长短对着粒密度、一二次枝梗籽粒比例、穗颈弯曲度等性状的形成具有重要作用,直接影响籽粒结实率和每穗粒数等性状,最终制约水稻产量的提高。品种矮化之后,收获指数已很高,进一步提高稻谷产量,应依靠提高生物学产量;不少籼稻育种家认为选育一次枝梗数较多的长穗型大穗品种或组合是解决在高株、高生物学产量的基础上,同时保证高收获指数、进一步获得高产的有效措施。穗粒数、结实率等产量构成要素的形成主要受超显性作用,而超显性效应被认为是水稻杂种优势形成的重要遗传基础,成为水稻杂种优势利用的趋势。因此,发掘、研究长穗基因具有重要的实际意义。
水稻穗长是典型的数量性状,前人已利用F2、代换系、高世代回交、DH等不同群体开展有关其QTLs定位的研究,结果不尽相同。吴亚辉等(2013)以日本晴和一个籼稻材料H71D为亲本构建F2群体,对穗长(即PL)、一次枝梗数、二次枝梗数、总粒数、穗着粒密度等5个穗部性状进行QTL定位。检测到影响穗长的QTL只有位于第6染色体的qPL-6-1,其LOD值为3.23,贡献率为15.22%。王军等(2012)以广陆矮4号为受体、日本晴为供体构建的85个染色体单片段代换系群体为试验材料,对代换片段上穗长QTL进行鉴定:共检测到22个穗长QTLs,分布在第10染色体外的11条染色体。Ahamadi等(2008)以Taromemolaei和IR64和构建的59个BC2F5群体为材料,共检测到8个穗长相关QTLs,分别位于第2、4、11和12染色体上。方萍等(2002)利用IR64和Azucena构建的DH群体对穗长性状进行QTLs鉴定,高氮水平下检测到2个控制穗长QTLs,分别位于第1和第4染色体上;低氮水平下检测到5个穗长QTLs,分别位于第1、3、4、6染色体上。
综上,绝大部分穗长QTL研究受环境、遗传因素等限制还处于初定位阶段,少有精细定位、克隆穗长QTL的报道;真正能够稳定遗传并用于水稻穗长的分子标记辅助选择的主效QTL更是少见。因此,在多环境下定位并鉴定能够稳定遗传的穗长QTL,不仅可以为水稻穗长基因的精细定位及克隆奠定扎实的实验基础,同时也为穗长的分子标记辅助改良育种提供有力的分子标记。
技术实现要素:
本发明要解决的技术问题是克服现有技术的不足,提供一种新的水稻穗长主效QTLPL6-5的定位及与主效QTLPL6-5连锁的分子标记,该主效QTLPL6-5能够在不同环境及遗传背景中稳定检测,为水稻穗型改良育种提供了新的位点选择,分子标记为精细定位、克隆水稻穗长QTLPL6-5提供了有力工具。
为解决上述技术问题,本发明采用以下技术方案:
一种水稻穗长主效QTLPL6-5(也可为“QTL PL6-5”)的定位,所述水稻穗长主效QTLPL6-5位于水稻第6染色体长臂上,定位于分子标记RM20118与分子标记RM20210之间,所述分子标记RM20118的正向引物F如SEQ ID No.1所示,所述分子标记RM20118的反向引物R如SEQ ID No.2所示,所述分子标记RM20210的正向引物F如SEQ ID No.3所示,所述分子标记RM20210的反向引物R如SEQ ID No.4所示。
上述的水稻穗长主效QTLPL6-5的定位,优选的,所述分子标记RM20118与分子标记RM20210之间还有一分子标记M6-7,所述分子标记M6-7的正向引物F如SEQ ID No.5所示,所述分子标记M6-7的反向引物R如SEQ ID No.6所示;
所述水稻穗长主效QTLPL6-5定位于所述分子标记RM20118与分子标记M6-7之间。
上述的水稻穗长主效QTLPL6-5的定位,优选的,所述分子标记RM20118与分子标记M6-7相距1.3Mb,所述分子标记M6-7与分子标记RM20210相距1.2Mb。
作为一个总的发明构思,本发明还提供一种与水稻穗长主效QTLPL6-5连锁的分子标记,所述分子标记为M6-7,位于水稻第6染色体长臂上,所述分子标记M6-7的正向引物F如SEQ ID No.5所示,所述分子标记M6-7的反向引物R如SEQ ID No.6所示。
上述的与水稻穗长主效QTLPL6-5连锁的分子标记,优选的,所述分子标记M6-7是以“巨穗稻”HR1128和粳稻日本晴为亲本获得的,所述分子标记M6-7对粳稻日本晴扩增的条带大小为157bp,所述分子标记M6-7对“巨穗稻”HR1128扩增的条带大小为125bp。
作为一个总的发明构思,本发明还提供一种与水稻穗长主效QTLPL6-5连锁的分子标记,所述分子标记为RM20118,位于水稻第6染色体长臂上,所述分子标记RM20118的正向引物F如SEQ ID No.1所示,所述分子标记RM20118的反向引物R如SEQ ID No.2所示。
作为一个总的发明构思,本发明还提供一种与水稻穗长主效QTLPL6-5连锁的分子标记,所述分子标记为RM20210,位于水稻第6染色体长臂上,所述分子标记RM20210的正向引物F如SEQ ID No.3所示,所述分子标记RM20210的反向引物R如SEQ ID No.4所示。
本发明的主要创新点在于:
本发明采用分子标记基因型与单株表型相结合的QTL分析方法,定位并鉴定了一个新的水稻穗长主效QTLPL6-5,该QTL能够在多个定位群体及不同环境中被检测到,稳定性高,最高解释了群体穗长12.69%的表型变异,来自“巨穗稻”HR1128的等位基因对穗长具有增效作用。
本发明还提供了3个与该QTLPL6-5连锁的分子标记RM20118、M6-7和RM20210,它们都位于水稻第6染色体长臂。其中InDel标记M6-7为新开发的分子标记,该标记对亲本日本晴扩增的条带为157bp大小,对HR1128扩增的条带大小为125bp大小。分子标记RM20118与M6-7相距1.3Mb,分子标记M6-7与RM20210相距1.2Mb。
与现有技术相比,本发明的优点在于:
1、水稻穗长主效QTLPL6-5效应值较大,能够在不同环境及遗传背景中稳定检测,为水稻穗型改良育种提供了新的位点选择;来自巨穗稻HR1128的等位基因对穗长有增效作用,通过QTL辅助选择,可选育穗长适当增加的优良品种。
本发明涉及的上述3个分子标记RM20118、M6-7和RM20210为精细定位、克隆水稻穗长QTLPL6-5提供了有力工具,同时也为检测品种是否含有该穗长增效等位基因提供便利。
附图说明
图1为本发明实施例1中遗传定位群体构建流程图。
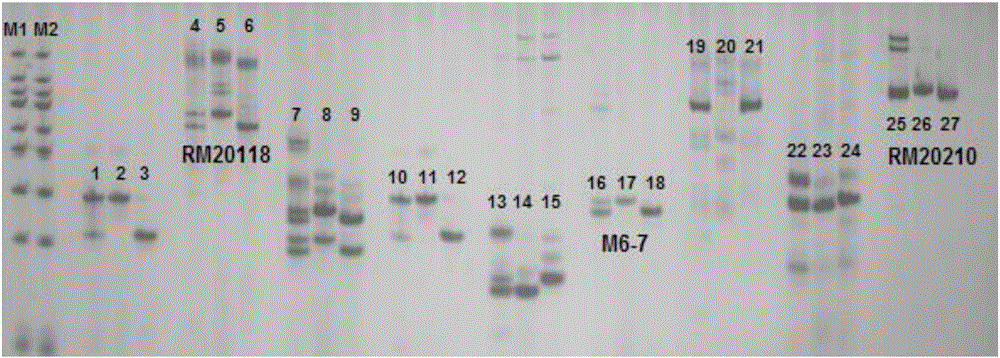
图2为本发明实施例1中多态性分子标记筛选及与QTL连锁的分子标记带型图。图中M1和M2为DNA分子标记对照,各点样孔对应样品分别为F1,NIP,HR1128(1-27个孔,每3个孔为一个循环),共检测了9对分子标记,从左至右分别为RM7555,RM20118,RM5814,MRG6555,RM20675,M6-7,RM20683,RM176,RM20210。
图3为本发明实施例1中亲本穗长性状比较图。
图4为本发明实施例1中群体穗长的分布频率。
图5为本发明实施例1中穗长主效QTL在BIL152群体定位图。
图6为本发明实施例1中穗长主效QTL在BIL196a群体定位图。
图7为本发明实施例1中穗长主效QTL在BIL196b群体定位图。
图8为本发明实施例1中穗长主效QTL在BIL196b-156群体定位图。
具体实施方式
以下结合说明书附图和具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。
以下实施例中所采用的材料和仪器均为市售。
实施例1
一种本发明的水稻穗长主效QTLPL6-5(也可为QTL PL6-5)的定位,水稻穗长主效QTL PL6-5位于水稻第6染色体长臂上,定位于分子标记RM20118与分子标记RM20210之间,分子标记RM20118的正向引物F如SEQ ID No.1所示,分子标记RM20118的反向引物R如SEQ ID No.2所示,分子标记RM20210的正向引物F如SEQ ID No.3所示,分子标记RM20210的反向引物R如SEQ ID No.4所示。
SEQ ID No.1为:5’-AGGCGACAGGGACACGATGG-3’
SEQ ID No.2为:5’-AAGCCGGATATTCCGTGTGAAGG-3’
SEQ ID No.3为:5’-TCGCTGTCTACTGATGATGATGG-3’
SEQ ID No.4为:5’-CAAAGCATATGGAAACCCTAGCC-3’
本实施例中,分子标记RM20118与分子标记RM20210之间还有一分子标记M6-7,分子标记M6-7的正向引物F如SEQ ID No.5所示,分子标记M6-7的反向引物R如SEQ ID No.6所示;水稻穗长主效QTL PL6-5定位于分子标记RM20118与分子标记M6-7之间。
SEQ ID No.5为:5’-GCACGATGGATGAATTAGCG-3’
SEQ ID No.6为:5’-GGAGGCAAAATAGGAGGAAAAT-3’
本实施例中,分子标记RM20118与分子标记M6-7相距1.3Mb,分子标记M6-7与分子标记RM20210相距1.2Mb。
本实施例中,分子标记M6-7是以“巨穗稻”HR1128和粳稻日本晴为亲本获得的,分子标记M6-7对粳稻日本晴扩增的条带大小为157bp,分子标记M6-7对“巨穗稻”HR1128扩增的条带大小为125bp。
本实施例的上述3个分子标记RM20118、M6-7和RM20210为精细定位、克隆水稻穗长QTL PL6-5提供了有力工具,同时也为检测品种是否含有该穗长增效等位基因提供便利。
本发明定位并鉴定了上述新的水稻穗长主效QTL PL6-5,主要采用分子标记基因型与单株表型相结合的QTL分析方法,具体过程如下:
1、遗传定位群体的构建
本实施例的用于衍生遗传定位群体的水稻亲本为“巨穗稻”HR1128和国际水稻测序品种粳稻日本晴(Nipponbare,NIP)。以上亲本在穗长等其他产量相关性状上都具有极显著差异。图3给出了2个亲本间的穗型结构比较照片,从图中可以看出HR1128的穗长显著优于日本晴的,且在穗分枝数、穗粒数等方面极显著的多于日本晴,这为后续遗传群体的构建提供了丰富的变异。
本实施例的遗传定位群体为:HR1128与日本晴的高世代回交、自交系分离群体BIL196a、BIL196b、BIL152(BC3F2),分别包含199个、132个和200个单株;衍生于BIL196b长沙群体中的分离群体BIL196b-156(BC3F4),含有384个单株。
以上高世代回交单株均主要含有水稻第6染色体的杂合片段,具有较为清晰的遗传背景,具体的构建流程见图1。
2、材料的田间种植及表型鉴定
本实施例中的遗传群体及亲本对照材料在当季均同期播种,栽插于同一试验田中。其中遗传群体BIL196a和BIL152及亲本材料于2014年冬季种植在海南省三亚市南繁试验基地,群体BIL196b及亲本材料于2014年夏季种植在湖南省长沙市长沙县春华试验基地,群体BIL196b-156及亲本材料于2015年冬季种植在海南省三亚市南繁试验基地。上述材料均单本移栽,人工插秧,插秧规格行距为30cm,株距为16.5cm。
本实施例中的遗传群体及亲本对照材料的穗长性状的表型数据收集完全按照如下方法开展:穗长为单株主穗的穗颈节到最高颖尖的长度,单位为厘米(cm),如表1所示。
各定位群体中穗长性状的统计分析及频率分布图采用EXCEL软件完成,各群体中穗长性状均为正态分布,如图4所示,符合QTL定位的基本条件。
表1 亲本及群体穗长性状统计表
3、材料DNA的提取及分子标记基因型鉴定
本实施例中群体单株及亲本材料的基因组DNA均采用CTAB法提取,具体步骤如下:采摘幼穗分化期水稻叶片。取新鲜的叶片少量置于2ml离心管中并加入一颗5mm钢珠,放入液氮中浸泡1min,迅速取出并放入高通量组织碎磨仪中震荡打碎。加入已预热的2×CTAB提取缓冲液750μl浸透粉末并倒转离心管,使粉末充分散开,于65℃水浴30min,其间每隔5分钟轻柔混合1次。
取出离心管,冷却至室温,加入750μl的氯仿∶异戊醇(体积比24∶1),轻缓颠倒混匀,静置10min。12000rpm离心10min,取上清600μl转移至新1.5ml离心管中,加等体积已预冷的异丙醇,保存于-20℃,静置20min。12000rpm离心10min,倒掉上清液。加入75%(体积分数)酒精700μl,12000rpm离心10mim。倒掉上清液,将离心管倒置于吸水纸上,自然干燥。加入50μl TE缓冲液溶解DNA,4℃保存备用(-20℃长期保存)。
本实施例中用于检测群体单株及亲本材料标记基因型的分子标记来自GRAMENE、国家水稻数据中心等网站公共数据库。经过亲本间多态性分子标记的筛选,用于4套高世代回交分离群体单株基因型检测的SSR分子标记分别为BIL196a(12个)、BIL196b(10个)、BIL152(10个)、BIL196b-156(5个),其中InDel分子标记M6-7为本发明新开发的标记。图2展示了部分多态性分子标记的筛选结果及与主效QTL PL6-5连锁的3对分子标记(RM20118、M6-7和RM20210)的带型图。分子标记的开发具体通过Gramene网站上公布的SSR引物以及根据生物信息学比对已经测序的粳稻品种日本晴和籼稻品种9311在这一区间的序列差异,进一步设计的InDel引物,筛选获得多态性分子标记。引物均由上海生物工程技术有限公司和湖南擎科生物技术有限公司合成。
本实施例中用于鉴定群体单株及亲本基因型的分子标记均经PCR反应扩增和聚丙烯酰胺凝胶电泳试验完成,具体步骤分别为:PCR反应体系为10μl。其中2 EasyTaqPCRSuperMixforPAGE,5ul;正向F引物0.2μl、反向R引物0.2μl、ddH2O加4.1μl和DNA模板0.5μl。
PCR扩增程序:94℃预变性5min;94℃变性30s,55℃复性30s,72℃延伸45s,35个循环;72℃延伸10min;取出PCR产物4℃保存。
聚丙烯酰胺凝胶电泳步骤如下:PCR扩增产物在8%的聚丙烯酰胺凝胶上电泳,电泳槽型号为:JY-CZ-B。具体操作如下:用清水充分洗涤玻璃板、样品梳和电泳槽,置于支架上晾干。晾干后,将两块玻璃板对齐扣到一起,装进电泳槽中。配置50ml的聚丙烯酰胺凝胶溶液:将质量分数为40%的丙烯酰胺10ml,蒸馏水30ml,5×TBE 10ml,质量分数为10%的过硫酸铵0.25ml-0.5ml(当室温高时多加入,室温低时少加入,可视具体情况来选择加入量)和TEMED 25μl迅速加入100ml小烧杯中,用玻璃棒搅拌均匀。将上述配好的聚丙烯酰胺凝胶溶液沿玻璃凹板上部缓缓灌入两块玻璃板间,两对玻璃板胶灌好后,插入梳子,静置1h左右。在电泳槽中灌满0.5×TBE电极缓冲液,轻轻拔出梳子。每个点样孔加入PCR产物1.5μl。连接电源,在电压200V,电流100mA电泳1h左右。关闭电源,回收电极缓冲液,取下玻璃板,撬开玻璃板取出凝胶,用ddH2O冲洗数次准备银染。
PCR产物带型银染过程如下:在装有凝胶的胶盒中倒入300ml显色液,在脱色摇床上轻摇8min,回收显色液,用ddH2O冲洗两遍。向胶盒中加入300ml显色液,在脱色摇床上轻摇至条带清晰,倒出显色液,用ddH2O冲洗两遍。将凝胶置于胶片观察灯上照相。
银染过程中所需试剂配制:染色液包括2g AgNO3,用ddH2O定容至1L。显影液包括20gNaOH定容至1L,然后加入8ml甲醛(现用现配)。
4、遗传连锁图谱的构建及穗长QTL的定位
4.1遗传连锁图谱的构建
本实施例中采用MAPMAKER 3.0软件构建遗传连锁分析图谱,具体分为2个过程,首先将步骤3得到的多态性引物分别对4套分离群体的所有单株DNA分别进行PCR扩增,聚丙烯酰胺凝胶电泳后银染照相和带型判读,与亲本“HR1128”相同带型记为“A”,与亲本“日本晴”相同带型记为“B”,杂合体记为“H”,缺失的带型记为“-”。
其次,分别准备好符合软件格式的单株基因型数据文件(.RAW)并命名;打开MAPMAKER 3.0软件的运行程序,键入命令“PHOTO”加文件要保存的名称,然后按回车键,键入命令“PD”调出需要构建连锁图谱的源文件,回车后键入命令“TRANS ALL”,软件将自动识别源文件中的所有标记名称;继续键入命令“S 1-n”后软件将所有标记进行编号并排序,回车后键入命令“GROUP”软件将所有标记进行分群,继续键入命令“ORDER”后,软件将依据标记基因型重组率给出最优遗传连锁图谱标记,最后键入命令“Q”后按“YES”退出并保存构建好的遗传连锁图谱。
按照上述软件命令运行,本实施例中4套分离群体的遗传连锁图谱构建完成,其图谱遗传距离分别为BIL152图谱长202.8cM、BIL196a图谱长70.3cM、BIL196b图谱长142.2cM、BIL196b-156图谱长6cM,各图谱中涉及到的分子标记及其遗传位置如图5、6、7和8所示;其中群体BIL196b-156的遗传图谱相对于其他群体更小,为进一步缩小穗长主效QTL PL6-5奠定了基础。
4.2穗长QTL的定位
根据后代株系的扩增条带所表示的基因型,将其对应的穗长性状调查的结果作为表型值,输入由中国农业科学院作物科学研究所王建康课题组发展的完备区间作图软件(ICIMappingV4.0,免费软件),进行数据分析,获得与水稻穗长相关的候选区间及相关标记。取LOD值大于等于2.5来判定该区域是否存在QTL,命名遵照McCouch等人于1997年提出的一个关于水稻QTL命名的方法。
本发明在分离群体BIL152、BIL196a和BIL196b中同时定位到穗长主效QTL PL6-5,如图5、6和7所示,其两侧标记均为RM20118和RM20210,其LOD值分别为5.71、5.98和3.06,分别解释了群体中穗长12.43%、12.69%和12.67%的表型变异率;QTL加性效应值分别为-0.75、-0.60和-1.22,来自亲本HR1128的等位基因对穗长具有增效作用。
如表2和上述3套回交分离群体穗长QTL定位结果显示,QTL PL6-5能在不同地点(三亚和长沙)和不同季节(三亚南繁和长沙正季)被多次定位,说明该QTL遗传效应稳定,对穗长的表型变异贡献较大,被初步界定于SSR标记RM20018和RM20210之间,随后在BIL152、BIL196a群体中检测到QTL PL6-5,位于SSR标记RM20118和RM20210之间,这二者在水稻染色体上的物理位置相距2.5Mb左右。
本发明为进一步缩小穗长QTL PL6-5的区间范围,构建了衍生于BIL196b的次级定位分离群体BIL196b-156。该群体单株量远大于前3个分离群体,同时具有更为精细的遗传连锁图谱(长6cM)。通过开发QTL区域内新的InDel分子标记M6-7,其序列为M6-7-F:GCACGATGGATGAATTAGCG,M6-7-R:GGAGGCAAAATAGGAGGAAAAT。如图8所示,将该主效QTL PL6-5最终定位于RM20118和M6-7之间,两者物理位置相距1.3Mb,而分子标记RM20210位于M6-7的右侧,因此该QTL定位区间被缩小至1.3Mb范围内,为后续该主效QTL的精细定位及克隆奠定基础。
表2 高世代回交分离群体中穗长QTL的效应分析
至此,完成了对新的水稻穗长主效QTL PL6-5的定位工作,同时还提供了与该QTL连锁的3个分子标记RM20118、M6-7和RM20210,其中InDel分子标记M6-7为本发明新开发的分子标记。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,其中所用方法如无特别说明均为常规方法。虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。
<110> 湖南杂交水稻研究中心,湖南农业大学
<120> 水稻穗长主效QTLPL6-5的定位及与主效QTLPL6-5连锁的分子标记
<130> 无
<160> 6
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<400> 1
aggcgacagg gacacgatgg 20
<210> 2
<211> 23
<212> DNA
<213> 人工序列
<400> 2
aagccggata ttccgtgtga agg 23
<210> 3
<211> 23
<212> DNA
<213> 人工序列
<400> 3
tcgctgtcta ctgatgatga tgg 23
<210> 4
<211> 23
<212> DNA
<213> 人工序列
<400> 4
caaagcatat ggaaacccta gcc 23
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
gcacgatgga tgaattagcg 20
<210> 6
<211> 22
<212> DNA
<213> 人工序列
<400> 6
ggaggcaaaa taggaggaaa at 22
- 还没有人留言评论。精彩留言会获得点赞!