一种草莓ABA结合蛋白FaABAR及其应用的制作方法
本发明属于生物工程技术领域,具体涉及一种草莓aba结合蛋白faabar及其应用。
背景技术:
植物的生长发育主要受植物激素调控。激素要发挥作用,首先要与其受体结合,然后猝发一系列信号转导,最终引起生理反应并调节了植物的发挥或适应了逆境环境。脱落酸(aba)是一种植物激素,参与了植物种子萌发、幼苗生长、休眠和气孔运动等,是调控草莓果实成熟的主导激素。
假定脱落酸受体abar(abaabscisicacidreceptor)是2006年在拟南芥(arabidopsisthaliana)中首次鉴定的,该蛋白与镁离子螯合酶h亚基(chlh)高度同源,并证实abar蛋白能够与(+)-aba特异性结合,而且abar-aba的这种结合在动力学上符合受体-配体结合的所有特征。但研究发现,大麦中的abar不能与(+)-aba特异性结合。随后,又进行了进一步的研究,利用aba免疫亲和层析技术,进一步证明了拟南芥abar蛋白的c-端是与(+)-aba结合的关键区,并在aba相关表型中发挥着关键的作用;此外还发现,水稻(oryzasativa)中abar也能够特异性结合(+)-aba。由此,研究人员推测之前没有检测到大麦中abar与aba的特异性结合,可能是由于大麦中abar基因功能冗余或者实验员操作不当导致。值得关注的是,脱落酸受体鉴定工作在模式植物上近年来取得了实质性突破。这些受体,一类是细胞质膜上常规的g蛋白偶联受体gcr2和新型的g蛋白偶联受体gtg1、gtg2,另一类是含有start特征区的aba受体pyr/pyl/rcar,还有一类是定位于质体/叶绿体内参与叶绿素合成的镁离子螯合酶h亚基的aba受体abar/chlh。
研究发现,草莓中faabar参与了草莓果实的成熟调控。但草莓中faabar能否结合aba目前科学界一直不清楚。本发明专利首次在草莓分离到了abar同源蛋白,该蛋白命名为faabar,并在世界上首次通过等温滴定微量技术(isothermaltitrationcalorimeter,itc技术)和表面等离子体共振(surfaceplasmonresonance,spr技术)检测到faabar与脱落酸aba的结合,首次提供分子生物学证据证实草莓中faabar可以结合aba,为果实成熟调控的分子机制研究奠定基础。
技术实现要素:
本发明的一方面提供了一种草莓faabar蛋白,所述faabar蛋白能够结合aba。
进一步地,其中所述蛋白为如下(a)或(b):(a)由seqidno.1所示的氨基酸序列组成的蛋白;(b)将seqidno.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加,且能与aba结合的由(a)衍生的蛋白质。
本发明另一方面是提供了所述的草莓faabar蛋白的编码基因。
进一步地,所述草莓faabar蛋白的编码基因为如下(a)或(b)的基因:(a)由seqidno.2所示的核苷酸序列组成的基因;(b)在严格条件下与(a)限定的dna序列杂交且编码所述草莓faabar蛋白的dna分子。
在另一方面,本发明提供了草莓faabar蛋白编码基因的重组表达载体。
在另一方面,本发明提供了草莓faabar蛋白编码基因的转基因细胞系。
在另一方面,本发明提供了草莓faabar蛋白编码基因的转基因宿主菌。
本发明另一方面,提供了所述草莓faabar蛋白或草莓faabar蛋白的编码基因在调节草莓果实成熟中的应用。
进一步地,所述faabar蛋白或其编码基因通过与脱落酸aba结合调节草莓果实的成熟。
进一步地,所述faabar蛋白为如下(a)或(b):
(a)由seqidno.1所示的氨基酸序列组成的蛋白;
(b)将seqidno.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加,且能与aba结合的由(a)衍生的蛋白质。
进一步地,所述草莓faabar蛋白的编码基因为如下(a)或(b):
(a)由seqidno.2所示的核苷酸序列组成的基因;
(b)在严格条件下与(a)限定的dna序列杂交且编码所述草莓faabar蛋白的dna分子。
本发明另一方面,提供了一种具有抑制由aba引起的草莓faabar蛋白活化活性的化合物的筛选方法,其特征在于包括以下(a)-(c)的步骤:
(a)在被检测化合物存在的条件下,使草莓faabar蛋白与aba接触,
(b)检测草莓faabar蛋白与aba的结合,
(c)选择能够抑制上述结合的化合物。
本发明另一方面,提供了一种用于调节草莓果实成熟的方法,其特征在于,抑制aba与草莓faabar蛋白的结合
本发明另一方面,提供了一种检测草莓faabar蛋白与脱落酸aba结合的方法,其特征在于,使草莓faabar蛋白与aba接触,通过等温滴定量热仪测定滴定产生的热量,若检测过程中有较大的滴定信号产生且有明显的减小趋势,则判定草莓faabar蛋白与脱落酸aba结合;若检测过程中产生的滴定信号较小或没有减弱的趋势,则说明这两者之间只有稀释热,而并非是发生了结合。
本发明另一方面,提供了一种检测草莓faabar蛋白与脱落酸aba结合的方法,其特征在于,将faabar蛋白质样品偶联到生物传感器表面,将含有aba的样品注入并流经生物传感器表面,通过稳态模型进行拟合,检测faabar蛋白质样品的解离常数判定草莓faabar蛋白与脱落酸aba的结合力。
本发明的有益效果:本发明通过等温热量滴定技术和表面等离子共振检测技术首次检测到草莓faabar蛋白与aba的结合,提供分子生物学证据证实草莓中faabar可以结合aba,为果实成熟调控的分子机制研究奠定基础。
简要附图说明
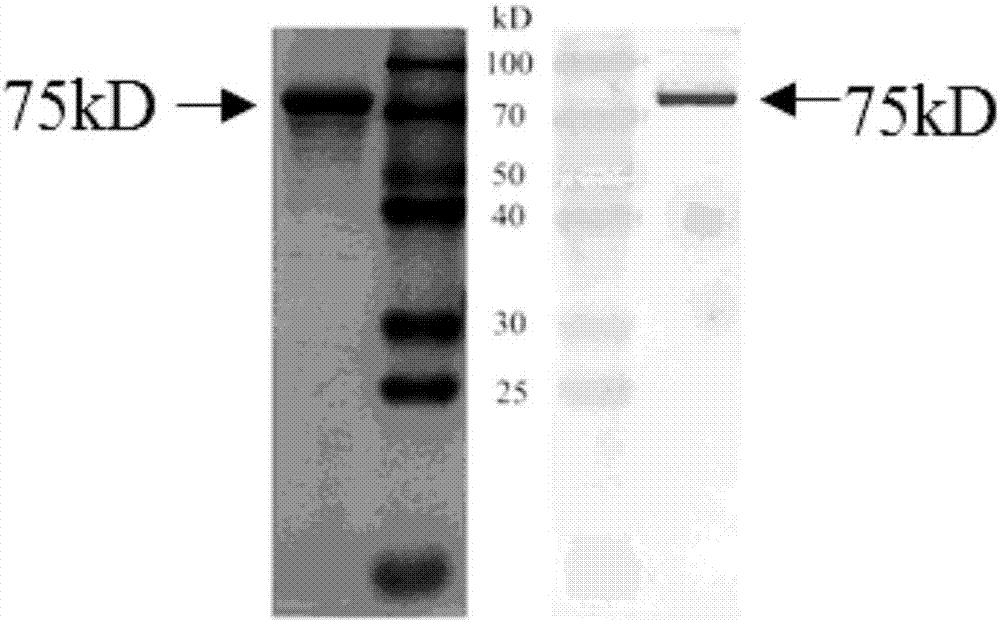
图1本发明克隆的faabar蛋白真核表达图谱,在75kd处蛋白表达出faabar特异条带蛋白。
图2本发明克隆的faabar蛋白的western-blot检测,免疫反应证实成功克隆了75kdfaabar蛋白。
图3等温热量滴定试验结果itc分析证实了faabar可以结合aba。
图4不同浓度的aba溶液流经偶联过faabar蛋白的cm5芯片时,表面等离子共振仪检测到的光电信号的变化。
图5通过稳态分析法,将图5中对应的稳态响应值对aba浓度拟合曲线图。
具体实施方式
下面用实施例来进一步说明本发明,但本发明并不受其限制。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例1:faabar基因克隆
草莓植株为北京农学院东大地温室栽培种植的“北农香”品种。温室栽培条件控制在:温度20-25℃、相对湿度70%-85%、光照14h、黑暗10h。采摘新鲜草莓果实,用刀片削去果实表面的种子,并将果肉切成适量大小后立即液氮速冻,保存在-80℃超低温冰箱中。
使用北京博迈德基因技术有限公司的easyspin植物rna快速提取试剂盒,提取草莓果实中的总rna,再使用北京全式金生物技术有限公司的
(1)加入以下混液体系:
(2)轻轻混匀,25℃孵育10分钟后,42℃孵育30分钟。
(3)85℃加热5秒钟,失活
根据ncbi上公布的abar序列,设计该基因后半段(2104bp-4143bp)引物。
上游引物带有酶切位点ecorⅰ(下标横线)
abar-f:5’-gaattcaaaaatggctgccaacaatccatctg-3’(seqidno.3)
下游引物带有酶切位点notⅰ(下标横线)
abar-r:5’-gcggccgcccgatcgattccctcaattttg-3’(seqidno.4)
pcr反应体系为:
pcr设定条件为:95℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸2min10s,重复32循环,72℃延伸10min。扩增结束后,用1%的琼脂糖凝胶电泳检测目的片段的扩增情况。
实施例2:目的片段与t载体连接和转化
将上述pcr产物连接到peasy-t1simple(购于北京全式金生物技术有限公司)。
混匀后离心,置于25℃反应15min。接着进行重组片段转化至大肠杆菌e.coli.dh5α中,在含有iptg和x-gal的lb(kan+amp)固体培养基上培养10-16小时,蓝白斑筛选阳性转化子。
挑取阳性克隆进行菌液pcr,挑选条带正确的菌落送于睿博兴科生物技术有限公司进行测序。得到如seqidno.2所示的核苷酸序列,命名为faabar(2043bp)。
实施例3:目的片段和ppiczb载体的双酶切
按照快速质粒小量制备试剂盒(离心柱ⅱ型)(北京百泰克生物技术有限公司)说明书,分别提取abar-t1和ppiczb的质粒,分别用neb公司的限制性内切酶ecorⅰ和notⅰ进行酶切,回收相应的片段。
22℃孵育10min,取10μl连接产物转化至100μle.coli.dh5α中,在含有kan的lb固体培养基上培养10-16小时,挑取阳性克隆菌液pcr并送公司测序。
实施例4:重组质粒线性化
根据faabar基因序列及真核表达载体ppiczb的基因序列,选用pmeⅰ的酶切位点,将ppiczb-abar的质粒进行线性化。
离心混合均匀后,37℃条件下线性化1h。
实施例5:重组质粒ppiczb-abar电转化酵母感受态
制备酵母菌株x-33感受态,方法如下:(1)挑取生长良好的x-33单菌落接入到2ml的ypd液体培养基中,28℃,250rpm振荡培养12h左右;(2)将振荡培养好的2ml菌液加到100mlypd液体培养基中,28℃,250rpm振荡培养至od600位1.3-1.5;(3)用50ml离心管收集菌液,4℃,5000rpm条件下离心5min,弃掉上清;(4)加入100ml事先在冰上预冷的超纯水,重悬菌体;(5)低温离心机4℃,5000rpm条件下离心5min,弃掉上清收集菌体;(6)加入50ml事先在冰上预冷的超纯水,重悬菌体;(7)低温离心机4℃,5000rpm条件下离心5min,弃掉上清收集菌体;(8)加入5ml事先在冰上预冷的1m山梨醇,重悬菌体;(9)低温离心机4℃,5000rpm条件下离心5min,弃掉上清收集菌体;(10)用200μl事先在冰上预冷的1m山梨醇重悬菌体,并每管80μl体积分装待用。
接着,重组质粒ppiczb-abar电转化酵母感受态。(1)取线性化成功并清洁回收的10μl线性化产物,加入到80μl分装的x-33酵母感受态中,轻轻混匀后,在冰上静止10min;(2)将混合物快速加入0.2cm预先置于冰上预冷的电转杯,1500vpulse,点击处理;(3)快速加入预冷的500μlypd液体培养基和500μl1m山梨醇溶液的混合物,吹打混匀后吸出,于28℃,250rpm振荡培养3h后涂板于ypds/zeocin平板上;(4)一般在平板上培养3-5天即可出现菌落;(5)挑取单菌落,摇菌提取酵母质粒并用pcr鉴定。
实施例6:真核表达蛋白表达量分析
(1)挑取鉴定正确的单菌落于装有30mlbmgy培养基的250ml锥形瓶中,30℃,220rpm振荡培养到od600为2-6(2.5-3.0最好);(2)收集菌体,5000rpm,5min离心,用bmmy培养基重悬至od600为1.0左右,并取样1ml液氮冻存,剩下的菌液继续30℃,220rpm振荡培养;(3)每24h向培养基中添加甲醇使菌液中甲醇终浓度为0.5%;(4)参照0h,4h,12h,16h,20h,24h,28h,36h进行取样,每次取样1ml,并迅速用液氮冻存;(5)将所取样品于12000rpm离心2min,弃尽培养基,收集菌体;(6)向菌体中加入100μl水和100μl的2×sds上样缓冲液,涡旋使菌体重悬并置于沸水中煮沸8min,800rpm快速离心数秒,吸取10μl上清点样进行sds-page电泳检测,结果如图1所示,目的蛋白faabar约为75kd。
实施例7:目的蛋白faabar纯化
ni柱预处理:(1)将ni-agaroseresin填料混匀后加入层析柱(每ml填料纯化20-30mghis标签蛋白),室温静置10min,待凝胶与溶液分层后,把底部的出液口打开,让乙醇通过重力作用缓慢流出;(2)向装好的柱中加入5倍体积的的去离子水,将乙醇冲洗干净后,再用10倍体积的bindingbuffer平衡柱子,平衡后即可上样。
目的蛋白faabar纯化:(1)将培养好的菌液用50ml离心管5000rpm,离心5min,收集菌体,弃尽培养基,(2)100mg菌体加入5mlbreakingbuffer,并添加pmsf(pmsf的保存浓度为100mm,工作浓度为1mm);(3)加入与菌体等体积的玻璃珠(玻璃珠直径为400-600μm),30s涡旋振荡,30s冰上静置,20分钟左右,混液成粘稠状;(4)低温离心机4℃,8000rpm,离心15分钟;(5)取上清与平衡好的填料在冰上(4℃)进行结合,低速旋转混合结合2h,为了使结合更加充分,可以在50ml中进行结合;(6)将结合好的混合液重新上柱,流出流穿液;(7)使用15倍柱体积的bindingbuffer冲洗柱子,洗去杂蛋白;(8)使用15倍柱体积的washingbuffer冲洗柱子,洗去杂蛋白;(9)使用适量elutionbuffer洗脱,分管收集洗脱峰,第一管收集0.5ml,以后每管收集1ml;(10)洗脱后,用过量的elutionbuffer冲洗柱子,再用10倍柱体积的去离子水洗涤柱子,最后用3倍柱体积的20%乙醇平衡,封柱后4℃保存。
实施例8:目的蛋白faabar的western-blot检测
(1)将10μlfaabar蛋白进行sds-page电泳;(2)将电泳完毕的胶进行转染nc膜,220ma,1.5h;(3)转膜完成后,用5%的脱脂牛奶封闭1h;(4)用pbst(含有0.5%tween20的pbs)溶液漂洗3次,2min/次;(5)在pbst溶液中加入一抗(1:200-1:1000),室温孵育2h;(6)用pbst溶液漂洗3次,3min/次;(7)在pbst溶液中加入二抗(1:20000),室温孵育1h;(8)用pbst溶液漂洗3次,3min/次;(9)用dab显色试剂盒显色。结果如图2所示,免疫反应证实成功克隆了75kdfaabar蛋白。
实施例9:faabar蛋白定量分析及浓缩
用bio-rad公司的bioradproteinassay试剂盒,定量测定纯化并置换好的faabar蛋白的浓度为0.5mg/ml。然后,参照5mlhitraptmdesaltingcolumn使用说明书,除去faabar蛋白质elutionbuffer中的盐分,并置换为ph=7.4的pbs缓冲液。参照amiconultra0.5mlcentrifugalfilters使用说明书,将faabar蛋白质浓缩。
实施例10:等温热量滴定试验证明草莓faabar蛋白结合aba
(1)纯化faabar片段蛋白,将纯化好的蛋白buffer置换为ph=7.4的pbs缓冲液,超滤蛋白使其浓缩至20μm左右(约为1.5mg/ml);(2)用ph=7.4的pbs缓冲液aba,使其母液浓度为1mm;(3)彻底清洗等温滴定量热仪,并用pbs缓冲液润洗样品池;(4)设定等温滴定量热仪程序:设定温度为25℃,dp=5;总共滴定20次;第一次滴定0.5μl,其余滴定2.0μl;滴定间隔为150s;转子转速为750rpm;(5)反应结束后,使用仪器配套的origin7.0进行数据分析。结果如图3所示,当每一滴aba滴入faabar蛋白中时,有较大的滴定信号产生,且有明显减小的趋势,说明滴定产生的热量不仅有化合物的稀释热,还有相互反应的结合热,由此判断aba与faabar蛋白可以发生相互作用。配套的origin7软件直接可得出,aba与faabar蛋白的结合常数ka为1.94×104±9.62×103,即解离平衡常数kd值51.8μm。
实施例11:表面等离子共振试验证明草莓faabar蛋白结合aba
(1)通过不同芯片种类的特点,初步确定使用cm5芯片用于试验;(2)通过预试验,确定0.5mg/mlfaabar蛋白样品与aba能够在ph=4.0的环境下在芯片表面用最短时间偶联到饱和;(3)通过biacore提供的氨基偶联试剂盒将0.5mg/mlfaabar蛋白质样品偶联到芯片表面,保证偶联量在最短时间达到饱和;(4)运行时,使用10mm的pbs缓冲液,流速设定为50μl/min,温度设为25℃,待基线稳定之后,开始进行测定;(5)将aba的浓度梯度设定为6.25、12.5、25、80、120μm,样品结合和解离时间分别设为120s和600s,由于faabar蛋白样品与aba能够在进样开始时快速结合并达到饱和,且在进样结束后又快速解离回到基线水平,反应中不需要进行再生过程;(6)使用biacoreevalutionsoftware分析软件,通过稳态模型进行拟合,分析faabar蛋白质样品与aba结合的亲和力。结果如图4和图5所示,通过对实时传感图(图4)和对应的稳态响应值对aba浓度拟合曲线图(图5)的分析,图5中的垂直直线即为aba与faabar蛋白的解离平衡常数kd值(亲和力常数)为50.3μm。
应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
sequencelisting
<110>北京农学院
<120>一种草莓aba结合蛋白faabar及其应用
<130>2017
<160>2
<170>patentinversion3.3
<210>1
<211>681
<212>prt
<213>草莓
<400>1
alaalaasnasnproserglualathrilealalysargargsertyr
151015
alaasnthrilesertyrleuthrproproalagluasnalaglyleu
202530
tyrlysglyleulysglnleusergluleuilealasertyrglnser
354045
leulysaspthrglyargglyglnglnilevalserserileileser
505560
thralaargglncysasnleuasplysaspvalaspleuproaspglu
65707580
glyvalgluileseralalysgluargaspleuvalvalglylysval
859095
tyrasnlysilemetgluilegluserargleuleuprocysglyleu
100105110
hisvalileglygluproprothralametglualavalalathrleu
115120125
valasnilealaalaleuasnargproglugluasnilepheserleu
130135140
proalaileleualagluthrvalglyargaspilegluaspleutyr
145150155160
argglnserasplysglyileleulysaspvalgluleuleulysgln
165170175
ilethraspalaserargglyalavalserserphevalglucysthr
180185190
thrasnglulysglyglnvalvalaspvallysasnlysleuthrser
195200205
ileleuglypheglyileasngluprotrpileglntyrleuserasn
210215220
thrlysphetyrargalaaspargglulysleuargthrleupheglu
225230235240
tyrleuglyglucysleulysleuilevalalaaspasngluilegly
245250255
serleulysglnalaleugluglylysphevalgluproglyprogly
260265270
glyaspproileargasnprolysvalleuprothrglylysasnile
275280285
hisalaleuaspproglnserileprothrthralaalametasnser
290295300
alalysvalvalvalgluargleuilegluargglnlysleuaspasn
305310315320
glyglylystyrprogluthrilealaleuvalleutrpglythrasp
325330335
asnilelysthrtyrglygluserleualaglnvalleutrpmetval
340345350
glyvalasnprovalalaaspglyleuglyargvalasnlysvalglu
355360365
valvalproleuglugluleuglyargproargileaspvalvalval
370375380
asncysserglyvalpheargaspleupheileasnglnmetasnleu
385390395400
leuaspargalavallysmetvalalagluleuaspgluproleuglu
405410415
glnasnphevalarglyshisalaleugluglnalagluthrleugly
420425430
ileglyvalargglualaalathrargilepheserasnalasergly
435440445
sertyrserserasnileasnleualavalgluasnsersertrpasn
450455460
aspglulysglnleuglnaspmettyrleuserarglysserpheala
465470475480
pheaspcysaspalaproglyalaglymetalagluasnarglysval
485490495
pheglumetalaleuserthralaaspalathrpheglnasnleuasp
500505510
sersergluileserleuthraspvalserhistyrpheaspserasp
515520525
prothrasnleuvalglnasnleuarglysaspglylyslysproser
530535540
sertyrilealaaspthrthrthralaasnalaglnvalargthrleu
545550555560
sergluthrvalargleuaspalaargthrlysleuleuasnprolys
565570575
trptyrgluglymetleuserserglytyrgluglyvalarggluile
580585590
glulysargleuthrasnthrvalglytrpseralathrserglygln
595600605
valaspasnphevaltyrgluglualaasnalathrpheilelysasp
610615620
gluglumetleuasnargleumetlysthrasnproasnserphearg
625630635640
lysleuleuglnthrpheleuglualaasnglyargglytyrtrpasp
645650655
thraspglugluasnilegluargleulysgluleutyrsergluval
660665670
gluasplysilegluglyileasparg
675680
<210>2
<211>2043
<212>dna
<213>草莓
<400>2
gctgccaacaatccatctgaagctacaatagctaagcgtcggagctacgccaacaccatc60
agctatttgacaccacctgcagaaaatgctgggctttacaaaggcctcaagcagttgagc120
gagcttatcgcgtcctatcagtcacttaaagacaccggccgtggacaacagattgtgagc180
tcaataatcagcactgctaggcaatgcaatcttgataaagatgtagacctacctgatgaa240
ggcgtggaaatatctgccaaagaaagagatcttgtggtcggaaaggtgtataacaaaatc300
atggagattgagtcccgcctgctgccctgtgggcttcatgtcattggtgagcctccaaca360
gccatggaagcagttgcaactctggtgaacattgctgcactgaaccgtccagaagagaac420
attttctcactcccagctatattggctgagacagttggaagagacatagaggatctttac480
agacaaagtgataaagggatactgaaggatgtggagcttctaaagcaaataacagacgca540
tcaaggggagcagtttcttcatttgtggagtgtacaacaaatgagaagggtcaagtagtt600
gatgtaaagaataagctgacctcaattcttgggtttggaatcaatgagccttggattcag660
tacttgtcaaacacaaaattttacagggcagacagggagaaacttagaacattgtttgag720
tacttgggagaatgcttgaagctgatcgtggctgacaatgagatagggagcttgaaacaa780
gcattggagggtaaatttgttgagccaggacctggtggtgacccgatcagaaacccgaaa840
gtgttgccaacaggaaagaatattcacgcacttgatccacaatctatacccaccacagca900
gcaatgaacagcgcaaaggttgtggttgagaggttgatagagaggcagaagcttgataat960
ggaggaaagtaccctgagacgattgcacttgttttgtggggtacagacaatatcaagacc1020
tatggtgagtccttggctcaggttttgtggatggttggtgtgaatccagttgctgatggt1080
cttggacgagtcaacaaggtagaagtagtgcctcttgaagagcttggaagacccaggatt1140
gatgttgttgttaactgctcgggagtcttcagagacctcttcatcaatcagatgaatttg1200
cttgaccgagcagtgaagatggtagctgaactagatgagccacttgaacagaactttgtc1260
aggaagcatgcactggagcaagcagaaacccttggcattggggttcgtgaagctgcgacc1320
cggatcttctccaatgcttcaggctcctattcctctaatataaatcttgctgtggagaac1380
tcctcatggaatgatgagaagcagctgcaggacatgtatctgagcaggaaatcatttgct1440
tttgattgcgatgctccaggtgcaggcatggctgagaacagaaaagtttttgaaatggca1500
ttgagcacagctgatgcaacattccaaaacctggactcatcagaaatctcacttactgat1560
gtgagtcactactttgattcagatccaaccaatcttgtgcaaaacctaaggaaggatgga1620
aagaaacctagttcttacattgctgacaccaccacagctaacgctcaggttcgtacactc1680
tctgagaccgtgcgtcttgatgcaaggaccaagttgttgaatcccaagtggtatgaagga1740
atgttgtctagtggttacgagggtgttcgtgagattgagaagagactcactaatacagtc1800
gggtggagtgcaacttctgggcaagttgacaactttgtgtatgaagaggccaacgcgact1860
ttcattaaagatgaggagatgttgaacaggcttatgaaaacaaatccaaactcctttagg1920
aagctgttacagacgttcctggaggccaacggacgtggttactgggacactgatgaggag1980
aatattgaaaggttgaaggagctgtactcagaagttgaagacaaaattgagggaatcgat2040
cgg2043
- 还没有人留言评论。精彩留言会获得点赞!