猪流行性腹泻病毒特异性SIgAELISA检测试剂盒及其应用的制作方法
本发明涉及一种elisa检测试剂盒及其应用,特别涉及一种用于猪流行性腹泻病毒特异性siga检测的elisa检测试剂盒及其在评价pedv感染及免疫状态中的应用。本发明属于医药技术领域。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)等病原引起的猪的肠道疾病。ped已成为危害世界养猪业的重要疾病之一,给养猪业带来重大经济损失。pedv主要引起仔猪腹泻、脱水和死亡。经粪口途径传播是其主要的传播方式。到目前为止,检测pedv感染和接种疫苗后常用的方法有基于rna的rt-pcr、实时定量pcr、多重pcr和rt-环介导等温扩增技术,以及检测抗体的igg和iga检测方法,检测病原的间接免疫荧光方法和电镜技术。
pedv感染猪只后不会出现病毒血症,血清中的各类抗体不能有效清除病毒,但对igg和iga抗体的检测能够有效评估免疫状况和自然感染状况。pedv感染的靶器官是仔猪小肠绒毛膜上皮细胞。黏膜免疫系统是机体的第一道防线,而黏膜免疫系统中病原特异性的分泌型iga(siga)抗体能有效中和病毒、阻断病原体与机体接触,促进病原体排出体外。siga主要存在于消化道、呼吸道及生殖道的黏膜表面以及初乳中,由分泌片(sc)、两个iga分子和联接链(j)组成,sc片段能够覆盖iga分子中的蛋白酶酶切位点,从而保证了siga分子的稳定性。因此,机体内pedv特异性siga水平是评价机体能否有效阻断pedv感染的重要指标。鉴于此,本发明建立了能够评价pedv感染及免疫状态的siga检测试剂盒及其检测方法。
技术实现要素:
本发明的目的之一是提供一株能够稳定分泌抗sigasc片段单克隆抗体的杂交瘤细胞株,由该杂交瘤细胞株分泌的单克隆抗体及其在检测siga中的用途。
本发明的目的之二是提供一种用于pedv特异性siga检测的elisa检测试剂盒、检测方法及其在评价pedv感染及免疫状态中的应用。
为了达到上述目的,本发明采用了以下技术手段:
本发明以初乳中纯化出的siga为抗原,免疫balb/c小鼠,获得一株稳定分泌抗sigasc片段单克隆抗体的杂交瘤细胞株,所述的杂交瘤细胞株,命名为2f9,分类命名为小鼠抗猪sigasc片段单克隆抗体细胞株,保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,其微生物保藏号是:cgmccno.13813,保藏时间是:2017年3月20日。
由所述的杂交瘤细胞株分泌的单克隆抗体也在本发明的保护范围之内。
进一步的,本发明还提出了所述的单克隆抗体在制备检测特异性siga试剂中的用途。
本发明的一种pedv特异性sigaelisa检测试剂盒,包括抗sigasc片段的单克隆抗体,所述的单克隆抗体由杂交瘤细胞株2f9分泌产生。
在本发明所述的试剂盒中,优选的,所述的抗sigasc片段的单克隆抗体是用辣根过氧化物酶标记的。
在本发明所述的试剂盒中,优选的,还包括由纯化的pedv粒子包被的酶标板、稀释液、洗涤液、阳性对照、阴性对照、abts显色液以及终止液。
在本发明所述的试剂盒中,优选的,所述的阳性对照为pedvsiga抗体阳性的猪直肠拭子或初乳样品,所述的阴性对照为pedvsiga抗体阴性的猪直肠拭子或初乳样品。
在本发明所述的试剂盒中,优选的,所述的酶标板上,pedv粒子的包被浓度为5.8ng/孔,优选的,所述的pedv粒子为pedv-lnct2病毒粒子。
所述的pedv-lnct2病毒已记载在文献“猪流行性腹泻病毒g1与g2基因亚型毒株抗原差异性分析,王潇博,《中国农业科学院》2016年”中,由哈尔滨兽医研究所保存,提供。
使用本发明所述的试剂盒用于pedv特异性siga抗体检测时,按照以下步骤进行:
(1)从冰箱取出试剂盒,室温放置30分钟;
(2)取出酶标板,分别设置阳性对照孔、待测样品孔、阴性对照孔和空白对照孔,记录各孔位置,待检样品及标准阳性对照样品、标准阴性对照样品分别用稀释液做1:100稀释后,分别加入待测样品孔、阳性对照孔、阴性对照孔,空白对照孔不加;
(3)置37℃恒温箱作用1h;
(4)弃去液体,吸水纸上拍干,每孔加洗涤液,静置,甩去洗涤液,吸水纸上拍干,如此重复洗板2-3次;
(5)每孔加入按照1:3000倍稀释的辣根过氧化物酶标记的抗sigasc片段的单克隆抗体,空白对照孔不加;
(6)37℃恒温箱作用1h;
(7)弃去液体,吸水纸上拍干,每孔加洗涤液,静置,甩去洗涤液,吸水纸上拍干,如此重复洗板2-3次;
(8)每孔中加入abts显色液,混匀,37℃避光显色15min;
(9)终止:每孔中加入终止液终止反应。
(10)测定:以空白孔调零,用酶标仪在405nm波长下测定各孔吸光值;
(11)结果判定
直肠拭子:od405值>0.261判为阳性,od405值≤0.261判为阴性;
初乳样品:od405值>0.305判为阳性,od405值≤0.305判为阴性。
进一步的,本发明还提出了所述的试剂盒在制备检测pedv特异性siga试剂中的用途。
相较于现有技术,本发明的有益效果在于:
1、本发明中所用的毒株pedv-lnct2毒株(g2亚型)s基因与cv777毒株s基因(g1亚型)的同源性为93.2%,以pedv-lnct2粒子为抗原完全可以结合cv777毒株诱导产生的siga抗体。
2、本发明中所用的阴性样品和阳性样品都经ifa验证,检测样品也同样用ifa进行了检测,检测结果与ifa高度一致。ifa被认为是检测方法的金标准,具有敏感性和特异性强等优点。由于目前没有pedv特异性siga商品化检测试剂盒,本研究建立的elisa检测方法与ifa检测方法进行比较,结果具有可信性,因此,pedv特异性sigaelisa检测方法可以用来检测猪群的pedv感染状况或其免疫状况。
3、siga主要存在于消化道、呼吸道及生殖道的黏膜表面以及初乳中,采集方便,不会引起动物应激反应。
4、本发明获得的抗sc片段的单克隆抗体能够与siga分子中的sc片段特异性结合,与iga分子无反应,能够有效排除iga分子对siga的影响。
5、检测猪初乳和直肠拭子中的siga可以为母猪及仔猪何时接种疫苗提供有效帮助。pedv特异性sigaelisa检测方法为检测猪体的主动免疫和被动免疫状态提供了一个敏感和特异性检测方法。
附图说明
图1为sds-page鉴定凝胶过滤层析纯化的各组分的鉴定结果;
1-7为凝胶过滤层析纯化的不同组分;m为marker;
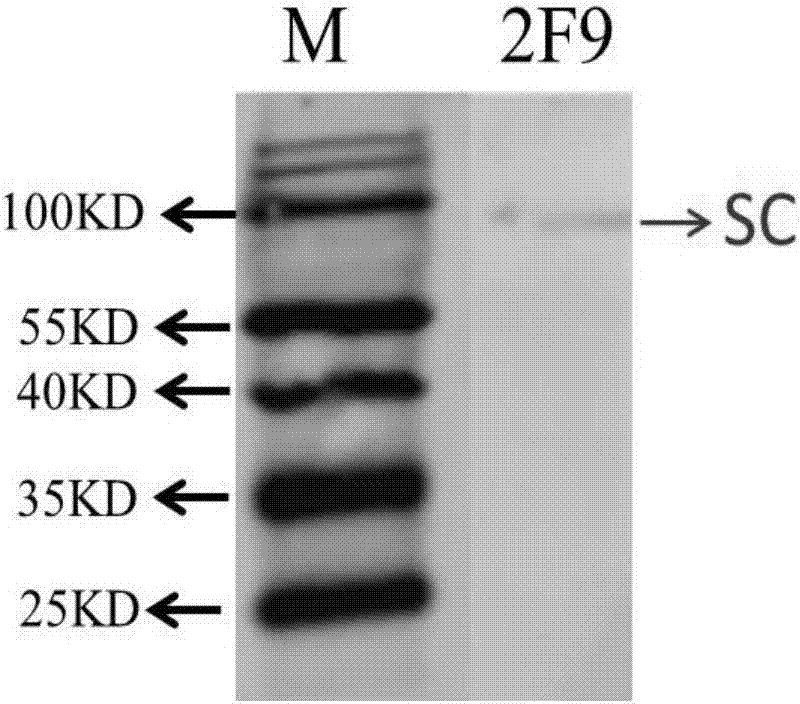
图2为westernblot鉴定;
图3为电镜观察pedv粒子(负染法);
图4为抗原最佳包被浓度的确定;
图5为ifa检测直肠拭子和初乳样品中的pedv特异性siga;
1和3为pedv-siga阳性直肠拭子分别与感染pedv的vero-e6细胞和健康vero-e6细胞反应结果;2为pedv-siga阴性直肠拭子与感染pedv的vero-e6细胞反应结果;4和6为pedv-siga阳性初乳样品分别与感染pedv的vero-e6细胞和健康vero-e6细胞反应结果;5为pedv-siga阴性初乳样品与感染pedv的vero-e6细胞反应结果;
图6为间接elisa临界值的确定;
虚线为测定直肠拭子时的临界值;实线为检测初乳样品时的临界值;
图7为pedv不同抗体效价的初乳样本elisa检测敏感性实验。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
本发明实施例所使用的细胞、试验动物、抗体和试剂:
sp2/0和vero-e6细胞系由中国农业科学院哈尔滨兽医研究所猪消化道传染病创新团队保存;rpmi1640培养液(gibco);hat和ht培养基、peg(mw4000)、弗氏完全佐剂、弗氏不完全佐剂均购自sigma公司;balb/c小鼠由本所实验动物中心代为购买。辣根过氧化物酶(hrp)购自sigma公司;2,2-连氮基双-3-乙基-苯丙噻唑啉磺胺(abts)为bbi产品;pedv阳性、阴性直肠拭子样品均来自感染实验中pedv攻毒猪和阴性对照猪;阴性初乳采自于中国农业科学院哈尔滨兽医研究所实验动物基地。凝胶过滤层析柱superdex20010/300gl购自gehealthcare公司。
实施例1稳定分泌针对于siga分子分泌片(sc)抗体的杂交瘤细胞株的制备
1.母猪初乳的采集和纯化
1.1初乳采集及纯化
母猪分娩后1-3天内采集初乳,对采集到的初乳在4℃,15000g离心15min,收集乳清,弃去沉淀和脂肪层。乳清边搅拌边滴加等量的饱和硫酸铵,使硫酸铵的饱和度达到50%,4℃搅拌30min,15000g离心30min。将沉淀用生理盐水稀释后缓慢滴加饱和硫酸铵,使其饱和度达到40%,离心弃去上清液。沉淀用ph7.5的pbs溶解,15000g离心30min,上清液即为猪siga初提液,4℃条件下保存,备用。
1.2siga抗体的提纯
按常规方法处理sephadexg-200,装柱平衡后将siga粗提液加于sephadexg-200柱。用0.01mol/l、ph为7.5的pbs洗脱于多个收集管中。各管洗脱液用10%sds-page电泳鉴定。10%sds-page电泳鉴定后收集并混合siga主峰液,最后经proteing柱纯化,去除igg。收集的提纯液即为猪siga。
2.抗猪siga单克隆抗体的制备
2.1balb/c小鼠的免疫
将纯化的猪siga抗体与等量弗氏完全佐剂混合后腹部皮下接种6周龄balb/c小鼠5只,每只接种抗原剂量为100μg。2周后注射同一剂量弗氏不完全佐剂处理的抗原。细胞融合前3d,用等量不加佐剂的抗原(每只200μg)腹腔注射加强免疫1次,即可进行细胞融合。
2.2细胞融合及阳性杂交瘤细胞株的建立
免疫鼠脾细胞与sp2/0细胞按照5:1比例混合后加peg融合,于96孔培养板中37℃、co2培养箱中培养。当杂交瘤细胞的培养液开始变黄,或杂交瘤细胞长满至孔底面积的1/10时,吸取上清液,经间接elisa和wb法筛选阳性杂交瘤细胞。用有限稀释法对阳性孔连续3次亚克隆,至所有单克隆孔均为阳性为止。将最终获得的单克隆扩大培养后建株,冻存。
2.3单抗腹水的制备及效价的测定
取8周龄balb/c小鼠腹腔注射灭菌石蜡油(每只0.5ml),7d后将生长状态良好的杂交瘤细胞,以每只约5×105个腹腔注射balb/c小鼠。7d左右小鼠腹部开始明显膨大,反复抽取腹水,以3000r/min离心10min除去细胞成分和其他沉淀,收集上清液。纯化后加入0.02%叠氮钠,分装,-70℃保存。将腹水用pbs递增稀释,以elisa测定单抗的效价。
2.4亚型鉴定单抗亚型鉴定
按照亚型鉴定试剂盒操作说明书对以上试验中得到的单克隆抗体进行亚型鉴定。
2.5阳性杂交瘤细胞株分泌单抗稳定性的测定
将冻存3个月的阳性杂交瘤细胞复苏,24孔细胞板培养,检测上清是否呈阳性来判定复苏的阳性细胞是否有分泌抗体的能力。将经过3次亚克隆的阳性率达100%的杂交瘤细胞进行体外连续传代培养3个月,每隔2周检测1次细胞上清液。
3结果
3.1sds-page鉴定纯化后的siga
纯化后的siga的sds-page鉴定结果如图1所示,siga有sc片段、重链、轻链和j链组成。1-7为凝胶过滤层析收集到的不同组分鉴定,选取2、3、4号样品作为抗原。
3.2westernblot鉴定单抗与siga反应
经elisa筛选和westernblot鉴定,最终获得一株稳定分泌针对于siga分子分泌片(sc)抗体的杂交瘤细胞株,命名为2f9,分类命名为小鼠抗猪sigasc片段单克隆抗体细胞株,将该细胞株扩大培养后建株,并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是:北京市朝阳区大屯路1号院3号中国科学院微生物研究所,其微生物保藏号是:cgmccno.13813,保藏时间是:2017年3月20日。
单克隆抗体2f9的westernblot鉴定如图2所示,从该结果可以看出2f9抗体能够与siga分子的sc片段结合。
3.3单抗腹水的效价的测定
待小鼠腹部膨大后抽取其腹水,3000r/min离心10min取上清。采用elisa方法检测上清和腹水抗体效价。结果表明:2f9单抗细胞上清液抗体效价高于1:1000,腹水抗体效价高于1:100000。
3.4亚型鉴定单抗亚型鉴定
经鉴定,单克隆抗体2f9的重链为igg1亚型,轻链为κ型。
3.5阳性杂交瘤细胞株分泌单抗稳定性的测定
将冻存细胞株复苏后于24孔培养板中培养,间接elisa检测细胞上清液,结果od405值仍很高。将细胞传代3个月,每隔2周检测1次上清液,结果显示od405值稳定。
实施例2检测pedv特异性siga抗体的间接elisa方法的建立
1、方法
1.1.pedv-lnct2毒株的培养
vero-e6细胞长满形成单层后,弃去营养液,用pbs(磷酸盐缓冲溶液,ph7.2)洗涤三遍,接种pedv-lnct2毒株。病毒接种剂量按照5%浓度接种,接种病毒同时添加胰酶,胰酶的终浓度为10μg/ml。观察细胞病变,待80%~90%细胞出现病变时,将病毒冻存至-20冰箱,收毒,备用。
1.2.pedv的纯化
pedv-lnct2病毒液经5000g离心5min去除细胞碎片后,用超速离心机100000g离心2h,弃去上清液,收集沉淀。沉淀用蔗糖梯度密度离心纯化,共设置5个蔗糖浓度,20%、30%、40%、50%和60%。超速离心机sw32转子100000g离心2h后,收集50%~60%蔗糖层之间的样品,样品经sw32转子100000g离心2h进行脱糖处理,弃去上清液收集沉淀。沉淀即为纯化的病毒粒子,并进行电镜鉴定。
1.3.ifa筛选阴性样品和阳性样品
veroe6细胞长满单层后,接种pedv-lnct2,观察细胞病变情况,待细胞刚出现病变,即可用4%多聚甲醛固定细胞,加入待检直肠拭子浸出液和初乳样品(30倍稀释),37℃反应1h,pbs洗涤3次后加入纯化的2f9抗体(1:10000)37℃孵育1h,pbs洗涤3次,加入山羊抗小鼠igg/alexafluor488(中杉金桥)反应30min,洗涤后荧光显微镜下观察结果。
1.4.腹水纯化及hrp标记
将实施例1制备得到的腹水按照hitrapproteinghp(gehealthcare)抗体纯化说明书进行纯化,纯化后的抗体2f9经浓度测定后,对抗体2f9进行hrp标记,按文献(金伯泉等,2002)介绍的简易过碘酸钠法进行hrp-单抗标记试验,对标记过的抗体2f9进行效价测定。
1.5.间接elisa反应条件的优化
1.5.1抗原最佳包被浓度的选择
将纯化的pedv-lnct2病毒粒子(浓度为1.584μg/μl)进行系列倍比稀释,每孔包被100μl(每孔分别含742ng、371ng、185ng、92.5ng、46.25ng、23.12ng、11.56ng、5.8ng、2.9ng、1.45ng和0.725ng抗原)。间接elisa测定各孔od405值,选定p/n值(阳性样品od值/阴性样品od值)最大并且所需抗原包被浓度最小时作为最佳抗原包被浓度。
1.5.2一抗最佳孵育时间的优化
将一抗的孵育时间设置为30min、lh、1.5h、2h和4h5个时间段,分别进行elisa试验,筛选出一抗孵育最佳时间。
1.5.3hpr标记的2f9单克隆抗体最佳稀释倍数和反应时间确定
hpr标记的2f9单克隆抗体按照1:2000、1∶4000、1∶8000、1∶16000、1∶32000、1∶64000等不同浓度稀释经elisa试验确定最佳稀释倍数。分别设置为15min、30min、45min、60min、90min,进行elisa试验,筛选出酶标抗体最佳作用时间。
1.5.4底物反应时间的优化
将底物的作用时间分别设置为5min、10min、15min、20min、25min,进行elisa试验,选出底物最佳作用时间。
1.6.阴性和阳性临界值判定
经ifa检测筛选出来的30份pedvsiga阴性直肠拭子和27份siga阴性初乳样品,用于该elisa检测方法阴性和阳性临界值的判定。根据od405值分别计算出份阴性直肠拭子样品和初乳样品的平均值
1.7.间接elisa的特异性试验
pedv、tgev、pcv2和porv已知阳性血清作为检测抗体。以pedvsiga阳性直肠拭子和初乳样品作为阳性对照,以pedvsiga阴性直肠拭子和初乳样品作为阴性对照,用已建立的elisa方法进行特异性试验,测定其od405值。
1.8.间接elisa的敏感性试验
选取经ifa标定的6份初乳样品,经倍比稀释后用本发明建立的elisa方法进行检测,测定其敏感性。
2、结果
2.1电镜鉴定纯化的pedv粒子
如图3所示,纯化的病毒粒子经负染法后观察,可见病毒纯化效果较好,杂质少,纤突蛋白完整且明显。
2.2标记后抗体效价的测定
腹水经纯化后用辣根过氧化物酶(hrp)标记,标记后抗体的效价为1:10000。
2.3间接elisa反应条件的优化
2.3.1最佳包被抗原浓度的选择
纯化的pedv病毒粒子经倍比稀释作为包被抗原,进行elisa试验。结果表明当包被2.9ng/孔抗原时,od405值明显下降;包被5.8ng/孔抗原时p/n值最大(图4),因此确定该浓度为最佳包被浓度,并用于后续的试验。
2.3.2最佳工作条件的选择
按照最佳抗原包被浓度进行常规的操作步骤对检测样品孵育时间、hrp标记的2f9单抗的最佳作用浓度和时间、底物作用时间等分别进行优化。结果表明,最佳的工作条件分别是检测样品37℃孵育1h、hrp标记的2f9单抗的最佳稀释浓度是1∶3000倍稀释,37℃孵育1h、底物作用15min。
2.3.3ifa筛选阴性样品和阳性样品
通过ifa筛选,本研究共筛选到30份pedv阴性猪直肠拭子和27份pedv阴性的初乳样品,以及30份pedv阳性猪直肠拭子和30份pedv阳性的初乳样品。阴性样品与阳性样品的ifa检测结果如图5所示。
2.3间接elisa临界值的确定
采用本发明所建立的elisa方法分别对30份pedv阴性的直肠拭子和27份阴性初乳样品进行检测,结果如图6所示,直肠拭子
2.4间接elisa的特异性试验
采用所建立的elisa方法进行特异性试验。结果表明,该elisa方法具有较好的特异性,与常见的病毒血清抗体没有交叉反应(表1)。
表1所建立的elisa方法进行特异性试验结果
2.5间接elisa的敏感性试验
如图7所示,6份经ifa标定的初乳样品的elisa检测值与ifa测定的效价呈正相关,随着抗体稀释倍数增加od405值呈平缓递减。当ifa检测标定的抗体效价在200-6400之间时,elisa检测可获得较好的敏感性。
实施例3试剂盒的组装、符合性实验及初步应用
1、试剂盒的组装
(1)酶标板:该酶标板已包被有纯化的pedv-lnct2病毒粒子,包被浓度为5.8ng/孔。制备方法如下:
(a)将纯化的pedv-lnct2病毒粒子,然后加入酶标板的各孔中,加入的量为5.8ng/每孔,4℃包被过夜;
(b)洗涤:取出拍干后,以pbst缓冲液洗涤3次(5min/次),拍干液体;
(c)用1%bsa-pbst,100μl/孔,37℃封闭1h,洗涤同步骤(b);
(2)10×洗涤液:所述10×洗涤液是含有5v/v%tween-20、8w/w%氯化钠、0.2w/w%氯化钾、2.9w/w%磷酸氢二钠和0.2w/w%磷酸二氢钾的水溶液,ph7.4;
(3)10×样品稀释液:所述10×样品稀释液是含有5w/w%牛血清白蛋白、5v/v%tween-20、8w/w%氯化钠、0.2w/w%氯化钾、2.9w/w%磷酸氢二钠和0.2w/w%磷酸二氢钾的水溶液,ph7.4;
(4)酶标试剂:hrp标记的2f9单抗(实施例2制备)用pbs缓冲液以1∶3000倍稀释;
(5)abts底物显色液;
(6)终止液:2mol/l的h2so4溶液;
(7)标准阳性对照样品:pedvsiga阳性的直肠拭子或初乳样品;
(8)标准阴性对照样品。pedvsiga阴性的直肠拭子或初乳样品。
2、符合性实验及初步应用
采集黑龙江省部分猪场猪直肠拭子165份和初乳样品各30份,利用ifa和本发明建立的elisa方法检测样品中的pedv特异性siga抗体,测定阳性率和符合性。其中,本发明的建立的elisa方法具体操作步骤如下:
(1)准备:从冰箱取出试剂盒,室温放置30分钟。用蒸馏水将10×洗涤液、10×稀释液分别稀释成1×洗涤液、1×稀释液;
(2)加样:取出酶标板,固定于框架上,分别设置阳性对照孔、待测样品孔、阴性对照孔和空白对照孔,记录各孔位置。待检样品及标准阳性对照样品、标准阴性对照样品分别用稀释液做1:100稀释后,分别加入待测样品孔、标准品孔,100μl/孔。空白对照孔不加;
(3)温育:置37℃恒温箱作用1h。
(4)洗板:弃去液体,吸水纸上拍干,每孔加洗涤液250μl,静置5min,甩去洗涤液,吸水纸上拍干,如此重复洗板3次。
(5)加酶标试剂:每孔加入酶标试剂100μl,空白对照孔不加。
(6)温育:37℃恒温箱作用1h。
(7)洗板:弃去液体,吸水纸上拍干,每孔加洗涤液250μl,静置5min,甩去洗涤液,吸水纸上拍干,如此重复洗板3次。
(8)显色:每孔中加入100μl底物显色液,平板混匀器混匀30s,37℃避光显色15min。
(9)终止:每孔中加入50μl终止液终止反应。
(10)测定:以空白孔调零,用酶标仪在450nm波长下测定各孔吸光值(od)。
(11)结果判定
直肠拭子:od405值>0.261判为阳性,od405值≤0.261判为阴性;
初乳样品:od405值>0.305判为阳性,od405值≤0.305判为阴性。
结果如表2所示,从该结果可以看出临床检测样品中pedv特异性siga抗体阳性率达49.7%,ifa检测的阳性率为50.9%,二者符合率为97.6%;对30份临床中采集的初乳样品进行检测,二者的阳性率均为100%。初步应用表明所检测猪群中普遍存在pedv特异性siga抗体。
表2间接elisa和ifa检测临床猪直肠拭子中siga及结果比较
- 还没有人留言评论。精彩留言会获得点赞!
- 特异性抑制PADI2基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 用于抑制单链RNA病毒复制的治疗的制造方法与工艺
- 基于miRNA数据和组织特异性网络的药物重定位方法与流程
- 用于蓝舌病病毒型特异性检测的竞争ELISA检测试剂盒及其应用的制造方法与工艺
- 特异性抑制CA7基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 用于结肠特异性递送的药物组合物的制造方法与工艺
- 特异性抑制SPIB基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 一种特异性抑制MIF的shRNA药物及其应用的制造方法与工艺
- 一种用于猪繁殖与呼吸综合征病毒特异性检测的荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 特异性抑制PADI2基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 用于抑制单链RNA病毒复制的治疗的制造方法与工艺
- 基于miRNA数据和组织特异性网络的药物重定位方法与流程
- 用于蓝舌病病毒型特异性检测的竞争ELISA检测试剂盒及其应用的制造方法与工艺
- 特异性抑制CA7基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 用于结肠特异性递送的药物组合物的制造方法与工艺
- 特异性抑制SPIB基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 一种特异性抑制MIF的shRNA药物及其应用的制造方法与工艺
- 一种用于猪繁殖与呼吸综合征病毒特异性检测的荧光定量RT‑PCR试剂盒及应用的制造方法与工艺