一种提高微藻生产虾青素含量的方法与流程
本发明属于活性分子领域,尤其涉及一种提高微藻生产虾青素含量的方法。
背景技术:
虾青素(astaxanthin)是一种具有强抗氧化活性的类胡萝卜素。虾青素的化学名称为3,3’-二羟基-4,4-二酮基-β,β’-胡萝卜素,分子式为c40h52o4,其具有的长的共轭不饱和双键以及共轭双键末端的α-羟基酮结构,使得其具有更活泼的电子效应,能够有效清除自由基,具有强的抗氧化作用。
目前投入生产的虾青素的来源主要有三种,水产废料,红发夫酵母(phaffiarhodozyma)及雨生红球藻(rangarao,a2010)。相比而言雨生红球藻有以下优点:1.自身可以进行光合作用,不需要额外提供碳源,2.逆境下诱导积累大量类胡罗卜素的方式,不仅赋予了其在逆境胁迫下的强大生存能力也使其成为天然虾青素含量最高的物种。雨生红球藻细胞内合成的虾青素是左旋虾青素,而工业生产的及其他来源的虾青素都是三种旋光物的混合物。但同时利用雨生红球藻生产虾青素也有一些弊端:如藻生物量积累缓慢,增殖缓慢,容易污染,及需要外界胁迫条件来诱导产生虾青素。因此国内外学者正致力于通过雨生红球藻培养条件的优化、分子改良等方法使雨生红球藻可以同时获得虾青素和生物量的积累。
微藻由于具有生物量大,生长周期短,易培养等优点,被视为生产色素,维生素,多不饱和脂肪酸等高附加值产品的重要来源。产类胡萝卜素的微藻可以在逆境下天然合成包括虾青素在内的大量类胡萝卜素(最多可占藻干重的4~5%),雨生红球藻最高可生产占干重3~5%的虾青素(jinek,m.,etal.2012)。
雨生红球藻(haematococcuspluvialis)属于绿藻门(chlorophyta)、绿藻纲(chlorophyceae)、团藻目(volvoeales)、红球藻科(haematococceae)、红球藻属(haematococcus)。是一种具有双鞭毛的淡水单细胞绿藻,藻细胞直径约5~50μm,细胞壁由纤维素层和果胶质层等内外两层组成。雨生红球藻具有三种营养类型,即光合自养(photoautotrophic)、化能异养(heterotrophic)及混合营养(mixtrophic)。有研究证明在光照条件下额外添加醋酸盐可以有效提高雨生红球藻的营养水平。雨生红球藻的生活史呈现多样性,具有微小细胞(microzooid),游动细胞(motilemacrozooid),不动孢子(non-motilepalmelloid)和红细胞(haematocyst)四种形态。在弱光、氮磷丰富的环境中主要以绿色的游动细胞的形式存在,细胞呈前端凸起的椭圆形,原生质体和细胞壁间存在较大空间,细胞具两条顶生、等长、长度约等于体长的鞭毛,细胞大小约20~30μm,这一过程中藻细胞生长旺盛,光合作用强,细胞多呈绿色,细胞内主要含有叶绿素a、叶绿素b、叶黄素,仅有少量β-胡萝卜素;而在不利条件(高光、高温、高盐和营养饥饿)下,则以不动孢子(厚壁孢子)形式存在,此时藻细胞呈圆形,失去鞭毛无法游动,细胞直径10μm~50μm不等,此时细胞内含有的主要色素成分是虾青素和β-胡萝卜素,藻细胞呈现红色。传统观点认为,累积虾青素主要在厚壁孢子阶段进行。雨生红球藻的增殖方式为细胞分裂,遭遇不良环境会转变成厚壁孢子。雨生红球藻是否营有性生殖目前尚无明确报道。雨生红球藻生产虾青素的技术仍有待完善,尤其在雨生红球藻培养、虾青素积累及提取等方面仍存在微藻生产虾青素含量低技术难题。
有研究表明,雨生红球藻在生长阶段和虾青素积累阶段,对光照、温度、无机盐等生长条件的要求有所不同,低光强、低温和充足的营养物质更加有利于雨生红球藻的快速生长,而高光、高温、各种营养物质的胁迫则会导致虾青素的大量积累。因此,目前国内外对雨生红球藻都是用二阶段培养法,首先采用最适生长条件实现微藻营养细胞的高密度生长,继而对其进行胁迫处理,促使营养细胞转变为厚壁孢子,最大程度的提高虾青素产量。
胁迫条件是雨生红球藻积累虾青素的关键环节,并在很大程度上决定了虾青素的产量和质量。目前,尽管对光照、温度等传统胁迫因子条件参数已基本确定,但高光等胁迫方式不仅导致细胞大量死亡,同时由于形成厚壁孢子,降低了生物的直接利用率,并使虾青素的提取成本和难度大为增加。
综上所述,目前还没有一种能显著促提高微藻生产虾青素含量的方法和产品,因此寻找一种有效且工艺处理成本低的提高微藻生产虾青素含量的方法是本领域技术人员亟待解决的技术问题。
技术实现要素:
有鉴于此,本发明公开了一种提高微藻生产虾青素含量的方法,能显著促进微藻生产虾青素,而且该方法效率高,成本低,具有广泛的工业应用前景。
本发明公开了醇类化合物在提高微藻生产虾青素含量中的应用。
本发明还公开了在制备提高微藻生产虾青素含量的产品中的应用。
在一些实施例中,所述醇类化合物为甲醇、乙醇或丁醇中的一种或多种。
在一些实施例中,所述醇类化合物为甲醇或/和乙醇。
在一些实施例中,所述醇类化合物为乙醇。
在一些实施例中,所述乙醇为无水乙醇。
在一些实施例中,所述微藻为雨生红球藻、杜氏盐藻或小球藻中的一种。
在一些实施例中,所述微藻为雨生红球藻。
其中,雨生红球藻、杜氏盐藻或小球藻同属绿藻,雨生红球藻、杜氏盐藻或小球藻均能合成虾青素,均含有虾青素合成途径。在合成虾青素的微藻中,雨生红球藻是模式微藻。对于杜氏盐藻或小球藻来说,对醇类化合物(如乙醇)产生同样的生理生化反应,因此,醇类化合物能促进雨生红球藻、杜氏盐藻或小球藻合成虾青素。
本发明还公开了一种提高微藻生产虾青素含量的促进剂,包括:醇类化合物和微藻培养基。
在一些实施例中,所述微藻培养基为所述微藻的生长需要的培养基。
本发明提供了一种提高微藻生产虾青素含量的方法,包括以下步骤:
1)获得处于平台期的微藻,将醇类化合物与平台期微藻混合处理,得到处理后的微藻;
2)收集处理后的微藻,分离、提取微藻中的虾青素。
其中,正常生长情况下,处于平台期的雨生红球藻,细胞呈圆形,无鞭毛,整个藻细胞呈绿色并充满原生质体,细胞质内出现一些储存有虾青素的脂质油滴。而乙醇处理情况下,处于平台期的雨生红球藻整个细胞呈红色,细胞壁特化,细胞内充满脂质油滴。
在一些实施例中,所述醇类化合物为甲醇、乙醇或丁醇中的一种或多种。
在一些实施例中,所述醇类化合物为乙醇。
作为优选,所述醇类化合物在平台期微藻中的体积百分比为0.0999%-0.3984%。
更为优选,所述醇类化合物在平台期微藻中的体积百分比为0.0999%-0.2991%。
最为优选,所述醇类化合物在平台期微藻中的体积百分比为0.1996%。
在一些实施例中,所述平台期微藻的密度为1×105-2×105个/ml。
在一些实施例中,所述平台期微藻的密度为1.42×105个/ml。
在一些实施例中,所述微藻为雨生红球藻、杜氏盐藻或小球藻中的一种。
在一些实施例中,所述微藻为雨生红球藻。
在一些实施例中,所述醇类化合物与平台期微藻的混合处理时间为5~7天。
本发明的目的针对现有技术还没有一种能显著提高微藻生产虾青素含量的方法和产品。因此,本发明意外的发现醇类化合物在促进微藻合成虾青素中的应用和醇类化合物在制备促进微藻合成虾青素产品中的应用,实验数据表明,醇类化合物确实能显著提高微藻生产虾青素含量,与正常培养的微藻中的虾青素含量相比,醇类化合物处理微藻生产的虾青素显著提高,醇类化合物处理组的总虾青素的含量由干重的0.7%上升至3.85%。结果表明,醇类化合物使得微藻处于胁迫状态,乙醇处理后的微藻细胞呈红色,细胞壁特化,细胞内大量充满脂质油滴,说明醇类化合物能促进微藻生产虾青素。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
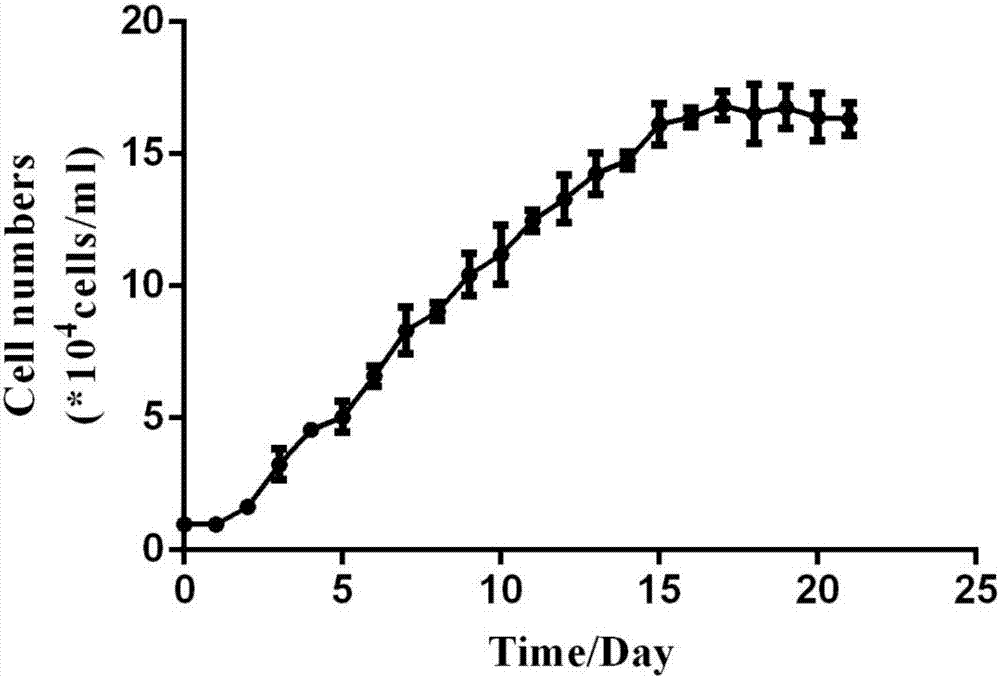
图1示雨生红球藻生长曲线测定结果,其中,横坐标为时间(单位:天),纵坐标为细胞密度(单位:104个/ml);
图2示不同浓度的乙醇梯度处理雨生红球藻的虾青素含量,其中,横坐标为每50ml雨生红球藻中乙醇含量,纵坐标为虾青素相对od值;
图3示光学显微镜下的雨生红球藻细胞形态,其中,a为正常生长组,b为乙醇处理组;
图4示正常生长和乙醇处理雨生红球藻的透射电镜分析,其中,a为正常生长组,b为乙醇处理组;
图5示正常生长和乙醇处理雨生红球藻的hplc色谱图,其中,a为正常生长组,b为乙醇处理组;
图6示正常生长和乙醇处理雨生红球藻的虾青素和脂质含量变化,其中,control为正常生长组,etoh为乙醇处理组,横坐标的free-ast为虾青素,monoester为虾青素单脂,diester为虾青素双脂,纵坐标为在干重中的重量百分比;
图7示正常生长和乙醇处理雨生红球藻的叶黄素和类胡萝卜素含量变化,其中,control为正常生长组,etoh为乙醇处理组,横坐标的lutein为叶黄素,carotenoid为类胡萝卜素,纵坐标为在106个细胞的质量;
图8示正常生长和乙醇处理雨生红球藻的光合作用活性,其中,control为正常生长组,etoh为乙醇处理组,横坐标为时间(天),纵坐标为fv/fm比值;
图9示正常生长和乙醇处理雨生红球藻的电子传递速率,其中,control为正常生长组,etoh为乙醇处理组,横坐标为时间(单位为天),纵坐标为电子传递速率;
图10示正常生长和乙醇处理雨生红球藻的脂肪酸成分,其中,wt为正常生长组1,wt4为正常生长组4,etoh为乙醇处理组,横坐标为不同种类的脂肪酸,纵坐标为脂肪酸含量百分比。
具体实施方式
本发明提供了一种提高微藻生产虾青素含量的方法,本发明的方法能显著提高微藻生产虾青素含量,而且该方法效率高,成本低,具有广泛的工业应用前景。
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
其中,以下实施例的试剂均为市售。
实施例1
藻种的培养,具体步骤如下:
雨生红球藻haematococcuspluvialisccap3601购买自厦门大学海洋藻类研究中心。雨生红球藻的培养采用液体bbm培养基。雨生红球藻的培养在恒温培养箱中进行,温度为25±1℃,光照强度18.75±2.5μmolm-2s-1,12h/12h光暗周期下静置培养,每天手动震荡1~2次。
实施例2
生长曲线的测定,具体步骤如下:
初始接种浓度为1×104个细胞/ml,从接种的第二天开始,连续22天每天用浮游植物计数框对三瓶平行藻样的浓度进行计算,从而测定雨生红球藻的生长周期,绘制生长曲线。
生长曲线测定的结果如图1,通过计数,本实验中得到的雨生红球藻的生长曲线如图所示,初始接种的藻细胞数目为1×104个细胞/ml,从第二天开始,雨生红球藻快速生长,到了第16天,微藻生长缓慢,接种的第1~15天为对数生长期,第16天进入平台期。
实施例3
不同浓度的乙醇梯度处理雨生红球藻,具体步骤如下:
将处于平台期(从104个/ml接种培养到第16天)的雨生红球藻,分为8组,每组体积为50ml,ctr组为正常培养,5μl组为添加5μl乙醇处理组,10μl组为添加10μl乙醇处理组,20μl组为添加20μl乙醇处理组,50μl组为添加50μl乙醇处理组,100μl组为添加100μl乙醇处理组,150μl组为添加150μl乙醇处理组,200μl组为添加200μl乙醇处理组,分别处理7天,固定乙醇添加量,其他的培养条件不变,测定雨生红球藻的生物量和虾青素的含量。虾青素的相对含量采用检测od480值的方法测定。
结果如图2,在480nm的波长处测其od值。结果与正常生长组比较可发现,低剂量的乙醇(5μl、10μl、20μl)对雨生红球藻积累虾青素的影响不大,高剂量的乙醇进行胁迫处理可明显提高提高虾青素的积累量。其中,在50ml处于平台期的雨生红球藻中边摇晃瓶身边缓慢加入100μl的无水乙醇,单位藻细胞内虾青素积累达到最大值。
实施例4
光学显微镜下的雨生红球藻细胞形态,具体步骤如下:
将处于平台期(从104个/ml接种培养到第16天,培养条件为在恒温培养箱中进行,温度为25±1℃,光照强度18.75±2.5μmolm-2s-1,12h/12h光暗周期下培养)的雨生红球藻,分为两组,每组体积为50ml,a组为正常生长组,不添加任何物质,b组为乙醇处理组,b组中添加100μl乙醇,处理时间为7天,两组的处理条件为在恒温培养箱中进行,温度为25±1℃,光照强度18.75±2.5μmolm-2s-1,12h/12h光暗周期下培养。
将正常生长组和乙醇处理组的雨生红球藻分别用5%的甲醇固定液固定,吸取10μl至载玻片上,使用普通光学显微镜进行镜检,物镜倍数60×,观察乙醇处理藻的形态变化。
结果如图3所示,正常生长组雨生红球藻藻液仍为绿色,在培养基中均匀分布,无明显贴壁生长状况,藻细胞呈圆形,无鞭毛,藻细胞整体呈绿色,原生质体充满整个细胞,细胞内已经有存储有虾青素的脂质油滴出现;乙醇处理组的雨生红球藻呈红色,细胞壁特化,细胞内充满大量的脂质油滴。
实施例5
正常生长和乙醇处理雨生红球藻的透射电镜分析,具体步骤如下:
取实施例4的a组正常生长组,b组乙醇处理组的雨生红球藻细胞30ml,在4℃,3000×g条件下分别离心10min收集。去掉上清液后,藻细胞分别用1×pbs缓冲液悬浮清洗3次,5000g离心3min收集藻细胞。溶于ph7.2含有2.5%(v/v)戊二醛及2%(w/v)多聚甲醛浓度为0.1mnah2po4缓冲液中的进行固定,并在4℃条件下用真空泵真空处理30min。5000×g离心1min并去掉上清液,重新加固定液在4℃固定12h。固定完成后,5000×g离心1min去除固定液,并加入ph7.2浓度为0.1m的nah2po4缓冲液清洗4次(15min和30min各2次)。之后样品用1%(w/v)四氧化锇在4℃下固定3h,完成后用0.1mnah2po4缓冲液(ph7.2)清洗4次(15min和30min各2次)。完成后用梯度浓度的乙醇(30%,50%,70%,80%,90%v/v)对样品进行脱水,每隔10min更换一种浓度,最后用100%的乙醇冲洗两次(每次30min)。之后样品分别重悬于环氧丙烷(2次,每次30min)和1:1(v/v)环氧丙烷:环氧树脂(1次,30min)中进行细胞渗透。完成后藻细胞固定于100%w/v环氧树脂中,24h,且在70℃中包埋的时间不少于8h。藻细胞完成包埋后利用8800ultratomeiii进行超微切片,并用乙酸双氧铀及柠檬酸铅对切片进行染色。处理后的切片利用tecnai-10透射电子显微镜进行观察。
透射电镜观察藻细胞内部细胞结构变化如图4所示,图4a正常生长组的雨生红球藻可见明显的细胞核、叶绿体、蛋白核、细胞壁等结构,叶绿体中具有多层类囊体膜结构,在细胞周边分散分布。乙醇处理组的雨生红球藻如图4b,可见细胞壁增厚,依然可以看到清晰的细胞核结构,但叶绿体减少,细胞中充满了脂质油滴。
实施例6
正常生长和乙醇处理雨生红球藻的hplc色谱图,具体步骤如下:
标准品配制:先分别在干净的棕色瓶中配制虾青素、番茄红素、叶黄素、岩藻黄素和β-胡萝卜素标准品的母液,保存于-80℃冰箱中备用。分别取8ul标准品母液于新的棕色瓶中,混合均匀,标记好再放入-20℃冰箱待测。
色谱条件:色谱柱为atlantisc18(4.6×250mm),流动相a相为乙腈:甲醇:去离子水(75:15:5),b相为甲醇:乙酸乙酯(70:30),其中甲醇、乙腈、乙酸乙酯均为色谱纯。柱温设置为室温,进样量10ul,流速为1ml/min,检测波长为432nm、442nm、455nm和480nm。
取实施例4的a组正常生长组,b组乙醇处理组的雨生红球藻进行色谱分析。结果如图5~图7可见,乙醇处理组的虾青素单酯和虾青素二酯大量积累,乙醇处理组的虾青素单酯和虾青素二酯的含量极显著提高,p<0.01。由峰面积计算各种色素的含量变化,如图6所示,乙醇处理后总虾青素(monoester和diester含量总和)的含量由干重的0.7%上升至3.85%,如图7所示,β胡萝卜素作为虾青素的合成前体,含量有极显著下降,p<0.01,而叶黄素水平保持稳定。
实施例7
取实施例4的a组正常生长组,b组乙醇处理组的雨生红球藻测定其光合作用效率和电子传递速率。
结果如图9可见,乙醇处理组的雨生红球藻的光合作用效率和电子传递速率随处理时间延长而显著下降,表明乙醇处理让雨生红球藻处于胁迫状态,在受到外界胁迫作用时光合作用效率会下降。
实施例8
雨生红球藻脂肪酸成分分析,具体步骤如下:
取平台期(从104个/ml接种培养到第16天)的雨生红球藻,分成3组,每组为50ml,wt组为3瓶,wt4组为3瓶,etoh组为3瓶。
根据yang等人的方法(ffectofanintroducedphytoenesynthasegeneexpressiononcarotenoidbiosynthesisinthemarinediatomphaeodactylumtricornutummar.drugs2015,13,5334-5357)进行脂质的提取,使用气相色谱-质谱进行分析。4400rpm离心10min收集藻细胞,采用冻干仪器冻干藻,并称其干重,向干燥好的藻细胞加入koh-ch3oh,超声波破碎,上清与hcl-ch3oh混匀后75℃反应10min后液体分层,用正己烷萃取,加入c19内标,由氮吹仪吹干。用于脂肪酸干重和组分的分析。
正常生长和乙醇处理雨生红球藻的脂肪酸成分如图10所示。wt组的脂肪酸含量从高到低依次是c16:0,c18:2和c18:3,随着生长时间延长,四天之后的wt4组雨生红球藻脂肪酸组成差异不大,但c18:2有所降低而c18:3有所升高。乙醇处理后的etoh组主要脂肪酸发生了变化,含量由高到低依次为c16:0,c18:0和c18:1,etoh组的c16:0,c18:0和c18:1均有极显著提高,p<0.01,而这一结果与虾青素酯中的脂肪酸的主要成分一致。乙醇处理后的etoh组饱和脂肪酸(sfa)中除c18:0显著上升外,其余种类变化不显著。乙醇处理后的etoh组单不饱和脂肪酸(mufa)都有不同程度的显著增长,而多不饱和脂肪酸(pufa)都呈下降趋势。
综上所述,以上实施例的实验数据表明,醇类化合物确实能显著促进微藻生产虾青素,与正常培养的微藻中的虾青素含量相比,醇类化合物处理微藻生产的虾青素显著提高,醇类化合物处理组的总虾青素的含量由干重的0.7%上升至3.85%。结果表明,醇类化合物使得微藻处于胁迫状态,乙醇处理后的微藻细胞呈红色,细胞壁特化,细胞内大量充满脂质油滴,说明醇类化合物能促进微藻生产虾青素。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!