一种高效基因编辑快速制备PD-1-T细胞方法及其应用与流程
技术领域
本发明属于生物医学领域,尤其是涉及一种高效基因编辑快速制备PD-1-T细胞方法及其应用。
背景技术:
机体免疫系统中的T细胞是淋巴细胞的主要构成部分,T淋巴细胞主要用来抵抗外来入侵物且具有多样的生物学功能。它是机体进行对抗疾病的入侵、感染以及肿瘤形成的主要“战士”。目前,肿瘤治疗的方法一般为手术、放疗和化疗,在这些方法中存在一些问题,其中过继治疗中会出现免疫逃逸现象,影响抗肿瘤效应。
PD-1(programmed death 1)即程序性死亡受体1是一种负性抑制性的调节受体,当T细胞活化后可明显使PD-1表达上升,通过与配体PD-L1的联合作用可明显抑制T细胞的活化和细胞增殖能力,影响T细胞分泌各种细胞因子的能力。通过封闭或者敲除这类分子,可助于肿瘤免疫激活,已有报道采用抗体封闭PD-1或使用PD-1抑制剂进行治疗,是很有前景的肿瘤免疫辅助治疗方法。而在实验中发现,使用阻断剂或PD-1抑制剂时也存在一些弊端如抗体具有免疫原性且费用较高。因此寻找一种高效且成本适中的方法至关重要。
CRISPR/Cas9(Clustered Regμlarly Interspaced Short Palindromic Repeats)基因技术是近两年来新出现的一种生物技术,通过人工设计RNA形成sgRNA指导Cas9蛋白在靶位点定点切割DNA,是目前生物医学领域研究的一大热点。现在诱导特异性T淋巴细胞的方法多采用融合细胞刺激,因此本研究利用CRISPR/Cas9基因编辑技术敲除T细胞上PD-1受体基因,在体内外进一步验证融合细胞诱导的特异性T细胞的抗肿瘤作用。
但是现有的CRISPR/Cas9基因技术尽管在许多领域得到了运用,也表现出了很好的效果,但是在肿瘤治疗方面,特别是敲除T细胞上的PD-1基因上在公开技术中并没有涉及,此外,现有的CRISPR/Cas9敲除PD-1基因技术并没有发现有联合应用高穿透肽小分子TAT,这样就存在质粒转染效率和PD-1基因编辑效率较低的问题。因此,在使用CRISPR/Cas9基因技术敲除PD-1基因的基础上使用融合细胞诱导的特异性PD-1-T细胞具有抗肿瘤作用,并且联合应用高穿透肽小分子TAT为肿瘤的免疫治疗提供了一种新的策略。
技术实现要素:
本发明的目的在于,针对上述存在的问题,提供一种高效基因编辑快速制备PD-1ˉT细胞方法及其应用,本发明的方法可有效敲除PD-1基因,显著提高质粒转染效率与PD-1基因编辑效率以获得特异性PD-1ˉT细胞,产生抗肿瘤效应,运用于肿瘤治疗中。
为实现上述发明目的,本发明采用的技术方案如下:
本发明的一种高效基因编辑快速制备PD-1ˉT细胞方法,包括以下步骤:
1)获取人外周血T淋巴细胞:取外周血100ml,用等量PBS稀释血液后缓慢加入淋巴细胞分离液,离心,弃血清,将白膜层中单个核细胞吸出于新的离心管中,离心,弃上清,用15~30mlPBS洗三次;用不完全1640重悬置于培养箱中,1.5~2.5h细胞贴壁后,吸取悬浮的细胞,过尼龙绵柱后得到T淋巴细胞。
2)质粒转染:将步骤1)所得T淋巴细胞调整浓度为1×107/ml,质粒调整为相同浓度,分别吸取90~120μl细胞悬液、2~5μl质粒与2~10μl高穿透力小分子引导肽TAT水溶液均匀混合后吸入无菌的电转杯,电转后快速将细胞转移至12孔板中并加入2ml预热的完全培养基,置于37℃,5%CO2培养箱继续培养,即可完成质粒转染,得到PD-1ˉT细胞。
3)融合细胞的制备:向步骤(1)中的贴壁细胞中加入GM-CSF1000M/ml、IL-4500M/ml诱导出DC细胞,然后靶细胞HepG2,使用分子量为1450的PEG诱导DC/HepG2融合。
4)PD-1-T肿瘤特异性T细胞的扩增:使用步骤(3)所得DC/HepG2融合诱导步骤(2)中完成质粒转染的PD-1ˉT细胞增殖。
进一步地,在步骤(1)中,所述外周血用等量PBS稀释加入淋巴细胞分离液离心后分为四层,从上到下依次是血清、白膜层、分离液、红细胞,所述离心条件为在1500~2000rpm下,离心10~15min。
进一步地,所述质粒为px330-PD-1-gRNA质粒,所述px330-PD-1-gRNA质粒的构建方法为根据PD-1基因的CDS区设计gRNA,用BBSI酶切pX330质粒将gRNA和线性化的pX330质粒通过T4连接酶连接,之后转化大肠杆菌,挑取单克隆进行测序,筛选出重组入sgRNA的pX330-PD-1-gRNA质粒,进行单克隆菌的扩增,提取质粒。
进一步地,所述电转杯的电转条件设置为210V,20ms、310V,20ms、410V,20ms。
进一步地,所述完全培养基为DMEM培养基,并加以10%的胎牛血清和100M/ml的抗生素。
本发明还提供了一种高效基因编辑快速制备PD-1ˉT细胞方法在抗肿瘤中应用。
更进一步地,所述肿瘤为实体肿瘤,该实体肿瘤为肝癌、肺癌、肠癌、前列腺癌、胰腺癌和肺腺癌的一种或几种。
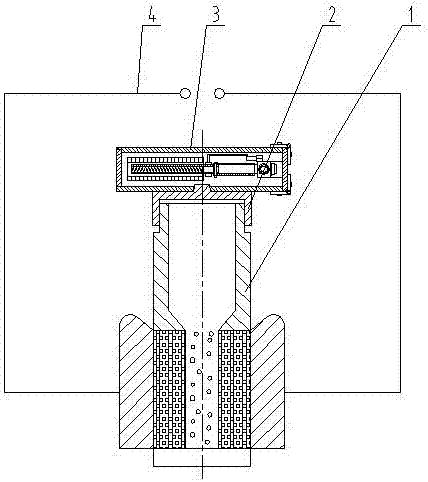
更进一步地,所述步骤2)的电转杯,包括杯子和杯盖,所述杯盖的上方还设有能够将杯子内腔清洗干净以及消毒烘干的清洗烘干器,所述杯盖包括盖体以及设于盖体上部的凸起,所述清洗烘干器的底部设有与凸起相互配合的凹槽,所述清洗烘干器通过底部的凹槽与盖体的凸起紧密连接,所述杯子包括杯体以及设于杯体内的正、负电极,在所述正、负电极外圈的两侧还分别设有导电体,在所述两侧导电体还设有连接导线,所述正、负电极通过导电体与连接导线与外部的电转仪电性连接,所述的清洗烘干器包括左、右封板、上盖板和下托板而围成的箱式结构,在所述箱式结构的任一封板内安装有铰接座,在所述的铰接座上连接有铰接轴,所述铰接轴伸出的一端连接有伸缩管,所述伸缩管的另一端还连接有加热棒,所述清洗器开关上连接有导线与插头,在所述加热棒的外圆周上安装有毛刷,在所述伸缩管上设有能够使得加热棒加热或毛刷旋转的清洗器开关,所述的安装有铰接座的封板与上盖板以及封板与下托板之间均安装有活页。
本发明所述的外周血采自健康志愿者,所述淋巴细胞分离液购自天津市灏洋生物制品公司。
综上所述,由于采用上述技术方案,本发明相比现有技术所具有的突出的实质性特点和显著的进步是:
(1)将CRISPR/Cas9基因技术运用于T细胞中PD-1基因的敲除,特异性好。本发明利用CRISPR/Cas9基因技术成功构建出sgRNAs,利用电穿孔技术将此px330-PD-1-gRNA质粒转染至人外周血来源的T淋巴细胞并进行敲除T细胞上的PD-1基因,所获得的PD-1-T细胞阻断了负抑制性的调节受体,具有更好的肿瘤抑制活性。
(2)将经过基因敲除的T细胞用融合细胞扩增,抗肿瘤效应更强。本发明利用PEG化学法进行DC/HepG2的融合,用融合细胞诱导出特异性的PD-1-T淋巴细胞,根据本发明实验来看,所诱导出的特异性的PD-1-T淋巴细胞在荷人肝癌SCID鼠体内通过抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡来延缓肿瘤的生长,从而延长荷瘤小鼠的生存时间,说明诱导细胞抗肿瘤效应更强,适合医学推广。
(3)运用TAT,提高基因编辑效率:本发明在质粒转染的过程中使用了高穿透力小分子引导肽TAT,高穿透力小分子引导肽TAT与质粒混合后,再转染T细胞,显著提高了质粒的转染效率和PD-1基因的编辑效率,最大程度的发挥CRISPR/Cas9基因敲除技术的效力,相比现有技术中使用该技术敲除PD-1基因具有更高的效率,在本发明实验中可以明显看出无论是基因敲除PD-1基因T细胞表达水平效果显著。
(4)本发明所采用的电转杯结构合理,在所述杯盖的上方还设有能够将杯子内腔清洗干净以及消毒烘干的清洗烘干器,清洗烘干器通过盖体上部的凸起与清洗烘干器底部的凹槽相互配合紧密连接,且本清洗烘干器使用时可通过伸缩杆以及上盖板与下托板的延长,将毛刷伸入到杯体内刷洗,还可以通过加热棒对杯体进行加热并烘干,使得杯体清洗方便,杯子的耐用度高大大节约了实验的经费。
附图说明
图1为本发明敲除PD-1基因的情况。
图2为本发明各组细胞刺激的T淋巴细胞组增殖指数。
图3为本发明体外诱导的特异性T淋巴细胞对HepG2的杀伤情况
图4为本发明体外诱导的特异性T淋巴细胞对A549的杀伤情况。
图5为本发明在30:1杀伤浓度下,各组细胞对HepG2、A549的杀伤效率。
图6为本发明制备DC/HepG2诱导的PD-1-T细胞体内过继治疗小鼠后肿瘤细胞的凋亡情况。
图7为本发明实验中各细胞促进过继治疗小鼠后肿瘤细胞的凋亡情况。
图8为本发明实验中治疗后肿瘤体积的大小。
图9为本发明实验中各组小鼠生存率。
图10是电转杯的主视结构示意简图。
图11是杯子1的内部剖视结构示意简图。
图12是杯盖2的内部剖视结构示意简图。
图13是清洗器3的内部剖视结构示意简图。
图14是清洗器3对杯子1进行清洗的示意简图。
图15是清洗器3对杯子1进行加热烘干的示意简图。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等。如无特殊说明,均可从商业途径得到。
一、实施例中使用的材料及试剂:
外周血采自健康志愿者,所述淋巴细胞分离液购自天津市灏洋生物制品公司。
人肝癌HepG2细胞(ATCC,货号HB-8065),公众可从申请人处获得该申请材料,只为重复本发明实验所用,不可作为其它用途。
二、高效基因编辑快速制备PD-1ˉT细胞方法:
(1)获取人外周血T淋巴细胞:取外周血100ml,用等量PBS稀释血液后缓慢加入淋巴细胞分离液,离心,弃血清,将白膜层中单个核细胞吸出于新的离心管中,离心,弃上清,用20mlPBS洗三次;用不完全1640重悬置于培养箱中,2h细胞贴壁后,吸取悬浮的细胞,过尼龙绵柱后得到T淋巴细胞。所述外周血用等量PBS稀释加入淋巴细胞分离液离心后分为四层,从上到下依次是血清、白膜层、分离液、红细胞,所述离心条件为在1500rpm下,离心10min。
(2)质粒转染:将步骤(1)所得T淋巴细胞调整浓度为1×107/ml,质粒调整为相同浓度,分别吸取100μl细胞悬液、4μl质粒和5μl高穿透力小分子引导肽TAT水溶液均匀混合后吸入无菌的电转杯,电转后快速将细胞转移至12孔板中并加入2ml预热的完全培养基,置于37℃,5%CO2培养箱继续培养,即可完成质粒转染,得到PD-1ˉT细胞。所述质粒为px330-PD-1-gRNA质粒,所述px330-PD-1-gRNA质粒的构建方法为根据PD-1基因的CDS区设计gRNA,用BBSI酶切pX330质粒将gRNA和线性化的pX330质粒通过T4连接酶连接,之后转化大肠杆菌,挑取单克隆进行测序,筛选出重组入sgRNA的pX330-PD-1-gRNA质粒,进行单克隆菌的扩增,提取质粒。所述完全培养基为DMEM培养基,并加以10%的胎牛血清和100M/ml的抗生素。
所述步骤(2)的电转杯,包括杯子1和杯盖2,所述杯盖2的上方还设有能够将杯子1内腔清洗干净以及消毒烘干的清洗烘干器3,所述杯盖2包括盖体9以及设于盖体9上部的凸起10,所述清洗烘干器3的底部设有与凸起10相互配合的凹槽22,所述清洗烘干器3通过底部的凹槽22与盖体9的凸起10紧密连接,所述杯子1包括杯体5以及设于杯体5内的正、负电极7,在所述正、负电极7外圈的两侧还分别设有导电体6,在所述两侧导电体6还设有连接导线4,所述正、负电极7通过导电体6与连接导线4与外部的电转仪电性连接,所述的清洗烘干器3包括左、右封板11、上盖板12和下托板21而围成的箱式结构,在所述箱式结构的任一封板11内安装有铰接座19,在所述的铰接座19上连接有铰接轴20,所述铰接轴20伸出的一端连接有伸缩管16,所述伸缩管16的另一端还连接有加热棒14,所述清洗器开关15上连接有导线与插头17,在所述加热棒14的外圆周上安装有毛刷13,在所述伸缩管16上设有能够使得加热棒14加热或毛刷13旋转的清洗器开关15,所述的安装有铰接座19的封板11与上盖板12以及封板11与下托板21之间均安装有活页18。
(3)融合细胞的制备:向步骤(1)中的贴壁细胞中加入GM-CSF1000M/ml、IL-4500M/ml诱导出DC细胞,然后靶细胞HepG2,使用分子量为1450的PEG诱导DC/HepG2融合。所述电转杯的电转条件设置为210V,20ms、310V,20ms、410V,20ms。
(4)PD-1-T肿瘤特异性T细胞的扩增:使用步骤(3)所得DC/HepG2融合诱导步骤(2)中完成质粒转染的PD-1ˉT细胞增殖。
本发明还提供了一种高效基因编辑快速制备PD-1ˉT细胞方法在抗肿瘤中应用。
所述肿瘤为实体肿瘤,该实体肿瘤为肝癌、肺癌、肠癌、前列腺癌、胰腺癌和肺腺癌的一种或几种。所述肿瘤具体可为在裸鼠上生长的人肝癌。
三、肿瘤相关获得PD-1ˉT细胞的鉴定:
1、基因敲除PD-1基因T细胞表达水平检测
根据T7E1酶切鉴定敲除情况,提取转染px330-PD-1-gRNA的T细胞基因组进行PCR扩增后,经T7E1酶切后出现两个现行条带,大小分别为370 bp、530 bp,符合原质粒片段大小(如图1)。
2、DC/HepG2刺激诱导的PD-1-T淋巴细胞的增殖情况
用流式细胞仪检测CFSE荧光衰减程度,检测融合细胞诱导的各组特异性T淋巴细胞的增殖情况。如图2所示,经SPSS统计结果,分析得DC/HepG2刺激诱导的PD-1-T淋巴细胞组的增殖明显高于DC/HepG2刺激诱导的PD-1+T淋巴细胞组和单独T细胞组,并且差异有统计学意义,Ρ<0.05。结果显示DC/HepG2体外刺激诱导的PD-1-T淋巴细胞有更强的细胞增殖能力。
3、DC/HepG2诱导的PD-1-T淋巴细胞能特异性杀伤靶细胞的检测情况
将T细胞、DC/HepG2融合细胞刺激培养5-7天后的T细胞、PD-1+T、PD-1-T淋巴细胞作为效应细胞,对数期生长的HepG2细胞、A549细胞作为靶细胞。经过杀伤公式计算后结果显示,在20:1和30:1的比例下,DC/HepG2诱导的PD-1-T淋巴细胞对靶细胞HepG2的杀伤效率要高于DC/HepG2诱导的PD-1+T淋巴细胞和其他组的杀伤效率(如图3)。在三个杀伤效靶比下,DC/HepG2诱导的PD-1-T淋巴细胞对A549的杀伤效率都要高于DC/HepG2诱导的PD-1+T淋巴细胞和其他组细胞(如图4)。在30:1的杀伤比例下,DC/HepG2诱导的PD-1-T淋巴细胞的杀伤效率都要高于对其他靶细胞的杀伤效率(如图5)。
4、DC/HepG2诱导的PD-1-T细胞能促进肿瘤组织内肿瘤细胞凋亡的检测实验
取荷瘤小鼠的肿瘤组织制成石蜡切片,用荧光TΜNEL方法检测肿瘤细胞的凋亡情况。在荧光显微镜下观察染色后的肿瘤组织切片,发绿色荧光的细胞则为阳性细胞即凋亡或正在凋亡的肿瘤细胞,蓝色荧光为细胞核。结果显示DC/HepG2诱导的PD-1-T细胞实验组的荷人肝癌小鼠的肿瘤细胞凋亡数目明显多于其他对照(如图6)。同时用统计图进行了各组肿瘤细胞凋亡数目的统计学分析DC/HepG2诱导的PD-1-T淋巴细胞与其他组相比均有差异,差异有统计学意义(图7),*P<0.05, **P<0.01,***P<0.001。
5、DC/HepG2诱导的PD-1-T细胞对小鼠生存时间影响的实验
构建小鼠肝癌模型,在荷瘤一周后开始过继治疗诱导的T淋巴细胞,每周治疗一次,共治疗3次,每6天观察记录肿瘤体积大小。通过观察在治疗后第18天时,各组肿瘤体积大小出现差别,DC/HepG2诱导的PD-1-T细胞过继治疗后小鼠肿瘤体积能显著抑制肿瘤的生长,其效果明显好于其他对照组且差别有统计学意义(如图7)。记录观察小鼠生存率,结果显示DC/HepG2诱导的PD-1-T淋巴细胞能明显延长荷瘤小鼠的生存时间(如图8)。
本发明并不局限于前述的具体实施方式,本发明扩展到任何本说明书中披露的新特征或新的组合,以及披露的任一新方法或过程的步骤或新的组合。
- 还没有人留言评论。精彩留言会获得点赞!