一种适体和鲁米诺-金纳米粒子功能化的RNA膜及其制备方法和应用与流程
本发明涉及生物材料制备技术领域,具体涉及一种适体和鲁米诺-金纳米粒子功能化的RNA膜及其制备方法和应用。
背景技术:
循环肿瘤细胞(CTCs)是从原发性肿瘤流入脉管系统或淋巴系统并在体内循环的细胞。它是肿瘤生长相关基因组和蛋白质组的载有信息的货运载体,其进入循环系统并在重要的远端器官中形成转移,是造成大多数癌症相关死亡的重要原因。因此,从外周血检测CTCs可成为常规癌症诊断的可靠替代,有望成为一种新的癌症“生物标记物”,用于观测疾病进展和指导治疗实施。然而,由于缺少可靠的用于鉴定CTCs的工具箱,因此阐明体液中的CTCs功能仍远远落后于基因组和蛋白质组。
物理法基于肿瘤细胞与正常细胞物理性质,如大小、变形性、密度、介电性等的差异,利用外力场比如磁场,流体场,电场等的作用进行分离捕获。生物化学法通常依赖于细胞膜表面的抗原与偶联在分离介质上的抗体相结合,达到分离捕获的目等。这些方法已被用于癌细胞的识别,捕获,分离和成像,这被认为是用于CTCs计数的有希望的工具。
由于生物纳米复合物和典型的CTCs表面标志物之间的局部地形交互的设计,虽然上述这些技术可以识别并结合特有的CTCs,但是它们被限制为低能力和低特异性结合捕获CTCs。CTCs可能具有一个以上的表面标记物,单个表面生物标志物的丰度也可随着细胞周期阶段的变化而波动,导致生物标志物与其相应识别分子之间的结合亲和力可发生变化。现有技术并没有关于能够高效检测CTCs的材料或方法的报道。
技术实现要素:
本发明的目的在于提供一种适体和鲁米诺-金纳米粒子功能化的RNA膜及其制备方法和应用。本发明提供的适体和鲁米诺-金纳米粒子功能化的RNA膜能够实现循环肿瘤细胞的捕获和释放,且能够使电致化学发光增强,实现生物传感的高效检测。
本发明提供了一种适体和鲁米诺-金纳米粒子功能化的RNA膜,包括RNA膜和功能修饰单元,所述功能修饰单元包括Ramos适体和鲁米诺-金纳米粒子,所述RNA膜和Ramos适体和鲁米诺-金纳米粒子分别通过羧基-氨基和Au-N键作用力结合;
所述适体和鲁米诺-金纳米粒子功能化的RNA膜的制备方法包括以下步骤:
1)将HAuCl4溶液在加热、搅拌的条件下与鲁米诺溶液混合,得到鲁米诺-金纳米粒子溶液;
2)将5μM磷酸化的DNA 1和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA1;所述DNA1的序列如SEQ ID NO.1所示;
所述引物1的序列如SEQ ID NO.4所示,或所述引物1为在SEQ ID NO.4所示的序列的5’端标记有巯基或生物素的物质;
3)将5μM磷酸化的DNA2和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA2;所述DNA2的序列如SEQ ID NO.2所示;
4)将5μM步骤2)得到的所述环化的DNA 1和5μM步骤3)得到的所述环化的DNA2与4mM核糖核苷酸混合物溶液、5UμL-1T7 RNA聚合酶和滚环转录反应缓冲液混合,在37℃下孵育24小时,得到RNA膜;所述反应缓冲液包括40mM Tris-HCL、6mM MgCl2、2mM亚精胺和1mM DTT,pH值为7.9;
5)将步骤4)得到的RNA膜与步骤1)得到的鲁米诺-金纳米粒子溶液混合,37℃进行孵育反应12h,得到鲁米诺-金纳米粒子功能化的RNA膜;
6)将步骤5)得到的鲁米诺-金纳米粒子功能化的RNA膜中加入20μM的Ramos适体溶液,25℃黑暗中温育12h,得到适体和鲁米诺-金纳米粒子功能化的RNA膜;所述Ramos适体为在SEQ ID NO.3所示的序列的5’端标记有羧基的物质;
所述步骤1)与步骤2)~步骤4)没有时间先后顺序的限定。
优选的是,所述步骤4)中核糖核苷酸混合物包括dATP、dGTP、dCTP和NH2-dUTP。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜的制备方法,包括以下步骤:
1)将HAuCl4溶液在加热、搅拌的条件下与鲁米诺溶液混合,得到鲁米诺-金纳米粒子溶液;
2)将5μM磷酸化的DNA 1和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA1;所述DNA1的序列如SEQ ID NO.1所示;
所述引物1的序列如SEQ ID NO.4所示,或所述引物1为在SEQ ID NO.4所示的序列的5’端标记有巯基或生物素的物质;
3)将5μM磷酸化的DNA2和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA2;所述DNA2的序列如SEQ ID NO.2所示;
4)将5μM步骤2)得到的所述环化的DNA 1和5μM步骤3)得到的所述环化的DNA2与4mM核糖核苷酸混合物溶液、5UμL-1T7 RNA聚合酶和滚环转录反应缓冲液混合,在37℃下孵育24小时,得到RNA膜;所述反应缓冲液包括40mM Tris-HCL、6mM MgCl2、2mM亚精胺和1mM DTT,pH值为7.9;
5)将步骤4)得到的RNA膜与步骤1)得到的鲁米诺-金纳米粒子溶液混合,37℃进行孵育反应12h,得到鲁米诺-金纳米粒子功能化的RNA膜;
6)将步骤5)得到的鲁米诺-金纳米粒子功能化的RNA膜中加入20μM的Ramos适体溶液,25℃黑暗中温育12h,得到适体和鲁米诺-金纳米粒子功能化的RNA膜;所述Ramos适体为在SEQ ID NO.3所示的序列的5’端标记有羧基的物质;
所述步骤1)与步骤2)~步骤4)没有时间先后顺序的限定。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜或上述技术方案所述制备方法得到的适体和鲁米诺-金纳米粒子功能化的RNA膜的细胞捕获或释放用药物,所述细胞为循环肿瘤细胞。
优选的是,引物1为在SEQ ID NO.4所示的序列的5’端标记有生物素的物质。
优选的是,通过添加与Ramos适体的序列互补的DNA3,置换细胞,实现细胞的释放,所述DNA3的序列如SEQ ID NO.5所示。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜或上述技术方案所述制备方法得到的适体和鲁米诺-金纳米粒子功能化的RNA膜的电化学发光试剂。
优选的是,引物1为在SEQ ID NO.4所示的序列的5’端标记有巯基的物质。
优选的是,所述试剂还包括3-氨丙基三乙氧基硅烷。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜或上述技术方案所述制备方法得到的适体和鲁米诺-金纳米粒子功能化的RNA膜的生物传感器,所述生物传感器包括经适体和鲁米诺-金纳米粒子功能化的RNA膜修饰的电极。
本发明提供了适体和鲁米诺-金纳米粒子功能化的RNA膜。本发明提供的适体和鲁米诺-金纳米粒子功能化的RNA膜含有大量的氨基,能够保证所形成的的RNA及RNA膜稳定;鲁米诺-金纳米粒子对RNA膜的表面修饰能够使其具有电致化学发光的性质;Ramos适体对RNA膜的表面修饰能够使其对Ramos细胞有特异性识别作用。本发明提供的功能化的RNA膜能够实现细胞的捕获和释放,且能够产生电化学发光,实现生物传感的高效检测。
附图说明
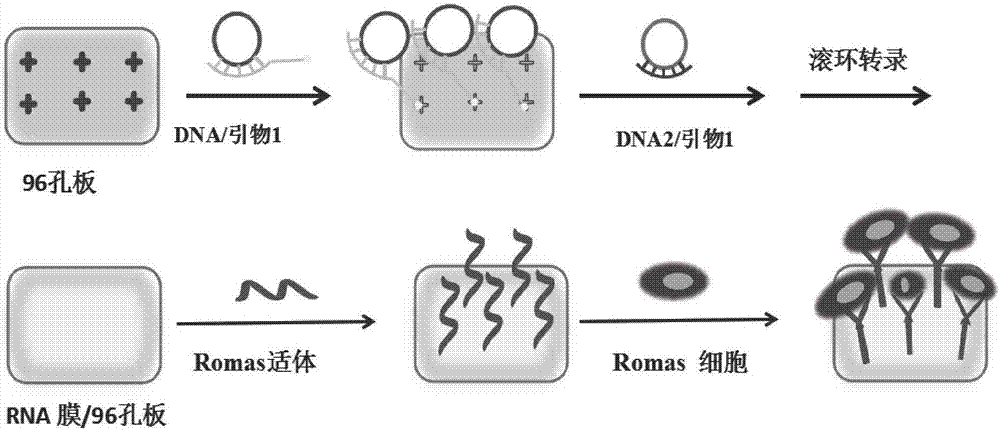
图1为本发明提供的RNA膜的制备示意图;
图2为本发明实施例2提供的细胞捕获的适体和鲁米诺-金纳米粒子功能化的RNA膜的制备方法示意图;
图3为本发明实施例2提供的细胞捕获和释放结果图;
图4为本发明实施例3提供的RNA膜合成的琼脂糖凝胶检测结果图;
图5为本发明实施例3提供的RNA膜、luAuNPs和luAuNPs功能化的RNA膜的观测结果图;
图6为本发明实施例3提供的各阶段电极的CV曲线和EIS曲线结果图;
图7为本发明实施例3提供的ECL反应结果图;
图8为本发明实施例3提供的基于APS作为ECL增强器和luAu NP功能化的RNA膜用于细胞传感原理图;
图9为本发明实施例3提供的不同Ramos细胞量的ECL强度曲线图及对Ramos细胞选择性图。
具体实施方式
本发明提供了一种适体和鲁米诺-金纳米粒子功能化的RNA膜,包括RNA膜和功能修饰单元,所述功能修饰单元包括Ramos适体和鲁米诺-金纳米粒子,所述RNA膜和Ramos适体和鲁米诺-金纳米粒子分别通过羧基-氨基和Au-N键作用力结合;
所述适体和鲁米诺-金纳米粒子功能化的RNA膜的制备方法包括以下步骤:
1)将HAuCl4溶液在加热、搅拌的条件下与鲁米诺溶液混合,得到鲁米诺-金纳米粒子溶液;
2)将5μM磷酸化的DNA 1和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA1;所述DNA1的序列如SEQ ID NO.1所示;
所述引物1的序列如SEQ ID NO.4所示,或所述引物1为在SEQ ID NO.4所示的序列的5’端标记有巯基或生物素的物质;
3)将5μM磷酸化的DNA2和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA2;所述DNA2的序列如SEQ ID NO.2所示;
4)将5μM步骤2)得到的所述环化的DNA 1和5μM步骤3)得到的所述环化的DNA2与4mM核糖核苷酸混合物溶液、5UμL-1T7 RNA聚合酶和滚环转录反应缓冲液混合,在37℃下孵育24小时,得到RNA膜;所述反应缓冲液包括40mM Tris-HCL、6mM MgCl2、2mM亚精胺和1mM DTT,pH值为7.9;
5)将步骤4)得到的RNA膜与步骤1)得到的鲁米诺-金纳米粒子溶液混合,37℃进行孵育反应12h,得到鲁米诺-金纳米粒子功能化的RNA膜;
6)将步骤5)得到的鲁米诺-金纳米粒子功能化的RNA膜中加入20μM的Ramos适体溶液,25℃黑暗中温育12h,得到适体和鲁米诺-金纳米粒子功能化的RNA膜;所述Ramos适体为在SEQ ID NO.3所示的序列的5’端标记有羧基的物质;
所述步骤1)与步骤2)~步骤4)没有时间先后顺序的限定。
在本发明的技术方案所述基因的具体核苷酸序列如表1所示。
表1核苷酸序列表
本发明对上述基因的来源没有特殊的限定,采用本领域技术人员熟知的基因合成生物公司进行合成即可。
本发明将HAuCl4溶液在加热、搅拌的条件下与鲁米诺溶液混合,得到鲁米诺-金纳米粒子溶液。具体地,本发明优选将质量百分比为0.01%的HAuCl4溶液加热至沸腾,在搅拌的条件下,加入体积比为(50~70):1,更优选为62.5:1的0.01mol/L的鲁米诺溶液,冷却得到鲁米诺-金纳米粒子溶液。本发明对HAuCl4和鲁米诺的来源没有特殊的限定,采用本领域技术人员熟知的HAuCl4和鲁米诺的常规市售产品即可,优选的,所述HAuCl4购自生工生物科技有限公司(上海,中国),鲁米诺购自sigma公司;在本发明中,所述鲁米诺溶液的溶剂优选为NaOH溶液,NaOH溶液的浓度为0.01mol/L,氯金酸溶液的溶剂为水。在本发明中,所述搅拌优选剧烈搅拌,所述搅拌的速率优选为700r/min,且鲁米诺溶液的添加优选迅速。在HAuCl4沸点下,氯金酸与鲁米诺发生氧化还原反应,得到的混合物的颜色由黄色变成红色或紫色。
本发明得到鲁米诺-金纳米粒子溶液后,优选通过TEM和UV/Vis光谱进行表征。
本发明将5μM磷酸化的DNA 1和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA1;所述DNA1的序列如SEQ ID NO.1所示。在本发明中,所述磷酸化的作用为便于DNA1在T4连接酶作用下成环,本发明对所述磷酸化的DNA1的来源没有特殊的限定,采用本领域技术人员熟知的磷酸化DNA常规市售产品即可。
本发明所述磷酸化DNA1和引物1混合后,在25℃条件下,在连接酶的作用下,能够使DNA1的切口连接,形成环状DNA1。在本发明中,所述引物1的序列如SEQ ID NO.4所示,或所述引物1为在SEQ ID NO.4所示的序列的5’端标记有巯基或生物素的物质;本发明引物1所述SEQ ID NO.4所示序列部分能够作用于DNA1,使DNA1形成环状。在SEQ ID NO.4所示的序列的5’端标记有巯基或生物素的引物1能够使形成环状的DNA1特异性结合于相应介质上,具体地,本发明引物1的5’端标记巯基能够使RNA膜具有与金电极结合的功能,标记生物素能够使RNA膜具有与修饰有链霉亲和素的介质相结合的功能。本发明对所述引物1中生物素或巯基的标记方法没有特殊限定,采用本领域技术人员熟知的生物公司进行合成或购买即可。
在本发明中,所述冷却至25℃需要的时间优选不超过1h,更优选为20~50min。
本发明对所述T4连接酶的来源没有特殊的限定,采用本领域技术人员熟知的T4连接酶的常规市售产品即可,本发明优选采用购自Thermo的T4连接酶。在本发明中,所述T4连接酶的浓度优选为0.05UμL-1。在本发明中,所述连接体系的体积优选为50μL。
本发明将5μM磷酸化的DNA2和5μM的引物1于水中混合,95℃保持2min,冷却至25℃,加入T4连接酶和连接反应缓冲液,25℃连接反应12h,得到环化的DNA2;所述DNA2的序列如SEQ ID NO.2所示。在本发明中,所述冷却到25℃需要的时间优选不超过1h,更优选为20~50min。
本发明对所述T4连接酶的来源没有特殊的限定,采用本领域技术人员熟知的T4连接酶的常规市售产品即可,本发明优选采用购自Thermo的T4连接酶。在本发明中,所述T4连接酶的浓度优选为0.05UμL-1。在本发明中,所述连接体系的体积优选为50μL。
得到环化的DNA1和环化的DNA2后,本发明以环化的DNA1和环化的DNA2为原料进行RNA膜的合成,本发明将5μM步骤2)得到的所述环化的DNA 1和5μM步骤3)得到的所述环化的DNA 2与4mM核糖核苷酸混合物溶液、5UμL-1T7 RNA聚合酶和滚环转录反应缓冲液混合,在37℃下孵育24小时,得到RNA膜;所述反应缓冲液包括40mM Tris-HCL、6mM MgCl2、2mM亚精胺和1mM DTT,pH值为7.9。
在本发明中,所述核糖核苷酸混合物包括dATP、dGTP、dCTP和NH2-dUTP。核糖核苷酸混合溶液的浓度指的是单个核苷酸的浓度。本发明对dUTP进行氨基修饰能够使得合成的RNA膜带有丰富的氨基,便于与适体上的羧基、鲁米诺-金纳米粒子发生反应。本发明对dATP、dGTP、dCTP和NH2-dUTP的来源没有特殊的限定,采用本领域技术人员熟知的dATP、dGTP、dCTP和NH2-dUTP的常规市售产品即可,如购自新英格兰生物。
本发明将环化的DNA1、环化的DNA2和T7 RNA聚合酶及滚环转录反应缓冲液、核糖核苷酸混合物溶液混合后,会发生RNA滚环转录反应,环化的DNA1和环化的DNA2会形成长单链,DNA1和DNA2对应形成的长单链之间互补序列的存在,会发生交联杂交,最终形成RNA膜。本发明所述RNA膜制备示意图如图1所示。
得到RNA膜后,本发明将得到的RNA膜与鲁米诺-金纳米粒子溶液混合,37℃进行孵育反应12h,得到鲁米诺-金纳米粒子功能化的RNA膜;本发明鲁米诺-金纳米粒子功能化的RNA膜具有电致化学发光性质。在本发明中,所述RNA膜与鲁米诺-金纳米粒子溶液的体积比优选为1:5,更优选将RNA膜的用量设为100μL,鲁米诺-金纳米粒子溶液的用量设为500μL。在本发明中,所述孵育反应完成后,优选进行离心,除去上清液后,得到的沉淀为鲁米诺-金纳米粒子功能化的RNA膜。所述鲁米诺-金纳米粒子功能化的RNA膜优选用水溶液定量到100μL备用。
得到鲁米诺-金纳米粒子功能化的RNA膜后,本发明将步骤5)得到的鲁米诺-金纳米粒子功能化的RNA膜中加入20μM的Ramos适体溶液,25℃黑暗中温育12h,得到适体和鲁米诺-金纳米粒子功能化的RNA膜;所述Ramos适体为在SEQ ID NO.3所示的序列的5’端标记有羧基的物质。在本发明中,所述功能化的RNA膜和Ramos适体溶液的体积比优选为2:1,更优选取功能化的RNA膜100μL,Ramos适体溶液50μL进行具体反应。在本发明中,Ramos适体上的羧基与鲁米诺-金纳米粒子功能化的RNA膜上的氨基发生反应,两者结合后,RNA膜具有特异性识别Ramos细胞的功能。
在本发明中,所有的试剂,包括缓冲液优选灭菌后使用;所述灭菌优选为蒸汽高压灭菌或过滤方式灭菌;所述蒸汽高压灭菌的条件优选为121℃,40分钟;所述过滤方式灭菌的条件优选为过0.22μm孔径滤膜。本发明所有操作优选在无菌条件下进行。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜的制备方法,所述制备方法的具体操作方式如上述内容所述。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜或上述技术方案所述制备方法得到的适体和鲁米诺-金纳米粒子功能化的RNA膜的细胞捕获或释放用药物,所述细胞为循环肿瘤细胞。
在本发明中,当适体和鲁米诺-金纳米粒子功能化的RNA膜应用于细胞捕获时,所述引物1为在SEQ ID NO.4所示的序列的5’端标记有生物素的物质。
本发明所述细胞捕获优选在96孔板中进行,所述96孔板优选采用链霉亲和素进行改性。本发明对所述链霉亲和素改性的96孔板的来源没有特殊的限定,采用常规市售链霉亲和素改性的96孔板即可。本发明在细胞捕获过程中,优选将改性后的96孔板作为反应容器进行上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜的制备。由于引物1中修饰有生物素,反应完成后,RNA膜能够通过链霉亲和素结合到96孔板上。将RNA膜固定在96孔板上后,本发明优选在96孔板中加入初始密度为2×105个细胞/mL的Ramos(1mL)接种到每个孔中,并用PBS洗涤两次以除去未附着的细胞,实现细胞的捕获。在本发明中,细胞捕获情况的检测优选采用细胞计数法。
在本发明中,当适体和鲁米诺-金纳米粒子功能化的RNA膜应用于细胞释放时,引物1为在SEQ ID NO.4所示的序列的5’端标记有生物素的物质,通过添加与Ramos适体的序列互补的DNA3,置换细胞,实现细胞的释放,所述DNA3的序列如SEQ ID NO.5所示。在本发明中,所述DNA3与Ramos适体的序列互补,能够实现与RNA膜的结合,释放细胞。在本发明中,所述细胞释放的检测优选采用细胞计数法。释放的细胞活力用商品化的台盼蓝试剂盒检测。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜或上述技术方案所述制备方法得到的适体和鲁米诺-金纳米粒子功能化的RNA膜的电化学发光试剂。
在本发明中,适体和鲁米诺-金纳米粒子功能化的RNA膜应用于电化学发光增强过程中,所述引物1为在SEQ ID NO.4所示的序列的5’端标记有巯基的物质。在本发明中,所述试剂还包括3-氨丙基三乙氧基硅烷。在本发明中,所述电化学发光增强过程中,优选在反应体系中加入3-氨丙基三乙氧基硅烷(APS),所述APS的添加能够使信号得到进一步增强。
本发明还提供了上述技术方案所述适体和鲁米诺-金纳米粒子功能化的RNA膜或上述技术方案所述制备方法得到的适体和鲁米诺-金纳米粒子功能化的RNA膜的生物传感器,所述生物传感器包括经适体和鲁米诺-金纳米粒子功能化的RNA膜修饰的电极。
在本发明中,所述巯基能够与金电极发生反应,形成Au-S键,将RNA膜与金电极连接。本发明在将适体和鲁米诺-金纳米粒子功能化的RNA膜应用于电化学发光增强过程中时,优选以金电极为固体介质,本发明优选将金电极加入预处理后的环状DNA1溶液中后,4℃静置12h,得到固定有环状DNA1的电极,随后将所述固定有环状DNA1的电极放入环状DNA2溶液中,加入核糖核苷酸溶液、滚环转录反应缓冲液和T7 RNA聚合酶,按照上述技术方案所述的反应条件进行反应,得到固定在金电极上的RNA膜。
随后,按照上述技术方案所述操作依次添加luAuNPs溶液和Ramos适体溶液,得到固定有适体和鲁米诺-金纳米粒子功能化RNA膜的金电极。
得到固定在金电极上的适体和鲁米诺-金纳米粒子功能化的RNA膜后,本发明将所述固定在金电极上的适体和鲁米诺-金纳米粒子功能化的RNA膜进行ECL检测。本发明所述ECL检测优选采用Ramos细胞进行,将电极浸入含有Ramos细胞的培养基中,37℃反应2h,冲洗电极去除游离的Ramos细胞。本发明对所述ECL检测方法没有特殊的限定,采用本领域技术人员熟知的ECL检测方法即可。本发明所述ECL检测优选采用10mM的H2O2溶液作为测定Ramos细胞的工作溶液,未经细胞处理的Au电极作为检测的对照组。在本发明中,所述电致化学发光过程中,优选在反应体系中加入3-氨丙基三乙氧基硅烷(APS),所述APS的添加能够信号得到进一步增强。具体地,本发明优选将20μL含有0.5μLAPS的去离子水滴加到Au电极表面,在25℃下保持12h。
下面结合具体实施例对本发明所述的一种适体和鲁米诺-金纳米粒子功能化的RNA膜及其制备方法和应用做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
药品和试剂
1-乙基-[3-(二甲基氨基)丙基]-碳二亚胺(EDC),N-羟基琥珀酰亚胺酯(NHS),三(2-羧乙基)膦盐酸盐购自Sigma-Aldrich。3-氨丙基三乙氧基硅烷(APS)从Sigma-Aldrich购买。
将鲁米诺(Sigma)溶解在NaOH溶液(0.1mol L-1)中制备鲁米诺母液(0.01mol L-1)。链霉亲和素改性的96孔培养板和氯金酸是从生工生物科技有限公司购买,(上海,中国)。
T7 RNA聚合酶和核糖核苷酸(dATP、dGTP、dCTP、NH2-dUTP)是从新英格兰生物购买。
T4DNA连接酶购自Thermo。
所有寡核苷酸由Sangon Biotech Co.,Ltd。(中国上海)合成(表1)。
实验用水为超纯水(18.25MΩ)。
对于细胞实验,所有的试剂,缓冲液和培养基通过蒸汽高压灭菌器(121℃,40分钟)灭菌或过滤(0.22μm孔径,Millipore)灭菌,并维持在无菌条件下。
仪器
透射电子显微镜(JEM-2100,JEOL)和扫描电子显微镜(SEM)对形貌进行表征。紫外可见吸收光谱由紫外可见分光光度计(Cary 60,Agilent)获得。用CHI600E电化学工作站(中国上海)进行循环伏安(CV)实验。ECL强度用MPI-E型光致电化学发光分析仪(西安雷米克斯电子有限公司,中国西安)测量。
实施例1
luAu NPs的制备
将50mL HAuCl4溶液(0.01%,w/w)加热至沸点并剧烈搅拌,然后快速加入0.8mL 0.01mol/L的鲁米诺溶液。沸点下,混合物的颜色会从黄色变成红色或紫色。然后除去加热源,将胶体溶液冷却至室温,并通过TEM和UV/Vis光谱进行表征。表征结果见图5B、图5C和图5D。
环状DNA的合成
在超纯水中将5μM磷酸化的DNA 1与5μM的引物1混合。将该混合溶液在95℃下变性退火并保持2min,并在1h内冷却至25℃。然后,将溶液与0.05UμL-1的T4连接酶和其缓冲液在25℃下温育12小时以连接环化的DNA 1中的切口,得到环化的DNA1。
在超纯水中将5μM磷酸化的DNA 2与5μM的引物1混合。将该混合溶液在95℃下变性退火并保持2min,并在1h内冷却至25℃。然后,将溶液与0.05UμL-1的T4连接酶和其缓冲液在25℃下温育12小时以连接环化的DNA 2中的切口,得到环化的DNA2。
RNA膜的合成
对于RNA膜的自组装,将5μM环化的DNA 1和5μM环化的DNA2与4mM核糖核苷酸溶液混合物(dATP,dGTP,dCTP,dUTP),和5UμL-1T7RNA聚合酶及滚环转录反应缓冲液(40mM Tris-HCL,6mM MgCl2,2mM亚精胺,1mM DTT,pH7.9)在37℃下孵育24小时,得到RNA膜。
适体和luAu NP功能化的RNA膜的制备
RNA膜在37℃与luAu NPs溶液反应12h。在这段时间内,luAu NP被Au-N键固定在膜表面,就形成了luAu NP的RNA膜,25℃下,加入20μM的Ramos适体溶液在黑暗中温育12小时,适体和luAu NP功能化的RNA膜形成,其表征结果见图5A。
实施例2
细胞的捕获和释放
本实验采用的是经链霉亲和素改性的96孔板。首先,将DNA 1和5’端标记有生物素的引物1用实施例1中提供的合成方法合成环状DNA 1。由于生物素的存在,5μM的环状DNA 1通过生物素修饰的引物1连接到96孔板上,在37℃下反应2小时,使生物素和链霉亲和素结合,然后加入5μM环状DNA2,4mM核糖核苷酸溶液混合物(dATP,dGTP,dCTP,NH2-dUTP),滚环转录反应缓冲液和5UμL-1 T7RNA聚合酶,在37℃下反应24小时合成RNA膜。96孔板上修饰RNA膜在37℃与luAu NPs溶液反应12h。在这段时间内,luAu NP被Au-N键固定在膜表面。用超纯水彻底冲洗luAu NPs/RNA膜修饰的96孔板以去除游离luAu NP。25℃下,加入20μM的Ramos适体溶液在黑暗中温育12小时,然后洗去游离的适体。将初始密度为2×105个细胞/mL的Ramos(1mL)接种到每个孔中,并用PBS洗涤两次以除去未附着的细胞。为了检查细胞释放,将96孔板在含有5μM二级互补序列DNA3的溶液中在37℃孵育30分钟,DNA3可以与Ramos适体互补,可将细胞释放,然后洗涤两次以使释放的细胞从膜表面脱落。这在肿瘤转移的诊断和预后、药物研发、个体化治疗及其探索肿瘤转移机制等方面具有潜在的价值。
表面功能化的微/纳米尺度颗粒和微粒广泛用于细胞和蛋白质的分离。细胞与底物之间增强的局部生物分子—配体相互作用可显着提高捕获效率。通过羧基-氨基结合的具有针对特定细胞适体的RNA膜,这些RNA膜可以识别并捕获细胞。本实验中,我们通过RNA膜上的氨基可以和Ramos适体上的羧基结合,形成适体/luAuNPs/RNA膜,可用来特异性捕获Romas细胞。将初始密度为2×105个细胞/mL的Ramos(1mL)接种到适体/luAuNPs/RNA膜修饰的96孔板(用于细胞捕获的适体和鲁米诺-金纳米粒子功能化的RNA膜的制备方法示意图如图2所示)中,并用PBS洗涤两次以除去未附着的细胞。功能化RNA膜的所需Ramos细胞可以被适体和鲁米诺-金纳米粒子功能化的RNA膜有效捕获,而其他血细胞包括不需要的细胞将自由穿过适体和鲁米诺-金纳米粒子功能化的RNA膜。其捕获效率为93%。这些结果为适体可以与纳米材料相容地结合提供了有力证据。为了检测细胞释放,将5μM二级互补序列DNA3的溶液加到96孔板中在37℃孵育30分钟。然后洗涤两次以使释放的细胞从膜表面脱落。DNA3可以与Ramos适体互补,所以可以使Romas细胞得以释放。显微照片显示细胞附着于膜上,附着的细胞在用DNA3处理后从膜上释放(细胞捕获和释放结果图如图3所示,图3A为细胞捕获和释放的荧光图像。为了清楚观察,用Vybrant细胞标记溶液标记细胞。误差线表示标准偏差(n=5)。图3B为细胞捕获和释放的定量分析图),释放的细胞活力约为91%。图3A是RNA膜捕获的细胞暗场成像图、明场成像图和暗明场叠加成像图,表明RNA膜上捕获了大量细胞。图3B是捕获时和释放后细胞的量,表明大部分细胞被释放了。
实施例3
制备适体和鲁米诺-金纳米粒子功能化的RNA膜修饰的Au电极
对于电极的预处理,将裸金电极依次用1.0mm,0.3mm,0.05mm的Al2O3抛光成镜面状,依次在超纯水,乙醇,超纯水中超声处理10min。然后在CHI600E电化学工作站上采用用循环伏安法(CV)在-0.2和1.6V之间(相对于在0.5M H2SO4中的Ag/AgCl)以100mV s-1的扫描速率清洁金电极,直到获得可再现的循环伏安图。通过在含有[Fe(CN)6]3和[Fe(CN)6]4(均为1mM)的PBS(0.1M,pH 7.0)中的Ag/AgCl在-0.2和0.6V之间循环来表征,峰—峰的差值小于100mV。
制备实验中,5μM环状DNA 1(由DNA1和5’端标记有巯基的引物1用实施例1中提供的合成方法合成),将Au电极放在5μM环状DNA 1溶液中,4℃下12h,环状DNA1通过Au-S键固定在Au电极上,得到环状DNA 1修饰的金电极。然后电极稍微清洗以去除未结合的环状DNA 1。接下来将环状DNA 1修饰的金电极浸入互补的环状DNA2溶液中,加入4mM核糖核苷酸溶液混合物(dATP,dGTP,dCTP,NH2-dUTP),滚环转录反应缓冲液和5UμL-1 T7RNA聚合酶,在37℃下孵育24小时。在此期间,环状DNA 1和互补环状DNA2相互补充形成RNA膜。得到的RNA膜修饰的Au电极用超纯水彻底清洗以去除自由互补的环状DNA2。
适体、luAuNPs功能化RNA膜改性的Au电极的制备
将RNA修饰的Au电极浸入luAuNPs溶液中,4℃下反应12h,通过Au-N键将luAuNP固定在膜的表面上。用超纯水彻底冲luAuNPs/RNA膜修饰的Au电极以除去游离的luAuNPs。将该修饰电极置于鲁米诺溶液(1×10-3mol L-1)中,在4℃下保温12h,然后在25℃的黑暗中浸入20μM的Ramos适体溶液中反应12h,通过羧基与氨基反应将适配体自组装在膜表面,然后冲洗Au电极去除游离适体,得到适体、luAuNPs功能化RNA膜改性的Au电极。将20μL含有0.5μL APS的去离子水滴加到Au电极表面,在25℃下保持1h,得到APS增强的适体、luAuNPs功能化RNA膜改性的Au电极。
细胞培养
将Ramos,K562和Hela细胞悬浮于含有10%FBS和1%青霉素链霉素的DMEM培养基中,在37℃,5%CO2气氛的平衡空气湿润培养箱中培养。使用血球计数仪测定细胞密度,所述细胞的密度为2×105个细胞/mL。
ECL检测
对于ECL测量,将制备的适体、luAuNPs功能化的RNA膜修饰的Au电极浸入含有不同量的Ramos细胞的培养基中,37℃反应2h,然后冲洗Au电极以除去游离的Ramos细胞。10mM的H2O2溶液被用作测定Ramos细胞的工作溶液。未经细胞处理的Au电极、经K562细胞处理的Au电极和Hela细胞处理的Au电极作为对照组。
RNA膜的表征
图4为RNA膜合成的琼脂糖凝胶检测结果图,电泳分析结果中,(a)为引物1,(b)为DNA 1,(c)为DNA 2,(d)环化的DNA 1,(e)环化的DNA2,(f)为RNA膜。所述琼脂糖的浓度为1%。
图4所示为,使用溴化乙锭(EB)染色的聚丙烯酰胺凝胶电泳实施例1进行的RNA膜电泳表征(滚环转录反应),然后在UV照射下成像。通过透射电子显微镜(TEM)(JEM-2100,JEOL)检查RNA膜,luAuNPs和luAuNPs功能化的RNA膜的形态。
图5为RNA膜、luAuNPs和luAuNPs功能化的RNA膜的观测结果图;其中,图5A为RNA膜的TEM图像,图5B为luAuNPs的TEM图像,图5C为luAuNPs功能化的RNA膜的TEM图像,图5D为RNA膜、luAuNPs和luAuNPs功能化的RNA膜的UV/Vis吸收光谱,其中(a)为RNA膜,(b)为luAuNPs,(c)为luAuNPs/RNA膜。如图5所示,由于用luAuNPs修饰(图5B),RNA膜(图5A)的起皱和折叠层改变了,并且在用10nm luAu NPs进一步修饰后,我们发现luAuNPs密集地修饰在RNA膜(图5C)。
图5D显示用luAuNP修饰RNA膜前后的UV/Vis光谱(图5D-c)的比较。RNA膜在约260nm处显示峰,并且在约355nm和525nm处显示峰。用luAuNP修饰后,在355nm和525nm处发现了新的吸收带,被认为是luAuNP的等离子体激元带。这表明luAuNPs在RNA膜上的成功附着。结果与TEM测量结果一致。
电极的表征
循环伏安(CV)是一种有效而简便的电化学技术,用于监测修饰电极表面特征的变化。图6为各阶段电极的CV曲线和EIS曲线结果图
其中,图6A中,(a)为裸金电极的CV曲线;(b)为DNA1/Primer 1+Au电极的CV曲线;(c)为RNA膜+Au电极的CV曲线;(d)为适体+luAu NPs+RNA膜+Au电极的CV曲线;(e)为细胞+适体+luAu NPs+RNA膜+Au电极的CV曲线。图6B中,(a)为裸金电极的EIS曲线;(b)为DNA1/Primer 1+Au电极的EIS曲线;(c)为RNA膜+Au电极的EIS曲线;(d)为适体+luAu NPs+RNA膜+Au电极的EIS曲线;(e)为在10mM PBS(2.5mM Fe(CN)64-/3-+0.1M KCl,pH7.4)中的细胞+适体+luAu NP+RNA膜+Au电极的EIS曲线。
图6A显示了使用2.5mM Fe(CN)64-/3-作为电活性探针逐步修饰的Au电极的CV曲线。裸金电极在曲线a中表现出一对可逆的氧化还原峰和强的峰电流,归因于大的表面积和优异的电导率。当DNA1/引物1固定在上述电极上时,发现电流信号明显下降(曲线b)。RNA膜形成后,CV中的峰电流逐渐减少(曲线c)。然而,当luAu NP沉积在RNA膜修饰的电极上时,观察到安培响应的轻微增加(曲线d)。luAu NPs可以增加电极的有效表面积,所以提高电子转移速率是合理的。随后通过适体和细胞之间的特异性结合捕获细胞后,阳极和阴极峰之间的间隙变宽(曲线e)。这种现象归因于RNA或DNA和细胞的电子惰性特征,其阻碍了Fe(CN)64-/3-离子在电极表面的电子转移和质量传递。电化学阻抗谱(EIS)也可以给出修饰过程中Au电极表面阻抗变化的进一步信息。EIS测量使用的是CHI 660电化学分析仪(CH Instruments,Inc。),电极是具有裸Au电极的常规三电极系统或改性金电极为工作电极,铂丝为辅助电极,Ag/AgCl电极为参比电极。电解液为在含有2.5mM Fe(CN)64-/3-的0.01M PBS(pH 7.4)。图6B中的曲线a显示了裸金电极的EIS,近乎于直线,这是一个质量扩散限制电子转移过程的特点。随着DNA1/引物1(b)和RNA膜(c)的固定,电子传递阻力逐渐增加。然而,当适体和luAu NPs组装在电极上时,EIS显示较低的电阻(d)。其原因可能是固定在RNA膜层上的luAuNPs起着重要的作用,其与导线类似,使得电子转移更容易发生。对于形成luAu NPs机理,一种观点认为主要是负电荷的纳米金颗粒与质子化胺之间的静电吸附;另一种观点认为纳米金颗粒和胺之间存在较强的共价键。
ECL的增强机制推理
图7ECL反应结果图,其中,图7A为可能的反应机制和ECL电位曲线;其中(a)Au NPs,(b)luAu NPs;图7B为在0.1M PBS(pH8.0)中修饰金电极,可能的发光机制和发光电位曲线,扫描速率:100mV s-1,其中,(a)APS,(b)luAuNPs,(c)luAuNPs/APS。
我们可以合理地推断出鲁米诺对ECL是必不可少的,因为用金纳米颗粒代替luAuNPs没有观察到明显的ECL信号(图7A)。结果表明,ECL来自鲁米诺,金纳米颗粒不能产生ECL,但增加了界面面积以捕获更多的鲁米诺分子,促进鲁米诺的电子转移和ECL过程。另外,当用N2从溶液中除去溶解的氧时,ECL发射强度降低,表明溶解氧是溶液中产生luAu NPs的ECL的重要共同反应物。即由氧化性物质如O2-能够增强由鲁米诺阴离子电氧化成鲁米诺自由基引起的ECL。其机制可能是:去质子化鲁米诺的鲁米诺阴离子(LH-)可被氧化成鲁米诺自由基(LH·),然后LH·迅速去质子化成鲁米诺单阴离子自由基(L-·)。O2—·由L-·和溶解氧反应而成。鲁米诺ECL发光来源于激发态的3-氨基邻苯二甲酸(AP*),其可由L-·与O2—·的反应引起。
为了鉴定3-氨丙基三乙氧基硅烷(APS)对于ECL增强的功能,进行对照实验。在缺少luAuNPs的情况下,PBS中APS的ECL强度非常弱(图7B,曲线a),这表明APS不能生成ECL,因此ECL来自luAuNPs(图7B,曲线b),APS仅催化luAuNPs的ECL反应。如果3-缩水甘油醚氧基丙基三乙氧基硅烷替代APS涂覆在luAuNPs改性表面上,则ECL增强不明显,这与APS增强ECL不同。由于APS和3-缩水甘油醚氧基丙基三乙氧基硅烷除了前者具有胺官能团外,而后者具有环氧官能团,其他基团类似,因此可以推断APS的胺基在ECL增强中起关键作用,有助于在ECL反应期间产生自由基。根据之前的报道,还原物APS(RC3H7-NH2)在电极上可以产生氧化物(RC3H7-NH2+·)。在这种情况下,O2和APS在电极上的氧化还原反应可能产生O2·,后者会与L·发生反应,随后进一步氧化成AP*,导致发光。在图7B中用等式描述了可能的ECL机制。
Ramos细胞检测
通过与不同浓度的细胞孵育来评估细胞生物传感器的灵敏度和定量范围(基于APS作为ECL增强剂和luAu NP功能化的RNA膜用于细胞传感原理图如图8所示)。通过Au-S键的作用,将引物1结合在金电极表面,滚环转录后在金电极表面形成富含氨基的RNA膜。通过Au-N键作用,RNA膜上的氨基与luAu NP结合,产生电致化学发光信号。通过羧基-氨基反应,RNA膜上的氨基与羧基修饰的Ramos适体结合,捕获Ramos细胞后电致化学发光信号减弱,实现对Ramos细胞的检测。
图9为不同Ramos细胞量的ECL强度曲线图及对Ramos细胞选择性图。其中图9A为在0.1M PBS(pH 7.4)中,对于不同Ramos细胞量(分别为0,50,100,200,300,400,500,600和700个细胞)的相对ECL强度结果图。插图:ECL强度与Ramos细胞数量从50到700个细胞的图。图9B为当用200个Ramos细胞,2000个K562细胞和2000个Hela细胞和200个Ramos细胞在混合溶液中分析时的生物传感器的选择性结果图。
图9A显示了ECL反应与Ramos细胞数量之间的关系。随着Ramos细胞数量的增加,ECL信号逐渐降低。ECL强度与Ramos细胞数量呈线性关系,在50700个细胞范围内,检出限为50个细胞。线性关系可表示为Y=13466.88-18.2X,相关系数R=0.986,其中Y是ECL强度,X是Ramos细胞的量。如图9B所示,通过分别与200个Ramos细胞,2000个K562细胞和2000个Hela细胞孵育研究生物传感器对Ramos细胞的选择性识别,生物传感器对Ramos,K562,Hela以及含Ramos细胞(200个细胞)的混合物的交叉反应性可忽略不计。尽管它们的浓度很高,但只有完全匹配的细胞才能被捕获,并且设计的方案具有对其他对照细胞具有良好的选择性。通过使用在相同条件下制备的五个电极分析相同浓度的细胞来探索生物传感器的再现性,相对标准偏差(RSD)小于5.4%,表明功能化RNA膜ECL策略的重复性是可行的。
原始Ramos细胞适体序列的优异特异性已被证实(见图9B)。此外,通过研究其对各种非靶细胞的抗干扰能力,验证了Ramos细胞在纯缓冲液测定中的高度特异性。为了研究6%(v/v)全血中的检测特异性,检测了几种非靶细胞诱导的非特异性电流变化,所有的检测都是在相同的条件下进行的。实验结果表明,即使这些细胞的数量远高于目标分析物,但这些非靶细胞对ECL强度没有明显影响,这个功能是这个检测系统的另一个优点。为了研究所提出的系统在生物流体中的适用可能性,使用人血来添加不同浓度的靶细胞。对于1000到3000的细胞,回收率(85%到125%)是可以接受的。表2清楚地表明,该方法在血液中没有受损的快速测定可以成为真实生物样品中的潜在分析工具。
将Ramos细胞加入人血液样品中测定的回收率,细胞分析结果如表2所示。回收率在85%~125%之间。
表2细胞分析结果
总之,本发明提供了一种基于RNA膜的平台,通过使用寡核苷酸来进行细胞特异性的捕获和释放。重要的是,杂交适体的分子间杂交和转化的整个过程不涉及任何可能破坏细胞的因素。因此,这种可编辑的RNA膜平台具有很多生物和生物医学应用的巨大潜力,例如再生医学和细胞分离。此外,本发明的适体和鲁米诺-金纳米粒子功能化的RNA膜在APS添加的情况下能够实现ECL的大幅度增强,靶细胞的检测限可以低至50个细胞,该平台能够在生物流体中得到广泛的应用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110> 临沂大学
<120> 一种适体和鲁米诺-金纳米粒子功能化的RNA膜及其制备方法和应用
<160> 5
<170> SIPOSequenceListing 1.0
<210> 1
<211> 92
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
atagtgagtc gtattaactt acgctgagta cttcgattca agtccagtcc ataatactgc 60
gtgtgcgttg gtacgttaat acgactatcc ct 92
<210> 2
<211> 92
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atagtgagtc gtattaacgt accaacgcac acgcagtatt atggactgga cttgaatcga 60
agtactcagc gtaagtttag aggcatatcc ct 92
<210> 3
<211> 47
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
aacaccggga ggatagttcg gtggctgttc agggtctcct cccggtg 47
<210> 4
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
tttttttttt aatacgactc actataggga t 31
<210> 5
<211> 48
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
caccgggagg agaccctgaa cagccaccga actatcctcs ccggtgtt 48
- 还没有人留言评论。精彩留言会获得点赞!
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺