一种定点突变的甘露聚糖酶及其应用的制作方法
本发明涉及一种定点突变的甘露聚糖酶,特别是涉及来源于armillariellatabescens的β-甘露聚糖酶man47的突变体。
背景技术:
β-甘露聚糖酶(ec3.2.1.78)是一类能水解甘露聚糖上β-1,4-糖苷键、促使其水解生成小的寡甘露糖的酶的总称。根据酶作用底物特异性和作用特点,β-甘露聚糖酶可以分为外切β-甘露聚糖酶和内切β-甘露聚糖酶两种类型。其中,内切β-甘露聚糖酶是降解β-甘露聚糖的主要酶,它主要水解甘露聚糖和异甘露聚糖(半乳甘露聚糖、葡甘露聚糖、半乳葡甘露聚糖)中的β-1,4-d-甘露糖苷键。β-甘露聚糖酶对底物有严格的键专一性。
β-甘露聚糖酶广泛存在于自然界中,在动物(海洋动物)、发芽植物(如番茄、咖啡豆、瓜儿豆、魔芋、四棱豆等)的种子和微生物(包括细菌、真菌和放线菌)中都有所发现,其中微生物是β-甘露聚糖酶的主要来源。β-甘露聚糖酶在食品、医药、造纸、饲料和石油等工业中有广泛的应用。考虑到动物摄食、营养和饲料加工等过程的特殊要求,饲用甘露聚糖酶需具备一定的特殊性:如:良好温度稳定性,能够经受高温制粒的加工后在常温下仍具有高酶活;广谱的ph稳定性,一般动物的消化道不同位置酸碱环境不同,ph值在2.5-6.8左右,因此饲用甘露聚糖酶需要在酸性的环境下稳定存在的同时还需要在酸性和中性的条件下维持较高活性。
由于甘露聚糖酶在农业、食品等领域的广泛应用需求,人们对甘露聚糖酶的研究日益活跃。目前主要集中在(1)甘露聚糖酶的制备生产方法,如专利:cn201110038699.7(一种利用天然枯草芽孢杆菌制备β-甘露聚糖酶的方法)、cn201210133095.5(一种快速生产高纯度低聚甘露聚糖的方法)、cn200610073160.4(β-甘露聚糖酶及其表达方法与专用工程菌)、cn200510103125.8(一种甘露聚糖酶及其编码基因与应用)、cn201010601999.7(一种生产β-甘露聚糖酶的菌株及生产工艺);(2)筛选和克隆来自不同物种或者具有耐热或者耐酸的β-甘露聚糖酶,如专利:cn200810113343.3(一种嗜酸β-甘露聚糖酶man5a及其基因和应用)、cn200710121923.2(β-甘露聚糖酶及基因和制备方法以及载体和宿主细胞)、cn201010550927.4(一种新型β-甘露聚糖酶基因的克隆及重组酶的制备)、cn201110086452.2(耐热β-甘露聚糖酶及其编码基因、重组菌和应用)、cn201210121370.1(一种耐酸耐高温β-甘露聚糖酶基因及其应用)、cn201110410517.4(β-1,4-内切甘露聚糖酶tviman5a基因的克隆及重组酶的制备)、cn201110330274.3(一种具有宽ph范围的β-甘露聚糖酶ba-man5a及基因和应用)、cn201010621906.7(一种高温酸性甘露聚糖酶man5c1及其基因和应用)、cn201310190483.1(高温β-甘露聚糖酶编码基因及基因工程菌和应用)、cn201310190147.7(一种β-甘露聚糖酶、编码基因及其生产菌和应用)、cn201110262497.0(一种ph2.5~6.5范围内有高活性的β-甘露聚糖酶man5a及基因和应用)、cn01410234352.3(一种高温酸性β-甘露聚糖酶man5dw1基因和应用)、cn200510085377.2(一种β-甘露聚糖酶及其编码基因和应用);(3)对碱性和中性β-甘露聚糖酶的基因克隆,如专利:cn201110058791.x(一种耐碱β-甘露聚糖酶man5a及基因和应用)、cn201310062872.6(一种耐高温碱性甘露聚糖酶man5x27及基因和应用)、cn201410234434.8(一种中性β-甘露聚糖酶man26dw1及其基因和应用)。
然而,目前饲料添加剂用酶生产后都需要经过高温制粒,添加剂的使用都是通过添加在饲料中一起喂食动物,经胃到达肠道,在肠道中发挥酶的作用。在这个过程中,饲用酶会受到动物肠道消化酶不同程度的破坏,而降低了使用效率,因此,发现和制造能够耐高温、耐酸、具有对消化酶(如对胰蛋白酶)耐受性提高的β-甘露聚糖酶,对于β-甘露聚糖酶用作饲用酶的应用十分有价值。
技术实现要素:
本发明的首要目的是提供一种定点突变的甘露聚糖酶,它具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高等优点。
本发明是对来自假密环菌(armillariellatabescens)的β-甘露聚糖酶man47的基因进行定点突变。由假密环菌(armillariellatabescens)中获得的β-甘露聚糖酶man47,该酶的成熟蛋白的氨基酸序列为seqidno.1。
根据本发明所述的一种定点突变改造的β-甘露聚糖酶man47,是由氨基酸序列为seqidno.1的来源于假密环菌(armillariellatabescens)的β-甘露聚糖酶man47中制造多个氨基酸取代而产生的具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的β-甘露聚糖酶man47突变体,所述的氨基酸取代是第197、280和380位的取代。
根据本发明所述的定点突变改造的β-甘露聚糖酶man47的进一步特征,所述在第197位的氨基酸取代是用亮氨酸(leucine,leu,l)取代异亮氨酸(isoleucine,ile,i);第280位的氨基酸取代是用天冬酰胺(asparagine,asn,n)取代赖氨酸(lysine,lys,k);第380位的氨基酸取代是用丙氨酸(alanine,ala,a)取代缬氨酸(valine,val,v);所述的定点突变改造的β-甘露聚糖酶man47突变体的氨基酸序列为seqidno.2。
本发明所述的假密环菌(armillariellatabescens)来源的β-甘露聚糖酶man47突变体(mman47),具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的特点。该突变体酶与野生型β-甘露聚糖酶man47相比在高温90℃和ph4.0的条件下,酶活力是野生型的8倍以上,在人工肠液(ph6.8胰蛋白酶浓度10mg/ml溶液)中,突变酶的胰蛋白酶抗性较野生型提高了60%,半衰期达到180分钟。
进一步地,本发明提供了一种dna分子,其编码本发明所述的具有耐高温、对胰蛋白酶耐受性提高的假密环菌(armillariellatabescens)来源的β-甘露聚糖酶man47突变体。
优选地,本发明所述的dna分子的核苷酸序列为seqidno.3。
本发明的另一个目的是提供一种载体,其含有本发明所述的dna分子。
本发明的又一个目的是提供一种宿主细胞,其含有本发明所述的dna分子,或者含有本发明所述的载体。
上述载体和宿主细胞都可以通过本领域公知的技术手段进行制备。
本发明还提供了本发明所述的具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的假密环菌(armillariellatabescens)来源的β-甘露聚糖酶man47突变体的生产方法,包括:在适于mman47体表达的条件下培养本发明所述的宿主细胞,并从培养基中分离所述的mman47。
当本发明所述的dna分子以合适的取向和正确的阅读框插入到所述的载体,或者转入所述的宿主细胞中,所述的dna分子可以在任何真核或者原核表达系统中表达。许多宿主-载体系统都可以用来表达蛋白质编码序列。宿主-载体系统包括但不限于:用噬菌体、质粒或粘粒转化的细菌;含有酵母载体的微生物,如酵母;用病毒感染的哺乳动物细胞系统;用病毒感染的昆虫细胞系统;用细菌感染的植物细胞系统。本发明优选的载体包括:病毒载体、质粒、粘粒或者寡核苷酸。
本发明优选的宿主为真核系统如毕赤酵母;本发明优选的蛋白质表达方法为毕赤酵母甲醇诱导分泌表达。
本发明人成功地获得了一种具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的假密环菌(armillariellatabescens)来源的β-甘露聚糖酶man47突变体,通过活性鉴定实验,证明该mman47具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的生物活性,且该生物活性达到了应用于饲料及其添加剂加工、食品及其添加剂加工的程度。
本发明的另一目的是提供将所述的具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的β-甘露聚糖酶man47突变体在制备饲料或食品添加剂中的应用。结合目前的饲料和食品的加工工艺,可将本发明所述的具有耐高温、较宽的ph稳定性、对胰蛋白酶耐受性提高的β-甘露聚糖酶man47突变体作为饲料剂添加到饲料中进行分解饲料原料中的甘露聚糖和异甘露聚糖。
附图说明
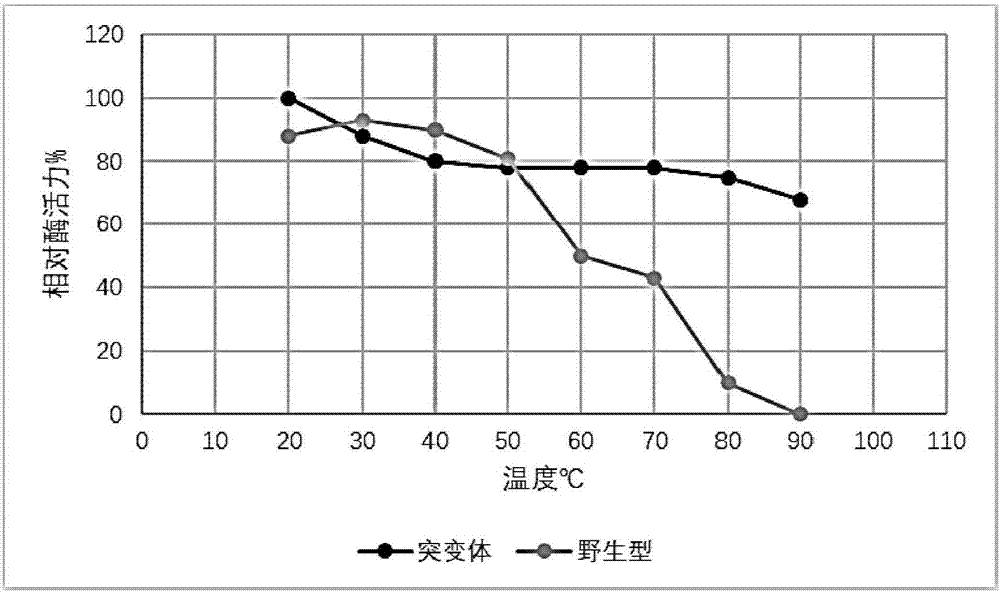
图1显示man47突变体与野生型β-甘露聚糖酶man47对温度的稳定性。
图2显示man47突变体与野生型β-甘露聚糖酶man47的ph稳定性。
图3显示man47突变体和野生型酶在胰蛋白酶中的稳定性。
具体实施方式
本文中所采用的术语,除非另有说明,均为本领域技术人员所通常理解的含义。以下提供在本发明中使用的一些特殊术语的定义。
“wtman47”表示野生型β-甘露聚糖酶man47,其基因以斜体wtman47表示。
“mman47”表示突变体β-甘露聚糖酶man47,其基因以mtman47表示。
实施例1:wtman47和mtman47的合成
本发明以armillariellatabescens的β-甘露聚糖酶man47基因(ncbi数据库id:dq286392)序列作为参考,在5’端加入5’-gtcgaattc-3’在3’端加入3’-cctagggac-5’,(gaattc)为限制酶切位点ecori,(ggatcc)为限制酶切位点bamhi。采用人工全合成的方法合成wtman47基因。
本发明以armillariellatabescens的β-甘露聚糖酶man47基因序列(ncbi数据库id:dq286392)作为参考,将第197位的氨基酸用用亮氨酸(leucine,leu,l)取代,第280位的氨基酸用天冬酰胺(asparagine,asn,n)取代,第380位的氨基酸用丙氨酸(alanine,ala,a)取代,在5’端加入5’-gtcgaattc-3’在3’端加入3’-cctagggac-5’,(gaattc)为限制酶切位点ecori,(ggatcc)为限制酶切位点bamhi。采用人工全合成的方法合成mtman47目的基因。
基因合成由商业性公司例如上海捷瑞生物有限公司完成。
实施例2:重组质粒wtman47和mtman47表达质粒的构建
基因克隆按常规方法(sambrook,etal.2001,molecularcloningalaboratorymanual.coldspringharborlabroratorypress.usa)进行,将实施例1所得的wtman47和mtman47分别克隆到phil-s1构建成表达质粒phil-s1-wtman47和表达质粒phil-s1-mtman47,克隆后的目的基因经酶切、测序鉴定。
具体做法:
含mtman47的重组质粒phil-s1的构建过程为:ecori+bamhi双酶切质粒phil-s1和目的片断mtman47,酶切产物进行0.8%琼脂糖凝胶电泳,并切胶回收。利用t4dna连接酶进行质粒phil-s1和mtman47的连接。cacl2法制备e.colidh5α感受态细胞,转化dh5α感受态细胞,筛选转化子,碱提质粒。用ecori+bamhi、hindⅲ、saci酶切鉴定重组质粒phil-s1-mtman47。挑取重组质粒peg纯化法(sambrook,etal.2001,molecularcloningalaboratorymanual.coldspringharborlabroratorypress.usa)提取质粒dna。以t7和sp6为测序引物,采用dna自动序列仪,正反向进行测定。酶切结果如图1示,重组载体phil-s1-mtman47的酶切鉴定,bamhi、ecori双酶切(样品1)切下一条带位于2100bp左右,hindiii单酶切(样品2),saci单酶切(样品3)。
含wtman47的重组质粒phil-s1的构建过程为:将含wtman47的重组质粒phil-s1的构建过程中的目的片断mtman47替换为wtman47,其他操作过程与含mtman47的重组质粒phil-s1的构建过程相同。
实施例3:重组mtman47和重组wtman47的表达
重组mtman47的表达:用saci酶切重组质粒phil-s1-mtman47和质粒phil-s1,酶切产物进行0.8%琼脂糖凝胶电泳,切胶回收酶切后的线性重组质粒phil-s1-mtman47和质粒phil-s1。按pichiaexpressionkit(invitrogeninc.,美国)手册中的原生质法转化毕赤酵母菌gs115,筛选mut+转化子。利用甲醇作为唯一碳源对重组菌进行诱导表达(按pichiaexpressionkit手册操作)中,培养液经sds-page电泳分析表明,转化子经诱导表达后,培养液上清出现明显的目的蛋白带,而转化不含目的基因的空质粒的对照菌在相同的条件下诱导96小时,在上清中未检测到目的蛋白条带。转化子经甲醇诱导表达后,培养液上清出现明显的目的蛋白带;而转化不含目的基因的空质粒的阴性对照菌,在相同的条件下诱导在上清中无目的蛋白出现。
具体做法如下:
一、重组子与毕赤酵母的同源重组
(一)线性化质粒
saci酶切重组质粒phil-s1-mtman47和质粒phil-s1,同时线性化质粒phil-s1是作为下面实验的对照。
酶切phil-s1-mtman47(120总体系):12μlbufferl+8μlsaci+100μlphil-s1-mtman47
酶切phil-s1(120μl总体系):12μlbufferl+8μlsaci+100μlphil-s1
0.8%琼脂糖凝胶电泳酶切样品,切胶回收酶切后的线性重组质粒phil-s1-mtman47和质粒phil-s1。
(二)培养用于原生质化的毕赤酵母菌gs115
1.从平板上挑取一个gs115单克隆接种于10mlypd中,在150ml锥形瓶中,30℃,250-300rpm振荡培养过夜;
2.从昨日培养的的10mlypd菌液中分别取5,10,20μl接种于200mlypd中,在500ml的锥形瓶中,250-300rpm振荡培养过夜;
3.检测3个瓶中菌液的od600值,取od600=0.2-0.3的菌液转入离心管中,室温1500×g离心5min,弃上清,收集的细胞用于原生质化。
(三)毕赤酵母菌gs115的原生质化
1.培养收集的细胞重悬于200ml的无菌水中,转移至两个无菌的10ml离心管中;
2.室温下,1500×g离心5min,弃上清;
3.用10ml新鲜配制的sed洗沉淀,室温下,1500×g离心5min,弃上清;
4.用10ml1m山梨醇洗沉淀,室温下,1500×g离心5min,弃上清;
5.用10mlsce重悬沉淀;
6.取一管zymolyase冻融后轻弹管壁,使溶液混匀;
7.取7.5μlzymolyase加入管中,30℃温育30min;
8.室温下750×g离心10min,收集菌体,弃上清;
9.用10ml1m山梨醇洗原生质体,轻轻敲打管壁分散沉淀,室温下750×g离心10min,收集菌体,弃上清;
10.用10mlcas洗菌体,室温下750×g离心10min,收集菌体,弃上清;
11将沉淀重悬于0.6mlcas中,此原生质体在30min内必须使用。
(四)原生质法转化毕赤酵母菌gs115
1.分别取100μl毕赤酵母原生质体加入a、b、c3个无菌15ml离心管中;
2.a管中不加dna作为阴性对照,b管中加入30μl线性化的原质粒phil-s1,c管中加入30μl线性化的重组质粒phil-s1-mtman47,室温下温育10min,期间准备一支3ml新鲜配制的peg/cat;
3.各管中加入1ml新鲜配制的peg/cat,轻轻混匀,室温下温育10min;
4.室温下750×g离心10分钟,弃上清,控干;
5.将沉淀重悬于150μlsos中,室温温育20min;
6.各管加入850μl1m山梨醇,准备铺板;
7.涂布rd固体培养基,每板涂布200μl,28-30℃温育倒置培养,转化子约在4-6天出现。
(五)筛选mut+转化子
1.用无菌牙签挑取his+转化子,分别在mm和md板上一一对应点菌,同时点上gs115/his+mutsalbumin和gs115/his+mut+β-gal作为对照。
2.28-30℃温育倒置培养2天;
3.两天后,观察对照mm和md板,若在两板上均生长良好为mut+,若在md上生长良好,在mm板上生长少或不生长则为muts。
(六)重组菌的诱导表达
1.挑取一个his+mut+转化子的单克隆,接种于25mlbmg,在250ml的锥形瓶中,28-30℃,250-300rpm振荡培养,直至od600=2-6(约16-18h);
2.1500-3000×g离心5min收集细胞,弃上清,重悬细胞于bmm中至od600为1.0(约需100-200mlbmm),在1升的锥形瓶中,28-30℃,250-300rpm继续振荡培养。
3.每24h加100%甲醇,始终浓度至0.5%,保持诱导表达;
4.诱导表达96h的时间。培养液离心2-3min,留取上清放入-80℃保存以用于纯化表达产物。
经诱导96小时培养上清中总蛋白量达0.23mg/ml。目的蛋白的分子量约47kda。
重组wtman47的表达:将重组mtman47的表达过程中的重组质粒替换为phil-s1-wtman47,其他操作过程与重组mtman47的表达流程相同。
实施例4:重组mtman47和wtman47的纯化
诱导表达的发酵液经70%饱和(nh4)2so4沉淀,收取沉淀获得粗酶样品。粗酶样品以等体积的pbs溶解,离心后取上清上疏水色谱层析phenylsepharose柱,以连续梯度的洗脱缓冲液洗脱,收集目的峰。透析脱盐,pbs溶液平衡后浓缩。具体如下:
1、硫酸氨沉淀收集粗酶
重组表达发酵液加入(nh4)2so4粉末至40%饱和度,4℃,10000g离心20分钟,上清继续再加入(nh4)2so4粉末至70%饱和度。4℃,10000g离心20分钟。即获得粗酶样品。
2、分子筛sephadexg-25脱盐
0.1mol/lnaoh清洗sephadexg-25柱,约3-4个柱体积,再用超纯水洗脱3-4个柱体积,然后用ph5.0,0.02mol/lnaac-0.02mol/lhac缓冲液平衡sephadexg-25至基线,采用aktaexplorer-100蛋白质纯化系统自动上样系统将上清加入到已平衡的柱子,0.02mol/lnaac-0.02mol/lhac缓冲液洗脱以除去硫酸铵等盐,收集蛋白峰,测定酶活力和蛋白含量。
3、deae-sepharosetmfastflow阴离子交换层析
采用aktaexplorer-100蛋白质纯化系统自动上样系统将3.6.2中得到的蛋白峰加入到用ph5.0,0.02mol/lnaac-0.02mol/lhac缓冲液平衡过的deae-sepharosetmfastflow(1.6cm×9.5cm)阴离子交换柱上端(平衡速度和上样速度均为1.0ml/min),用缓冲液洗脱至基线,改用以同样缓冲液配制的1mol/lnacl进行阶段洗脱,将每个峰产物合并,收集产物,测定酶活力和蛋白含量。目的峰用sds-page电泳鉴定。
实施例5:mtman47及wtman47重组蛋白的热稳定性、ph稳定性和胰蛋白酶抗性的检测
(1)甘露聚糖酶酶活力的测定采用dns法:
检测原理:利用3,5-二硝基水扬酸溶液与还原糖液共热后被还原成棕红色的氨基化合物,在一定范围内还原糖的量和棕红色物质颜色深浅的程度成正比例关系,因此可用于比色测定。
检测方法:取0.5%的槐豆胶溶液(用ph6.8,0.04mna2hpo4-0.02m柠檬酸)70μl,加入10μl混合酶液,振荡混匀40℃反应15min后,加入120μldns终止反应,100℃显色10min,于540nm处测定od540值,反应0min的混合液为对照组。
甘露聚糖酶酶活力定义:在ph6.8,40℃试验条件下,以每分钟水解底物产生1μmol相当于d-甘露糖的还原糖的酶量定义为1个甘露聚糖酶单位(iu/ml)。
(2)标准曲线的制定及酶活力计算:
标准甘露糖浓度为2mg/ml。按下表量取试剂,沸水浴15min后,立即冷却,测定od540值。
表1:标准曲线
标准曲线如下:y=0.2285x+0.0031(r2=0.9995)
酶降解生成还原糖的含量=活性组还原糖含量-对照组还原糖含量
(3)蛋白质浓度测定
蛋白质浓度采用bradford法测定,方法如下:
1)分别在试管中加1mg/ml牛血清白蛋白即bsa(0,3,7,15,20,25ml),以双蒸水补足至100μl。
2)每管各加入2ml考马斯亮蓝溶液,振荡混匀,室温放置5min。
3)测量a595吸光值,做出标准曲线。标准曲线为:y=1.3668x(r2=0.9977)
4)待测样品稀释5倍,测量其a595吸光值,根据标准白蛋白吸收曲线确定待测样品的蛋白质浓度。
(4)突变体酶的热稳定性
在ph5.0条件下,将突变体酶液和野生型酶液在不同的温度(20℃,30℃,40℃,50℃,60℃,70℃,80℃,90℃)下温育30min,按常规法测定酶活力,以未处理的原酶液活力为100%,计算各组酶的相对活力。检测结果man47突变体与野生型β-甘露聚糖酶man47相比在高温90℃和ph4.0的条件下,酶活力是野生型的提高8倍以上,结果如图1所示。
(5)突变体酶的ph稳定性
将突变体酶液和野生型酶液与上述不同ph(3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,)缓冲液于40℃,温育30min后,按常规法测定酶活力,以未处理的原酶液活力为100%,计算各组酶的相对活力。检测结果man47突变体在ph3.0~8.0之间稳定性较好,残留酶活力70%以上,而野生型酶在ph3.0~6.0之间较稳定,当ph>7时,野生型酶的酶活力迅速下降丧失活性。结果如图2所示。
(5)突变体酶对胰蛋白酶稳定性的影响
突变体酶液和野生型酶液用人工模拟肠液(ph6.810mg/ml胰蛋白酶溶液)于40℃保温10min、30min、60min、90min、120min、180min后,dns法测定酶活力,以胰蛋白酶溶液处理0min的酶液活力为100%,计算各组酶的相对活力,考查野生型酶和突变体酶的在胰蛋白酶中的稳定性。结果在人工肠液(ph6.810mg/ml胰蛋白酶溶液)中40℃处理10min后测活,突变酶的胰蛋白酶抗性较野生型提高了50%。结果如图3所示。
sequencelisting
<110>暨南大学
<120>一种定点突变的甘露聚糖酶及其应用
<130>
<160>3
<170>patentinversion3.4
<210>1
<211>427
<212>prt
<213>假密环菌(armillariellatabescens)
<400>1
alavalproglutrpglyglncysglyglyileglytrpthrglygln
151015
thrthrcysvalserglythrvalcysalaalaleuasnasptyrtyr
202530
serglncysvalproglythralathrthrthralaalaprothrthr
354045
alathrserthrthrileserserthrserargthrthralathrser
505560
thrthralaseralaproserserthrglyphevalthrthrsergly
65707580
thrglupheargleuasnglyalalysphethrilepheglyalaasn
859095
sertyrtrpvalglyleumetglytyrserthrthraspmetasnlys
100105110
alaphealaaspilealaalathrglyalathrvalvalargthrtrp
115120125
glypheasngluvalthrserproasnglyiletyrtyrglnsertrp
130135140
serglyserthrprothrileasnthrglyserthrglyleuglnasn
145150155160
pheaspalavalvalalaalaalaalaalahisglyleuargleuile
165170175
valalailethrasnasntrpserasptyrglyglymetaspvaltyr
180185190
valasnglnilevalglyserglyseralahisaspleuphetyrthr
195200205
aspcysgluvalileserthrtyrmetasntyrvallysthrpheval
210215220
serargtyrvalasngluprothrileleuglytrpgluleualaasn
225230235240
gluproargcyslysglyserthrglythrthrserglysercysthr
245250255
alathrthrilethrlystrpalaalaalaileseralatyrilelys
260265270
serileaspproasnhisleuvalglyileglyaspgluglyphetyr
275280285
asngluproseralaprothrtyrprotyrglnglysergluglyile
290295300
asppheaspalaasnleualaileserserileasppheglythrphe
305310315320
hissertyrproilesertrpglyglnthrthraspproglnglytrp
325330335
glythrglntrpilealaasphisalathrsermetthralaalagly
340345350
lysprovalileleugluglupheglyvalthrthrasnglnalathr
355360365
valtyrglyalatrptyrglngluvalvalserserglyleuthrgly
370375380
alaleuiletrpglnalaglysertyrleuserserglyalathrpro
385390395400
aspaspglytyralailetyrproaspaspprovaltyrserleuglu
405410415
thrsertyralavalthrleulysalaargala
420425
<210>2
<211>427
<212>prt
<213>改造后序列
<400>2
alavalproglutrpglyglncysglyglyileglytrpthrglygln
151015
thrthrcysvalserglythrvalcysalaalaleuasnasptyrtyr
202530
serglncysvalproglythralathrthrthralaalaprothrthr
354045
alathrserthrthrileserserthrserargthrthralathrser
505560
thrthralaseralaproserserthrglyphevalthrthrsergly
65707580
thrglupheargleuasnglyalalysphethrilepheglyalaasn
859095
sertyrtrpvalglyleumetglytyrserthrthraspmetasnlys
100105110
alaphealaaspilealaalathrglyalathrvalvalargthrtrp
115120125
glypheasngluvalthrserproasnglyiletyrtyrglnsertrp
130135140
serglyserthrprothrileasnthrglyserthrglyleuglnasn
145150155160
pheaspalavalvalalaalaalaalaalahisglyleuargleuile
165170175
valalaleuthrasnasntrpserasptyrglyglymetaspvaltyr
180185190
valasnglnilevalglyserglyseralahisaspleuphetyrthr
195200205
aspcysgluvalileserthrtyrmetasntyrvallysthrpheval
210215220
serargtyrvalasngluprothrileleuglytrpgluleualaasn
225230235240
gluproargcyslysglyserthrglythrthrserglysercysthr
245250255
alathrthrilethrasntrpalaalaalaileseralatyrilelys
260265270
serileaspproasnhisleuvalglyileglyaspgluglyphetyr
275280285
asngluproseralaprothrtyrprotyrglnglysergluglyile
290295300
asppheaspalaasnleualaileserserileasppheglythrphe
305310315320
hissertyrproilesertrpglyglnthrthraspproglnglytrp
325330335
glythrglntrpilealaasphisalathrsermetthralaalagly
340345350
lysprovalileleugluglupheglyalathrthrasnglnalathr
355360365
valtyrglyalatrptyrglngluvalvalserserglyleuthrgly
370375380
alaleuiletrpglnalaglysertyrleuserserglyalathrpro
385390395400
aspaspglytyralailetyrproaspaspprovaltyrserleuglu
405410415
thrsertyralavalthrleulysalaargala
420425
<210>3
<211>1281
<212>dna
<213>改造后的核苷酸序列(人工合成)
<400>3
gctgttcctgagtggggccaatgtggcggcattggatggacaggacagaccacttgcgtt60
agtggtacagtatgcgcagctctcaatgactattattctcaatgtgtgcctggaacggcc120
acaacaacggccgctcccacgactgctacatcaacaaccatttcttccacttctcgcaca180
actgctacgtcgaccacagcttccgcaccatcttctactggctttgtaactacctctggc240
acagagttccgcctcaacggtgccaaatttactatcttcggcgccaactcatactgggtc300
gggttgatgggctatagcactacagatatgaataaagccttcgcagacatcgcggctaca360
ggtgccaccgtcgtccgcacatggggcttcaatgaggtaacgagtcctaacgggatttat420
taccagagttggtccggaagtacaccaactatcaacacaggttctacgggtcttcaaaac480
tttgatgccgtcgtcgctgctgctgctgcacatggcttgaggcttattgttgccctcacg540
aacaactggtccgactatggtggaatggatgtatacgttaaccaaattgtcgggtctggc600
tctgcgcacgatttattctataccgactgtgaggttatatctacttacatgaactacgtc660
aagaccttcgtctcgcgctatgtgaacgaacctactattttaggttgggagcttgcaaat720
gaacctagatgcaaggggagtaccgggacgacctctggatcatgcactgcaacgactatc780
acaaattgggccgcggcaatttcagcgtacatcaagtcgatcgatcccaaccatcttgtc840
gggataggagatgaagggttctacaatgaacctagcgcaccaacatatccatatcaaggt900
agcgaaggtatcgattttgatgcaaatttggccattagtagcattgatttcggtacattc960
cattcctatcctatcagctggggtcaaaccactgatcctcagggatggggtacgcaatgg1020
atcgctgatcatgcaacgtcaatgacagctgcgggaaagcccgtaatcttagaggagttt1080
ggagctaccactaatcaagcaactgtttatggcgcctggtatcaggaagttgtctcttcg1140
ggtcttactggtgctcttatttggcaagctggttcttatttatcatccggagctactccg1200
gacgacggatatgcaatttatcctgatgatcctgtatattccctggaaacctcctatgcg1260
gttacattgaaagcgcgggcg1281
- 还没有人留言评论。精彩留言会获得点赞!