自细胞提取胞器的方法与流程
本发明涉及一种自细胞提取胞器的方法,尤其涉及一种以研磨件研磨细胞并从中提取胞器的方法。
背景技术:
胞器(organelle)是细胞中功能独立的生物组织。在众多的胞器当中,线粒体(mitochondrion)是细胞内进行氧化磷酸化和合成三磷酸腺苷(atp)的主要场所。由于三磷酸腺苷为细胞活动的能量来源,所以线粒体又有(细胞能量工厂)之称。除了为细胞提供能量外,线粒体还参与细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长周期的能力。由于分析线粒体的基因组有助于进行遗传学以及部分疾病的研究,因此发展能自细胞内提取质量良好的线粒体的方法有助于促进相关研究领域发展。
目前有采用化学方式或物理方式破坏细胞膜以取得细胞内部的胞器。然而,上述各传统方法皆容易于破坏细胞膜的同时,也将胞器的胞器膜一并破坏,使得能成功提取的完整胞器数量极为稀少。因此,发展一种能破坏细胞膜但又能保持胞器完整性的提取方法,是目前业界亟欲解决的问题之一。
技术实现要素:
发明人发现公知技术提取胞器的方法容易于细胞液中产生气泡,使得气泡破裂时产生的冲击力容易对胞器产生破坏,这情形在自动化操作时尤为严重。有鉴于此,本发所要解决的技术问题在于,针对现有技术的不足明提供一种自细胞提取胞器的方法,有助于改善破坏细胞膜的同时一并对胞器膜产生破坏的问题。
本发明所要解决的技术问题是通过如下技术方案实现的:
一种自细胞提取胞器的方法,包括以下步骤:将多个细胞和溶液均匀混合以得到混合物;将混合物置入容器内;将容器置入研磨装置中,研磨装置包括研磨件和连接于研磨件的机械动力源;将研磨件浸入位于容器内的混合物;进行混合物研磨,对研磨装置设定研磨参数,而使机械动力源根据研磨参数控制研磨件研磨混合物,以得到均质化混合物;将均质化混合物离心以得到上清液;以及将上清液离心以得到含有多个胞器的沉淀物;在进行混合物研磨的步骤中,保持研磨件的至少部分体积位于混合物中。
更好地,进行所述混合物研磨包括有如下的子步骤:
利用所述研磨参数中的一旋转参数来控制所述机械动力源,以使所述容器以自身的一轴心为旋转轴相对研磨件旋转;以及
利用所述研磨参数中的一推压参数来控制所述机械动力源,以使所述研磨件沿所述容器的所述轴心在所述容器中进行往复移动而研磨所述混合物。
更好地,所述旋转参数为每分钟3转/每分钟-7转/每分钟。
更好地,当进行所述混合物研磨时,在所述混合物中的细胞数量的80%~90%破裂时停止研磨,以得到所述均质化混合物。
更好地,所述推压参数为2公斤重-5公斤重。
更好地,所述研磨件沿所述轴心相对所述容器往复移动10次-20次。
更好地,所述溶液为包括蔗糖、乙二醇双氨基乙基醚四乙酸以及4-羟乙基哌嗪乙磺酸混合的一缓冲溶液,蔗糖的体积摩尔浓度为0.25mol/l,乙二醇双氨基乙基醚四乙酸的体积摩尔浓度为0.5mmol/l,且4-羟乙基乙磺酸的体积摩尔浓度为3mmol/l。
更好地,所述的步骤中的操作温度小于等于4℃。
更好地,所述的多个胞器为线粒体。
本发明还提供一种自细胞提取胞器的方法,包括以下步骤:将多个细胞和溶液均匀混合以得到混合物;将混合物置入容器内;将研磨件浸入位于容器内的混合物;进行混合物研磨,使研磨件与容器之间以一轴心为旋转轴而产生相对旋转,以及使研磨件沿轴心而相对容器往复移动以得到均质化混合物;将均质化混合物离心以得到上清液;以及将上清液离心以得到含有胞器的沉淀物;在进行混合物研磨的步骤中,保持研磨件的至少部分体积位于混合物中。
根据本发明所记载的自细胞提取胞器的方法,研磨件与容器之间以一轴心为旋转轴而产生相对旋转,并且至少局部的研磨件于混合物中沿轴心而相对容器往复移动研磨含有细胞的混合物。在进行混合物研磨的步骤中,保持研磨件的至少部分体积位于混合物中。由此,搭配适当的研磨力道、研磨速度、操作温度以及研磨频率等参数,本发明所记载的方法能在破坏大量细胞的细胞膜的同时维持胞器的完整性,以成功自细胞内提取大量质量良好的胞器。
以上的关于本发明内容的说明及以下的具体实施方式的说明用以示范与解释本发明的原理,并且提供本发明的权利要求更进一步的解释。
附图说明
图1为本发明一实施例自细胞提取胞器的步骤流程图;
图2为本发明一实施例的研磨件研磨混合物的立体示意图。
【附图标记说明】
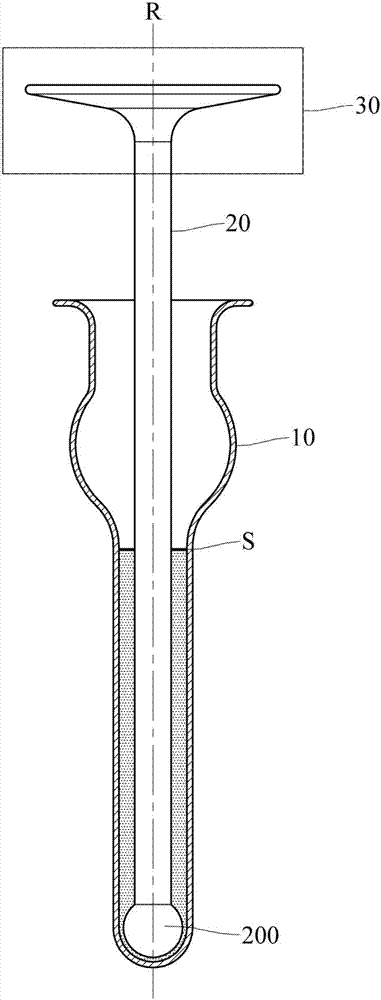
10研磨管
20研磨棒
30机械动力源
200研磨头
r旋转轴
s液面
具体实施方式
以下在实施方式中详细叙述本发明的详细特征以及优点,其内容足以使本领域普通技术人员了解本发明的技术内容并据以实施,且根据本说明书所记载的内容、权利要求及附图,本领域普通技术人员可轻易地理解本发明的目以及优点。以下的实施例进一步详细说明本发明的观点,但非以任何观点限制本发明权利要求保护范围。
首先说明本发明所用的细胞的取得方式。欲从中提取胞器的细胞为人工培养于培养皿的生物细胞,亦可以为人工培养于细胞培养瓶的生物细胞。举例来说,此细胞为贴附于一t75培养瓶(t75flask)内表面上的动物细胞,并且t75培养瓶内的细胞数量大于等于1x108个。
使用一吸取器(例如为一可调式微量吸管,eppendorf)移除培养基内的旧细胞培养基(culturemedium)。细胞培养基可以为添加重量百分浓度为10%的胎牛血清溶液(10wt%fbs)的dulbecco’s改良培养基(dmemmedium)。
接着,以吸取器取适量磷酸盐缓冲生理盐水(phosphatebufferedsaline,pbs)加入至培养瓶内,并且适度摇晃培养瓶以令磷酸盐缓冲生理盐水清除黏附于细胞膜的细胞代谢物,之后再以吸取器移除培养瓶内的磷酸盐缓冲生理盐水。此步骤可反复执行数次以加强细胞代谢物的清除效果。举例来说,加入至t75培养瓶内的磷酸盐缓冲生理盐水为1毫升(ml)至5毫升。较佳地,加入至t75培养瓶内的磷酸盐缓冲生理盐水为3毫升。另外,当细胞贴附于具有较大的细胞培养面积的一t175培养瓶(t175flask)内时,加入至培养瓶内进行清洁的磷酸盐缓冲生理盐水为10毫升。
接着,以吸取器取适量胰蛋白酶(trypsin)加入培养瓶内,并且将培养瓶置于37摄氏度无菌环境下3分钟至5分钟,以令胰蛋白酶产生水解反应而切断连接细胞膜和培养瓶的肽键,进而使细胞脱离培养瓶的内表面。举例来说,加入t75培养瓶内的胰蛋白酶为1毫升至3毫升。较佳地,加入t75培养瓶内的胰蛋白酶为1毫升。另外,当细胞贴附于t175培养瓶内时,加入培养瓶内的胰蛋白酶为5毫升。
接着,以吸取器取适量且未使用过的新细胞培养基加入至培养瓶内以抑止胰蛋白酶的水解反应,并且将培养瓶内的细胞以及细胞培养基移入一离心管中。举例来说,加入t75培养瓶内的新细胞培养基为1毫升至3毫升。较佳地,加入t75培养瓶内的新细胞培养基为2毫升。另外,当细胞贴附于t175培养瓶内时,加入培养瓶内的新细胞培养基为5毫升。此外,前述离心管的容量为15毫升。
接着,以离心力300g值,离心时间5分钟,离心温度22摄氏度的参数进行离心,而令细胞沉淀至离心管底部。进行离心后,用吸取器移除离心管内的液体。
接着,以吸取器取适量seh缓冲液(sehbuffer)加入离心管中,并以离心力300g值,离心时间5分钟,离心温度22摄氏度的参数进行离心以清洗细胞。进行离心后,用吸取器移除离心管内的液体。举例来说,加入离心管中的seh缓冲液为1毫升至3毫升。较佳地,加入离心管中的seh缓冲液为2毫升。本步骤可重多次以加强清洁效果。沉淀于离心管底部细胞即为以下步骤中所使用的细胞。
前述seh缓冲溶液具备有维持浸泡于其中的胞器的双层膜结构稳定的功能。seh缓冲溶液的制备方式为混合蔗糖(sucrose)、乙二醇双氨基乙基醚四乙酸(ethyleneglycol-bis(2-aminoethylether)-n,n,n’,n’-tetra-aceticacid,egta)、4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonicacid,hepes)在溶液中,使溶液中蔗糖的体积摩尔浓度为0.25mol/l、乙二醇双氨基乙基醚四乙酸的体积摩尔浓度为0.5mmol/l及4-羟乙基乙磺酸的体积摩尔浓度为3mmol/l后,再以氢氧化钠(naoh)溶液及盐酸(hcl)溶液调整前述混合溶液的酸碱值(ph值)至7.2。制备完成的seh缓冲溶液必须储存于4摄氏度(4℃)的环境中。
执行上述取得细胞的过程中,除了有特别说明操作温度的步骤之外,操作温度皆须保持小于等于4摄氏度(4℃),所有欲使用的容器及溶液在使用前皆须先降温至4摄氏度或是4摄氏度以下。例如,容器与溶液在使用前与使用过程中,皆置于一碎冰堆或是一冰砖内,其用意在于将容器与溶液的温度先降至4摄氏度,并保持操作温度在4摄氏度。由此,可避免细胞以及胞器的蛋白质成分在执行各步骤时因温度上升而产生变性。然而,操作温度并非用以限制本发明。在本发明其他实施例中,亦可根据细胞与胞器蛋白质成分的不同,采用不同的操作温度。
接下来说明将胞器自细胞内提取出来的方法,图1为本发明一实施例自细胞提取胞器的步骤流程图,图2为本发明一实施例的研磨件研磨混合物的立体示意图,如图1和图2所示,首先,将多个细胞和一溶液均匀混合以得到一混合物,为步骤s10。
详细来说,将上述沉淀于离心管底部的细胞及溶液置入一混合用容器,接着以吸取器反复吸取及释放混合用容器内的溶液,以令沉淀的多个细胞和溶液均匀混合,即能得到前述的混合物。步骤s10所用的溶液例如为seh缓冲溶液或是dulbecco’s改良培养基(dmemmedium)等培养液,并且置入混合用容器的溶液为1~5毫升。混合用容器可以为干净的新离心管,也可以继续使用原先盛装细胞的离心管。
在完成步骤s10后,可自混合用容器内取10~40微升(microlitre,μl)的混合物置放于细胞计数器(cellcount)以确认混和物中的细胞数量。较佳地,可取20微升的混合物作计数用。
接着,将混合物置入一容器内,为步骤s20。
详细来说,将前述步骤的全部混合物或部分混合物加入研磨用容器内,使研磨用容器内的细胞数量大于等于1x107个,以取得较佳的研磨效果。较佳地,研磨用容器内的细胞数量为1x107~2x107个。研磨用容器可以为图2所示的研磨管10。
接着,将容器置入一研磨装置中,且研磨装置包括一研磨件和连接于研磨件的一机械动力源30,为步骤s30。
详细来说,研磨装置的研磨件可以为图2所示的研磨棒20。研磨装置的机械动力源30例如为一液压马达或是气缸。
接着,将一研磨件浸入位于容器内的混合物,为步骤s40。
详细来说,将研磨件缓缓地浸入位于容器内的混合物中,以避免研磨件接触混合物的液面时将空气一并带入混合物中而产生气泡。如此一来,可避免混合物中的气泡破裂时产生的冲击力对胞器产生的破坏,进而提升自细胞内提取出的胞器的完整性。在本实施例中,先将混合物置入容器内,再将研磨件浸入位于容器内的混合物中,但不以此为限。在本发明其他实施例中,先将研磨件置入容器内,再将混合物置入容器内,并且使部分的研磨件位于混合物的液面之下。
接着,进行混合物研磨,对研磨装置设定一研磨参数,而使机械动力源根据研磨参数控制研磨件研磨混合物,以得到一均质化混合物,且于进行研磨时,研磨件的至少部分体积保持位于混合物中,为步骤s50。
详细来说,对研磨装置设定的研磨参数包括一旋转参数和一推压参数。如图2所示,研磨装置根据旋转参数而控制研磨管10(容器)以一旋转轴r(容器的自身轴心)相对研磨棒20(研磨件)旋转。研磨装置的机械动力源30根据推压参数而控制研磨棒20的研磨头200于混合物中沿旋转轴r相对研磨管10往复移动。由于研磨管10的内壁面与研磨头200之间的仅有不到0.1毫米(mm)的间隙,因此在研磨棒与研磨管之间相对移动的过程中,混合物中的细胞的细胞膜与研磨棒表面或研磨管表面彼此摩擦而受到破坏。如此一来,细胞内的胞器自细胞中穿过破损的细胞膜而均匀散布于溶液中以得到均质化混合物。值得注意的是,在进行混合物研磨的过程中,研磨头200保持浸入混合物中。也就是说,如图2所示,研磨头200于进行混合物研磨的过程中保持位于混合物的一液面s下方。如此一来,可避免研磨头接触混合物的液面时将空气带入混合物中而产生气泡,防止混合物中的气泡破裂时产生的冲击力对胞器产生的破坏,进而提升自细胞内提取出的胞器的完整性。
进一步来说,上述研磨参数的旋转参数为每分钟3~7转(revolutionperminute,rpm),上述研磨参数的推压参数为2公斤重(kgw)至5公斤重,且研磨件于混合物中沿轴心而相对容器往复移动的次数为10~20次。上述的容器转速、研磨力道和研磨次数并非用以限制本发明。在其他实施例中,这些参数可视需求调整,使得停止研磨时,混合物中细胞数量的80%~90%破裂而得到前述均质化混合物。在本实施例中,研磨装置可以为杜恩斯匀浆器(douncehomogenizer),但不以此为限。
停止研磨时间点的判定方法以光学显微镜观察滴入染剂的混合物。详细来说,可随时将部分混合物取出,接着将台盼蓝(trypanblue)等染剂滴入取出的混合物中,并将滴入染剂的混合物置于光学显微镜下进行观察。由于破裂死亡的细胞会被染剂染色,而存活的细胞则会将染剂排出,因此当观察到混合物中80%~90%的细胞被染色时,即可推断已有足够数量的胞器离开破裂死亡的细胞而均匀分布于混合物中。
接着,将均质化混合物离心以得到一上清液,为步骤s60。
详细来说,将均质化混合物自容器(研磨管10)移至离心管内,并且以离心力1000g值,离心时间10分钟,离心温度4摄氏度的参数进行1~3次离心。离心后,存活的细胞以及较大较重的死亡细胞残骸沉淀至离心管底部,胞器、较小较轻的死亡细胞残骸悬浮在上清液(supernatant)中。以吸取器吸取包括胞器、较小较轻的死亡细胞残骸和溶液的上清液,并且置入另一离心管内。
最后,将上清液离心以得到含有多个胞器的一沉淀物,为步骤s70。
详细来说,将步骤s60中得到的上清液以离心力7000g值,离心时间15分钟,离心温度4摄氏度的参数进行1~3次离心,而使上清液中相对较重的胞器沉淀至离心管底部。进行离心后,以吸取器移除上清液并加入适量新的溶液(例如为seh缓冲溶液)。加入新的溶液后,以吸取器反复吸取释放离心管内的溶液,以令含有胞器的沉淀物和溶液均匀混合。步骤s70中所加入溶液的需求量视步骤s10中的细胞数量而定,每1x107至2x107数量的细胞需加入50微升(μl)的溶液。
在完成步骤s70后,加入以1:100的比例稀释的浓缩即用溶液的蛋白酶抑制剂(proteaseinhibitor)以利于之后胞器的保存。
最后,将胞器和seh缓冲溶液冷藏于4摄氏度环境中进行保存。
值得注意的是,上述步骤s10至s70于执行过程中,操作温度皆保持小于等于4摄氏度(4℃),所有欲使用的容器及溶液在使用前皆须先降温至4摄氏度或是4摄氏度以下。例如,在步骤s50执行前与步骤s50执行过程中,研磨件和容器皆置于一碎冰堆或是一冰砖内,以保持操作温度在4摄氏度。由此,可避免细胞以及胞器的蛋白质成分在执行各步骤时因温度上升而产生变性。然而,操作温度并非用以限制本发明。在本发明其他实施例中,亦可根据细胞与胞器蛋白质成分的不同,采用不同的操作温度。
此外,由细胞中提取的胞器可以牛血清白蛋白(bsa)的浓度作为参照标准品进行蛋白质定量分析(proteindetermination),以推估seh缓冲溶液中健康胞器的浓度。在进行蛋白质定量分析时,将浓度为0微克/微升(μg/μl)、0.25μg/μl、0.5μg/μl、1μg/μl、1.5μg/μ以及2μg/μl的牛血清白蛋白标准品与细胞中提取的胞器分别与定量试剂混合均匀后,置于37摄氏度下30分钟。接着利用机器测量牛血清蛋白标准品的吸光值,并利用标准品的吸光值制作标准曲线。最后,利用细胞中提取的胞器的吸光值以及吸光值标准曲线,以内插法求出细胞中提取的胞器的浓度。
以下借助于本发明实施例及比较例说明本发明所记载的自细胞提取胞器的方法,并且进行实验测试以比较其性质差异。
实施例一
首先,将2x107个动物细胞加入2微毫升seh缓冲溶液而得到混合物。本实施例欲提取的胞器为线粒体。
接着,将混合物置入一杜恩斯匀浆器的一研磨管内。
接着,将一杜恩斯匀浆器的一研磨棒浸入位于研磨管内的混合物。
接着,进行混合物研磨。在研磨的过程中,研磨棒的一研磨头保持位于混合物中。研磨管相对研磨棒旋转的转速为每分钟5转,杜恩斯匀浆器的研磨头施予混合物2公斤重(kgw)的外力,并在混合物中相对研磨管往复移动15次以得到均质化混合物。
接着,将均质化混合物移入一离心管内,并且以离心力1000g值,离心时间10分钟,离心温度4摄氏度的参数进行2次离心。完成离心后,以吸取器吸取离心管内的一上清液,并将上清液移入另一离心管中。
最后,将上清液以离心力7000g值,离心时间15分钟,离心温度4摄氏度的参数进行1次离心,以得到一沉淀物。进行离心后,以吸取器移除上清液并加入50微升新的seh缓冲溶液。以吸取器反复吸取释放离心管内的seh缓冲溶液,而令沉淀物和seh缓冲溶液均匀混合。
实施例二
实施例二中,各制作过程步骤大致与实施例一相同,其差异仅在于混合物研磨的步骤。
在进行混合物研磨时,在研磨的过程中,研磨头保持在混合物中。研磨管相对研磨棒旋转的转速为每分钟5转,杜恩斯匀浆器的研磨头施予混合物5公斤重(kgw)的外力,并且在混合物中相对研磨管往复移动15次以得到均质化混合物。
比较例一
比较例一中,各制作过程步骤大致与实施例一相同,其差异仅在于混合物研磨的步骤。
在进行混合物研磨时,研磨头于混合物研磨的过程中并未保持位于混合物的一液面下方。也就是说,当研磨头朝远离研磨管底部的方向移动时,研磨头整个自混合物液面抽离。当研磨头朝接近研磨管底部的方向移动时,研磨头自外部由混和物液面插入混和物内。研磨管相对研磨棒旋转的转速为每分钟5转,杜恩斯匀浆器的研磨头施予混合物2公斤重(kgw)的外力,并在混合物中相对研磨管往复移动15次以得到均质化混合物。
比较例二
比较例二中,各制作过程步骤大致与实施例一相同,其差异仅在于混合物研磨的步骤。
在进行混合物研磨时,在研磨的过程中,研磨头保持在混合物中。研磨管相对研磨棒旋转的转速为每分钟5转,以手动的方式驱动研磨头施予混合物外力,并在混合物中相对研磨管往复移动15次以得到均质化混合物。
接下来,以蛋白质定量分析分别推估以实施例一、实施例二、比较例一以及比较例二的方式所取得的沉淀物和seh缓冲溶液混合物中的线粒体浓度,以及以显微镜确认线粒体完整性。其结果如下表一所示。
表一
根据实施例一与实施例二的操作方法所取得的线粒体具有较高的线粒体浓度以及较佳的线粒体完整度。在实施例一和实施例二中,研磨头在进行混合物研磨的过程中保持在混合物的液面下方,有助于避免进行混合物研磨的过程中,研磨头将大量空气带入混合物中而产生过多气泡。如此一来,研磨头研磨细胞的效率得到提升,并且可避免气泡破裂产生的冲击力破坏胞器,有助于提高自细胞内提取出的胞器的完整性。此外,研磨棒借助于机械动力源驱动,而可避免研磨力道变化过大,有助于参数的标准化以维持线粒体的质量。
由上表比较实施例一与比较例一可知,比较例一的线粒体的浓度较低,完整度也较差。其原因在于比较例一的研磨头于进行混合物研磨的过程中并未保持位于混合物的液面下方,而容易产生过多气泡而破坏胞器,使自细胞内提取出的胞器的完整性下降。
由上表比较实施例一与比较例二可知,比较例二的线粒体的浓度较低,完整度也较差。其原因在于比较例二的研磨棒由手动驱动而相对研磨管往复移动。如此一来,容易因使用者手感不同而难以稳定控制研磨力道大小以及研磨棒移动方向,使得最后得到的线粒体浓度与质量不稳定。
综上所述,本发明记载的自细胞提取胞器的方法中,研磨件与容器之间以一轴心为旋转轴而产生相对旋转,并且至少局部的研磨件于混合物中沿轴心而相对容器往复移动研磨含有细胞的混合物。在进行混合物研磨的步骤中,保持研磨件的至少部分体积位于混合物中。由此,搭配适当的研磨力道、研磨速度、操作温度以及研磨频率等参数,本发明所记载的方法能在破坏大量细胞的细胞膜同时维持胞器的完整性,以成功自细胞内提取大量质量良好的胞器。
- 还没有人留言评论。精彩留言会获得点赞!