细胞培养的制作方法
本发明涉及细胞培养领域,具体地说,涉及3维细胞培养、3维共培养物和其方法和用途。
背景技术:
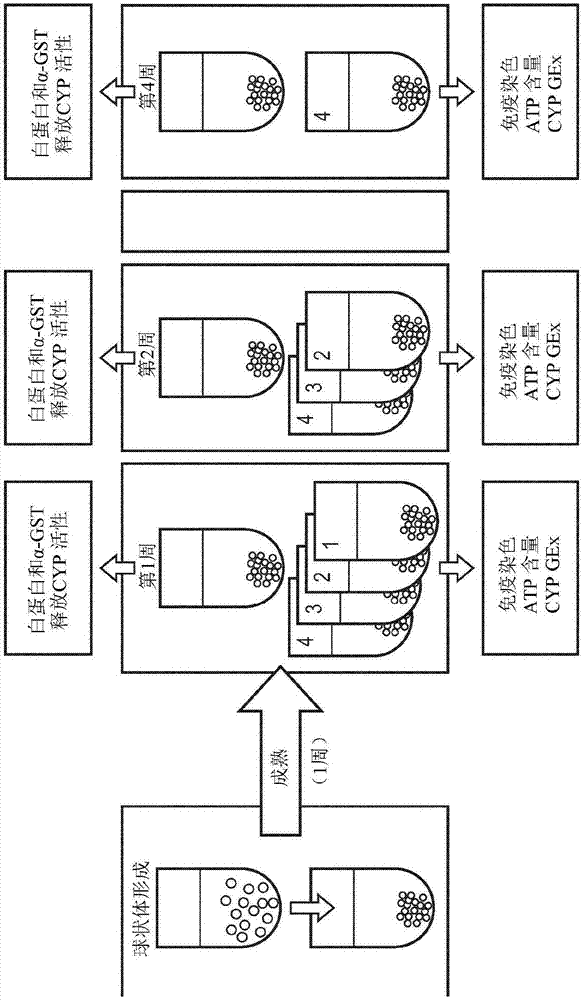
:使用2维细胞培养系统的毒理学研究已经用于检验药物对细胞存活和酶活性的作用等。虽然使细胞在塑料表面上呈平坦层生长是简明易懂的并且允许对细胞生理学和对刺激的反应的若干方面进行研究,但其未能反映出器官的实际结构和构造。在2维单层中,胞外基质、细胞与细胞和细胞与基质的相互作用消失,这些相互作用是分化、增殖和细胞功能必不可少的。3维培养系统可以形成特征与在体内观测到的特征类似的功能组织。与2维培养系统相比,3维细胞培养允许细胞在所有三个维度上与其周围环境相互作用,并且在生理学上更加相关。此类细胞展示存活力、增殖、分化、形态、对刺激的反应、药物代谢、基因表达和蛋白质合成等方面有所改善。3维细胞培养能够产生特定的组织样结构并且以比传统的2维细胞单层在生理学上更加相关的方式模拟实际组织的功能和反应。可以购得若干模拟人类器官的3维组织。举例而言,肺3维器官型组织可以使用在空气-液体界面(ALI)生长的原代人类细胞制备,在空气-液体界面中这些细胞将分化并形成功能组织。这些3维组织具有与人类支气管组织密切的形态相似性和代谢特征。其由布置成假复层结构的基底细胞、杯状细胞和纤毛细胞构成。与肺类似,存在积极摆动的纤毛,允许研究其功能和活性。与人类肺相比,已经在这些3维ALI培养物中发现类似水平的编码异生物质酶的mRNA。另外,这些组织可以在体外长时间维持。这种肺组织的3维模型是一种适于探索气溶胶和药物等的作用以及观测重复暴露的作用的模型。也已经描述了其它的3维模型,包含3维肝脏球形模型。肝球状体可以由最初在2维培养物中用于确定药物处理对肝细胞的作用的若干细胞类型构成。然而,尽管与人类肝脏组织相比,1期代谢基因表达类似,但原代人类肝细胞表达代谢酶不超过5天。另一限制是存活力短,这使得重复给药有困难。这些缺点可以通过使用替代的长期存活的肝脏细胞系,例如HepaRG细胞(ThermoFisherScientific)来克服。HepaRG细胞是一种保留原代人类肝细胞的许多特征的人类肝祖细胞系。其肝脏特异性和1期代谢基因表达比原代肝细胞大。另外,其使用寿命大大增加。3维球状体中HepaRG细胞的形成增加了使用寿命和代谢能力。对与肝脏相关的毒理学研究的关注涉及这个组织通过异生物质代谢来代谢若干化合物的能力。虽然许多化合物不活化并且溶解,但一些被生物活化并且因此变得有毒。因此,在不考虑肝脏中发生的生物活化过程下在器官中研究化合物的毒性可能会低估测试物质的毒性作用。因此,在气溶胶暴露领域中,需要一种改良的方法来研究物质在肺中的渗透和其在肝脏中的进一步生物活化。本发明力图解决所属领域中的这一需要。技术实现要素:在本公开中,已经建立个别的肺和肝培养物,并且在形态上和功能上进行表征。为了促进两种细胞类型的共培养,已经鉴别出使得肺与肝培养物维持存活力、结构完整性和功能的细胞培养条件以及特别是细胞培养基。有利的是,这使得有可能研发出多器官系统,这种系统重建肺与肝之间的相互关系,并且值得注意的是,不损失每个细胞个别特征。本文中的发现是完全意外的,即肺上皮细胞培养基可以用于成功地生长和维持肝球状体并且更值得注意的是,可以改善肝球状体的特征。使用这种多器官系统将大大有助于了解肝对如气溶胶等经肺吸收的化合物的代谢的作用。本公开提供了一种有用的工具来研究化合物在3维细胞培养系统中的影响,所述系统更接近临床情况,因此预期其更能预测,并提供一种独特、简单和廉价的3维肝和肺细胞共培养系统。本发明的方面和实施例在第一方面中,提供了一种分离的3维肝球状体,其中所述球状体具有:与在单独完全William'sE培养基中培养的3维肝球状体相比,增加的ATP含量;与在单独完全William'sE培养基中培养的3维肝球状体相比,相同或增加的细胞色素P4501A1和细胞色素P4501B1活性;以及与在单独William'sE培养基中培养的3维肝球状体相比,增加的白蛋白分泌。术语“单独完全William'sE培养基”意指仅仅由完全William'sE培养基组成的培养基,即由100%(v/v)完全William'sE培养基组成的培养基。在另一方面中,提供了一种分离的3维肝球状体,其用于3维多器官培养系统中,所述系统通过或可通过以下方法获得,所述方法包括:在包括以下或由以下组成或基本上由以下组成的细胞培养基中培养3维肝球状体:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,历时足以获得如下3维肝球状体的时间,其中:与在单独完全William'sE培养基中培养的3维肝球状体相比,ATP含量增加;与在单独完全William'sE培养基中培养的3维肝球状体相比,细胞色素P4501A1和细胞色素P4501B1活性相同或有所增加;并且与在单独完全William'sE培养基中培养的3维肝球状体相比,白蛋白分泌有所增加。适当地,球状体是或来源于人类肝祖细胞系,适当地,其中球状体是或来源于HepaRG细胞。适当地,球状体在包括以下或由以下组成或基本上由以下组成的细胞培养基中培养:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基。在另一方面中,提供了一种共培养物,其包括根据前述权利要求项中任一项所述的3维肝球状体和3维肺上皮细胞。适当地,共培养物维持在包括以下或由以下组成或基本上由以下组成的细胞培养基中:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基。在另一方面中,提供了3维器官培养系统,其包括本文所述的分离的3维肝球状体。在另一方面中,提供了一种3维多器官培养系统,其包括如本文所述的分离的3维肝球状体并且进一步包括至少一种其它3维细胞类型或包括本文所述的共培养物。适当地,3维肝球状体被浸没在培养系统上所含有的培养基中。适当地,3维多器官培养系统进一步包括3维肺上皮细胞,适当地,其中3维肺上皮细胞在3维多器官培养系统上的空气液体界面处。在另一方面中,提供了一种3维多器官培养系统,包括:(a)第一器官生长部分,其包括被调适成用于将第一3维细胞类型浸没在培养基中的第一器官腔;(b)第二器官生长部分,其包括被调适成用于将第二3维细胞类型在空气液体界面处培养的第二器官腔,所述第二3维细胞类型是与所述第一3维细胞类型不同的细胞类型;以及(c)将第一器官腔和第二器官腔连接以允许培养基在两者之间流动的培养基储集器。适当地,第一器官腔和第二器官腔含有相同的培养基。适当地,3维多器官培养系统包括本文所述的共培养物。适当地,使3维器官培养系统或3维多器官培养系统小型化。适当地,3维器官培养系统或3维多器官培养系统包括或是微流体装置,适当地,其中所述系统是芯片上器官。在另一方面中,提供了一种细胞培养基,包括以下或由以下组成或基本上由以下组成:(a)完全PneumaCult-ALI培养基与完全William'sE培养基的混合物;或(b)完全B-ALI培养基和完全William'sE培养基的混合物。适当地,细胞培养基进一步包括本文所述的3维肝球状体或共培养物。在另一方面中,提供了一种包括培养基的3维多器官培养系统,所述培养基由包括以下或由以下组成或基本上由以下组成的培养基组成的群组中选出:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,或其两个或多个的组合。在另一方面中,提供了一种制备用于3维器官培养系统中的3维肝球状体的方法,所述方法包括:(i)提供3维肝球状体;(ii)使所述3维肝球状体与包括以下或由以下组成或基本上由以下组成的培养基接触:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基;以及(iii)获得3维肝球状体以供用于3维器官培养系统中。在另一方面中,提供了一种制备用于3维多器官培养系统中的包括3维肝球状体和3维肺上皮细胞或由其组成或基本上由其组成的方法,所述方法包括:(i)提供3维肝球状体和3维肺上皮细胞;(ii)使3维肝球状体和3维肺上皮细胞与包括以下或由以下组成或基本上由以下组成的培养基接触:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基;以及(iii)获得3维肝球状体和3维肺上皮细胞的共培养物。在另一方面中,提供了一种体外的用于评估3维肝球状体对试剂的反应的方法,所述方法包括:(i)使如本文所述的3维肝球状体或共培养物或3维器官培养系统或3维多器官培养系统与至少一种试剂接触;以及(ii)测量3维肝球状体或共培养物或3维器官培养系统或3维多器官培养系统在与至少一种试剂接触后的一或多种反应;其中在与至少一种试剂接触前后一或多种反应的差异指示试剂调节细胞的反应。在另一方面中,提供了一种体外的用于评估3维肝球状体和3维肺上皮细胞对试剂的反应的方法,所述方法包括:(i)使共培养物或3维器官培养系统或3维多器官培养系统与至少一种试剂接触;以及(ii)测量共培养物或3维器官培养系统或3维多器官培养系统在与至少一种试剂接触后的一或多种反应;其中在与至少一种试剂接触前后一或多种反应的差异指示试剂调节细胞的反应。适当地,步骤(ii)包括测量至少一种试剂对3维肺上皮细胞的渗透。适当地,体外方法包括以下进一步的步骤:(iii)测量至少一种试剂在3维肝球状体中的生物活化;其中步骤(ii)和(iii)中的测量同时进行,或其中步骤(iii)中的测量在步骤(ii)中的测量后进行。适当地,试剂是气溶胶,更适当地,气溶胶是或来源于烟雾,适当地,香烟烟雾。在另一方面中,提供了细胞培养基的用途,所述细胞培养基包括以下或由以下组成或基本上由以下组成:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,用于培养3维肝球状体或3维肺上皮细胞或用于共培养3维肝球状体和3维肺上皮细胞。在另一方面中,提供了如本文所述的3维器官培养系统或3维多器官培养系统的用途,其用于毒性测试,或用于药物发现,或用于测定试剂对肺细胞的渗透,和/或用于测定试剂在肝细胞中的生物活化,其中所述试剂是气溶胶。另一方面涉及基本上如本文所述并且参考随附描述和图式的肝球状体、共培养物、3维器官培养系统、3维多器官培养系统、细胞培养基、方法或用途。在随附独立和附属权利要求项中陈述其它特定和优选的方面。附属权利要求项的特征可以在适当时与独立权利要求项的特征组合,并且呈除权利要求书中所明确陈述的组合以外的组合。因此还公开了上述一或多种实施例的组合。附图说明图1.用于表征3维器官型肺组织的实验设计和终点的示意概图(GEx:基因表达)。图2.用于表征肝球状体的实验设计和终点的示意概图(GEx:基因表达)。图3.在成熟后1周、2周、3周和4周3维器官型肺培养物的苏木精和伊红和阿辛蓝(Alcianblue)染色。上皮细胞的代表性横截面以20×放大率显示。图4.在成熟后1周、2周、3周和4周测量3维器官型肺培养物的ATP含量。显示3个独立测量的结果。Rep:复制;RLU:相对光单元图5.在成熟后1周、2周、3周和4周,测量响应于用低渗生理盐水刺激,在3维器官型肺培养物的顶表面液体中的ATP分泌。显示6个独立测量的结果。Rep:复制图6.在成熟后1周、2周、3周和4周,测量3维器官型肺培养物中的细胞色素P4501A1/B1活性。结果展示基础CYP活性、在用TCDD和利福平(rifampicin)处理48小时后诱导的活性以及在用α-萘黄酮抑制后诱导的活性。结果呈现为3个独立实验的平均值±SEM。点线指示基于每个时间点的平均值的倾向。图7.在1周、2周、3周和4周评估3维器官型肺培养物中编码1期药物代谢酶的基因的表达的调控倍数。在用TCDD和利福平处理48小时的肺培养物(n=3)与未处理的培养物(n=3)之间比较基因表达,并且使用ΔΔCT方法计算变化倍数。热图列出20个最大上调(红色,左侧)和下调基因(蓝色,右侧)以及变化倍数。在热图的左侧上显示基因标志。图8.在成熟后1周、2周、3周和4周,针对细胞角蛋白19表达对肝球状体进行染色。以10×放大率展示呈伪彩色的代表性影像(CK19是红色,细胞核是蓝色)。图9.在成熟后1周、2周、3周和4周测量肝球状体和其条件培养基的总ATP含量。显示3个独立测量的结果。Rep.复制图10.在成熟后1周、2周、3周和4周,定量来自肝球状体的白蛋白分泌。显示8个独立测量的结果。点线指示基于每个时间点的平均值的倾向。Rep:复制;在成熟后1周、2周、3周和4周评估肝球状体的α-GST产生。显示8个独立测量的结果。Rep:复制;在成熟后1周、2周、3周和4周,测量肝球状体中的细胞色素P4501A1/B1活性。结果展示基础CYP活性、在用TCDD和利福平处理48小时后诱导的活性以及在用α-萘黄酮抑制后诱导的活性。结果呈现为3个独立实验的平均值±SEM;在成熟后1周、2周、3周和4周测量肝球状体中的细胞色素P4501A2活性。结果展示基础CYP活性、在用TCDD和利福平诱导48小时后诱导的活性以及在用马来酸氟伏沙明(fluvoxaminemaleate)抑制后诱导的活性。结果呈现为3个独立实验的平均值±SEM。图11.在William'sE和完全B-ALI培养基或完全PneumaCult-ALI培养基(StemCellTechnologies,Grenoble,France)的混合物中培养后测量肝球状体和其条件培养基的总ATP含量。结果呈现为5个独立测量的平均值±SEM;在William'sE和完全B-ALI培养基或完全PneumaCult-ALI培养基的混合物中培养后测量肝球状体中的细胞毒性。结果呈现为5个独立测量的平均值±SEM。RFU:相对荧光单位图12.在William'sE和完全B-ALI培养基或完全PneumaCult-ALI培养基的混合物中培养后测量肝球状体中的细胞凋亡。结果呈现为5个独立测量的平均值±SEM;在William'sE和完全B-ALI培养基或完全PneumaCult-ALI培养基的混合物中培养后测量肝球状体中的CYP1A1/B1活性。结果呈现为3个独立测量的平均值±SEM。具体实施方式除非另有指示,否则本公开的实施采用分子生物学、微生物学、细胞生物学和生物化学的常规技术。这类技术在例如以下文献中充分解释:《分子克隆实验指南(MolecularCloning:ALaboratoryManual)》,第二版(Sambrook等人,1989)ColdSpringHarborPress;《寡核苷酸合成(OligonucleotideSynthesis)》(MJ.Gait编辑,1984);《分子生物学方法(MethodsinMolecularBiology)》,HumanaPress;《细胞生物学实验手册(CellBiology:ALaboratoryNotebook)》(J.E.CeIMs编辑,1998)AcademicPress;《动物细胞培养(AnimalCellCulture)》(R.I.Freshney编辑,1987);《细胞和组织培养入门(IntroductiontoCellandTissueCulture)》(J.P.Mather和P.E.Roberts,1998)PlenumPress;《细胞和组织培养实验室程序(CellandTissueCulture:LaboratoryProcedures)》(A.Doyle,IB.Griffiths,和D.G.Newell编辑,1993-8)J.WileyandSons;《酶学方法(MethodsinEnzymology)》(AcademicPress,Inc.);《分子生物学现代方法(CurrentProtocolsinMolecularBiology)》(F.M.Ausubel等人编辑,1987);《PCR:聚合酶链反应(PCR:ThePolymeraseChainReaction)》,(Mullis等人编辑,1994)。除非另有指示,否则采用市售试剂盒和试剂的程序通常根据制造商确定的方案使用。本文中使用的技术术语和表达一般被赋予在分子生物学、微生物学、细胞生物学和生物化学的相关领域中经常应用于它们的含义。所有以下术语定义适用于本申请的整个内容。术语“包括”不排除其它要素或步骤。术语“基本上由……组成”是指所给出的实施例所需的那些要素。此术语允许实质上不影响所述实施例的基础和新颖或功能特征的要素存在。此术语允许除所叙述的组分或成分之外的其它组分或成分存在,条件是组合物的基本特征实质上不受这些组分或成分的存在影响。在细胞培养基的情况下,此术语允许实质上不影响细胞培养基的基础和新颖或功能特征的要素或成分存在。此术语允许除所叙述的要素或成分之外的其它要素或成分存在,条件是细胞培养基的基本特征实质上不受这些要素或成分的存在影响。举例来说,此术语允许除所叙述的要素或成分之外的其它要素或成分存在,条件是与在不包含所述其它要素或成分的细胞培养基中培养的细胞相比,在细胞培养基中培养的细胞的基本特征实质上不受这些要素或成分的存在影响。不定冠词“一(a/an)”并不排除多个。细胞培养细胞培养一般是指在人造环境中生长前从组织移出细胞。可以直接从含有待培养的细胞的组织移出待培养的细胞,并且任选地在培养前用酶或机械方式处理。作为替代,待培养的细胞可以来源于先前建立的细胞株系或细胞系。细胞培养可以提供一种用于研究包含以下在内的细胞的各个方面的系统:生理学;生物化学;包含气溶胶在内的药物或化合物的作用;药物或化合物的筛选和研发或优化;药物或化合物功效的研究;药物或化合物吸收的研究;毒性筛选;毒理学;目标发现;药物动力学;药效学;以及再生医学。细胞在含有细胞培养基的人造环境中生长,细胞培养基供应生长因子、激素、气体和必需营养素,例如维生素、氨基酸、碳水化合物、矿物质等等,并且例如根据温度、pH值和压力调控人造环境。一些细胞需要锚定到固体或半固体衬底,而其它细胞可以在漂浮在培养基中的同时生长。本公开包含“3维细胞培养”的用途,其包含在使用或不使用基质或支架下在3维上培养细胞的任何方法。已经研发多种不同的3维细胞培养方法,包含球状体培养和器官型培养。在本公开中尤其关注球状体系统、尤其是肝球状体系统。球状体术语“球状体”采用如所述领域中通常所了解的含义,其是在3维上分裂成细胞球的单细胞,或在3维上多个细胞的聚集体,在球状体内的3维细胞生长中使用或不使用基质或支架进行支撑。3维球状体可以是黏附细胞或悬浮生长的球状体。可利用用于培养球状体的若干不同系统,包含生长成聚集体的球状体,例如在纳米培养盘上、在悬浮培养物中、在凝胶上、在涂有聚-HEMA的塑料上、经由细胞封装,或经由悬滴系统生长成聚集体。其它方法包含使用转瓶、旋转系统、凹板法和液体覆盖。生物反应器还可以被调适成用于3维球状体细胞培养中。在一个实施例中,所用方法是悬滴系统-例如GravityPLUS悬滴系统(InSphero)。这种方法涉及使用GravityTRAPULA盘,GravityTRAPULA盘是一种被设计用于生产球状体的非粘附性的经过涂布的微量滴定板。球状体成熟通常在接种2至5天内发生,取决于细胞类型和培养条件。适当地,球状体在100μl或更多或200μl更多或300μl或更多的体积中培养。适当地,球状体在球状体微量培养板中培养。3维细胞培养基质或支架可以用于球状体培养。这些常常是可以支撑3维细胞生长和分化的多孔衬底。已经研发出多种材料来生产在物理外观、孔隙率、渗透性、机械特征和纳米级表面形态上有差异的3维支架。这类材料的实例包含:胶原蛋白凝胶、海绵或生物凝胶;纤维蛋白;纤维结合蛋白;层粘连蛋白;海藻酸盐、水凝胶;交联粘多糖;基于聚合物的支架、合成支架;肽支架;以及壳聚糖复合物支架。根据细胞通讯和细胞外基质的发展,3维球状体更紧密地类似体内组织。这些基质帮助细胞在球状体内移动,类似于细胞在活组织中移动的方式。因此球状体是有很大改良的用于分化、存活、细胞迁移、细胞极化、基因表达和生长的模型。球状体可以使用所属领域中众所周知的各种方法收获和研究,所述方法包含用板式读取器测量的比色、荧光和发光分析法或其容易通过显微法来观测。其它技术包含蛋白质印迹法、RNA印迹法或DNA印迹法、组织学技术(例如免疫组织化学、原位杂交、免疫荧光)等等。还涵盖光学成像法的使用,例如反向明视场显微法、荧光显微法、单光子发射计算机断层摄影法(single-photonemissioncomputedtomography,SPECT)、正电子发射地形图(positronemissiontopography,PET)、磁共振成像(magneticresonanceimaging,MRI)和契伦科夫发光成像(Cerenkovluminescenceimaging,CLI)技术。使用3维球状体的应用包含研究体外细胞和组织在更紧密地接近在体内发现的环境的环境中的增殖、筛选化合物、毒理学分析、细胞疗法、细胞递送、药物递送、生物化学替换、生产生物活性分子、组织工程、生物材料和临床试验。球状体在3维细胞培养中的使用一般在《药物研发专家见解(ExpertOpin.DrugDiscov)》.(2015)10,519-540中评述。在一个实施例中,球状体是或来源于肝细胞以形成3维肝球状体。这类肝球状体可以使用所属领域中已知并且描述于例如以下中的各种方法制备:ALTEX(2014)31,441-477和《毒理学:毒理学官方杂志(Toxicol.Sci.Off.J.Soc.Toxicol)》.(2013)133,67-78。一个方面涉及一种分离的3维肝球状体,其中所述球状体具有:与在单独完全William'sE培养基中培养的3维肝球状体相比,增加的ATP含量;与在单独完全William'sE培养基中培养的3维肝球状体相比,相同或增加的细胞色素P4501A1和细胞色素P4501B1活性;以及与在单独完全William'sE培养基中培养的3维肝球状体相比,增加的白蛋白分泌。另一方面涉及一种用于3维多器官培养系统中的分离的3维肝球状体,所述系统通过或可通过以下方法获得,所述方法包括:在包括以下或由以下组成或基本上由以下组成的细胞培养基中培养3维肝球状体:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,历时足以获得如下3维肝球状体的时间,其中:与在单独完全William'sE培养基中培养的3维肝球状体相比,ATP含量增加;与在单独完全William'sE培养基中培养的3维肝球状体相比,细胞色素P4501A1和细胞色素P4501B1活性相同或有所增加;并且与在单独完全William'sE培养基中培养的3维肝球状体相比,白蛋白分泌有所增加。适当地,分离的3维肝球状体可以显示与在先前针对培养肝细胞而优化的细胞培养基(例如William'sE培养基)中生长的分离的3维肝球状体相比改善的特征。与在单独完全William'sE培养基中培养的分离的3维肝球状体相比,分离的3维肝球状体可以具有增加的ATP含量、相同或增加的细胞色素P4501A1和细胞色素P4501B1活性以及增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少1.5倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少1.0倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少1.9倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.1倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少1.9倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少1.8倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.1倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.1倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少2.0倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.4倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.4倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少2.1倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.9倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.3倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少2.6倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.6倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.9倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少2.5倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.7倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.1倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少3.3倍的增加的白蛋白分泌。分离的3维肝球状体可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.7倍的ATP含量、比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少2.6倍的细胞色素P4501A1和细胞色素P4501B1活性以及比在单独完全William'sE培养基中培养的3维肝球状体高至少3.1倍的增加的白蛋白分泌。本文中描述了测量ATP含量、细胞色素P4501A1和细胞色素P4501B1活性以及白蛋白分泌的方法。适当地,当在培养物中生长时分离的3维肝球状体与在单独完全William'sE培养基中培养的3维肝球状体相比坏死细胞的数目相同或数目有所增加。适当地,当在培养物中生长时分离的3维肝球状体与在单独完全William'sE培养基中培养的3维肝球状体相比凋亡细胞的数目有所增加。适当地,与在单独完全William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有调节(例如增加或减少)水平的谷胱甘肽(GSH)。适当地,与在单独完全William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有增加水平的氧化谷胱甘肽(GSSG)。适当地,在培养9天后观测本文所述的变化。还涵盖共培养物的使用。在一个方面中,提供了一种共培养物,所述共培养物包括如本文所述的3维肝球状体以及至少一种其它细胞类型,适当地,3维肺上皮细胞。适当地,共培养物维持在如本文所述的细胞培养基中。在一个实施例中,球状体是或来源于肺细胞以形成3维肺球状体。这类肺球状体可以使用本领域中已知的各种方法,例如以下中描述的方法制备:ALTEX(2014)31,441-477和《毒理学:毒理学官方杂志(Toxicol.Sci.Off.J.Soc.Toxicol)》.(2013)133,67-78。细胞来源本公开利用多种细胞类型,包含肺细胞和肝细胞。用于本公开的细胞和细胞系可以使用所属领域中众所周知的方法从组织或流体中分离。用于本公开的细胞和细胞系可以由干细胞分化而来,例如胚胎干细胞或诱导性多能干细胞,或直接由体细胞分化而来。细胞和细胞系可以是或可以来源于人类或动物受试者或人类或动物细胞,包含多种哺乳动物物种中的任一种,适当地,人类,但包含大鼠、小鼠、猪、兔和非人类灵长类动物等等。细胞和细胞系可以从商业来源获得。包含肺上皮细胞在内的肺细胞是所关注的一种细胞类型。支气管和/或气管上皮细胞尤其用于本公开中。可以通过在支气管镜检查程序期间刷拭供体肺来收集人类支气管上皮细胞。在一个实施例中,肺细胞是正常人类支气管上皮(NormalHumanBronchialEpithelial,NHBE)细胞。肺上皮细胞可以被培养成单层未分化细胞,或在空气-液体界面处进一步发育成器官型肺上皮细胞状组织。可以使用以下方法在空气-液体界面处建立细胞。简单来说,可以在烧瓶中培养上皮细胞以增加细胞数目。培育期后,细胞从烧瓶脱离,计数并接种到插入物上。在这些插入物上,将细胞与培养基在顶侧和基础侧上一起培育。这个阶段确保细胞将分裂并完全覆盖插入物,从而形成上皮细胞。接着,去除顶部培养基,保留基础培养基,并替换为更完全培养基。培养物像这样再培育一段时间。同时,细胞将分化成3种细胞类型:基础细胞、杯状细胞和纤毛细胞。在成熟结束时,培养物备用。空气液体界面用于培养人类鼻上皮细胞的用途描述于《可视化实验杂志(JVisExp.)》2013;(80):50646。可以从具有不同病变的人类或动物受试者,包含被归类为吸烟者或非吸烟者的受试者,获得肺上皮细胞。肝细胞是所关注的另一细胞类型。在一个实施例中,所用细胞是肝细胞。肝细胞是肝的细胞,其构成肝脏细胞质质量的70%-85%。肝细胞的功能性高度取决于其形成极性表型的能力,极性表型只在3维培养中建立。一种肝细胞来源是原代肝细胞,其是一种广泛用于研究肝生理学和病理学的各种方面的体外模型。用于分离人类肝细胞的技术可以基于捐赠肝的两步胶原蛋白酶灌注。然而,这些细胞表达代谢酶不超过5天。另一限制是其短存活力。这些缺点可以通过使用替代的长期存活的肝细胞系,例如人类或动物肝祖细胞系来克服。人类肝祖细胞系的一个这类实例是HepaRG细胞系(ThermoFisherScientific)。HepaRG细胞保留原代人类肝细胞的许多特征。其肝脏特异性和代谢基因表达比原代肝细胞大并且使用寿命更长。3维球状体中HepaRG细胞的重新组织进一步增加使用寿命和代谢能力,这表明球状体可以为毒性测试提供更佳的替代的体外肝模型。还可以用原代肝细胞与肝星形细胞或原代肝细胞与脂肪组织衍生干细胞的混合物创造肝球状体。在一个实施例中,肺细胞是一种肺上皮细胞,例如支气管和/或气管上皮细胞。在一个实施例中,肝细胞是HepaRG细胞,适当地,球状体HepaRG细胞。还涵盖细胞的组合,包含肝和肺细胞的组合。涵盖例如支气管和/或气管上皮细胞等肺上皮细胞与HepaRG细胞、适当地球状体HepaRG的组合。本公开的一个方面涉及一种3维多器官培养系统。此培养系统可以包括多种细胞的使用,例如如本文所述的肝细胞和肺细胞。还涵盖其它细胞类型的使用,包含(但不限于)内皮细胞、(肺)成纤维细胞和免疫细胞,例如单核细胞/巨噬细胞、树突状细胞、嗜中性白血球和肥大细胞。在一个实施例中,本公开的方法排除从受试者分离或获得细胞样品的步骤。细胞培养基本公开的一个方面涉及可以用于培养3维细胞的细胞培养基。在一个实施例中,细胞培养基可以用于培养肝和肺细胞,不会损失每个细胞个别特征。在本文所述的培养基中培养的肝细胞甚至可以显示与在先前针对培养肝细胞而优化的细胞培养基(例如William'sE培养基)中生长的肝细胞相比改善的特征。适当地,肺细胞保留如本文所述的其特征。本文所述的培养基可以用于培养肝细胞或培养肺细胞或共培养肝细胞和肺细胞。适当地,与在单独完全William'sE培养基中培养的分离的3维肝球状体相比,在细胞培养基/培养基中生长的肝细胞可以具有增加的ATP含量、相同或增加的细胞色素P4501A1和细胞色素P4501B1活性以及增加的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有比在单独完全William'sE培养基中培养的分离的3维肝球状体高至少1.5倍的ATP含量、与在单独完全William'sE培养基中培养的细胞相比高至少1.0倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少1.9倍的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.1倍的ATP含量、高至少1.9倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少1.8倍的增加的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.1倍的ATP含量、高至少2.1倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少2.0倍的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.4倍的ATP含量、高至少2.4倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少2.1倍的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.9倍的ATP含量、高至少2.3倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少2.6倍的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.6倍的ATP含量、高至少2.9倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少2.5倍的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.7倍的ATP含量、高至少2.1倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少3.3倍的白蛋白分泌。在细胞培养基/培养基中生长的肝细胞可以具有与在单独完全William'sE培养基中培养的细胞相比高至少2.7倍的ATP含量、高至少2.6倍的细胞色素P4501A1和细胞色素P4501B1活性以及高至少3.1倍的白蛋白分泌。本文中描述了测量ATP含量、细胞色素P4501A1和细胞色素P4501B1活性以及白蛋白分泌的方法。适当地,在细胞培养基/培养基中生长的肝细胞与在单独William'sE培养基中培养的细胞相比坏死细胞的数目相同或数目有所增加。适当地,在细胞培养基/培养基中生长的肝细胞与在单独William'sE培养基中培养的细胞相比凋亡细胞的数目增加。适当地,与在单独William'sE培养基中培养的细胞相比,在细胞培养基/培养基中生长的肝细胞具有调节(例如增加或减少)水平的谷胱甘肽(GSH)。适当地,与在单独William'sE培养基中培养的细胞相比,在细胞培养基/培养基中生长的肝细胞具有增加水平的氧化谷胱甘肽(GSSG)。适当地,在培养9天后观测本文所述的变化。测量ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌的方法详细地描述于实例中。ATP含量可以使用分析法(Promega,Dübendorf,Switzerland)来测定。CYP1A1/B1、CYP1A2和CYP2B6的活性可以使用P450-Glo分析法(Promega,Dübendorf,Switzerland)来测定。白蛋白分泌可以使用人类白蛋白ELISA试剂盒(Abcam)来测定。适当地,在细胞培养基/培养基中生长的肺细胞维持存活力、结构完整性和功能。适当地,与在完全PneumaCult-ALI培养基或完全B-ALI培养基中培养的肺细胞相比,在细胞培养基/培养基中生长的肺细胞维持相同的存活力、结构完整性和功能。适当地,在细胞培养基/培养基中生长的肺细胞与在完全PneumaCult-ALI培养基或完全B-ALI培养基中培养的肺细胞相同。培养基可以是含有100%(v/v)完全PneumaCult-ALI培养基的完全PneumaCult-ALI培养基,对其不作任何添加或稀释。培养基可以是含有100%(v/v)完全B-ALI培养基的完全B-ALI培养基,对其不作任何添加或稀释。培养基可以是包括完全PneumaCult-ALI培养基和完全William'sE培养基或由其组成或基本上由其组成的混合物。将完全PneumaCult-ALI培养基用完全William'sE培养基稀释。在一个实施例中,混合物包括30%至99.9%(v/v)、40%至99.9%(v/v)、50%至99.9%(v/v)、60%至99.9%(v/v)、70%至99.9%(v/v)完全PneumaCult-ALI培养基或由其组成,其余体积用完全William'sE培养基补足至100%(v/v)。培养基可以是包括以下或由以下组成或基本上由以下组成的混合物:包括完全B-ALI培养基和完全William'sE培养基或由其组成或基本上由其组成的混合物。将完全B-ALI培养基用完全William'sE培养基稀释。在一个实施例中,混合物包括30%至99.9%(v/v)、40%至99.9%(v/v)、50%至99.9%(v/v)、60%至99.9%(v/v)、70%至99.9%(v/v)完全B-ALI培养基或由其组成,其余体积用完全William'sE培养基补足至100%(v/v)。(i)完全B-ALI培养基在一个实施例中,细胞培养基由完全B-ALI培养基组成。换句话说,细胞培养基含有100%(v/v)完全B-ALI培养基,不添加培养基成分。在另一实施例中,细胞培养基基本上由完全B-ALI培养基组成。完全B-ALI培养基促进肺上皮细胞的分化。完全B-ALI培养基通过将含有B-ALI生长基础培养基、B-ALI分化基础培养基和BALISingleQuots试剂盒的B-ALIBulletKit(Lonza,目录编号193514)的内含物组合在一起来制备。B-ALIBulletKit是由生长和分化培养基SingleQuots试剂盒、生长基础培养基和分化基础培养基组成。其促进肺上皮细胞的完全分化。根据本公开的此实施例,在单独完全B-ALI培养基(即,100%(v/v)完全B-ALI培养基)中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比相同或增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,在单独完全B-ALI培养基(即,100%(v/v)完全B-ALI培养基)中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加1.9倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比相同的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加1.9倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。在另一实施例中,细胞培养基包括完全B-ALI培养基,其限制条件为在包括完全B-ALI培养基的细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比相同的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,细胞培养基包括完全B-ALI培养基,其限制条件为在包括完全B-ALI培养基的细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加1.9倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比相同的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加1.9倍的白蛋白分泌(参见表1)。适当地,当在培养物中生长时分离的3维肝球状体与在单独William'sE培养基中培养的3维肝球状体相比凋亡细胞的数目有所增加。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有调节(例如增加或减少)水平的谷胱甘肽(GSH)。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有增加水平的氧化谷胱甘肽(GSSG)。适当地,在培养9天后观测本文所述的变化。(ii)完全B-ALI培养基和完全William'sE培养基在一个实施例中,细胞培养基包括完全B-ALI培养基与完全William'sE培养基的混合物或由其组成或基本上由其组成。完全William'sE培养基被开发用于分离和长期维持成年大鼠肝上皮细胞。完全B-ALI培养基通过将含有B-ALI生长基础培养基、B-ALI分化基础培养基和BALISingleQuots试剂盒的B-ALIBulletKit(Lonza,目录编号193514)的内含物组合在一起来制备。B-ALIBulletKit是由生长和分化培养基SingleQuots试剂盒、生长基础培养基和分化基础培养基组成。其促进气道上皮细胞的完全分化。完全William'sE培养基通过用HepaRG维持与代谢补充剂(ThermoFisherScientific,目录编号HPRG720)和GlutaMAXTM溶液(ThermoFisherScientific,目录编号35050061)补充William'sE培养基(ThermoFisherScientific,目录编号12551032)来制备。William'sE培养基描述于《实验细胞研究(Exp.CellRes)》.(1974)89:139且展示于表2中。完全B-ALI培养基与完全William'sE培养基混合。组合在一起的每一培养基的百分比可以变化。在一个实施例中,混合物包括至少70%(v/v)完全B-ALI培养基、由其组成或基本上由其组成,其余体积由完全William'sE培养基补足至100%(v/v)。在一个实施例中,混合物包括70%/30%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括75%/25%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括80%/20%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括85%/15%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括90%/10%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括95%/5%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。适当地,当混合物包括90%/10%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括90%/10%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.1倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加1.9倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加1.8倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括80%/20%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括80%/20%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.4倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.4倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.1倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括70%/30%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括70%/30%(v/v)完全B-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.1倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.1倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.0倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。如从表1中概述的结果可见,80%/20%(v/v)完全B-ALI培养基/完全William'sE培养基的混合物引起与在单独完全William'sE培养基中培养的3维肝球状体相比组合的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌的6.9倍增加。因此,充分预期完全B-ALI培养基在完全William'sE培养基中的进一步稀释将引起与在单独完全William'sE培养基中培养的3维肝球状体相比组合的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性增加。公开60%/40%(v/v)完全B-ALI培养基/完全William'sE培养基、50%/50%(v/v)完全B-ALI培养基/完全William'sE培养基、40%/60%(v/v)完全B-ALI培养基/完全William'sE培养基和30%/70%(v/v)完全B-ALI培养基/完全William'sE培养基。适当地,当在培养物中生长时分离的3维肝球状体与在单独William'sE培养基中培养的3维肝球状体相比凋亡细胞的数目有所增加。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有调节(例如增加或减少)水平的谷胱甘肽(GSH)。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有增加水平的氧化谷胱甘肽(GSSG)。适当地,在培养9天后观测本文所述的变化。(iii)完全PneumaCult-ALI培养基在一个实施例中,细胞培养基由完全PneumaCult-ALI培养基组成。换句话说,细胞培养基含有100%(v/v)完全PneumaCult-ALI培养基,不添加培养基成分。在另一实施例中,细胞培养基基本上由完全PneumaCult-ALI培养基组成。PneumaCult-ALI培养基促进肺上皮细胞的分化。完全PneumaCult-ALI培养基通过将PneumaCult-ALI基础培养基(StemCellTechnologies,参考05002)与PneumaCult-ALI10X补充剂(StemCellTechnologies,参考05003)、PneumaCult-ALI维持补充剂(StemCellTechnologies,参考05006)、氢化可的松储备溶液(StemCellTechnologies,参考07925)和含0.2%肝素钠盐的PBS(StemCellTechnologies,参考37250)混合来制备。根据本公开的此实施例,在单独完全PneumaCult-ALI培养基(即,100%(v/v)完全PneumaCult-ALI培养基)中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,在单独完全PneumaCult-ALI培养基(即,100%(v/v)完全PneumaCult-ALI培养基)中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.7倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.1倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加3.3倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。在另一实施例中,细胞培养基包括完全PneumaCult-ALI培养基,其限制条件为在包括完全PneumaCult-ALI培养基的细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,细胞培养基包括完全PneumaCult-ALI培养基,其限制条件为在包括完全PneumaCult-ALI培养基的细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.7倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.1倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加3.3倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。适当地,当在培养物中生长时分离的3维肝球状体与在单独William'sE培养基中培养的3维肝球状体相比凋亡细胞的数目有所增加。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有调节(例如增加或减少)水平的谷胱甘肽(GSH)。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有增加水平的氧化谷胱甘肽(GSSG)。适当地,在培养9天后观测本文所述的变化。(iv)完全PneumaCult-ALI培养基和完全William'sE培养基在一个实施例中,细胞培养基包括完全PneumaCult-ALI培养基与完全William'sE培养基的混合物或由其组成。完全PneumaCult-ALI培养基通过将PneumaCult-ALI基础培养基(StemCellTechnologies,目录编号05002)与PneumaCult-ALI10X补充剂(StemCellTechnologies,目录编号05003)、PneumaCult-ALI维持补充剂(StemCellTechnologies,目录编号05006)、氢化可的松储备溶液(StemCellTechnologies,目录编号07925)和含0.2%肝素钠盐的PBS(StemCellTechnologies,目录编号37250)混合来制备。完全William'sE培养基通过用HepaRG维持与代谢补充剂(ThermoFisherScientific,目录编号HPRG720)和GlutaMAXTM溶液(ThermoFisherScientific,目录编号35050061)补充William'sE培养基(ThermoFisherScientific,目录编号12551032)来制备。完全PneumaCult-ALI培养基与完全William'sE培养基混合。组合在一起的每一培养基的百分比可以变化。在一个实施例中,混合物包括至少70%(v/v)完全PneumaCult-ALI培养基、由其组成或基本上由其组成,其余体积由完全William'sE培养基补足至100%(v/v)。在一个实施例中,混合物包括70%/30%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括75%/25%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括80%/20%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括85%/15%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括90%/10%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。在另一实施例中,混合物包括95%/5%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成。适当地,当混合物包括90%/10%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括90%/10%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.9倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.3倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.6倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括80%/20%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括80%/20%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.7倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.5倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加3.1倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括70%/30%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的ATP含量;(B)与在单独完全William'sE培养基中培养的3维肝球状体相比增加的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独William'sE培养基中培养的3维肝球状体相比增加的白蛋白分泌。适当地,在培养9天后观测本文所述的变化。适当地,当混合物包括70%/30%(v/v)完全PneumaCult-ALI/完全William'sE培养基、由其组成或基本上由其组成时,在细胞培养基中培养9天的3维肝球状体具有:(A)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.6倍的ATP含量;(B)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.9倍的细胞色素P4501A1和细胞色素P4501B1活性;以及(C)与在单独完全William'sE培养基(即,100%(v/v)完全William'sE培养基)中培养相同时间段的3维肝球状体相比增加2.5倍的白蛋白分泌(参见表1)。适当地,在培养9天后观测本文所述的变化。适当地,当在培养物中生长时分离的3维肝球状体与在单独William'sE培养基中培养的3维肝球状体相比凋亡细胞的数目有所增加。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有调节(例如增加或减少)水平的谷胱甘肽(GSH)。适当地,与在单独William'sE培养基中培养的3维肝球状体相比,分离的3维肝球状体具有增加水平的氧化谷胱甘肽(GSSG)。适当地,在培养9天后观测本文所述的变化。如从表1中概述的结果可见,与在单独完全William'sE培养基中培养的3维肝球状体相比,70%/30%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基的混合物引起组合的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌的8倍增加。因此,充分预期完全PneumaCultALI培养基在完全William'sE培养基中的进一步稀释将引起与在单独完全William'sE培养基中培养的3维肝球状体相比组合的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性增加。公开60%/40%(v/v)完全PneumaCult-ALI/完全William'sE培养基、50%/50%(v/v)完全PneumaCult-ALI/完全William'sE培养基、40%/60%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基和30%/70%(v/v)完全PneumaCult-ALI/完全William'sE培养基。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,由80%/20%(v/v)完全PneumaCult-ALI/完全William'sE培养基组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌最大倍数的总体增加。包括80%/20%(v/v)完全PneumaCult-ALI/完全William'sE培养基或由其组成或基本上由其组成的细胞培养基混合物对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,由100%(v/v)完全PneumaCult-ALI培养基组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第二大倍数的总体增加。由100%(v/v)完全PneumaCult-ALI培养基组成或基本上由其组成的细胞培养基对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,包括70%/30%(v/v)完全PneumaCult-ALI/完全William'sE培养基、由其组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第三大倍数的总体增加。包括70%/30%(v/v)完全PneumaCult-ALI/完全William'sE培养基或由其组成或基本上由其组成的细胞培养基混合物对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,包括90%/10%(v/v)完全PneumaCult-ALI/完全William'sE培养基、由其组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第四大倍数的总体增加。包括90%/10%(v/v)完全PneumaCult-ALI/完全William'sE培养基或由其组成或基本上由其组成的细胞培养基混合物对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,包括80%/20%(v/v)完全B-ALI/完全William'sE培养基、由其组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第五大倍数的总体增加。包括80%/20%(v/v)完全B-ALI培养基/完全William'sE培养基或由其组成或基本上由其组成的细胞培养基混合物对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,包括70%/30%(v/v)完全B-ALI/完全William'sE培养基、由其组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第六大倍数的总体增加。包括70%/30%(v/v)完全B-ALI培养基/完全William'sE培养基或由其组成或基本上由其组成的细胞培养基混合物对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,包括90%/10%(v/v)完全B-ALI/完全William'sE培养基、由其组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第七大倍数的总体增加。包括90%/10%(v/v)完全B-ALI培养基/完全William'sE培养基或由其组成或基本上由其组成的细胞培养基混合物对于本公开的某些实施例来说是优选的。在本公开中针对3维肝球状体的培养进行测试的多种培养基中,包括100%(v/v)完全B-ALI培养基、由其组成或基本上由其组成的混合物引起3维肝球状体的ATP含量、细胞色素P4501A1和细胞色素P4501B1活性和白蛋白分泌第八大倍数的总体增加。由100%(v/v)完全B-ALI培养基组成或基本上由其组成的细胞培养基对于本公开的某些实施例来说是优选的。另一方面涉及用于鉴别可以用于共培养本文所述的肺细胞和肝细胞的共培养培养基的方法,所述方法包括:(a)提供包括完全PneumaCult-ALI培养基或完全William'sE培养基的培养基;(b)将完全PneumaCult-ALI培养基或完全William'sE培养基与针对肝细胞培养优化或特定用于培养肝细胞的培养基混合以提供细胞培养基混合物;(c)将肺细胞和肝细胞的共培养物加入细胞培养基混合物:以及(d)鉴别如下细胞培养基混合物,其中肝细胞具有:与在单独完全William'sE培养基中培养的肝细胞相比增加的ATP含量;与在单独完全William'sE培养基中培养的肝细胞相比相同或增加的细胞色素P4501A1和细胞色素P4501B1活性;以及与在单独William'sE培养基中培养的肝细胞相比增加的白蛋白分泌,并且肺细胞保持其特征。本文中描述了肝细胞的其它特性。另一方面涉及一种可以用于共培养通过或可通过此方法获得的肺细胞和肝细胞的共培养培养基,其中在共培养培养基中培养的肝细胞具有:与在单独完全William'sE培养基中培养的肝细胞相比增加的ATP含量;与在单独完全William'sE培养基中培养的肝细胞相比相同或增加的细胞色素P4501A1和细胞色素P4501B1活性;以及与在单独William'sE培养基中培养的肝细胞相比增加的白蛋白分泌,并且肺细胞保持其特征。本文中描述了肝细胞的其它特性。3维器官培养系统3维器官培养系统、尤其呈小型化形式的培养系统适用于本公开中,因为其允许对器官如何发挥功能进行研究。例如可以在如本文所述的筛选分析法中研究对某些刺激的反应、对一或多种化合物或组合物的反应以及此类化合物或组合物的药物动力学行为。小型化3维器官培养系统,又称为芯片上器官,尤其受到关注,因为其允许对成组器官进行组合研究,也就是说,研究至少3维肺组织和肝组织。这允许重现肺组织与肝组织之间的相互作用的复杂性。因此,考虑肺和肝器官并且允许这多个器官进行动态培养的本公开的3维培养系统是非常有利的。大部分的3维器官培养系统是器官型的,这意味着其寻求再现器官或器官系统的主要功能。还描述了将肺组织和肝组织互连的小型化流体系统。适当地,芯片上器官是一种微流体装置,其具有至少一种组织类型,例如肺或肝的至少一种生理功能,或更适当地,具有至少两种不同组织类型,例如肺和肝的至少一种生理功能。芯片上器官可以是来自包含哺乳动物、非哺乳动物和动物在内的任何生物体的任何活组织或器官。芯片上器官一般包括至少一个被安置在其中的微流体通道。这些通道的确切尺寸将基于芯片的功能和/或尺寸而不同。至少一个微流体通道一般用以为芯片上的生物材料提供和补充养分。在一个方面中,3维多器官培养系统包括:(a)第一器官生长部分,其被调适成用于将例如肝等第一3维细胞类型培养或浸没在培养基中;(b)第二器官生长部分,其被调适成用于将例如肺等第二3维细胞类型在空气液体界面处培养,所述第二3维细胞类型是与所述第一3维细胞类型不同的细胞类型;以及(c)将第一器官腔和第二器官腔连接以允许培养基在两者之间流动的培养基储集器。第一器官生长部分可以包括第一器官腔或插孔或器皿或容器或密封构件。第二器官生长部分可以包括第二器官腔或插孔或器皿或容器或密封构件。储集器可以由微流体通道来提供。适当地,例如第一器官腔等第一器官生长部分和例如第二器官腔等第二器官生长部分含有相同的培养基,例如包括以下或由以下组成或基本上由以下组成的培养基:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,或如本文所述的其变化形式。除本文所述的细胞类型之外,芯片可以包括其它细胞类型以产生多器官芯片。所属领域的技术人员能够设计出具有实现具体应用所需的最佳数目的通道和/或通道尺寸的芯片。芯片可以包括用以调节流体流量的流体控制元件,例如泵或阀门微通道,以控制芯片内的微循环。芯片上的细胞和组织可以使用例如气体交换膜来充氧。芯片可以进一步包括一或多个用于监测细胞的变化和/或细胞对其周围条件反应的传感器。芯片可以由所属领域的技术人员熟悉的任何合适材料构造。这类材料、适当地生物相容性材料的实例是硅、聚氨酯、玻璃、塑料、聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯、聚四氟乙烯(TEFLON.TM.)、聚氯乙烯(PVC)、聚二甲基硅氧烷(PDMS)和橡胶。芯片还可以视需要包括其它组分,例如充氧器、泵、阀门、气体交换器和气泡捕集器。所属领域中描述了各种芯片上器官,参见例如《实验室芯片(LabChip)》(2015)15,2688-2699和《实验室芯片(Lab.Chip)》(2013)13,3538。芯片上组织或器官的功能可以使用各种方法评估,本文描述了一些方法。举例来说,可以使用成像技术在形态上监测组织或器官。肺芯片的功能性可以例如通过测量渗透屏障功能、表面活性剂产生并测量对细胞因子的反应来监测。肝芯片的功能性可以使用多种分析法监测,本文描述了至少一些分析法。这类分析法可以包含转运体功能、细胞色素P450表达和白蛋白分泌。基于肝的3维培养肝在解毒、碳水化合物、脂质和蛋白质的代谢以及内源性和外源性物质的生物转化中发挥重要作用。肝功能性与由所谓肺叶组成的复杂3维结构内所包埋的高度专业化细胞(大部分是肝细胞)的装配紧密关联。化合物的生物转化通常产生无毒且更可溶的代谢物,然而,有时可能形成引起肝毒性的更有毒性的代谢物。可以使用所属领域中在文献中有充分记载的各种方法培养3维肝细胞,包含使用胶原蛋白夹心式培养、膜生物反应器、搅拌式生物反应器、悬滴、聚苯乙烯支架培养和使用微流体装置培养3维肝细胞。肝细胞可以经由各种方法变成3维,包含使用夹心式培养、固体支架材料-例如聚苯乙烯支架、水凝胶-例如I型胶原蛋白或肝细胞自组装成球状体。虽然有限的刚刚分离的原代人类肝细胞的使用可能是本公开的优选肺细胞类型,但其可用性受到限制。人类肝细胞系的其它选择包含HepG2和Hep2/C3A。一种尤其合适的细胞来源是HepaRG细胞系。人类肝细胞的其它来源是人类胚胎干细胞(hESC)来源的肝细胞和来源于诱导多能干细胞(iPSC)的肝细胞。3维肝球状体尤其适用于本公开中。其可以在无支架的系统中在多孔板中通过肝细胞自组装成聚集体或在搅拌式生物反应器中产生。肝球状体形成肝状结构,并且可存活较长时间段,展示了良好的功能性,这使得其非常适合于高通量应用和用于芯片上。基于肺的3维培养因为呼吸道的形态从上呼吸道变成下呼吸道,所以已经使用原代细胞或细胞系建立许多不同的细胞培养模型并且涵盖其用于本公开中。确切使用哪些细胞或细胞系的选择将取决于用于所给出研究的呼吸道的关注区域。芯片上肺模型能够再现活体肺的结构和功能。在这类模型的一个实例中,可以制造微流体系统,其含有两个被膜分开的紧密并置的微通道。膜可以涂有胞外基质,并且人类肺泡上皮细胞和人类肺部微血管内皮细胞可以在膜的相对侧上进行培养。一旦细胞生长到汇合,就将空气引入到上皮细胞隔室中,从而产生空气-液体界面以模拟肺泡气隙的内层。因为肺表面暴露于空气,所以细胞模型在空气-液体界面进行培养,以更逼真地模拟肺。筛选可以使用本文所述的方法确定一或多种试剂对3维细胞、组织或器官的作用。在一个方面中,描述了一种体外的用于评估3维细胞、组织或器官对试剂的反应的方法,所述方法包括:(i)使3维细胞或共培养物或3维器官培养系统或3维多器官培养系统与至少一种试剂接触;以及(ii)测量在与至少一种试剂接触之后的一或多种反应;其中在与至少一种试剂接触前后一或多种反应的差异指示所述试剂调节细胞、组织或器官的反应。还描述了体外的用于评估3维肝细胞、组织或器官和3维肺细胞、组织或器官对试剂的反应的方法,所述方法包括:(i)使共培养物或3维器官培养系统或3维多器官培养系统与至少一种试剂接触;以及(ii)测量在与至少一种试剂接触之后的一或多种反应;其中在与至少一种试剂接触前后一或多种反应的差异指示所述试剂调节细胞、组织或器官的反应。适当地,测量或测定至少一种试剂对3维肺细胞、组织或器官的渗透。适当地,测量或测定至少一种试剂在3维肝细胞、组织或器官中的生物活化。这些步骤可以同时或彼此相继进行。可以使用本文所述的方法测定一或多种试剂对3维肺细胞、组织或器官的作用。可以使用本文所述的方法测定一或多种试剂对3维肝细胞、组织或器官的作用。可以使用本文所述的方法测定一或多种试剂对3维肺细胞、组织或器官和3维肝细胞、组织或器官的作用。可以使用本文所述的方法测定一或多种试剂对例如气溶胶等试剂渗透到3维肺细胞、组织或器官以及其在肝细胞、组织或器官中的进一步生物活化的作用。所述试剂可以包含(但不限于)药物、毒素、病原体、抗原、抗体和气溶胶等。试剂可以加入本文所述的3维培养系统中,并且可以监测或确定其对3维培养的细胞、组织或器官的作用。可以测量的作用的实例包含氧气的消耗、二氧化碳的产生、细胞活力、蛋白质的表达、酶的活性、渗透、渗透屏障功能、表面活性剂产生、对细胞因子的反应、转运体功能、细胞色素P450表达、白蛋白分泌等等。可以与不同浓度的试剂平行进行多种分析法,以获得对多种浓度的差异反应。如本领域中已知,测定试剂的有效浓度的方法通常使用由1:10或其它对数标度稀释产生的一系列浓度。必要时,浓度可以用第二连续稀释进一步细化。通常,这些浓度之一充当阴性对照。试剂(例如测试化合物)可以是所关注的任何化合物并且包含小的有机化合物、多肽、肽、较高分子量碳水化合物、聚核苷酸、脂肪酸和脂质、气溶胶或气溶胶的一或多种组分等等。测试化合物可以个别地筛选,或以化合物的集合或组合文库筛选。可以从包含合成或天然化合物的文库在内的各种来源获得测试化合物。可以使用呈细菌、真菌、植物和动物提取物形式的天然化合物的文库。通过常规化学、物理和生物化学手段修饰的天然或以合成方式产生的文库和化合物可以用于产生组合文库。已知的药剂可以进行定向或随机的化学改性,例如酰化、烷基化、酯化、酸化以产生结构类似物以供筛选。当使用组合文库筛选时,可以筛选化学上类似或不同的分子的大型文库。在组合筛选时,所发现的命中数目与所测试的分子数目成比例。可以筛选大量化合物,每天能测试数千种化合物,其中可以应用实验室自动化和机器人技术。可以在所属领域中发现用于合成分子文库的方法的许多实例。小的有机化合物包含分子量低于约5000、通常低于约2500、通常低于约2000、更通常低于约1500、宜约100到约1000的化合物。小的有机化合物可以是生物或合成有机化合物。小的有机化合物中存在的原子一般是在包括碳、氢、氧和氮的群组中,并且如果呈药物学上可接受的形式,那么可以包含卤素、硼、磷、硒和硫。一般来说,氧、氮、硫或磷如果存在的话,那么结合于碳或彼此一或多种或结合于氢,从而形成多种官能团,例如羧酸、醇、硫醇、羧酰胺、氨基甲酸酯、羧酸酯、酰胺、醚、硫醚、硫酯、磷酸酯、膦酸酯、烯烃、酮、胺、醛等。小的有机化合物在本文使用此术语时还包含分子量低于约5000的小型肽、小型寡核苷酸、小型多糖、脂肪酸、脂质等等。药剂的实例描述于《(ThePharmacologicalBasisofTherapeutics)》,Goodman和Gilman,McGraw-Hill,NewYork,N.Y.,(1996),第九版中。试剂可以是毒素。可以分析呈溶解状态的测试化合物和可以溶解于合适溶剂中的固体样品。还可以通过将样品暴露气体一段时间来分析呈气体形式的测试化合物。所关注的样品包含环境样品、生物样品、制造样品、化合物文库以及合成和天然存在的化合物。可以筛选具有至少约5,000、更通常至少约10,000的分子量的多肽。测试多肽一般将具有约5,000到约5,000,000或更大分子量,更通常约20,000到约1,000,000分子量。可以考虑各种多肽,例如具有类似结构特征的多肽家族、具有特定生物功能的多肽、与特定微生物、尤其是致病微生物相关的多肽。这类多肽包含细胞因子或白细胞介素、酶、鱼精蛋白、组蛋白、白蛋白、免疫球蛋白、硬多肽、磷酸化多肽、粘多肽、紫色多肽、脂质多肽、糖多肽、T细胞受体、蛋白多糖、促生长素、促乳素、胰岛素、胃蛋白酶、在人类血浆中发现的多肽、凝血因子、血型因子、多肽激素、癌症抗原、组织特异性抗原、肽激素、营养标记物、组织特异性抗原和合成肽,这些可以糖化或不糖化。可以筛选多核苷酸。测试多核苷酸可以是天然化合物或合成化合物。多核苷酸包含寡核苷酸并且由例如核糖核苷酸和脱氧核糖核苷酸等天然核苷酸和其衍生物构成,不过还涵盖非天然核苷酸模拟物,例如2'修饰的核苷、肽核酸和寡聚核苷膦酸酯。更高分子量多核苷酸可以具有约20到约5,000,000个或更多个核苷酸。可以测量的一或多个变量包含细胞、亚细胞物质、亚细胞组分或细胞产物的可定量要素,尤其是可以在高通量分析系统中准确测量的要素。输出可以是任何细胞、细胞组分或细胞产物的特征、条件、状态或功能,包含存活力、呼吸、代谢、细胞表面决定子、受体、蛋白质或其构形或翻译后修饰、脂质、碳水化合物、有机或无机分子、DNA、RNA等等或来源于这类细胞组分的部分。虽然变量可以提供定量读数,但在一些情况下,可以获得半定量或定性结果。读数变量可以例如包含单个值或平均值,或中位值或其方差。各种方法可以用于测量变量以确定细胞、组织或器官对试剂/测试化合物的反应。为了测量存在的分子的量,一种方法是用可检测部分标记分子,可检测部分荧光、发光、放射性、酶活性等等。荧光和发光部分可用于标记生物分子、结构或细胞类型。免疫荧光部分可以不仅结合于特定蛋白质,而且还结合特定构象、裂解产物或如磷酸化等位点改性。个别肽和蛋白质可以被工程化成自动发荧光。可以使用免疫分析技术,例如免疫组织化学、放射免疫分析(RIA)或酶联免疫吸附分析(ELISA)和相关非酶技术。这些技术利用特异性抗体作为报告分子,这些特异性抗体由于高度特异性地连接到单分子标靶而尤其适用。基于细胞的ELISA或相关非酶或基于荧光的方法能够测量细胞表面参数。筛选分析的结果可以与从参考化合物、浓度曲线、对照等获得的结果相比。试剂可以是气溶胶,例如烟雾,或来源于烟雾的气溶胶。气溶胶一个实施例涉及研究例如气溶胶等试剂渗透到本文所述的3维肺细胞、组织或器官中。另一实施例涉及研究例如气溶胶等试剂渗透到3维肺细胞、组织或器官中以及其在肝细胞、组织或器官中的进一步生物活化。具体地说,这可以在本文所述的3维器官培养系统上进行。气溶胶可以由气溶胶形成装置获得或产生。吸烟制品和可抽吸制品是气溶胶形成装置的类型。吸烟制品或可抽吸制品的实例包含但不限于香烟、小雪茄和雪茄。在某些气溶胶形成装置而不是燃烧中,烟草组合物或另一气溶胶形成材料被一个或多个电加热元件进行加热,以产生气溶胶。在另一类型的被加热的气溶胶形成装置中,通过将热量从可燃性燃料元件或热源转移到物理上分开的气溶胶形成材料来产生气溶胶,所述气溶胶形成材料可以位于热源内、热源周围或热源下游。通常在被加热的吸烟制品中,通过将热量从热源转移到物理上分开的气溶胶形成基材或材料来生成气溶胶,所述气溶胶形成基材或材料可以位于热源内、热源周围或热源下游。在抽吸期间,挥发性化合物通过来自热源的热转移从气溶胶形成材料释放,并且夹带在被抽吸穿过吸烟制品的空气中。随着所释放的化合物冷却,化合物冷凝,形成气溶胶被使用者吸入。如本文中使用的术语“气溶胶形成材料”用于描述能够在加热挥发性化合物时释放的材料,其可以形成气溶胶。气溶胶形成材料可以包含植物类材料。气溶胶形成材料的实例包含但不限于烟草组合物、烟草、烟草提取物、烟丝、切丝填料、烘烤的烟草、膨胀烟草、均质烟草、再造烟草和烟斗烟草。替代地,所述气溶胶形成材料可以包括非植物类材料。气溶胶可以呈烟雾形式。如本文所用,术语‘烟雾’用于描述由如香烟等吸烟制品或通过燃烧气溶胶形成材料而产生的一类气溶胶。烟雾包含多种试剂,需要时,其可以呈个别化合物形式提供。这类试剂的实例包含无烟碱干颗粒物、一氧化碳、甲醛、乙醛、丙酮、丙烯醛、丙醛、巴豆醛、甲基乙基甲酮、丁醛、苯并[a]芘、苯酚、间甲酚、邻甲酚、对甲酚、儿茶酚、间苯二酚、氢醌、1,3-丁二烯、异戊二烯、丙烯腈、苯、甲苯、吡啶、喹啉、苯乙烯、N'-亚硝基去甲烟碱(NNN)、N'-亚硝基新烟草碱(NAT)、N'-亚硝基假木贼碱(NAB)、4-(甲基亚硝氨基)-1-(3-吡啶基)-1-丁酮(NNK)、1-氨基萘、2-氨基萘、3-氨基联苯、4-氨基联苯、一氧化氮(NO)、氧化二氮(NOx)、氢氰酸、氨、砷、镉、铬、铅、镍、硒和汞。本文所述的3维器官培养系统可以暴露于烟雾达多个时间量。烟雾可以使用Vitrocell吸烟机器人递送,如《美国生理学杂志:肺细胞和分子生理学(Am.J.Physiol.LungCellMolPhysiol)》304:L489-L503(2013)中所述。可以使用每个香烟确定的抽吸次数和每分钟暴露确定的抽吸次数,并且变化香烟数目以相对于暴露时间调整。参考香烟,例如参考香烟3R4F,可以用作烟雾来源,并且在吸烟机器人上吸烟,基本上与国际标准化组织吸烟方案(ISO2000)一致。暴露后,在分析之前3维器官培养系统可以任选与新鲜培养基一起培育。试剂盒还涵盖试剂盒。本文所述的培养基可以填充到一或多种合适容器中。合适容器可以是包括盖子,例如可密封或可再密封盖子的可消毒烧瓶或可消毒瓶或可消毒烧杯。因此,本公开还涉及一种容器,其包括本文所述的培养基。本公开还涉及多个包括本文所述的培养基的容器。另外,本公开涉及一种包装或试剂盒,其包括单个或多个任选地包括培养基的烧瓶或瓶子,以及关于制备其的说明书。任选地,一或多种本文所述的细胞类型可以包含于包装或试剂盒中。任选地,一或多种参考香烟可以包含于包装或试剂盒中。还可以包含使用说明书。其它方面在以下编号段落中呈现本发明的其它方面:1.一种分离的3维肝球状体,其中所述球状体具有:与在单独完全William'sE培养基中培养的3维肝球状体相比,增加的ATP含量;与在单独完全William'sE培养基中培养的3维肝球状体相比,相同或增加的细胞色素P4501A1和细胞色素P4501B1活性;以及与在单独William'sE培养基中培养的3维肝球状体相比,增加的白蛋白分泌。2.一种用于3维多器官培养系统中的分离的3维肝球状体,所述系统通过或可通过以下方法获得,所述方法包括:在包括以下或由以下组成或基本上由以下组成的细胞培养基中培养3维肝球状体:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,历时足以获得如下3维肝球状体的时间,其中:与在单独完全William'sE培养基中培养的3维肝球状体相比,ATP含量增加;与在单独完全William'sE培养基中培养的3维肝球状体相比,细胞色素P4501A1和细胞色素P4501B1活性有所增加;并且与在单独完全William'sE培养基中培养的3维肝球状体相比,白蛋白分泌有所增加。3.根据段落1或段落2的分离的3维肝球状体,其中所述球状体是或来源于人类肝祖细胞系,适当地,其中所述球状体是或来源于HepaRG细胞。4.根据段落1或段落3的分离的3维肝球状体,其中所述球状体在包括以下或由以下组成或基本上由以下组成的细胞培养基中培养:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基。5.一种共培养物,其包括根据前述段落中任一段落的3维肝球状体和3维肺上皮细胞。6.根据段落5的共培养物,其中所述共培养物维持在包括以下或由以下组成或基本上由以下组成的细胞培养基中:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基。7.一种3维器官培养系统,其包括根据段落1至4中任一段落的分离的3维肝球状体。8.一种3维多器官培养系统,其包括根据段落1至4中任一段落的分离的3维肝球状体并且进一步包括至少一种其它3维细胞类型,或包括根据段落5或段落6的共培养物。9.根据段落7的3维器官培养系统或根据段落8的3维多器官培养系统,其中所述3维肝球状体被浸没在含于所述培养系统上的培养基中。10.根据段落8或9的3维多器官培养系统,其进一步包括3维肺上皮细胞,适当地,其中所述3维肺上皮细胞在3维多器官培养系统上的空气液体界面处。11.一种3维多器官培养系统,其包括:(a)第一器官生长部分,其包括被调适成用于将第一3维细胞类型浸没在培养基中的第一器官腔;(b)第二器官生长部分,其包括被调适成用于将第二3维细胞类型在空气液体界面处培养的第二器官腔,所述第二3维细胞类型是与所述第一3维细胞类型不同的细胞类型;以及(c)将第一器官腔和第二器官腔连接以允许培养基在两者之间流动的培养基储集器。12.根据段落11的3维多器官培养系统,其中第一器官腔和第二器官腔含有相同的培养基。13.根据段落11或段落12的3维多器官培养系统,其包括根据段落5或段落6的共培养物。14.根据段落7的3维器官培养系统或根据段落8到13中任一段落的3维多器官培养系统,其中所述系统小型化。15.根据段落7或14的3维器官培养系统或根据段落8到14中任一段落的3维多器官培养系统,其中所述系统包括或是微流体装置,适当地,其中所述系统是芯片上器官。16.一种细胞培养基,其包括以下或由以下组成或基本上由以下组成:(a)完全PneumaCult-ALI培养基与完全William'sE培养基的混合物;或(b)完全B-ALI培养基和完全William'sE培养基的混合物。17.根据段落16的细胞培养基,其进一步包括根据段落1到4中任一段落的3维肝球状体或根据段落5或段落6的共培养物。18.一种包括培养基的3维多器官培养系统,所述培养基由包括以下或由以下组成或基本上由以下组成的培养基组成的群组中选出:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,或其两个或多个的组合。19.一种制备用于3维器官培养系统中的3维肝球状体的方法,包括:(i)提供3维肝球状体;(ii)使所述3维肝球状体与包括以下或由以下组成或基本上由以下组成的培养基接触:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基;以及(iii)获得3维肝球状体以供用于3维器官培养系统中。20.一种制备用于3维多器官培养系统中的共培养物的方法,所述共培养物包括3维肝球状体和3维肺上皮细胞或由其组成或基本上由其组成,所述方法包括:(i)提供3维肝球状体和3维肺上皮细胞;(ii)使3维肝球状体和3维肺上皮细胞与包括以下或由以下组成或基本上由以下组成的培养基接触:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基;以及(iii)获得3维肝球状体和3维肺上皮细胞的共培养物。21.一种体外的用于评估3维肝球状体对试剂的反应的方法,所述方法包括:(i)使根据段落1到4中任一段落的3维肝球状体或根据段落5或6的共培养物或根据段落7、14或15的3维器官培养系统或根据段落8到15中任一段落的3维多器官培养系统与至少一种试剂接触;以及(ii)测量所述3维肝球状体或所述共培养物或所述3维器官培养系统或所述3维多器官培养系统在与所述至少一种试剂接触后的一或多种反应;其中在与所述至少一种试剂接触前后一或多种反应的差异指示所述试剂调节细胞的反应。22.一种体外的用于评估3维肝球状体和3维肺上皮细胞对试剂的反应的方法,所述方法包括:(i)使根据段落5或6的共培养物或根据段落7、14或15的3维器官培养系统或根据段落8到15中任一段落的3维多器官培养系统与至少一种试剂接触;以及(ii)测量共培养物或3维器官培养系统或3维多器官培养系统在与所述至少一种试剂接触后的一或多种反应;其中在与至少一种试剂接触前后一或多种反应的差异指示所述试剂调节细胞的反应。23.根据段落22的体外方法,其中步骤(ii)包括测量所述至少一种试剂对所述3维肺上皮细胞的渗透。24.根据段落23的体外方法,包括以下其它步骤:(iii)测量至少一种试剂在3维肝球状体中的生物活化;其中步骤(ii)和(iii)中的测量同时进行,或其中步骤(iii)中的测量在步骤(ii)中的测量后进行。25.根据段落22到24中任一段落的体外方法,其中所述试剂是气溶胶,适当地,其中所述气溶胶是或来源于烟雾,适当地,香烟烟雾。26.一种细胞培养基的用途,所述细胞培养基包括以下或由以下组成或基本上由以下组成:(a)完全PneumaCult-ALI培养基;或(b)完全B-ALI培养基;或(c)完全PneumaCult-ALI培养基和完全William'sE培养基或(d)完全B-ALI培养基和完全William'sE培养基,用于培养3维肝球状体或3维肺上皮细胞或用于共培养3维肝球状体和3维肺上皮细胞。27.根据段落7、14或15的3维器官培养系统或根据段落8到15中任一段落的3维多器官培养系统的用途,其用于毒性测试,或用于药物发现,或用于测定试剂对肺细胞的渗透,和/或用于测定试剂在肝细胞中的生物活化,其中所述试剂是气溶胶。虽然本文中已经参考附图详细地公开了本发明的说明性实施例,但是应了解本发明不限于精确的实施例,并且所属领域的技术人员在不脱离由所附权利要求书和其同等物界定的本发明的范围的情况下可以在其中进行多种改变和修改。还在下文实例中描述本发明,提供所述实例以更详细地描述本发明。这些实例阐述目前考虑用于进行本发明的优选方式,意图说明而不是限制本发明。实例实例1支气管器官型培养物的制备这些是根据来自Lonza(Basel,Switzerland)的标题为CloneticsTMB-ALITM空气-液体界面培养基的方案制备。简单来说,使正常人类支气管上皮细胞(NHBEC)在完全B-ALI培养基中在37℃下在5%CO2(90%相对湿度)中扩增,直到约80%汇合。使细胞胰蛋白酶化,洗涤并再悬浮。将35,000细胞接种到涂有I型胶原蛋白的插入物(RootSwitzerland)中,并将插入物置于预填充了完全B-ALI培养基(Lonza)的多孔板中并培育3天。接着移出顶部培养基,并且基础培养基被完全B-ALI培养基替换。使空气提升的插入物返回到培育箱,并且每2到3天替换培养基。另外,在成熟期期间一周进行顶部洗涤一次。在成熟时,通常在空气提升后的4周,使用培养物。在成熟后每周进行形态评估、ATP含量、顶部ATP分泌和CYP1A1/B1活性的测量一次,长达4周(参见图1)。除插入物专用于组织学评估和ATP含量测量以外,所有插入物都能在整个时程中再使用。实例2肝球状体的制备如来自InSphero的GravityTRAPTMULA板手册中所述来制备肝球状体。简单来说,首先使HepaRG细胞在37℃下解冻,历时2分钟,并接着混合到9ml预升温的William'sE培养基(ThermoFisherScientific,参考12551032)中,所述William'sE培养基补充有解冻、涂铺和通用补充剂(ThermoFisherScientific,参考HPRG770)和GlutaMAX溶液(ThermoFisherScientific,参考35050061)。接着将细胞在400×g下离心2分钟,接着培养基被具有与上述相同的补充剂的新鲜William'sE培养基替换。接着球状体微量板(参考4520)的每个孔分布约5000个细胞。5天后,培养基被补充有HepaRG维持和代谢补充剂(ThermoFisherScientific,参考HPRG720)和GlutaMAX溶液(ThermoFisherScientific,参考35050061)的新鲜William'sE培养基(ThermoFisherScientific,参考12551032)替换。一周后,球状体成熟并且准备好用于实验。实例3测定支气管器官型培养物和肝球状体的形态在固定和石蜡包埋、切片和用苏木精和伊红(H&E)和阿辛蓝染色后评估支气管器官型培养物的形态,如先前在《毒理科学(ToxicolSci)》.2015年9月;147(1):207-21中所述。在免疫染色后评估肝球状体形态。简单来说,肝球状体在4%新鲜多聚甲醛中固定隔夜。在1%TritonX-100/0.2%鱼皮明胶(FSG)中阻断后,将球状体用在具有0.1%FSG的PBS中稀释的小鼠抗细胞角蛋白19(1/500,Abcam,Cambridge,UK)染色24小时。使用FITC标记的山羊抗小鼠抗体(1/500,Abcam)目测初级抗体。接着使用具有DAPI的ProLongDiamond抗褪色剂(ThermoFisher)安装球状体,并通过在CellinsightTMCX7平台(赛默飞世尔)上高含量成像来评估。实例4测定支气管器官型培养物和肝球状体的ATP含量使用3D细胞活力分析(Promega,Dübendorf,Switzerland)根据制造商的建议进行测定。为了在支气管培养物中测量,将未稀释的试剂直接加入培养物中,得到细胞内ATP含量。为了分析肝球状体,首先将试剂在William'sE培养基(1:1(v/v))中稀释并接着加入球状体板的孔中。因此,肝球状体中的ATP测量考虑细胞内与细胞外ATP含量(即总ATP)。在加入试剂30分钟后,使用FLUOstarOmega板读取器(BMGLabtech,Ortenberg,Germany)记录发光。实例5测定支气管器官型培养物和肝球状体的ATP分泌在加入低渗(5.2mMKCl、1.2mMCaCl2、1.2mMMgCl2、10mM葡萄糖、10mMTES,pH7.4)生理盐水溶液后测量支气管器官型培养物的气管表面液体(ASL)中的ATP分泌。简单来说,首先将培养物用PBS洗涤,并接着用等张生理盐水处理5分钟。接着小心地收集顶部溶液。60分钟后,将培养物在顶端用低渗溶液处理5分钟,然后小心地收集顶部溶液。使用ATP分析系统(Promega)测量所收集的ASL样品的ATP含量。使用FLUOstarOmega板读取器(BMGLabtech)记录发光。从标准曲线外推ATP浓度实例6基因表达分析使用miRNeasy微型试剂盒(QIAGEN,Hilden,Germany)由肺和肝组织制备RNA。使用RT2第一链试剂盒制备cDNA并与RT2qPCR主混合物混合,然后将混合物涂铺在I期酶RT2轮廓仪PCR阵列(QIAGEN)上。使用ViiATM7实时PCR系统(ThermoFisher)进行qPCR,并根据QIAGEN所提供的说明书分析数据。未调整的p值<0.05(t检验)的改变倍数视为统计学上显著的。实例7测量CYP1A1/B1、CYP1A2和CYP2B6酶的可诱导性和活性两种培养系统的代谢能力通过使用P450-Glo分析法(Promega)根据制造商的说明书检查CYP1A1/B1、CYP1A2和CYP2B6酶的可诱导性和活性来进一步证实。在测量前48小时,用10nM2,3,7,8-四氯二苯并二恶英(TCDD)和25μM利福平(Sigma-Aldrich,Buchs,Switzerland)的组合诱导CYP活性。20μMα-萘黄酮和10μM顺丁烯二酸氟伏沙明(Sigma)分别用于抑制CYP1A1/B1和CYP2B6活性。一完成测量,就用PBS洗涤组织两次并返回到培育箱。实例8测量白蛋白分泌在最后一次培养基变化后48小时,使用人类白蛋白ELISA试剂盒(Abcam)定量肝球状体的白蛋白分泌。使用人类α-GSTELISA试剂盒(WuhanEIAab,LuBioScience分布,Luzern,Switzerland)分析相同细胞培养上清液的α-GST的释放。实例9测量细胞毒性和细胞凋亡ApoTox-GloTM三联分析(Promega,Dübendorf,Switzerland)用于测定受损/坏死和凋亡细胞的数目。首先将细胞与双-丙氨酰基-丙氨酰基-苯丙氨酰基-若丹明110(bis-AAF-R110)一起培育30分钟以定量受损细胞的数目。接着,将相同球状体与特定卡斯蛋白酶3/7试剂一起培育以测量凋亡细胞的数目。实例10PneumaCult-ALI培养基和William'sE培养基的混合物的制备完全PneumaCult-ALI培养基通过将PneumaCult-ALI基础培养基(StemCellTechnologies,参考05002)与PneumaCult-ALI10X补充剂(StemCellTechnologies,参考05003)、PneumaCult-ALI维持补充剂(StemCellTechnologies,参考05006)、氢化可的松储备溶液(StemCellTechnologies,参考07925)和含0.2%肝素钠盐的PBS(StemCellTechnologies,参考37250)混合来制备。William's培养基(ThermoFisherScientific,参考12551032)补充有HepaRG维持和代谢补充剂(ThermoFisherScientific,参考HPRG720)和GlutaMAX溶液(ThermoFisherScientific,参考35050061),得到完全William'sE培养基。将完全PneumaCult-ALI培养基与完全William'sE培养基以变化百分比混合,得到在70/30到100/0%(v/v)完全PneumaCult-ALI培养基/完全William'sE培养基范围内的混合物。实例11完全B-ALI培养基与完全William'sE培养基的混合物如实例1中所概述来制备完全William'sE培养基。通过将B-ALIBulletKitTM(Lonza,参考193514)的成分组合来制备完全B-ALI培养基。将完全B-ALI培养基与完全William'sE培养基以在70%到100%B-ALI培养基范围内变化的百分比混合。将完全B-ALI培养基与完全William'sE培养基以变化百分比混合,得到在70/30到100/0%(v/v)完全PB-ALI培养基/完全William'sE培养基范围内的混合物。实例12测定不同培养基的作用在9天期间通过在37℃下在5%CO2和90%相对湿度下培养细胞来评估不同培养基和其稀释的作用。在9天期间评估不同培养基和其稀释的作用。首先使用补充有解冻、涂铺和通用补充剂(ThermoFisherScientific,参考HPRG770)和GlutaMAX溶液的William'sE培养基将HepaRG细胞接种到球状体微量培养板上。成熟1周后,将培养基更换成PneumaCult-ALI培养基或B-ALI分化培养基与补充有维持和代谢补充剂的William'sE培养基的混合物。在完全William'sE培养基中稀释的完全PneumaCult-ALI或B-ALI的百分比是70%、80%、90%和100%。9天后,球状体用于实验。将用培养基混合物获得的所有结果与仅仅用完全William'sE培养基维持的球状体相比。实例13测量总谷胱甘肽水平GSH/GSSG-Glo分析(Promega,Dübendorf,Switzerland)用于测定作为抗氧化能力的标记的总谷胱甘肽水平。在此分析中,将球状体与总谷胱甘肽缓冲液(GSH+GSSG)或氧化谷胱甘肽缓冲液(GSH)一起培育30分钟。在添加荧光素检测试剂后,用FLUOstarOmega板读取器测量发光。因为分析允许测量总GSH+GSSG和GSSG,所以能够推导出样品中的GSH量。实例14进行的一些实验的结果概括在表1中。实例15肝球状体的ATP含量发现当使用完全Pneumacult-ALI培养基或完全B-ALI培养基时在所有条件下ATP显著(P<0.05)增加。当球状体维持在100%完全Pneumacult-ALI培养基中时看到最高ATP含量,当使用70%、80%和90%完全Pneumacult-ALI培养基时ATP含量类似。与在完全Pneumacult-ALI培养基中培养的球状体相比,维持在完全B-ALI培养基中的球状体的ATP含量始终较低,并且维持在100%完全B-ALI培养基中的球状体获得最低值。实例16肝球状体的细胞色素P4501A1和细胞色素P450B1活性在完全William'sE培养基与完全B-ALI培养基的混合物中或在完全William'sE培养基与完全Pneumacult培养基的混合物中培养的被诱导的球状体中细胞色素P4501A1和细胞色素P450B1的活性显著(P<0.05)增加。在维持在100%完全B-ALITM培养基中的被诱导的球状体中,细胞色素P4501A1和细胞色素P450B1活性类似于在完全William'sE培养基中培养的球状体。在用70%和80%完全Pneumacult-ALI或完全B-ALITM培养基维持的样品中基础细胞色素P4501A1和细胞色素P450B1活性也显著(P<0.05)较高。实例17评估受损/坏死肝球状体的数目除70%完全Pneumacult-ALI条件以外,在所有条件下与完全William'sE培养基和完全Pneumacult-ALI培养基/完全B-ALI培养基混合物一起培育9天显著(P<0.005)增加受损/坏死细胞的数目。此外,增加量的完全Pneumacult-ALI培养基/完全B-ALI培养基使坏死细胞的数目增加。当使用完全B-ALI混合物时,与完全Pneumacult-ALI混合物相比(当比较混合物的类似%时),受损/坏死细胞的数目显著(P<0.05)较高。除标准条件以外,用含有70%完全Pneumacult-ALI的培养基混合物获得最低的坏死细胞数目。所有培养基混合物都显著增加凋亡细胞的数目(P<0.05),其中在完全William'sE培养基和完全Pneumacult-ALI培养基混合物中培养的球状体中见到最高数目。对于70%、80%和100%混合物(当比较类似%混合物)时,与完全William's培养基和完全Pneumacult-ALI培养基混合物相比,维持在完全William'sE和完全B-ALI培养基混合物中的球状体中的凋亡细胞的数目显著(P<0.05)较低。允许最低的凋亡细胞数目的条件是在100%B-ALI培养基下获得的。实例18肝球状体的谷胱甘肽(GSH)和氧化谷胱甘肽(GSSG)水平在完全William'sE培养基与完全Pneumacult-ALI培养基/完全B-ALI培养基的多种混合物中培养肝球状体9天,与完全William'sE培养基相比,在具有70%和80%完全Pneumacult-ALI培养基的培养物中GSH的水平显著(P<0.05)较高。更高量的完全Pneumacult-ALI培养基不会进一步增加GSH含量,反而降低其。类似地,与单独完全William'sE培养基相比,维持在与70%完全B-ALI培养基的混合物中的球状体中GSH水平显著(P<0.05)较高。如同完全Pneumacult-ALI培养基一样,GSH含量随着增加完全B-ALI培养基的量而减少,最终(在100%完全B-ALI培养基下)到达低于在William'sE培养基中培养的球状体中看到的值。还利用相同分析,测量GSSG含量。与100%完全William'sE培养基相比,维持在完全William'sE培养基与完全Pneumacult-ALI培养基/完全B-ALI培养基的混合物中的肝球状体中GSSG始终显著较高,这与使用的完全Pneumacult-ALI培养基/完全B-ALI培养基的类型或其浓度无关。虽然在完全William'sE培养基和完全B-ALI培养基混合物中培养的球状体中GSSG含量仅仅略高于维持在仅仅完全William'sE培养基中的球状体,但用完全William'sE培养基和完全Pneumacult-ALI培养基混合物维持的球状体中GSSG含量大大增加。实例19肝球状体的白蛋白分泌虽然用完全William'sE培养基维持的球状体的白蛋白分泌低于预期结果(预期:15-30皮克/天/细胞;获得:4皮克/天/细胞(Gunness等人,2013)),但测得在测试的所有培养基混合物下白蛋白的释放显著(P<0.05)增加。用70%、80%和90%完全William'sE和完全Pneumacult-ALI培养基/完全B-ALI培养基维持的球状体分泌的白蛋白在用完全Pneumacult-ALI维持的球状体下显著(P<0.05)高于完全B-ALITM培养基(当比较相同%时)。实例20基因表达在1周、2周、3周和4周评估3维器官型肺培养物中编码1期药物代谢酶的基因的表达的调控倍数。在用TCDD和利福平处理48小时的肺培养物(n=3)与未处理的培养物(n=3)之间比较基因表达,并且计算变化倍数。在TCDD和利福平存在下图7中示出的所有基因在第3周都上调。在TCDD和利福平存在下图7中示出的所有基因在第4周都下调。实例21用于产生肺球状体的板用于形成球状体的板被命名为球状体微量板(参考4520)。使用于制备球状体的细胞(HepaRG)解冻并立刻接种到这些板中。因为孔涂有超低粘附性表面,所以细胞不连接并且实际上聚集。一周后,细胞形成球状体,可以进一步用于实验。CYP诱导(代谢标记)、白蛋白分泌(代谢和健康标记)和ATP含量(健康标记)都增加,这意味着与来自InSphero的孔相比,这些孔中的球状体更健康。不受任何理论限制,这可能是因为球状体微量板中可以含有的培养基体积增加。与InSphero相比,使用板,αGST的分泌大大减少。CYP可诱导性多维持两周(InSpheroCYP可诱导性仅仅维持2周,而下其维持4周)。发现在头3周期间ATP含量高30%,并且在第4周高40%。白蛋白分泌在第2周(高10%)和第3周(20%)也更高,但其然后达到与InSphero板类似的值。对于αGST释放,在第4周(降低50%)和第5周(降低63%)看到巨大差异。实例22结果概述在本研究中,在4周时间期间,在健康、形态和代谢活性方面研究肺和肝的3维器官型培养物。结果表明:维持在空气-液体界面处的3维支气管培养物具有稳定的ATP含量,直到第3周,并且在测试期期间未展现出形态的改变。在4周时间期间其保留响应于刺激产生ATP的能力。另外,3维支气管培养物在第2周和第3周展现出较高的CYP1A1/B1活性,而在整个测试期中在诱导后若干(但非全部)编码代谢酶的基因的表达升高(参见图7)。尽管在测试期期间ATP含量以及CYP1A1和1A2可诱导性降低并且α-GST释放有最低程度的增加,HepaRG球状体仍然具有稳定的形态。出乎意料地,在第一周培养后白蛋白分泌快速减少。用完全William'sE培养基和完全Pneumacult-ALI培养基混合物维持球状体9天,与完全William'sE培养基条件相比,ATP含量、细胞色素P4501A1和细胞色素P450B1可诱导性以及分泌的白蛋白都有所改善。同时,坏死或凋亡细胞的数目和GSH/GSSG比率受混合物负面影响,这可能是氧化应激的结果。用完全William'sE培养基和完全B-ALI培养基混合物进行的测试还显示与完全William'sE培养基相比,ATP含量、细胞色素P4501A1和细胞色素P450B1可诱导性以及分泌的白蛋白有所增加。在本公开的某些实施例中,共培养物使用完全Pneumacult-ALI培养基是合适的。因为本公开的一个方面涉及具有互连的肺和肝组织的芯片上双器官系统,所以100%完全Pneumacult-ALI培养基的使用允许使用肺培养物,无需作任何进一步优化。因为肝球状体似乎可用100%完全Pneumacult-ALI培养基维持,所以其是适于在芯片上多器官系统中共培养的条件。在本文中引用的或描述的任何出版物都提供了在本申请的提交日期之前公开的有关信息。本文中的陈述不应解释为承认:发明人丧失先于这样的公开的资格。在上面的说明书中提及的所有出版物都通过引用并入本文。在不脱离本发明的范围和精神的情况下,本发明的各种修改和变化对于所属领域的技术人员来说将是显而易见的。尽管已结合特定优选实施例描述本发明,但应了解,如所要求的本发明不应过度限于这类特定实施例。实际上,细胞生物学和分子生物学或有关领域的技术人员显而易见的用于实现本发明的所描述模式的各种修改意图在以下权利要求书的范围内。表1在每一种培养基中获得的结果的比较。变化倍数表示为与单独William'sE培养基相比。70%P80%P90%P100%P70%B80%B90%B100%BCYP诱导2.92.52.32.12.12.41.91.0ATP含量2.62.72.92.72.12.42.11.5白蛋白2.53.12.63.32.02.11.81.9B=70%、80%、90%和100%(v/v)下的完全B-ALITM培养基。在70%、80%和90%(v/v)下,剩余体积用William'sE培养基补足到100%(v/v)。P=70%、80%、90%和100%(v/v)下的完全PneumaCult-ALI培养基。在70%、80%和90%(v/v)下,剩余体积用William'sE培养基补足到100%(v/v)。表2William'sE培养基的组成当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1