用于从全血中分离核酸的装置和方法与流程
用于使来自生物样品、特别地全血的核酸稳定化的组合物、方法和可用于所述方法的包含所述组合物的血液采集管的特征在于,实现了全血中的核酸、特别地rna的有效稳定化并且允许快速有效的分离方法(过程)。在此,稳定化包括全部核酸、特别地全部rna(包括无细胞血浆中所含的核酸、特别地rna,以及血液中存在的细胞所含的核酸、特别地rna)。
现有技术
wo02/056030a2描述了一种用于稳定化样品中的rna含量的容器,其具有预定的真空以抽吸预定的样品体积,其中在所述容器中提供用于抑制基因诱导和对抗核酸的酶促降解的试剂(mittel),特别地巯基乙醇、二硫苏糖醇(dtt)和离液盐(离液序列高的盐),特别地异硫氰酸胍或盐酸胍。
wo00/09746a1描述了一种血液采集容器,其包含用于裂解(lyse)细胞和稳定化核酸的溶液,该溶液具有胍盐、缓冲液、洗涤剂和还原剂,特别地dtt、β-巯基乙醇和tcep(三(2-羧基乙基)膦)。其中还原剂、特别地β-巯基乙醇或dtt被认为是对于稳定化血清中的rna是所必需的。
wo2009/018034a1涉及通过添加非离子型洗涤剂来提高sds在用于细胞的裂解缓冲液中的溶解度以及通过添加裂解缓冲液和随后添加十倍体积的提取缓冲液从动物组织中分离dna的方法,所述裂解缓冲液由以下组成:2mnacl、1.2%sds、12mmedta、24mmtris-hcl(三羟甲基氨基甲烷盐酸盐),ph8.0,含2%吐温(tween聚氧乙烯脱水山梨醇脂肪酸酯),所述提取缓冲液由以下组成:50mmtris-hcl、ph7、10mmedta、7m盐酸胍、5%吐温20。
wo2007/060248a1涉及用离液盐裂解细胞,即肝组织和随后添加非离液盐以将核酸结合到载体材料上。
de10147439a1描述了为了从血液中分离dna而加入裂解试剂,然后通过离心分离含dna的细胞组分。沉淀的dna通过用盐酸胍重新悬浮并除去杂质例如蛋白质来纯化并通过加入酒精而沉淀并分离。
de102014220090b3描述了用于收集含有核酸的生物样品的容器,可向其中引入咽拭子(abstrichtupfer),其中该容器包含裂解液。
cn104673623a根据针对带有盖子的样品容器的英文摘要描述了用于使血细胞核酸和无细胞dna稳定化的组合物。
发明目的
本发明的目的在于,提供用于使全血中的全部核酸稳定化并且之后从全血中分离的替代组合物和优选地替代方法。优选地,组合物应使全血中的rna稳定化并允许用于分离全部核酸、特别地rna的快速方法。更优选地,该组合物应允许对可变的血液体积(血容量、血量)进行核酸的稳定化,使得包含该组合物的血液采集管不必被配置成吸入预定的血液体积。
技术实现要素:
本发明利用权利要求的特征,特别地通过使全血中的全部核酸、特别地rna稳定化的组合物,和用于使全血中的全部核酸稳定化以便随后分离的方法来实现上述目的,所述方法同时用于细胞的分解(或称为解体或崩解(aufschluss)),使得当与所述组合物接触时,特别地在采血时,细胞核酸被释放并且可以在性质和浓度方面稳定地保存,然后被分离。在此,所述组合物的特征在于,它特别地防止在其被混入的全血中的rna的分解和重新合成。相应地,本发明涉及所述组合物,优选地包含在血液采集管中的组合物用于所述方法的用途,特别地用作用于稳定化和分离血液中全部rna的手段(试剂),而不需要在将rna吸附到吸附剂之前的沉淀和分离rna的步骤。为了进行分离,可以使血液和含水(水性)组合物的混合物在不沉淀rna的前提下与吸附剂接触。通过使含水组合物和血液的混合物与吸附剂接触而进行的rna的分离可直接地由含水组合物与血液的完全(充分)混合进行,即例如,在没有核酸从混合物中沉淀和分离的情况下进行,任选地在储存后进行,在所述储存期间将所述混合物例如从采血点运输到分析过程所在地。
生物样品优选地是液体并且任选地包含人或动物细胞。生物样品例如可为体液,例如脑脊液、尿液、痰液,含有单独或均质细胞的活体组织切片和特别地全血(也称为血液)。本说明书涉及全血作为生物样品的代表。
组合物以水溶液的形式具有或由以下组成:
至少一种胍盐,优选地硫氰酸胍;
至少一种缓冲剂物质,优选地2-(n-吗啉代)乙磺酸(mes);
非离子型洗涤剂,优选地tritonx-100;和
用于二价阳离子的络合剂,优选地乙二胺四乙酸(edta);
并且特别地不含还原剂,例如不含硫醇化合物或其前体化合物,特别地不含β-巯基乙醇和二硫苏糖醇(dtt)。
以水溶液的形式,所述组合物具有或由以下组成:
至少一种胍盐,例如达1.8至2.6m、优选地2.0至2.4m、更优选地2.2m;
至少一种缓冲剂物质,以将血液体积缓冲为5.0至8.0的ph值,例如ph5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9或6.0至7.5、7.6、7.7、7.8、7.9、优选地ph6.5至7.3的浓度,例如至少50mm、优选地至少70mm、例如最高达100mm或最高达74mm的mes;
非离子型洗涤剂,例如tritonx-100,达10至20%(重量/体积)、优选地12至18%(重量/体积);
例如500至100mm、优选地70至80mm、更优选地约72mm的用于二价阳离子的络合剂、特别地edta,
例如用于达到如下的血液体积与含水组合物的体积的比例:1:13或1:3或高达1:2、优选地高达1:2.6或高达1:2.5或1:2.4。
优选地,本发明涉及所述组合物如下的用途:用作用于生物样品、特别地全血中所包含的细胞的分解剂,用作用于生物样品的全部核酸的稳定剂并用于通过将核酸从生物样品与该组合物的混合物吸附到核酸吸附剂上来进行分离,其中所述组合物以水溶液的形式包含或由以下组成:
a.至少一种胍盐,
b.至少一种缓冲剂物质,其用于缓冲至ph5.0-8.0,
c.至少一种非离子型洗涤剂和
d.至少一种用于二价阳离子的络合剂并且是
e.不含还原剂的。
优选地,所述组合物由以下的水溶液组成:
a.至少一种胍盐,
b.至少一种缓冲剂物质,
c.至少一种非离子型洗涤剂和
d.至少一种络合剂
和任选地蛋白酶和/或dna酶。
所述组合物可用作用于全血中所包含的细胞的分解剂,并可用作用于其中所包含的全部核酸的稳定剂以及可用于通过将核酸直接从生物样品与该组合物的混合物吸附到用于核酸的吸附剂上来进行分离。
缓冲剂物质例如选自:三(三(羟甲基)氨基甲烷)、柠檬酸盐或二水合磷酸盐(磷酸氢二钠)或二水合磷酸盐(磷酸氢钠)、bistris-缓冲液(双(2-羟甲基)-亚氨基-三-(羟甲基)-甲烷)、aces(n-(2-乙酰氨基)-2-氨基甲磺酸)、碳酸氢钠、优选地2-(n-吗啉代)乙磺酸(mes)。
非离子型洗涤剂例如选自:吐温20(聚氧乙烯(20)脱水山梨糖醇单月桂酸酯)、nonidetp40(4-壬基苯酚-聚乙二醇)、吐温80(聚氧乙烯脱水山梨糖醇单油酸酯)、brij58(聚乙二醇十六烷基醚)、tritonx-114(辛基苯酚聚乙二醇醚)、优选地tritonx-100(聚乙二醇-对-(1,1,3,3-四甲基丁基)苯基醚)。
所述组合物具有如下优点:使包含在全血中的人体细胞分解并且使来自全血的全部核酸、特别地rna稳定化,其中全血和组合物可以可变的体积比存在。因此,包含该组合物的血液采集管可被配置成吸入可变的血液体积,例如可将血液采集管配置成吸入达到1:13或1:3、优选地高达1:2或高达1:2.6的与所述组合物的体积比的血液。为了吸入可变的血液体积,含有所述组合物的血液采集管可具有例如活塞,该活塞可从管中手动取出。
所述组合物的特征在于,它不需要从全血和组合物的混合物中沉淀核酸来稳定化和分离全血中的核酸、特别地rna。因此,根据本发明的方法优选地包括从全血和组合物的混合物中分离核酸、特别地rna,而无需沉淀核酸、特别地rna的步骤,或无需如下的离心步骤,该离心步骤用于在将核酸、特别地rna结合至吸附剂之前分离沉淀的核酸。
根据本发明,优选地从全血和组合物的混合物中如下分离出全部rna:
任选地在加入蛋白酶例如蛋白酶k并例如在室温下孵育约15分钟后,任选地在将加入蛋白酶之前或之后加入dna酶(dnase),使全血和组合物的混合物与用于核酸的吸附剂接触,
其中在与吸附剂接触之前没有成分从所述混合物(任选地包括添加的蛋白酶和/或dna酶)中分离,
然后除去未结合在吸附剂上的物质,例如通过洗涤吸附剂来除去,
并洗脱结合在吸附剂上的核酸,例如通过使吸附剂与含水缓冲液接触来洗脱,所述含水缓冲液具有一定的ph值、一定的醇含量和/或使结合在吸附剂上的核酸溶解的离子浓度。
全血和组合物的混合物可完全地并且在时间上直接在制备该混合物后与用于核酸的吸附剂接触。这导致的优点是,用于分离核酸、特别地rna的方法在使混合物与吸附剂接触之前不要求进行用于沉淀的孵育并且不要求进行离心,以及不需要添加另外的物质并因此能容易且快速地进行。
在接触由全血和组合物构成的混合物(任选地包含添加的蛋白酶)之后,可任选地加入dna酶以消化dna并基本分离rna。
用于核酸的吸附剂例如为二氧化硅表面、特别地二氧化硅(凝胶)膜、二氧化硅(凝胶)悬浮液或二氧化硅涂覆的磁性颗粒,其能够例如以如下名称获得,用于分离核酸:preanalytix公司的paxgene、macherey-nagel公司的nucleospin、roche公司的用于血液/骨髓的mrna分离试剂盒(mrnaisolationkitforblood/bonemarrow)或高纯度病毒核酸大容量试剂盒(highpureviralnucleicacidlargevolumekit)。
当吸附剂由二氧化硅涂覆的颗粒、优选地磁性颗粒组成时,优选地向全血和组合物的混合物中加入有效体积的稀释剂。所述稀释剂可为例如从roche公司获得的用于血液/骨髓的dna/rna稳定化试剂(roche产品编号11934317001)或根据本发明的组合物,在各自的情况下任选地具有最高达30体积/体积%的乙醇含量、优选地10至30体积/体积%的乙醇含量,例如20体积/体积%的乙醇含量。可如此确定有效体积,其中rna基本上达总量的至少80%被吸附至二氧化硅涂覆的颗粒,优选地基本上完全被吸附至二氧化硅涂覆的颗粒。将稀释剂加入到全血和组合物的混合物中的有效体积优选地为在将二氧化硅涂覆的颗粒(其优选地为磁性颗粒)混合到混合物中之前或之后添加的混合物体积的50至150%,例如80至120%,优选地100%。特别地,在该实施方式中,优选地向混合物添加蛋白酶。
二氧化硅涂覆的颗粒可为例如chemagen公司或appliedbiosystems公司的那些(rna结合珠,产品编号100191)或roche公司的用于血液/骨髓的mrna分离试剂盒(产品编号11934333001)或根据hain.h.,phun.d.,luongn.h.,chaun.,chinhh.d.,hoangl.h.,leslie-peleckyd.l.(2008),mechanismforsustainablemagneticnanoparticlesunderambientconditions,journalofthekoreanphysicalsociety,52(5),1327-1331的那些、或根据quyd.v.,hieun.m.,trap.t.,namn.h.,hain.h.,sonn.t.,nghiap.t.,anhn.t.v.,hongt.t.,luongn.h.(2013)synthesisofsilica-coatedmagneticnanoparticlesandapplicationinthedetectionofpathogenicviruses,journalofnanomaterials,doi:10.1155/2013/603940的那些。
即使对于由二氧化硅涂覆的颗粒(其优选地为二氧化硅涂覆的磁性颗粒)组成的吸附剂,也可使由全血和组合物组成的完全
根据本发明,完全混合物可直接与吸附剂接触,因为没有成分或级分从全血和组合物的混合物中分离出来,特别地,不要求离心这种混合物以分离出沉淀的成分,例如,不需要进行离心分离出沉淀的核酸以及随后分离液相并溶解核酸。这目前归因于,该组合物不会与全血在混合(混合物)中沉淀出核酸、特别地rna。相反,该组合物具有如下优点:全血和组合物的混合物(任选地添加有蛋白酶和/或dna酶)可在没有进一步的处理步骤或没有添加剂的情况下与用于核酸的吸附剂、特别地二氧化硅表面接触以使核酸结合在吸附剂上。因此,该组合物允许一种用于分离核酸的方法,该方法在与吸附剂接触之前在无需分离含核酸的级分(例如不通过离心来沉淀以及随后溶解)的情况下进行。
该组合物稳定化全血和组合物的混合物中的核酸、特别地rna,例如在储存至少3天、优选地至少5天、例如最高达4天,特别地没有冷冻,例如在至少0℃下储存、例如在室温至22.5℃下储存的情况下。因此,该方法优选地包括从混合物中分离核酸、特别地rna,例如在无冷冻的情况下储存之后或在至少0℃、例如在15至25℃、特别地在最高达22.5℃下储存之后。可替代地或另外地,可将混合物冷冻储存,例如在-40℃或以下。
现在将参考附图通过实施例更详细地描述本发明,附图示出了:
-图1从以各种体积比与本发明的组合物混合的全血中分离的rna的完整性,
-图2从以各种体积比与本发明的组合物混合的全血中分离的rna浓度,
-图3和4将根据wo00/09746在稳定剂中储存后的全血样品与在根据本发明的组合物中储存的情况下的全血样品(sp.1(1号供体)和sp.2(2号供体))的rna完整性进行比较,
-图5从与本发明的组合物混合的全血中分离的全部rna中的各种mrna的浓度的聚类分析,
-图6用于表示存储依赖性的表达差异的相关矩阵,
-图7和8示出了通过rt-pcr确定的在两个供体样品中的mrna的相对量,所述mrna是从与本发明的组合物混合的存储了5天后的全血中分离出来的。
本发明的组合物以血液采集管中的水溶液的形式存在,血液样品被吸入到所述血液采集管内。血液采集管可直接用于采血。可替代地,可将组合物与全血(其优选地来自之前直接采集的全血样品)混合。通常通过将全血样品与组合物混合来进行血液样品的细胞的分解(或称为分解、崩解)和核酸、特别地rna的稳定化。
实施例1:全血的rna的分离
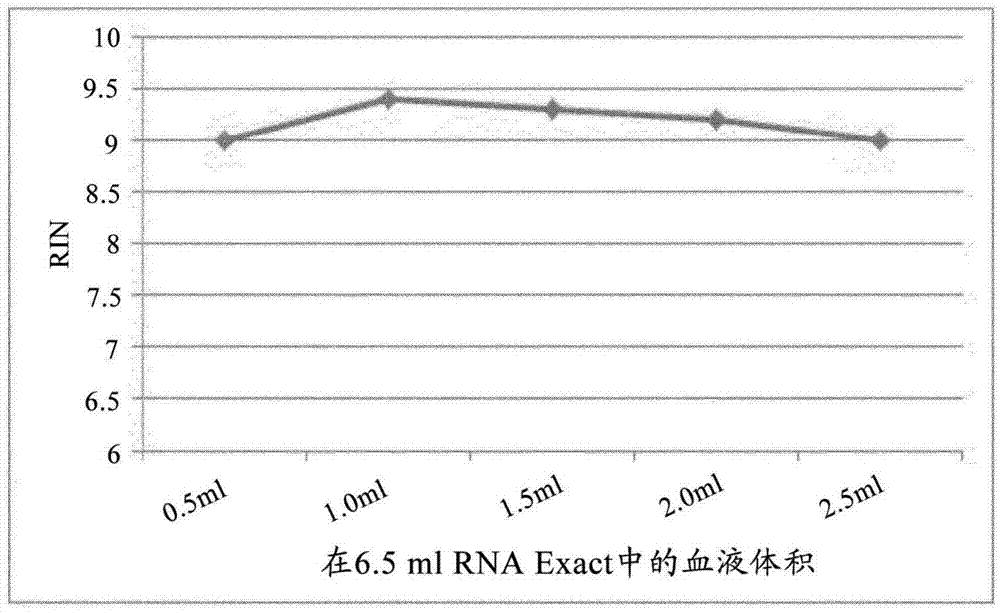
作为本发明的组合物,使用了由以下组成的水溶液:在水中的2.2m硫氰酸胍、72mmmes、14.4%(重量/体积)tritonx-100和72mmedta。使6.5ml该组合物容纳在常规的血液采集管中,刚刚采集的血液被抽取到该血液采集管中,所述血液未经进一步处理且不含添加剂。将该全血分别以0.5ml、1.0ml、1.5ml、2.0ml和2.5ml的体积抽取到血液采集管中。通过抽吸血液体积,任选地另外通过摇动,特别地在抽掉(einziehen)气泡之后进行混合。
向组合物和全血的混合物添加蛋白酶k(250μl,18μg/ml)。将混合物在室温下孵育约15分钟。随后,使混合物完全通过带有用于核酸的吸附剂的柱(highpureviralnucleicacidlargevolumekit,购自roche)。根据制造商的说明用洗涤缓冲液洗涤吸附剂,然后用100μl洗脱缓冲液洗脱结合的核酸。
通过rna纳米芯片系统(agilenttechnologies,usa)中的电泳评估洗脱的rna的品质,使用agilent2100生物分析仪进行检测,其中所谓的rin(rna完整性数(rnaintegritynumber))(在分析中使用bioanalyzer2100测定)作为rna完整性的量度被给出。图1示出了对全血与组合物(rnaexact)的不同体积比的分析结果:rna完整性不依赖于体积比,或者对于与全血的不同体积比,所述组合物可使相同品质的rna稳定化,并且可从混合物中分离出rna。
图2示出了针对不同的体积比被分离出来的洗脱液中的测量到的rna浓度。结果显示,通过使在100μl洗脱液中的rna浓度与血液体积成比例地增加,对于不同的体积比,组合物rna(exact)使rna以相同的程度稳定,并且将其从中以相同的程度分离出来。这表明,该组合物适合于裂解全血中的细胞和以不同体积比稳定化全血中的核酸。
实施例2:根据本发明的组合物与对比溶液的稳定化能力的比较
作为根据本发明的组合物(rnaexact),在各自的情况下使用实施例1的组合物6.5ml并与2.5ml之前直接抽取的不含另外的添加剂的血液混合以制备组合物和全血的混合物。为了进行比较,使用了如下的溶液(对比物,对应于wo00/09746a1):其由在水中的4.0m硫氰酸胍、45mmtris/hcl、18.0%(重量/体积)tritonx-100和0.8%(重量/体积)dtt组成并被调节至6.0的ph值。2.5ml的对比溶液(如在wo00/09746a1中所描述的(比例1+1))与同样2.5ml的之前直接抽取的血液样品混合。将混合物在22.5℃下储存并用macherey-nagel公司的nucleospinrnabloodmidikit将rna从混合物中分离出来。在对比溶液中,如macherey-nagel的使用规范中所提供的,加入1/3体积的70%乙醇。对于具有根据本发明的组合物的混合物,这不是必需的。图3和图4示出了bioanalyzer2100中rna纳米芯片上的洗脱液的毛细管电泳分离结果。甚至在3天后和5天后也可以从具有根据本发明的组合物的样品混合物中分离具有高完整性的rna,而在使用对比溶液的情况下,仅在第0天,即直接地在与血液混合后,这才是可能的。
实施例3:全血中的rna的稳定化和分离
作为本发明的组合物,使用各6.5ml的实施例1的组合物并与2.5ml的在之前直接采集的血液(其不含另外的添加剂)混合以制备组合物和全血的混合物。为了进行比较,将血液吸入含有用于抑制凝结的edta的血液采集管中(s-monovettesedta-k3,可从sarstedt公司获得)。所述血液分别来自三个不同的供体。
将根据本发明的混合物和对比样品在22.5℃下孵育,其中立即地(t0,第0天)、在孵育1天(t1)和孵育3天(t3)后取出等分试样。从取出的等分试样中直接地并且立即地分离核酸,如实施例1中所述。
用dna酶(thermofisherscientific,产品编号en0521)处理洗脱的核酸以移除dna,并通过微阵列分析测定约47,000个转录物(mrna)的浓度(agilent公司的humanht-12v4.0expressionbeadchip)。在评估中,对于相同的rna总量,转录物数量的差异首先显示超过2倍。因此,在图5中,矩阵中的相等亮度显示相当数量的转录物。图5示出了三个样品组的转录物数量:stabil(稳定)(根据本发明的组合物)、unbeh(仅与edta混合)和t0(不含添加剂,在血液采集后立即分离),分别针对在指定时间点的供体1,2和3的样品。
图5中分析的等分试样为:
其中edta-对比样品被标记为“k”。
对199个示例性选择的转录物的聚类分析(示于图5中)清楚地表明,对于供体在孵育的不同时间点的与根据本发明的组合物混合的血液样品(stabil)各自显示相当的转录物模式,而仅加入edta的对比样品(unbeh)在不同的孵育时间点在每个供体内显示出很大的差异,这表明转录物数量随时间和相对于t0的变化。
对于仅加入edta的血液样品,在第3天相对于第0天对于768个转录物发现了浓度差异,而掺入本发明组合物的样品,在每个供体内,发现在稍后的时间点分析的样品的个体rna与t0相比在浓度上差异很小至没有差异(参见图6的相关矩阵,对比样品=k,在各个时间点为kt0、kt1、kt3,具有本发明的组合物t0、t1、t3)。
该结果显示,依据血液样品的与组合物混合的等分试样中的在3天的时间内的单个供体的转录物的恒定数量,本发明的组合物在孵育期间使来自全血的各个rna分子稳定,并且组合物例如与edta对比样品相比显着降低了mrna的变性和/或诱导。
实施例4:基于来自全血的rna的逆转录和pcr
将分别达2.5ml的来自两个不同供体的全血在采集后直接与6.5ml的本发明的组合物混合并在22.5℃下孵育,所述组合物由在水中的2.2m硫氰酸胍、72mmmes、14.4%(重量/体积)tritonx-100和72mmedta组成。立即(t0)和在3天(t3)后、在4天(t4)后和在5天(t5)后从这些混合物中取出等分试样并在-80℃下冷冻。随后,将所有样品平行解冻并置于核酸吸附剂(nucleospinrnablood,macherey-nagel)上。根据制造商的说明洗涤吸附剂并洗脱核酸。将dna酶(dnasei,无rna酶,产品编号en0521,thermofisherscientific)加入洗脱液中。用“firststrandcdnasynthesiskit”(产品编号k1612,thermofisherscientific)逆转录rna以获得cdna。使用maximasybrgreengreen/roxqpcrmastermix(产品编号nr.#k0222,thermofisherscientific)作为复制物(doppelansatz)、通过实时pcr,用对β-肌动蛋白、gapdh、il-8、c-fos、il-1b和tnf-α基因的核苷酸序列具有特异性的引物对该产物进行扩增并定量。
为了进行评价,将对于β-肌动蛋白和gapdh的cdna获得的ct值用作内部标准,然后将对于il-8、c-fos、il-1b和tnf-α测量的ct值标准化至该内部标准。另外,使il-8、c-fos、il-1b和tnf-α的cdna在t3、t4和t5处的这些相对浓度与它们各自在t0处的浓度相关。这些结果称为ddct,并且图7示出了一个供体的血液,图8示出了另一个供体的血液。这两个样品的结果都表明了,本发明的组合物在22.5℃的孵育期内稳定地保持全血中特异性检测的细胞mrna的相对浓度。
- 还没有人留言评论。精彩留言会获得点赞!