示出葡萄糖依赖性线粒体呼吸和双相胰岛素分泌响应的人多能干细胞衍生的功能性β细胞的产生的制作方法
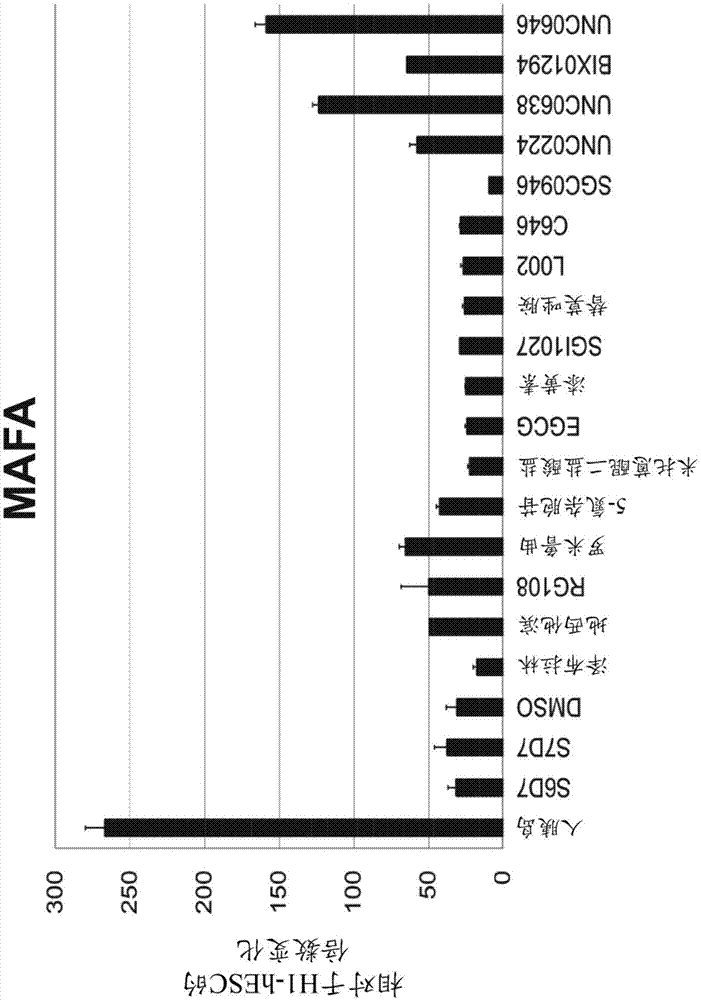
本申请要求美国临时申请62/352,968(2016年6月21日提交)的优先权,该美国临时申请全文以引用方式并入本文。本发明涉及由多能干细胞的分化所致的产生体外功能性胰腺β细胞和群体的方法。具体地,本发明涉及表现出线粒体呼吸/活性响应以及双相胰岛素分泌响应的β细胞或β细胞群。
背景技术:
:用于ⅰ型糖尿病的细胞替代疗法的进展以及可移植胰岛的缺乏已使得人们把注意力集中在开发适于移植的胰岛素分泌细胞或β细胞的来源上。一种方法是由多能干细胞诸如胚胎干细胞或诱导的多能细胞生成功能性β细胞。在脊椎动物胚胎发育中,多能细胞可在被称为原肠胚形成的过程中产生包括三个胚层(外胚层、中胚层和内胚层)的细胞群。组织(诸如甲状腺、胸腺、胰腺、肠和肝脏)将从内胚层经由中间阶段发育而来。d’amour等人描述了在高浓度激活蛋白和低血清的存在下产生人胚胎干细胞衍生的定形内胚层的富集培养物(naturebiotechnology2005,23:1534-1541;美国专利7,704,738)。将这些细胞移植在小鼠的肾包膜下导致分化成具有内胚层组织特征的更成熟的细胞(美国专利7,704,738)。在添加fgf-10和视黄酸后,这些衍生自人胚胎干细胞的定形内胚层细胞还可进一步分化成pdx1阳性细胞(美国专利申请公布2005/0266554)。这些胰腺前体细胞在免疫缺陷小鼠的脂肪垫中的后续移植导致在3-4个月成熟期后形成功能胰腺内分泌细胞(美国专利7,534,608和7,993,920)。一直以来,使用小分子抑制剂来诱导胰腺内分泌前体细胞。例如,tgf-β受体和bmp受体的小分子抑制剂(development2011,138:861-871;diabetes2011,60:239-247)已用于提高胰腺内分泌细胞的数目。另外,小分子活化剂也已用于生成定形内胚层细胞或胰腺内胚层细胞(curr.opin.cellbiol.2009,21:727-732;naturechem.biol.2009,5:258-265)。一般来讲,祖细胞分化成功能性β细胞的过程经历多个阶段,并且对从祖细胞诸如人多能干细胞生成胰腺细胞的方案的改善已经取得了进展。虽然有这些研究进展,但是祖细胞分化过程中的每一步骤均提出独特的挑战。因此,为了产生功能性胰腺内分泌细胞,并且具体地,功能性β细胞的目的,仍存在对于进一步分化方案发展的需要。具体地,希望提供体外产生功能性β细胞中所观察到的有迅速调节葡萄糖刺激的胰岛素分泌(“gsis”)能力的葡萄糖响应型胰岛素生成细胞。具体地,希望提供一种产生如下体外功能性β细胞的方法:表现出线粒体呼吸/活性提高,之后胰岛素分泌的第一时相和第二时相。gsis从葡萄糖经由葡萄糖转运蛋白(溶质载体家族2,成员1;slc2a1;或通常称为葡萄糖转运蛋白1;glut1,用于人β细胞)转运到β细胞中开始,并且葡萄糖经过称为糖酵解的过程代谢为丙酮酸。丙酮酸转运到线粒体中,其通过tca(三羧酸)代谢并后续激活电子传递链(“etc”并且此处称为“线粒体活性”或“线粒体呼吸”)循环而与胰岛素胞吐密切偶联,以确保迅速和恰当量的胰岛素释放。胰岛内的功能性β细胞显示在葡萄糖浓度突然增大时以两个连续相分泌胰岛素(henquin等人diabetologia(2009)52(5):739-751)。双相的幅度和持续时间受细胞内ca2+信号或加性分泌偶联因子的动力学调节。第一时相(1st)胰岛素分泌表示结合和可易于释放的胰岛素颗粒的较小库胞吐。第二时相(2nd)胰岛素分泌(幅度较低但持续时间较长)表示颗粒从颗粒储备库转移,并且它们锚定/引发以释放。双相gsis,即β细胞成熟的关键标记在人发育的产后阶段前检测不到,并且这不同于在不成熟β细胞中所见的单相gsis(otonkoski等人diabetes(1988)37:286-291)。在2型糖尿病中,gsis的第1时相不存在;并且gsis的第2时相也有所下降。已报道β细胞数目经自体免疫攻击而急剧下降的1型糖尿病不含稳健的双相gsis(krogvold等人diabetes(2015)64:2506-2512)。技术实现要素:如所体现和充分描述的那样,本发明提供了由多能干细胞分化所致的产生体外功能性β细胞(功能性胰腺β细胞)和细胞群的方法。具体地,本发明涉及产生表现出线粒体呼吸/活性响应以及双相胰岛素分泌响应的功能性胰腺β细胞(产胰岛素细胞)或功能性β细胞群。本发明的一个方面是使多能干细胞分化成功能性β细胞的方法。本发明的一个特定方面是使胰腺内胚层细胞分化成表达pdx1、nkx6.1、mafa、ucn3和slc2a1的功能性β细胞的方法。在实施方案中,该方法包括在补充有unc0638、unc0642、ucn0646、tc-e5003、a366、pf03814735、zm447439、sb747651a、pfi1、ly303511、ms436、azt、deza、吡咯沙敏、ci9994或mc1568中的一种或多种小分子的培养基中培养胰腺内分泌细胞。本发明的一个实施方案是通过体外分化胰腺内分泌细胞获得的表达单激素胰岛素、pdx1、nkx6.1和mafa的功能性胰腺β细胞的体外群体。在一些实施方案中,功能性β细胞的群体也共表达ucn3和slc2a1。在实施方案中,mafa表达相比于不成熟β细胞是提高的。在实施方案中,功能性β细胞的体外群体通过在补充有unc0638、unc0642、ucn0646、tc-e5003、a366、pf03814735、zm447439、sb747651a、pfi1、ly303511、ms436、azt、deza、吡咯沙敏、ci9994或mc1568中的一种或多种小分子的培养基中培养胰腺内分泌细胞获得。在本发明的另一个实施方案是使多能干细胞分化成表达pdx1、nkx6.1、mafa、ucn3和slc2a的功能性β细胞的方法,该方法包括以下步骤:使多能干细胞分化成胰腺内分泌细胞;并且使胰腺内分泌细胞分化成表达pdx1、nkx6.1、mafa、ucn3和slc2a1的功能性β细胞。在实施方案中,mafa表达相比于不成熟β细胞是提高的。在一些实施方案中,该方法包括在补充有unc0638、unc0642、ucn0646、tc-e5003、a366、pf03814735、zm447439、sb747651a、pfi1、ly303511、ms436、azt、deza、吡咯沙敏、ci9994或mc1568中的一种或多种小分子的培养基中培养胰腺内分泌细胞。在上述每个实施方案中,培养基还补充有zm447439、肝素、n-乙酰半胱氨酸、以及制剂i中的一种或多种。在以上实施方案中,培养基还补充有t3、t4及其类似物中的一种或多种。在以上实施方案中,培养基补充有alk5抑制剂。在以上一些实施方案中,培养基不含alk5抑制剂。在以上本发明的实施方案中,培养基补充有azt或deza。在以上一些实施方案中,培养基补充有azt和deza两者。在上述本发明的实施方案中,培养基还补充有γ分泌酶抑制剂。在以上一些实施方案中,培养基补充有t3。在一些实施方案中,t3在1nm至1μm的范围内。在特定实施方案中,t3在1nm至100nm的范围内。此外,在上述本发明的实施方案中,功能性β细胞通过对选自以下的一种或多种细胞进行分步分化获得:表达定形内胚层的特征性标记物的细胞;表达原肠管细胞的特征性标记物的细胞;表达前肠内胚层细胞的特征性标记物的细胞;表达胰腺内胚层细胞的特征性标记物的细胞;胰腺内分泌前体细胞;以及表达不成熟β细胞的特征性标记物的细胞(胰腺内分泌细胞)。在上述每个实施方案中,该方法包括在空气-液体界面处培养所述细胞。在上述一些实施方案中,该方法包括培养悬浮液中的细胞,例如悬浮液中的细胞簇。在以上实施方案中,相比于不成熟β细胞,经分化功能性β细胞以更高的水平表达mafa。在一些实施方案中,相比于不成熟β细胞,经分化功能性β细胞以更高的水平表达ucn3。在以上一些实施方案中,mafa和ucn3的表达相比于不成熟β细胞的表达有所提高。在以上本发明的实施方案中,功能性β细胞群表现出葡萄糖刺激的胰岛素分泌和葡萄糖依赖性线粒体呼吸。在上述实施方案中,葡萄糖刺激的胰岛素分泌和葡萄糖依赖性线粒体呼吸与人胰岛细胞的类似。在上述本发明的实施方案中,功能性β细胞以多相分泌胰岛素。在上述实施方案中,葡萄糖依赖性线粒体呼吸在葡萄糖刺激后具有基础耗氧率以上约20%至约80%范围内的最大耗氧率响应。在一些实施方案中,耗氧率响应发生于葡萄糖刺激后的至少15分钟。在以上实施方案中,葡萄糖刺激的胰岛素分泌包括响应于葡萄糖刺激的快速双相胰岛素分泌。在实施方案中,双相胰岛素分泌的第一时相具有相比于基线分泌的至少四倍增加到至少八倍增加,并且双相胰岛素分泌的第二时相具有相比于基线分泌的至少两倍到至少四倍增加。在一些实施方案中,胰岛素分泌发生于葡萄糖刺激后的至少五分钟到至少十分钟。在一些实施方案中,使多能干细胞分化的方法包括以下步骤:使多能干细胞分化成表达定形内胚层的特征性标记物的细胞(“第1阶段细胞”);使第1阶段细胞分化成表达原肠管细胞的特征性标记物的细胞(“第2阶段细胞”);使第2阶段细胞分化成表达前肠内胚层细胞的特征性标记物的细胞(“第3阶段细胞”);使第3阶段细胞分化成表达胰腺内胚层细胞的特征性标记物的细胞(“第4阶段细胞”);使第4阶段细胞分化成胰腺内胚层/内分泌前体细胞(表达胰腺内胚层细胞和胰腺内分泌前体细胞中的一者或两者的特征性标记物的细胞;“第5阶段”);使第5阶段细胞分化成不成熟β细胞(胰腺内分泌细胞;“第6阶段”);以及使第6阶段细胞分化成功能性β细胞(胰腺内分泌细胞;“第7阶段”)。在一些实施方案中,分化的方法包括通过在补充有mcx化合物和gdf-8的培养基中培养多能干细胞,使多能干细胞分化成第1阶段细胞。在一些实施方案中,该方法包括通过在补充有fgf7和抗坏血酸的培养基中培养第1阶段细胞,使第1阶段细胞分化成第2阶段细胞。在一些实施方案中,该方法包括通过在补充有fgf7、视黄酸、sant-1、pkc活化剂、bmp抑制剂和抗坏血酸的培养基中培养第2阶段细胞,使第2阶段细胞分化成第3阶段细胞。在一些实施方案中,该方法包括通过在补充有fgf7、视黄酸、sant-1、pkc活化剂、bmp抑制剂和抗坏血酸的培养基中培养第3阶段细胞,使第3阶段细胞分化成第4阶段细胞。在一些实施方案中,该方法包括通过在补充有sant-1、pkc活化剂、bmp抑制剂、抗坏血酸的培养基中培养第4阶段细胞,使第4阶段细胞分化成第5阶段细胞。在一些实施方案中,培养基还补充有t3、t4或其类似物中的一种或多种。在一些实施方案中,培养基还补充有alk5抑制剂。在一些实施方案中,该方法包括通过在补充有bmp抑制剂,抗坏血酸,t3、t4或其类似物中的一种或多种的培养基中培养第5阶段细胞,使第5阶段细胞培养成胰腺内分泌细胞。在一些实施方案中,培养基补充有t3。在一些实施方案中,t3在1nm至1μm的范围内。在某些实施方案中,t3在1nm至100nm的范围内。在一些实施方案中,培养基还补充有alk5抑制剂。在其它实施方案中,培养基不补充alk5抑制剂。在一些实施方案中,培养基还补充有γ分泌酶抑制剂。在某些实施方案中,培养基补充有zm447439、肝素、n-乙酰半胱氨酸、以及制剂i中的一种或多种。在一些实施方案中,培养基补充有azt或deza。在一些实施方案中,培养基补充有azt和deza两者。在实施方案中,该方法包括在空气-液体界面处培养所述细胞。在一些实施方案中,该方法包括培养悬浮液中的细胞,例如悬浮液中的细胞簇。在上述分化方法的每个实施方案中,胰腺内胚层细胞(“第4阶段细胞”)可为冷冻保存的。在一些实施方案中,使胰腺内胚层细胞分化成胰腺内分泌前体细胞的方法包括培养冷冻保存的细胞。在上述每个实施方案中,多能干细胞可为人多能干细胞,诸如人胚胎干细胞。在一个实施方案中,多能干细胞可为人h1或h9细胞。本发明的另一个实施方案是使多能干细胞分化成表达pdx1、nkx6.1、mafa、ucn3和slc2a的功能性β细胞的方法,该方法包括:(a)使多能干细胞分化成表达定形内胚层的特征性标记物的细胞,该表达定形内胚层的特征性标记物的细胞通过在补充有活化素a和wnt3a的培养基中培养多能干细胞获得;(b)使表达定形内胚层的特征性标记物的细胞分化成不成熟β细胞;以及(c)通过在补充有unc0638、unc0642、ucn0646、tc-e5003、a366、pf03814735、zm447439、sb747651a、pfi1、ly303511、ms436、azt、deza、吡咯沙敏、ci9994或mc1568中的一种或多种的培养基中培养不成熟β细胞,使不成熟β细胞分化成表达pdx1、nkx6.1、mafa、ucn3和slc2a1的功能性β细胞。该方法中所用的多能干细胞可为人多能干细胞,诸如人胚胎干细胞。在一个实施方案中,多能干细胞是人cyt49细胞。这些功能性β细胞可具有类似于人胰岛细胞的葡萄糖依赖性线粒体呼吸或葡萄糖刺激的胰岛素分泌。功能性β细胞也可以以多相分泌胰岛素。在该方法的某些实施方案中,培养基不含alk5抑制剂。在一些实施方案中,培养基还补充有肝素、n-乙酰半胱氨酸、制剂i、以及t3、t4或其类似物中的一种或多种。在其它实施方案中,培养基补充有t3。在另选的实施方案中,培养基补充有zm447439、肝素、n-乙酰半胱氨酸、以及t3、t4或其类似物中的一种或多种,并且不包含alk5抑制剂。培养基可补充有t3、azt或deza。该方法可包括在空气-液体界面处、悬浮簇中、滚瓶中或微载体上培养不成熟β细胞。在一个实施方案中,该方法包括在滚瓶中培养不成熟β细胞。在另一个实施方案中,该方法包括在滚瓶中的微载体上培养不成熟β细胞。该方法中的使多能干细胞分化成不成熟β细胞可包括:(a)通过在补充有活化素a和wnt3a的培养基中培养多能干细胞,使多能干细胞分化成表达定形内胚层的特征性标记物的细胞(“第1阶段细胞”);(b)使第1阶段细胞分化成表达原肠管细胞的特征性标记物的细胞(“第2阶段细胞”);(c)使第2阶段细胞分化成表达前肠内胚层细胞的特征性标记物的细胞(“第3阶段细胞”);(d)使第3阶段细胞分化成表达胰腺内胚层细胞的特征性标记物的细胞(“第4阶段细胞”);(e)使第4阶段细胞分化成胰腺内分泌前体细胞(“第5阶段”);以及(f)使第5阶段细胞分化成不成熟β细胞。在某些实施方案中,步骤e.和f.包括在空气-液体界面处、悬浮簇中、滚瓶中或微载体上培养。在其它实施方案中,步骤e.和f.包括在滚瓶中培养细胞。在其它实施方案中,步骤e.和f.包括在滚瓶中的微载体上培养不成熟β细胞。在某些实施方案中,该方法包括通过在补充有fgf7和抗坏血酸的培养基中培养第1阶段细胞,使第1阶段细胞分化成第2阶段细胞。在其它实施方案中,该方法还包括通过在补充有fgf7、视黄酸、sant-1、pkc活化剂和抗坏血酸的培养基中培养第2阶段细胞,使第2阶段细胞分化成第3阶段细胞。在某些实施方案中,培养基不含bmp抑制剂。在另一个实施方案中,该方法包括通过在补充有fgf7、视黄酸、sant-1、pkc活化剂和抗坏血酸的培养基中培养第3阶段细胞,使第3阶段细胞分化成第4阶段细胞。同样,在某些实施方案中,培养基不含bmp抑制剂。在另一个实施方案中,该方法包括通过在补充有sant-1、pkc活化剂、bmp抑制剂和抗坏血酸的培养基中培养第4阶段细胞,使第4阶段细胞分化成第5阶段细胞。培养基还可补充有t3、t4或其类似物中的一种或多种。在一个另选的实施方案中,该方法包括通过在补充有bmp抑制剂,抗坏血酸,t3、t4或其类似物中的一种或多种的培养基中培养第5阶段细胞,使第5阶段细胞培养成不成熟β细胞。培养基还可补充有alk5抑制剂或γ分泌酶抑制剂。该方法还可包括通过在不含alk5抑制剂并补充有zm447439、azt、n-乙酰半胱氨酸、deza、制剂i、以及t3、t4或其类似物中的一种或多种的培养基中培养不成熟β细胞,使不成熟β细胞分化成表达pdx1、nkx6.1、mafa、ucn3和slc2a的功能性β细胞。在上述分化的方法的每个实施方案中,培养基可为悬浮培养物或细胞聚集体悬浮培养物。在某些实施方案中,培养可在滚瓶中、微载体上或者滚瓶中的微载体上实施。附图说明图1a-1h示出对于上调第7阶段的mafa或ucn3表达的小分子筛选的结果。图1a至1d表明相比于s6d7、或第7阶段未经处理的或经dmso处理的培养物,用以下项处理之后mafa的第7阶段表达显著地上调:unc0638(选择性g9a和glp组蛋白赖氨酸甲基转移酶抑制剂)、unc0646(有效和选择性g9a/glp抑制剂)、unc0642(有效和选择性g9a和glp组蛋白赖氨酸甲基转移酶抑制剂)、tc-e5003(选择性prmt1精氨酸甲基转移酶抑制剂)、a366(有效和选择性g9a/glp组蛋白赖氨酸甲基转移酶抑制剂)、pf03814735(极光激酶a和b抑制剂)、zm447439(抑制极光激酶b)、sb747651a二盐酸盐(有效msk1抑制剂;还抑制其它agc组激酶)、pfi1(bet溴结构域抑制剂)、ly303511(brd2、brd3和brd4抑制剂)、ms436(有效和选择性brd4溴结构域抑制剂)、以及mc1568(选择性地抑制ii(iia)类hdac)。图1e至1h表明相比于s6d7、或第7阶段未经处理的或经dmso处理的培养物,在添加5-氮杂胞苷(“azt”)(dna甲基转移酶抑制剂)、吡咯沙敏(组蛋白脱乙酰酶抑制剂)和ci994(组蛋白脱乙酰酶抑制剂)之后ucn3的第7阶段表达提高。所有条件s7d7;ali簇。图2a和2b表明了所选小分子作为mafa或ucn3上调剂的稳健性,因为它们的效应在不同的第7阶段调节方案中得以维持。发现3-去氮腺嘌呤a(“deza”)是mafa而非ucn3的有效上调剂(图2a)。证实azt为第7阶段期间ucn3而非mafa的上调剂(图2b)。所有条件s7d7;ali簇。图3a-3m表明在改善的第7阶段调节七天之后,ali细胞簇中一组成熟标记物的基因表达提高至人胰岛中所观察到的水平。第7阶段分化期间所用的改善包括:(i)移除alk5抑制剂ii;(ii)降低t3浓度;(iii)添加deza;(iv)添加azt;(v)添加zm;(vi)葡萄糖浓度降低至5.56mm;以及(vii)添加维生素、非必需氨基酸、脂质、丙酮酸钠、以及微量元素(制剂i-表xii)的限定混合物。图3a示出利用alk5抑制剂ii的条件下inhbb富集到高于人胰岛中所见的表达,并且在不存在或存在azt/deza情况下移除alk5抑制剂使inhbb下降至人胰岛中所见的水平。图3b示出通过移除alk5抑制剂ii,ali簇中inha的表达提高到人胰岛水平。而mafa和slc2a1表达(分别示于图3c和图3d)因移除alk5抑制剂ii而下降,azt/deza的添加使mafa和slc2a1表达挽救至人胰岛水平。通过在ali簇中添加azt/deza并移除alk5抑制剂ii,ucn3(图3e)、g6pc2(葡萄糖-6-磷酸酶催化亚基2;图3f)和pdk1(丙酮酸脱氢酶激酶1;图3g)的表达提高到人胰岛水平或其以上。ins(胰岛素;图3h)、gjd2(缝隙连接蛋白质,δ2;也为cx36/连接蛋白36;图3i)、six2(six同源盒2;图3j)、以及pdx1(图3k)的表达首先通过移除alk5抑制剂ii并随后添加azt/deza以逐步分步的方式得到提高。nkx6.1(图3l)和glp1r(高血糖素样肽1受体;图3m)的表达在各条件下并未显著改变,但其在ali簇中的表达始终处于人胰岛中所观察到的水平或其以上。所有条件s7d7;ali簇。图4a-4e表明就蛋白质的存在而言,s7d7在共表达下列成熟标记物的ali细胞簇中生成的c-肽细胞:pdx1(图4a)、nkx6.1(图4b)、mafa(图4c)、slc2a1(图4d)、以及ucn3(图4e)。代表性的人胰岛染色示于左列。无alk5、低t3、zm、h、nac、azt/deza、fi、blar001条件示于中间列。无alk5、低t3、zm、h、nac、azt/deza、fi、blar004条件示于右列。所有条件s7d7;ali簇。图5a-5f表明特别地通过第7阶段特异性“无alk5、低t3、zm、h、nac、azt、deza、fi、blar001”调节,在ali上s7d7生成表现出人胰岛类似的葡萄糖依赖性线粒体呼吸动力学的c-肽细胞。图5a示出由注射后(“ip”)15min之后相比于基线的ocr123.3%±12.92所示,人胰岛迅速响应于高d-葡萄糖,并且随时间推移维持较高的ocr(131.5%±11.32;72minip)。相反地,富集不成熟c-肽阳性细胞的s6d7ali簇缺乏对高d-葡萄糖迅速的ocr响应(104.4%±3.37;15minip),并且表现出随时间推移相对较弱的ocr响应(113.3%±4.51;72minip)。图5d表明在s7d7ali簇组之内,仅“无alk5、低t3、zm、h、nac、azt/deza、fi、blar001”条件表现出人胰岛类似的葡萄糖依赖性线粒体呼吸动力学(112.4%±3.25–15minip;129.5%±3.78–72minip)。以下s7d7ali簇条件表现出与不成熟s6d7ali簇无区别的葡萄糖依赖性线粒体动力学:“alk5、t3、zm、h、nac、fi、blar001”(100.3%±4.04–15minip;107.8%±6.51–72minip)(图5b);“无alk5、低t3、zm、h、nac、fi、blar001”(96.9%±3.06–15minip;109.0%±4.58–72minip)(图5c);“无alk5、低t3、zm、h、nac、fi、blar004”(103.4%±4.76–15minip;113.6%±6.72–72minip)(图5e);以及“无alk5、低t3、zm、h、nac、azt/deza、fi、blar004”(102.1%±4.04–15minip;112.7%±3.38–72minip)(图5f)。图6a-6l展示在悬浮培养物中分化成不成熟胰腺β细胞的aggrewelltm细胞簇。图6a示出通过其使(i)新鲜s4d3单层或s4d3冷冻保存的细胞(ii)经由aggrewelltm方法装配成(iii)细胞簇的过程。图6b示出在s4d5aggrewelltm簇中检测到胰腺内胚层tfpdx1(顶部,左侧)和nkx6.1(顶部,中间)的较高蛋白质存在,但内分泌tfneurod1(顶部,右侧);分配tfsox2(底部,中间)和cdx2(底部,右侧)的另选非胰腺内胚层谱系的较低蛋白质存在。在图6c中,facs分析示出细胞的99.3±0.1%为pdx1+(左侧),84.4±0.1%为nkx6.1+(中间),但2.2±0.4%为nkx6.1+neurod1+(右侧)或1.35±0.55%为nkx6.1+chga+(中间)(s4dsaggrewelltm簇)。图6d示出稳健的胰腺内胚层特征在于s4d3冷冻保存细胞的s4d4aggrewelltm簇中得以维持,因为相比于s4d3单层而言维持了pdx1(顶部,左侧)、nkx6.1(顶部,右侧)的较高基因表达,以及neurod1(底部,左侧)和chga(底部,右侧)的较低表达。图6e示出通过其使(i)新鲜s4d3单层或s4d3冷冻保存的细胞(ii)经由aggrewelltm方法装配成细胞簇,并且(iii)在悬浮培养物中分化成(iv)s6d6的不成熟β细胞的过程。s6d6aggrewelltm簇的facs分析示出稳健的不成熟β细胞蛋白质分布,因为78.5±1.87%的细胞为nkx6.1+chga+(左侧,图6f)、73.6±4.34%为nkx6.1+neurod1+(右侧,图6f)且38.4±5.96%为nkx6.1+insulin+(左侧,图6g)。大部分胰岛素阳性群体(总细胞的50.2±6.92%为insulin+)为nkx6.1+(左侧,图6g)并且不为高血糖素阳性(7.43±1.49%insulin+glucagon+;(右侧,图6g)。图6h通过if示出在s6d6,aggrewelltm簇中的大部分c-肽阳性细胞为pdx1+(左侧)和nkx6.1+(中间)两者。图6i示出成熟门禁tfmafa(右侧)的蛋白质存在已经容易地在s6d6检出,并且在s6d6-s6d7以比先前的ali簇更高的水平表达(naturebiotechnology,2014(32)11,1121-1133)(还可参见图3c以进行alis7d7比较)。在s6d6-s6d7,insulin(图6j)、pdx1(图6k)和nkx6.1(图6l)的表达高于先前的ali簇。图7a-7m展示s7d7aggrewelltm簇经由悬浮培养物生成为成熟胰腺β细胞。图7a示出如下过程:(i)新鲜s4d3单层或s4d3冷冻保存的细胞装配成aggrewelltm簇,通过(ii&iii)第5、6和7阶段经悬浮培养物调节,以产生(iv)s7d7aggrewelltm簇。第7阶段期间通过“无alk5低t3zmhnacdezaaztfiblar001”培养的s7d7aggrewelltm簇维持了基线β细胞蛋白质分布(图7b-7c)。89%的细胞为nkx6.1+chga+(左侧,图7b)、77.7%为nkx6.1+neurod1+(右侧,图7b)且40.8%为nkx6.1+insulin+(左侧,图7c)。大部分胰岛素阳性群体(总细胞的46.4%为insulin+)为nkx6.1+(左侧,图7c)并且不为高血糖素阳性(3.9%insulin+glucagon+;(右侧,图7c)。在第7阶段“无alk5低t3zmhnacdezaaztfiblar001或blar004”调节的s7d7aggrewelltm簇中,成熟标记物mafa(图7d)、ucn3(图7e)、slc2a1(图7f)、g6pc2(图7g)、insulin(图7h)和nkx6.1(图7i)的基因表达处于人胰岛水平或其以上。相比于在ali簇中,aggrewelltm(“无alk5低t3zmhnacdezaaztfiblar001或blar004”)中成熟标记物诸如mafa(图3c)、g2pc2(图3f)、insulin(图3h)和nkx6.1(图3l)的s7d7表达水平较高。图7j-7m表明将deza和azt添加到“无alk5低t3zmhnacfiblar004”第7阶段调节,产生在s7d7共表达以下项(就蛋白质的存在而言)的显著数目的非高血糖素(图7j;底部,右侧)c-肽细胞:pdx1(图7j;底部,左侧)、nkx6.1(图7j;底部,中间)、mafa(图7k;底部,左侧)、ucn3(图7k;底部,中间)、以及slc2a1(图7k;底部,右侧)。图7l-7m表明通过“无alk5低t3zmhnacfiblar004”-特异性第7阶段调节,产生在s7d7共表达以下成熟标记物(就蛋白质的存在而言)的c-肽细胞:pdx1(图7l;底部,左侧)、nkx6.1(图7l;底部,中间)、mafa(图7m;底部,左侧)、slc2a1(图7m;底部,右侧),但非高血糖素(图7l;底部,右侧)或ucn3(图7m;底部,中间)。图8a–8i显示通过悬浮培养物所产生的具有人胰岛-类似的葡萄糖依赖性线粒体呼吸和gsis动力学的多能干细胞衍生的成熟胰腺β细胞。图8a-8b均示出由15minip之后相比于基线的ocr123.3%±12.92所示,人胰岛细胞迅速响应于高d-葡萄糖,并且随时间推移维持较高的ocr(131.5%±11.32;72minip)。富集不成熟c-肽阳性细胞的s6d7ali簇缺乏对高d-葡萄糖迅速的ocr响应(104.4%±3.37;15minip),并且表现出随时间推移相对较弱的ocr响应(113.3%±4.51;72minip)。在悬浮液中aggrewelltm簇环境中,在s7d13的“无alk5、低t3、zm、h、nac、fi、blar004”条件下观察到人胰岛类似的葡萄糖依赖性线粒体呼吸动力学(110.7%±2.46–15minip;125.9%±2.27–72minip)(图8a)。悬浮液中“无alk5、低t3、zm、h、nac、azt、deza、fi、blar004”aggrewelltm簇响应于高葡萄糖刺激的耗氧量高于人胰岛水平(162.0%±11.51–15minip;177.1%±0.99–72minip)(图8b)。图8c示出人胰岛内的成熟β细胞表现出响应于葡萄糖刺激的多轮快速的双相胰岛素分泌的能力。人胰岛显示能够多轮“通-断”切换胰岛素分泌。测试的所有条件均表现出对kcl的较强胰岛素分泌响应(图8c-8i)。添加exendin-4并未增大所示的人胰岛中gsis响应的幅值,但被包括在内以与ali或aggrewelltmgsis特征进行比较(图8d)。无论是blar001(图8e)还是blar004(图8f)中,在“无alk5、低t3、zm、h、nacfi”中第7阶段期间调节的s7d21-ali簇示出第一(约4-10倍于第一gsis响应的第一时相)相对缓慢的双相gsis响应,但未示出第二响应。ali簇不能在刺激后再灌流3mmd-葡萄糖时切断胰岛素分泌的第二时相。“无alk5、低t3、zm、h、nac、fiblar004”中第7阶段期间调节的s7d14aggrewelltm簇表现出较强的第一双相gsis(约5倍于第一gsis响应的第一时相),接着能够完全切断gsis,以及较弱的第二单相响应(图8g)。在将deza和azt添加至“无alk5、低t3、zm、h、nac、fiblar004”调节情况下,s7d14aggrewelltm簇表现出多轮人胰岛类似的双相gsis(约5-7倍于第一gsis响应的第一时相),并且能够在高葡萄糖脉冲之间完全切断gsis(图8h-8i)。图9a-9q展示在多种类型的悬浮培养物中产生衍生自cyt49hesc的胰腺内胚层。图9a示出分步分化方案以产生cyt49hesc-衍生的胰腺内胚层。对各阶段指示重要的转录因子(“tf”)。图9b示出相对于hesc输入(以百万个细胞/ml计)所产生的s4d3细胞数。图9c示出对于0.1pbsmini和0.5pbsmini的s4d3产量。例如,对于0.5pbs悬浮培养形式,每一个hesc细胞产生4.08±0.854个细胞,这显著高于pec-01d12(2.23±0.090)。图9c显示当从100ml(0.1pbs)放大至500ml(0.5pbs)培养基体积时,s4d3总细胞产量(以百万个细胞计)增加约6倍。图9d和9e示出得自以下的s4d3聚集体的相差图像和直径(以微米计):2升滚瓶(图9d右侧)、0.1pbs(图9e中间)和0.5pbs(图9e右侧)悬浮液形式;2升滚瓶产生的pec-01d12(图9d左侧)和pec-01d15(图9e左侧)作为现有技术的示例示出。0.1pbs和0.5pbs悬浮培养物所产生的s4d3聚集体一致小于滚瓶产生的聚集体。图9f-9l示出s4d3聚集体的基因表达。对2升滚瓶、0.1pbs和0.5pbs所产生的s4d3聚集体、以及2升滚瓶产生的pec-01d15而言,示出nkx6.1(图9f)、ptf1a(图9g)、pdx1(图9h)、sox2(图9i)、cdx2(图9j)、neurod1(图9k)和chga(图9l)相对于cyt49hesc的基因表达。图9f-9l显示相对于pec-01d15(现有技术),胰腺内胚层基因程序被强烈诱导,同时限制了可选内胚层谱系表达和早期胰腺内分泌分化。图9n-9p示出相对于2升滚瓶产生的pec-01d12聚集体(图9m)和pec-01d15聚集体(图9q),2升滚瓶(图9n)、0.1pbs(图9o)和0.5pbs(图9p)的新方案所产生的s4d3聚集体的胰腺内胚层标记物(例如pdx1,nkx6.1)的蛋白质共定位较强,但可选的内胚层谱系的蛋白质标记物(例如sox2,cdx2)和内分泌分化的标记物(例如chga)并非如此。图10a-10ab展示多种类型的悬浮培养物中衍生自cyt49hesc的产胰岛素细胞的产生。图10a示出用于产生cyt49hesc-衍生的非功能性产胰岛素细胞的所公开分步分化方案。对各阶段指示重要的转录因子(“tf”),开始于s4d3cyt49hesc-衍生的细胞输入第5阶段调节中。图10b示出相对于hesc输入(以百万个细胞/ml计)所产生的s6d7细胞数。例如,对于利用新方案的0.5pbs悬浮培养形式,每一个hesc细胞产生2.4±0.169个s6d7细胞。图10c示出0.1pbs和0.5pbs培养物的s6d7产量。图10c显示当从100ml(0.1pbs)放大至500ml(0.5pbs)培养基体积时,s6d7总细胞产量(以百万个细胞计)增加约7.5倍。图10d示出得自2升滚瓶(图10d左侧)、0.1pbs(图10d中间)和0.5pbs(图10d右侧)悬浮液形式的s5d3聚集体的相差图像。图10e示出得自2升滚瓶(图10e左侧)、0.1pbs(图10e中间)和0.5pbs(图10e右侧)悬浮液形式的s6d7聚集体的相差图像,各图下方具有指出的聚集体直径。图10f示出得自2升滚瓶(图10f左侧)和0.1pbs(图10f右侧)悬浮液形式的s7d13聚集体的相差图像。0.1pbs和0.5pbs使悬浮培养物维持紧密的聚集体结构到第7阶段。相反地,第6-7阶段聚集体松散,从而在2升滚瓶悬浮培养物中形成细胞层。图10g-10n示出s4d3、s5d3、s6d7和s7d7的基因表达。图10g-10n显示使用新方案的所有悬浮培养方法诱导稳健的胰腺单激素胰岛素产生细胞的基因特征图;2升滚瓶、0.1pbs和0.5pbs悬浮法相对等几率诱导pdx1(图10g)、nkx6.1(图10h)、chga(图10i)、neurod1(图10j)、ngn3(图10k)、insulin(图10l)、mafa(图10m)以及glucagon(图10n)的表达。图10o-10t示出在0.5pbs中s5d3(图10o-10p)、2升滚瓶中s6d7(图10q)、0.1pbs中s6d7(图10r)、2升滚瓶中s7d13(图10s)、以及0.1pbs中s7d14(图10t),分步形成了产胰岛素细胞标记物诸如chga、nkx6.1、insulin而非glucagon的蛋白质共定位。图10u示出对于pec-01-衍生的s6d7细胞,共表达chga、insulin或glucagon的nkx6.1细胞的发生率以及insulin和glucaon共表达细胞的发生率。图10u示出对于2升滚瓶中pec-01衍生的s6d7聚集体,多激素胰岛素产生细胞的发生率较高,并因此单激素胰岛素阳性细胞的数目较低。图10v示出对于以下项而言glucagon和nkx6.1的共定位:pec-01-衍生的s6d7;0.1pbss7d14和滚瓶(rb)s7d13。图10v显示在所有测试的条件下(利用新方案的pec-01-衍生的s6d7;0.1pbss7d14和rbs7d13),所有insulin+glucagon+细胞对nkx6.1的存在呈阴性。图10w-10ab示出在0.1pbs中s6d7(图10w-10x)、0.1pbs中s7d16(图10y-10z)、以及2升滚瓶中s7d23(图10aa-10ab),产胰岛素细胞标记物诸如synaptophysin(泛内分泌标记物),nkx6.1、insulin和mafa的蛋白质共定位。通过第7阶段,观察到指示非功能性单激素胰岛素产生细胞的synaptophysin、nkx6.1、insulin和mafa之间稳健的蛋白质共定位。具体实施方式在结合附图阅读以下对本发明的详细说明时能够更好地进行理解。附图被提供用于举例说明本发明的某些实施方案。然而,本发明并不限于示出的精确布置方式、示例和手段。为了清晰说明本公开内容,以非限制性方式将本发明的具体实施方式分成描述或阐明本发明的某些特征、实施方案或应用方式的多个小节。a.定义干细胞是通过其在单细胞水平上既自我更新又分化的能力来定义的未分化细胞。干细胞可产生子代细胞,包括自我更新祖细胞、非更新祖细胞和终末分化细胞。干细胞的特征还在于其在体外分化成来自多个胚层(内胚层、中胚层和外胚层)的多种细胞谱系的功能性细胞的能力。干细胞还在移植后产生多种胚层的组织,并且在注射到胚泡内之后,促成基本上至大部分(如果不是所有的话)组织。干细胞是根据其发育潜能分类的。多能干细胞能够产生所有胚胎细胞类型。分化是未特化的(“未定向的”)或特化不足的细胞获得特化细胞(例如神经细胞或肌肉细胞)的特征的过程。分化细胞为已在细胞谱系中占据更特化的(“定向的”)位置的细胞。当应用于分化的方法时,术语“定向的”是指已经在分化途径中进行到一定程度的细胞,其中在正常情况下,该细胞将继续分化成特定的细胞类型或一个亚群的细胞类型,并且在正常情况下,不能分化成不同的细胞类型或回复至分化程度更低的细胞类型。“去分化”是指细胞回复到细胞的谱系当中特化(或定向)程度较低的地位的过程。如本文所用,“细胞谱系”限定细胞的遗传,即它来自哪些细胞和它能产生什么细胞。细胞谱系将细胞放置在发育和分化的遗传方案内。“谱系特异性标记”是指与所关注谱系的细胞的表型明确相关的特性,可用来评估未定向细胞相对于所关注谱系的分化。如本文所用,“标记”为在所关注的细胞中被差异表达的核酸或多肽分子。在该上下文中,差异表达意指与未分化细胞或在分化的另一阶段处的细胞相比阳性标记物的水平升高并且阴性标记物的水平下降。与其他细胞相比,标记物核酸或多肽在所关注细胞中的可检测水平充分地较高或较低,使得可使用本领域已知的多种方法中的任何一种方法来将所关注细胞与其他细胞鉴别和区分开来。如本文所用,“细胞密度”和“接种密度”在本文可互换使用,并且是指每单位面积的固体或半固体平坦或弯曲培养基所接种的细胞的数量。如本文所用,“悬浮培养物”是指悬浮在培养基中而不是粘附到表面上的细胞、单个细胞或群集的培养物。如本文所用,当在细胞中充分地检测到特定标记物时,细胞“对于特定标记物是阳性的”,“阳性的”或是“+”。相似地,当在细胞中未充分检测到特定标记物时,细胞“对于特定标记物是阴性的”、“阴性的”或是“–”。具体地,通过荧光活化细胞分选细胞术(“facs”)检测到的阳性通常大于2%,而通过facs检测到的阴性阈值通常小于约1%。通过聚合酶链反应细胞术(“pcr”)检测到的阳性通常小于或等于约30个循环(cts);而通过pcr检测到的阴性通常大于约31个循环。尝试着在静态体外细胞培养物中将多能干细胞的分化过程复制到功能性胰腺内分泌细胞中时,通常将该分化过程视为通过多个连续阶段累进。具体地,该分化过程常被视为通过多个阶段循序累进。在这种分步进行的分化中,“第1阶段”是指分化过程的第一步骤,多能干细胞分化为表达定形内胚层的特征性标记物的细胞(“第1阶段细胞”)。“第2阶段”是指第二步骤,表达定形内胚层细胞的特征性标记物的细胞分化为表达原肠管细胞的特征性标记物的细胞(“第2阶段细胞”)。“第3阶段”是指第三步骤,表达原肠管细胞的特征性标记物的细胞分化为表达前肠内胚层细胞的特征性标记物的细胞(“第3阶段细胞”)。“第4阶段”是指第四步骤,表达前肠内胚层细胞的特征性标记物的细胞分化为表达胰腺内胚层细胞的特征性标记物的细胞(“第4阶段细胞”)。“第5阶段”是指第五步骤,表达胰腺内胚层细胞的特征性标记物的细胞分化为表达胰腺内胚层细胞和胰腺内分泌前体细胞中的一者或两者的特征性标记物的细胞(统称为“第5阶段细胞”,或者“胰腺内胚层/内分泌前体细胞”)。“第6阶段”是指第六步骤,表达胰腺内分泌前体细胞的特征性标记物的细胞分化成表达不成熟β细胞的特征性标记物的细胞(“第6阶段细胞”)。在产生本发明的细胞和细胞群的过程中并且为了产生本发明的细胞和细胞群的目的,使用第七步骤,“第7阶段”,并且其是指表达不成熟β细胞(胰腺内分泌细胞)的特征性标记物的细胞分化成表达与第6阶段细胞相比具有更成熟表型的功能性β细胞的特征性标记物的细胞。“具有更成熟表型的功能性β细胞”或“第7阶段细胞”意指这样的胰腺内分泌细胞:当相比于第6阶段细胞时,不仅呈单激素胰岛素+、mafa+、nkx6.1+、ucn3+、slc2a1+和pdx1+,而且以比不太成熟胰腺内分泌细胞(特别是不成熟β细胞)更高的水平表达mafa。应当注意在特定群体过程中并非所有细胞都以相同的速率经历这些阶段。因此,在体外细胞培养物中检测到存在该细胞,该细胞比存在于细胞群中的大多数细胞在分化途径中进程靠前或靠后的情况并不少见,尤其在处于后期分化阶段的培养物中。例如,在细胞培养物处于第5阶段期间,不时能观察到有胰腺内分泌细胞的特征性标记物出现。出于举例说明本发明的目的,本文描述了与上文定义的各阶段相关联的各种细胞类型的特征。如本文所用,“定形内胚层”是指具有在原肠胚形成过程中从上胚层产生的细胞的特性并形成胃肠道及其衍生物的细胞。定形内胚层细胞表达下列标记中的至少一种标记:foxa2(也称为肝细胞核因子3-β(“hnf3-β”))、gata4、sox17、cxcr4、鼠短尾突变体表型(brachyury)、cerberus、otx2、小耳畸形(goosecoid)、c试剂盒、cd99和mixl1。定形内胚层细胞的特征性标记物为cxcr4、foxa2和sox17。因此,定形内胚层细胞可通过其对cxcr4、foxa2和sox17的表达来表征。此外,取决于细胞能保持在第1阶段的时长,可能观察到hnf4α增多。如本文所用,“原肠管细胞”是指源于定形内胚层的细胞,并且所述细胞可产生所有的内胚层器官,诸如肺、肝、胰腺、胃和肠。肠管细胞的特征可在于其中的hnf4α表达较之定形内胚层细胞表达的hnf4α表达大幅提高。例如,在第2阶段期间,可能观察到hnf4α在mrna中的表达增大到之前的十到四十倍。如本文所用,“前肠内胚层细胞”是指产生食道、肺、胃、肝、胰腺、胆囊和一部分十二指肠的细胞。前肠内胚层细胞表达下列标记物中的至少一种:pdx1、foxa2、cdx2、sox2、以及hnf4α。前肠内胚层细胞可通过其相较于肠管细胞,对pdx1的表达的增长来表征。例如,超过百分之五十的第3阶段培养物的细胞通常表达pdx1。如本文所用,“胰腺内胚层细胞”是指表达下列标记物中的至少一种的细胞:pdx1、nkx6.1、hnf1β、ptf1α、hnf6、hnf4α、sox9、ngn3、胃泌素;hb9、或prox1。胰腺内胚层细胞的特征可在于缺乏cdx2或sox2大量表达。如本文所用,“胰腺内分泌前体细胞”是指能够变成胰腺激素表达细胞的胰腺内胚层细胞。胰腺内分泌前体细胞表达以下标记物中的至少一种:ngn3;nkx2.2;neurod1;isl1;pax4;pax6;或arx。胰腺内分泌前体细胞的特征可在于其表达nkx2.2和neurod1。如本文所用,“胰腺内分泌细胞”是指能够表达下列激素中的至少一种的细胞:胰岛素、胰高血糖素、生长抑素、生长素释放肽和胰多肽。除了这些激素以外,胰腺内分泌细胞的特征性标记物还包括以下中的一种或多种:neurod1、isl1、pdx1、nkx6.1、pax4、arx、nkx2.2、hb9和pax6。“贝塔细胞”(“β细胞”)是能够表达胰岛素而非高血糖素、生长激素抑制素、生长素释放肽和胰腺多肽的胰腺内分泌细胞。表达β细胞的特征性标记物的胰腺内分泌细胞的特征可在于其对胰岛素以及下列转录因子中的至少一种的表达:pdx1、nkx2.2、nkx6.1、neurod1、isl1、hnf3β、hb9、mafa和pax6。“功能性β细胞”是显示如下完善过程的胰腺内分泌细胞:确保迅速调节葡萄糖刺激的胰岛素分泌(“gsis”),特别是在线粒体呼吸/活性提高之后跟随胰岛素分泌(“双相gsis”)的第一时相和第二时相。详细地,功能性β细胞表现出下列双相gsis特征中的至少一种:(i)线粒体呼吸/活性与胰岛素分泌偶联;(ii)对所提较高需求(此处定义为高葡萄糖浓度)快速的胰岛素分泌响应;(iii)在需求衰减之后能够迅速切断胰岛素分泌;(iv)能够多轮“通-断”切换胰岛素分泌;(v)能够分泌恰当量的胰岛素(取决于要求);并且(vi)能够响应于多种胰岛素促分泌素(例如exendin-4,或氨基酸—l-谷氨酸盐和l-精氨酸)。功能性β细胞的特征可在于其对胰岛素和至少一种下列转录因子的表达:pdx1、nkx2.2、nkx6.1、neurod1、isl1、hnf3β、hb9、pax6、mafa、slc2a1、ucn3和glp1r。“不成熟β细胞”是不表现出葡萄糖依赖性线粒体呼吸/活性、以及双相gsis的胰腺内分泌细胞。表达β细胞的特征性标记物的不成熟β细胞的特征可在于其对胰岛素以及至少一种下列转录因子的表达:pdx1、nkx2.2、nkx6.1、neurod1、isl1、hnf3β、hb9、mafa和pax6。如本文所用,“空气-液体界面”或“ali”是指存在于开放培养容器或部分填充有培养基的培养容器中的空气-液体界面。虽然为了方便起见而在本文中称作“空气”,但是本发明不限于在周围环境中存在的气体和组合物的混合物。本发明具体地设想和包括具有与周围环境不同的组合物的气态混合物,包括例如富含特定组分或其中特定组分已经被耗尽或消除的混合物。在本文中可互换使用的是“d1”、“1d”和“第1天”;“d2”、“2d”和“第2天”等等。这些数字字母组合是指在本专利申请的逐步分化方案过程中的不同阶段中温育的具体天数。第一时相(1st)胰岛素分泌表示在葡萄糖浓度突然增大时,结合和可易于释放的胰岛素颗粒的较小库迅速胞吐。第二时相(2nd)胰岛素分泌相比于第一时相胰岛素分泌幅度较低但持续时间较长,表示颗粒从颗粒储备库转移,并且它们结合/引发以释放。ocr被定义为耗氧率,并且为特别是经由电子传递链(“etc”)的线粒体呼吸的指标;线粒体活性的直接量度。“有效量”或“治疗量”或其等同形式是指应当存在用来提供一定程度的hesc分化或部分分化的hesc(诸如经受一个或多个先前分化阶段的那些)的进一步分化的化合物的量。在另外的示例中,化合物可存在于hesc的培养基中,或者可添加到hesc的某些生长阶段期间。在一些实施方案中,化合物、试剂、小分子或生长因子用于产生定形内胚层、前肠、胰腺前肠和胰腺内胚层-谱系细胞,包括胰腺激素分泌细胞。在某些示例中,干细胞可在任何分化之前或分化的第一第阶段期间暴露于化合物、试剂、小分子或生长因子,而在其它示例中,干细胞可首先分化成中间细胞类型(例如定形内胚层),然后暴露于化合物、试剂、小分子或生长因子。本发明的“化合物”、“小分子化合物”或其等同形式是指本文公开的通式所涵盖的化合物(例如表xi),并且包括该式(结构公开于本文)之内的任何特定化合物或其类似物。本发明的化合物可根据其化学结构或化学名来鉴定。当化学结构和化学名有冲突时,用化学结构来确定化合物的种类。本发明的化合物可包含一个或多个手性中心或双键,并因此可作为立体异构体,诸如双键异构体(即几何异构体)、对映体或非对映体存在。因此,本文所述的化学结构涵盖所示化合物的所有可能对映体和立体异构体,包括立体异构纯形式(例如几何纯、对映纯或非对映纯)以及对映和立体异构的混合物。对映和立体异构混合物可用本领域技术人员公知的分离技术或手性合成技术拆分成其对映体或立体异构体组分。本发明的化合物还包括同位素标记的化合物,其中一个或多个原子的原子量不同于通常存在于自然界的原子量。可引入本发明化合物的同位素的示例包括但不限于2h、3h、13c、14c、15n、18o、17o、31p、32p、35s、18f和36cl。此外,当例示本发明化合物的局部结构时,应当理解括号表示局部结构与分子其余部分的连接点。b.多能干细胞的表征多能干细胞可表达指定的tra-1-60和tra-1-81抗体(thomson等人,1998,science282:1145-1147)中的一种或多种。多能干细胞在体外的分化导致tra-1-60和tra-1-81丧失表达。未分化的多能干细胞通常具有碱性磷酸酶活性,所述碱性磷酸酶活性可通过用4%多聚甲醛固定细胞,然后用以商标red出售的碱性磷酸酶底物试剂盒显色来检测,如由制造商(vectorlaboratories,inc.,burlingame,california)描述的。未分化的多能干细胞通常也表达oct4和tert,这通过逆转录聚合酶链反应(“rt-pcr”)检测。增殖的多能干细胞的另一期望表型具有分化成所有三个胚层(内胚层、中胚层和外胚层)的细胞的潜能。可以例如通过如下方式来确认干细胞的多能性:将细胞注射入重症联合免疫缺陷(“scid”)小鼠,使用4%的多聚甲醛固定形成的畸胎瘤,然后针对来自该三个胚层的细胞类型的证据进行组织学检测。另选地,可以通过产生胚状体并评估胚状体中与三个胚层相关的标记物的存在来确定多能性。增殖的多能干细胞系可用标准g显带技术进行核型分析并与公开的相应灵长类物种的核型相比较。希望获得具有“正常核型”(其意指细胞是整倍体的)的细胞,其中所有人染色体都存在并且无明显的改变。c.多能干细胞的来源任何多能干细胞均可用于本发明的方法中。可使用的多能干细胞的示例性类型包括建立的多能细胞系,包括在妊娠期间的任何时间取得的胚胎前组织(诸如胚泡)、胚胎组织或胎儿组织,所述时间通常但不一定是在约10至12周妊娠前。非限制性示例是建立的人胚胎干细胞(“hesc”)系或人胚胎干细胞,诸如人胚胎干细胞系h1(nih代码:wa01)、h7(nih代码:wa07)、h9(nih代码:wa09)(wicellresearchinstitute,madison,wi,usa)、以及sa002(cellartisabcorporation,goteburg,sweden)。取自在没有饲养细胞的情况下培养过的多能干细胞群的细胞也是合适的选择。还可使用诱导多能细胞(ips)或重新编程的多能细胞,其可使用多种多能相关的转录因子的被迫表达而来源于成人体细胞,所述转录因子诸如oct4、nanog、sox2、klf4和zfp42(annurevgenomicshumgenet2011,12:165-185;还可参见ips,cell,126(4):663-676)。在本发明的方法中使用的人胚胎干细胞也可如thomson等人(美国专利5,843,780;science,1998,282:1145-1147;currtopdevbiol1998,38:133-165;procnatlacadsciu.s.a.1995,92:7844-7848)所述那样进行制备。也可使用突变的人胚胎干细胞系,诸如bg01v(bresagen、athens、georgia.),或衍生自成人体细胞的那些细胞,诸如takahashi等人,cell131:1-12(2007)中公开的细胞。在某些实施方案中,适用于本发明的多能干细胞可根据以下文献中描述的方法来获取:(cellstemcell4:16-19,2009);wright等人(cellstemcell1:55-70,2007);wright等人(cellstemcell2:230-240);wright等人(naturebiotechnol26:101-106,2008);wright等人(cell131:861-872,2007);以及美国专利申请公布2011/0104805。在某些实施方案中,适用于本发明的多能干细胞可被认为是“初始的”并且根据以下文献中描述的方法获得:gafni等人(nature,504:282,2013),以及ware等人(pnas,111:4484–4489,2014)。所有这些参考文献、专利和专利申请全文以引用方式并入本文,尤其是它们与多能细胞的分离、培养、扩增和分化有关的内容。多能干细胞的其它来源包括诱导的多能干细胞(ips,cell,126(4):663-676)。合适细胞的其它来源包括人脐带组织衍生的细胞、人羊水衍生的细胞、人胎盘衍生的细胞,以及人孤雌生殖体。在一个实施方案中,脐带组织衍生的细胞可通过美国专利7,510,873的方法获得。在另一个实施方案中,胎盘组织衍生的细胞可使用美国专利申请公布2005/0058631的方法获得。在另一个实施方案中,羊水衍生的细胞可使用美国专利申请公布2007/0122903的方法获得。这些专利申请中的每个的公开内容由于涉及细胞的分离和表征而全文以引用方式并入本文。在某些实施方案中,多能干细胞可能为非胚胎来源的。d.多能干细胞的扩增和培养在受权利要求保护的本发明中可使用多种不同的扩增和培养多能干细胞的已知方法。例如,可将多能干细胞接种到合适的培养基质上。在一个实施方案中,合适的培养基质是细胞外基质组分,诸如衍生自基底膜或可形成粘附分子受体-配体偶联物的一部分的那些。一种合适的培养基质是以商标matrigeltm(corningincorporated,corning,newyork)出售的重构基底膜。matrigeltm是来自engelbreth-holmswarm肿瘤细胞的可溶性制剂,其在室温下胶凝形成重构的基底膜。在本领域中已知的其它细胞外基质组分和组分混合物适合作为替代物。取决于所扩增的细胞类型,这些替代物可包括单独的层粘连蛋白、纤连蛋白、蛋白聚糖、巢蛋白、硫酸肝素等,或者这些物质的各种组合。可在存在可促进细胞存活、增殖和保持理想特性的培养基的情况下,将多能干细胞以合适的分布接种到培养基质上。所有这些特性可得益于对接种分布的认真考虑并可由本领域技术人员轻松确定。合适的培养基可由以下组分制得:dulbecco改良的eagle培养基(“dmem”),以商品名(目录号11965-092)由lifetechnologiescorporation,grandislandnewyork出售;敲除dulbecco改良的eagle培养基(“kodmem”),以商品名(目录号10829-018)由lifetechnologiescorporation出售;ham'sf12/50%dmem基础培养基;200mml-谷氨酰胺,以商品名(目录号25030-081)由lifetechnologies出售;非必需氨基酸溶液,以商品名(目录号11140-050)由lifetechnologies出售;β-巯基乙醇,sigma-aldrichcompany,llcsaintlouis,mo(目录号m7522);人重组碱性成纤维细胞生长因子(“bfgf”),以商品名(目录号13256-029)由lifetechnologies出售。人胚胎干细胞的大规模扩增和受控分化过程也可使用悬浮生物反应器来实现。e.多能干细胞的分化当多能细胞向功能性β细胞分化时,它们经多个阶段分化,每一阶段的特征可在于其中有无特定标记物存在。细胞分化至这些阶段是通过特定培养条件实现的,所述培养条件包括存在和缺乏添加至培养基中的某些因子。一般来讲,这种分化可涉及多能干细胞分化成定形内胚层谱系和定形内胚层细胞。这些细胞随后可进一步分化成原肠管细胞,这些原肠管细胞可继而分化成前肠内胚层细胞。前肠内胚层细胞可分化成胰腺内胚层细胞,这些胰腺内胚层细胞可随后进一步分化成胰腺内分泌前体细胞或胰腺内胚层/胰腺内分泌前体细胞。这些细胞可分化成产生或分泌胰腺激素的细胞。本申请通过以下步骤提供多能干细胞向胰腺内分泌细胞的分阶段分化:优选地在部分填充有培养基的培养容器中存在的空气-液体界面处或悬浮液中培养细胞,具体地在第5阶段至第7阶段中的一个或多个中在空气-液体界面处或悬浮液中培养细胞。单独或与alk-5抑制剂进一步组合的甲状腺激素三碘甲腺原氨酸(“t3”)和甲状腺素(“t4”)及其类似物中的一种或多种可用于在分化的第1阶段至第7阶段中的一个或多个处,并且优选地在第5阶段至第7阶段中的每个处的细胞培养。另选地,alk-5抑制剂可在分化的一个或多个阶段中,但是优选地在第5阶段至第7阶段中的每个阶段处并且更优选地在第5阶段至第6阶段中的每个阶段处单独使用。更优选地,甲状腺激素或其类似物和alk5抑制剂中的一种或多种用于一个或多个分化阶段中,优选地在第5阶段至第7阶段中的每个阶段处并且更优选地在第5阶段至第6阶段中的每个阶段处。合适的甲状腺激素类似物可包括但不限于:gc-1(sobertirome)(购自r&dsystems,inc.minneapolis,minnesota);3,5-二碘甲状腺丙酸(“dipta”);kb-141,讨论于j.steroidbiochem.mol.biol.,2008,111:262-267以及proc.natl.acad.sci.us2003,100:10067-10072;mb07344,讨论于proc.natl.acad.sci.us2007,104:15490-15495;t0681,讨论于j.lipidres.,2009年5月,50:938以及endocr.pract.2012,18(6):954-964,所述文献的公开内容全文以引用方式并入本文。可用的alk5抑制剂包括:alk5抑制剂ii(enzolifesciences,inc.,farmingdale,newyork),其也为优选的alk5抑制剂;alk5i(axxora,inc.,sandiego,california)、sd208(r&dsystems);tgf-β抑制剂sb431542(xcessbiosciences,inc.,sandiego,california);itd-1(xcessbiosciences);ly2109761(xcessbiosciences);a83-01(xcessbiosciences);ly2157299(xcessbiosciences);tgf-β受体抑制剂v(emdmilliporechemical,gibstown,newjersey);tgf-β受体抑制剂i(emdmillipore);tgf-β受体抑制剂iv(emdmillipore);tgf-β受体抑制剂vii(emdmillipore);tgf-β受体抑制剂viii(emdmillipore);tgf-β受体抑制剂ii(emdmillipore);tgf-β受体抑制剂vi(emdmillipore);以及tgf-β受体抑制剂vi(emdmillipore)。在本发明的附加优选的实施方案中,该方法包括在一个或多个阶段处理细胞,但优选在第7阶段期间用分化培养基处理细胞,所述分化培养基包含抗氧化剂诸如维生素e、乙酰半胱氨酸、维生素c、抗氧化剂补充剂(目录号a1345,sigma-aldrichcompany,llcsaintlouis,missouri)、谷胱甘肽、超氧化物歧化酶、过氧化氢酶等及其组合中的一者或两者。在另外更优选的实施方案中,在进行第6阶段中,使用γ分泌酶抑制剂,其可为γ分泌酶抑制剂xx(emdmillipore),γ分泌酶抑制剂xxi(emdmillipore),γ分泌酶抑制剂xvi(emdmillipore),n-[(3,5-二氟苯基)乙酰基]-l-丙氨酰基-2-苯基]甘氨酸-1,1-二甲基乙酯(“dapt”)(目录号2634,tocrisbioscience,bristol,unitedkingdom)等,以及它们的组合。γ分泌酶抑制剂的可用量可为约50nm至5000nm,优选地为约50nm至500nm。抗氧化剂的量可为约0.1μm至100μm,或者约0.1μm至20μm,并且优选地为约1μm至10μm。另选地,抗氧化剂的可用量可为约100nm至5mm,约1000nm至2mm,并且优选地为约0.1mm至1mm。在本发明的实施方案中,某些小分子用于分化的一个或多个阶段的培养基中,优选地在第6阶段和第7阶段中的一个或两个处。感兴趣的小分子是能够抑制极光激酶、p90核糖体s6激酶或甲基转移酶受体dot1l的那些,并且优选地连同减小培养细胞的氧化应激的抗氧化剂一起使用。特别要关注的是极光激酶抑制剂ii和rsk抑制剂ii。极光激酶抑制剂ii是已知名称为(4-(4′-苯甲酰胺基苯氨基)-6,7-二甲氧基喹唑啉)的细胞可渗透化合物。rsk抑制剂ii是二氢蝶啶酮即2-(3,5-二氟-4-羟基-苯氨基)-8-异戊基-5,7-二甲基-7h-蝶啶-6-酮的外消旋混合物。感兴趣的其它极光激酶抑制剂包括zm447439和pf03814735。另外感兴趣的是dot1l的蛋白甲基转移酶受体抑制剂,特别是epz-5676。epz-5676是蛋白甲基转移酶dot1l的s-腺苷甲硫氨酸(“sam”)抑制剂。该化合物是示出抑制细胞增殖的dot1l(端粒沉默1-样干扰素(disruptoroftelomeresilencing1-like))甲基转移酶抑制剂。已知其化学名为9h-嘌呤-6-胺,9-[5-脱氧-5-[[顺-3-[2-[6-(1,1-二甲基乙基)-1h-苯并咪唑-2-基]乙基]环丁基](1-甲基乙基)氨基]-β-d-核糖呋喃基]-和(2r,3r,4s,5r)-2-(6-氨基嘌呤-9-基)-5-[[[3-[2-(6-叔丁基-1h-苯并咪唑-2-基)乙基]环丁基]-丙-2-基氨基]甲基]氧杂环戊烷-3,4-二醇。另外感兴趣的抑制剂是dna甲基转移酶抑制剂诸如5-氮杂胞苷(“azt”)、组蛋白脱乙酰酶抑制剂诸如吡咯沙敏和ci994。感兴趣的附加小分子包括unc0638、unc0646、unc0642和a366(g9a和glp组蛋白赖氨酸甲基转移酶抑制剂)、tc-e5003(prmt1精氨酸甲基转移酶抑制剂)、sb747651a二盐酸盐(msk1抑制剂;还抑制其它agc组激酶)、pfi1(bet溴结构域抑制剂)、ly303511(brd2、brd3和brd4抑制剂)、ms436(brd4溴结构域抑制剂)和mc1568(选择性抑制ii类hdac)、以及3-去氮腺嘌呤a(“deza”)。在本发明的一个优选的实施方案中,小分子用于第6阶段和第7阶段中的一个和多个的培养基中,并且更优选地用于第7阶段中。可通过选择显示成熟标记物的最佳表达的量来确定可用的小分子的量,并且该量不产生毒性效应。通常,可用的量将为约500nm至10μm,或者约500nm至5μm,并且优选地为约500nm至2μm。多能细胞向表达具有成熟表型的胰腺内分泌细胞(功能性β细胞)的特征性标记物的细胞的分化多能干细胞的特性为本领域技术人员所熟知的,并且多能干细胞的其他特性有待继续鉴定。多能干细胞标记物包括例如一种或多种如下物质的表达:abcg2、cripto、foxd3、连结素43、连结素45、oct4、sox2、nanog、htert、utf1、zfp42、ssea-3、ssea-4、tra-1-60、tra-1-81。这些可通过rt-pcr检测。示例性多能干细胞包括人胚胎干细胞系h9(nih代码:wa09)、人胚胎干细胞系h1(nih代码:wa01)、人胚胎干细胞系h7(nih代码:wa07)和人胚胎干细胞系sa002。同样适用的是表达下列多能细胞标记特征中的至少一种的细胞:abcg2、cripto、cd9、foxd3、connexin43、connexin45、oct4、sox2、nanog、htert、utf1、zfp42、ssea-3、ssea-4、tra-1-60和tra-1-81。适用于本发明的是表达定形内胚层谱系的特征性标记物中的至少一种的细胞。在本发明的一个方面,表达定形内胚层谱系的特征性标记物的细胞为原条前体细胞。在另一方面,表达定形内胚层谱系的特征性标记物的细胞是中内胚层细胞。在另一方面,表达定形内胚层谱系的特征性标记物的细胞是定形内胚层细胞。表达胰腺内胚层谱系的特征性标记物中的至少一种的细胞也适用于本发明。在本发明的一个方面,表达胰腺内胚层谱系的特征性标记物的细胞是胰腺内胚层细胞,其中pdx1和nkx6.1的表达基本上高于cdx2和sox2的表达。在某些实施方案中,大于30%的细胞表达pdx1和nkx6.1,并且小于30%的细胞表达cdx2或sox2,如用facs所测量的。其中pdx1和nkx6.1的表达是cdx2或sox2的表达的至少两倍的细胞特别有用。还适用于本发明的是表达胰腺内分泌谱系的特征性标记物中的至少一种的细胞。在本发明的一个方面,表达胰腺内分泌谱系的特征性标记物的细胞为胰腺内分泌细胞。胰腺内分泌细胞可为能够表达以下激素中的至少一种的表达胰腺激素的细胞:胰岛素、胰高血糖素、生长抑素、生长素释放肽或胰多肽。在一个优选的实施方案中,所述胰腺内分泌细胞是产生胰岛素的β细胞。在本发明的某些实施方案中,为了到达表达功能性β细胞(成熟表型的胰腺内分泌β细胞)的特征性标记物的细胞,采用以多能干细胞开始的方案。该方案包括:第1阶段:将从细胞培养系获得的多能干细胞,诸如胚胎干细胞,用合适的因子处理以诱导定形内胚层细胞的形成。第2阶段:用合适的因子处理从第1阶段得到的细胞,以诱导细胞形成为表达原肠管细胞的特征的标记物。第3阶段:用合适的因子处理从第2阶段细胞得到的细胞,以诱导其进一步分化成表达前肠内胚层细胞的特征性标记物的细胞。第四阶段:用合适的因子处理从第3阶段得到的细胞,以诱导其进一步分化成表达胰腺内胚层细胞的特征性标记物的细胞。将所述细胞任选地进一步在第4阶段后期时在空气-液体界面处或悬浮培养物中培养;对于第4阶段后期,将细胞转移至空气-液体界面或聚集为悬浮培养的簇。第5阶段:用合适的因子处理从第4阶段得到的细胞,所述因子在某些实施方案中包括:(i)t3、t4或其类似物中的一种或多种;(ii)alk5抑制剂;或(iii)(i)和(ii)两者,并且任选地在空气-液体界面处或悬浮液中培养,以诱导其分化成表达胰腺内胚层/内分泌前体细胞的特征性标记物的细胞。第6阶段:用合适的因子处理从第5阶段细胞得到的细胞,所述因子在某些实施方案中包括:(i)t3、t4或其类似物中的一种或多种;(ii)alk5抑制剂;(iii)γ分泌酶抑制剂、rsk抑制剂、骨形态发生蛋白(bmg)受体抑制剂以及dot1l的蛋白甲基转移酶抑制剂中的一种或多种;(iv)(i)和(ii)两者;(v)(i)、(ii)和(iii);(vi)(i)和(iii);或(vii)(ii)和(iii),并且任选地在空气-液体界面处或悬浮液中培养,以诱导其分化成表达胰腺内分泌细胞(特别是不成熟β细胞)的特征性标记物的细胞。第7阶段:用合适的因子处理从第6阶段细胞得到的细胞,所述因子在某些实施方案中包括:(i)t3、t4或其类似物中的一种或多种;(ii)alk5抑制剂;(iii)抗氧化剂;(iv)极光激酶抑制剂、rsk抑制剂以及dot1l的蛋白甲基转移酶抑制剂中的一种或多种;(v)(i)和(ii);(vi)(i)和(iii);(vii)(i)和(iv);(viii)(ii)和(iii);(ix)(ii)和(iv);(x)(i)、(ii)和(iii);(xi)(i)、(iii)和(iv);(xii)(ii)、(iii)和(iv);(xiii)(i)、(ii)和(iv);(xiv)(iii)和(iv);或(xv)(i)、(ii)、(iii)以及(iv),并且在空气-液体界面处或悬浮液中培养,以诱导其形成功能性β细胞即胰腺内分泌细胞,该胰腺内分泌细胞表达单激素胰岛素并且是pdx1、nkx6.1、ucn3、slc2a1和mafa阳性的而且具有比第6阶段细胞更高的mafa表达水平,并且所得细胞群具有比第6阶段细胞更高百分比的mafa阳性和单激素胰岛素表达细胞。虽然在某些实施方案中本发明涵盖使多能干细胞(例如,第1阶段之前的细胞)分化成第7阶段细胞,但是本发明也涵盖使其它阶段的细胞向第7阶段分化。具体地,本发明涵盖第4阶段细胞至第7阶段细胞的分化。虽然上文将分化过程描述为独立的阶段,但处理和经历分化过程的细胞的进程可能是依次或连续的。多能干细胞向第6阶段细胞或第7阶段细胞的分化可在悬浮培养物中进行。可通过将处理过的细胞群暴露于可特异性识别由感兴趣的分化细胞表达的蛋白质标记物的试剂,诸如抗体来确定分化效率。用于评估对经培养的或经分离的细胞中的蛋白质标记和核酸标记的表达的方法为本领域的标准方法。这些方法包括rt-pcr、northern印迹、原位杂交(参见例如,currentprotocolsinmolecularbiology(ausubel等人编辑,2001增刊))以及免疫测定法,例如分段材料的免疫组织化学分析,western印迹、以及用于未受损细胞中容易获得的标记物的流式细胞分析(facs)(参见例如harlow和lane,usingantibodies:alaboratorymanual,newyork:coldspringharborlaboratorypress(1998))。还可将已分化细胞进一步纯化。例如,在用本发明的方法处理多能干细胞后,可通过使处理过的细胞群暴露于特异性识别由经纯化的分化细胞特征性表达的蛋白质标记物的试剂(诸如抗体)来纯化已分化的细胞。在某些实施方案中,分化的细胞是未经纯化的。含有足够量的细胞分化所需的维生素、矿物质、盐、葡萄糖、氨基酸和载体蛋白的任何合适的生长培养基可用于第1阶段至第7阶段中的各个阶段。优选地,使用以下项:第1阶段—mcdb-131(购自lifetechnologiescorporation,grandisland,ny)或rpmi(购自sigma-aldrich);第2阶段—mcdb-131或dulbecco改良的eagle培养基f12(“dmem-f12”);第3阶段至第5阶段—mcdb-131、blar(表1和表iv)、或dmem;以及第6阶段和第7阶段—blar或cmrl(lifetechnologies)。优选地,对于第1阶段至第4阶段,培养基的葡萄糖浓度保持在或更优选地低于约10mm;并且对于第5阶段至第7阶段,培养基的葡萄糖浓度保持在大于约10mm。优选地对于第7阶段,培养基包含足够量的维生素、非必需氨基酸、脂质、丙酮酸钠以及微量元素,例如制剂i。第1阶段:多能细胞分化成表达定形内胚层细胞的特征性标记物的细胞。可采用本领域已知的方法或本发明提出的方法,使多能干细胞分化成表达定形内胚层细胞的特征性标记物的细胞。被报道为可用于使多能干细胞分化成表达定形内胚层谱系的特征性标记物的细胞的方法公开于:d’amour等人,naturebiotechnology23,1534-1541(2005);shinozaki等人,development131,1651-1662(2004);mclean等人,stemcells25,29-38(2007);以及d’amour等人,naturebiotechnology24,1392-1401(2006)。另外合适的分化方法公开于:美国专利申请公布2007/0254359;美国专利申请公布2009/0170198;美国专利申请公布2011/0091971;美国专利申请公布2010/0015711;美国专利申请公布2012/0190111;美国专利申请公布2012/0190112;以及美国专利申请公布2012/0196365。这些公开内容全文以引用方式并入本文中,因为它们涉及多能干细胞分化成定形内胚层细胞。在一个实施方案中,用合适的生长培养基处理多能细胞,优选地为mcdb-131或rpmi。该培养基优选地补充有生长分化因子(诸如生长分化因子8(“gdf8”))和糖原合成酶激酶-3β(“gsk3β”)抑制剂(诸如在美国专利申请公布2010/0015711中公开的环苯胺-吡啶三嗪化合物,该专利全文以引用方式并入本文),以诱导其分化成表达定形内胚层细胞的特征性标记物的细胞。优选的gsk3β抑制剂是14-丙-2-烯-1-基-3,5,7,14,17,23,27-七氮杂四环[19.3.1.1~2,6~.1~8,12~]二十七-1(25),2(27),3,5,8(26),9,11,21,23-壬-16-酮(“mcx化合物”)。处理可涉及使多能干细胞与补充有约50ng/ml至约150ng/ml、或者约75ng/ml至约125ng/ml、优选地约100ng/ml的gdf8的培养基接触。处理还可涉及使细胞与约0.1μm至约5μm、或者约0.5μm至约2.5μm,优选地约1μm的mcx化合物接触。可将多能细胞培养约二至五天,优选地约二至三天,以促进其分化成表达定形内胚层细胞的特征性标记物的细胞。在一个优选的实施方案中,在gdf8和mcx化合物的存在下培养细胞一天,接着在gdf8和较低浓度的mcx化合物的存在下培养细胞一天,接着在存在gdf8并且缺乏mcx化合物的情况下培养细胞一天。具体地,将细胞在gdf8和约1μm的mcx化合物的存在下培养一天,接着在gdf8和约0.1μm的mcx化合物的存在下培养一天,接着在存在gdf8并且缺乏mcx化合物的情况下培养一天。另选地,可将细胞在gdf8和约1μmmcx化合物的存在下培养一天,然后在gdf8和约0.1μmmcx化合物的存在下培养一天。另选地,可将多能干细胞在含有活化素a的培养基中在不存在血清的情况下培养,然后将所述细胞与活化素a和血清一起培养,然后将所述细胞与活化素a和另一浓度的血清一起培养,如d’amour等人,naturebiotechnology23,1534-1541(2005)中所公开。在另一替代形式中,可通过将多能干细胞在含有活化素a的培养基中在不存在血清的情况下培养,然后将所述细胞与活化素a和血清一起培养,使多能干细胞分化成表达定形内胚层细胞的特征性标记物的细胞,如d’amour等人,naturebiotechnology,2005中所公开。也可通过将多能干细胞在含有活化素a和wnt配体的培养基中在不存在血清的情况下培养,然后去除wnt配体并将所述细胞与活化素a和血清一起培养,使多能干细胞分化成表达定形内胚层谱系的特征性标记物的细胞,如d’amour等人,naturebiotechnology24,1392-1401(2006)中所公开。在本发明的一个实施方案中,用活化素a和wnt3a处理多能干细胞,以导致形成表达定形内胚层细胞的特征性标记物的细胞。处理可涉及使多能干细胞与约50ng/ml至约150ng/ml、或者约75ng/ml至约125ng/ml、或者约100ng/ml的活化素a接触。处理还可涉及使所述细胞与约10ng/ml至约50ng/ml、或者约15ng/ml至约30ng/ml、或者约20ng/ml的wnt3a接触。可将多能细胞培养三天左右以获得定形内胚层细胞。在一个实施方案中,在活化素a和wnt3a的存在下培养细胞一天,接着在活化素a(不存在wnt3a)的存在下培养细胞剩余的时间。为了检测表达定形内胚层细胞的特征性标记物的细胞的形成,可在实施特定方案前后测试细胞是否存在标记物。多能干细胞通常不表达此类标记物。因此,在细胞开始表达定形内胚层的特征性标记物后,就能够检测到多能细胞的分化。第二阶段:使表达定形内胚层细胞的特征性标记物的细胞分化成表达原肠管细胞的特征性标记物的细胞。可使表达定形内胚层细胞的特征性标记物的细胞进一步在生长培养基(诸如mcdb-131或dmem-f12)中分化成表达肠管细胞的特征性标记物的细胞。在一个实施方案中,表达肠管细胞的特征性标记物的细胞的形成包括:用包含成纤维细胞生长因子(“fgf”),优选fgf7或fgf10的培养基来培养表达定形内胚层细胞的特征性标记物的细胞,从而分化细胞。例如,细胞培养物可包含约10ng/ml至约75ng/ml,或者约25ng/ml至约75ng/ml,又或者约30ng/ml至约60ng/ml,或者约50ng/ml的成纤维细胞生长因子,优选地为fgf7或fgf10,更优选地为fgf7,并且最优选地为约25ng/mlfgf7。可在这些条件下培养所述细胞约二至三天,优选地约两天。在另一个实施方案中,表达肠管细胞的特征性标记物的细胞的形成包括:用成纤维细胞生长因子,优选地fgf7或fgf10,和抗坏血酸(维生素c)来培养表达定形内胚层谱系的特征性标记物的细胞。该培养基可包含约0.1mm至约0.5mm的抗坏血酸、或者约0.2mm至约0.4mm的抗坏血酸、或者约0.25mm的抗坏血酸。细胞培养物还可包含约10ng/ml至约35ng/ml、或者约15ng/ml至约30ng/ml、或者约25ng/ml的成纤维细胞生长因子,优选地fgf7或fgf10,更优选地fgf7。例如,该细胞培养物可包含约0.25mm的抗坏血酸和约25ng/ml的fgf7。在一个实施方案中,用fgf7和抗坏血酸处理第1阶段细胞2天。第3阶段:表达原肠管细胞的特征性标记物的细胞分化成表达前肠内胚层细胞的特征性标记物的细胞通过在生长培养基(诸如mcdb-131、dmem)或定制培养基(诸如blar)中培养这些细胞,可以将从第2阶段得到的原肠管细胞进一步分化成第3阶段细胞或表达前肠内胚层特征性标记物的细胞(表i)。培养基可补充有:(i)成纤维细胞生长因子,优选地fgf7或fgf10,并且更优选地fgf7;(ii)视黄酸(“ra”);(iii)音猬因子(“shh”)信号转导途径拮抗剂,诸如smoothened拮抗剂1(“sant-1”),即1-氨基哌嗪,n-[(3,5-二甲基-1-苯基-1h-吡唑-4-基)亚甲基]-4-(苯基甲基)-或((e)-4-苄基-n-((3,5-二甲基-1-苯基-1h-吡唑-4-基),亚乙基-哌嗪-1-胺);hpi-1,即2-甲氧基乙基1,4,5,6,7,8-六氢-4-(3羟基苯基)-7-(2-甲氧基苯基)-2-甲基-5-氧代-3-喹啉甲酸酯,并优选地sant-1;(iv)蛋白激酶c(“pkc”)活化剂,诸如((2s,5s)-(e,e)-8-(5-(4-(三氟甲基)苯基)-2,4-戊二烯酰基氨基)苯并内酰胺)(“tpb”)、佛波醇-12,13-二丁酸酯(“pdbu”)、佛波醇-12-肉豆蔻酸酯-13-乙酸酯(“pma”)或indolactamv(“ilv”),并优选地tpb;(v)骨形态发生蛋白(“bmp”)抑制剂,诸如ldn-193189、头蛋白、或脊索发生素,并优选地ldn-193189;以及(vi)抗坏血酸。另选地,smoothened(“smo”)受体抑制剂(诸如mrt10(n[[[3-苯甲酰基氨基)苯基]氨基]硫代甲基]-3,4,5-三甲氧基苯甲酰胺))或环巴胺也可使用。例如,细胞培养物可包含约100nm至约500nm,或者约100nm至约400nm,或者约200nm的pkc活化剂。可在存在这些生长因子、小分子激动剂和拮抗剂的情况下培养细胞约二至四天,优选地约二至三天,更优选地约两天。另选地,第3阶段细胞可通过以下步骤获自第2阶段细胞:在补充有smo受体抑制剂、sant-1、视黄酸、以及头蛋白的培养基中培养这些细胞。可将细胞培养约二至四天,优选地约两天。在一个实施方案中,该培养基补充有约10ng/ml至约35ng/ml、或者约15ng/ml至约30ng/ml、或者约25ng/ml的成纤维细胞生长因子,优选地fgf7或fgf10,更优选地fgf7;约0.1mm至约0.5mm抗坏血酸,或者约0.2mm至约0.4mm、或者约0.25mm的抗坏血酸;约0.1μm至约0.4μm的sant-1;约100至约300nm的tpb;以及约50nm至约200nm,和约100nm的ldn-193189。在另一个实施方案中,该培养基补充有约25ng/ml的fgf-7、约1μm视黄酸、约0.25μm的sant-1、约200nm的tpb、约100nm的ldn-193189和约0.25mm的抗坏血酸。在一个实施方案中,该培养基补充有约0.1μm至约0.3μmsant-1、约0.5μm至约3μm视黄酸,和约75ng/ml至约125ng/ml头蛋白。第4阶段:使表达前肠内胚层细胞的特征性标记物的细胞分化成表达胰腺内胚层细胞的特征性标记物的细胞。在一个实施方案中,本发明的方法包括通过用分化培养基处理第3阶段细胞而衍生得到第4阶段细胞,该分化培养基可为任何合适的生长培养基并且优选地为mcdb-131、dmem或定制培养基诸如blar(表i)。该培养基可补充有以下中的一种或多种:(a)alk5抑制剂,其选自:tgf-β受体抑制剂v、tgf-β受体抑制剂i、tgf-β受体抑制剂iv、tgf-β受体抑制剂vii、tgf-β受体抑制剂viii、tgf-β受体抑制剂ii、tgf-β受体抑制剂vi、tgf-β受体抑制剂iii、tgf-β抑制剂sb431542、sd-208、itd-1、ly2109761、a83-01、ly2157299、alk5i和alk5抑制剂ii;(b)甲状腺激素,其选自t3、t4、t3类似物、t4类似物、以及它们的混合物;(c)shh信号转导途径拮抗剂,其选自sant-1或hip-1;(d)bmp受体抑制剂,其选自ldn-193189、头蛋白或脊索发生素;(e)pkc活化剂,其选自tpb、ppbu、pma和ilv;(f)成纤维细胞生长因子,其选自fgf-7或fgf-10;(g)视黄酸;以及(h)抗坏血酸。例如,生长培养基,诸如mcdb131或优选地blar,可补充有shh信号转导途径拮抗剂(诸如sant-1或hpi-1)、bmp抑制剂(诸如ldn-193189、头蛋白或脊索发生素)、抗坏血酸,以及pkc活化剂(诸如tpb、pdbu、pma或ilv),以提供可用的分化培养基。在此类培养基中培养第3阶段细胞约二至四天,优选地约二至三天,更优选地约三天通常足以使第3阶段细胞分化成第4阶段细胞。在另一个实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂。在一个优选的实施方案中,可用补充有以下项的培养基处理第3阶段细胞三天:约0.25μmsant-1;约100nmra;约2ng/mlfgf7;约100nmldn-193189;约0.25mm抗坏血酸;以及约200nm的tpb。在第4阶段中,在整个阶段期间或在平面培养约2至3天后,细胞可以在空气-液体界面处培养。具体地,本发明提供了用于使衍生自多能干细胞的细胞在空气-液体界面处分化的体外细胞培养物,所述体外细胞培养物包括:(a)培养容器;(b)在所述容器内一定体积的生长培养基,所述体积足以填充该容器的体积的仅一部分;(c)该容器内的空气,所述空气填充该容器邻接培养基的部分;(d)多孔基质,所述多孔基质定位在培养基和空气之间的界面处;以及(e)置于基质表面上的衍生自多能干细胞的细胞,使得培养基仅接触细胞表面的一部分。另选地,第4阶段可完全在平面培养物中进行。另选地,在第4阶段中,平面培养约2至3天之后,细胞可聚集为细胞簇。具体地,本发明提供了用于使所制备的细胞分化为聚集细胞诸如细胞簇的体外细胞培养物,所述体外细胞培养物包括:(a)有利于细胞聚集或形成细胞簇的培养容器;(b)所述容器内一定体积的生长培养基(培养基);以及(c)置于该容器内的衍生自多能干细胞的细胞,使得诱导细胞聚集并形成簇。在实施方案中,容器是带有孔或微孔的平板,诸如aggrewelltm板(微孔板;stemcelltechnologiesinc.,vancouver,canada)。具体地,在带有微孔的平板中,例如使用aggrewelltm板制备细胞簇,以形成均一尺寸和形状的细胞聚集体。在一些实施方案中,每个孔或微孔接种约500至2000个细胞来制备聚集细胞或细胞簇。具体地,每个孔或微孔接种约50至约3000个细胞,优选地接种约50至约2000个细胞,约50至1000个细胞,约50至约900个细胞,约50至约800个细胞,约100至约800个细胞,约250至约800个细胞,或约500至约800个细胞。更优选地,每个孔或微孔接种约700至约800个细胞。在另一个实施方案中,可将细胞聚集法所形成的细胞簇进一步在悬浮液(悬浮培养物)中培养,包括从孔或微孔移除聚集细胞或细胞簇,并将聚集细胞/细胞簇接种到悬浮培养容器中。在实施方案中,将聚集细胞/细胞簇以约0.75×106个细胞/ml至约2.0×106个细胞/ml,优选地约1×106个细胞/ml至约2.0×106个细胞/ml,更优选地约1.5×106个细胞/ml至约2.0×106个细胞/ml的细胞密度接种到悬浮培养物中。本领域技术人员已知的任何悬浮培养系统均可用于悬浮培养聚集细胞。具体地,悬浮培养系统可包括在烧瓶(诸如旋转摇瓶或旋转轮烧瓶)中接种聚集细胞或细胞簇。在另一个实施方案中,在第4阶段完成时(培养2天或3天后)可用rho相关激酶(“rock”)抑制剂处理细胞,所述抑制剂诸如y27632((1r,4r)-4-((r)-1-氨基乙基)-n-(吡啶-4-基)环己甲酰胺)、gsk269962(n-[3-[[2-(4-氨基-1,2,5-噁二唑-3-基)-1-乙基-1h-咪唑并[4,5-c]吡啶-6-基]氧]苯基]-4-[2-(4-吗啉基)乙氧基]苯甲酰胺)、h1152((s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰]高哌嗪二盐酸盐)和sr3677(n-[2-[2-(二甲氨基)乙氧基]-4-(1h-吡唑-4-基)苯基-2,3-二氢-1,4-苯并二氧杂苯-2-甲酰胺二盐酸盐)。在某些实施方案中,可使用约1μm至20μm,约1μm至15μm,约1μm至10μm或约10μm的rock抑制剂。在本发明的某些实施方案中,仅第4阶段后期的细胞,例如已在贴壁平面培养物中培养1至2天或1至3天的细胞,可随后在空气-液体界面处培养或培养为聚集细胞(诸如细胞簇)以便完成第4阶段。在本发明的一个实施方案中,在第4阶段的后期在空气-液体界面处培养用rock抑制剂处理过的细胞。在一些实施方案中,接种0.5至约0.75×105个细胞/微升以在空气-液体界面处培养;另选地,接种约2至6×106个细胞以在空气-液体界面处培养。在另一个实施方案中,培养经rock抑制剂处理的第4阶段后期细胞以使细胞聚集形成聚集细胞,诸如细胞簇。在实施方案中,将细胞接种到有利于细胞聚集或成细胞簇(细胞的三维聚集体)的容器中。在一些实施方案中,容器是带有孔或微孔的平板。具体地,在带有微孔的平板中,例如使用aggrewelltm板(stemcelltechnologiesinc.,vancouver,canada)制备细胞簇,以形成均一尺寸和形状的细胞聚集体。在一些实施方案中,每个孔或微孔接种约50至3000个细胞来制备聚集细胞或细胞簇。具体地,每个孔或微孔接种约50至约3000个细胞,优选地接种约50至约2000个细胞,约50至1000个细胞,50至900个细胞,50至800个细胞,100至800个细胞,250至800个细胞,或约500至约800个细胞。更优选地,每个孔或微孔接种约700至800个细胞。在另一个实施方案中,将聚集细胞或细胞簇进一步悬浮培养。在某些实施方案中,在空气-液体界面处培养或者培养成聚集细胞例如形成细胞簇之前,可用细胞脱附溶液处理平面培养物中的贴壁细胞,所述细胞脱附溶液为诸如包含蛋白水解酶和胶原蛋白酶(诸如trypletm、accutasetm或dispasetm)的溶液。在一个另选的实施方案中,可通过用包含补充有alk5抑制剂、头蛋白和pkc活化剂(诸如tpb)的生长培养基的分化培养基处理第3阶段细胞,从第3阶段细胞获得第4阶段细胞。在某些实施方案中,培养基可补充有约0.1μm的alk5抑制剂、约100ng/ml的头蛋白、以及约500nm的tpb。细胞培养物可为单层形式。处理可持续总共约三天。在某些实施方案中,可将细胞处理两天,然后可在最后一天用蛋白水解酶、胶原酶或这两者处理细胞,产生单细胞悬浮液。可将所得的细胞接种在空气-液体界面处或接种产生聚集细胞或细胞簇。单细胞可聚集成直径小于约100微米的细胞簇,然后在alk5抑制剂和ldn-193189存在下进行培养。在某些实施方案中,可在补充有约200nm的alk5抑制剂和约100nm的ldn-193189的培养基中培养直径小于约100微米的细胞簇。在一个另选的实施方案中,在空气-液体界面处或悬浮液中培养第4阶段细胞可显著增加胰腺内胚层标记物连同内分泌相关标记物。第5阶段:使表达胰腺内胚层细胞的特征性标记物的细胞分化成表达胰腺内分泌前体细胞的特征性标记物的细胞。在一个实施方案中,本发明的方法包括通过用分化培养基处理第4阶段细胞产生第5阶段细胞,该分化培养基可为任何合适的生长培养基并且优选地为mcdb-131、dmem或定制培养基诸如blar(表i)。培养基可补充有以下中的一种或多种:(a)alk5抑制剂,其选自:tgf-β受体抑制剂v、tgf-β受体抑制剂i、tgf-β受体抑制剂iv、tgf-β受体抑制剂vii、tgf-β受体抑制剂viii、tgf-β受体抑制剂ii、tgf-β受体抑制剂vi、tgf-β受体抑制剂iii、tgf-β抑制剂sb431542、sd-208、itd-1、ly2109761、a83-01、ly2157299、alk5i和alk5抑制剂ii;(b)甲状腺激素,其选自t3、t4、t3类似物、t4类似物、以及它们的混合物;(c)shh信号转导途径拮抗剂,其选自sant-1或hip-1;(d)bmp受体抑制剂,其选自ldn-193189、头蛋白或脊索发生素;(e)视黄酸;(f)抗坏血酸;(g)肝素;以及(h)硫酸锌,并且优选地在空气-液体界面处培养细胞约两天至四天,优选地约三天,以使细胞分化成第5阶段细胞。在另一个实施方案中,生长培养基还补充有smo抑制剂(诸如mrt10或环巴胺)和选自fgf-7或fgf-10的成纤维细胞生长因子中的一者或两者。对第4阶段细胞的处理进行约二至四天,优选地约三天以将细胞分化成第5阶段细胞。在一个优选的实施方案中,第4阶段细胞通过用补充有以下物质的培养基处理细胞来分化成第5阶段细胞:约0.1μm至约0.4μm的sant-1并且优选约0.25μm的sant-1,约50nm的ra,约0.1mm至约0.5mm的抗坏血酸、或者约0.2mm至约0.4mm并且优选地约0.25mm的抗坏血酸,约50nm至约200nm并且优选地约100nm的ldn-193189,约1μm的t3,以及约10000nm的alk5抑制剂、更优选地alk5抑制剂ii。在另外的实施方案中,细胞还任选用以下物质处理:约1μm至15μm、或者约1μm至10μm、或者约5μm至10μm、优选地约10μm的硫酸锌(znso4)以及约1μg/ml至100μg/ml,优选地约10μg/ml的肝素。对第4阶段细胞的处理进行约二至四天,优选地约3天以将细胞分化成第5阶段细胞。在另一个实施例中,本发明的方法包括通过如下过程获得第5阶段细胞:用补充有肝素、smo抑制剂或shh信号转导途径拮抗剂、ra、bmp受体抑制剂和alk5抑制剂的培养基处理第4阶段细胞,并在空气-液体界面处培养细胞约3天,以使所述细胞分化成第5阶段细胞。在另选的实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂两者,连同ra、bmp受体抑制剂和alk5抑制剂。因此,在一个实施方案中,可通过用补充有肝素、znso4、smo抑制剂或shh信号转导途径拮抗剂、ra、ldn-193189和alk5抑制剂ii的培养基处理第4阶段细胞,使第4阶段细胞分化成第5阶段细胞。在另选的实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂两者。在一个实施方案中,通过用补充有约10μg/ml的肝素、约0.25μm的sant-1、约50nm的ra、约50nm的ldn-193189、约10nm的t3和约1000nm的alk5抑制剂的培养基处理细胞,使第4阶段细胞分化成第5阶段细胞。合适的alk5抑制剂包括但不限于sd-208、alk5抑制剂ii、tgf-β受体抑制剂v、tgf-β受体抑制剂i、tgf-β受体抑制剂iv、tgf-β受体抑制剂vii、tgf-β受体抑制剂viii、tgf-β受体抑制剂ii、tgf-β受体抑制剂vi、tgf-β受体抑制剂iii,以及它们的组合。对第4阶段细胞的处理进行约二至四天,优选地约3天以将细胞分化成第5阶段细胞。在一个优选的实施方案中,alk5抑制剂为alk5抑制剂ii。在另一个优选的实施方案中,使用约10000nm的alk5抑制剂ii。在一个另选的优选实施方案中,用补充有约10μg/ml的肝素、约0.25μm的sant-1、约50nm的ra、约100nm的ldn-193189,以及约10,000nm(10mm)的alk5抑制剂ii的培养基处理第4阶段细胞。在另一个另选的实施方案中,本发明的方法包括:用补充有smo抑制剂或shh信号转导途径拮抗剂、ra以及alk5抑制剂的培养基处理第4阶段细胞,以及优选地在空气-液体界面处或悬浮液中培养细胞约两天至四天,优选地约3天,以使所述细胞分化成第5阶段细胞。在一个另选的实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂两者。在一个实施方案中,通过用补充有约0.25μm的sant-1、约50nm的ra、约50nm的ldn-193189、约1μm的t3和约1000nm的alk5抑制剂的培养基处理细胞,使第4阶段细胞分化成第5阶段细胞。用于在空气-液体界面处培养的接种细胞量可变化。例如,为了在空气-液体界面处培养细胞,可将含有约0.5至6×105个细胞/μl的单细胞悬浮液的液滴接种在多孔基质(例如,过滤器)上。悬浮液可包含可接种到多孔基质(诸如定位在空气-液体界面处的滤器)上的约2×105个细胞/μl至约6×105个细胞/μl;约4×105个细胞/μl至约6×105个细胞/μl;约5×105个细胞/μl至约6×105个细胞/μl;约5×105个细胞/μl至约6×105个细胞/μl;约2×105个细胞/μl至约5×105个细胞/μl;约2×105个细胞/μl至约4×105个细胞/μl;或约3×105个细胞/μl。在一些实施方案中,将包含约0.5×105个细胞/μl至约0.75×105个细胞/μl;约0.6×105个细胞/μl至约0.75×105个细胞/μl;或约0.5×105细胞/μl至约0.6×105细胞/μl的单细胞悬浮液的液滴接种到多孔载体上以在ali处培养。对于悬浮培养,在带有微孔的平板中产生细胞簇,随后接种至悬浮培养系统。在一些实施方案中,aggrewelltm板用于诱导聚集,其中每个孔或微孔接种约50至3000个细胞以制备聚集细胞或细胞簇。具体地,每个孔或微孔接种约50至约3000个细胞,优选地接种约50至约2000个细胞,约50至1000个细胞,约50至约900个细胞,约50至约800个细胞,约100至约800个细胞,约250至约800个细胞,或约500至约800个细胞。更优选地,每个孔或微孔接种约700至约800个细胞。将聚集细胞/细胞簇以约0.75×106个细胞/ml至约2.0×106个细胞/ml,优选地约1×106个细胞/ml至约2.0×106个细胞/ml,约1.25×106个细胞/ml至约2.0×106个细胞/ml,并且更优选地约1.5×106个细胞/ml至约2.0×106个细胞/ml的细胞密度接种到悬浮培养物中。在另一个实施方案中,本发明的方法包括:用补充有bmp受体抑制剂(例如,ldn-193189、头蛋白或脊索发生素)和alk5抑制剂的培养基处理第4阶段细胞约1天,以使第4阶段细胞分化成第5阶段细胞。例如,培养基可补充有约100nm的ldn-193189和约100nm的alk5抑制剂以及约1μm的t3。细胞可为贴壁平面培养物或簇形式。在某些实施方案中,在空气-液体界面处培养或者培养形成聚集细胞或细胞簇之前,可用细胞脱附溶液处理细胞,所述细胞脱附溶液为诸如包含蛋白水解酶和胶原蛋白酶的溶液。根据前述方法,本发明还提供了用于使表达胰腺内胚层的特征性标记物的细胞分化成表达胰腺内分泌前体细胞(胰腺内胚层/胰腺内分泌前体细胞)的特征性标记物的细胞的细胞培养物,所述细胞培养物包括:(a)培养容器;(b)在所述容器内一定体积的生长培养基,所述体积足以填充所述容器的体积的仅一部分;(c)所述容器内的空气,所述空气填充所述容器邻接所述培养基的部分;(d)多孔基质,所述多孔基质定位在所述培养基和所述空气之间的界面处;以及(e)置于所述基质表面上的衍生自多能干细胞的表达胰腺内胚层细胞的特征性标记物的细胞,使得所述培养基仅接触所述细胞的表面的一部分。根据前述方法,另选地本发明还提供了用于使表达胰腺内胚层的特征性标记物的细胞分化成表达胰腺内分泌前体细胞(胰腺内胚层/胰腺内分泌前体细胞)的特征性标记物的细胞的细胞培养物,所述细胞培养物包括:(a)有利于细胞聚集或形成细胞簇的培养容器;(b)所述容器内一定体积的生长培养基(培养基);(c)置于容器内的衍生自多能干细胞的细胞,使得诱导细胞聚集并形成簇;以及(d)置于悬浮液(悬浮培养物)内的所产生细胞簇。在实施方案中,用于细胞聚集的容器是带有孔或微孔的平板,诸如aggrewelltm板(微孔板;stemcelltechnologiesinc.,vancouver,canada)。在一些实施方案中,悬浮培养系统可包括在悬浮培养容器(诸如烧瓶,例如旋转摇瓶或旋转轮烧瓶)中接种聚集细胞或细胞簇。第6阶段:使表达胰腺内分泌前体细胞的特征性标记物的细胞分化成表达不成熟β细胞的特征性标记物的细胞。在一个实施方案中,本发明的方法包括通过用分化培养基处理第5阶段细胞获得第6阶段细胞,该分化培养基可为任何合适的生长培养基,优选地诸如mcdb-131或cmrl,并且更优选定制培养基诸如blar(表i)。该培养基可补充有以下中的一种或多种:(a)alk5抑制剂,其选自:tgf-β受体抑制剂v、tgf-β受体抑制剂i、tgf-β受体抑制剂iv、tgf-β受体抑制剂vii、tgf-β受体抑制剂viii、tgf-β受体抑制剂ii、tgf-β受体抑制剂vi、tgf-β受体抑制剂iii、tgf-β抑制剂sb431542、sd-208、itd-1、ly2109761、a83-01、ly2157299、alk5i和alk5抑制剂ii;(b)甲状腺激素,其选自t3、t4、其类似物以及其的混合物;(c)bmp受体抑制剂,优选地选自ldn-193189、头蛋白或脊索发生素;(d)γ分泌酶抑制剂,如γ分泌酶抑制剂xx、γ分泌酶抑制剂xxi、γ分泌酶抑制剂xvi、或dapt;(e)抗坏血酸;(f)肝素;以及(g)硫酸锌。可将细胞优选地在空气-液体界面处或悬浮培养物中培养约两天至四天,优选地约三天,以使第5阶段细胞分化成第6阶段细胞。任选地,培养基还可补充有shh信号转导途径拮抗剂、smoothened受体抑制剂、成纤维细胞生长因子和视黄酸中的一种或多种。在一个优选的实施方案中,可通过用补充有约50nm的ra、约0.25mm的抗坏血酸、约100nm的ldn-193189、约10,000nm的alk5抑制剂并且优选地alk5抑制剂ii、1μm的t3、约100nm的γ分泌酶抑制剂的培养基处理约七天,使第5阶段细胞分化成第6阶段细胞。另选地,可通过用补充有约0.25μm的sant-1、约50nm的ra、约0.25mm的抗坏血酸、约1000nm的alk5抑制剂和1μm的t3的培养基处理第5阶段细胞约三天,使其分化成第6阶段细胞。可根据需要,将细胞在此类培养基中再培养两天或以上。另选地,可通过用补充有肝素、smo抑制剂或shh信号转导途径拮抗剂、bmp抑制剂、t3、t4、其类似物及其混合物,以及alk5抑制剂的培养基处理并且优选地在空气-液体界面处或悬浮培养物中培养约一至七天,或者约六天,或者约七天,使第5阶段细胞分化成第6阶段细胞。在一个另选的实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂两者。例如,细胞可在补充有约10μg/ml的肝素、约0.25μm的sant-1、约100nm的ldn-193189、约1000nm的t3、以及约500nm至约10,000nm,或者约500nm,或者约1000mm,并且或者约10,000nm的alk5抑制剂的培养基中培养。合适的alk5抑制剂包括但不限于sd-208、alk5抑制剂ii、tgf-β受体抑制剂v、tgf-β受体抑制剂i、tgf-β受体抑制剂iv、tgf-β受体抑制剂vii、tgf-β受体抑制剂viii、tgf-β受体抑制剂ii、tgf-β受体抑制剂vi、tgf-β受体抑制剂iii,以及它们的组合。在一个优选的实施方案中,alk5抑制剂为alk5抑制剂ii。在更优选的实施方案中,使用约10,000nm(10mm)的alk5抑制剂ii。因此,在一个实施方案中,可通过用补充有肝素、smo抑制剂或shh信号转导途径拮抗剂、bmp抑制剂、t3、t4、其类似物及其混合物,以及alk5抑制剂的培养基处理并且优选地在空气-液体界面处或悬浮液中优选地培养约七天,使第5阶段细胞分化成第6阶段细胞。在一个另选的实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂两者。在某些实施方案中,在空气-液体界面处或悬浮液中培养之前,可用细胞脱附溶液处理细胞,所述细胞脱附溶液为诸如包含蛋白水解酶和胶原蛋白酶的溶液。在另一个实施方案中,可通过用补充有肝素、smo抑制剂或shh信号转导途径拮抗剂、bmp抑制剂、t3和alk5抑制剂ii的培养基处理并且在空气-液体界面处培养约5天至约7天,或者约5天,或者约6天,或者约7天,使第5阶段细胞分化成第6阶段细胞。在这些实施方案中,培养基可补充有约10μg/ml的肝素、约0.25μm的sant-1、约100nm的ldn-193189、约1000nm的t3以及约10,000nm的alk5抑制剂ii。在某些实施方案中,培养基还可补充有硫酸锌(znso4)。例如,培养基可进一步补充有约10mm的znso4。在一个另选的实施方案中,培养基可补充有smo抑制剂和shh信号转导途径拮抗剂两者。在本发明的特别优选的实施方案中,将极光激酶抑制剂优选地极光激酶抑制剂ii、rsk抑制剂优选地rsk抑制剂ii,以及dot1l的蛋白质甲基转移酶抑制剂优选地epz-5676中的一者或多者添加到培养基中。对于极光激酶和rsk抑制剂,所添加的量可为约100nm至5000nm,或者约1000nm至5000nm,或者约2000nm至5000nm,或者约3000nm至5000nm,并且优选地约1000nm至2000nm,并且对于dot1l抑制剂,所添加的量为约100nm至1000nm,并且更优选地1μm至约10nm。根据前述方法,本发明还提供了一种用于使表达胰腺内胚层/内分泌前体细胞的特征性标记物的细胞分化成表达不成熟β细胞的特征性标记物的细胞的细胞培养物,所述细胞培养物包括:(a)培养容器;(b)在所述容器内一定体积的生长培养基,所述体积足以填充所述容器的体积的仅一部分;(c)所述容器内的空气,所述空气填充所述容器邻接所述培养基的部分;(d)多孔基质,所述多孔基质定位在所述培养基和所述空气之间的界面处。以及(e)置于所述基质表面上的衍生自多能干细胞的表达胰腺内胚层/内分泌前体细胞的特征性标记物的细胞,使得所述培养基仅接触所述细胞的表面的一部分。根据前述方法,另选地本发明还提供了用于使表达胰腺内分泌前体细胞(或胰腺内胚层/内分泌前体细胞)的特征性标记物的细胞分化成表达不成熟β细胞的特征性标记物的细胞的细胞培养物,所述细胞培养物包括:(a)有利于细胞聚集或形成细胞簇的培养容器;(b)所述容器内一定体积的生长培养基(培养基);(c)置于容器内的衍生自多能干细胞的细胞,使得诱导细胞聚集并形成簇;以及(d)置于悬浮液(悬浮培养物)内的所产生细胞簇。在一些实施方案中,用于细胞聚集的容器是带有孔或微孔的平板,诸如aggrewelltm板。在一些实施方案中,悬浮培养系统可包括在悬浮培养容器(诸如烧瓶,例如旋转摇瓶或旋转轮烧瓶)中接种聚集细胞或细胞簇。在一个实施方案中,利用根据本发明的实施方案培养的第5阶段细胞并且使所述细胞分化成第6阶段细胞,而在其它实施方案中,可在当前方法中利用根据其它方案培养的第5阶段细胞,以获得第6阶段和第7阶段细胞。在一个实施方案中,本发明的方法导致第6阶段细胞的形成,所述第6阶段细胞是单激素阳性的。因此,在一个实施方案中,本发明的方法产生共表达nkx6.1、胰岛素、嗜铬粒蛋白和pdx1的第6阶段细胞。在另一个实施方案中,本发明的方法产生共表达nkx6.1和胰岛素的第6阶段细胞。在本发明的某些实施方案中,该方法在第4阶段至第6阶段或第4阶段后期至第6阶段,或第5和第6阶段采用定制培养基blar(参见表i)。培养基可每天更换或另选地每隔一天更换。在另一个实施方案中,本发明涉及形成共表达nkx6.1和嗜铬粒蛋白的第6阶段细胞的方法,所述方法包括在空气-液体界面处或悬浮液中培养第4阶段,优选地第4阶段后期细胞到第6阶段细胞。在另一个实施方案中,本发明涉及通过在空气-液体界面处或悬浮液中培养第4阶段,优选地第4阶段后期细胞到第6阶段细胞来形成表达nkx6.1的第6阶段细胞的单激素胰岛素阳性的细胞的方法。第7阶段:表达不成熟β细胞的特征性标记物的细胞分化成有双相gsis和线粒体呼吸响应能力的表达功能性β细胞的特征性标记物的细胞。在一个实施方案中,本发明的方法包括用分化培养基处理第6阶段细胞七天,该分化培养基可为任何合适的生长培养基,优选地诸如mcdb-131或cmrl,或更优选定制培养基诸如blar001(表1)或blar004(表iv)。该培养基补充有以下中的一种或多种:2.7g/1000ml碳酸氢钠,并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10nm的t3(“低t3”);1mmn-乙酰半胱氨酸(“nac”);0.5μm的zm447439(“zm”);以及下列构成制剂i(“fi”)的组分(表xii)—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学限定的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a(corning,目录号25-021);1:2000稀释的微量元素b(corning,目录号25-022)。可添加以获得第7阶段细胞的附加化合物包括约10nm的t3(“低t3”);5μm5-氮杂胞苷(“azt”)(sigmaaldrich,目录号a2385);或约1μm3-去氮腺嘌呤a(“deza”)(biovision,inc.,目录号2060)。在获得第7阶段细胞的实施方案中,培养基不包含alk5抑制剂。在一个实施方案中,可通过用补充有约10nm的t3、约0.5μm的一种或多种极光激酶抑制剂ii、以及约1mm的n-乙酰基半胱氨酸的培养基处理,使第6阶段细胞分化成第7阶段细胞。另选地,可通过用补充有肝素、t3、t4、其类似物或其混合物、抗氧化剂、以及极光激酶抑制剂、或它们的混合物的培养基处理,并且在空气-液体界面处或悬浮培养物中培养约七天至二十一天、或者约七天至十天、优选地约七天,使第6阶段细胞分化成第7阶段细胞。根据前述方法,本发明还提供了一种用于使表达胰腺内分泌前体细胞的特征性标记物的细胞分化成表达功能性β细胞的特征性标记物的细胞的细胞培养物,所述细胞培养物包括:(a)培养容器;(b)在所述容器内一定体积的生长培养基,所述体积足以填充所述容器的体积的仅一部分;(c)所述容器内的空气,所述空气填充所述容器邻接所述培养基的部分;(d)多孔基质,所述多孔基质定位在所述培养基和所述空气之间的界面处;以及(e)置于所述基质表面上的衍生自多能干细胞的表达胰腺内胚层/内分泌前体细胞的特征性标记物的细胞,使得所述培养基仅接触所述细胞的表面的一部分。在一个实施方案中,利用根据本发明的实施方案培养的第6阶段细胞并且使所述细胞分化成第7阶段细胞,而在其它实施方案中,可在当前方法中利用根据其它方案培养的第6阶段细胞,以获得第7阶段细胞。在另一个实施方案中,本发明的方法导致第7阶段细胞的形成,所述第7阶段细胞是单激素阳性的。因此,在一个实施方案中,本发明的方法产生共表达nkx6.1、嗜铬粒蛋白、pdx1、ucn3、slc2a1和mafa的第7阶段细胞。在另一个实施方案中,本发明的方法产生共表达nkx6.1、pdx1、胰岛素、ucn3、slc2a1和mafa的第7阶段细胞。在另外的实施方案中,产生细胞群,其中至少约10%,或者至少约20%,或者至少约30%,或者至少约40%,或者至少约50%,或者至少约60%,或者至少约70%,或者至少约80%,或者至少约90%的细胞群的细胞中的每个表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在一些实施方案中,所得细胞群的至少10%的细胞表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在其它实施方案中,该群体的至少20%的细胞表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在其它实施方案中,该群体的至少30%的细胞表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在其它实施方案中,该群体的至少40%的细胞表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在其它实施方案中,该群体的至少50%的细胞表达胰岛素、pdx1、nkx6.1和mafa。在其它实施方案中,至少60%、70%、80%或90%的细胞表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在另选的实施方案中,该群体的至少91%、92%、93%、94%、95%、96%、97%、98%或99%的细胞表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa。在本发明的某些优选实施方案和优选实施方案中,该方法在第4阶段至第7阶段或第4阶段后期至第7阶段,或第5、第6和第7阶段采用定制培养基blar(表i)。培养基可优选地每天更换或另选地每隔一天更换。在另一个实施方案中,本发明涉及形成共表达nkx6.1、pdx1、mafa、ucn3、slc2a1和嗜铬粒蛋白的第7阶段细胞的方法,所述方法包括在空气-液体界面处或悬浮液中培养第4阶段,优选地第4阶段后期细胞到第7阶段细胞。在另一个实施方案中,本发明涉及通过在空气-液体界面处或悬浮液中培养第4阶段细胞,优选地第4阶段后期细胞至第7阶段细胞来形成表达nkx6.1、pdx1、ucn3、slc2a1和mafa的第7阶段细胞的单激素胰岛素阳性的细胞(功能性β细胞)的方法。虽然本发明设想在从多能细胞至胰腺内分泌细胞的途径中的所有阶段中在空气-液体界面处培养,但是本发明提供在平面或浸没的培养物中形成第1阶段至第4阶段细胞,以及通过在空气-液体界面处或悬浮培养物中培养细胞形成第5、第6和第7阶段的细胞。在其它实施方案中,本发明涉及分化多能细胞的分步方法,该方法包括在空气-液体界面处培养第4、第5和第6阶段的细胞。在某些实施方案中,在第4阶段至第7阶段期间培养的细胞可在空气-液体界面处培养。在其它实施方案中,仅有第4阶段后期至第6阶段的细胞、或第5阶段和第6阶段的细胞在空气-液体界面处或悬浮液中培养。在另一个另选的实施方案中,第1阶段至第4阶段通过在平面培养物中培养细胞来进行,并且第5阶段至第7阶段、或第6阶段至第7阶段、或仅第7阶段通过在悬浮培养物中培养来进行。另外,在t3、t4、其类似物中的一种或多种,以及alk5抑制剂,或者t3、t4及其类似物中的一种或多种;或alk5抑制剂存在下在第5、第6和第7阶段中的一个或所有阶段期间进行培养。在优选的实施方案中,在t3和alk5抑制剂的存在下并且更优选地在t3和alk5抑制剂ii的存在下,在第5、第6和第7阶段中的一个或多个,以及优选地所有阶段期间进行培养。在更优选的实施方案中,在低浓度t3存在下在第7阶段期间进行培养。在优选的实施方案中,在不包含alk5抑制剂情况下在第7阶段期间进行培养。当在空气-液体界面(“ali”)处培养细胞时,可在多孔基质上培养细胞,使得所述细胞在顶侧上与空气接触,并且在底侧处与细胞培养基接触。例如,可将足够体积的培养基添加至包含所述多孔基质(例如,过滤器芯子(filterinsert))的培养容器的底部,使得培养基接触存在于基质上的细胞的底表面但是不包封或浸没它们。合适的多孔基质可由将不会对细胞的生长和分化产生不利影响的任意材料形成。示例性多孔基质是由聚合物制成的,诸如聚对苯二甲酸乙二酯(“pet”)、聚酯或聚碳酸酯。合适的多孔基质可为经涂覆的或未经涂覆的。在一个实施方案中,涂层可为matrigeltm。在本发明的另一个实施方案中,多孔基质是可涂覆有matrigeltm的多孔过滤器芯子。在本发明的另一个实施方案中,多孔基质是未涂覆的过滤器芯子。基质的孔隙率应当足以维持细胞活力并且促进细胞的分化。在空气-液体界面处培养细胞包括将细胞接种到多孔基质诸如多孔过滤器芯子上。在某些实施方案中,基质的孔尺寸范围可为约0.3微米至约3微米。接种可通过以下方式实现:将细胞作为单细胞从单层培养物释放或作为细胞簇从单层培养物释放到悬浮液中,随后将单细胞悬浮液或悬浮的细胞培养物等分到在ali处的多孔基质上。可将细胞从具有约1000个细胞/μl至约100,000个细胞/μl的悬浮液接种到多孔基质上。细胞可作为包含单个细胞或细胞聚集体或细胞簇的细胞悬浮液的液滴而接种。在某些实施方案中,可将细胞在空气-液体界面处培养,其使用关于在空气液体界面处培养和分化多能干细胞的美国专利申请公布2014/0186305中所公开的方法(其公开内容并入本文)。培养基可以每隔一天或优选地每天更换或更新。在多孔基质的顶部上生长的细胞一般不是单个细胞,而相反它们呈片形式或以聚集细胞簇形式存在的。相较于浸没在培养基中的细胞,在ali处培养的细胞可经历更高的氧张力。在某些实施方案中,本发明的方法可通过在悬浮培养物中培养细胞并使细胞分化为簇来进行。悬浮培养并分化多能干细胞的示例性合适的方法公开于美国专利申请公布2014/0242693和2014/0295552(其公开内容并入本文),如该专利涉及用悬浮簇来培养和分化多能干细胞。在特定实施方案中,本发明提供了包括如下的体外细胞培养物:使所制备的细胞分化为聚集细胞例如细胞簇,包括在具有生长培养基(培养基)的有利于细胞聚集或形成细胞簇的培养容器中接种细胞,使得诱导细胞聚集并形成簇。在一些实施方案中,可用于诱导细胞聚集的容器是带有孔或微孔的平板,诸如aggrewelltm板。将所得的聚集细胞或细胞簇进一步在悬浮液(悬浮培养物)中培养,包括从微孔移除聚集细胞/细胞簇并将其接种到悬浮培养容器中,使得聚集细胞在悬浮液中分化。本发明的实施方案涵盖在空气-液体界面处或悬浮液中形成第4阶段后期至第7阶段的细胞,优选地第5至第7阶段的细胞。细胞可通过使多能干细胞分化形成,或通过进一步分化第3、第4、第5或第6阶段的细胞而形成。可完全在空气-液体界面处培养第4阶段细胞,或可在第4阶段的早期部分期间(约一至两天)在浸没的平面培养物中培养细胞,并且随后在第4阶段的后期部分期间(约第二天至第三天)在空气-液体界面处或悬浮液中培养细胞。优选地,第4阶段不在ali处或悬浮液中进行,而是在浸没的培养物中进行。在一个实施方案中,本发明提供了由多能干细胞产生表达功能性β细胞的特征性标记物的细胞的方法,该方法包括:培养多能干细胞;使多能干细胞分化成表达胰腺内胚层的特征性标记物的细胞;并且通过在空气-液体界面处或悬浮液中培养,使表达胰腺内胚层的特征性标记物的细胞分化成表达胰腺内分泌细胞的特征性标记物的细胞。该方法可包括用补充有以下项的培养基处理:(i)t3、t4或其类似物;(ii)alk5抑制剂;或(i)和(ii)两者。该方法可包括通过用补充有以下项的培养基处理以及在平面培养物中培养来将表达前肠内胚层细胞的特征性标记物的细胞(第3阶段细胞)分化成表达胰腺内胚层细胞的特征性标记物的细胞(第4阶段细胞):(i)t3、t4或其类似物中的一种或两种;(ii)alk5抑制剂;或(i)和(ii)两者。该方法也可包括通过用补充有以下项的培养基处理以及在平面培养物中培养或在空气-液体界面处或悬浮液中培养,使表达胰腺内胚层细胞的特征性标记物的细胞(第4阶段细胞)分化成表达不成熟β细胞的特征性标记物的细胞(第6阶段细胞):(i)t3、t4或其类似物中的一种或两种;(ii)alk5抑制剂;或(i)和(ii)两者。该方法还包括通过用补充有以下项的培养基处理,使第6阶段细胞分化成表达与第6阶段细胞相比具有更成熟表型的功能性β细胞的特征性标记物的细胞(第7阶段细胞):(i)t3、t4或其类似物中的一种或两种;(ii)alk5抑制剂;或(i)和(ii)两者;连同极光激酶抑制剂、rsk抑制剂、以及蛋白甲基转移酶dot1l抑制剂中的一种或多种,以及任选地抗氧化剂诸如维生素e或乙酰基半胱氨酸。可用的乙酰基半胱氨酸的优选量为约0.1mm至约2mm。维生素e的优选量为约0.1μm至约10μm。在另一个实施方案中,该方法还包括通过用补充有以下项的培养基处理第5阶段细胞来实施第6阶段:(i)t3、t4或其类似物中的一种或两种;(ii)alk5抑制剂;或(i)和(ii)两者;连同γ分泌酶抑制剂、rsk抑制剂以及蛋白甲基转移酶dot1l抑制剂中的一种或多种。在另一个实施方案中,通过用补充有以下项的培养基处理第5阶段细胞来实施第6阶段:(i)t3、t4或其类似物中的一种或两种;(ii)alk5抑制剂;或(i)和(ii)两者;连同γ分泌酶抑制剂、rsk抑制剂以及蛋白甲基转移酶dot1l抑制剂中的一种或多种;随后通过用补充有以下项的培养基处理来实施第7阶段:(i)t3、t4或其类似物中的一种或两种;(ii)alk5抑制剂;或(i)和(ii)两者;连同极光激酶抑制剂、rsk抑制剂、蛋白甲基转移酶dot1l抑制剂中的一种或多种,以及任选地抗氧化剂诸如维生素e或乙酰基半胱氨酸。本发明的一个实施方案是形成功能性β细胞(表达成熟表型的特征性标记物的胰腺内分泌细胞)(第7阶段细胞)的方法,所述方法包括通过在空气-液体界面处或悬浮液中培养,使表达胰腺内胚层细胞的特征性标记物的细胞(第4阶段细胞)分化成表达第7阶段细胞的特征性标记物的细胞。表达更成熟表型的功能性β细胞的特征性标记物的细胞表达pdx1和至少一种以下转录因子:nkx2.2、nkx6.1、neurod1、isl1、hnf3β、mafa、ucn3、slc2a1、pax4、hb9和pax6。在一个实施方案中,本发明的方法导致形成对nkx6.1、pdx1、hb9和mafa呈阳性的第6阶段细胞。优选地,至少在第5阶段至第7阶段期间,该方法包括用补充有t3、t4或其类似物,alk5抑制剂,或这两者的培养基进行处理。第6阶段细胞可为对nkx6.1、pdx1、hb9和mafa呈阳性的细胞。在其它实施方案中,第6阶段或第7阶段细胞是单激素阳性细胞。例如,第6阶段和第7阶段细胞可为如下细胞:(a)共表达nkx6.1和嗜铬粒蛋白;(b)共表达nkx6.1和胰岛素;或者(c)共表达nkx6.1、pdx1、mafa和单激素胰岛素。相比于第6阶段细胞,第7阶段细胞以提高的水平和细胞群内增加的细胞数来表达单激素胰岛素和mafa。在另一个实施方案中,本发明提供通过在优选地空气-液体界面处或悬浮液中培养和分化pdx1和nkx6.1共表达细胞的群体来增加单激素阳性细胞(例如,共表达nkx6.1和胰岛素的细胞,或共表达nkx6.1和嗜铬粒蛋白的细胞)的数目的方法。在另一个实施方案中,通过用选自以下的化合物处理使空气-液体界面处或悬浮液中培养的胰腺内胚层细胞进一步分化成功能性β细胞:alk5抑制剂、bmp抑制剂、γ分泌酶抑制剂、ephrin配体、ephb抑制剂、pkc抑制剂、egfr抑制剂、视黄酸、维生素c、t3/t4、葡萄糖、细胞周期调节剂、wnt调节剂、shh抑制剂、极光抑制剂、抗氧化剂、维生素e、乙酰基半胱氨酸、或它们的组合。在另一个实施方案中,本发明涉及分化多能细胞的分步方法,该方法包括在包含足够量以下物质的培养基中培养第4阶段至第6阶段细胞:(i)t3、t4及其类似物中的一种或多种;(ii)alk5抑制剂;或(i)和(ii)两者;并且进一步在任选地包含极光激酶抑制剂、rsk抑制剂、以及蛋白甲基转移酶dot1l抑制剂、以及抗氧化剂中的一种或多种的培养基中培养第6阶段细胞,以产生表达胰岛素、pdx1、nkx6.1、ucn3、slc2a1和mafa的功能性β细胞(成熟表型的胰腺内分泌细胞)和功能性β细胞群体。根据本文所述的方法产生的第6阶段细胞和第7阶段细胞还适用于根据化合物对胰腺激素和内分泌标记物的分泌的影响来筛选化合物。具体地,在ali处或悬浮培养物中培养的第4阶段细胞至第7阶段细胞可以来自384至6孔形式的不同培养形式进行测试。这样的形式允许在随后表达的胰腺内胚层、胰腺内分泌前体、胰腺内分泌和胰腺β细胞标记物上以各种剂量和时间间隔来评估各种小分子或生物制剂。此类评估可通过以下方式实现:用pcr测量基因表达,用facs、或免疫染色测量蛋白质表达,或用elisa来测量受到小分子/生物制剂的添加影响的细胞的细胞因子分泌。f.可通过本发明的方法获得的细胞。本发明提供可通过本发明的方法获得的第7阶段细胞或第7阶段细胞群。在某些实施方案中,细胞或细胞群在分化之后是未经纯化的。在某些实施方案中,这些第7阶段细胞表达单激素胰岛素并呈pdx1、nkx6.1、ucn3、slc2a1和mafa阳性;此外,这些细胞具有比第6阶段细胞更高的mafa表达水平。所述细胞以比第6阶段细胞(不成熟β细胞)更高的水平表达ucn3。相比于第6阶段细胞,所得的细胞群具有更高百分比的mafa阳性和单激素胰岛素表达细胞两者。本发明还提供了胰岛素阳性细胞或胰岛素阳性细胞群,其表达由nkx6.1表达(优选地大于约30%)、pdx1表达(优选地大于约30%)、ucn3表达(优选地大于约10%)、slc2a1表达(优选地大于约10%)、以及mafa表达(优选地大于约10%)表征的功能性β细胞(成熟表型的胰腺内分泌细胞)特征性标记物。在本发明的实施方案中,第7阶段细胞或细胞群为产胰岛素细胞或产胰岛素细胞群体。产胰岛素细胞是功能上成熟的β细胞,其表现出类似于人胰岛细胞的对葡萄糖的线粒体呼吸/活性和gsis响应。在本发明的实施方案中,功能上成熟的β细胞产生于悬浮培养物中。在一些实施方案中,功能性β细胞表现出葡萄糖刺激的胰岛素分泌和葡萄糖依赖性线粒体呼吸。在一些实施方案中,葡萄糖刺激的胰岛素分泌和葡萄糖依赖性线粒体呼吸与人胰岛细胞的类似。本发明的实施方案中,功能性β细胞以多相分泌胰岛素。在一些实施方案中,葡萄糖依赖性线粒体呼吸在葡萄糖刺激后具有基础耗氧率以上约20%至约80%,优选地约20%至约70%、20%至约约60%,更优选地约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%或约80%范围内的最大耗氧率响应。在一些实施方案中,耗氧率响应发生于葡萄糖刺激后的至少10分钟至约15分钟,优选地约10分钟、约11分钟、约12分钟、约13分钟、约14分钟、约15分钟。在一些实施方案中,基础ocr以上的较高耗氧率维持至少60分钟到至少80分钟,优选地至少70分钟到至少80分钟,更优选地至少70、71、72、73、74、75、76、77、78、79或80分钟。在以上实施方案中,葡萄糖刺激的胰岛素分泌包括响应于葡萄糖刺激的快速双相胰岛素分泌。在实施方案中,双相胰岛素分泌的第一时相具有相比于基线分泌的至少四倍增加到至少八倍增加,优选地相比于基线分泌的至少四倍增加、五倍增加、六倍增加、七倍增加、或八倍增加。在实施方案中,双相胰岛素分泌的第二时相具有相比于基线分泌的至少两倍到至少四倍增加,优选地相比于基线分泌的至少两倍增加、三倍增加或四倍增加。在实施方案中,胰岛素分泌发生于葡萄糖刺激后的至少五分钟到至少十分钟,优选地葡萄糖刺激后的至少5分钟、至少6分钟、至少7分钟、至少8分钟、至少9分钟或至少10分钟。表a和b示出了适用于本发明方法的实施方案的示例性培养条件。如下表a和b所用,“mcx”是mcx化合物,“aa”是活化素,“alk5inh.”是alk5抑制剂,“ra”是视黄酸,“vit.c”为抗坏血酸,“inh.”是抑制剂,并且“act.”是活化剂。在某些实施方案中,对某一阶段(例如,第1阶段、第2阶段、第3阶段、第4阶段、第5阶段、第6阶段、或第7阶段任一者)细胞的任一种处理可与对另一阶段(例如,第1阶段、第2阶段、第3阶段、第4阶段、第5阶段、第6阶段、或第7阶段任一者)细胞的任一种处理结合起来。在其它实施方案中,可使用表b所示的培养条件,将通过不同于表a的那些的方法所获得的第4阶段细胞分化成第5阶段至第7阶段细胞。在其它实施方案中,可使用表b所示的培养条件,将通过不同于表a和b的那些的方法所获得的第5阶段细胞分化成第6阶段或第7阶段细胞。在其它实施方案中,可使用表b所示的培养条件,将通过不同于表a和b的那些的方法所获得的第6阶段细胞分化成第7阶段细胞。该文档中通篇引用的出版物据此全文以引用方式并入。本发明通过下述非限制性实施例进一步举例说明,但并不受其限制。实施例以下实施例中所用的材料和化合物的供应商示于表x。实施例1上调mafa或ucn3表达的小分子的筛选和鉴定。以下实施例涉及鉴定可经由提高包括mafa(v-maf肌肉腱膜纤维肉瘤癌基因同源物a)或ucn3(尿皮素3)在内的成熟β细胞标记物的基因表达来增强胰腺β细胞成熟状态的小分子。将ez8培养基所培养的人胚胎干细胞系h1(“h1-hesc”)的细胞在第28代作为单细胞以0.094×106个细胞/cm2接种于1:30稀释的matrigeltm包被的皿上如下培养基中:dulbecco改良的eagle培养基营养混合物f-12(“dmem-f12”)、1:100稀释的glutamaxtm(“1x浓度”)、0.25mm抗坏血酸、100ng/ml成纤维细胞生长因子2(“fgf2”)、1ng/ml的转化生长因子β(“tgfβ”)、1:100稀释的胰岛素-转铁蛋白-硒-乙醇胺(“its-x”)、2%不含脂肪酸的牛血清白蛋白(“faf-bsa”)、以及20ng/ml的胰岛素样生长因子-1(“igf-1”),该培养基补充有10μm的rock抑制剂y-27632(“y-化合物”)。仅在接种后前24小时期间添加y-化合物。接种后四十八小时,将培养物在不完全pbs(不含镁或钙的磷酸盐缓冲盐水溶液)中洗涤。对于图1a至1h,使用以下方案来分化培养物。在方案的第1至第4阶段期间,将培养物保持在平面贴壁培养物上。a.第1阶段(3天):将细胞在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠(sigma-aldrichco.llc,st.louis,missouri,目录号5761),并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/ml生长分化因子8(“gdf8”)、以及1.5μm的14-丙-2-烯-1-基-3,5,7,14,17,23,27-七氮杂四环[19.3.1.1~2,6~.1~8,12~]二十七-1(25),2(27),3,5,8(26),9,11,21,23-壬-16-酮(“mcx化合物”)。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及0.1μmmcx化合物的mcdb-131培养基中再培养一天。随后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、以及100ng/mlgdf8的mcdb-131中再培养一天。b.第2阶段(2天):将细胞用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/ml成纤维细胞生长因子7(“fgf7”)的mcdb-131培养基处理两天。c.第3阶段(2天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;2%faf-bsa;25ng/mlfgf7;0.25μmsant-1(n-[(3,5-二甲基-1-苯基-1h-吡唑-4-基)亚甲基]-4-(苯基甲基)-1-哌嗪胺);1μm视黄酸(“ra”);0.25mm的抗坏血酸;300nm的pkc活化剂((2s,5s-(e,e)-8-(5-(4-三氟甲基)苯基-2,4,-戊二烯酰氧基氨基)苯并内酰胺(“tpb”);以及骨形态发生蛋白(“bmp”)受体抑制剂ldn-193189-hcl(“ldn-hcl”)的blar001定制培养基(参见表i)处理两天。用于第3阶段第一天的ldn-hcl的浓度为100nm,并且第3阶段第二天为10nm。d.第4阶段(3天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;2%faf-bsa;0.25μm的sant-1;50nm的ra;2ng/mlfgf7;50nmldn-hcl;0.25mm的抗坏血酸;以及200nmtpb的blar001培养基处理三天。在第4阶段(3天)结束时,将平面皿上培养的细胞接种到空气-液体界面(ali”)上。具体地,将细胞用10μm的y-27632处理4小时,用pbs冲洗并用酶trypletm表达酶以1x的浓度处理约2分钟,然后移除酶,并且通过轻敲烧瓶从matrigeltm表面移除细胞。将所得的细胞悬浮液以0.5-1.0×106个细胞的密度(在5μl的等分试样中)接种到10cm板上的0.4微米或3.0微米多孔细胞培养物滤器芯子上。将8.0ml的培养基添加至每一滤芯的底部,并且不另外添加培养基至过滤器的顶上或顶侧。在第5、第6和第7阶段的持续时间每天更换培养基。e.第5阶段(3天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nmra;100nmldn-hcl;1μm的t3(呈3,3',5-三碘-l-甲状腺原氨酸钠盐形式);10μm的2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-二氮杂萘(“alk5抑制剂ii”或“alk5”)的blar001培养基处理三天。f.第6阶段(7天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素;10μmznso4;100nmldn-hcl;1μm的t3;10μmalk5抑制剂ii;以及100nm(s,s)-2-[2-(3,5-二氟苯基)乙酰氨基]-n-(5-甲基-6-氧代-6,7-二氢-5h-二苯并[b,d]氮杂-7-基)丙酰胺(“γ分泌酶抑制剂xx”)的blar001培养基处理七天。g.第7阶段(7天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;1μm的t3;10μm的alk5抑制剂ii;1mmn-乙酰半胱氨酸(“nac”)的blar001培养基处理。此外,在第7阶段(s7)期间,对于图1a-1h,将细胞以20mmd-葡萄糖加上bme维生素补充剂(100x的1:100稀释度)调节,并暴露于如表xi所列和所描述的所有79种小分子中。在79种小分子中,下列化合物诱导mafa或ucn3的表达:(i)泽布拉林;(ii)罗米鲁曲;(iii)5-氮杂胞苷;(iv)米托蒽醌二盐酸盐;(v)egcg;(vi)漆黄素;(vii)sgi1027;(viii)替莫唑胺;(ix)l002;(x)c646;以及(xi)sgc0946。对于图2a至2b,使用以下方案来分化培养物:在方案的第1至第4阶段期间,将培养物保持在平面贴壁培养物上。a.第1阶段(3天):将细胞在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠,并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/ml生长分化因子8(“gdf8”)、以及1.5μm的14-丙-2-烯-1-基-3,5,7,14,17,23,27-七氮杂四环[19.3.1.1~2,6~.1~8,12~]二十七-1(25),2(27),3,5,8(26),9,11,21,23-壬-16-酮(“mcx化合物”)。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及0.1μmmcx化合物的mcdb-131培养基中再培养一天。随后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、以及100ng/mlgdf8的mcdb-131中再培养一天。b.第2阶段(2天):将细胞用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/ml成纤维细胞生长因子7(“fgf7”)的mcdb-131培养基处理两天。c.第3阶段(2天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;1%faf-bsa;25ng/mlfgf7;0.25μmsant-1(n-[(3,5-二甲基-1-苯基-1h-吡唑-4-基)亚甲基]-4-(苯基甲基)-1-哌嗪胺);1μm视黄酸(“ra”);0.25mm的抗坏血酸;300nm的pkc活化剂((2s,5s-(e,e)-8-(5-(4-三氟甲基)苯基-2,4,-戊二烯酰氧基氨基)苯并内酰胺(“tpb”);以及骨形态发生蛋白(“bmp”)受体抑制剂ldn-193189-hcl(“ldn-hcl”)的blar001定制培养基处理两天。用于第3阶段第一天的ldn-hcl的浓度为100nm,并且第3阶段第二天为50nm。d.第4阶段(3天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;1%faf-bsa;0.25μm的sant-1;50nm的ra;2ng/mlfgf7;70nmldn-hcl;0.25mm的抗坏血酸;以及200nmtpb的blar001培养基处理三天。在第4阶段(3天)结束时,将平面皿上培养的细胞接种到空气-液体界面(ali”)上。具体地,将细胞用10μm的y27632处理4小时,用pbs冲洗并用酶trypletm表达酶以1x的浓度处理约2分钟,然后移除酶,并且通过轻敲烧瓶从matrigeltm表面移除细胞。将所得的细胞悬浮液以0.5-1.0×106个细胞的密度(在5μl的等分试样中)接种到10cm板中的0.4微米或3.0微米多孔细胞培养物滤器芯子上。将8.0ml的培养基添加至每一滤芯的底部,并且不另外添加培养基至过滤器的顶上或顶侧。在第5、第6和第7阶段的持续时间每天更换培养基。e.第5阶段(3天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nm的ra;100nmldn-hcl;1μm的t3(呈3,3',5-三碘-l-甲状腺原氨酸钠盐形式);10μm的2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-二氮杂萘(“alk5抑制剂ii”或“alk5”)的blar001培养基处理三天。f.第6阶段(7天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;100nmldn-hcl;1μm的t3;10μmalk5抑制剂ii;以及100nm(s,s)-2-[2-(3,5-二氟苯基)乙酰氨基]-n-(5-甲基-6-氧代-6,7-二氢-5h-二苯并[b,d]氮杂-7-基)丙酰胺(“γ分泌酶抑制剂xx”)的blar001培养基处理七天。g.第7阶段(7天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10nm的t3(“低t3”);1mmn-乙酰半胱氨酸(“nac”)的blar001培养基处理。另外对于图2a和2b,添加0.5μm的zm447439(“zm”);以及构成制剂i(“fi”)的以下组分(表xii)—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学限定的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a;以及1:2000稀释的微量元素b保持七天。第7阶段期间所添加的附加化合物包括5μm5-氮杂胞苷(“azt”);或1μm或10μm3-去氮腺嘌呤a(“deza”)。本文所述的实施方案使用申请人的专有blar培养基,具体地blar001或blar004培养基。blar培养基首先描述于均提交于2013年12月18日的pct/us13/75939和美国序列号13/998,884,它们要求提交于2012年12月31日的61/747,662的权益;随后同样描述于rezania等人(2014)naturebiotech,32(11)1124-1134的补充表3(在线公布,2014年9月11日),上述参考文献全文并入本文中。blar001和blar004在所列试剂或赋形剂的浓度或水平方面有所不同。一般来讲,本文的实施方案在第1-7阶段中基本上如上所述分化人多能细胞。对于第7阶段,添加各种小分子,并通过定量实时pcr评估它们的效果。表ii列出小分子及其目标。评估这些小分子,并且每者以2μm在第阶段7添加。该实施例中测试的化合物的化学名和结构示于表xi中。分化细胞的定量和表征:对于各阶段基因表达的量化,人胰岛、h1-hesc、第6阶段第7天(s6d7)、以及第7阶段第7天至第7阶段第14天(s7d7-s7d14)的细胞作为ali簇收获,大致如rezania等人(2014)(出处同上)所述。使用定制taqman阵列(appliedbiosystems,fostercity,california)来在细胞中评估基因表达。使用序列检测软件(加利福尼亚州福斯特城的应用生物系统公司(appliedbiosystems,fostercity,california))来分析数据,并且使用gapdh作为未分化的h1-hesc的管家基因使用δδct方法来将数据归一化。引物详情列于表iii中。表iii:rt-qpcr引物的列表:基因测定id1mafahs04419861_sh2ucn3hs00846499_s13gapdhhs99999905_m1图1a至1d为示出用小分子处理后mafa表达的定量实时pcr分析的数据的图,其中相比于s6d7、或第7阶段(s7d7)未经处理的或经dmso处理的培养物,各个小分子使mafa的表达得到提高。相比于s6d7、或第7阶段未经处理的或经dmso处理的培养物,添加unc0638(图1a;选择性g9a和glp组蛋白赖氨酸甲基转移酶抑制剂)、unc0646(图1a;有效和选择性g9a/glp抑制剂)、unc0642(图1a;有效和选择性g9a和glp组蛋白赖氨酸甲基转移酶抑制剂)、tc-e5003(图1b;选择性prmt1精氨酸甲基转移酶抑制剂)、a366(图1b;有效和选择性g9a/glp组蛋白赖氨酸甲基转移酶抑制剂)、pf03814735(图1b;极光激酶a和b抑制剂)、zm447439(图1b;抑制极光激酶b)、sb747651a二盐酸盐(图1b;有效msk1抑制剂;还抑制其它agc组激酶)、pfi1(图1b;bet溴结构域抑制剂)、ly303511(图1b;brd2、brd3和brd4抑制剂)、ms436(图1b;有效和选择性brd4溴结构域抑制剂)、以及mc1568(图1c;选择性地抑制hdacii类(iia))显著地上调了mafa的表达。图1e至1h为示出用小分子处理后ucn3表达的定量实时pcr分析的数据的图,相比于s6d7或第7阶段未经处理的或经dmso处理的培养物,添加5-氮杂胞苷(“azt”)(图1e;dna甲基转移酶抑制剂)、吡咯沙敏(图1g;组蛋白脱乙酰酶抑制剂)和ci994(图1g;组蛋白脱乙酰酶抑制剂)显著上调了ucn3的表达。图2a和2b表明了所选小分子作为mafa或ucn3上调剂的稳健性,因为它们的效应在不同的第7阶段调节方案中得以维持。图2a和2b所示的培养条件与图1的区别在于第7阶段(s7)的下列改变:(i)移除alk5抑制剂ii(“alk5”);(ii)降低t3的浓度(“低t3”);(iii)添加zm447439(“zm”);以及(iv)添加维生素、微量元素、脂质、以及氨基酸的混合物(制剂i—表xii)。具体地,所测试的基础条件为:(1)无alk5抑制剂ii(“alk5”);(2)低t3;(3)低zm;(4)低h;(5)低nac;(6)fi;以及blar001。证实azt为第7阶段期间ucn3(图2b)而非mafa(图2a)的上调剂。除测试的小分子之外,还发现3-去氮腺嘌呤a(“deza”;图2a)即使在zm447439的存在下也为mafa而非ucn3(图2b)表达的有效上调剂。概括地说,该实施例展示对第7阶段期间上调成熟标记物mafa或ucn3表达的小分子的鉴定。实施例2在空气与液体界面处产生具有改善的成熟标记物表达以及人胰岛类似的葡萄糖依赖性线粒体呼吸动力学的内分泌细胞。以下实施例展示了共表达以下成熟标记物的c-肽(胰岛素原分子中连接胰岛素a-和b-链的较短31个氨基酸多肽)细胞的产生:pdx1(胰腺和十二指肠同源盒1);nkx6.1(nk6同源盒1);mafa;ucn3;slc2a1(溶质载体家族2成员1;也称为glut1/葡萄糖转运蛋白1);并示出类似于人胰岛细胞的葡萄糖依赖性线粒体呼吸动力学。将ez8培养基所培养的人胚胎干细胞系h1(“h1-hesc”)的细胞在第28代作为单细胞以0.094×106个细胞/cm2接种于1:30稀释的matrigeltm包被的皿上如下培养基中:dulbecco改良的eagle培养基营养混合物f-12(“dmem-f12”)、1:100稀释的glutamaxtm(“1x浓度”)、0.25mm抗坏血酸、100ng/ml成纤维细胞生长因子2(“fgf2”)、1ng/ml的转化生长因子β(“tgfβ”)、1:100稀释的胰岛素-转铁蛋白-硒-乙醇胺(“its-x”)、2%不含脂肪酸的牛血清白蛋白(“faf-bsa”)、以及20ng/ml的胰岛素样生长因子-1(“igf-1”),该培养基补充有10μm的rock抑制剂y-27632(“y-化合物”)。接种后四十八小时,将培养物在不完全pbs(不含镁或钙的磷酸盐缓冲盐水溶液)中洗涤。对于图3a-3m、4a-4e和5a-5f,使用以下方案来分化培养物。在方案的第1至第4阶段期间,将培养物保持在平面贴壁培养物上。a.第1阶段(3天):将细胞在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠,并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/ml生长分化因子8(“gdf8”)、以及1.5μm的14-丙-2-烯-1-基-3,5,7,14,17,23,27-七氮杂四环[19.3.1.1~2,6~.1~8,12~]二十七-1(25),2(27),3,5,8(26),9,11,21,23-壬-16-酮(“mcx化合物”)。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及0.1μmmcx化合物的mcdb-131培养基中再培养一天。随后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、以及100ng/mlgdf8的mcdb-131中再培养一天。b.第2阶段(2天):将细胞用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/ml成纤维细胞生长因子7(“fgf7”)的mcdb-131培养基处理两天。c.第3阶段(2天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;1%faf-bsa;25ng/mlfgf7;0.25μmsant-1(n-[(3,5-二甲基-1-苯基-1h-吡唑-4-基)亚甲基]-4-(苯基甲基)-1-哌嗪胺);1μm视黄酸(“ra”);0.25mm的抗坏血酸;300nm的pkc活化剂((2s,5s-(e,e)-8-(5-(4-三氟甲基)苯基-2,4,-戊二烯酰氧基氨基)苯并内酰胺(“tpb”);以及骨形态发生蛋白(“bmp”)受体抑制剂ldn-193189-hcl(“ldn-hcl”)的blar001定制培养基处理两天。用于第3阶段第一天的ldn-hcl的浓度为100nm,并且第3阶段第二天为50nm。d.第4阶段(3天)以及s4d3的ali转化:将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;1%faf-bsa;0.25μm的sant-1;50nm的ra;2ng/mlfgf7;70nmldn-hcl;0.25mm的抗坏血酸;以及200nmtpb的blar001培养基处理三天。在第4阶段(3天)结束时,将平面皿上培养的细胞接种到空气-液体界面(ali”)上。对于ali转化,将细胞用10μm的y-化合物处理4小时,用pbs冲洗并用酶trypletm表达酶以1x的浓度处理约2分钟,然后移除酶,并且通过轻敲烧瓶从matrigeltm表面移除细胞。将所得的细胞悬浮液以0.5-1.0×106个细胞的密度(在5μl的等分试样中)接种到10cm板中的0.4微米或3.0微米多孔细胞培养物滤器芯子上。将8.0ml的培养基添加至每一滤芯的底部,并且不另外添加培养基至过滤器的顶上或顶侧。在第5、第6和第7阶段的持续时间每天更换培养基。e.第5阶段(3天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nm的ra;100nmldn-hcl;1μm的t3(呈3,3',5-三碘-l-甲状腺原氨酸钠盐形式)(sigmaaldrich,目录号t6397);10μm的2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-二氮杂萘(“alk5抑制剂ii”或“alk5”)的blar001培养基处理三天。f.第6阶段(7天):将细胞在ali上用包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;100nmldn-hcl;1μm的t3;10μmalk5抑制剂ii;以及100nm(s,s)-2-[2-(3,5-二氟苯基)乙酰氨基]-n-(5-甲基-6-氧代-6,7-二氢-5h-二苯并[b,d]氮杂-7-基)丙酰胺(“γ分泌酶抑制剂xx”)的blar001培养基处理七天。g.第7阶段(7天):将ali上的细胞用两种定制blar培养基处理:blar001和blar004。第一种培养基是blar001培养基(组分的列表概述于表i),其包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10nm的t3(“低t3”);1mmn-乙酰半胱氨酸(“nac”);0.5μm的zm447439(“zm”);以及构成制剂i(“fi”)的以下组分—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学上明确的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a;1:2000稀释的微量元素b,处理七天。第7阶段期间所添加的附加化合物包括1μm的t3或10nm的t3(“低t3”);10μmalk5抑制剂ii;5μm5-氮杂胞苷(“azt”);或1μm或10μm3-去氮腺嘌呤a(“deza”)。第二种培养基是blar004(组分的列表概述于表iv中)培养基,其包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);1mmn-乙酰半胱氨酸(“nac”);0.5μm的zm447439(“zm”);以及构成制剂i(“fi”)的以下组分—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学上明确的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a;1:2000稀释的微量元素b,处理七天。第7阶段期间所添加的附加化合物包括1μm的t3或10nm的t3(“低t3”);10μmalk5抑制剂ii;5μm5-氮杂胞苷(“azt”);或1μm或10μm3-去氮腺嘌呤a(“deza”)。分化细胞的表征和定量:对于各阶段基因表达的量化,人胰岛、h1-hesc,第6阶段第7天(s6d7)、以及第7阶段第7天至第7阶段第14天(s7d7-s7d14)的细胞作为ali簇收获,如rezania等人,naturebiotechnology,201432(11):1121-1133中所述。使用定制taqman阵列(加利福尼亚州福斯特城的应用生物系统公司(appliedbiosystems,fostercity,california))来在细胞中评估基因表达。使用序列检测软件(加利福尼亚州福斯特城的应用生物系统公司(appliedbiosystems,fostercity,california))来分析数据,并且使用gapdh作为未分化的h1-hesc的管家基因使用δδct方法来将数据归一化。引物详情列于表v中。为了定量各阶段的蛋白质共定位,作为ali细胞簇收获人胰岛和s7d7细胞,并通过免疫荧光(“if”)进行分析。制备h1-hesc-衍生的细胞并大致如上文rezania等人(2014)所述进行染色,并且使用本文表vi所列的抗体。对于冷冻切片,将细胞用pbs冲洗,然后在4℃下于4%pfa中固定过夜。在固定之后,除去4%pfa,利用pbs冲洗细胞两次,并在4℃下在30%蔗糖溶液中温育过夜。将样品在oct溶液中冷冻保存,并将5μm切片置于superfrostplus载玻片上(vwrinternational,llc,radnor,pa,目录号48311-703)。这蒙迪欧if染色,在4℃下以适当的稀释度加入一次抗体过夜,而在室温下加入二次抗体30分钟,然后利用pbs冲洗并加入具有dapi的vectastain固定试剂(vectorlaboratoriesinc.,burlingame,california,目录号h-1200)。使用nikonti荧光显微镜(nikoninstruments,inc.,melville,ny)来使切片可视化。对于各阶段葡萄糖依赖性线粒体活性的定量,收获成熟人胰岛、s6d7ali簇、以及s7d7ali簇,并且在注射20mmd-葡萄糖之前和之后,在xfe24extracellularflux分析仪(seahorsebioscience,目录号102238-100)上测量其耗氧率(“ocr”)。将ali簇从其第7阶段调节移除,并在37℃非co2环境和设计用于实现基线ocr的培养基中温育2小时。预温育培养基包含溶于xf基础培养基的1mmd-葡萄糖、1mml-谷氨酰胺和1mm丙酮酸钠。在预温育之后,将ali簇装载到进行以下测量的seahorse机器上:(i)3x基线ocr(d-葡萄糖注射前);以及(ii)5xd-葡萄糖注射后(注射后温育时间:72分钟)。使所有ocr测量规一化为旋转器中各个ali或aggrewell簇样品的dna含量。通过qiaampdnamicrokit(qiagen,目录号56304)分离dna,并且通过nanodrop8000uv-vis分光光度计(thermoscientific,目录号nd8000)测量dna含量。图3a-3m表明在第7阶段调节七天之后,ali细胞簇中一组成熟标记物的基因表达提高至人胰岛中所观察到的水平。成熟标记物在此处定义为参与正向刺激快速葡萄糖刺激的胰岛素分泌(gsis)的基因。以下列表详细说明观察到ali簇中s7d7改善成熟标记物的基因表达的第7阶段分化方案的改变:(i)移除alk5抑制剂ii;(ii)降低t3浓度;(iii)添加deza;(iv)添加azt;(v)添加zm;(vi)葡萄糖浓度降低至5.56mm;以及(vii)添加维生素、非必需氨基酸、脂质、丙酮酸钠、以及微量元素的限定混合物(制剂i-“fi”)。对于第7阶段期间基于blar001和blar004的调节两者,看到关于成熟基因的基因表达特征的类似观察和结果。图3a示出利用alk5抑制剂ii的条件下inhbb富集到高于人胰岛中所见的表达。所述观察表明在s7细胞中,alk5抑制剂ii对tgfb1(转化生长因子β1)的抑制引发了抑制gsis过程的负性tgf-β信号转导特征。观察到在存在或不存在azt/deza的情况下移除alk5抑制剂使inhbb下降到人胰岛中所见的水平,因此消除了第7阶段期间对gsis的负面tgf-β信号转导影响。此外,图3b示出观察到通过移除alk5抑制剂ii,ali簇中inha的表达提高到人胰岛水平。同时观察到mafa和slc2a1表达(分别示于图3c和3d)因移除alk5抑制剂ii而下降,azt/deza的添加使mafa和slc2a1表达挽救至人胰岛水平。通过在ali簇中添加azt/deza并移除alk5抑制剂ii,ucn3(图3e)、g6pc2(葡萄糖-6-磷酸酶催化亚基2;图3f)和pdk1(丙酮酸脱氢酶激酶1;图3g)的表达提高到人胰岛水平或其以上。观察到ins(胰岛素;图3h)、gjd2(缝隙连接蛋白质,δ2;也为cx36/连接蛋白36;图3i)、six2(six同源盒2;图3j)、以及pdx1(图3k)的表达首先通过移除alk5抑制剂ii并随后添加azt/deza以逐步分步的方式得到提高。观察到nkx6.1(图3l)和glp1r(高血糖素样肽1受体;图3m)的表达在各条件下并未改变,但其在ali簇中的表达始终处于人胰岛中所观察到的水平或其以上。图4a-4e表明就蛋白质的存在而言,s7d7在共表达下列成熟标记物的ali细胞簇中生成的c-肽细胞:pdx1(图4a)、nkx6.1(图4b)、mafa(图4c)、slc2a1(图4d)、以及ucn3(图4e)。对于图4a-4e中的每者,if-染色作为单道在顶行以c-肽表示,并且在底行以感兴趣的成熟蛋白表示。代表性的人胰岛染色示于左列,无alk5、低t3、zm、h、nac、azt/deza、fi、blar001条件示于中间列,并且无alk5、低t3、zm、h、nac、azt/deza、fi、blar004条件示于右列。大多数(如果不是全部)的c-肽阳性细胞对pdx1(图4a)和nkx6.1(图4b)呈共阳性,如人胰岛中所见。在blar001和blar004条件两者下,很大一部分的c-肽阳性细胞也对mafa(图4c)、slc2a1(图4d)和ucn3(图4e)呈共阳性。然而,mafa、slc2a1和ucn3的表达不限于c-肽共阳性细胞。图5a-5f示出特别地通过第7阶段特异性“无alk5、低t3、zm、h、nac、azt、deza、fi、blar001”调节,在空气-液体界面(“ali”)上s7d7生成表现出人胰岛类似的葡萄糖依赖性线粒体呼吸动力学的c-肽细胞。在基线和20mmd-葡萄糖注射后测量由耗氧率(“ocr”)表示的线粒体呼吸或活性。在20mmd-葡萄糖注射后进行72分钟时段内五次ocr测量,并且测量结果表示为相对于各单独样品的dna含量归一化的ocr基线的百分比。图5a示出由注射后(“ip”)15分钟(“min”)之后相比于基线的ocr123.3%±12.92所示,人胰岛(黑色圆圈线)迅速响应于高d-葡萄糖,并且随时间推移维持较高的ocr(131.5%±11.32;72minip)。相反地,观察到富集不成熟c-肽阳性细胞的s6d7ali簇(灰色三角形线)缺乏对高d-葡萄糖迅速的ocr响应(104.4%±3.37;15minip),并且表现出随时间推移相对较弱的ocr响应(113.3%±4.51;72minip)。图5d示出在s7d7ali簇组之内,观察到仅无alk5、低t3、zm、h、nac、azt/deza、fi、blar001条件(灰色正方形线)表现出人胰岛类似的葡萄糖依赖性线粒体呼吸动力学(112.4%±3.25–15minip;129.5%±3.78–72minip)。观察到以下s7d7ali簇条件(黑色正方形线)表现出与不成熟s6d7ali簇无区别的葡萄糖依赖性线粒体动力学:alk5、t3、zm、h、nac、fi、blar001(100.3%±4.04–15minip;107.8%±6.51–72minip)(图5b);无alk5、低t3、zm、h、nac、fi、blar001(96.9%±3.06–15minip;109.0%±4.58–72minip)(图5c);无alk5、低t3、zm、h、nac、fi、blar004(103.4%±4.76–15minip;113.6%±6.72–72minip)(图5e);以及无alk5、低t3、zm、h、nac、azt/deza、fi、blar004(102.1%±4.04–15minip;112.7%±3.38–72minip)(图5f)。概括地说,该实施例表明改善引入第7阶段调节中增强了ali上hesc-衍生的成熟β细胞的成熟状态。具体地,该实施例示出在ali上产生了共表达多个β细胞成熟标记物并表现出类似于人胰岛的β细胞特定功能性(诸如葡萄糖依赖性线粒体呼吸)的c-肽细胞。实施例3以适于规模可变的悬浮培养的细胞簇形式产生稳健的胰腺内胚层和不成熟β细胞以下实施例展示以适于规模可变的悬浮培养的aggrewelltm细胞簇形式产生稳健的胰腺内胚层或不成熟β细胞。该实施例中所用的悬浮培养物是旋转摇瓶中培养的aggrewelltm簇(“旋转器中的aggrewelltm簇”)。将ez8培养基所培养的人胚胎干细胞系h1(“h1-hesc”)的细胞在第28代作为单细胞以0.094×106个细胞/cm2接种于1:30稀释的matrigeltm包被的皿上如下培养基中:dulbecco改良的eagle培养基营养混合物f-12(“dmem-f12”)、1:100稀释的glutamaxtm(“1x浓度”)、0.25mm抗坏血酸、100ng/ml成纤维细胞生长因子2(“fgf2”)、1ng/ml的转化生长因子β(“tgfβ”)、1:100稀释的胰岛素-转铁蛋白-硒-乙醇胺(“its-x”)、2%不含脂肪酸的牛血清白蛋白(“faf-bsa”)、以及20ng/ml的胰岛素样生长因子-1(“igf-1”),该培养基补充有10μm的rock抑制剂y-27632(“y-化合物”)。仅在接种后前24小时期间添加y-化合物。接种后四十八小时,将培养物在不完全pbs(指定为“-/-”意指不含镁或钙的磷酸盐缓冲盐水溶液)中洗涤。对于图6a至6l,使用以下方案来分化培养物。如上所述培养图6i至6l所示的s6d6ali细胞簇,不同之处在于在第4阶段第3天,通过再培养48小时(第4阶段第5天或s4d5),由新鲜s4d3单层或冷冻保存的s4d3细胞(如下文更详细描述)制备aggrewelltm细胞簇。培养基在整个分化方案中每天更换。a.第1阶段(3天):将细胞在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠,并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/ml生长分化因子8(“gdf8”)、以及1.5μm的14-丙-2-烯-1-基-3,5,7,14,17,23,27-七氮杂四环[19.3.1.1~2,6~.1~8,12~]二十七-1(25),2(27),3,5,8(26),9,11,21,23-壬-16-酮(“mcx化合物”)(gsk-3β抑制剂)。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及0.1μmmcx化合物的mcdb-131培养基中再培养一天。随后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、以及100ng/mlgdf8的mcdb-131中再培养一天。b.第2阶段(2天):将细胞用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/ml成纤维细胞生长因子7(“fgf7”)的mcdb-131培养基处理两天。c.第3阶段(2天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;1%faf-bsa;25ng/mlfgf7;0.25μmsant-1(n-[(3,5-二甲基-1-苯基-1h-吡唑-4-基)亚甲基]-4-(苯基甲基)-1-哌嗪胺);1μm视黄酸(“ra”)(sigmaaldrich,目录号r2625);0.25mm的抗坏血酸;300nm的pkc活化剂(2s,5s-(e,e)-8-(5-(4-三氟甲基)苯基-2,4,-戊二烯酰氧基氨基)苯并内酰胺(“tpb”);以及骨形态发生蛋白(“bmp”)受体抑制剂ldn-193189-hcl(“ldn-hcl”)的blar001定制培养基(参见表i)处理两天。用于第3阶段第一天的ldn-hcl的浓度为100nm,并且第3阶段第二天为10nm。d.第4阶段(3天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;1%faf-bsa;0.25μm的sant-1;50nm的ra;2ng/mlfgf7;70nmldn-hcl;0.25mm的抗坏血酸;以及200nmtpb的blar001培养基处理三天。e.第4阶段第3天单层的冷冻保存:s4d3单层的冷冻保存的细胞库通过以下过程建立。简而言之,将s4d3单层用10μmy-化合物处理4小时。随后,采用trypletm表达酶将细胞作为单细胞悬浮液释放,然后用“释放”培养基(第4阶段完全培养基,如详述于补充有4ku/mldnasei和10μmy-化合物的“k部分”)对酶进行中和。使单细胞离心沉降,重悬于冰冷的“释放”培养基中,并通过nc-100进行计数。将冰冷的“冷冻保存”培养基(60%ksr;15%blar001;5%hepes(1m浓度);20%dmso)以1:1比率添加到冰冷中“释放”培养基的单细胞悬浮液中。将含5.0×106个细胞的4.5ml1:1“冷冻保存/释放”培养基加入单个5ml冷冻保存小瓶中。将小瓶转移到通过以下冷冻概况来冷冻细胞的crf(控制速率冷却器)(planarplc,目录号kryo360)中,并长期储存于液氮中。crf冷冻过程示于表vii中。f.冷冻保存的s4d3单层细胞的解冻:使包含5.0×106个s4d3单层细胞的冷冻5ml小瓶在37℃水浴中解冻2分钟。将细胞收集于s4d3后培养基(详述于下文“g”部分)中,并且以约787个细胞/aggrewelltm400ex板的aggrewelltm孔的密度添加。g.第4阶段(2天)对于aggrewelltm簇转变:对于aggrewelltm簇的产生,将第4阶段第3天单层细胞、或解冻的冷冻保存第4阶段第3天细胞用y-化合物处理4小时,用pbs冲洗,并用accutase细胞分离液处理3分钟,随后移除酶,并通过轻敲烧瓶从matrigeltm表面移除细胞。将所得的细胞悬浮液以约787个细胞/aggrewelltm400ex板的aggrewelltm孔的密度添加,并使平板以100xg小心地离心,以产生aggrewelltm簇。每簇的细胞量的范围可为50至3000个细胞。聚集培养48小时后用于使第4阶段第3天单层细胞转化为aggrewelltm簇的培养基如下所述(“s4d3后培养基”):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;1%faf-bsa;0.25μmsant-1;50nm的ra;2ng/mlfgf7;70nmldn-hcl;0.25mm抗坏血酸;以及200nmtpb的blar001培养基处理两天。仅在前24小时期间,将十(10)μmy-化合物和2μg/ml人重组层粘连蛋白添加到培养基中。在两天之后(此处称为s4d5),将aggrewelltm簇从aggrewelltm板的孔中移除,并转移到pbs0.1mag旋转器(“悬浮液中的aggrewell簇”)。h.第5阶段(3天):从aggrewelltm400ex板获取s4d5aggrewelltm簇,并采用27rpm(转/分钟)的旋转速度以1.5-2.0百万个细胞/ml的细胞密度转移到pbs0.1mag旋转器的第5阶段培养基中三天。将细胞用包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nmra;100nmldn-hcl;1μm的t3(呈3,3',5-三碘-l-甲状腺原氨酸钠盐形式);以及10μm的2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-二氮杂萘(“alk5抑制剂ii”或“alk5”)的blar001培养基处理。仅在第5阶段第1天补充4ku/mldnasei和5μmy-化合物。i.第6阶段(6天至8天):将aggrewelltm簇在包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;100nmldn-hcl;1μm的t3;10μm的alk5抑制剂ii,以及100nm的(s,s)-2-[2-(3,5-二氟苯基)乙酰氨基]-n-(5-甲基-6-氧代-6,7-二氢-5h-二苯并[b,d]氮杂-7-基)丙酰胺(“γ分泌酶抑制剂xx”)的blar001培养基处理。分化细胞的定量和表征:对于各阶段蛋白质共定位的量化,收获得到s4d5aggrewelltm簇和s6d6aggrewelltm簇并通过免疫荧光(“if”)分析。所用的表征过程和试剂如实施例2的表vi所示。对于各阶段的基因表达的量化,收获得到第4阶段第5天aggrewelltm簇和第6阶段第6天aggrewelltm簇,并且通过反转录酶定量聚合酶链反应(“qrt-pcr”)进行分析,如naturebiotechnology,(32)11,1121-1133所述。所用的表征过程和试剂如实施例2的表v所示。对于蛋白质存在的共定位的量化,收获得到第4阶段第5天aggrewelltm簇和第6阶段d6aggrewelltm簇,并通过荧光激活流式细胞术(“facs”)进行分析。如naturebiotechnology,2014(32)11,1121-1133中所述并且使用表vii中列出的抗体进行facs染色。将分化的细胞在trypletm表达酶中于37℃温育5-10分钟,释放到单细胞悬浮液中,然后将其用包含0.2%bsa的pbs染色缓冲液洗涤两次。通过利用活/死紫色荧光活性染料在4℃下保持30分钟实现细胞内抗体染色,然后在冷pbs中单次洗涤。使细胞固定于300μl的cytofix/cytoperm缓冲液中,然后在perm/wash缓冲液中洗涤两次。然后将细胞与适当的抗体在4℃下温育30分钟(针对未缀合的抗体)或1小时(针对缀合的抗体),并且然后在使用bdfacsdiva软件在bdfacscantoii上进行分析之前洗涤两次(至少获取30,000项事件)。在facs分析期间排除非活细胞,并通过使用同种型抗体(“igg”)来确定门控。图6a示出通过其使(i)新鲜s4d3单层或s4d3冷冻保存的细胞(ii)经由aggrewelltm方法装配成(iii)细胞簇的过程。图6b示出在s4d5aggrewelltm簇中检测到胰腺内胚层tfpdx1(顶部,左侧)和nkx6.1(顶部,中间)的较高蛋白质存在,但内分泌tfneurod1(顶部,右侧)、分配tfsox2(底部,中间)和cdx2(底部,右侧)的另选非胰腺内胚层谱系的较低蛋白质存在。facs分析(图6c)示出细胞的99.3±0.1%为pdx1+(左侧),84.4±0.1%为nkx6.1+(中间),但2.2±0.4%为nkx6.1+neurod1+(右侧)或1.35±0.55%为nkx6.1+chga+(中间)。图6d示出稳健的胰腺内胚层特征在于s4d3冷冻保存细胞的s4d4aggrewelltm簇中得以维持,因为相比于s4d3单层而言维持了pdx1(顶部,左侧)、nkx6.1(顶部,右侧)的较高基因表达,以及neurod1(底部,左侧)和chga(底部,右侧)的较低表达。总而言之,相比于naturebiotechnology,2014(32)11,1121-1133中所报道的先前第4阶段细胞,s4d5aggrewelltm簇表现出较大程度的非内分泌胰腺内胚层特征。结果是显著性的,因为aggrewelltm簇提供了以向β细胞分化为基础而发育悬浮培养物的规模可变起点。图6e示出通过其使(i)新鲜s4d3单层或s4d3冷冻保存的细胞(ii)经由aggrewelltm方法装配成细胞簇,并且(iii)在悬浮培养物中分化成(iv)s6d6的不成熟β细胞的过程。s6d6aggrewelltm簇的facs分析示出不成熟β细胞蛋白质分布,因为78.5±1.87%的细胞为nkx6.1+chga+(左侧,图6f)、73.6±4.34%为nkx6.1+neurod1+(右侧,图6f)且38.4±5.96%为nkx6.1+insulin+(左侧,图6g)。大部分胰岛素阳性群体(总细胞的50.2±6.92%为insulin+)为nkx6.1+(左侧,图6g)并且不为高血糖素阳性(7.43±1.49%insulin+glucagon+;(右侧,图6g)。图6h通过if示出在s6d6,aggrewelltm簇中的大部分c-肽阳性细胞为pdx1+(左侧)和nkx6.1+(中间)两者。令人惊奇地,成熟门禁tfmafa(右侧)的蛋白质存在已经容易地在s6d6处检出,并且在s6d6-s6d7以比先前的ali簇更高的水平表达(naturebiotechnology,2014(32)11,1121-1133)(图6i;还可参见图3c以进行alis7d7比较)。相似地,在s6d6-s6d7,insulin(图6j)、pdx1(图6k)和nkx6.1(图6l)的表达高于先前的ali簇。结果证明,s4d5aggrewelltm簇可向不成熟β细胞状态分化而培养于悬浮培养物中,从而针对基于悬浮培养分化成功能性成熟β细胞来提供规模可变的待发起点。概括地说,该实施例表明第4阶段细胞可聚集成细胞簇,同时维持其胰腺内胚层的表型。此外,这些第4阶段细胞簇可通过规模可变的悬浮培养而进一步向稳健不成熟β细胞表型(第6阶段)分化。实施例4具有类似于成熟人胰岛的提高的β细胞成熟标记物表达和蛋白质存在的内分泌细胞的悬浮培养物产生以下实施例展示表现出以下成熟标记物的共表达和蛋白质存在的c-肽细胞的悬浮培养物的产生:pdx1、nkx6.1、mafa、ucn3和slc2a1。将ez8培养基所培养的h1-hesc细胞系的细胞在第28代作为单细胞以0.094×106个细胞/cm2接种于1:30稀释的matrigeltm包被的皿上如下培养基中:dmem-f12、1:100稀释(“1x浓度”)的glutamaxtm、0.25mm抗坏血酸、100ng/mlfgf2、1ng/ml的tgfβ、1:100稀释的its-x、2%faf-bsa、以及20ng/ml的igf-1,该培养基补充有10μm的y-化合物。仅在接种后前24小时期间添加y-化合物。接种后四十八小时,将培养物在pbs(-/-)中洗涤。对于图7a至7m,使用以下方案来分化培养物。在方案的第1至第4阶段期间,将培养物保持在平面贴壁培养物上。从s4d3单层、或冷冻保存的s4d3细胞开始,制备aggrewelltm细胞簇,并再培养48小时(第4阶段第5天或s4d5)。培养基在整个分化方案中每天更换。在第5、第6和第7阶段期间,使aggrewelltm簇如实施例3所述培养于悬浮培养物中,不同的是相比于6天,第6阶段发生在7天内。a.第1阶段(3天):将细胞在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠,并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及1.5μm的mcx化合物。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及0.1μmgsk-3β抑制剂的mcdb-131培养基中再培养一天。随后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、以及100ng/mlgdf8的mcdb-131中再培养一天。b.第2阶段(2天):将细胞用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/mlfgf7的mcdb-131培养基处理两天。c.第3阶段(2天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;1%faf-bsa;25ng/mlfgf7;0.25μmsant-1;1μmra;0.25mm抗坏血酸;300nm的tpb”);以及ldn-hcl的blar001定制培养基处理两天。用于第3阶段第一天的ldn-hcl的浓度为100nm,并且第3阶段第二天为10nm。d.第4阶段(3天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;1%faf-bsa;0.25μmsant-1;50nmra;2ng/mlfgf7;70nmldn-hcl;0.25mm抗坏血酸;以及200nmtpb的blar001培养基处理三天。第4阶段第3天单层的冷冻保存:s4d3单层的冷冻保存的细胞库通过实施例3和表vii所概述的过程建立。e.冷冻保存的s4d3单层细胞的解冻:使包含5.0×106个s4d3单层细胞的冷冻5ml小瓶如实施例3所述进行解冻。f.aggrewelltm簇转化的第4阶段(2天):由第4阶段第3天单层细胞、或解冻的冷冻保存第4阶段第3天细胞产生aggrewelltm簇,如实施例3所述。g.第5阶段(3天):从aggrewelltm400ex板获取s4d5aggrewelltm簇,并采用27rpm(转/分钟)的旋转速度以1.5-2.0百万个细胞/ml的细胞密度转移到pbs0.1mag旋转器的第5阶段培养基中三天。将细胞用包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nmra;100nmldn-hcl;1μm的t3;以及10μm的alk5抑制剂ii的blar001培养基处理。仅在第5阶段第1天补充4ku/mldnasei和5μmy-化合物。h.第6阶段(7天):将aggrewelltm簇在包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;100nmldn-hcl;1μm的t3;10μm的alk5抑制剂ii、以及100nm的γ分泌酶抑制剂xx的blar001培养基中处理。i.第7阶段(6天至7天):将aggrewelltm簇在包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”)、10nm的t3(“低t3”);1mmnac;0.5μmzm”);以及构成制剂i(“fi”)的以下组分—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学上明确的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a;1:2000稀释的微量元素b的blar001或blar004培养基中处理七天。第7阶段期间所添加的附加化合物包括4μmazt”;或1μmdeza。为清楚起见,在利用上述浓度的两种条件(blar001或blar004基础培养基中)下,在第7阶段期间培养悬浮液中的aggrewelltm簇:(i)无alk5、低t3、zm、h、nac;(ii)无alk5、低t3、zm、h、nac、azt、deza。对于第5、第6和第7阶段,细胞培养物的调节以s4d5aggrewelltm簇或s4d3转化的ali簇起始。从aggrewelltm400ex板获取s4d5aggrewelltm簇,并采用27rpm(转/分钟)的旋转速度以1.5-2.0百万个细胞/ml的细胞密度转移到pbs0.1mag旋转器中。分化细胞的定量和表征:第7阶段aggrewelltm簇和人胰岛以if、facs和qrt-pcr表征,如实施例2和3所述。图7a示出如下过程:(i)新鲜s4d3单层或s4d3冷冻保存的细胞装配成aggrewelltm簇,通过(ii&iii)第5、6和7阶段经悬浮培养物调节,以产生(iv)s7d7aggrewelltm簇。如s6d6aggrewelltm簇(图6f-6g)所观察,第7阶段期间通过“无alk5低t3zmhnacdezaaztfiblar001”培养的s7d7aggrewelltm簇维持了基线β细胞蛋白质分布(图7b-7c)。89%的细胞为nkx6.1+chga+(左侧,图7b)、77.7%为nkx6.1+neurod1+(右侧,图7b)且40.8%为nkx6.1+insulin+(左侧,图7c)。大部分胰岛素阳性群体(总细胞的46.4%为insulin+)为nkx6.1+(左侧,图7c)并且不为高血糖素阳性(3.9%insulin+glucagon+;(右侧,图7c)。除基线β细胞分布特征之外,在第7阶段“无alk5低t3zmhnacdezaaztfiblar001或blar004”调节的s7d7aggrewelltm簇中,成熟标记物mafa(图7d)、ucn3(图7e)、slc2a1(图7f)、g6pc2(图7g)、insulin(图7h)和nkx6.1(图7i)的基因表达处于人胰岛水平或其以上。相比于在ali簇中,aggrewelltm(“无alk5低t3zmhnacdezaaztfiblar001或blar004”)中成熟标记物诸如mafa(图3c);g2pc2(图3f);insulin(图3h);和nkx6.1(图3l)的s7d7表达水平比较高。实际上,图7j-7m表明将deza和azt添加到“无alk5低t3zmhnacfiblar004”第7阶段调节,产生在s7d7共表达以下项(就蛋白质的存在而言)的显著数目的非高血糖素(图7j;底部,右侧)c-肽细胞:pdx1(图7j;底部,左侧)、nkx6.1(图7j;底部,中间)、mafa(图7k;底部,左侧)、ucn3(图7k;底部,中间)、以及slc2a1(图7k;底部,右侧)。对于各图,if-染色作为单道在顶行以c-肽表示。虽然mafa、slc2a1和ucn3的蛋白质存在不限于c-肽阳性细胞,预期至少约10%的细胞群将显示共表达c-肽、pdx1、nkx6.1、mafa、slc2a1和ucn3。相比之下,图7l-7m表明通过“无alk5低t3zmhnacfiblar004”-特异性第7阶段调节,产生在s7d7共表达以下一组部分成熟标记物(就蛋白质的存在而言)的c-肽细胞:pdx1(图7l;底部,左侧)、nkx6.1(图7l;底部,中间)、mafa(图7m;底部,左侧)、slc2a1(图7m;底部,右侧),但非高血糖素(图7l;底部,右侧)以及ucn3(图7m;底部,中间)。aggrewelltm簇的第7阶段“无alk5低t3zmhnacdezaaztfiblar004”调节产生了显著数目的成熟β细胞,类似于成熟成人胰岛,如基因表达和蛋白质存在所估计。概括地说,该实施例表明通过第7阶段调节的变化,第4阶段细胞簇可进一步在悬浮培养物中向功能性β细胞分化。具体地,实施例4示出在悬浮培养物中细胞簇内产生了c-肽细胞,其共表达β细胞的适当功能性所必须的β细胞成熟标记物。实施例5具有成熟人胰岛类似的葡萄糖依赖性线粒体呼吸和葡萄糖刺激的胰岛素分泌动力学的内分泌细胞的悬浮培养物产生以下实施例展示通过悬浮培养物产生了功能成熟的β细胞,该功能成熟的β细胞具有人胰岛类似的葡萄糖依赖性线粒体呼吸和葡萄糖刺激的胰岛素分泌(“gsis”)动力学。培养条件与实施例4相同。将ez8培养基所培养的h1-hesc细胞系的细胞在第28代作为单细胞以0.094×106个细胞/cm2接种于1:30稀释的matrigeltm包被的皿上如下培养基中:dmem-f12、1:100稀释(“1x浓度”)的glutamaxtm、0.25mm抗坏血酸、100ng/mlfgf2、1ng/ml的tgfβ、1:100稀释的its-x、2%faf-bsa、20ng/ml的igf-1,该培养基补充有10μm的y-化合物。仅在接种后前24小时期间添加y-化合物。接种后四十八小时,将培养物在pbs(-/-)中洗涤。对于图8a至8i,使用以下方案来分化培养物。在方案的第1至第4阶段期间,将培养物保持在平面贴壁培养物上。从s4d3单层、或冷冻保存的s4d3细胞开始,制备aggrewelltm细胞簇,并再培养48小时(第4阶段第5天或s4d5)。培养基在整个分化方案中每天更换。在第5、第6和第7阶段期间,使aggrewelltm簇培养于悬浮培养物中(如实施例3所述)。图8e至8f所示的ali簇如实施例2所述培养。简而言之:a.第1阶段(3天):将细胞在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠,并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及1.5μm的mcx化合物。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/mlgdf8、以及0.1μmgsk-3β抑制剂的mcdb-131培养基中再培养一天。随后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、以及100ng/mlgdf8的mcdb-131中再培养一天。b.第2阶段(2天):将细胞用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/mlfgf7的mcdb-131培养基处理两天。c.第3阶段(2天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;1%faf-bsa;25ng/mlfgf7;0.25μmsant-1;1μmra;0.25mm抗坏血酸;300nm的tpb”);以及ldn-hcl的blar001定制培养基处理两天。用于第3阶段第一天的ldn-hcl的浓度为100nm,并且第3阶段第二天为10nm。d.第4阶段(3天):将细胞用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;1%faf-bsa;0.25μmsant-1;50nmra;2ng/mlfgf7;70nmldn-hcl;0.25mm的抗坏血酸;以及200nmtpb的blar001培养基处理三天。e.第4阶段第3天单层的冷冻保存:s4d3单层的冷冻保存的细胞库使用实施例3和表vii所概述的过程建立。f.冷冻保存的s4d3单层细胞的解冻:使包含5.0×106个s4d3单层细胞的冷冻5ml小瓶如实施例3所述进行解冻。相同的过程可用于转化ali或aggrewelltm簇。g.用于aggrewelltm簇转化或s4d3ali簇转化的第4阶段(2天):由第4阶段第3天单层细胞、或解冻的冷冻保存第4阶段第3天细胞产生aggrewelltm簇,如实施例3所述。ali簇产生于第4阶段第3天细胞,如实施例2所述。类似于实施例4,对于第5、第6和第7阶段,细胞培养物的调节以s4d5aggrewelltm簇或s4d3转化的ali簇起始。从aggrewelltm400ex板获取s4d5aggrewelltm簇,并采用27rpm(转/分钟)的旋转速度以1.5-2.0百万个细胞/ml的细胞密度转移到pbs0.1mag旋转器中。h.第5阶段(3天):将aggrewelltm或ali簇用包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nmra;100nmldn-hcl;1μm的t3;以及10μm的alk5抑制剂ii的blar001培养基处理三天。对于aggrewelltm簇,仅在第5阶段第1天补充4ku/mldnasei和5μmy-化合物。i.第6阶段(7天):将aggrewelltm或ali簇在包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;100nmldn-hcl;1μm的t3;10μm的alk5抑制剂ii、以及100nm的γ分泌酶xx的blar001培养基中处理。j.第7阶段(7天至14天):将aggrewelltm或ali簇在包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”)、10nm的t3(“低t3”);1mmnac;0.5μmzm”);以及构成制剂i(“fi”)的以下组分—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学上明确的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a;1:2000稀释的微量元素b的blar001或blar004培养基处理七天。第7阶段期间所添加的附加化合物包括4μmazt”;或1μmdeza。为清楚起见,在利用上述浓度的两种条件(blar001或blar004基础培养基中)下,在第7阶段期间培养悬浮液中的aggrewelltm或ali簇:(i)无alk5、低t3、zm、h、nac;(ii)无alk5、低t3、zm、h、nac、azt、deza。图8a、8b、8h、8i:在第7阶段期间,将悬浮液中的aggrewell簇在两种条件下培养至s7d13或s7d14:(i)无alk5、低t3、0.5μmzm、10μg/mlh、1mmnac;(ii)s7d1至s7d5—无alk5、低t3、0.5μmzm、10μg/mlh、1mmnac;5μmazt;1μmdeza;s7d6至s7d13或s7d14—无alk5、低t3、0.5μmzm、10μg/mlh、1mmnac。分化细胞的定量和表征:对于s6d7ali簇的葡萄糖依赖性线粒体活性的量化,将第7阶段aggrewelltm簇、以及成熟人胰岛如实施例2所述通过seahorsexfe24装置进行表征。收获得到ali/aggrewelltm簇或人胰岛,并且在注射20mmd-葡萄糖之前和之后,在xfe24extracellularflux分析仪上测量其耗氧率(“ocr”)。将ali/aggrewelltm簇或人胰岛从其第7阶段调节移除,并在37℃非co2环境和设计用于实现基线ocr的培养基中温育2小时。预温育培养基包含溶于xf基础培养基的1mmd-葡萄糖、1mml-谷氨酰胺和1mm丙酮酸钠。在预温育之后,将ali/aggrewelltm簇或人胰岛装载到进行以下测量的seahorse机器上:(i)3x基线ocr(d-葡萄糖注射前);(ii)5xd-葡萄糖注射后(注射后温育时间:72分钟)。使所有ocr测量规一化为各样品的dna含量。通过qiaampdnamicroki分离dna,并且通过nanodrop8000uv-vis分光光度计测量dna含量。对于葡萄糖依赖性胰岛素分泌的量化,将第7阶段ali簇、aggrewelltm簇和成熟人胰岛通过细胞灌注系统(bioreptechnologies,miami,florida,目录号peri4-02)进行表征。简而言之,为使胰岛素分泌归一化为基线,将ali/aggrewelltm簇或人胰岛转移到温热的(37℃)kreb缓冲液(表ix)中。将细胞装载到灌注室(bioreptechnologies,目录号peri-chamber),并用补充有下列中任一者的四个顺序kreb缓冲液连续地灌注(100μl/min流速):(i)3mmd-葡萄糖;(ii)16.7mmd-葡萄糖±100ng/mlexendin-4(“ex4”);以及(iii)含有3mmd-葡萄糖的25mmkcl。具体灌注方案示于各图中。每分钟收集灌注液试样,并通过c-肽elisa(mercodia,uppsala,sweden,目录号10-1136-01)检测c-肽蛋白质水平(以ng/ml为单位)。图8a和8b示出悬浮液中的s7d13aggrewelltm簇对于20mmd-葡萄糖的线粒体响应。图8a和8b均示出由注射后(“ip”)15分钟(“min”)之后相比于基线的ocr123.3%±12.92所示,人胰岛(黑色圆圈线)迅速响应于高d-葡萄糖,并且随时间推移维持较高的ocr(131.5%±11.32;72minip)。相反地,富集不成熟c-肽阳性细胞的s6d7ali簇(灰色三角形线)缺乏对高d-葡萄糖迅速的ocr响应(104.4%±3.37;15minip),并且表现出随时间推移相对较弱的ocr响应(113.3%±4.51;72minip)。在悬浮液中aggrewelltm簇环境中,在s7d13的“无alk5、低t3、zm、h、nac、fi、blar004”条件下观察到人胰岛类似的葡萄糖依赖性线粒体呼吸动力学(110.7%±2.46–15minip;125.9%±2.27–72minip)(灰色正方形线)(图8a)。相比之下,“无alk5、低t3、zm、h、nac、fiblar001或blar004”s7d7ali簇并未显示人胰岛水平的葡萄糖依赖性线粒体呼吸动力学(图5c和5e)。此外,悬浮液中“无alk5、低t3、zm、h、nac、azt、deza、fi、blar004”aggrewelltm簇响应于高葡萄糖刺激的耗氧量显著高于人胰岛水平(162.0%±11.51–15minip;177.1%±0.99–72minip)(灰色正方形线)(图8b)。deza和azt仅在第7阶段调节的前四天期间施用,这意味着azt和deza获得的功能性线粒体响应性在第7阶段aggrewelltm簇中稳定至少10天。图8c示出人胰岛内的成熟β细胞表现出响应于葡萄糖刺激的多轮快速的双相胰岛素分泌的能力。第二双相gsis响应相比于第一(约7-8倍于第一gsis响应的第一时相)有所钝化。另外,人胰岛显示能够多轮“通-断”切换胰岛素分泌,并且能够在kcl-介导的膜去极化时大量释放胰岛素颗粒。测试的所有条件均表现出对kcl的较强胰岛素分泌响应(图8c-8i)。添加exendin-4(“ex4”)并未增大所示的人胰岛中gsis响应的幅值,但被包括在内以与ali或aggrewelltmgsis特征进行比较(图8d)。无论是blar001(图8e)还是blar004(图8f)中,在“无alk5、低t3、zm、h、nacfi”中第7阶段期间调节的s7d8-s7d10ali簇示出单一(约4-10倍于第一gsis响应的第一时相)相对缓慢的双相gsis响应,但未示出第二响应。而且,ali簇不能在刺激后再灌流3mmd-葡萄糖时切断胰岛素分泌的第二时相。相比之下,“无alk5、低t3、zm、h、nac、fiblar004”中第7阶段期间调节的s7d14aggrewelltm簇表现出较强的第一双相gsis(约5倍于第一gsis响应的第一时相),接着能够完全切断gsis,以及较弱的第二单相响应(图8g)。在将deza和azt添加至“无alk5、低t3、zm、h、nac、fiblar004”调节情况下,s7d14aggrewelltm簇表现出多轮人胰岛类似的双相gsis(约5-7倍于第一gsis响应的第一时相),并且能够在高葡萄糖脉冲之间完全切断gsis(图8h-8i)。图8h和8i表示“无alk5、低t3、zm、h、nac、deza、aztblar004”s7d14aggrewelltm簇条件的两次生物平行测定。在图8h-8i中,deza和azt仅在第7阶段调节的前四天期间施用,这意味着azt和deza获得的稳健双相gsis响应在第7阶段aggrewelltm簇中稳定至少10天。概括地说,实施例5表明通过细胞聚集和悬浮培养产生了具有人胰岛-类似的葡萄糖依赖性线粒体呼吸和gsis动力学的hesc-衍生的功能性β细胞(第7阶段)。以上实施例描述了各个小分子,其通常用作细胞周期抑制剂,但在本文发明中描述之前是意料不到的,它们诱导关键成熟β细胞标记物(包括pdx1、nkx6.1、mafa、ucn3和slc2a1)的表达。实施例6:在多种类型的悬浮培养物中产生衍生自cyt49hesc的胰腺内胚层。以下实施例展示以多种悬浮培养形式(滚瓶和pbsbiotechmaglifttm垂直轮生物反应器)利用分化方案,改善地产生衍生自人多能干细胞,尤其是cyt49人胚胎干细胞系(“hesc”)的胰腺内胚层细胞。表xiii列出对cyt49hesc-衍生的胰腺内胚层进行的特定增强。具体地,由cyt49hesc产生的胰腺内胚层表现出可选内胚层谱系和内分泌分化两者的发生率较低(均为进一步有效的产生产胰岛素细胞的重要要求),并且更类似于h1hesc-衍生的胰腺内胚层(实施例3)。此外,产生cyt49hesc-衍生的胰腺内胚层所需的时间减少5天。新cyt49hesc-衍生的胰腺内胚层方案可应用于滚瓶和生物反应器形式,从而允许横向扩展(scale-out)和纵向扩展(scaleup)制备。表xiv概述了对分化方案所作的主要调整,以产生改善的cyt49hesc-衍生的胰腺内胚层。主要差异包括第3-4阶段期间缺乏bmp-抑制,并且使用mcdb131(第1-2阶段)和blar001(第3-4阶段)作为基础培养基。将工作细胞库4a(“wcb4a”)第27代人胚胎干细胞系cyt49(“cyt49-hesc”;nih登记0041)的细胞作为单细胞以0.033×106个细胞/cm2接种于经组织培养物处理的皿上含有以下的生长培养基中:dulbecco改良的eagle培养基营养(dmem)混合物f-12,以及1:100xglutamax(“dmem-f12”;lifetechnologies,carlsbad,california,目录号10565)、1:10稀释(“10%浓度”)的xenofree(“xf”)剔除血清替代物(“ksr”;lifetechnologies,目录号12618)、1:100稀释(“1x浓度”)的mem非必需氨基酸、1:100稀释(“1x浓度”)的青霉素-链霉素、10ng/ml的人活化素a(r&dsystems,minneapolis,minnesota,目录号338-ac)、以及10ng/ml人调节蛋白-β1(peprotech,rockyhill,newjersey,目录号100-03)。1:10稀释(“10%浓度”;valleybiomedical,winchester,virginia,目录号hp-1022)的人血清ab仅在接种后前24小时期间使用。在接种后九十六个小时,使汇合的cyt49hesc培养物在以上所提及的生长培养基中传代。另选地,使汇合的cyt49hesc通过accumax(innovativecelltechnologies,sandiego,california,目录号am105)处理(在37℃下3分钟)作为单细胞悬浮液释放,并在31rpm的速度和一百万个细胞/ml的浓度下,在滚瓶(corning,corning,newyork,目录号cls431644)中含有以下的培养基中聚集:dmem-f12、以及1:100xglutamax(lifetechnologies,目录号10565)、1x浓度的青霉素-链霉素、1:50稀释的补充剂(lifetechnologies,目录号me130070l1)、10ng/ml人活化素a、10ng/ml人调节蛋白-β1、以及200ng/mllr3-igf1(cellsciences,newburyport,massachusetts,目录号lrm001)。对于图9a-9q,使用下列方案(图9a所示)以悬浮培养形式分化培养物。在方案的第1至第4阶段期间,使悬浮培养物在2升滚瓶(“rb”)中以31rpm、0.1pbsmini或0.5pbsminimaglifttm垂直轮生物反应器(pbsbiotech,camarillo,ca)中以45rpm维持。“0.1pbs”是指100mlminimaglifttm垂直轮生物反应器,并且“0.5pbs”是指500mlminimaglifttm垂直轮生物反应器。将cyt49hesc聚集体以约0.18-0.36百万个细胞/ml在2升滚瓶的500ml培养基体积、0.1pbsmini的100ml培养基体积、或0.5pbsmini的500ml培养基体积中输入。每天更换细胞培养基。a.第1阶段(2天):将未分化的es聚集体在以下第1阶段培养基中培养一天:mcdb-131培养基,其包含2.7g/1000ml碳酸氢钠,并补充有0.5%faf-bsa、1:100稀释(“1x浓度”)的glutamaxtm、4.5mmd-葡萄糖(以获得10mm的d-葡萄糖的最终浓度)、100ng/ml人活化素a、50ng/ml小鼠wnt3a(randdsystems,目录号1324-wn)、以及1:10000稀释的its-x(“胰岛素-转铁蛋白-硒-乙醇胺”;thermofisherscientific,waltham,massachusetts,目录号51500056)。然后,将细胞在包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1x浓度的glutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、100ng/ml人活化素a、以及1:10000稀释的its-x的mcdb-131培养基中再培养一天。b.第2阶段(3天):将聚集体用包含2.7g/1000ml碳酸氢钠并补充有0.5%faf-bsa、1xglutamaxtm、4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度)、0.25mm抗坏血酸、以及50ng/ml成纤维细胞生长因子7(“fgf7”;peprotech,目录号af-100-19)的mcdb-131培养基处理两天。c.第3阶段(2天):将聚集体用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1xglutamaxtm;0.25%faf-bsa;25ng/mlfgf7;0.25μmsant-1(n-[(3,5-二甲基-1-苯基-1h-吡唑-4-基)亚甲基]-4-(苯基甲基)-1-哌嗪胺);1μm视黄酸(“ra”);0.25mm的抗坏血酸;以及300nm的pkc活化剂((2s,5s-(e,e)-8-(5-(4-三氟甲基)苯基-2,4,-戊二烯酰氧基氨基)苯并内酰胺(“tpb”)的blar001定制培养基处理两天。d.第4阶段(3天):将聚集体用包含3.6g/1000ml碳酸氢钠并补充有1:200稀释的its-x;4.5mmd-葡萄糖(以获得10mmd-葡萄糖的浓度);1x浓度的glutamaxtm;0.25%faf-bsa;0.25μm的sant-1;50nm的ra;2ng/mlfgf7;0.25mm的抗坏血酸;以及300nmtpb的blar001培养基处理三天。美国专利8,445,273;8,895,300(全文以引用方式并入本文中)描述了通过至少以下所列的方案产生的pec-01(“胰腺内胚层细胞—01”)d15。cyt49hesc聚集体以每ml的1.0μl至2.0μl聚集体沉淀体积(“apv”)输入。以下方案的第1至第4阶段作为悬浮培养物维持于以31rpm旋转的2升滚瓶的500ml体积中。a.第1阶段(2天;d1-d2):将未分化的es聚集体用补充有1x浓度的glutamaxtm;0.2%胎牛血清(“fbs”;hyclone,loganutah,目录号sh30070.03);1x浓度的青霉素-链霉素;1:5000稀释的its(invitrogen,waltham,massachusetts,目录号41400);100ng/ml活化素a;以及50ng/mlwnt3a的rpmi1640培养基(lifetechnologies,目录号21870-076)处理一天。细胞随后在rpmi1640培养基中再培养一天,所述rpmi1640培养基补充有1x浓度的glutamaxtm;0.2%胎牛血清;1x浓度的青霉素-链霉素;1:5000稀释的its;100ng/ml活化素a;以及50ng/mlwnt3a。b.第2阶段(3天;d3-d5):将聚集体用补充有1x浓度的glutamaxtm;0.2%胎牛血清;1x浓度的青霉素-链霉素;1:1000稀释的its;25ng/ml人fgf7;以及2.5um转化生长因子β抑制剂iv(“tgf-β”;emdbioscience,billerica,massachusetts,目录号616454)的rpmi1640培养基处理一天。细胞随后在rpmi1640培养基中再培养两天,所述rpmi1640培养基补充有1x浓度的glutamaxtm;0.2%胎牛血清;1x浓度的青霉素-链霉素;1:1000稀释的its;以及25ng/ml人fgf7。c.第3阶段(3天;d6-d8):将聚集体用补充有1:50稀释的b-27补充剂(invitrogen,目录号17504-044);1x浓度的青霉素-链霉素;1x浓度的glutamaxtm;1:1000稀释的its;3nmttnpb(“4-[(e)-2-(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)-1-丙烯基]苯甲酸”;sigma-aldrich,st.louis,missouri,目录号t3757);0.25umkaad-环杷明(“3-酮基-n-氨基乙基-n’-氨基己酰基二氢肉桂酰基环杷明”;torontoresearchchemicals,northyork,canada,目录号k171000);以及50ng/ml人头蛋白(randdsystems,目录号3344-ng)的dmem-hi葡萄糖培养基(invitrogen,目录号11960-051)处理三天。d.第4阶段(3天:d9-d12;d12也称为“pec-01d12”):将聚集体用补充有1:50稀释的b-27补充剂;1x浓度的青霉素-链霉素;1x浓度的glutamaxtm;50ng/ml人表皮生长因子(“egf”;peprotech,目录号af-100-15);50ng/mlfgf7;以及50ng/ml人头蛋白的dmem-hi葡萄糖培养基处理三天。e.d12的冷冻保存:使聚集体重悬于补充有1x浓度的glutamaxtm;15%浓度的dmso(“二甲基亚砜”;origenbiomedical,austin,texas,目录号cp-10);60%浓度的不含xf的ksr;以及25mmhepes缓冲溶液(“n-2-羟乙基哌嗪-n-2-乙烷磺酸”;thermofisherscientific,目录号15630080)的dmem-hi葡萄糖培养基中。使用以下方案,使d12聚集体冷冻保存于控制速率冷却器(“crf”;planerplc,sheppertonsunbury-on-thames,unitedkingdom,目录号kryo560-16)中:(1)起始温度-2.0c;(2)以-2.0c/min到-9.0c;(3)-9.0c下保持10分钟,并手动地开始冷冻;(4)以-0.2c/min到-40c;(5)以-25c/min到-150c;(6)转移至液氮储存。f.pec-01冻存后(3天;d13-d15):将聚集体用补充有1:50稀释的b-27补充剂;1x浓度的青霉素-链霉素;1x浓度的glutamaxtm;50ng/ml人表皮生长因子(“egf”;peprotech,目录号af-100-15);50ng/mlfgf7;以及50ng/ml人头蛋白的dmem-hi葡萄糖培养基处理三天。在第一天,仅将10u/mldnasei(roche,basel,switzerland,目录号04536282001)补充到培养基中。分化细胞的表征:对于利用2升滚瓶、0.1pbs、或0.5pbs悬浮培养方法的基因表达的量化,收获得到cyt49-hesc、第4阶段第3天(“s4d3”)和pec-01d15聚集体,如naturebiotechnology,2014,(32)11,1121-1133中所述。使用定制taqman阵列(加利福尼亚州福斯特城的应用生物系统公司(appliedbiosystems,fostercity,california))来在细胞中评估基因表达。使用序列检测软件(加利福尼亚州福斯特城的应用生物系统公司(appliedbiosystems,fostercity,california))来分析数据,并且使用gapdh作为未分化的cyt49-hesc的管家基因使用δδct方法来将数据归一化。引物详情列于表xv中。对于利用2升滚瓶、0.1pbs、或0.5pbs悬浮培养方法的蛋白质存在共定位的量化,收获得到cyt49-hesc、第4阶段第3天(“s4d3”)和pec-01d15聚集体,并通过荧光激活流式细胞术(“facs”)进行分析。如naturebiotechnology,2014(32)11,1121-1133中所述并且使用表xvi中列出的抗体进行facs染色。将分化的细胞在accumax(innovativecelltechnologies,sandiego,california,目录号am105)中室温下温育20分钟,释放到单细胞悬浮液中,然后将其用automacs运行缓冲液(bergisch,germany,miltenylbiotec,目录号120-091-221)洗涤两次,并在室温下固定于4%多聚甲醛(“4%pfa”;sigma-aldrich,目录号158127)中30分钟,随后在automacs运行缓冲液中洗涤两次。然后将细胞与适当的抗体(表xvi)在使用bdfacsdiva软件在bdfacscantoii上进行分析之前温育(至少获取30,000项事件)。在facs分析期间排除非活细胞,并通过使用同种型抗体(“igg”)来确定门控。对于利用2升滚瓶、0.1pbs、或0.5pbs悬浮培养方法的细胞产量的量化,收获得到cyt49-hesc和第4阶段第3天(“s4d3”)聚集体,并通过nc-100(chemometec,allerod,denmark,目录号nc-100)进行计数。图9a示出如何利用新方案使cyt49hesc向胰腺内胚层(例如s4d3)分化。此处强调pec-01d12和pec-01d15作为现有技术的示例。基于悬浮培养方法经由胰腺内胚层中间体来商业规模产生产胰岛素细胞的适应性,利用悬浮培养方法,即2升滚瓶、或0.1pbs、或0.5pbs垂直轮生物反应器。虽然2升滚瓶形式是横向扩展胰腺内胚层细胞的可用工具,但对于最终商业规模的产胰岛素细胞并不理想。pbsbiotechmaglifttm垂直轮生物反应器系统是可选的纵向扩展系统,其将提供逐步改善产胰岛素细胞产量的能力,同时随时间推移增大体积并维持较小/紧凑的聚集体尺寸。图9b表明可以预知,s4d3的细胞产量反映出细胞数目相对于hesc输入有显著扩增。s4d3细胞与hesc输入的比率在利用新方案的所有悬浮液培养方法之间一致;对于2升滚瓶为4.30±0.782,对于0.1pbs为3.27±0.585,并且对于0.5pbs为4.08±0.854,且相对于现有技术(2.23±0.090pec-01d12细胞/hesc输入)显著增加。此外,在图9c中表明,可使用pbsmaglifttm垂直轮生物反应器系统有效地放大所公开的分化方案。当培养基体积从100ml(0.1pbs)增至500ml(0.5pbs)时,观察到s4d3产量增大约6倍(图9c)。此外,相对于基于滚瓶的s4d3(~274±92.5微米)和pec-01d12(~259±55.3微米),利用0.1pbs(~150±33.2微米)或0.5pbs(~153±37.6微米)悬浮液形式导致均一较小的s4d3聚集体。需要冷冻保存、解冻并另外的三天培养pec-01d12来使pec-01聚集体尺寸降低到0.1pbs和0.5pbs所见的规模(pec-01d15;~191±45.4微米)(图9d-9e)。已表明在所有悬浮培养方法中利用新cyt49hesc-衍生分化方案来实现稳健的胰腺内胚层表型。在2升滚瓶、0.1pbs、0.5pbs方法中,nkx6.1(图9f)、ptf1a(图9g)、pdx1(图9h)均被显著地诱导,这类似于pec-01d15。不同于导致sox2(可选的内胚层谱系;图9i)、neurod1(早期内分泌分化;图9k)、chga(早期内分泌分化;图9l)表达提高的pec-01d15分化方案,在cyt49中测试的所有悬浮培养方法中,新分化方案使这些非胰腺内胚层标记物下降。实际上,此类非胰腺内胚层的富集使胰腺内胚层产生效率下降,如以蛋白质水平所评估。相对于pec-01d12(~38.0%;图9m),pdx1与nkx6.1之间的蛋白质共定位在利用新cyt49hesc-衍生分化方案的所有新s4d3悬浮培养方法中得到提高;2升滚瓶~64.6%(图9n)、0.1pbs~48.9%(图9o)和0.5pbs~65.3%(图9p)。此外,pec-01d12中所观察的~49%的pdx1+nkx6.1+胰腺内胚层还表达sox2+(图9m),这不同于利用新cyt49hesc-衍生分化方案的所有新s4d3悬浮培养方法;2升滚瓶~2.0%(图9n)、0.1pbs~10.0%(图9o)和0.5pbs~6.2%(图9p)。pec-01d12中所见的相对较低百分比的胰腺内胚层也通过相对于所有新s4d3悬浮培养方法而言早期内分泌分化的发生率增大(~49.6%;图9m)反映出;2升滚瓶~26.9%(图9n)、0.1pbs~26.6%(图9o)和0.5pbs~30.2%(图9p)。需要冷冻保存、解冻和3天附加细胞培养pec-01d12来使pdx1和nkx6.1(pec-01d15;~47.5%;图9q)的共定位略微提高,且sox2(~22.5%;图9q)和chga(~42.5%;图9q)下降。nkx6.1与cdx2之间的蛋白质共定位在测试的所有条件下均较低(图9m-9q),如由所有类型悬浮培养中s4d3的较低cdx2基因表达所反映(图9j)。实施例7:在多种类型的悬浮培养物中产生衍生自cyt49hesc的产胰岛素细胞:以下实施例展示以多种悬浮培养形式(滚瓶、以及0.1pbs和0.5pbsbiotechmaglifttm垂直轮生物反应器两者)利用新分化方案,改善地产生衍生自cyt49人胚胎干细胞系(“hesc”)的胰腺产胰岛素细胞。表xvii列出对cyt49hesc-衍生的产胰岛素细胞进行的特定增强。同时,类似于pec-01-衍生和类似pec-01-衍生产胰岛素细胞的持续时间(现有技术为stemcellstranslmed,2015(10)4,1214-1222),用于由cyt49hesc产生胰岛素阳性细胞的新分化方案经由多激素胰岛素产生细胞(ins+gcg+两者)以及单激素胰岛素产生细胞中pdx1、nkx6.1、chga、mafa的蛋白质存在的显著下降而表现出提高的单激素胰岛素产生细胞(仅ins+)的产量。gcg-存在的缺乏,以及单激素胰岛素阳性细胞中nkx6.1、mafa-存在的诱导是最终获取人胰岛类似的功能性所需要的(实施例2-5)。此外,新cyt49hesc-衍生的胰腺胰岛素产生细胞方案首次表现出在生物反应器中纵向扩展的能力,这相比于滚瓶的横向扩展而言能够更好地控制产胰岛素细胞的最终商业细胞制造(实施例7)。表xviii概述了对分化方案所作的主要调整,以产生改善的cyt49hesc-衍生的胰腺内胚层。主要差异包括所用的小分子和基础培养基。缩写包括:nic—烟酰胺;mg—matrigel(基质凝胶);gsi—γ分泌酶抑制剂;rocki—rho-相关的蛋白激酶抑制剂。将工作细胞库4a(“wcb4a”)第27代人胚胎干细胞系cyt49(“cyt49-hesc”;nih登记0041)如实施例6所述进行接种和维持。而且,通过第1-4阶段,cyt49hesc的聚集和分化如实施例6所述的那样实施。对于图10a-10ab,在第5-7阶段期间使用下列方案(图10a所示)以悬浮培养形式分化培养物。在方案的第5至第7阶段期间,使悬浮培养物在滚瓶(“rb”)中以31rpm、0.1pbsmini或0.5pbsminimaglifttm垂直轮生物反应器中以45rpm维持。“0.1pbs”是指100mlminimaglifttm垂直轮生物反应器,并且“0.5pbs”是指500mlminimaglifttm垂直轮生物反应器。需注意,第7阶段分化方案称为基础调节,因为用于诱导产胰岛素细胞功能性的混合物不包括在内并且是另一公开的主题。在第5-6阶段期间,每天更换培养基,而在第7阶段,每隔一天更换培养基。a.第5阶段(3天):将s4d3cyt49(实施例6—新cyt49hesc-衍生方案)或pec-01d15衍生的聚集体用包含2.7g/1000ml碳酸氢钠、补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;0.25μmsant-1;50nm的ra;100nmldn-hcl;1μm的t3;以及10μm的alk5抑制剂ii的blar001培养基处理。b.第6阶段(7天):将聚集体在包含2.7g/1000ml碳酸氢钠,补充有1:200稀释的its-x;14.5mmd-葡萄糖(以实现20mmd-葡萄糖的最终浓度);1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”);10μmznso4;100nmldn-hcl;1μm的t3;10μm的alk5抑制剂ii、以及100nm的γ分泌酶抑制剂xx的blar001培养基中处理。对于第6-7阶段,将0.5pbs悬浮培养物中的s5d3聚集体转移到0.1pbs悬浮培养物中。c.第7阶段(7至23天):将聚集体在包含2.7g/1000ml碳酸氢钠并补充有1:200稀释的its-x;1xglutamaxtm;2%faf-bsa;10μg/ml的肝素(“h”)、10nm的t3(“低t3”);1mmnac;以及构成制剂i(“fi”)的以下组分—1:200稀释的rpmi维生素补充剂;1:200稀释的mem非必需氨基酸补充剂;1:2000稀释的化学上明确的脂质浓缩物;1:200稀释的丙酮酸钠;1:2000稀释的微量元素a;1:2000稀释的微量元素b的blar001培养基中处理。分化细胞的表征:对于利用滚瓶、0.1pbs、或0.5pbs悬浮培养方法的基因表达的量化,收获得到cyt49-hesc、第4阶段第3天(“s4d3”)、第5阶段第3天(“s5d3”)、第6阶段第7天(“s6d7”)、以及第7阶段第7天(“s7d7”)聚集体,如naturebiotechnology,2014,(32)11,1121-1133和实施例1中所述。引物详情列于表xix中。对于利用滚瓶、0.1pbs、或0.5pbs悬浮培养方法的蛋白质存在共定位的量化,收获得到cyt49-hesc、第5阶段第3天(“s5d3”)、第6阶段第7天(“s6d7”)、第7阶段第13天(“s7d13”)、以及第7阶段第14天(s7d14”)聚集体,并如实施例1所述通过荧光激活流式细胞术(“facs”)进行分析。用于facs分析的抗体的列表示于表xx中。对于利用滚瓶、0.1pbs、或0.5pbs悬浮培养方法的细胞产量的量化,收获得到cyt49-hesc和第6阶段第7天(“s6d7”)聚集体,并通过nc-100(chemometec,allerod,denmark,目录号nc-100)进行计数。对于利用滚瓶、0.1pbs、或0.5pbs悬浮培养方法的蛋白质共定位的量化,收获得到第6阶段第7天(“s6d7”)、第7阶段第16天(“s7d16”)、以及第7阶段第23天(s7d23”)聚集体,并通过免疫荧光(“if”)进行分析。如naturebiotechnology,2014,(32)11,1121-1133和先前实施例所述制备cyt49-hesc-衍生的聚集体,并使用本文表xxi中列出的抗体。图10a示出用于通过第5-7阶段向产胰岛素细胞分化s4d3cyt49-衍生的hesc的新方案。具体地,此处衍生的产胰岛素细胞表现出pdx1、nkx6.1、chga、insulin和mafa的共表达和蛋白质存在而无glucagon。图10b示出s6d7的细胞产量约等于2升滚瓶(“rb”)(0.95±0.31,s6d7相对于hesc输入)和0.1pbs(0.92±0.23,s6d7相对于hesc输入)悬浮培养方法的初始hesc输入。出人意料地是,使用0.5pbs形式的悬浮培养在s6d7表现出最高的细胞产量;对于一个hesc细胞输入,产生2.4±0.169s6d7个细胞。此外,已表明(参见图10c),可使用maglifttm垂直轮生物反应器系统有效地放大第5-7阶段分化方案。当培养基体积从100ml(0.1pbs)增至500ml(0.5pbs)时,观察到s6d7产量增大约7.5倍(图10c)。此外,相对于基于2升滚瓶的聚集体,利用0.1pbs或0.5pbs悬浮形式导致均一较小的s5d3(图10d)、s6d7(图10e)和s7d13-s7d14(图10f)聚集体。简而言之,采用所公开的使用滚瓶的方案培养的s6d7聚集体悬浮液表现出以下直径;rb~265±79.0微米(图10e左侧)、0.1pbs~190±59.9微米(图10e中间)和0.5pbs~227±59.0微米(图10e右侧)。另外,利用pbsminimaglifttm垂直轮生物反应器通过s7d14维持人胰岛水平功能性(实施例7)所需的紧密的聚集体尺寸和结构(图10f)。相反地,2升滚瓶悬浮液中的s7d13聚集体最终丧失其紧密的聚集体结构,并且形成松散的细胞层(图10f)。已示出使用新方案的所有悬浮培养方法诱导稳健的胰腺产胰岛素细胞的基因特征图;rb、0.1pbs和0.5pbs诱导了维持/提高的β细胞转录因子pdx1(图10g)、nkx6.1(图10h);内分泌标记物/转录因子chga(图10i)、neurod1(图10j)、ngn3(图10k);β细胞激素insulin(图10l);以及早期β细胞成熟转录因子mafa(图10m)的表达。相反地,当在2升滚瓶中使用新分化方案(“pec-01-衍生”)使pec-01d15聚集体分化成产胰岛素细胞时,观察到显著诱导了glucagon连同insulin的表达(图10l、10n)。实际上,蛋白质存在的分析表明,如先前在naturebiotechnology,2014,(32)11,1121-1133中所述,新分化方案诱导了稳健的胰腺内分泌前体(第5阶段),导致在cyt49hesc品系中产生单激素胰岛素产生细胞(第6-7阶段)。图10o示出经由s5d3,0.5pbs中培养的聚集体的约54.1%为chga+nkx6.1+(对于所有悬浮液形式,从s4d3的~1%chga+nkx6.1+增大;图9n-9p),这是较高内分泌分化率的结果—由s5d3的pax4+chga+细胞富集所示。pax4是ngn3的直接靶基因,胰腺中内分泌分化的驱动者。通过s7d13-s7d14,nkx6.1+insulin+细胞总数在所有悬浮液形式中显著增加;从s5d3的约15.4%(图10p)增至s6d7的rb中~40.3%(图10q);s6d7的0.1pbs中~44.7%(图10r);s7d13的rb中~51.8%(图10s);以及s7d14的0.1pbs中~48.9%(图10t)。相似地,通过s7d13-s7d13,nkx6.1+chga+细胞的百分比从s4d3的~1%(图9n-9p)增至s6d7的rb中~81.0%(图10q);s6d7的0.1pbs中~88.7%(图10r);s7d13的rb中~79.6%(图10s);以及s7d14的0.1pbs中~80.9%(图10t)。已表明第7阶段新方案所产生的大部分nkx6.1+insulin+细胞是单激素的,并且不富集α-细胞激素glucagon;s6d7的rb中insulin+glucagon+为~18.8%(图10q);s6d7的0.1pbs中为~14.4%(图10r);s7d13的rb中为~7.7%(图10s);以及s7d14的0.1pbs中为~6.5%(图10t)。此外,已表明多激素细胞仅占第7阶段总细胞的较小分数(图10s-10t),其可能起源于chga+nkx6.1-群体,cyt49-衍生的s4d3细胞的数目相对于h1-衍生的s4d3细胞固有地较高(实施例3)。出人意料地是,s6d7的2升滚瓶中的pec-01衍生的聚集体表现出insulin与glucagon之间的~41.9%共定位。在所有测试条件中,glucgaon+insulin+细胞不为nkx6.1+,如对s6d7的2升滚瓶中pec-01-衍生的聚集体、以及s7d14的新方案s4d3-衍生的0.1pbs、s7d13的2升滚瓶所示(图10v)。if-分析中反映了产胰岛素内分泌细胞的稳健诱导。无论是以rb还是0.1pbs形式培养,聚集体均示出在s6d7(0.1pbs–图10w)和s7d16-d23(rb–图10aa;0.1pbs–图10y)两者对synaptophysin+nkx6.1+insulin+细胞的较大富集。此外,早期成熟转录因子mafa已在s6d7的0.1pbs中被诱导(图10x),并且变为在s7d23的rb中(图10ab)和s7d16的0.1pbs中(图10z)在第7阶段与insulin-阳性细胞共存在。尽管本发明已结合各种具体材料、操作步骤和实施例进行了描述和举例说明,然而应当理解,本发明并不限于出于描述和举例说明目的选择的材料和操作步骤的特定组合。本领域的技术人员应当理解,本发明可能暗示此类细节的多种变型。认为说明书和实施例的作用仅在于示例,本发明的真实范围和实质仅由随附权利要求书限定。本申请中提到的所有参考文献、专利和专利申请全文以引用方式并入本文。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1