三维培养皮肤片、用于其制造的细胞培养容器和该三维培养皮肤片的制造方法与流程
本发明涉及三维培养皮肤片。此外,本发明涉及用于制造三维培养皮肤片的细胞培养容器。此外,本发明涉及三维培养皮肤片的制造方法。本申请基于2016年6月24日提出的日本申请(特愿2016-125843号)和2016年12月28日提出的日本申请(特愿2016-256778号)的优先权。
背景技术:
皮肤是将生物体内与生物体外的环境分开的覆盖体表的器官。皮肤作为物理性屏障起作用,避免干燥、有害物质向生物体内侵入,对生命的维持发挥不可缺少的作用。
高等脊椎动物的皮肤如果从最外层起大致区分则由表皮、真皮、皮下组织的层形成。已知在表皮与真皮的界面具有起伏,该起伏随着老化而平坦化(例如,参照非专利文献1。)。表皮主要由被称为角质形成细胞的细胞构成,在表皮的最深部(基底层)角质形成细胞分裂,同时一边向上层分化成棘层、颗粒层、进而角质层,一边向表面移动,不久变成污垢脱落。该循环在人的情况下以大致4周进行。
尝试了构建在生物体外模仿了表皮结构及其功能的各种培养皮肤模型,也已经有市售品(例如,参照专利文献1、非专利文献2、和非专利文献3)。此外,进行了下述尝试:在具有通过光刻而制作的槽的模型中注入胶原凝胶,在对该胶原凝胶接种成纤维细胞而制作的支架上进一步接种角质形成细胞而制作三维培养皮肤模型(专利文献2、非专利文献4),使用在培养表面设置有起伏的细胞培养器材,研究对原代人角质形成细胞所包含的干细胞的配置的影响(非专利文献5),也使用由生物降解性高分子脱乙酰壳多糖、聚己内酯或其混合物形成的细胞培养器材表面,研究了对人角质形成细胞的分化的影响(非专利文献6)。此外,也进行了下述尝试:在从由人的捐献体采集的皮肤组织除去了上皮组织和细胞成分的人无细胞化真皮基质上,接种角质形成细胞,制作三维培养皮肤(非专利文献7)。
这样的培养皮肤模型在化妆品、对皮肤涂抹的药剂的安全性试验、基础研究等中使用,作为代替动物的模型而受到关注,但是仍然得不到具有与人的皮肤同等水平的厚度和屏障功能的培养皮肤模型。
现有技术文献
专利文献
专利文献1:日本特开2012-235921号公报
专利文献2:美国专利申请公开第2011/0171180号说明书
非专利文献
非专利文献1:lavkerr.m.structuralalterationsinexposedandunexposedagedskin.jinvestdermatol.1979jul;73(1):59-66.
非专利文献2:belle.,etal.,thereconstitutionoflivingskin.jinvestdermatol.1983jul;81(1suppl):2s-10s.
非专利文献3:“ケラチノサイト三次元培養スターターキット”,[online],2009年5月11日,フナコシ株式会社,[2016年6月16日检索],网站<url:http://www.funakoshi.co.jp/contents/3571>
非专利文献4:clemental,moutinhotjjr,pinsgd.micropatterneddermal-epidermalregenerationmatricescreatefunctionalnichesthatenhanceepidermalmorphogenesis.actabiomater.2013dec;9(12):9474-84.
非专利文献5:viswanathanp.,etal.,mimickingthetopographyoftheepidermal-dermalinterfacewithelastomersubstrates.integrbiol(camb).2016jan;8(1):21-9.
非专利文献6:salernos.,polymericmembranesmodulatehumankeratinocytedifferentiationinspecificepidermallayers.colloidssurfbbiointerfaces.2016oct1;146:352-62.
非专利文献7:katoh.,etal.,fabricationoflargesizeexvivo-producedoralmucosalequivalentsforclinicalapplication.tissueengpartcmethods.2015sep;21(9):872-80.
技术实现要素:
发明所要解决的课题
虽然开发了作为代替动物的模型的培养皮肤模型,但在体外(invitro)构建的以往的模型与生物体的表皮相比难以说具有充分的厚度。此外,以往的培养皮肤模型与动物、特别是人来源的皮肤相比,不具有充分的屏障功能。进一步此外,在使用已经市售的三维培养试剂盒的情况下,存在只有在使用未传代或传代次数少的原代培养表皮细胞(例如,传代次数0或1)的情况下才能获得具有所希望厚度的三维培养皮肤这样的问题。因此,要求不限于使用传代次数少的原代培养细胞的情况,即使使用构成皮肤的任意细胞,也可廉价、稳定并且简便地获得具有与生物体同等或与其接近的厚度的三维培养皮肤的技术。
用于解决课题的方法
鉴于上述要求,本发明者们进行了研究,结果发现,通过用在培养表面上具有凸部的多孔性膜对表皮细胞进行培养,可获得与以往的培养方法相比具有厚度的三维培养皮肤片,从而完成了本发明。
即,本发明包含以下发明。
[1]一种三维培养皮肤片,其至少包含表皮细胞,并在基底部的至少一部分具有凹凸。
[2]根据[1]所述的三维培养皮肤片,该表皮细胞为角质形成细胞。
[3]根据[1]或[2]所述的三维培养皮肤片,在该三维培养皮肤片的内部的至少一部分进一步包含不存在表皮细胞的区域。
[4]根据[1]~[3]中任一项所述的三维培养皮肤片,该三维培养皮肤片的厚度平均为20μm以上。
[5]根据[1]~[4]中任一项所述的三维培养皮肤片,该凹凸的高度为平均1μm~300μm。
[6]根据[1]~[4]中任一项所述的三维培养皮肤片,该凹凸的高度为平均1μm~90μm。
[7]根据[1]~[6]中任一项所述的三维培养皮肤片,该凹凸的相邻的间隔宽度为平均1μm~300μm。
[8]根据[1]~[6]中任一项所述的三维培养皮肤片,该凹凸的间隔宽度为平均1μm~100μm。
[9]根据[1]~[8]中任一项所述的三维培养皮肤片,其进一步具备具有与该基底部接触的凸部的多孔性膜。
[10]根据[9]所述的三维培养皮肤片,上述凸部由非生物物质形成。
[11]一种细胞培养容器,其用于制造[1]~[10]中任一项所述的三维培养皮肤片,该细胞培养容器具有:在培养表面的至少一部分设置的多孔性膜、以及配置在该多孔性膜上并用于在三维培养皮肤片的基底部形成凹凸的凸部。
[12]根据[11]所述的细胞培养容器,其由非生物物质形成。
[13]根据[11]或[12]所述的细胞培养容器,该凸部的高度为平均1μm~300μm。
[14]根据[11]或[12]所述的细胞培养容器,该凸部的高度为平均1μm~90μm。
[15]根据[11]~[14]中任一项所述的细胞培养容器,该凸部的相邻的间隔宽度为平均1μm~300μm。
[16]根据[11]~[14]中任一项所述的细胞培养容器,该凸部的相邻的间隔宽度为平均1μm~100μm。
[17]根据[11]~[16]中任一项所述的细胞培养容器,该凸部由珠形状、棱柱形状、锥体形状、锥台形状、吊钟型、和/或格子状形成。
[18]一种三维培养皮肤片的制造方法,其包含:工序(1),在细胞培养容器内,接种悬浮于培养基的包含表皮细胞的细胞,所述细胞培养容器具有在培养表面的至少一部分设置的多孔性膜、以及配置在该多孔性膜上并用于在三维培养皮肤片的基底部形成凹凸的凸部;工序(2),使培养基与该细胞培养容器的多孔性膜的外侧接触而进行培养。
[19]根据[18]所述的制造方法,其进一步包含:工序(3),除去上述细胞培养容器内的培养基,将上述皮肤细胞暴露于空气,并进行培养。
[20]根据[18]或[19]所述的制造方法,上述凸部由非生物物质形成。
[21]根据[18]~[20]中任一项所述的制造方法,该凸部的高度为平均1μm~300μm。
[22]根据[18]~[20]中任一项所述的制造方法,该凸部的高度为平均1μm~90μm。
[23]根据[18]~[22]中任一项所述的制造方法,该凸部的相邻的间隔宽度为平均1μm~300μm。
[24]根据[18]~[22]中任一项所述的制造方法,该凸部的相邻的间隔宽度为平均1μm~100μm。
[25]根据[18]~[24]中任一项所述的制造方法,该凸部由珠形状、棱柱形状、锥体形状、锥台形状、吊钟型、和/或格子状形成。
[26]根据[18]~[25]中任一项所述的制造方法,该表皮细胞包含从生物组织离析培养之后传代次数为2以上的表皮细胞。
[27]根据[18]~[26]中任一项所述的制造方法,上述表皮细胞为角质形成细胞。
发明的效果
根据本发明的三维培养皮肤片,可获得以往的三维培养皮肤片所不具有的有凹凸的基底部(表皮基底膜样结构体)、以及肥厚化的三维培养皮肤片。由此,能够提供对化妆品、向皮肤涂抹的药剂的安全性试验、基础研究有用的三维皮肤模型。此外,如果使用本发明的细胞培养容器,则能够稳定并且廉价地提供以往得不到的肥厚化的三维培养皮肤片。进一步此外,如果使用本发明的培养方法,则能够稳定并且廉价地提供以往得不到的肥厚化的三维培养皮肤片。
附图说明
图1是本发明的概念图。(a)表示本发明的细胞培养容器的剖面图。(b)为将(a)的一部分放大的图。
图2是表示本发明的三维培养皮肤片的结构的概念图。
图3是表示本发明的方案的概念图。
图4是表示本发明的方案的概念图。
图5是表示本发明的方案的概念图。
图6是表示本发明的方案的概念图。
图7是表示本发明的方案的概念图。
图8是表示使用珠在基底部形成了凹凸的三维培皮肤片的剖面图的照片。(a)是利用不具有珠的培养表面构建了三维培养皮肤片的照片。(b)是利用具有平均粒径10μm的pet珠的培养表面构建了三维培养皮肤片的照片。(c)是利用具有平均粒径30μm的pet珠的培养表面构建了三维培养皮肤片的照片。(a)~(c)使用了传代次数为4的人角质形成细胞。
图9是表示通过纤维在基底部形成了凹凸的三维培养皮肤片的剖面图的照片。(a)是利用不具有珠的培养表面构建了三维培养皮肤片的照片(对照)。(b)是利用具有聚酯制的纤维(纵:平均50μm,横:平均50μm间隔的网状,厚度:平均50μm,以下,称为“n1”。)的培养表面构建了三维培养皮肤片的照片。(a)~(b)使用了传代次数为4的人角质形成细胞。
图10表示为了在本发明的三维培养皮肤片形成凹凸而在实施例中使用的聚酯纤维的放大图。
图11a是使用具有图10所示的各纤维的细胞培养容器在基底部形成了凹凸的三维培养皮肤片的剖面图。分别以20倍的倍率观察。
图11b是使用具有图10所示的各纤维的细胞培养容器在基底部形成了凹凸的三维培养皮肤片的剖面图。分别以20倍的倍率观察。
图12是对使用具有图10所示的纤维的细胞培养容器制作的三维培养皮肤片的屏障功能(水分蒸发量)进行了评价的图。分别对人皮肤、在不具有凹凸的多孔性膜上培养的皮肤片(仅膜)、使用在多孔性膜上载置了225布的培养容器制作的皮肤片(225布)、使用在多孔性膜上载置了225布的培养容器制作的皮肤片(225布粘接)、使用在多孔性膜上载置了300布的培养容器制作的皮肤片(300布)、使用在多孔性膜上载置了300布的培养容器制作的皮肤片(300布粘接),研究了水分蒸发量。
具体实施方式
以下,参照附图对用于实施本发明的方案详细地说明,但本发明的技术范围不仅仅限定于下述方案。
<三维培养皮肤片的构成例>
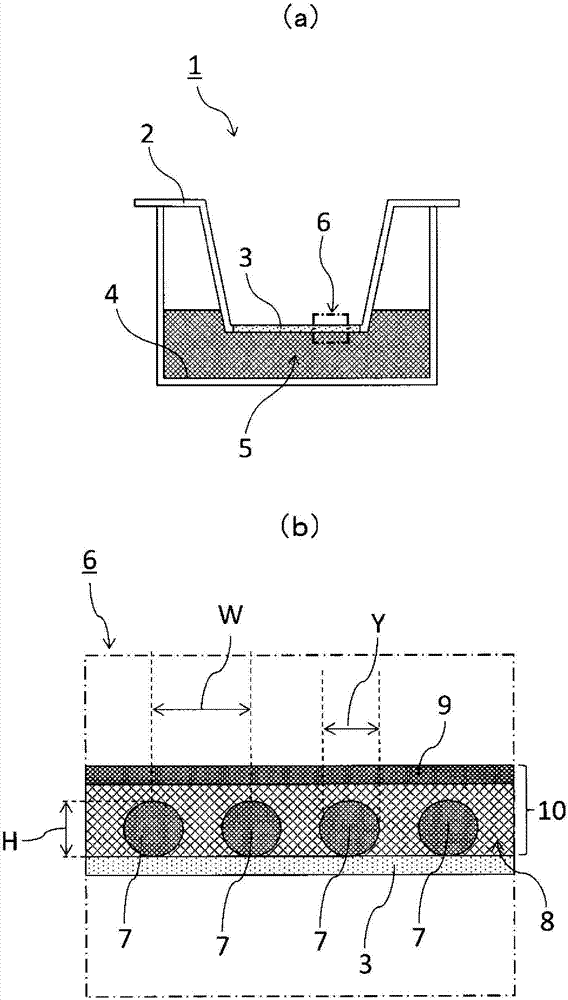
图1是表示本实施方式中使用的细胞培养容器1、及其一部分的培养表面剖面放大部6的剖面图。细胞培养容器1包含接种细胞的细胞培养小室(cellcultureinsert)2、和用于在细胞培养小室2的外部填充培养基的底部孔(bottomwell)4。细胞培养小室2具备多孔性膜3。能够通过多孔性膜3而从填充细胞培养小室2的外部的培养基5对多孔性膜3上的细胞供给营养成分和氧等。在本发明的实施方式中,在多孔性膜3的表面,具备用于在本发明的三维培养皮肤片10形成凹凸的凸部7。通过在本发明的细胞培养容器1中接种表皮细胞进行培养,可获得表皮细胞被复层化,在三维培养皮肤片10的基底部11(参照图2,粗线)的至少一部分具有凹凸、和/或在三维培养皮肤片的内部的至少一部分具有不存在表皮细胞的区域的三维培养皮肤片10。
在本发明中,三维培养皮肤片10的“基底部”,是指在将表皮细胞接种于细胞培养容器1时,形成为片状的表皮细胞与细胞培养容器表面相接的面,例如,是指与图1所示的多孔性膜3的表面、和/或凸部7相接的面(参照图2,11,粗线)。此外,在本发明中,所谓“基底部”,为与生物体的皮肤组织中的、在表皮与真皮之间形成的基底膜相当的结构体,但未必具有与生物体的基底膜同样的膜结构。即,本发明中的“基底部”,包含至少一部分具有凹凸形状的“表皮基底膜样结构体”,该表皮基底膜样结构体包含表皮细胞。此外,该表皮基底膜样结构体可以包含在生物体的皮肤组织中由表皮细胞所形成的基底膜。
图2是表示从图1(b)除去了多孔性膜3和凸部7的三维培养皮肤片10的剖面图。三维培养皮肤片10包含不具有细胞核的角质层9、和角质层9以外的表皮细胞8。通过上述的多孔性膜3上所具备的凸部7,三维培养皮肤片10以细胞包围不存在表皮细胞的区域va和/或三维培养皮肤片内部的不存在表皮细胞的区域vb的周边的形式形成凹凸。
在本发明中,三维培养皮肤片10的基底部11所具有的“凹凸”,是指在本发明的三维培养皮肤片中,构成与细胞培养容器的培养面相接的面的至少一部分,并且与将表皮细胞在平坦的培养器材表面进行了培养时偶然获得的起伏相比大的起伏。在本发明中,三维培养皮肤片10的凹凸的凸,是指向细胞培养容器的空气暴露(上层)方向突出的基底部11的部分,例如,作为图2的三维培养皮肤片凸部t1的、通过图1的多孔性膜3上的凸部7而形成的部分。另一方面,在本发明中,三维培养皮肤片的凹凸的凹,是指与凸相反地向表皮的基底部方向凹陷的部分,例如,图2的三维细胞片凹部b1。可以将任意的三维培养皮肤片凸部t1的前端部和与其相邻的三维培养皮肤片凹部b1的最凹陷部相对于培养面的垂直方向的距离称为三维培养皮肤片的凹凸的高度h’1。形成于三维培养皮肤片10的凹凸形状和高度h’1依赖于多孔性膜3上所具备的凸部7的形状和高度h。此外,形成于三维培养皮肤片10的三维培养皮肤片凸部间隔宽度w’1依赖于通过多孔性膜3上的凸部7而形成的凸部间隔宽度w。此外,形成于三维培养皮肤片10的三维培养皮肤片凸部宽度y’依赖于通过多孔性膜3上的凸部7而形成的凸部宽度y。
对于三维培养皮肤片的凹凸的高度h’1、三维培养皮肤片凸部间隔宽度w’1、和/或三维培养皮肤片凸部宽度y’,例如,可以制作进行了he染色的组织切片,使用市售的光学显微镜测定,也可以通过免疫组织化学法进行染色,使用荧光显微镜、共聚焦显微镜或双光子激光器显微镜进行观察来测定,也可以使用电子显微镜进行观察来测定,没有特别限定。三维培养皮肤片的凹凸的高度h’1可以由通过对通常的显微镜、荧光显微镜等装备了照相机的装置获得的图像来测定。作为显微镜,例如,可以使用例如オリンパス株式会社系统工业显微镜(落射透射兼用)bx51。作为照相机,例如,可以使用オリンパス株式会社显微镜用数字照相机“dp71”。获得的图像可以通过图像解析的通用方法导入到计算机解析软件,进行解析。
在本发明中,如图2右侧所示,三维培养皮肤片10的任意剖面的一部分有时具有未在三维培养皮肤片10的基底部11形成凹凸的不存在表皮细胞的区域vb。由于在该剖面的不存在表皮细胞的区域vb的不存在表皮细胞的区域底部b2的下部存在细胞,因此在剖面的外观上,看起来没有形成与三维培养皮肤片10的外部相连的凹凸形状。例如,在多孔性膜3上的凸部7为珠形状的情况下,在凸部7不与多孔性膜3相接的剖面中,观察到不存在表皮细胞的区域vb。或者,在多孔性膜3上的凸部7由编入了纤维的网形状形成的情况下(例如,参照后述的图7),在包含纤维不与多孔性膜3粘接的部位的剖面中,观察到不存在表皮细胞的区域vb。或者,在细胞培养中凸部7从多孔性膜3上游离而细胞侵入到凸部7下部而生长的情况下,有时观察到不存在表皮细胞的区域vb。在本发明中,三维培养皮肤片10所具有的凹凸包含表皮细胞8包围包含上述例子的不存在表皮细胞的区域vb的形状。不存在表皮细胞的区域vb的高度h’2基本上与三维培养皮肤片的凹凸的高度h’1几乎一致。
在本说明书中,所谓“三维”,是指与以往的将附着细胞通过细胞培养皿等的培养而获得的几乎1层的细胞层、即二维的细胞层的状态不同,细胞沿垂直方向堆叠,进行了复层化的形态。例如,本发明的三维培养皮肤片是指在表皮基底膜样结构具有凹凸,表皮细胞被复层化而具有厚度的三维化的结构体。
在本说明书中,所谓“三维培养皮肤片”,是指区别于生物体生来具备的皮肤组织的,将分解细胞间的粘附蛋白质而零散获得的皮肤组织来源的细胞、和/或包含由多能干细胞分化诱导而获得的构成皮肤的细胞的细胞群接种于细胞培养容器等,在细胞培养容器上培养而再构建而得的片状的三维皮肤样组织。在本发明中,构成三维培养皮肤片的细胞包含表皮细胞,也可以称为三维培养表皮片。在本发明中,三维培养皮肤片或三维培养表皮片可以包含表皮细胞以外的细胞,例如,构成表皮的表皮细胞以外的细胞(黑素细胞、朗格汉斯细胞、梅克尔细胞等)和/或真皮组织所包含的细胞(成纤维细胞、神经细胞、肥大细胞、浆细胞、血管内皮细胞、组织细胞、麦斯纳氏小体等)。此外,本发明的三维培养皮肤片可以进一步具备具有与基底部11接触的凸部的多孔性膜3。
构成本发明的三维培养皮肤片的细胞可以为任何动物来源,但优选为脊椎动物来源,更优选为哺乳动物来源,最优选为人来源。
在本发明中,所谓“表皮细胞”,是指包含构成表皮的分化阶段不同的全部细胞的细胞。表皮细胞主要由被称为角化细胞或角质形成细胞的细胞构成。在生物体中,表皮组织由分化阶段不同的表皮细胞层状重叠而形成。表皮的最深部被称为基底层或基底细胞层(以下,称为“基底层”),认为由圆柱状的细胞形成一层,包含干细胞。基底层也是与真皮的界面,在其上层存在棘层。此外,在生物体中,在基底层的正下方存在构成真皮的乳头层。
所谓棘层,也被称为棘细胞层,在生物体组织中由2~10层左右构成。该层由于看起来彼此以棘相连,因此被称为棘层。仅基底层的细胞具有增殖能力,表皮细胞随着分化阶段进行而一边变化为扁平形状一边向外层移动。
如果分化阶段由棘层开始进行,则形成具有透明角质颗粒、层状颗粒的颗粒层(颗粒细胞层)。颗粒层在生物体组织中由2~3层左右构成。如果分化阶段由颗粒层进一步进行,则细胞核消失,形成角质层(角质层细胞层)。表皮大致区分而构成上述4种层,但表皮组织除了表皮细胞以外还包含黑素细胞、朗格汉斯细胞、梅克尔细胞等,分别防止紫外线到达真皮、对皮肤的免疫功能发挥重要作用、参与知觉。在本发明中,三维培养皮肤片可以包含表皮细胞以外的细胞,可以根据所使用的用途而适当变更。
皮肤具备的“屏障功能”,一般而言,是指防止体内的水分、生物体成分损失的功能、防止异物(微生物、病毒、灰尘等)从生物体外部进入生物体内部的功能。在本说明书中,本发明的三维培养皮肤片所具有的屏障功能可以通过研究经表皮水分蒸发量(transepidermalwaterloss:tewl)来评价。从三维培养皮肤片的经表皮水分蒸发量、即水分透过量越少,则表示屏障功能越高。在本发明中,调查经表皮水分蒸发量的方法可以使用本领域技术人员所使用的一般方法(例如,参照kumamotoj.,tsutsumim.,gotom.,nagayamam.,dendam.japanesecedar(cryptomeriajaponica)pollenallergeninduceselevationofintracellularcalciuminhumankeratinocytesandimpairsepidermalbarrierfunctionofhumanskinexvivo.arch.dermatol.res.308:49-54,2016)。
在本发明中,三维培养皮肤片的凹凸的高度h’1的下限值的平均例如可以为1μm以上、5μm以上、10μm以上、15μm以上、20μm以上、25μm以上、30μm以上。在本发明中,三维培养皮肤片的凹凸的高度h’1的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、150μm以下、100μm以下、80μm以下、75μm以下。在本发明中,三维培养皮肤片的凹凸的高度h’1的平均例如可以为1μm~300μm,可以为1μm~200μm,可以为1μm~100μm,可以为5μm~250μm,可以为10μm~200μm,可以为15μm~150μm,可以为20μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
在本发明中,三维培养皮肤片凸部间隔宽度w’1(或w’2)的下限值的平均例如可以为1μm以上、5μm以上、8μm以上、10μm以上、12μm以上、15μm以上。三维培养皮肤片凸部间隔宽度w’1(或w’2)的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、180μm以下、170μm以下、150μm以下、125μm以下、100μm以下、90μm以下。在本发明中,三维培养皮肤片凸部间隔宽度w’1(或w’2)的平均例如可以为1μm~300μm,可以为1μm~200μm,可以为1μm~100μm,可以为1μm~90μm,可以为5μm~250μm,可以为8μm~200μm,可以为10μm~180μm,可以为12μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
在本发明中,三维培养皮肤片凸部宽度y’1的下限值的平均例如可以为1μm以上、5μm以上、10μm以上、15μm以上、20μm以上、25μm以上。在本发明中,三维培养皮肤片凸部宽度y’1的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、150μm以下、100μm以下、80μm以下、75μm以下。在本发明中,三维培养皮肤片凸部宽度y’1的平均例如可以为1μm~300μm,可以为5μm~250μm,可以为10μm~200μm,可以为15μm~150μm,可以为20μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
通过在三维培养皮肤片的至少一部分使基底部11具有凹凸,从而与不具有凹凸的相比,可获得基底部11上的表皮细胞层(例如,棘层、颗粒层和/或角质层)肥厚化的三维培养皮肤片。特别是,通过本发明而获得的三维培养皮肤片具有下述优异效果:不依靠由细胞、细胞粘附蛋白质等生物物质构成的凸部,仅仅通过由非生物物质构成的凸部而物理性地使该基底部11形成凹凸,就肥厚化。此外,在该凸部为由非生物物质构成的凸部的情况下,即使在培养期间中和之后使用的情况下,凸部都不被分解,可以稳定地在三维培养皮肤片的基底部维持凹凸结构,能够使本发明的效果持续。本发明的三维培养皮肤片的凹凸的平均的高度、形状和间隔宽度能够通过在细胞培养容器的多孔性膜表面设置的凸部的高度、形状和间隔宽度等来控制。此外,通过本发明而获得的三维培养皮肤片与以往的三维培养皮肤片相比是经皮水分蒸发量少、屏障功能高的三维培养皮肤片。通过在三维培养皮肤片的基底部11的至少一部分具有凹凸,从而屏障功能提高。三维培养皮肤片的基底部11优选与培养表面(包含多孔性膜和凸部的培养面)密合。如果三维培养皮肤片的基底部11与培养表面密合,则屏障功能进一步提高。更优选为三维培养皮肤片的基底部11与培养表面的整面密合的状态。
在本发明中,在多孔性膜表面设置的凸部可以由生物物质构成,也可以由非生物物质构成,也可以将生物物质与非生物物质组合而构成。在本说明书中,所谓“非生物物质”,是指除了生物物质、即构成生物体的生物高分子(核酸、蛋白质、多糖和它们的构成要素(核苷酸、核苷、氨基酸、糖))、维生素等以外的物质。为了构成本发明的凸部而使用的非生物物质优选为对细胞的培养不产生影响的生物适应性物质。在本发明中,在多孔性膜表面设置的凸部可以为进一步在表面涂覆了生物物质例如胶原、纤连蛋白、层粘连蛋白、明胶、玻连蛋白、多聚赖氨酸(d体、l体)、血小板反应蛋白等的凸部。
以往的三维培养皮肤片通过在将包含构成细胞外基质的蛋白质的凝胶注入到具有凹凸的模型而形成的凹凸面,接种表皮细胞来制作(例如,美国专利申请公开第2011/0171180号说明书)。然而,该方法中,由于培养面整体由包含蛋白质的凝胶而形成,因此它们在培养中被分解,其结果存在细胞不能粘附,三维培养皮肤片收缩这样的问题。另一方面,本发明中,该凸部设置在不伸缩的多孔性膜表面上,即使培养,培养面也不被分解,因此可以获得不收缩的三维培养皮肤片。
在本发明中使用的细胞可以为将生物组织、特别是皮肤组织切细,用胶原酶、胰蛋白酶等蛋白质分解酶进行处理而获得的原代表皮细胞,可以为将原代表皮细胞进行传代操作使其增殖而得的表皮细胞,可以使用由es细胞、ips细胞、或muse细胞等多能干细胞分化诱导而获得的表皮细胞,可以为株化的表皮细胞。优选为由生物组织采集并接种的原代培养表皮细胞、或将该原代培养细胞进一步进行传代处理而获得的传代表皮细胞。如果是由生物组织采集而获得的表皮细胞,则维持与生物体同样的性质的可能性高,适合用于进行调查药剂的效果、副作用的试验,或进行基础研究。
在本发明中,所谓原代培养表皮细胞,是从生物组织采集后用细胞培养容器仅培养一次而回收的表皮细胞,也称为“传代次数0(或第1代)”的表皮细胞。将变成汇合或近汇合(subconfluent)的传代次数为0的表皮细胞,通过对于本领域技术人员而言公知的方法进行传代操作,可以进一步扩增培养。通过1次传代操作而获得的表皮细胞称为“传代次数为1(或第2代)”的表皮细胞。与传代操作数对应地可以表述为“传代次数为2、3、4···n(n(整数)为传代次数)(第n+1代)”。市售的原代培养细胞(例如,クラボウ社的冷冻nhek(nb),目录编号:kk-4009)中,也有连本发明中所称的传代次数为0~传代次数为2左右的细胞也作为原代培养细胞而提供的,该情况下的传代次数以市售的细胞所附的文件等所记载的传代次数或代数作为参考,作为本发明的传代次数。各传代操作之间也可以包含将细胞进行冷冻处理的工序。
通常,未株化的体细胞多数通过反复进行传代操作而性质变化,或构成的细胞的比例变化,因此变化为与传代次数少的细胞群体不同的细胞群体。可以认为这是因为,每次反复进行传代而反复进行细胞分裂,端粒都变短,或者通过变为汇合、和/或胰蛋白酶处理等而施加生物胁迫和/或物理胁迫,从而引起细胞的老化。因此,通常,在使用使用了培养细胞的组织模型的情况下,使用传代次数少的细胞。
然而,原代培养细胞是直接从生物体组织离析的细胞,由于传代次数少,因此能够供给的细胞数有限度。不仅从伦理问题考虑能够采集的组织的大小、量受限,而且通过供体而获得的细胞的性质也存在不均匀。原代培养细胞也有市售品,但从供给量方面考虑,必然为高价格。因此,在需要构建大量的三维培养皮肤片的情况下,需要大量获得高价的细胞使用,在成本方面有问题。为了廉价地制造,也可以将原代培养细胞传代使其增殖而使用,但如上所述,所得的细胞未必显示与原代培养细胞同样的性质。在制作表皮细胞的三维培养皮肤模型的情况下,原代表皮细胞、将该细胞三维化的试剂盒有市售,可以购入该试剂盒来制作(例如,角质形成细胞三维培养启动试剂盒,cellntec社),但在使用了传代次数为2以上的表皮细胞的情况下,存在自发地三维化的性质变弱,得不到厚的三维培养皮肤模型(也称为三维培养皮肤片)等问题(例如,后述的实施例1~3中所示的对照)。
在本发明的实施方式中,只要在三维培养皮肤片的基底部11具有凹凸,则即使在使用了由生物体组织离析培养后传代次数为2以上的表皮细胞的情况下也能够构建具有以往仅通过原代培养细胞(例如,传代次数为0或1)才能获得的厚度的三维培养皮肤片。在使用了原代培养细胞(例如,传代次数为0或1)的情况下,也能够通过本发明获得具有厚度的三维培养皮肤片。所使用的表皮细胞的由生物体组织离析培养后的传代次数例如可以为1、2、3、4、5、6、7、8、9、10、或10以上,只要三维培养皮肤片的棘层、颗粒层、和/或角质层肥厚化,就没有限定。在本发明的实施方式中,对所使用的原代表皮细胞的动物种没有特别限定,但优选为人来源。此外,在本发明的实施方式中,所使用的原代表皮细胞可以为胎儿、新生儿、未成年、或成人来源等中的任一种,优选为胎儿、新生儿、或未成年来源的细胞。在使用人的未成年来源的细胞的情况下,例如,优选使用小于20岁、1~19岁、1~10岁、1~5岁的细胞。即使是使用人的成人来源的细胞的情况下,也优选使用青年,例如20岁~29岁、30岁~39岁、40岁~49岁的细胞。
在本发明的一实施方式中,三维培养皮肤片的平均的厚度可以为20μm以上、21μm以上、22μm以上、23μm以上、24μm以上、25μm以上、26μm以上、27μm以上、28μm以上、29μm以上、30μm以上、35μm以上、40μm以上、45μm以上、50μm以上、55μm以上、60μm以上、65μm以上、70μm以上、75μm以上、80μm以上、85μm以上、90μm以上、95μm以上、100μm以上、105μm以上、110μm以上、115μm以上、120μm以上、125μ以上、150μm以上、175μm以上、200μm以上、225μm以上、250μm以上、275μm以上、300μm以上。更优选的平均的厚度为80μm以上。三维培养皮肤片的平均的厚度的上限值根据表皮细胞的动物种、传代次数、年龄等而变化,因此没有特别限定。
<用于制造三维培养皮肤片的细胞培养容器的构成例(1)>
用于制作本发明的三维培养皮肤片的细胞培养容器的概念图示于上述的图1中。将设置在细胞培养容器1的凸部7的改变例示于图3~图5中。
图3表示本发明的细胞培养容器1的一实施方式。在多孔性膜3上,配置有用于在本发明的三维培养皮肤片形成凹凸的凸部71。凸部71具有珠形状。通过调节凸部的高度h1,能够控制本发明的三维培养皮肤片的凹凸的高度h’1。例如,如图3(b)所示,凸部71a可以以位于正方形的格点的方式配置。通过调整凸部间隔宽度w1a,能够控制上述的本发明的三维培养皮肤片的凸部间隔宽度w’1。例如,如图3(c)所示,凸部71b以位于正三角形的格点的方式配置。通过调整凸部间隔宽度w1b,能够控制上述的本发明的三维培养皮肤片的凸部间隔宽度w’1。此外,通过调整凸部宽度y1,能够控制本发明的三维培养皮肤片的凹部宽度y’。
图4表示本发明的细胞培养容器1的一实施方式。在多孔性膜3上,配置有用于在本发明的三维培养皮肤片形成凹凸的凸部72。凸部72具有作为棱柱形状的一种的立方体形状。通过调节凸部的高度h2,能够控制本发明的三维培养皮肤片的凹凸的高度h’1。例如,如图4(b)所示,凸部72a可以以位于正方形的格点的方式配置。通过调整凸部间隔宽度w2a,能够控制上述的本发明的三维培养皮肤片的凸部间隔宽度w’1。例如,如图4(c)所示,可以以凸部72b的重心位于正三角形的格点的方式配置。通过调整凸部间隔宽度w2b,能够控制上述的本发明的三维培养皮肤片的凸部间隔宽度w’1。此外,通过调整凸部宽度y2,能够控制本发明的三维培养皮肤片的凹部宽度y’。
图5是表示设置在本发明的细胞培养容器1的凸部(73、74、75)的实施方式的剖面图。例如,图5(a)表示具有锥体形状(三棱锥、四棱锥、或圆锥)的凸部73。例如,图5(b)表示具有锥台形状的凸部74。例如,图5(c)表示具有吊钟型的凸部75。通过调整各个凸部的高度(h3、h4、h5),能够控制本发明的三维培养皮肤片的凹凸的高度h’1。通过调整凸部间隔宽度(w3、w4、w5),能够控制本发明的三维培养皮肤片的凸部间隔宽度w’1。此外,通过调整凸部宽度(y3、y4、y5),能够控制本发明的三维培养皮肤片的凹部宽度y’。关于各个凸部(73、74、75)的平面上的配置,可以与图3和图4同样地配置,但不限定于此。
在本发明的实施方式中,关于凸部(7、71、71a、71b、72、72a、72b、73、74、75)的形状,不限定于上述形状,例如,也包含近半球形、近长方体形等。关于凸部(7、71、71a、71b、72、72a、72b、73、74、75)的材质,可以由生物物质构成,也可以由非生物物质构成,可以将生物物质与非生物物质组合构成。可举出例如,聚酯或聚对苯二甲酸乙二醇酯(pet)、聚碳酸酯、聚苯乙烯、氧化锆、玻璃、不溶性胶原、硅橡胶等,只要能够进行细胞培养,则也可以为其他材质。为了易于细胞粘附,可以通过公知的方法对凸部(7、71、71a、71b、72、72a、72b、73、74、75)的表面进行等离子体处理等。凸部(7、71、71a、71b、72、72a、72b、73、74、75)可以如上述的实施方式那样在多孔性膜3上以等间隔配置,或可以以不均匀的间隔配置,该间隔的下限值的平均例如可以为1μm以上、5μm以上、8μm以上、10μm以上、12μm以上、15μm以上。凸部(7、71、71a、71b、72、72a、72b、73、74、75)的间隔的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、180μm以下、170μm以下、150μm以下、125μm以下、100μm以下。在本发明中,凸部(7、71、71a、71b、72、72a、72b、73、74、75)的间隔的平均例如可以为1μm~300μm,可以为5μm~250μm,可以为8μm~200μm,可以为10μm~180μm,可以为12μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
凸部的高度(h、h1、h2、h3、h4、h5)的下限值的平均例如可以为1μm以上、5μm以上、10μm以上、15μm以上、20μm以上、25μm以上、30μm以上。在本发明中,凸部的高度(h、h2、h3、h4、h5)的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、150μm以下、100μm以下、80μm以下、75μm以下。在本发明中,凸部的高度(h、h2、h3、h4、h5)的平均例如可以为1μm~300μm,可以为5μm~250μm,可以为10μm~200μm,可以为15μm~150μm,可以为20μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
凸部宽度(y、y1、y2、y3、y4、y5)的下限值的平均例如为1μm以上、5μm以上、10μm以上、15μm以上、20μm以上、25μm以上。在本发明中,凸部宽度(y、y1、y2、y3、y4、y5)的上限值的平均例如为300μm以下、250μm以下、200μm以下、150μm以下、100μm以下、80μm以下、75μm以下。在本发明中,凸部宽度(y、y1、y2、y3、y4、y5)的平均例如可以为1μm~300μm,可以为5μm~250μm,可以为10μm~200μm,可以为15μm~150μm,可以为20μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
可以使数个~数十个凸部(7、71、71a、71b、72、72a、72b、73、74、75)凝集而固定在多孔性膜3上。使凸部(7、71、71a、71b、72、72a、72b、73、74、75)固定的方法可以通过公知的方法共价结合地使其固定在多孔性膜3上,也可以使用粘接剂使其固定。作为粘接剂,优选为对细胞的粘附不产生影响,对细胞不产生毒性,并且不被细胞分解的物质。可举出例如,多聚-d-赖氨酸、琼脂糖等,但只要是可以产生同样的效果,将凸部(7、71、71a、71b、72、72a、72b、73、74、75)固定在多孔性膜3上的物质,也能够使用上述以外的粘接剂。此外,凸部(7、71、71a、71b、72、72a、72b、73、74、75)可以在多孔质膜3上直接形成,例如,也可以通过3d打印技术或半导体工艺技术(例如,将光刻工艺(包含纳米压印或热压纹等)和干蚀刻(例如,反应性离子蚀刻)或湿蚀刻组合的方法等)等中使用的方法形成。或者,可以仅仅在多孔性膜3上载置凸部(7、71、71a、71b、72、72a、72b、73、74、75)。
<用于制造三维培养皮肤片的细胞培养容器的构成例(2)>
用于制作本发明的三维培养皮肤片的细胞培养容器的概念图示于上述的图1中。将设置在细胞培养容器1的凸部7的其他改变例示于图6和7中。
图6表示本发明的细胞培养容器1的一实施方式。在多孔性膜3上,具备用于在本发明的三维培养皮肤片形成凹凸的凸部(76、77、78)。例如,如图6(a)所示,凸部76在多孔性膜3上以近似平行的条状配置。例如,如图6(b)所示,凸部77在多孔性膜3上以纵横等间隔的格子状配置。例如,如图6(c)所示,凸部78在多孔性膜3上以正三角形的格子配置。凸部(76、77、78)例如由纤维形成。凸部(76、77、78)可以由单一纤维形成,也可以由将细的纤维多根捆扎而得的物质形成。或者,凸部(76、77、78)可以由长方体状的结构体形成,也可以由近似半圆柱状的结构体构成。
图7为图6(b)的一实施方式,并且为具备交替编入了凸部77a与凸部77b的凸部的细胞培养容器1。图7(b)表示将图7(a)的z与z’连接的线上的剖面。
在本发明的实施方式中,凸部(76、77、77a、77b、78)的材质可以由生物物质构成,也可以由非生物物质构成,也可以将生物物质与非生物物质组合构成。可举出例如,聚酯或聚对苯二甲酸乙二醇酯(pet)、聚碳酸酯、聚苯乙烯、玻璃、不溶性胶原、硅橡胶等,但只要是细胞粘附并能够培养的材质,则可以为其他材质,没有特别限定。凸部(76、77、77a、77b、78)的高度的下限值的平均例如可以为1μm以上、5μm以上、10μm以上、15μm以上、20μm以上、25μm以上、30μm以上。在本发明中,凸部的高度的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、150μm以下、100μm以下、80μm以下、75μm以下。在本发明中,凸部(76、77、77a、77b、78)的高度的平均例如可以为1μm~300μm,可以为5μm~250μm,可以为10μm~200μm,可以为15μm~150μm,可以为20μm~100μm,可以为25μm~80μm,可以为30μm~75μm。在图7所示的实施方式中,凸部(77a、77b)的高度h7a可以以凸部77a和凸部77b交叉的凸部交点的最上部(c,c’)作为基准来确定。
凸部(76、77、77a、77b、78)可以在多孔性膜3上以等间隔固定,或也可以以不均匀的间隔固定,关于其平均间隔,例如,下限值可以为1μm以上、5μm以上、8μm以上、10μm以上、12μm以上、15μm以上。凸部(76、77、77a、77b、78)的平均间隔的上限值例如可以为300μm以下、250μm以下、200μm以下、180μm以下、170μm以下、150μm以下、125μm以下、100μm以下。在本发明中,凸部(76、77、77a、77b、78)的平均间隔例如可以为1μm~300μm,可以为5μm~250μm,可以为8μm~200μm,可以为10μm~180μm,可以为12μm~100μm,可以为25μm~80μm,可以为30μm~75μm。在图7所示的实施方式中,凸部间隔宽度w7a可以以凸部77a和凸部77b交叉的凸部的交点(c,c’)作为基准来确定。
凸部宽度(y6、y7、y8)可以均匀,可以不均匀。凸部宽度(y6、y7、y8)的下限值的平均例如可以为1μm以上、5μm以上、10μm以上、15μm以上、20μm以上、25μm以上。在本发明中,凸部宽度(y6、y7、y8)的上限值的平均例如可以为300μm以下、250μm以下、200μm以下、150μm以下、100μm以下、80μm以下、75μm以下。在本发明中,凸部宽度(y6、y7、y8)的平均例如可以为1μm~300μm,可以为5μm~250μm,可以为10μm~200μm,可以为15μm~150μm,可以为20μm~100μm,可以为25μm~80μm,可以为30μm~75μm。
为了易于细胞粘附,可以通过公知的方法对凸部(76、77、77a、77b、78)的表面进行等离子体处理等。在其他实施方式中,可以使用片段化成任意长度的纤维,使其固定于多孔性膜3上而形成凸部(76、77、77a、77b、78),也可以通过压接而设置凸部(76、77、77a、77b、78),也可以仅在多孔性膜3上载置凸部(76、77、77a、77b、78)。关于使凸部(76、77、77a、77b、78)固定在多孔性膜3上的方法,可以通过公知的方法共价结合地使其固定在多孔性膜3上,可以使用粘接剂使其固定。作为粘接剂,优选为对细胞的粘附不产生影响,对细胞不产生毒性,并且不被细胞分解的物质。可举出例如,多聚-d-赖氨酸、琼脂糖、葡甘露聚糖、紫外线固化树脂等,只要是能够产生同样的效果,将纤维固定在多孔性膜上的物质,就可以使用。为了使凸部(76、77、77a、77b、78)不在细胞培养中剥离,优选固定在多孔性膜3上。如果使用凸部(76、77、77a、77b、78)与多孔性膜3固定了的培养容器1,则能够获得不仅肥厚化,而且屏障功能高的三维培养皮肤片。
在本发明的实施方式中使用的细胞培养容器1的材质只要是通常细胞培养容器所使用的材质,就没有特别限定。例如为玻璃、聚苯乙烯、聚丙烯、聚碳酸酯等。本发明所使用的细胞培养容器的形状没有特别限定,可举出培养皿型、多孔板型、烧瓶型等。本发明的细胞培养容器由于在该细胞培养容器的一部分具有多孔性膜,因此优选为细胞培养小室型。本发明所使用的所谓细胞培养小室,是指具备细胞不能透过、但培养液等能够透过的具有多孔性孔的膜的细胞培养容器。从多孔性膜的培养表面的相反侧,即,附着细胞的附着面的背面侧也能够供给培养液等。本发明所使用的细胞培养小室可以使用市售品,可以为具有在多孔性膜的培养表面上直接成型而设置凸部的膜的细胞培养小室。在使用市售品的情况下,例如,可以使珠、纤维粘接而在多孔性膜表面上设置凸部,可以不粘接,而仅仅将凸部载置在多孔性膜3上。在不将凸部粘接在多孔性膜3上的情况下,例如,可以将与细胞培养小室2的内侧几乎相同直径的网状的凸部(例如,图7(a)等)不粘接地嵌入到细胞培养小室2。在该情况下,凸部可以是作为三维培养皮肤片制作用的培养容器的一部分而与细胞培养小室2一起提供或分开提供,在培养时组装的试剂盒的一部分。多孔性膜的平均孔径没有特别限定,例如为0.1μm~5.0μm,优选为0.2μm~4.0μm,进一步优选为0.3~3.5μm。此外,多孔性膜的原材料也与以往使用的多孔性膜同样,例如,使用聚酯或聚对苯二甲酸乙二醇酯(pet)、或聚碳酸酯、聚苯乙烯等即可。
在本发明的实施方式中,为了使细胞易于附着于在多孔性膜3上具有凸部的细胞培养容器而增殖,可以对培养表面进行涂覆。可举出例如,胶原、纤连蛋白、层粘连蛋白、明胶、玻连蛋白、多聚赖氨酸(d体、l体)、血小板反应蛋白等。
<三维培养皮肤片的制造方法>
在本发明的实施方式中,关于表皮细胞的接种数,按照公知的方法即可。例如,将表皮细胞以0.01×106~10.0×106个/cm2,优选为0.05×106~5.0×106个/cm2,更优选为0.1×106~1.0×106个/cm2的量接种。作为表皮细胞的培养所使用的培养基(也称为培养液),可以使用通常使用的培养基,例如kg培养基、epilifekg2(クラボウ社)、humedia-kg2(クラボウ社)、assay培养基(toyobo社)、cnt-prime、epithelialculturemedium(cellntec社)等,在约37℃下经0~14天进行。作为培养基,此外可以使用dmem培养基(gibco社)或将含有2-o-α-d-吡喃葡糖基-l-抗坏血酸的kgm与dmem进行1:1混合而得的培养基等。表皮细胞的三维化(复层化)可以使用cnt-prime,3dbarriermedium(cellntec社)。也可以使用其他培养基。
在本发明的实施方式中,为了对表皮细胞进行培养,三维化(复层化)而促进角质化,只要接种于包含上述细胞培养小室2的细胞培养容器1,使其增殖培养即可。具体而言,将表皮细胞悬浮于培养基,在细胞培养小室2上接种。为了使培养基与细胞培养小室的多孔性膜3的外侧接触,在底部孔4中也添加培养基,使细胞培养小室2浸渍而进行培养。由此,从表皮细胞的上部和底部两者供给培养基进行培养。
优选使细胞培养小室2上的表皮细胞培养数天左右(1~6天左右,优选为2~4天左右)直到变为汇合或近汇合。然后,为了进一步促进细胞三维化(复层化),优选将细胞培养小室内外的培养基向例如cnt-prime,3dbarriermedium(cellntec社)交换。由此,进一步促进表皮细胞的三维化。优选在将培养基交换成cnt-prime,3dbarriermedium(cellntec社)进行培养后,在1~36小时后,优选为6小时~24小时后,进一步优选为12小时~18小时后,仅除去细胞培养小室内部的培养基而将表皮细胞的上表面暴露于气相进行培养。由此,表皮细胞的三维化和角质化被促进,可获得更厚的三维培养皮肤片。
另外,本发明中的各培养工序的培养温度只要是来源动物的体温附近即可,具体而言,在人细胞的情况下,为33~38℃左右是适合的。
如上述那样操作通过本发明获得的三维培养皮肤片可以作为动物实验代替法之一、例如皮肤模型而使用。例如,可以用于对皮肤对化学物质(例如,化妆料、工业制品、家庭用品、药剂、皮肤外用剂等)的反应性进行评价的方法。此外,本发明的三维培养皮肤片由于可获得与以往的三维培养皮肤片相比更肥厚化的组织,因此在皮肤科学的基础研究中也能够作为有用的皮肤模型使用。进一步此外,本发明中获得的三维培养皮肤片由于与以往的三维培养皮肤片相比肥厚化,因此对外部的屏障功能也高,作为用于治愈烧伤、创伤等的三维培养皮肤片也是有用的。
在一实施方式中,本发明所使用的细胞培养容器可以为该凸部与该多孔性膜在培养结束后能够分离的细胞培养容器。在该情况下,用该细胞培养容器制造的三维培养皮肤片在使该凸部与该基底部接触的状态下从该多孔性膜分离。因此,能够使该三维培养皮肤片的基底部在维持凹凸结构的状态下移动。本发明所使用的细胞培养容器优选该凸部为生物物质,例如,包含胶原、纤连蛋白、层粘连蛋白、明胶、玻连蛋白、多聚赖氨酸(d体、l体)、血小板反应蛋白等的生物物质,特别更优选为不溶性胶原。
实施例
以下,基于实施例进一步详细地说明本发明,但本发明不受它们任何限定。
<细胞的准备>
本发明所使用的表皮细胞使用了来源于新生儿的角质形成细胞(以下,称为“角质形成细胞”。クラボウ社,制品名:冷冻nhek(nb),目录编号:kk-4009)。传代培养按照由销售公司提供的说明书进行。
<实施例1>
(1)将松本油脂制药株式会社制塑料珠(10μm:m-310,30μm:m-503)10mg分散于多聚-d-赖氨酸(1mg/mlmillipore)1ml而得的物质,滴加10μl到12-wellmillicellhangingcellcultureinserts0.4μmpet(millipore社,以下,称为“细胞培养小室”)中,在70℃下干燥24小时。
(2)将cellstartcts(gibco社)用dpbs(gibco社)进行50倍稀释,在1个细胞培养小室中滴加86μl,在37℃的条件下维持2小时。
(3)除去cellstartcts,将传代次数为4的来源于新生儿的角质形成细胞22~25万个分散于cnt-prime,epithelialculturemedium(cellntec社)500μl中,滴加在细胞培养小室内,将相同培养基(cnt-prime,epithelialculturemedium)1ml滴加到细胞培养小室外部,用37℃co2培养箱培养72小时。
(4)除去细胞培养小室内外的cnt-prime,epithelialculturemedium,用cnt-prime,3dbarriermedium(cellntec社)置换,用37℃co2培养箱培养16小时。
(5)除去细胞培养小室内外的培养基,细胞培养小室内曝露于空气,在细胞培养小室外加入500μlcnt-prime,3dbarriermedium。
(6)在每天将细胞培养小室外的500μlcnt-prime,3dbarriermedium进行交换的同时,用37℃co2培养箱培养7天。
(7)连细胞培养小室内膜一起切取培养表皮,用4%多聚甲醛pbs溶液固定,制作组织切片标本并按照公知的方法进行苏木精-曙红(he)染色,用显微镜观察。
将结果示于图8中。对于对细胞培养小室的培养表面无处置的样品(a),仅得到10μm左右的三维培养表皮,但在利用10μmpet珠(b)和30μmpet珠(c)在细胞培养小室表面设置凸部的情况下,确认到三维培养细胞的明显的肥厚化和角质层的形成。另外,图8(b)虽然看起来三维培养皮肤片从细胞培养小室的多孔性膜剥离,但其是在标本制作时分离的。
<实施例2>
(1)在12-wellmillicellhangingcellcultureinserts0.4μmpet(millipore社,“细胞培养小室”)中,铺上直径12mm的聚酯制的网。以后的步骤通过与实施例1的(2)~(7)相同的步骤进行。
将结果示于图9中。对于将细胞培养小室的培养表面无处置的样品(a),仅得到10μm左右的三维培养表皮,但对于设置有凸部的细胞培养小室(b),确认到三维培养细胞的明显的肥厚化和角质层的形成。特别是角质层的厚度与对照(a)相比接近2倍。另外,图9(b)具有形成部分空洞的部分,其是由标本制作时的操作导致的。
<实施例3>
进行了用于对细胞培养容器的凸部的宽度、间隔宽度、高度的变化对三维培养皮肤片的厚度带来何种变化进行观察的实验。
图10表示为了在本发明的三维培养皮肤片形成凹凸而在实施例中使用的聚酯纤维的放大图。
(1)在12-wellmillicellhangingcellcultureinserts0.4μmpet(millipore社,“细胞培养小室”)中铺上各纤维。以后的步骤通过与实施例1的(2)~(7)相同的步骤进行。
将本实施例中使用的各纤维的特征示于以下的表1中。此外,将使用它们而形成的凸部对三维培养皮肤片形成带来的结果示于以下的表1中。开口率由不存在网状纤维的区域的面积在培养面积中所占的比例算出。将制作的三维培养皮肤片的切片的he染色图像示于图11a和图11b中。另外,图11a和图11b中看到三维培养皮肤片与细胞培养小室的多孔性膜分离、纤维卷起而形成空洞的部分,都是由于标本制作时的操作而人为形成的。
表1
(※)
不可:三维培养皮肤片与对照相比未肥厚化,也不具有脱核的角质层样结构
可:三维培养皮肤片与对照相比肥厚化,一部分具有脱核的角质层样结构
良:三维培养皮肤片与对照相比肥厚化,几乎整体具有脱核的角质层样结构
优:三维培养皮肤片与对照相比肥厚化,整体具有脱核的角质层样结构
<实施例4>
(1)准备在12-wellmillicellhangingcellcultureinserts0.4μmpet(millipore社,“细胞培养小室”),将上述的no.255或no.300的纤维切割为孔形状而铺上的样品(称为“255布”、“300布”),使切割了的no.255或no.300的纤维用紫外线固化树脂(henkel社,loctite(注册商标)aa3554)粘接的样品(称为“255布粘接”、“300布粘接”)。此外,作为对照,使用了未通过布设置凸部的孔。进一步,作为对照,使用人皮肤(经由ケー·エー·シー株式会社(京都,日本)从biopredicinternational社(雷恩,法国)购入)。以后的步骤通过与实施例1的(2)~(6)相同的步骤进行。实验以三次重复(triplicate)进行。
<<屏障功能的评价>>
屏障功能的评价按照以下步骤进行。
将构建了三维表皮模型的小室嵌入到底部加入了培养液的硅橡胶容器中,水分蒸发仅从表皮模型表面发生。然后,每隔1小时测定嵌入了小室的容器的重量,将减少的重量设为水分蒸发量,换算成每单位面积的数值。该方法与kumamoto的论文(参照kumamotoj.,tsutsumim.,gotom.,nagayamam.,dendam.japanesecedar(cryptomeriajaponica)pollenallergeninduceselevationofintracellularcalciuminhumankeratinocytesandimpairsepidermalbarrierfunctionofhumanskinexvivo.arch.dermatol.res.308:49-54,2016)所记载的方法为相同原理。
对所得的结果进行统计学分析(anova方差分析后scheffe的多重检验分析),与仅用膜培养而获得的三维培养皮肤片相比,多重检验的结果是,将p<0.05的情况判断为有显著性差异。
该结果表明,通过使用紫外线固化树脂使255布和300布粘接了的细胞培养小室(255布粘接和300布粘接)而获得的三维培养皮肤片与不具有凹凸的三维培养皮肤片相比可获得经皮水分蒸发量显著少,屏障功能高的三维培养皮肤片(图12)。
由上述结果表明,用使用聚酯网形成了凸部的细胞培养表面制作三维培养皮肤片的结果是,与以往的方法相比形成相当厚、屏障功能高的三维培养皮肤片。
符号的说明
1细胞培养容器
2细胞培养小室
3多孔性膜
4底部孔
5培养基
6培养表面剖面放大部
7凸部
8表皮细胞
9角质层
10三维培养皮肤片
11基底部(粗线)
71、71a、71b、72、72a、72b、73~77、77a、77b、78凸部
b1三维培养皮肤片凹部
b2不存在表皮细胞的区域底部
c、c’凸部交点的最上部
h、h1、h2凸部的高度
h’1三维培养皮肤片的凹凸的高度
h’2不存在表皮细胞的区域的高度
h3~h5、h7a凸部的高度
t1三维培养皮肤片凸部
t2不存在表皮细胞的区域顶部
va、vb不存在表皮细胞的区域
w、w1、w1a、w1b凸部间隔宽度
w’1、w’2三维培养皮肤片凸部间隔宽度
w2、w2a、w2b、w3~w8凸部间隔宽度
y、y1~y8凸部宽度
y’三维培养皮肤片凸部宽度。
- 还没有人留言评论。精彩留言会获得点赞!