用于产生具有毛囊、皮脂腺和毛孔的人工皮肤的方法与流程
本发明涉及用于制造人工皮肤的方法,以及通过所述方法制造的人工皮肤。
背景技术:
近年来,考虑到动物保护,在欧洲各地已经促进开发废除动物实验并且用替代动物实验的方法进行药物和化妆品的药物效果和安全性评价的技术。此外,近年来,由于开发用于人工增殖从活对象取出的细胞的细胞培养技术中的进展,已经可以在保持多种器官或组织的生理功能的同时进行离体培养。因此,已经开发了使用人源培养细胞的多种测试评价方法,并且通过采用这些替代评价方法,还已经可以研究候选药物物质如何影响人体或者什么剂量将发挥期望作用或不利作用。此外,已经促进开发通过组合培养细胞、细胞骨架和培养基来制造人工皮肤的方法,并且其由dr.h.green的具有与天然皮肤相当的功能和结构的三维培养皮肤的发明引发,皮肤病学领域一直是开发替代动物实验的方法的开创者。迄今为止,还已提出人工皮肤的开发和生产,以及使用人工皮肤的替代动物实验的方法,以在没有实验室动物的情况下在皮肤上对药物和化妆品进行药物效果和安全性评价(例如,专利文献1)。
由表皮和真皮组织以及皮下组织构成的皮肤是一个大器官,其完全覆盖体表并且使身体内部与外界隔离开。皮肤分布有多种外胚层器官,例如毛囊、皮脂腺和汗腺,并且体被系统(皮肤器官系统)通过这些的结构和功能协作来构造。体被系统通过长出毛发来使体表抵御多种外部入侵,通过分泌皮脂和汗液来调整体表环境或排泄废物,并且还通过也与其他器官系统例如循环系统和神经系统合作来进一步承担各种生理功能,例如体温调节和感觉接收。由于通过皮肤附属物分泌到皮肤表面上的多种水溶性和亲脂性组分改变表皮层的物质渗透性和含水量,所述表皮层是刚性角质化复层上皮,因此提出了与变应性疾病的联系或与衰老相关的美学变化。
然而,迄今为止提出的人工皮肤简单地仅包含没有皮肤附属物的表皮层和真皮层,或者即使其包含皮肤附属物样结构(例如毛囊样结构)也不能再现正常的皮肤结构和功能。由于在没有功能性皮肤附属物的人工皮肤中不存在皮脂等的皮肤屏障功能,因此其作为实验室动物的替代物的用途受到限制。
例如,专利文献1显示,通过覆盖和培养包含收缩细胞(例如成纤维细胞)的胶原蛋白基质层和包含构成组织附属物的细胞(例如毛乳头细胞)的胶原蛋白基质层,可以在培养物中产生毛囊样结构。然而,专利文献1仅显示产生具有毛囊的类似外部形式的结构,并且未显示再现皮肤附属物的正常结构和功能的人工皮肤。
引用列表
专利文献
[专利文献1]日本公布未审查专利申请公布no.h10-136977
发明概述
本发明解决的问题
本发明的目的是提供具有毛囊、皮脂腺和毛孔的人工皮肤。
解决问题的手段
作为本发明人为了制造可再现动物皮肤屏障功能的人工皮肤而进行的广泛研究的结果,我们成功地制造了具有功能性皮肤附属物的人工皮肤。
换言之,在一个实施方案中,本发明涉及用于制造具有毛囊、皮脂腺和毛孔的人工皮肤的方法,特征在于,其包括以下每个步骤:
(a):制备具有真皮层和表皮层的人工皮肤或仅具有真皮层的人工皮肤的步骤;以及
(b):将分离的毛囊移植到步骤(a)中制备的人工皮肤的步骤;
其中:
所述分离的毛囊包含皮脂腺,并且
将所述分离的毛囊移植到所述人工皮肤,以使得所述人工皮肤的所述真皮层的表面与所述分离的毛囊的毛孔部的位置对齐。
此外,在一个实施方案中,本发明方法的特征在于,在所述步骤(a)中使用仅具有真皮层的人工皮肤,并且该方法包括在所述步骤(b)之后进行以下步骤:
(c):在所述人工皮肤的所述真皮层上形成表皮层的步骤。
此外,在一个实施方案中,本发明方法的特征在于,所述步骤(a)中人工皮肤的真皮层通过包含成纤维细胞、胶原蛋白和培养基的混合溶液发生胶凝而形成。
此外,在一个实施方案中,本发明方法的特征在于,所述步骤(a)中人工皮肤的真皮层如下形成:包含成纤维细胞、胶原蛋白和培养基的混合溶液发生胶凝,然后进一步添加包含胶原蛋白和培养基的混合溶液并使其胶凝,并将这重复至少一次或更多次。
此外,在一个实施方案中,本发明方法的特征在于,所述步骤(a)中“具有真皮层和表皮层的人工皮肤”的表皮层如下形成:向所述真皮层的表面施加包含角质化细胞和培养基的混合溶液,并对其进行培养。
此外,在一个实施方案中,本发明方法的特征在于,所述步骤(c)是以下步骤:通过向所述人工皮肤的所述真皮层的表面施加包含角质化细胞和培养基的混合溶液并对其进行培养来形成所述表皮层。
此外,在一个实施方案中,本发明方法的特征在于,所述步骤(a)是:
(a):制备具有真皮层、表皮层和脂肪组织层的人工皮肤的步骤。
此外,在一个实施方案中,本发明方法的特征在于,其包括在所述步骤(a)之后且在所述步骤(b)之前进行以下步骤:
(a’):将脂肪祖细胞包埋在分离的毛囊在步骤(b)中被移植的人工皮肤部位处的步骤。
此外,在一个实施方案中,本发明方法的特征在于,所述分离的毛囊是从动物皮肤分离的毛囊。
此外,在一个实施方案中,本发明方法的特征在于,所述分离的毛囊是从人皮肤分离的毛囊。
此外,在一个实施方案中,本发明方法的特征在于,所述分离的毛囊是人工诱导的再生毛囊。
此外,在一个实施方案中,本发明方法的特征在于,所述再生毛囊是如下制造的再生毛囊:使基本上由间充质谱系细胞构成的第一细胞聚集体与基本上由上皮细胞构成的第二细胞聚集体紧密接触并在支持物内对其进行培养。
此外,在一个实施方案中,本发明方法的特征在于,所述间充质谱系细胞或所述上皮细胞中的至少任一种通过诱导未分化细胞而获得。
此外,在一个实施方案中,本发明方法的特征在于,所述间充质谱系细胞或所述上皮细胞中的至少任一种是来源于动物毛囊的单细胞。
在另一个实施方案中,本发明涉及具有毛囊和皮脂腺的人工皮肤,特征在于,其还具有毛孔。
此外,在一个实施方案中,本发明涉及人工皮肤,其包含:
真皮层,其由包含成纤维细胞、胶原蛋白和培养基的凝胶组成;
表皮层,其形成在所述真皮层的表面上并且基本上由角质化细胞组成;和
具有皮脂腺的毛囊,
其中:
所述毛囊穿透所述表皮层并且埋入所述真皮层中,并且
所述毛囊的毛孔部与所述表皮层相连。
此外,在一个实施方案中,本发明人工皮肤的特征在于,其还在所述真皮层的下部中具有脂肪组织层。
此外,在一个实施方案中,本发明人工皮肤的特征在于,所述毛囊在所述真皮层中被脂肪祖细胞覆盖。
此外,在一个实施方案中,本发明的特征在于,其是通过本发明用于制造上述人工皮肤的方法制造的人工皮肤。
上述本发明一个或更多个特征的任意组合的发明也涵盖在本发明的范围内。
发明效果
根据本发明的方法,可以制造具有功能性毛囊、皮脂腺和毛孔并且再现正常皮肤屏障功能的人工皮肤。因此,可以提供可用于药物和化妆品的药物效果和安全性评价(特别是与毛发相关的药物和化妆品的药物效果和安全性评价)的人工皮肤。
附图简述
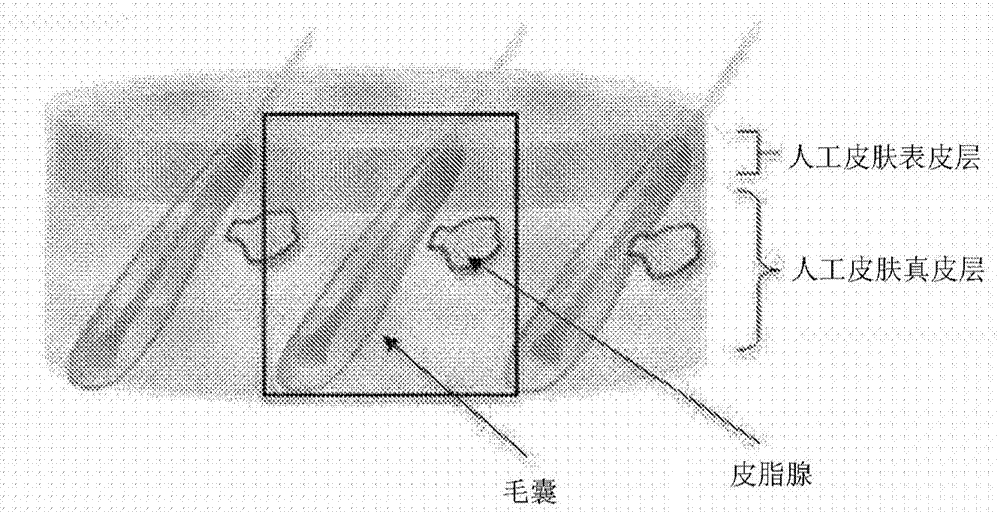
图1是通过本发明方法制造的具有毛囊和皮脂腺的人工皮肤的示意图,其中这些和表皮层通过毛孔部相连。图1a是并入皮肤附属物(例如毛囊)的人工皮肤的三维示意图。图1b示出了包括图1a中矩形所示区域中毛囊的截面示意图。人工皮肤的毛囊和皮脂腺的开口与人工皮肤的角质化表皮层连续,毛发从其表面冒出,皮脂分泌到体表。
图2示出了用于制造人工皮肤的本发明方法的两个实施方案。本发明方法一般地分为两种类型:在并入毛囊之后形成表皮的方法和在形成表皮层之后并入毛囊的方法,这取决于形成人工皮肤的角质化表皮层和并入包含皮脂腺的毛囊的时机。
图3示出了根据本发明方法的一个实施方案将分离的毛囊移植到仅具有真皮层的人工皮肤,随后形成表皮层并进行培养的结果。图3a示出了以下的照片:在第0天仅具有真皮层的人工皮肤(含细胞胶原蛋白凝胶)的形成,在第1天人工真皮层中成年小鼠胡须毛囊的并入,在人工真皮上进行培养的角质形成细胞的覆盖接种以在同一天内进行表皮层的形成,并进行观察直至第8天。图3b示出了当使用小鼠胡须毛囊作为在图3a过程中待移植的毛囊时人工皮肤的组织图像。在左上和左下照片中示出了包含并入人工皮肤中的毛囊之组织的连续切片的低倍放大图像,并且在a至c中示出了在左上和左下用矩形显示的区域的放大照片。放大的照片区域在低倍放大倍数下以符号a至c显示。人工皮肤的毛囊的毛孔部的上皮和角质化表皮层的连续部分在a中用箭头显示,毛球部在b中用箭头显示。图3c以顶部和底部照片示出了在并入小鼠身体毛囊,进行7天培养和在图3a过程中的观察之后从人工皮肤产生连续切片的组织图像。左边的照片是低倍放大的图像,在右边的顶部和底部照片中各自示出了用矩形显示的区域的放大图像。并入在人工皮肤中的毛囊和人工皮肤的角质化表皮层通过放大图像箭头区域中的毛孔部相连。此外,右下方照片中毛球部的he图像中以箭头显示的毛球部是组织学上健康的。
图4示出了根据本发明方法的一个实施方案将分离的毛囊移植到具有真皮层和表皮层的人工皮肤并进行培养的结果。图4a示出了以下的照片:在第0天具有真皮层和表皮层的人工皮肤(含细胞胶原蛋白凝胶)的形成,在第4天毛囊(小鼠胡须毛囊)的移植,并进行观察直至第10天。图4b示出了毛囊移植之后人工皮肤的组织图像(h&e染色)。示出毛囊的移植毛孔部和人工皮肤的表皮层在箭头区域中相连,毛发基质细胞和毛乳头细胞在箭头区域中存活,并且毛球部是组织学上健康的。
图5示出了观察随时间从并入在人工皮肤中的毛囊生长的毛干并通过图像分析测量毛干长度的结果。图5a是在将成年小鼠胡须毛囊移植到人工皮肤之后形成表皮层时毛干生长的观察结果。分别辨别并入到人工皮肤的多个毛囊,并且随时间追踪各自的毛干生长。生长的毛干用红色箭头显示,未生长的毛干用白色箭头显示。图5b是在将成年小鼠身体毛囊移植到人工皮肤之后形成表皮层时毛干生长的观察结果。类似于随时间对小鼠胡须的观察,辨别并入人工皮肤中的毛囊,并且测量显示毛发生长的毛囊的毛干长度(红色箭头)。图5c是在将人头部毛囊移植到人工皮肤之后形成表皮层时毛干生长的观察结果。与小鼠毛囊类似,测量毛干长度并绘图。
图6示出了在将毛囊移植到具有真皮层和表皮层的人工皮肤之后观察毛干生长的结果。在移植毛囊之前拍摄毛干的立体显微照片,从毛球部的最顶端测量杵状毛和生长期毛干的长度,在移植到人工皮肤之后第3、6和12天从人工皮肤切除毛干和毛囊,并类似地拍摄立体显微照片以测量毛干生长的量。以杵状毛的长度作为内标,测量生长期毛发的伸长量并绘图。
图7示出了器官培养中小鼠胡须毛囊随时间的变化。收获生长期的小鼠胡须以产生包含胶原蛋白鞘的完整毛囊(顶行)和在可变区域中去除胶原蛋白鞘的毛囊(底行)。将每种条件的毛囊黏附到具有薄层胶原蛋白凝胶的6cm塑料培养皿的底部,在5%co2环境下在含有10%fbs的dmem/f12(1∶1)中进行浸渍培养直至第3天。从培养开始(第0天)起用立体显微镜每日对此进行追踪。楔形显示毛干尖端,箭头显示毛球部的位置。右栏显示培养第3天的毛球部的放大图像。虚线显示毛球部的间充质组织边界。毛球部的位置与毛球部的间充质组织边界之间的偏离位置表明其是退化期或毛发生长终期。
图8示出了仅具有表皮和真皮的人工皮肤模型与具有表皮、真皮和脂肪组织层的人工皮肤模型之间的比较。图8a示出了该实验的流程。收获生长期的小鼠胡须以产生在可变区域中去除胶原蛋白鞘的毛囊。将这些并入作为6孔形式产生的人工皮肤的表皮+真皮模型或表皮+真皮+脂肪组织模型中,并进行器官培养3天。器官培养条件是5%co2环境下包含10%fbs的dmem/f12(1∶1),并且通过半气相培养进行。图8b示出了器官培养第3天的组织图像。并入表皮+真皮模型中的毛囊(左图)是线状毛囊间充质图像(箭头),指示退化期,而并入在表皮+真皮+脂肪组织模型中的毛囊(右图)指示是生长期的毛球部。右侧照片中的虚线显示真皮(der)和脂肪组织(adp)之间的边界。
图9示出了用人工产生的再生毛囊产生本发明的人工皮肤的结果。图9a示出了该实验的流程。在图9b中,顶行显示“表皮+真皮模型”的结果,中间行显示“表皮+真皮+脂肪组织模型”,并且底行显示“表皮+真皮+rec衍生脂肪祖细胞模型”。图9b左栏中所示的矩形区域的放大图像,即低倍放大视图,显示在右栏中。在任何模型中,均显示移植毛囊的上皮组织与人工皮肤的表皮层相连。
图10示出了比较“表皮+真皮模型”、“表皮+真皮+脂肪组织模型”和“表皮+真皮+rec衍生脂肪祖细胞模型”各自中毛干生长的结果。
具体实施方式
本发明涉及具有毛囊、皮脂腺和毛孔的人工皮肤及其制造方法。通过本发明方法制造的人工皮肤的特征在于,其具有带有皮脂腺的毛囊,所述毛囊穿透表皮层并且埋入真皮层中,并且所述毛囊的毛孔部与所述表皮层相连。
在活对象中,毛囊意指具有例如以下结构的产生毛发的皮肤附属物:毛乳头、毛发基质、根鞘、毛发纤维、毛发隆起、立毛肌、皮脂腺和毛囊漏斗部(所谓的毛孔)。然而,本文使用的“毛囊”不限于包含所有这些结构的那些,而是广泛地包括包含这些结构中至少一部分并且保持具有产生毛发之功能的结构的那些。
本文使用的“人工皮肤”是指至少具有真皮层的人工皮肤状结构,优选地是指还具有表皮层的那些。本文使用的“真皮层”意指主要由胶原蛋白或成纤维细胞构成的结构,“表皮层”意指主要由角质化细胞(角质形成细胞)构成的结构。本发明中使用的人工皮肤(移植分离的毛囊之前的人工皮肤)可以在移植毛囊之前制备,或者可以使用具有表皮层和真皮层的市售人工皮肤。
用于制造本发明中使用的人工皮肤(移植分离的毛囊之前的人工皮肤)的方法不受限制,并且真皮层可以通过例如包含成纤维细胞、胶原蛋白和培养基的混合溶液发生胶凝来产生。优选地,在包含成纤维细胞、胶原蛋白和培养基的混合溶液发生胶凝之后,进一步添加包含胶原蛋白和培养基的混合溶液并使其胶凝,并且这可以重复至少一次或更多次以形成真皮层。用于产生人工皮肤的真皮层的成纤维细胞的来源不受限制,并且例如可以使用来源于人、猴、猪、牛、马、狗、猫、小鼠、大鼠的成纤维细胞。此外,用于产生人工皮肤的真皮层的成纤维细胞可以来源于活对象的任何部位,并且例如可以使用来源于新生儿、胎儿或成人臀部、头皮、手掌、脚掌和包皮的成纤维细胞。
此外,本发明的人工皮肤的表皮层可以通过例如向通过上述方法产生的真皮层表面施加包含角质化细胞和培养基的混合溶液并对其进行培养来形成。用于产生人工皮肤的表皮层的角质化细胞的来源不受限制,并且例如可以使用来源于人、猴、猪、牛、马、狗、猫、小鼠、大鼠的角质化细胞。此外,用于产生人工皮肤的表皮层的角质化细胞可以来源于活对象的任何部位,并且例如可以使用来源于新生儿、胎儿或成人臀部、头皮、手掌、脚掌和包皮的角质化细胞。
此外,本发明的人工皮肤还可以在真皮层下面具有脂肪组织层。如本文使用的“脂肪组织层”不受特别限制,只要其包含脂肪细胞并且是具有允许细胞培养的组成的结构,并且例如可以是包含脂肪组织的胶原蛋白凝胶即可。
此外,尽管在本发明的人工皮肤中毛囊穿透表皮层并且埋入真皮层中,但是其可以构造成使得所述毛囊在所述真皮层中被脂肪祖细胞覆盖。用于产生具有这样构造的人工皮肤的方法没有限制,并且期望的构造可以如下获得:例如在将毛囊移植到由表皮层和真皮层组成的人工皮肤之前将脂肪祖细胞包埋在毛囊移植部位处,并随后移植毛囊。此外,期望的构造还可以例如如下获得:将脂肪祖细胞黏附在用于移植的毛囊周围,然后将毛囊移植到由表皮层和真皮层组成的人工皮肤。
用于本发明的脂肪祖细胞的来源没有特别限制,并且其可以是市售的脂肪祖细胞,可以是通过公知方法由市售或从活对象分离的间充质谱系干细胞诱导的脂肪祖细胞,或者可以是直接从活对象的组织分离的脂肪祖细胞。
用于本发明的分离的毛囊可以是从动物皮肤收获的分离的毛囊。在这种情况下,用于收获毛囊的动物的类型不受限制,并且例如可以使用来源于人、猴、猪、牛、马、狗、猫、小鼠、大鼠的分离的毛囊。用于修剪(トリミング)从动物皮肤收获的毛囊的方法不受限制,并且例如可以通过从收获的皮肤分离毛囊以不损伤皮脂腺来获得用于本发明的分离的毛囊。
此外,也可以使用人工诱导的毛囊作为本发明中使用的分离的毛囊。用于制造人工诱导的毛囊的方法不受限制,并且例如可以使用wo2012/108069或wo2012/115079中描述的方法来使用人工诱导的毛囊。具体地,可以在本发明中使用如下制造的再生毛囊原基来源毛囊:使基本上由间充质谱系细胞构成的第一细胞聚集体与基本上由上皮细胞构成的第二细胞聚集体紧密接触并在支持物内对其进行培养。在这种情况下,所述间充质谱系细胞或所述上皮细胞中的至少任一种可以是通过诱导未分化细胞(例如ips细胞、es细胞、多种组织干细胞或多种祖细胞)获得的间充质谱系细胞或上皮细胞。此外,所述间充质谱系细胞或所述上皮细胞中的至少任一种可以是从来源于动物毛囊的单细胞获得的间充质谱系细胞或上皮细胞。此外,可以将通过上述方法获得的再生毛囊原基移植到活对象的皮肤,一旦毛囊生长到一定程度就重新收获,并用于本发明。
此外,例如,可以通过使用wo2016/039279中描述的方法来将人工诱导的毛囊用于本发明。具体地,用可以激活wnt途径的生物活性物质刺激多能干细胞衍生胚状体,然后将所述胚状体结合到骨架,并将所述结合的物体移植到活动物体。然后,在所述移植部位形成高频率地包含皮肤附属物(例如毛囊或皮脂腺)的畸胎瘤,并且可以将从所述畸胎瘤收获的毛囊用于本发明。
在用于制造人工皮肤的本发明方法中,将分离的毛囊移植到人工皮肤,以使得人工皮肤的真皮层表面与所述分离的毛囊的毛孔部的位置基本上对齐。通过该步骤,在毛囊移植之后毛囊的毛孔部与人工皮肤的表皮层相连,并且毛囊和皮脂腺将作为皮肤附属物起作用。如本文使用的,毛囊的毛孔部与人工皮肤的表皮层“相连”(或毛囊的毛孔部与人工皮肤的表皮层是“连续的”)意指毛囊的毛孔部与人工皮肤的表皮层至少部分地组织学结合。
除非特别限定,否则本文使用的术语用于描述特定实施方案,并且不意图限制本发明。
此外,除非内容明确指示另外理解,否则本文使用的术语“包含/包括”意指存在所描述的项目(例如组分、步骤、要素和数值),并且不排除存在其他项目(例如组分、步骤、要素和数值)。
除非另外定义,否则本文使用的所有术语(包括技术术语和科学术语)具有与本发明所属技术领域技术人员广泛认可的含义相同的含义。除非另外明确定义,否则本文使用的术语应解释为具有与本文和相关技术领域的含义一致的含义,并且不应解释为具有理想化或过度正式的含义。
现在将参照实施例进一步详细描述本发明。然而,本发明可以通过各个方面实施,并且不应解释为限于本文描述的实施例。
实施例
实施例1:具有毛囊、皮脂腺和毛孔的人工皮肤的制造
通过本发明方法制造的人工皮肤的示意图示出在图1中。此外,在图2中示出了在该实施例中进行的用于制造人工皮肤的本发明方法的两个实施方案的过程。
1.材料和方法
(1)实验室动物
b57/b6小鼠购自shimizulaboratorysupplies,co.,ltd.(tokyo,japan)。小鼠的管理和操作根据nih实验室动物指南进行。所有实验由riken动物实验委员会进行审查并且在其批准之下实施。
(2)人体材料
在这项研究中,根据“赫尔辛基宣言(declarationofhelsinki)”(1975年修订,tokyo)的要点,在获得riken研究伦理审查委员会和供体医疗机构的咨询和批准之后,遵守“ethicalguidelinesformedicalandhealthresearchinvolvinghumansubjects”(publicnoticeoftheministryofeducation,culture,sports,scienceandtechnologyandministryofhealth,labourandwelfare2014年第3期)和相关法规并且在捐赠者的知情同意下在联合研究医疗机构捐赠并收获人体材料,并且在riken发育生物学中心(rikencenterfordevelopmentalbiology)的预定设施中使用。该研究中的人体材料是指在日本的医疗机构捐赠的头皮组织,以及从其分离的毛囊和周围组织,并且不包括购买的培养人源细胞。
(3)细胞培养
正常人新生儿包皮成纤维细胞(hdfn)和正常人新生儿包皮表皮角质化细胞(hekn)在第一次传代后从kurabo以冷冻细胞购买。将hdfn和hekn细胞在37℃的温浴中迅速解冻,然后用10%胎牛血清和含有50单位/ml青霉素和50μg/ml链霉素的dulbecco改良eagle培养基(dmem10)洗涤,在填充有dmem10培养基(对于hdfn细胞)和humedia-kg2培养基(对于hekn细胞)(kurabo)的塑料培养皿中以2,500个细胞/cm2的细胞密度接种,这些被称为第二代细胞。根据常规方法进行传代培养,用补充有0.25%胰蛋白酶-1mmedta(invitrogen)的d-pbs(-)(nacalaitesque)溶液消化,分散,然后调节细胞密度并在针对每种细胞设置的培养基条件下传代培养。将正常人细胞传代培养至第三代并进行人工皮肤产生,或设定为冷冻贮存液,并在解冻后作为第四代细胞用于人工皮肤产生。当用作冷冻贮存液时,二者都维持在培养物中直至60%至80%汇合,并且以80%或更高汇合率的状态用于人工皮肤产生。
(4)含有成纤维细胞的胶原蛋白凝胶的产生
将在(3)中传代培养的hdfn细胞通过胰蛋白酶edta溶液消化而单细胞化。随后,产生包含以下的中性胶原蛋白溶液:终浓度为3.8mg/ml的胶原蛋白(i-ac5mg/ml,koken)、1×dmem(sigma)、10mmnahco3(wakopurechemicalcorporation)、10mmhepes缓冲液(滴定并调节至ph7.4,wakopurechemicalcorporation)和5%胎牛血清,并在冰温条件下轻轻搅拌的同时使通过离心沉淀的hdfn细胞分散。作为中和酸性胶原蛋白溶液以获得细胞存活环境的添加剂,产生10x浓度的dmem、1mnahco3和1mhepes缓冲液,并作为贮存液在4℃下冷藏储存。将分散在中性胶原蛋白溶液中的hdfn细胞以各400μl分配到12孔细胞培养插入物(0.4μm/高密度孔)中,在37℃,5%co2和100%湿度条件下静置以胶凝30分钟,形成厚度为3至4mm的人工真皮层。为了使含有成纤维细胞的胶原蛋白凝胶的表面与细胞培养插入物的顶部的过滤器表面水平,以及为了使胶凝过程均匀,在冰上进行胶原蛋白溶液的制备和细胞分散,将制备的胶原蛋白溶液储存并埋入冰中,直至分配到细胞培养插入物中。将通过含有细胞的胶原蛋白溶液发生胶凝形成人工真皮层的细胞培养插入物置于填充有含有10ng/mlfgf2(wakopurechemicalcorporation)的dmem10培养基的12孔培养板中并培养过夜。以下培养条件全部为37℃,5%co2和100%湿度条件。
在培养含有人成纤维细胞的胶原蛋白凝胶过夜之后,目视确认由于微纤维形成的凝胶收缩。然后,将包含以下的100μl胶原蛋白溶液置于新的细胞培养插入物中,并用镊子转移收缩的凝胶:终浓度为3.8mg/ml的牛源酸性天然胶原蛋白1溶液(i-ac5mg/ml,koken)、1xdmem(sigma)、10mmnahco3(wakopurechemicalcorporation)、10mmhepes缓冲液(ph7.4)和5%胎牛血清。然后,将其在37℃,5%co2和100%湿度条件下静置以胶凝30分钟,并且用不含细胞的胶原蛋白凝胶填充周边间隙以防止12孔板的培养基组分流入细胞培养插入物中。在凝胶形成之后,以每天一次的频率进行类似的处理,持续三天。在每次处理时拍摄含有成纤维细胞的胶原蛋白凝胶的宏观照片,并测量到收缩迅速进行直至第3天,然后变为几乎静止状态,并且还确认含有成纤维细胞的胶原蛋白凝胶被产生以在生理上适当地发挥作用。
2.通过在将毛囊并入真皮层中之后形成表皮产生人工皮肤(图3)
通过将毛囊并入通过上述(1)-(4)的方法产生的含成纤维细胞的胶原蛋白凝胶中并随后覆盖表皮层来产生人工皮肤。
具体方法如下。首先,在形成含成纤维细胞的胶原蛋白凝胶后第1天,对所述胶原蛋白凝胶产生用于并入毛囊的切口。使用眼科微型手术刀(直刀直角22.5°,mani),在凝胶表面上形成约为毛囊宽度1.2倍的切口。切口的深度达到不损坏细胞培养插入物底部的过滤器表面的界限,其中倾斜度为约30度。在该切口中,从表面侧插入胡须毛囊、躯干背部皮肤的身体毛囊或人头部毛囊(其全部为分离的毛囊)。用镊子仅抓住从待插入毛囊伸出的毛干,并且毛球部或毛孔部保持不接触。在插入之后,将毛囊浸入不含细胞的中性胶原蛋白溶液中,然后并入切口中。调节所移植毛囊的深度,以使得毛囊的毛孔部与含成纤维细胞的胶原蛋白凝胶的表面几乎对齐。
然后,通过类似于下述“3.通过在形成真皮层和表皮层之后并入毛囊的人工皮肤产生”的方法在含成纤维细胞的胶原蛋白凝胶的表面上形成表皮层,并进行空气培养。
对于待并入人工皮肤中的毛囊,使用来自出生后5至7天大b57/b6小鼠的胡须和躯干背部皮肤的体毛,以及在生长期vi期的人头部毛囊,其正在生长毛发类型可以从体表识别的毛干。此外,基于各现有技术文献中描述的毛囊器官的皮肤移植技术,在立体显微镜下分离并处理小鼠胡须和背部皮肤体毛以及其中仍然留有杵状毛的人头皮毛囊(toyoshima等(naturecommunications,3:784,doi:10.1038/ncomms1784,2012);asakawa等(scientificreports,2:424,doi:10.1038/srep00424,2012);under等(hairtransplantation第5版(2010))。对于小鼠胡须,用外科手术刀切除位于毛囊狭窄部分上方的真皮组织和胶原蛋白鞘以及皮肤表皮层,以保留胶原蛋白鞘而不损伤皮脂腺和外根鞘。从皮肤上切下体毛,并将其分离为由10至15个完整毛囊组成的毛发组,以包含皮肤表皮层、真皮层和皮下脂肪层,并且水平于毛囊。分离人毛囊以获得由一个或两个毛囊组成的毛发组状态,并且类似于胡须修剪在毛囊上方的真皮组织和皮肤表皮层。
3.通过在形成真皮层和表皮层之后并入毛囊产生人工皮肤(图4)
通过在通过上述(1)-(4)的方法产生的含成纤维细胞胶原蛋白凝胶的表面上形成表皮层并随后并入毛囊来产生人工皮肤。
具体方法如下。将增殖至60%至80%汇合的hekn细胞通过胰蛋白酶消化而单细胞化,并悬浮于humedia-kg2培养基中至2×106个细胞/ml。将每孔500微升细胞悬浮液覆盖接种在(4)中产生的含成纤维细胞的胶原蛋白凝胶上,并培养以在含成纤维细胞的胶原蛋白凝胶上形成角质化表皮层。将覆盖的hekn细胞在humedia-kg2培养基或dmem10培养基中培养至接种后第4天,并且在hekn细胞接种后第1天、第2天和第3天用与覆盖接种相同的培养基条件进行总培养基更换。上述操作在含成纤维细胞的胶原蛋白凝胶收缩之后补充胶原蛋白凝胶后进行。调整孔中含有10ng/mlfgf2的dmem10培养基的量以使其与细胞培养插入物中humedia-kg2培养基的液体表面相同。通过在覆盖hekn细胞后第4天去除细胞培养插入物中的培养基,开始空气培养,其是其中表皮层直接暴露于大气氧分压条件的培养条件。
接下来,对形成有表皮层的含成纤维细胞的胶原蛋白凝胶进行毛囊并入。hekn细胞覆盖在含hdfn细胞的胶原蛋白凝胶上,在第3天进行毛囊并入,并在第4天开始空气培养。在该实施例中,使用以“2.通过在将毛囊并入真皮层中之后形成表皮产生人工皮肤”中所述方法制备的分离的小鼠胡须。通过形成穿透表皮层和含细胞胶原蛋白凝胶层二者的切口以与“2.通过在将毛囊并入真皮层中之后形成表皮产生人工皮肤”中所述方法类似的方式进行人工皮肤中毛囊的并入。为了防止在形成切口之后覆盖的表皮层和含细胞胶原蛋白凝胶层的脱离,通过在水平方向上用眼科微型手术刀进行浅移动在表皮层中形成第一切口,然后在真皮层中产生切口。
4.并入在人工皮肤中的毛囊的功能评价
4-1.上皮间连接
例如毛囊或汗腺的外胚层器官通过例如毛孔和管道的开口与皮肤表皮层相连而作为皮肤器官系统(体被系统)起作用。换言之,为了使皮脂腺与毛囊一起并入人工皮肤中以起作用,必要的是,所并入毛囊的毛孔部与人工皮肤的表皮层是连续的。
在并入毛囊后第4天和第7天除去培养基,并向细胞培养插入物和板孔中分别添加1ml和2ml的福尔马林固定剂(superfix,kurabo),以允许组织固定。组织固定在室温环境下进行6至12小时,在固定结束时在室温下转移至pbs(-),并切下垂直于包含并入毛囊和毛孔的人工皮肤的中线之表皮层和毛发生长方向的横切片以产生石蜡包埋块。然后,根据常规方法产生厚度为10μm的连续切片,进行h&e染色,追踪毛囊与表皮层之间连续性的位置以及与其相连的毛球部。
如图3b和3c所示,在将毛囊并入真皮层中之后形成表皮的人工皮肤中显示,毛囊外根鞘和人工皮肤的表皮层在并入人工皮肤中的毛囊的上部毛孔区域中相连。
此外,如图4b所示,显示在形成真皮层和表皮层之后并入毛囊的人工皮肤中,毛囊外根鞘和人工皮肤的表皮层也在并入人工皮肤中的毛囊的上部毛孔区域中相连。
由这些结果显示,通过本发明方法产生的人工皮肤中的毛囊通过毛孔与人工皮肤表皮层相连,并且具有功能性皮肤附属物。
4-2.组织学评价
使用并入毛囊后第4天和第7天的h&e染色图像,对毛球部的毛发基质细胞和毛乳头细胞的非生理性变性,或伴随细胞死亡或细胞质可染性变化的核形态,以及对各自具有特异性的细胞布置进行组织学分析,并与天然毛囊组织进行比较。
通过组织学分析构成并入在人工皮肤中的毛囊的毛球部的细胞是否存活以维持毛干形成,显示毛球部的毛发基质和毛乳头细胞在以下人工皮肤中均存活:在将毛囊并入真皮层中之后形成表皮的人工皮肤(图3b和3c),以及在形成真皮层和表皮层之后并入毛囊的人工皮肤(图4b)。
4-3.毛干生长
使用立体显微镜(stemi2000,zeiss),从毛囊并入时间(第0天)开始直至第3、4、7、14天随时间拍摄宏观照片,并且通过图像分析软件(axiovision,zeissandimagej,nih)测量毛干长度的变化。此外,通过图像分析类似地测量移植之前的毛囊和毛干长度,以及从并入毛囊的人工皮肤随时间收获的毛囊和毛囊的毛干长度,并且定量地功能性评价毛干生长。
结果显示,在将毛囊并入真皮层中之后形成表皮的人工皮肤中,毛干从毛囊并入人工皮肤中开始生长4天(图5a至5c)。此外,显示在形成真皮层和表皮层之后并入毛囊的人工皮肤中也维持毛干生长(图6)。
由这些结果显示,通过本发明方法获得的人工皮肤具有功能性皮肤附属物。
实施例2:还具有脂肪组织层的人工皮肤的产生
1.6孔形式人工皮肤的产生
通过以下过程进行6孔形式人工皮肤的产生。
<细胞培养>
正常人新生儿包皮成纤维细胞(hdfn)和正常人新生儿包皮表皮角质化细胞(hekn)在第一次传代后从kurabo以冷冻细胞购买。将hdfn和hekn细胞在37℃的温浴中迅速解冻,然后用10%胎牛血清和含有50单位/ml青霉素和50μg/ml链霉素的dulbecco改良eagle培养基(dmem10)洗涤,在填充有dmem10培养基(对于hdfn细胞)和humedia-kg2培养基(对于hekn细胞)(kurabo)的塑料培养皿中以2,500个细胞/cm2的细胞密度接种,这些被称为第二代细胞。根据常规方法进行传代培养,用补充有0.25%胰蛋白酶-1mmedta(invitrogen)的d-pbs(-)(nacalaitesque)溶液消化,分散,然后调节细胞密度并在针对每种细胞设置的培养基条件下传代培养。将正常人细胞传代培养至第二代并进行人工皮肤产生,或设定为冷冻贮存液,并在解冻后作为第三代细胞用于人工皮肤产生。当用作冷冻贮存液时,二者都维持在培养物中直至60%至80%汇合,并且以80%或更高汇合率的状态用于人工皮肤产生。
<含成纤维细胞胶原蛋白凝胶的产生>
将传代培养的hdfn细胞通过胰蛋白酶edta溶液消化而单细胞化。随后,产生包含以下的中性胶原蛋白溶液:终浓度为3.8mg/ml的胶原蛋白(i-ac5mg/ml,koken)、1×dmem(sigma)、10mmnahco3(wakopurechemicalcorporation)、10mmhepes缓冲液(滴定并调节至ph7.4,wakopurechemicalcorporation)和5%胎牛血清,并在冰温条件下轻轻搅拌的同时使通过离心沉淀的hdfn细胞分散。作为中和酸性胶原蛋白溶液以获得细胞存活环境的添加剂,产生10x浓度的dmem、1mnahco3和1mhepes缓冲液,并作为贮存液在4℃下冷藏储存。将分散在中性胶原蛋白溶液中的hdfn细胞以各400μl分配到6孔细胞培养插入物(0.4μm/高密度孔)中,在37℃,5%co2和100%湿度条件下静置以胶凝30分钟,形成厚度为1.0至1.5mm的人工真皮层。为了使含成纤维细胞胶原蛋白凝胶的表面与细胞培养插入物的顶部的过滤器表面水平,以及为了使胶凝过程均匀,在冰上进行胶原蛋白溶液的制备和细胞分散,将制备的胶原蛋白溶液储存并埋入冰中,直至分配到细胞培养插入物中。将通过含细胞的胶原蛋白溶液发生胶凝形成人工真皮层的细胞培养插入物置于填充有含有10ng/mlfgf2(wakopurechemicalcorporation)的dmem10培养基的6孔培养板中并维持培养直至表皮层形成。以下培养条件全部为37℃,5%co2和100%湿度条件。
<表皮层形成>
在通过上述方法产生的含成纤维细胞胶原蛋白凝胶的表面上形成表皮层,以产生人工皮肤。
具体方法如下。将增殖至60%至80%汇合的hekn细胞通过胰蛋白酶消化而单细胞化,并悬浮于humedia-kg2培养基中至3.7×106个细胞/ml。将每孔1毫升细胞悬浮液覆盖接种在实施例1中(4)中产生的含成纤维细胞的胶原蛋白凝胶上,并培养以在含成纤维细胞的胶原蛋白凝胶上形成角质化表皮层。将覆盖的hekn细胞在humedia-kg2培养基或dmem10培养基中培养至接种后第4天,并且在hekn细胞接种后第1天、第2天和第3天用与覆盖接种相同的培养基条件进行总培养基更换。上述操作在含成纤维细胞的胶原蛋白凝胶收缩之后补充胶原蛋白凝胶后进行。调整孔中含有10ng/mlfgf2的dmem10培养基的量以使其与细胞培养插入物中humedia-kg2培养基的液体表面相同。通过在覆盖hekn细胞后第4天除去细胞培养插入物中的培养基,开始空气培养,其是其中表皮层暴露于低氧分压条件(在37℃,5%co2,12.5%o2和100%湿度条件下)的培养条件。
将进行两天空气培养后的上述人工皮肤覆盖在下述含皮下脂肪的胶原蛋白凝胶(脂肪组织层)上,然后进行毛囊并入。
2.含皮下脂肪胶原蛋白凝胶(脂肪组织层)的产生
将具有不期望区域的皮肤组织(例如从小鼠背部皮肤组织修剪的结缔组织)切成条带,然后用镊子收获脂肪组织。将剥离的脂肪组织分散在用根据实施例1中(4)的方法制备的中性胶原蛋白溶液中,在37℃,5%co2和100%湿度条件下静置以胶凝30分钟并进一步切成3mm立方体,置于中性胶原蛋白凝胶溶液中,并用与上述类似的方法胶凝以得到皮下脂肪层。还产生不具有脂肪组织的胶原蛋白凝胶作为对照。
3.用于移植的毛囊的制备(图7)
本实施例中使用的毛囊是去除胶原蛋白鞘的通过实施例1中“2.通过在将毛囊并入真皮层中之后形成表皮产生人工皮肤”中描述的方法制备的小鼠胡须。
收获在生长期的小鼠胡须以产生包含胶原蛋白鞘的完整毛囊(图7顶行)和在可变区域中去除胶原蛋白鞘的毛囊(图7底行)。将每种条件的毛囊黏附到具有薄层胶原蛋白凝胶的6cm塑料培养皿的底部,并在5%co2环境下在含有10%fbs的dmem/f12(1∶1)中进行浸渍培养直至第3天。
从培养开始(第0天)起每日进行立体显微镜追踪。楔形显示毛干尖端,箭头显示毛球部的位置。右栏显示培养第3天的毛球部的放大图像。虚线显示毛囊最外层的间充质组织边界。在普通情况下,在毛囊从生长期经过退化期到毛发生长终期的结构变化中,已知毛球部移动到毛囊的上部以形成称为次级毛芽的结构。因此,毛球部的位置的上升和毛囊的间充质组织边界的偏离位置指示其是退化期或毛发生长终期。
注意,已知小鼠胡须毛囊在活对象内处于包裹在胶原蛋白鞘中的状态,并且当以附着于胶原蛋白鞘的状态对生长期毛囊进行离体培养时,毛干伸长并且维持生长期(例如biochemicalandbiophysicalresearchcommunications367(2008)299-304)。另一方面,公知的是,在毛发移植医疗护理部位,经受例如单毛囊移植技术的毛囊经历退化期进入毛发生长终期。类似地,发现当对通过外部处理(例如去除胶原蛋白鞘)刺激的在生长期的小鼠胡须毛囊进行离体培养时,产生毛球部的位置与毛球部的间充质组织边界之间的偏离位置,并且向退化期或毛发生长终期过渡(图7)。
4.具有皮下脂肪并且并入毛囊的人工皮肤的产生(图8a)
将两天空气培养后的人工皮肤置于脂肪组织层的顶部,然后并入毛囊。人工皮肤中毛囊的并入如下以与实施例1中“2.通过在将毛囊并入真皮层中之后形成表皮产生人工皮肤”中所述方法类似的方式进行:形成穿透表皮层和脂肪组织层二者的切口,产生上述去除胶原蛋白鞘的毛囊,并用镊子将其并入。在并入毛囊之后,进行三天的器官培养。器官培养条件是在5%co2环境下包含10%fbs的dmem/f12(1∶1),并且通过半气相培养进行。
5.归因于脂肪组织层的存在或不存在的毛囊生长比较(图8b)
图8b示出了器官培养第3天所移植毛囊的组织图像。显示并入没有脂肪组织层的人工皮肤中的毛囊(图8b左)具有线状毛囊间充质图像(箭头),指示退化期,而并入具有脂肪组织层的人工皮肤中的毛囊(图8b右)是生长期毛球部。右侧照片中的虚线显示真皮(der)与脂肪组织(adp)之间的边界。
由上述结果显示,脂肪组织具有促进毛囊生长的作用。换言之,显示可以通过毛囊与皮下脂肪组织之间的相互作用来评价本发明人工皮肤的毛囊生长。
实施例3:使用再生毛囊原基的人工皮肤制造
1.由rec细胞诱导脂肪祖细胞
脂肪祖细胞是rec(迅速扩增细胞,其购自baybioscienceinc.),其是市售的间充质谱系干细胞并且根据现有技术文献诱导(mabuchiy等,stemcellreports,1,152-165,2013)。
将rec在37℃的温浴中迅速解冻,然后用脂肪形成维持培养基(lonza)洗涤,以21,000个细胞/cm2的细胞密度接种在填充有相同培养基的塑料培养皿中并培养三天。接下来,为了诱导分化成脂肪细胞,除去脂肪形成维持培养基,然后替换成脂肪形成诱导培养基(lonza),并再培养2天。使用补充有0.25%胰蛋白酶-1mmedta(invitrogen)的d-pbs(-)(nacalaitesque)溶液按照常规方式收集细胞。确认获得的细胞中脂肪祖细胞标志物pparγ基因的表达,并将这些用作rec衍生脂肪祖细胞。
2.用于移植的再生毛囊的产生(图9a)
从e18.5小鼠背部皮肤,制备通过酶处理单细胞化的皮肤上皮细胞和间充质谱系细胞,并将这些用于产生再生毛囊原基。使用wo2012/108069和wo2012/115079中描述的方法进行再生毛囊原基的产生。
将再生毛囊原基转移至细胞培养插入物,并在用多气室调节气体分压的同时用含有10%fbs的dmem/f12(1∶1)培养基进行7天的器官培养。七天后,在立体显微镜下确认毛囊的出现(图9a,左中)。根据每个毛发组将其分开(图9a,右中)并且并入人工皮肤中。
3.再生毛囊向人工皮肤的移植(图9a)
将制备的再生毛囊并入以下三种类型的人工皮肤中,进行三天器官培养(包含10%fbs的dmem/f12(1∶1)培养基,5%co2环境),然后进行组织学分析。
1.表皮+真皮模型(实施例1中毛囊并入之前的人工皮肤)
2.表皮+真皮+脂肪组织模型(实施例2中毛囊并入之前的人工皮肤)
3.表皮+真皮+rec模型(具有并入在毛囊被移植在的移植孔中由rec诱导之脂肪祖细胞的1中人工皮肤)
在任何人工皮肤中,使用25g注射针形成到达人工皮肤下层的移植孔,并且进行并入以使得深度在人工皮肤表面与为分开毛囊的毛孔部的位置之间匹配。
在“表皮+真皮+rec模型”中,使用微量移液管将去除培养基的0.2μlrec衍生脂肪祖细胞聚集体注射到移植孔中,然后用与上述类似的方法并入毛囊。
4.所移植毛囊的组织学分析(图9b)
在图9b中,顶行显示“表皮+真皮模型”的结果,中间行显示“表皮+真皮+脂肪组织模型”,并且底行显示“表皮+真皮+rec衍生脂肪祖细胞模型”。图9b左栏中所示的矩形区域的放大图像,即低倍放大视图,显示在右栏中。在任何模型中,均显示所移植毛囊的上皮组织与人工皮肤的表皮层相连。
移植到“表皮+真皮模型”的再生毛囊组织偏离了毛囊组织的分化倾向,并且虽然看到包裹在上皮组织中的间充质细胞(图9b,顶行右侧,箭头),但是未见上皮细胞的毛发基质细胞分化。
在“表皮+真皮+脂肪组织模型”中,尽管在移植的毛囊中确认了许多由上皮包裹的间充质细胞聚集体(图9b,中间行右侧,箭头),但是结果显示毛球部特异性的分化倾向在围绕间充质细胞的上皮细胞中较低。此外,尽管在这两种模型中均观察到上皮组织的伸长(*星号),但未在组织学上确认向毛囊上皮的分化倾向。
在移植到“表皮+真皮+rec衍生脂肪祖细胞模型”的毛囊中,间充质细胞通过具有强分化倾向的上皮并入毛发基质中(图9b,底行,白色箭头)。此外,在移植的毛囊的上皮中心中确认具有强角质化倾向的毛干样结构(hs)。rec衍生脂肪祖细胞分布在毛囊周围(箭头)。作为人工皮肤中的结构,epi表示表皮层,der表示真皮层,并且adp表示皮下脂肪组织。
实施例4:脂肪组织和脂肪祖细胞对人工皮肤中毛囊的毛干生长的作用
收获在生长期的小鼠胡须以产生在可变区域中去除胶原蛋白鞘的毛囊。将所述毛囊并入实施例3的“表皮+真皮模型(无脂肪组织)”、“表皮+真皮+脂肪组织模型”或“表皮+真皮+rec衍生脂肪祖细胞(两天或七天诱导期)模型”的人工皮肤中,并进行器官培养3天。
器官培养条件是包含10%fbs的dmem/f12(1∶1),在5%co2,o2大气分压环境下,并且通过半气相培养进行。用立体显微镜(stemi2000,zeiss)对培养第3天的毛干生长进行宏观照相,并用图像分析软件(axiovision,zeissandimagej,nih)测量毛干长度的变化。此外,通过图像分析类似地测量移植之前的毛囊和毛干长度,以及从并入毛囊的人工皮肤随时间收获的毛囊和毛囊的毛干长度,并且定量地功能性评价毛干生长。
结果示于图10中。与“表皮+真皮模型”相比,“表皮+真皮+脂肪组织模型”或“表皮+真皮+rec衍生脂肪祖细胞模型”显示毛干生长效果,并且特别地具有7天诱导期的rec衍生祖细胞显示出最高的毛囊生长效果。
由上述内容显示,通过本发明方法制造的人工皮肤中的毛囊与在活对象皮肤中的毛囊表现出类似的行为。换言之,与传统人工皮肤相比,通过本发明方法制造的人工皮肤更接近地再现与活对象皮肤类似的结构和功能。此外,还表明,在根据本发明的人工皮肤中不仅可以引入例如毛囊的皮肤附属物,而且还可以引入脂肪和类似细胞。因此,可以认为,本发明的人工皮肤具有极其高的可用性,例如在针对皮肤的药物和化妆品的药物效果和安全性评价中具有极其高的可用性。
- 还没有人留言评论。精彩留言会获得点赞!