聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体、制备方法及抗氧化应用与流程
本发明属于生物技术领域,具体涉及一种聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体、制备方法及重组谷胱甘肽过氧化物酶GPx1突变体用聚乙二醇修饰前后在抗氧化方面的应用。
背景技术:
谷胱甘肽是含硒的谷胱甘肽过氧化物酶GPx1的底物,硒代半胱氨酸SeCys 是其催化基团。GPx同超氧化物歧化酶SOD、H2O2酶CAT是生物机体组织中存在的三种重要的抗氧化酶。GPx1是含硒GPx重要的亚型之一,在抗氧化体系中发挥重要作用,可以清除体内H2O2及各类氢过氧化物,阻断活性氧ROS,防止脂质过氧化,治疗由活性氧引起的衰老、白内障、肿瘤及心脑血管等疾病。 GPx1不仅能清除ROS,还可以谷胱甘肽GSH为还原剂降解脂质过氧化物,使细胞膜和其他机体生物组织免受过氧化作用的损伤,这种独特的保护作用使其在抗氧化酶体系中具有重要作用,是一种具有广泛市场应用前景的医药用酶。但该酶在常温条件下其巯基易氧化导致酶活力降低、半衰期短及稳定性相对较低,从而限制了其应用。对该酶进行化学修饰,在保持其酶活力同时以提高其生物学稳定性。
中国专利201110122788.X公开了一种修饰性谷胱甘肽过氧化物酶及其制备方法,该制备方法提供了一种修饰性猪谷胱甘肽过氧化物酶的方法,不包括重组谷胱甘肽过氧化物酶GPx1突变体及其GPx1模拟酶的单甲氧基聚乙二醇 (mPEG)化修饰方法。该制备方法是将单链单甲氧基聚乙二醇通过游离氯原子与谷胱甘肽过氧化物酶的氨基发生反应,且氨基修饰率为40~45%,在pH=10.0 条件下,1.5天酶活力为68.79%。本专利的制备方法,采用单甲氧基聚乙二醇琥珀酰亚胺丁酸酯与谷胱甘肽过氧化物酶的氨基发生反应,且氨基修饰率为 98.73%,在pH=10.0条件下,15天后酶活力为77.93%,显著高于已公开专利 201110122788.X。
技术实现要素:
本发明的第一个目的在于提供一种稳定性强的聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体(mPEG-GPx1)。
本发明的第二个目的是提供上述聚乙二醇修饰的重组谷胱甘肽过氧化物酶 GPx1突变体(mPEG-GPx1)的制备方法。
本发明的第三个目的是提供上述重组谷胱甘肽过氧化物酶GPx1突变体用聚乙二醇修饰前后在抗氧化方面的应用。mPEG修饰后GPx1的抗氧化作用强于修饰前,具体见本发明内容有益效果的(6)、(7)、(8)和实施例(5)~(10),也见图10~图15。
本发明公开的单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体,由重组谷胱甘肽过氧化物酶GPx1突变体的氨基与活化的直链状单甲氧基聚乙二醇琥珀酰亚胺酯连接,其结构式如下所示:
其中GPx1表示重组谷胱甘肽过氧化物酶GPx1突变体,该重组谷胱甘肽过氧化物酶GPx1突变体是经基因重组表达制得(参见中国专利201310302778.3), mPEG表示单甲氧基聚乙二醇。
本发明的另一个目的是提供上述单甲氧基聚乙二醇(mPEG)修饰的重组谷胱甘肽过氧化物酶GPx1突变体(mPEG-GPx1)的制备方法,是采用活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯作为修饰剂,与重组谷胱甘肽过氧化物酶 GPx1突变体反应,反应式为:
其中GPx1表示重组谷胱甘肽过氧化物酶GPx1突变体。
具体步骤为:采用活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯作为修饰剂,与重组谷胱甘肽过氧化物酶GPx1突变体在4~37℃、pH=6.0~9.0条件下反应10~60min,加入终止剂甘氨酸终止反应,透析去除副产物,得到单甲氧基聚乙二醇(mPEG)修饰的重组谷胱甘肽过氧化物酶GPx1突变体;其中,重组谷胱甘肽过氧化物酶GPx1突变体与活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯的用量质量比为1:10~120;
优选的:重组谷胱甘肽过氧化物酶GPx1突变体与活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯的用量质量比为1:60;反应条件为20℃、pH=8.5条件下反应30min。
其中活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯,通过以下步骤制备得到:
(1)称取分子量2000~12000的单甲氧基聚乙二醇(mPEG)1.0~3.0g,加入2~6mL N,N-二甲基甲酰胺,充分溶解;
(2)向步骤(1)溶液中加入0.06~0.18g丁二酸酐,混匀,密封;
(3)将步骤(2)混合物于90~100℃条件下反应2~4小时;
(4)将步骤(3)反应液冷却至室温,加入0.233~0.699g N-羟基琥珀酰亚胺、0.413~1.238g 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐,加热使其溶解;
(5)将步骤(4)混合物于25~30℃条件下反应8~12小时,冷却至室温;
(6)将步骤(5)冷却后反应液于0~8℃条件下,逐滴加入20~60mL乙醚,将所得沉淀过滤,真空干燥,再将干燥产物以二氯甲烷溶解,然后再用乙醚沉淀;重复将所得沉淀过滤、真空干燥、干燥产物以二氯甲烷溶解、再用乙醚沉淀操作过程3~5次;
(7)将步骤(6)所得产物真空干燥,即得到活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯。
本发明采用重组谷胱甘肽过氧化物酶GPx1突变体为实施对象,与现有技术相比具有以下有益效果:
(1)本发明首次采用活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯连接到重组谷胱甘肽过氧化物酶GPx1突变体上,经测定其氨基修饰率最高可达 98.73%;当氨基修饰率达40%以上时,进入体内后就可完全消除异体蛋白的抗原抗体反应,因此本发明的单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶 GPx1突变体具有消除酶蛋白抗原抗体反应的特性;
(2)本发明所获得的单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶 GPx1突变体,在pH=9.0条件下酶活力保持率高达100%,即与基因重组酶活力相近;
(3)酶的pH稳定性提高:在pH 5.0及pH 11.0条件下,重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为25.28%和48.62%;而单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为26.09%和53.36%,表明在低pH 5.0及高pH 11.0条件下其稳定性更好;
(4)酶的热稳定性提高:在55℃时,重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为51.44%;而单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为59.04%,表明其热稳定性好;
(5)酶的长期稳定性提高:在4℃条件下存放120天,单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体相对比活力可以保持63.69%,而 GPx1突变体活力维持47.77%;在-20℃条件下存放90天,单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体相对比活力可以保持77.39%,而 GPx1突变体活力维持60.42%;在冻干条件下存放12个月,单甲氧基聚乙二醇修饰的重组谷胱甘肽过氧化物酶GPx1突变体相对比活力可以保持91.22%,而 GPx1突变体活力维持89.50%。说明经过mPEG修饰后的GPx1可以提高酶活稳定性。
(6)GPx1和mPEG-GPx1都有抗氧化应激损伤能力,但后者强于前者:在 30μmol/L阿霉素诱导的人胚肾HEK293T细胞氧化应激模型中,模型组细胞存活率为55.05%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为65.02%、治疗组为61.04%,相较于模型组细胞存活率分别提高18.11%、10.88%;含0.8 U/mL mPEG-GPx1预防组细胞存活率为69.03%、治疗组为66.20%,相较于模型组细胞存活率分别提高25.40%、20.25%;含0.8U/mL GPx1预防组细胞存活率为64.54%、治疗组为57.18%,相较于模型组细胞存活率分别提高17.24%、3.87%。
在2.5μmol/L阿霉素诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞存活率为60.13%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为74.57%、治疗组为72.42%,相较于模型组细胞存活率分别提高24.01%、 20.44%;含0.08U/mL mPEG-GPx1预防组细胞存活率为85.80%、治疗组为 79.58%,相较于模型组细胞存活率分别提高42.69%、20.44%;含0.08U/mL GPx1 预防组细胞存活率为83.84%、治疗组为76.93%,相较于模型组细胞存活率分别提高39.43%、27.94%。
在600μmol/L过氧化氢(H2O2)诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞存活率为53.84%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为70.87%、治疗组为68.76%,相较于模型组细胞存活率分别提高 31.39%、27.48%;含0.1U/mL mPEG-GPx1预防组细胞存活率为93.67%、治疗组为83.46%,相较于模型组细胞存活率分别提高72.65%、54.72%;含0.1U/mL GPx1预防组细胞存活率为90.06%、治疗组为81.19%,相较于模型组细胞存活率分别提高66.96%、50.51%。
在400μmol/L H2O2诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞存活率为52.78%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为 73.95%、治疗组为65.89%,相较于模型组细胞存活率分别提高40.11%、24.84%;含0.08U/mL mPEG-GPx1预防组细胞存活率为95.11%、治疗组为84.69%,相较于模型组细胞存活率分别提高80.19%、60.45%;含0.08U/mL GPx1预防组细胞存活率为92.60%、治疗组为83.54%,相较于模型组细胞存活率分别提高75.45%、 58.27%。
(7)GPx1和mPEG-GPx1都能降低细胞膜上脂质过氧化物反应的发生,但后者强于前者。在30μmol/L阿霉素诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为240.17±5.35U/g,含2mM/L阳性药N- 乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为287.62±11.75U/g、治疗组 286.42±3.64U/g,相较于模型组细胞乳酸脱氢酶含量分别提高19.75±4.89%、 19.25±1.51%;含0.8U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为 295.02±0.59U/g、治疗组287.01±6.17U/g,相较于模型组细胞乳酸脱氢酶含量分别提高22.84±0.25%、19.50±2.57%;含0.8U/mL GPx1预防组细胞内乳酸脱氢酶含量为296.95±8.87U/g、治疗组288.74±1.96U/g,相较于模型组细胞乳酸脱氢酶含量分别提高23.64±3.69%、19.25±1.51%。
在2.5μmol/L阿霉素诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为538.41±4.59U/g,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为577.08±4.86U/g、治疗组572.45±4.45U/g,相较于模型组细胞乳酸脱氢酶含量分别提高7.18±0.90%、6.32±0.83%;含0.08U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为698.68±9.50U/g、治疗组 647.05±2.11U/g,相较于模型组细胞乳酸脱氢酶含量分别提高29.77±1.76%、 20.18±0.39%;含0.08U/mL GPx1预防组细胞内乳酸脱氢酶含量为647.76±3.92 U/g、治疗组612.42±2.82U/g,相较于模型组细胞乳酸脱氢酶含量分别提高 20.31±0.73%、13.75±0.52%。能够降低细胞膜的破损程度,减少乳酸脱氢酶的释放。
在600μmol/L H2O2诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为240.18±0.1U/g,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为308.60±7.58U/g、治疗组286.65±0.81U/g,相较于模型组细胞乳酸脱氢酶含量分别提高28.49±3.16%、19.35±0.34%;含0.1U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为400.56±1.87U/g、治疗组 350.67±0.22U/g,相较于模型组细胞乳酸脱氢酶含量分别提高66.78±0.78%、 46.01±0.09%;含0.1U/mL GPx1预防组细胞内乳酸脱氢酶含量为383.44±2.43 U/g、治疗组325.69±5.59U/g,相较于模型组细胞乳酸脱氢酶含量分别提高 59.65±1.01%、35.61±2.33%。
在400μmol/L H2O2诱导H9c2细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为536.05±5.02U/g,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为603.75±5.81U/g、治疗组577.12±5.03U/g,相较于模型组细胞乳酸脱氢酶含量分别提高12.63±1.08%、7.66±0.94%;含0.08U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为801.97±2.91U/g、治疗组 708.61±7.60U/g,相较于模型组细胞乳酸脱氢酶含量分别提高49.61±0.54%、 32.19±1.42%;含0.08U/mL GPx1预防组细胞内乳酸脱氢酶含量为773.67±5.98 U/g、治疗组680.66±0.11U/g,相较于模型组细胞乳酸脱氢酶含量分别提高 49.61±0.54%、26.98±0.02%。
(8)GPx1和mPEG-GPx1都能够阻断脂质过氧化物链式反应的发生,降低丙二醛的含量,但后者强于前者。在30μmol/L阿霉素诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内丙二醛含量为0.904±0.11nmol/mg,含2 mM/L阳性药N-乙酰半胱氨酸预防组细胞内丙二醛含量为0.452±0.02nmol/mg、治疗组0.442±0.02nmol/mg,相较于模型组细胞丙二醛含量分别降低 49.96±2.41%,51.11±0.16%;含0.8U/mL mPEG-GPx1预防组细胞内丙二醛含量为0.369±0.17nmol/mg、治疗组0.468±0.19nmol/mg,相较于模型组细胞丙二醛含量分别降低59.16±18.72%,48.26±21.56%;含0.8U/mL GPx1预防组细胞内丙二醛含量为0.389±0.13nmol/mg、治疗组0.401±0.07nmol/mg,相较于模型组细胞丙二醛含量分别降低57.01±14.33%,55.65±7.68%。
在2.5μmol/L阿霉素诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞内丙二醛含量为8.22±0.19nmol/mg,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内丙二醛含量为2.73±0.02nmol/mg、治疗组3.57±0.02nmol/mg,相较于模型组细胞丙二醛含量分别降低66.79±0.28%,56.53±0.29%;含0.08U/mL mPEG-GPx1预防组细胞内丙二醛含量为2.34±0.90nmol/mg、治疗组3.32±0.06 nmol/mg,相较于模型组细胞丙二醛含量分别降低71.49±1.10%,59.66±0.67%;含0.08U/mL GPx1预防组细胞内丙二醛含量为2.55±0.06nmol/mg、治疗组 3.45±0.25nmol/mg,相较于模型组细胞丙二醛含量分别降低69.01±0.70%, 57.97±3.07%。能够有效预防或治疗阿霉素对细胞的损伤。
在600μmol/L H2O2诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内丙二醛含量为0.911±0.01nmol/mg,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内丙二醛含量为0.437±0.02nmol/mg、治疗组0.435±0.01nmol/mg,相较于模型组细胞丙二醛含量分别降低52.08±1.52%,52.23±1.36%;含0.1U/mL mPEG-GPx1预防组细胞内丙二醛含量为0.303±0.17nmol/mg、治疗组0.332±0.01 nmol/mg,相较于模型组细胞丙二醛含量分别降低66.72±0.17%,63.57±1.33%;含0.1U/mL GPx1预防组细胞内丙二醛含量为0.326±0.13nmol/mg、治疗组 0.387±0.07nmol/mg,相较于模型组细胞丙二醛含量分别降低64.19±0.42%, 57.53±0.11%。
在400μmol/L H2O2诱导H9c2细胞建立氧化应激模型中,模型组细胞内丙二醛含量为8.313±0.13nmol/mg,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内丙二醛含量为2.67±0.01nmol/mg、治疗组3.25±0.03nmol/mg,相较于模型组细胞丙二醛含量分别降低67.88±0.12%,60.95±0.37%;含0.08U/mL mPEG-GPx1 预防组细胞内丙二醛含量为1.67±0.02nmol/mg、治疗组2.73±0.24nmol/mg,相较于模型组细胞丙二醛含量分别降低79.91±0.21%,67.12±2.85%;含0.08U/mL GPx1预防组细胞内丙二醛含量为2.03±0.05nmol/mg、治疗组3.03±0.03nmol/mg,相较于模型组细胞丙二醛含量分别降低75.62±0.54%,63.59±0.37%。
附图说明
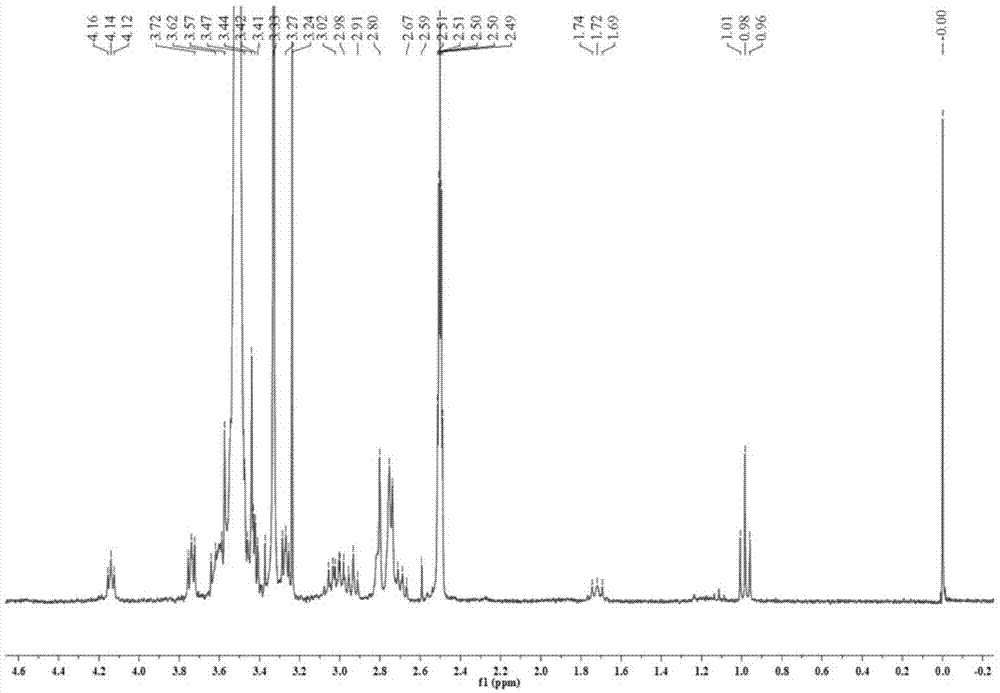
图1为本发明单甲氧基聚乙二醇琥珀酰亚胺丁酸酯氢核磁共振波谱图。
图2为本发明修饰结果SDS-PAGE电泳图,1为分子量14.3kD、20.1kD、 29.0kD、44.3kD、66.4kD、97.2kD,2为GPx1突变体,3为修饰剂(单甲氧基聚乙二醇琥珀酰亚胺丁酸酯),4为GPx1与修饰剂质量比为1:10的修饰产物,5 为GPx1与修饰剂质量比为1:20的修饰产物,6为GPx1与修饰剂质量比为1:30 的修饰产物,7为GPx1与修饰剂质量比为1:60的修饰产物,8为GPx1与修饰剂质量比为1:90的修饰产物,9为GPx1与修饰剂质量比为1:120的修饰产物。
图3为本发明修饰结果碘染图,1为分子量14.3kD、20.1kD、29.0kD、44.3kD、 66.4kD、97.2kD,2为GPx1突变体,3为修饰剂,4为GPx1与修饰剂质量比为 1:10的修饰产物,5为GPx1与修饰剂质量比为1:20的修饰产物,6为GPx1与修饰剂质量比为1:30的修饰产物,7为GPx1与修饰剂质量比为1:60的修饰产物, 8为GPx1与修饰剂质量比为1:90的修饰产物,9为GPx1与修饰剂质量比为1:120 的修饰产物。
图4为本发明GPx1与修饰剂质量比为1:10、1:20、1:30、1:60、1:90、1:120 条件下,单一赖氨酸位点修饰、多个赖氨酸位点修饰及未修饰GPx1结果对比图。
图5为本发明GPx1及mPEG-GPx1(其中,GPx1与修饰剂质量比为1:60) 在19、30、37、45、50、55℃条件下的酶活保存率对比图。
图6为本发明GPx1及mPEG-GPx1(其中,GPx1与修饰剂质量比为1:60) 在pH5.0、6.0、7.4、8.0、9.0、10.0、11.0条件下的酶活保存率对比图
图7为本发明GPx1及mPEG-GPx1(其中,GPx1与修饰剂质量比为1:60) 在4℃条件下存放不同时间的稳定性图。
图8为本发明GPx1及mPEG-GPx1(其中,GPx1与修饰剂质量比为1:60) 在-20℃条件下存放不同时间的稳定性图。
图9为本发明GPx1及mPEG-GPx1(其中,GPx1与修饰剂质量比为1:60) 冷冻干燥后在-20℃条件下存放不同时间的稳定性图。
图10为本发明GPx1及mPEG-GPx1对阿霉素引起HEK293T细胞损伤的预防及治疗作用细胞存活率图。
图11为本发明GPx1及mPEG-GPx1对阿霉素引起H9c2细胞损伤的预防及治疗作用细胞存活率图。
图12为本发明GPx1及mPEG-GPx1对阿霉素引起HEK293T细胞损伤的预防及治疗作用细胞内乳酸脱氢酶含量图。
图13为本发明GPx1及mPEG-GPx1对阿霉素引起H9c2细胞损伤的预防及治疗作用细胞内乳酸脱氢酶含量图。
图14为本发明GPx1及mPEG-GPx1对阿霉素引起HEK293T细胞损伤的预防及治疗作用细胞内丙二醛含量图。
图15为本发明GPx1及mPEG-GPx1对阿霉素引起H9c2细胞损伤的预防及治疗作用细胞内丙二醛含量图。
图16为本发明GPx1及mPEG-GPx1对过氧化氢(H2O2)引起HEK293T细胞损伤的预防及治疗作用细胞存活率图。
图17为本发明GPx1及mPEG-GPx1对H2O2引起H9c2细胞损伤的预防及治疗作用细胞存活率图。
图18为本发明GPx1及mPEG-GPx1对H2O2引起HEK293T细胞损伤的预防及治疗作用细胞内乳酸脱氢酶含量图。
图19为本发明GPx1及mPEG-GPx1对H2O2引起H9c2细胞损伤的预防及治疗作用细胞内乳酸脱氢酶含量图。
图20为本发明GPx1及mPEG-GPx1对H2O2引起HEK293T细胞损伤的预防及治疗作用细胞内丙二醛含量图。
图21为本发明GPx1及mPEG-GPx1对H2O2引起H9c2细胞损伤的预防及治疗作用细胞内丙二醛含量图。
具体实施方式
实施例1活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯合成。
1.通过以下方法获得:
(1)称取分子量5000的单甲氧基聚乙二醇(mPEG)2.0g,于烧瓶中加入4 mL N,N-二甲基甲酰胺,充分溶解。
(2)加入0.12g丁二酸酐,混匀,密封。
(3)混合物于100℃条件下反应3小时。
(4)将上述反应液冷却至室温后,加入0.466g N-羟基琥珀酰亚胺、0.825g 1- 乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐,加热使其溶解。
(5)于30℃条件下过夜反应12小时,冷却至室温。
(6)将冷却后的反应液于4℃下,逐滴加入40mL乙醚,将所得沉淀过滤,真空干燥。再将干燥过的产物以二氯甲烷溶解,然后再用乙醚沉淀。重复此过程 4次。
(7)将所得产物真空干燥,通过氢核磁共振波谱(图1)确证,即获得活化的直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯。
2.重组谷胱甘肽过氧化物酶GPx1突变体的获取:
通过本课题组已授权专利201310302778.3方法制备获取。
3.重组谷胱甘肽过氧化物酶GPx1突变体的mPEG化修饰
在反应温度20℃、pH 8.5、重组谷胱甘肽过氧化物酶GPx1突变体与直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯质量比分别为1:10、1:20、1:30、1:60、1:90、 1:120,反应30min后,加甘氨酸终止反应,分别获得所述的mPEG化修饰的重组谷胱甘肽过氧化酶GPx1突变体。
实施例1获得的重组谷胱甘肽过氧化物酶GPx1突变体mPEG化修饰产物,采用聚丙烯酰胺凝胶电泳SDS-PAGE(图2),考马斯亮蓝染色,染色结果证明, mPEG连接到GPx1上。
实施例1获得的重组谷胱甘肽过氧化物酶GPx1突变体mPEG化修饰产物,采用聚丙烯酰胺凝胶电泳SDS-PAGE,碘染(图3),染色结果证明,mPEG连接到GPx1上。
如图4所示,通过考察单一赖氨酸位点修饰、多个赖氨酸位点修饰及未修饰 GPx1,优选重组谷胱甘肽过氧化物酶GPx1突变体与直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯质量比为1:60,作为目标产物。
实施例2
mPEG化重组谷胱甘肽过氧化物酶GPx1突变体的修饰产物性能评价:
(1)重组谷胱甘肽过氧化物酶GPx1突变体与直链状单甲氧基聚乙二醇琥珀酰亚胺丁酸酯质量比为1:60时所获酶的热稳定性提高。
反应体系为500μL,其中包含50mmol/L pH 7.4的PBS、1mmol/L EDTA、 1mmol/L GSH、0.25mmol/L NADPH、1U谷胱甘肽还原酶和20-50nM的蛋白样品。反应混合物19~55℃预保温5min,然后加入终浓度0.5mmol/L H2O2启动反应。通过紫外分光光度计在340nm处监测NADPH吸光度值的变化情况。酶活力定义为37℃下,该蛋白每分钟氧化1μmol NADPH所需酶的量为一个活力单位,并以100%酶活力表示。如图5所示,在55℃时,重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为51.44%;而mPEG修饰的重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为59.04%。结果表明mPEG修饰的重组谷胱甘肽过氧化物酶GPx1突变体热稳定性好。
(2)酶的pH稳定性提高。反应体系为500μL,其中包含50mmol/L pH 5.0~11.0的PBS、1mmol/L EDTA、1mmol/L GSH、0.25mmol/L NADPH、1U谷胱甘肽还原酶和20-50nM的蛋白样品。反应混合物19-55℃预保温5min,然后加入终浓度0.5mmol/L H2O2启动反应。通过紫外分光光度计在340nm处监测 NADPH吸光度值的变化情况。酶活力定义为37℃下,该蛋白每分钟氧化1μmol NADPH所需酶的量为一个活力单位,并以100%酶活力表示。如图6所示,在 pH 5.0及pH11.0条件下,重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为25.28%和48.62%;而mPEG修饰的重组谷胱甘肽过氧化物酶GPx1突变体保持相对酶活为26.09%和53.36%。mPEG修饰的重组谷胱甘肽过氧化物酶GPx1 突变体稳定性稍好。
实施例3
mPEG化重组谷胱甘肽过氧化物酶GPx1突变体的修饰产物(mPEG-GPx1) 冻干保护剂筛选:
在4度层析冷柜中,分别将GPx1及mPEG-GPx1在含10%甘露醇、5%甘氨酸(W/V)冻干保护剂的溶液(200mL)中透析4小时,中间更换4次透析液,待透析完成后,-20℃条件下预冻12小时,Zirbus Voco 5冻干机中冻干;GPx1 及mPEG-GPx1未加冻干保护剂的样品在-20℃条件下预冻12小时,Zirbus Voco 5冻干机中冻干;按照实施例2酶活测定方法,测定37℃时酶活。以冻干前样品酶活力为100%计。
将GPx1及mPEG-GPx1直接冻干后,酶活力分别保持75.36%、82.42%;当使用10%甘露醇、5%甘氨酸做保护剂时,GPx1及mPEG-GPx1冻干后酶活力分别保持82.42%、86.19%;说明mPEG化重组谷胱甘肽过氧化物酶GPx1突变体的稳定性较GPx1突变体好,优选10%甘露醇、5%甘氨酸作为冻干保护剂。
实施例4
长期稳定性评价:
(1)将GPx1及mPEG-GPx分别加入40%甘油,于4℃条件下存放,分别于 0、15、30、45、60、75、90、105及120天时,按照实施例2所示酶活测定方法,测定其37℃酶活力。结果如图7所示,在120天时,mPEG-GPx1可以保持 63.69%相对比活力,而GPx1仅保持47.77%,mPEG修饰后的GPx1相比较于 GPx1可以提高33.33%酶活力,说明mPEG修饰后的GPx1酶活稳定性好。
(2)将GPx1及mPEG-GPx1分别加入40%甘油,于-20℃条件下存放,分别于0、15、30、60及90天时,按照实施例2所示酶活测定方法,测定其37℃酶活力。结果如图8所示,在90天时,mPEG-GPx1可以保持77.39%相对比活力,而GPx1仅保持60.42%,mPEG修饰后的GPx1相比较于GPx1可以提高28.09%酶活力,说明mPEG修饰后的GPx1可以提高酶活稳定性。
(3)将GPx1及mPEG-GPx1加入10%甘露醇、5%甘氨酸为冻干保护剂,冻干后于-20℃条件下存放,分别于1~12个月,按照实施例2所示酶活测定方法,测定其37℃酶活。结果如图9所示,在12个月时,mPEG-GPx1可以保持91.22%相对比活力,而GPx1保持89.50%,mPEG修饰后的GPx1相比较于GPx1可以提高1.92%酶活力。说明mPEG修饰后的GPx1即使冻干条件下存放酶活稳定性也略有提高,只是不如液体状态下明显。
实施例5 GPx1和mPEG-GPx1通过预防或治疗阿霉素引起的氧化应激损伤提高 HEK293T细胞存活率
HEK293T细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度30μmol/L阿霉素;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.8U/mL的GPx1及mPEG-GPx1,作用1小时后加入终浓度30μmol/L阿霉素作用24小时;治疗组中,分别加入终浓度30μmol/L阿霉素作用12小时,随后在细胞中分别加入终浓度0.8U/mL的GPx1及mPEG-GPx1作用12小时。每孔加入5mg/ml的MTT 溶液20μL,继续培养4h,终止培养后吸弃孔内培养上清液,并每孔加150μL二甲基亚讽(DMSO)终止反应,振荡5min,使结晶物质充分溶解。选择492nm波长,在酶标仪上测定各孔吸光值。计算不同组的细胞存活率。
如图10所示,在30μmol/L阿霉素诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞存活率为55.05%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为65.02%、治疗组为61.04%,相较于模型组细胞存活率分别提高 18.11%、10.88%;含0.8U/mL mPEG-GPx1预防组细胞存活率为69.03%、治疗组为66.20%,相较于模型组细胞存活率分别提高25.40%、20.25%;含0.8U/mL GPx1预防组细胞存活率为64.54%、治疗组为57.18%,相较于模型组细胞存活率分别提高17.24%、3.87%。说明,GPx1及mPEG-GPx1均具有抗氧化应激损伤能力,且经过mPEG修饰后的GPx1抗氧化应激损伤能力在HEK293T细胞中表现更强。
实施例6 GPx1和mPEG-GPx1通过预防或治疗阿霉素引起的氧化应激损伤提高 H9c2细胞存活率
H9c2细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96 孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度2.5μmol/L阿霉素;预防组中,分别加入终浓度 2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.08U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度2.5μmol/L阿霉素作用24小时;治疗组中,分别加入终浓度2.5μmol/L阿霉素,作用12小时后,再分别加入终浓度0.08 U/mL的GPx1及mPEG-GPx1作用12小时。每孔加入5mg/ml的MTT溶液20μL,继续培养4h,终止培养后吸弃孔内培养上清液,并每孔加150μL二甲基亚讽 (DMSO)终止反应,振荡5min,使结晶物质充分溶解。选择492nm波长,在酶标仪上测定各孔吸光值。计算不同组的细胞存活率。
如图11所示,在2.5μmol/L阿霉素诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞存活率为60.13%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为74.57%、治疗组为72.42%,相较于模型组细胞存活率分别提高 24.01%、20.44%;含0.08U/mL mPEG-GPx1预防组细胞存活率为85.80%、治疗组为79.58%,相较于模型组细胞存活率分别提高42.69%、20.44%;含0.08U/mL GPx1预防组细胞存活率为83.84%、治疗组为76.93%,相较于模型组细胞存活率分别提高39.43%、27.94%。说明,GPx1及mPEG-GPx1均具有抗氧化应激损伤能力,且经过mPEG修饰后的GPx1抗氧化应激损伤能力在H9c2细胞中表现更强。
实施例7 GPx1和mPEG-GPx1通过降低HEK293T细胞膜上脂质过氧化物反应预防和治疗阿霉素引起的氧化应激损伤
HEK293T细胞以1×105个/孔接种于含8mL10%胎牛血清的高糖DMEM培养液的培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度30μmol/L阿霉素;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.8U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度30μmol/L阿霉素作用24小时;治疗组中,分别加入终浓度30μmol/L阿霉素作用12小时,随后在细胞中分别加入终浓度0.8U/mL的GPx1及mPEG-GPx1作用12小时。通过南京建成乳酸脱氢酶试剂盒(A020-2),按照说明书所述步骤对损伤细胞中的乳酸脱氢酶指标进行评价。
如图12所示,在30μmol/L阿霉素诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为240.17±5.35U/g,含2mM/L阳性药 N-乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为287.62±11.75U/g、治疗组286.42±3.64U/g,相较于模型组细胞乳酸脱氢酶含量分别提高19.75±4.89%、 19.25±1.51%;含0.8U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为 295.02±0.59U/g、治疗组287.01±6.17U/g,相较于模型组细胞乳酸脱氢酶含量分别提高22.84±0.25%、19.50±2.57%;含0.8U/mL GPx1预防组细胞内乳酸脱氢酶含量为296.95±8.87U/g、治疗组288.74±1.96U/g,相较于模型组细胞乳酸脱氢酶含量分别提高23.64±3.69%、19.25±1.51%。能够降低细胞膜的破损程度,减少乳酸脱氢酶的释放。且mPEG修饰后的GPx1降低细胞膜损伤能力在HEK293T细胞中表现更强。
实施例8 GPx1和mPEG-GPx1通过降低H9c2细胞膜上脂质过氧化物反应预防和治疗阿霉素引起的氧化应激损伤
H9c2细胞以1×105个/mL接种于含8mL10%胎牛血清的高糖DMEM培养液的培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度2.5μmol/L阿霉素;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.08U/mL的GPx1及mPEG-GPx1,作用1小时后加入终浓度2.5μmol/L阿霉素作用24小时;治疗组中,分别加入终浓度2.5μmol/L阿霉素,作用12小时后,再分别加入终浓度0.08 U/mL的GPx1及mPEG-GPx1作用12小时。通过南京建成乳酸脱氢酶试剂盒 (A020-2),按照说明书所述步骤对损伤细胞中的乳酸脱氢酶指标进行评价。
如图13所示,在2.5μmol/L阿霉素诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为538.41±4.59U/g,含2mM/L阳性药 N-乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为577.08±4.86U/g、治疗组 572.45±4.45U/g,相较于模型组细胞乳酸脱氢酶含量分别提高7.18±0.90%、 6.32±0.83%;含0.08U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为 698.68±9.50U/g、治疗组647.05±2.11U/g,相较于模型组细胞乳酸脱氢酶含量分别提高29.77±1.76%、20.18±0.39%;含0.08U/mL GPx1预防组细胞内乳酸脱氢酶含量为647.76±3.92U/g、治疗组612.42±2.82U/g,相较于模型组细胞乳酸脱氢酶含量分别提高20.31±0.73%、13.75±0.52%。能够降低细胞膜的破损程度,减少乳酸脱氢酶的释放。且mPEG修饰后的GPx1降低细胞膜损伤能力在H9c2细胞中更强。
实施例9 GPx1和mPEG-GPx1通过阻断HEK293T细胞脂质过氧化物链式反应的发生预防和治疗阿霉素引起的氧化应激损伤
HEK293T细胞以1×105个/孔接种于含8mL10%胎牛血清的高糖DMEM培养液的培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度30μmol/L阿霉素;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.8U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度30μmol/L阿霉素作用24小时;治疗组中,分别加入终浓度30μmol/L阿霉素作用12小时,随后在细胞中分别加入终浓度0.8U/mL的GPx1及mPEG-GPx1作用12小时。通过南京建成丙二醛试剂盒(A003-1),按照说明书所述步骤对损伤细胞中的丙二醛指标进行评价。
如图14所示,在30μmol/L阿霉素诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内丙二醛含量为0.904±0.11nmol/mg,含2mM/L阳性药N- 乙酰半胱氨酸预防组细胞内丙二醛含量为0.452±0.02nmol/mg、治疗组 0.442±0.02nmol/mg,相较于模型组细胞丙二醛含量分别降低49.96±2.41%, 51.11±0.16%;含0.8U/mL mPEG-GPx1预防组细胞内丙二醛含量为0.369±0.17 nmol/mg、治疗组0.468±0.19nmol/mg,相较于模型组细胞丙二醛含量分别降低59.16±18.72%,48.26±21.56%;含0.8U/mL GPx1预防组细胞内丙二醛含量为 0.389±0.13nmol/mg、治疗组0.401±0.07nmol/mg,相较于模型组细胞丙二醛含量分别降低57.01±14.33%,55.65±7.68%。能够阻断脂质过氧化物链式反应的发生,降低丙二醛的含量,且mPEG修饰后的GPx1降低脂质过氧化物能力HEK293T 细胞中更强。
实施例10 GPx1和mPEG-GPx1通过阻断H9c2细胞脂质过氧化物链式反应的发生预防和治疗阿霉素引起的氧化应激损伤
H9c2细胞以1×105个/mL接种于含8mL10%胎牛血清的高糖DMEM培养液的培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度2.5μmol/L阿霉素;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.08U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度2.5μmol/L阿霉素作用24小时;治疗组中,分别加入终浓度2.5μmol/L阿霉素,作用12小时后,再分别加入终浓度0.08 U/mL的GPx1及mPEG-GPx1作用12小时。通过南京建成丙二醛试剂盒 (A003-1),按照说明书所述步骤对损伤细胞中的丙二醛指标进行评价。
如图15所示,在2.5μmol/L阿霉素诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞内丙二醛含量为8.22±0.19nmol/mg,含2mM/L阳性药N- 乙酰半胱氨酸预防组细胞内丙二醛含量为2.73±0.02nmol/mg、治疗组3.57±0.02 nmol/mg,相较于模型组细胞丙二醛含量分别降低66.79±0.28%,56.53±0.29%;含0.08U/mL mPEG-GPx1预防组细胞内丙二醛含量为2.34±0.90nmol/mg、治疗组3.32±0.06nmol/mg,相较于模型组细胞丙二醛含量分别降低71.49±1.10%, 59.66±0.67%;含0.08U/mL GPx1预防组细胞内丙二醛含量为2.55±0.06nmol/mg、治疗组3.45±0.25nmol/mg,相较于模型组细胞丙二醛含量分别降低69.01±0.70%, 57.97±3.07%。GPx1及mPEG-GPx1能够有效预防或治疗阿霉素对细胞的损伤。能够阻断脂质过氧化物链式反应的发生,降低丙二醛的含量,且mPEG修饰后的GPx1降低脂质过氧化物能力H9c2细胞中更强。
实施例11 GPx1和mPEG-GPx1通过预防或治疗H2O2引起的氧化应激损伤提高 HEK293T细胞存活率
HEK293T细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度600μmol/L H2O2;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.1U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度600μmol/L H2O2作用12小时;治疗组中,分别加入终浓度600μmol/L H2O2作用6小时,随后在细胞中分别加入终浓度0.1U/mL的GPx1及mPEG-GPx1作用6小时。每孔加入5mg/ml的MTT溶液20μL,继续培养4h,终止培养后吸弃孔内培养上清液,并每孔加150μL二甲基亚讽(DMSO)终止反应,振荡5min,使结晶物质充分溶解。选择492nm波长,在酶标仪上测定各孔吸光值。计算不同组的细胞存活率。
如图16所示,在600μmol/L H2O2诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞存活率为53.84%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为70.87%、治疗组为68.76%,相较于模型组细胞存活率分别提高 31.39%、27.48%;含0.1U/mL mPEG-GPx1预防组细胞存活率为93.67%、治疗组为83.46%,相较于模型组细胞存活率分别提高72.65%、54.72%;含0.1U/mL GPx1预防组细胞存活率为90.06%、治疗组为81.19%,相较于模型组细胞存活率分别提高66.96%、50.51%。说明,GPx1及mPEG-GPx1均具有抗氧化应激损伤能力,且经过mPEG修饰后的GPx1抗氧化应激损伤能力在HEK293T细胞中表现更强。
实施例12 GPx1和mPEG-GPx1通过预防或治疗H2O2引起的氧化应激损伤提高 H9c2细胞存活率
H9c2细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96 孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度400μmol/L H2O2;预防组中,分别加入终浓度2 mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.08U/mL的GPx1及mPEG-GPx1,作用1小时后加入终浓度400μmol/LH2O2作用12小时;治疗组中,分别加入终浓度400μmol/L H2O2作用6小时,随后在细胞中分别加入终浓度0.08U/mL的 GPx1及mPEG-GPx1作用6小时。每孔加入5mg/ml的MTT溶液20μL,继续培养4h,终止培养后吸弃孔内培养上清液,并每孔加150μL二甲基亚讽(DMSO) 终止反应,振荡5min,使结晶物质充分溶解。选择492nm波长,在酶标仪上测定各孔吸光值。计算不同组的细胞存活率。
如图17所示,在400μmol/L H2O2诱导H9c2大鼠心肌细胞建立氧化应激模型中,模型组细胞存活率为52.78%,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞存活率为73.95%、治疗组为65.89%,相较于模型组细胞存活率分别提高 40.11%、24.84%;含0.08U/mL mPEG-GPx1预防组细胞存活率为95.11%、治疗组为84.69%,相较于模型组细胞存活率分别提高80.19%、60.45%;含0.08U/mL GPx1预防组细胞存活率为92.60%、治疗组为83.54%,相较于模型组细胞存活率分别提高75.45%、58.27%。说明,GPx1及mPEG-GPx1均具有抗氧化应激损伤能力,且经过mPEG修饰后的GPx1抗氧化应激损伤能力在H9c2细胞中表现更强。
实施例13 GPx1和mPEG-GPx1通过降低HEK293T细胞膜上脂质过氧化物反应预防和治疗H2O2引起的氧化应激损伤
HEK293T细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度600μmol/L H2O2;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.1U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度600μmol/L H2O2作用12小时;治疗组中,分别加入终浓度600μmol/L H2O2作用6小时,随后在细胞中分别加入终浓度0.1U/mL的GPx1及mPEG-GPx1作用6小时。通过南京建成乳酸脱氢酶试剂盒(A020-2),按照说明书所述步骤对损伤细胞中的乳酸脱氢酶指标进行评价。
如图18所示,在600μmol/L H2O2诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为240.18±0.1U/g,含2mM/L阳性药N- 乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为308.60±7.58U/g、治疗组 286.65±0.81U/g,相较于模型组细胞乳酸脱氢酶含量分别提高28.49±3.16%、 19.35±0.34%;含0.1U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为 400.56±1.87U/g、治疗组350.67±0.22U/g,相较于模型组细胞乳酸脱氢酶含量分别提高66.78±0.78%、46.01±0.09%;含0.1U/mL GPx1预防组细胞内乳酸脱氢酶含量为383.44±2.43U/g、治疗组325.69±5.59U/g,相较于模型组细胞乳酸脱氢酶含量分别提高59.65±1.01%、35.61±2.33%。能够降低细胞膜的破损程度,减少乳酸脱氢酶的释放。且mPEG修饰后的GPx1降低细胞膜损伤能力在HEK293T细胞中表现更强。
实施例14 GPx1和mPEG-GPx1通过降低H9c2细胞膜上脂质过氧化物反应预防和治疗H2O2引起的氧化应激损伤
H9c2细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96 孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度400μmol/L H2O2;预防组中,分别加入终浓度2 mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.08U/mL的GPx1及mPEG-GPx1,作用1小时后加入终浓度400μmol/L H2O2作用12小时;治疗组中,分别加入终浓度400μmol/L H2O2作用6小时,随后在细胞中分别加入终浓度0.08U/mL的 GPx1及mPEG-GPx1作用6小时。通过南京建成乳酸脱氢酶试剂盒(A020-2),按照说明书所述步骤对损伤细胞中的乳酸脱氢酶指标进行评价。
如图19所示,在400μmol/L H2O2诱导H9c2细胞建立氧化应激模型中,模型组细胞内乳酸脱氢酶含量为536.05±5.02U/g,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内乳酸脱氢酶含量为603.75±5.81U/g、治疗组577.12±5.03U/g,相较于模型组细胞乳酸脱氢酶含量分别提高12.63±1.08%、7.66±0.94%;含0.08 U/mL mPEG-GPx1预防组细胞内乳酸脱氢酶含量为801.97±2.91U/g、治疗组 708.61±7.60U/g,相较于模型组细胞乳酸脱氢酶含量分别提高49.61±0.54%、 32.19±1.42%;含0.08U/mL GPx1预防组细胞内乳酸脱氢酶含量为773.67±5.98 U/g、治疗组680.66±0.11U/g,相较于模型组细胞乳酸脱氢酶含量分别提高 49.61±0.54%、26.98±0.02%。能够降低细胞膜的破损程度,减少乳酸脱氢酶的释放。且mPEG修饰后的GPx1降低细胞膜损伤能力在H9c2细胞中表现更强。
实施例15 GPx1和mPEG-GPx1通过阻断HEK293T细胞脂质过氧化物链式反应的发生预防和治疗H2O2引起的氧化应激损伤
HEK293T细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度600μmol/L H2O2;预防组中,分别加入终浓度2mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.1U/mL的GPx1及 mPEG-GPx1,作用1小时后加入终浓度600μmol/L H2O2作用12小时;治疗组中,分别加入终浓度600μmol/L H2O2作用6小时,随后在细胞中分别加入终浓度0.1U/mL的GPx1及mPEG-GPx1作用6小时。通过南京建成丙二醛试剂盒 (A003-1),按照说明书所述步骤对损伤细胞中的丙二醛指标进行评价。
如图20所示,在600μmol/L H2O2诱导人胚肾HEK293T细胞建立氧化应激模型中,模型组细胞内丙二醛含量为0.911±0.01nmol/mg,含2mM/L阳性药N- 乙酰半胱氨酸预防组细胞内丙二醛含量为0.437±0.02nmol/mg、治疗组 0.435±0.01nmol/mg,相较于模型组细胞丙二醛含量分别降低52.08±1.52%, 52.23±1.36%;含0.1U/mL mPEG-GPx1预防组细胞内丙二醛含量为0.303±0.17 nmol/mg、治疗组0.332±0.01nmol/mg,相较于模型组细胞丙二醛含量分别降低 66.72±0.17%,63.57±1.33%;含0.1U/mL GPx1预防组细胞内丙二醛含量为 0.326±0.13nmol/mg、治疗组0.387±0.07nmol/mg,相较于模型组细胞丙二醛含量分别降低64.19±0.42%,57.53±0.11%。能够阻断脂质过氧化物链式反应的发生,降低丙二醛的含量,且mPEG修饰后的GPx1降低脂质过氧化物能力HEK293T 细胞中更强。
实施例16 GPx1和mPEG-GPx1通过阻断H9c2细胞脂质过氧化物链式反应的发生预防和治疗H2O2引起的氧化应激损伤
H9c2细胞以1×105个/孔接种于含10%胎牛血清的高糖DMEM培养液的96 孔板中,置于37℃、5%CO2饱和湿度培养箱中培养,待细胞生长至80%密度时,分为4组,即正常对照组,模型组,预防组及治疗组。正常组加入与模型组等量培养基;模型组分别加入终浓度400μmol/L H2O2;预防组中,分别加入终浓度2 mmol/L阳性对照药N-乙酰半胱氨酸、终浓度0.08U/mL的GPx1及mPEG-GPx1,作用1小时后加入终浓度400μmol/L H2O2作用12小时;治疗组中,分别加入终浓度400μmol/L H2O2作用6小时,随后在细胞中分别加入终浓度0.08U/mL的 GPx1及mPEG-GPx1作用6小时。通过南京建成丙二醛试剂盒(A003-1),按照说明书所述步骤对损伤细胞中的丙二醛指标进行评价。
如图21所示,在400μmol/L H2O2诱导H9c2细胞建立氧化应激模型中,模型组细胞内丙二醛含量为8.313±0.13nmol/mg,含2mM/L阳性药N-乙酰半胱氨酸预防组细胞内丙二醛含量为2.67±0.01nmol/mg、治疗组3.25±0.03nmol/mg,相较于模型组细胞丙二醛含量分别降低67.88±0.12%,60.95±0.37%;含0.08U/mL mPEG-GPx1预防组细胞内丙二醛含量为1.67±0.02nmol/mg、治疗组2.73±0.24 nmol/mg,相较于模型组细胞丙二醛含量分别降低79.91±0.21%,67.12±2.85%;含0.08U/mL GPx1预防组细胞内丙二醛含量为2.03±0.05nmol/mg、治疗组 3.03±0.03nmol/mg,相较于模型组细胞丙二醛含量分别降低75.62±0.54%, 63.59±0.37%。能够阻断脂质过氧化物链式反应的发生,降低丙二醛的含量,且mPEG修饰后的GPx1降低脂质过氧化物能力H9c2细胞中更强。
- 还没有人留言评论。精彩留言会获得点赞!