一种提高白藜芦醇累积量的生物方法与流程
本发明属于生物工程技术领域,具体地说,是关于一株白藜芦醇合成酶系与延胡索酸基因b缺陷型菌株高产白藜芦醇的方法。
背景技术:
白藜芦醇(resveratrol,res)是一类含有芪类结构的多酚类化合物,又被称为芪三酚,其化学分子式为c14h12o3,无色针状结晶,易溶于乙醚、甲醇、乙醇等有机溶剂中,于1940年首次从毛叶藜芦的根部提取得到。在于很多自然界的植物中,如葡萄、虎杖、花生、桑植等植物当中都存在白藜芦醇,是植物为了保护自身防止被病菌侵害而产生的抗毒物质。白藜芦醇具有预防和治疗动脉粥样硬化,降低血小板聚集,抗病毒等多种生理活性,已被美国,加拿大等国家列为保健品,在中国,白藜芦醇提取物被制成了具有调血脂、抗肿瘤作用的胶囊。
目前白藜芦醇的生产方法主要有溶剂提取法、酶法提取、超临界co2萃取、微波萃取、生物发酵法提取等,作为一种近年来出现的方法,生物发酵法具有低耗能,低成本,生产速率快,反应条件温和等优势,而逐渐成为了生产白藜芦醇的主要趋势,但由于白藜芦醇合成酶的酶活较低,生物合成过程中辅因子的缺乏,成为了白藜芦醇高产的限制因素。
近来分子生物学的发展也为研究者从分子水平探究、提高白藜芦醇产量提供了新思路,白藜芦醇合成有三个关键酶基因,分别是酪氨酸裂解酶(tal)、香豆酰连接酶(4cl)和白藜芦醇合成酶(sts),三种基因以酪氨酸为底物合成白藜芦醇。丙二酰coa是白藜芦醇生物合成的主要底物之一,但是由于丙二酰coa在生物体内合成效率不高成为了提高白藜芦醇产量的主要限制因素,因此通过分子生物学方法通过向细胞内导入表达丙二酰coa合成酶的质粒,从而使胞内白藜芦醇产量得以提高,其次可以通过增加atp的合成,使白藜芦醇合成中的关键酶基因4cl的底物转化效率得到提高。
技术实现要素:
本发明的目的在于,提供了白藜芦醇合成通路上的三个关键酶基因及构建重组质粒的方法。
本发明还有一个目的在于,提供一种乙酰coa脱羧酶(accbc)及构建重组质粒的方法,其能促进丙二酰coa合成。
本发明还有一个目的在于,提供一种亚磷酸盐脱氢酶基因(ptdh)及构建重组质粒的方法,其能间接促进atp合成。
本发明还有一个目的在于,提供一种白藜芦醇合成酶系和accbc、ptdh组合生产白藜芦醇的菌株。
本发明还有一个目的在于,提供一种敲除延胡索酸酶基因(fumb)的方法,用以抑制丙二酰coa在旁路途径中被消耗。
本发明提供的白藜芦醇合成酶系重组质粒包括rgtal,pc4cl和ahsts基因序列和一个合适的载体片段;
根据本发明的一个优选实例,在白藜芦醇三种基因构成的重组质粒中,rgtal,pc4cl和ahsts编码区置于t7启动子之后。
根据本发明的另一个优选实施例,所述白藜芦醇三种基因构成的重组质粒具有壮观霉素抗性基因,用以筛选基因重组菌。
根据本发明的一个优选实例,所述accbc和ptdh构建在同一蛋白表达质粒中,accbc及ptdh编码区置于t7启动子之后。
根据本发明的一个优选实例,所述accbc和ptdh基因构成的重组质粒具有氯霉素抗性基因,用以筛选基因重组菌。
本发明提供的白藜芦醇合成酶系构成的重组质粒的构建方法包括以下步骤:
a)pcr扩增获得rgtal,pc4cl和ahsts序列;
b)利用overlappcr将pc4cl和ahsts序列连接在一起;
c)将rgtal片段克隆到pcdf-duet的第一个多克隆位点,将pc4cl和ahsts克隆到pcdf-duet的第二个多克隆位点。
本发明提供的accbc和ptdh构成的重组质粒的构建方法包括以下步骤:
a)pcr扩增获得accbc、ptdh序列;
b)将accbc片段克隆到pacyc-duet的第一个多克隆位点,将ptdh克隆到pacyc-duet的第二个多克隆位点。
本发明提供的fumb基因缺陷型菌株的敲除方法包括以下步骤:
a)利用pcr技术从pkd4质粒中扩增获得卡那霉素(kana)序列;
b)将kana基因电转入大肠杆菌bl21(de3)中,用以置换fumb基因;
c)消除kana基因以实现fumb基因的敲除;
本发明提供的白藜芦醇合成酶系重组质粒与accbc、ptdh基因构成的重组质粒可用于构建表达白藜芦醇合成酶系与丙二酰coa合成酶的基因缺陷型菌株。
本发明提供的累积白藜芦醇的方法通过发酵培养本发明提供的表达白藜芦醇合成酶系与表达丙二酰coa合成酶的fumb基因缺陷型菌株,累积白藜芦醇。
根据本发明的另一个优选实施例,通过对所发明的表达白藜芦醇的基因缺陷型菌株进行发酵,对发酵的温度、诱导剂iptg的浓度、诱导剂iptg的添加时间、酪氨酸添加时间、反应时间进行摸索,获得最优的发酵条件。
使用本发明提供的合成白藜芦醇的基因缺陷型菌株,可以显著地提高白藜芦醇生产量,由原始菌株的3.95mg/l提高到优化后的22.62mg/l,为进一步研究白藜芦醇产量建立一种方法,为其产业化生产奠定一种基础。
附图说明
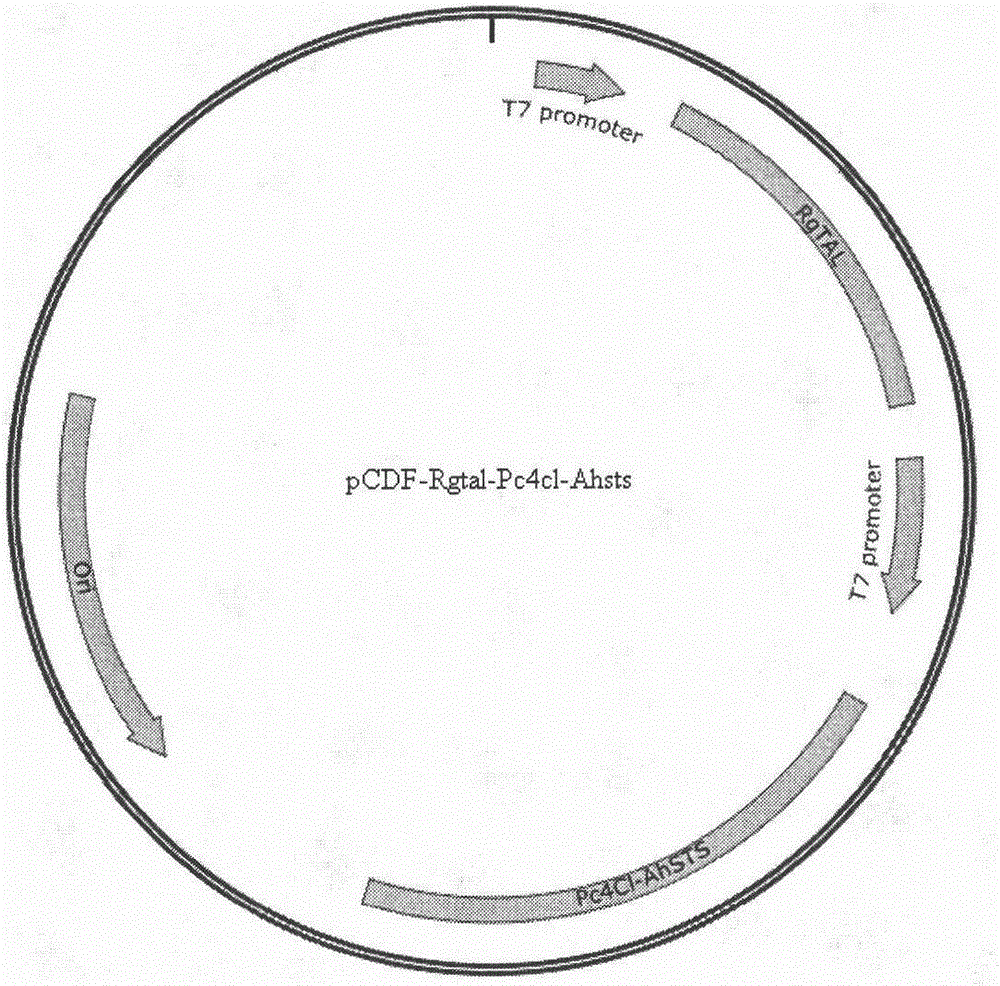
图1是pcdf-rgtal-pc4cl-ahsts的质粒图谱示意图,rgtal,pc4cl和ahsts均位于t7强启动子之后。
图2是pacyc-accbc-ptdh质粒图谱示意图,accbc、ptdh位于t7强启动子下。
图3是pcr扩增获rgtal的检测结果,其中泳道1为rgtalpcr扩增产物,m是蛋白标准分子量。
图4是overlappcr扩增获pc4c1-ahsts的检测结果,其中泳道1为获pc4c1-ahsts扩增产物,m是蛋白标准分子量。
图5是pcr扩增获accbc的检测结果,其中泳道1为accbcpcr扩增产物,m是蛋白标准分子量。
图6是pcr扩增获ptdh的检测结果,其中泳道1为ptdhpcr扩增产物,m是蛋白标准分子量。
图7是的fumb基因敲除pcr鉴定结果,其中泳道1为δfumb的pcr扩增产物,泳道2为fumb的pcr扩增产物,m是蛋白标准分子量。
图8是pcdf-δfumb-res蛋白表达的sds-page结果,其中1泳道为pcdf-δfumb-res纯化后的蛋白,2泳道为未加诱导剂的阴性对照,3泳道为pcdf-δfumb-res超声后的粗蛋白,m是蛋白标准分子量。
图9是白藜芦醇液相结果图,a是白藜芦醇的阳性对照,b为工程菌表达白藜芦醇的结果。
图10是pcdf-δfumb-res,pcdf-res,pcdf-fumb-res工程菌不同诱导条件下白藜芦醇产量结果。
图11是pcdf-δfumb-res菌株在不同碳源下白藜芦醇产量结果。
图12是pcdf-δfumb-res菌株在不同氮源下白藜芦醇产量结果。
图13是pcdf-δfumb-res菌株在不同微量离子下白藜芦醇产量结果。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
以下实施例中为注明具体条件的实验方法,通常按照常规条件,如《分子克隆:实验室手册》(newyork:coldspringharborlaboratorypress,1989)中所述的条件或厂商提供的方案进行。
在本发明的下述实施例中,使用的胶回收试剂盒、质粒提取试剂盒、均购自生工生物公司。
在本发明的下述实施例中,使用的clonexpressii和turbo保真酶来自南京诺唯赞生物科技有限公司,使用的ncoi、bamhi、ndei、kpni和ecorv均购自takara公司。
在本发明的下述实施例中,使用的表达载体pcdfduet-1、pacycduet-1,菌种e.colibl21(de3)、e.colidh5α,为中国药科大学生命中心实验室保存,其中菌种e.colibl21(de3)的atcc编号为baa-1025tm。
在本发明的下述实施例中,使用的e.colibl21(de3)感受态细胞、e.colidh5α感受态细胞,按照invitrogen公司pichiaexpressionkit手册中提供的方法进行。
在本发明的下述实施例中,使用的lb培养基的配方为:1%胰蛋白栋,0.5%酵母浸粉,1%nacl;使用的摇瓶发酵培养基的配方为:1%胰蛋白栋,0.5%酵母浸粉,1%nacl。配置固体lb平板培养基时,按照上述配方添加2%琼脂粉。
在本发明的下述实施例中,感受态细胞的制备和转化,按照《分子克隆:实验室手册》提供的方法进行。
实施例1两个表达质粒的构建
1.1引物设计
根据ncbi报道的rgtal、pc4cl和ahsts序列,设计以下6对引物:
rgtal-f:5′cccatgggcatggcgcctcgcccgacttcg3′
rgtal-r:5′cgcggatcctgtgccagcatcttcagcagaac3′
4cl-sts-1f:5′catatgggcgattgcgtggcc3′
4cl-sts-1r:5′gccagcggcgatctgccgaaaggaagcggaatggttagcgtgagtggtatc3′
4cl-sts-2f:5′gataccactcacgctaaccattccgcttcctttcggcagatcgccgctggc3′
4cl-sts-2r:5′ctcgagttaaatggccatgctac3′
4cl-sts-1nf:5′gtataagaaggagatatacatatgggcgattgcgtggcc3′
4cl-sts-2nr:5′cggtttctttaccagactcgagttaaatggccatgctacgc3′
accbc-f:5′ataaggagatataccatgggcgtgtcagtcgagactaggaag3′
accbc-r:5′gccgagctcgaattcggatcctgcttgatctcgaggagaac3′
ptdh-f:5′gcagatctcaattggatatcgatgctgccgaaactggtcatc3′
ptdh-r:5′ctttaccagactcgagggtaccgtccgcggctgggttcgctttc3′
其中rgtal-f和rgtal-r用于扩增rgtal编码区;4cl-sts-1f、4cl-sts-1r、4cl-sts-2f和4cl-sts-2r用于将pc4cl和ahsts连接;accbc-f和accbc-r用于扩增accbc编码区;ptdh-f和ptdh-r用于扩增ptdh编码区;4cl-sts-1r,4cl-sts-2f引物对的下划线表示gsglinker,其余下划线对应各自的限制性酶切位点。
1.2pcr扩增rgtal,accbc序列
以pmd-19t-rgtal,pmd-19t-accbc,pmd-19t-ptdh为模板,以1.1中设计的rgtal-f和rgtal-r,accbc-f和accbc-r,ptdh-f和ptdh-r为引物对,进行pcr扩增,具体如下:
扩增的反应体系为:turbo保真酶50μl,pmd-19t-rgtal2μl,上下游引物(10μm)各4μl,加入去离子水40μl,至体系总体积为100μl。
扩增反应条件均为:95℃4min;95℃30s,55℃30s,72℃1min,34个循环;72℃10min;4°∞,30个循环
pcr扩增产物分别进行凝胶电泳检测,检测结果如图3,图5,图6所示。获得的rgtal、accbc和ptdh产物的大小分别为2082bp、1776bp、1011bp符合rgtal、accbc、ptdh产物的预期大小。
1.3overlappcr扩增pc4cl-ahsts
以pmd-19t-pc4cl,pmd-19t-ahsts为模板,以1.1中设计的4cl-sts-1f,4cl-sts-1r和4cl-sts-2f,4cl-sts-2r为引物对,分别对pc4cl和ahsts进行pcr扩增,扩增的反应体系和1.2一致。
扩增反应条件均为:95℃4min;95℃30s,55℃30s,72℃1min,34个循环;72℃10min;4°∞,9个循环。
对扩增的产物进行胶回收,随后以胶回收的pc4cl,ahsts为模板,以4cl-sts-1和4cl-sts-2r为引物,进行overlappcr将pc4cl和ahsts连接在一起。反应体系和反应条件与1.2一致。对pcr扩增产物进行凝胶电泳检测,检测结果如图4所示。获得的产物的大小分别为2082bp,符合pc4cl-ahsts产物的预期大小。
1.4表达载体的构建
1.4.1pcdfduet-rgtal和pacycduet-accbc构建
将1.2,1.3中pcr产物rgtal,accbc凝胶回收纯化,分别与ncoi/bamhi双酶切的表达载体pcdfduet和ncoi/bamhi双酶切的表达载体pacycduet连接,将连接产物分别转化入宿主菌e.colide3,并涂布含有千分之一壮观霉素或氯霉素的固体lb平板上,37℃培养至大肠杆菌转化子长出。其中e.colide3是壮观霉素和氯霉素的菌株,不能在含有壮观霉素或氯霉素的固体lb平板上生长,因此,平板上长出的转化子均为转化了pcdfduet-rgtal或pacycduet-accbc质粒的大肠杆菌。挑取转化子鉴定,根据鉴定结果,最终获得两个质粒pcdfduet-rgtal和pacycduet-accbc。
1.4.2pcdfduet-rgtal-pc4cl-ahsts及pacycduet-accbc-ptdh构建
与1.4.1步骤相似,通过ndei/kpni和ecorv/kpni分别对构建好的质粒pcdfduet-rgtal和pacycduet-accbc-ptdh的第二个多克隆位点进行酶切,将rgtal-pc4cl和ptdh连入各自的载体中,经过验证后,获得质粒pcdfduet-rgtal-pc4cl-ahsts和pacycduet-accbc-ptdh。
实施例2fumb基因敲除菌株的构建
2.1引物设计
敲除fumb基因共需4条引物,用于同源重组的引物s1、s2及用于鉴定缺陷株的引物s3、s4。
s1:5’atgtcaaacaaaccctttatctaccaggcacctttcccgaagcgattgtgtaggctggag
s2:5’ttacttagtgcagttcgcgcactgtttgttgacgatttgcacggctgacatgggaattag
s3:5’cctgcgctattcacagaatg
s4:5’attgcagcagatccacgtag
2.2基因缺陷株δfumb的构建
同源重组辅助质粒pkd46转入宿主菌e.colibl21(de3),l-阿拉伯糖诱导后制备电转化感受态细胞。
以含卡那霉素抗性基因kana的质粒pkd4为模板,s1、s2为引物进行pcr扩增反应。于冰上将2μl抗性片段pkd4-kana加入电转化感受态细胞,混匀后置于1mm电击杯中进行电击转化。电击参数为:2.5kv,脉冲3ms。电击完成后立即加入无抗性lb液体培养基,于37℃培养3h,使接入抗性片段的细胞充分复苏。然后取菌液涂布至含kana的lb平板,筛选出含抗性基因的缺陷株阳性克隆。将阳性单克隆分别接入含kana及amp的培养基中,42℃培养4-5h,筛选出在kana中正常生长,在amp中不能生长的菌种,即为重组成功的菌株δfumb-kana。
将编码flp重组酶的质粒pcp20化学转化到菌株δfumb-kana中,30℃培养后涂布氨苄抗性平板并筛选出转化子,然后转接到不含抗生素的lb液体培养基中42℃过夜培养。在消除kana的同时,对温度敏感的质粒pkd46、pcp20在高温下会逐渐丢失。消除质粒的菌株为基因缺陷株阳性克隆。
将阳性单克隆分别接入含kana及amp的培养基中,42℃培养4-5h,筛选出在kana和amp中都不能生长的菌种,该菌种即为完成敲除目的基因的菌种。为进一步查看抗性基因kana的去除情况,以阳性单克隆为模板,s3、s4为引物进行pcr扩增鉴定,凝胶电泳检测结果如图7所示,pcr产物长度为0bp,对照野生株pcr产物为929bp,二者差异显著,证明基因缺陷株δfumb构建成功。
实施例3表达质粒转化合成白藜芦醇菌株
将δfumb基因缺陷株按照大肠杆菌感受态制作标准流程制作成为δfumb基因缺陷的大肠杆菌感受态,将构建成功的pcdfduet-rgtal-pc4cl-ahsts和pacycduet-accbc-pdth重组质粒转化到基因缺陷株δfumb,并涂布含有千分之一的壮观霉素和氯霉素的固体lb平板,37℃培养至转化子长出。其中基因缺陷株δfumb是无壮观霉素和氯霉素抗性菌株,不能在含有壮观霉素和氯霉素的固体lb平板上生长,因此,利用两种抗生素筛选获得了含有pcdfduet-rgtal-pc4cl-ahsts和pacycduet-accbc-ptdh重组质粒的基因缺陷菌株。命名为pcdf-δfumb-res
同时,将质粒pcdfduet-rgtal-pc4cl-ahsts转化宿主菌e.colibl21(de3),将pcdfduet-rgtal-pc4cl-ahsts和pacycduet-accbc-ptdh转化到宿主菌e.colibl21(de3),分别涂布含有千分之一体积的壮观霉素,壮观霉素和氯霉素的固体lb平板,37℃培养至转化子长出。其中e.colibl21(de3)不是壮观霉素和氯霉素抗性菌株,不能在含有壮观霉素和氯霉素的固体lb平板上生长,因此,含有壮观霉素平板上长出的转化子为成功转化pcdfduet-rgtal-pc4cl-ahsts质粒的菌株,命名为pcdf-res;在壮观霉素和氯霉素的固体lb平板上长出来的菌为成功转化了pcdfduet-rgtal-pc4cl-ahsts和pacycduet-accbc-ptdh两种质粒的菌株,命名为pcdf-fumb-res。对都建构好菌株进行测序验证,测序正确的菌株加体积比1∶1的40%甘油冻于-80℃,并用做后续白藜芦醇合成。
实施例4pcdf-δfumb-res,pcdf-res,pcdf-fumb-res摇瓶发酵白藜芦醇
将pcdf-δfumb-res,pcdf-res,pcdf-fumb-res三种甘油菌按照1%的接种量接种于lb液体培养基中,加入千分之一的抗生素。摇瓶培养过夜。
分别取1%体积的菌液转接入lb培养基中,,采用正交试验l16(45)对温度(℃)、iptg添加量(mm)、iptg添加时间(h)、酪氨酸添加时间(h)和反应时间(h)进行优化,试验设计如下表1。结果表明三种菌株中,在以4mm的酪氨酸为底物时,pcdf-δfumb-res的白藜芦醇平均产量最高,最高可达17.81mg/l。
表1诱导表达条件优化正交试验因素水平
实施例5安捷伦1200检测白藜芦醇
取发酵结束后的发酵菌液1ml于1.5mlep管中,12000rpm离心2min,取500μl上清液过0.22μl滤膜,滤过液做hplc分析,液相柱温30℃,流速1ml/min,流动相条件如表2:
表2安捷伦1200流动相条件
实施例6pcdf-δfumb-res培养条件优化
将同等诱导条件下白藜芦醇产量最高的菌株pcdf-δfumb-res为对象,研究其在加入不同种类的碳源,氮源及微量元素,并按一定比例配制成不同浓度lb液体培养基中的产量变化。具体优化方法见表3
表3lb培养基添加组分的种类与浓度
采用上述方法,进行平行实验,并分别取样检测发酵产物中的白藜芦醇累积量,其中pcdf-δfumb-res产生的自藜芦醇量高于pcdf-res,pcdf-fumb-res。对不同碳源,氮源及微量元素进行优化,所得结果如图11,图12,图13所示,优化碳源后,白藜芦醇最高产量可达22.62mg/l;优化氮源后,白藜芦醇最高产量可达19.00mg/l;优化微量元素后,白藜芦醇的最高产量可达21.42mg/l。
- 还没有人留言评论。精彩留言会获得点赞!