一株不产酪胺或组胺的植物乳杆菌及其应用的制作方法
本发明涉及一株分离自蒙古国风干肉的植物乳杆菌(lactobacillusplantarum)37x-6,还涉及所述植物乳杆菌在制备发酵剂或制备发酵食品中的应用。
背景技术:
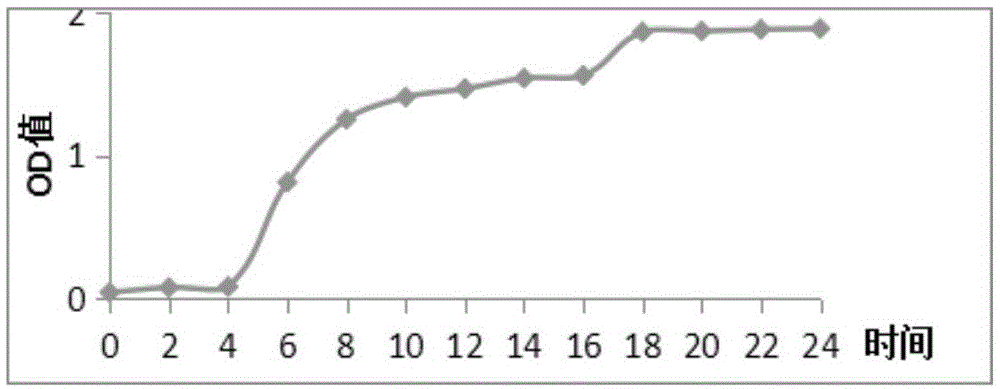
:生物胺是由氨基酸脱羧或醛和酮氨基化形成的小分子量含氮化合物。根据化学结构可将生物胺分为:脂肪族(尸胺、腐胺、精胺和亚精胺等),芳香族(酪胺和苯乙胺等),杂环族(组胺和色胺等)。生物胺在机体内主要的合成途径是氨基酸的脱羧反应,也有部分生物胺是通过醛的胺化作用形成的。适量的生物胺有利于人体的健康,但是过量的生物胺会使人体中毒,导致严重的后果,会引起头疼、血压变化、呼吸紊乱、心悸、呕吐等严重反应。组胺是生物胺中毒性最大的,过量的组胺会导致头疼、消化障碍及血压异常,甚至会引起神经性毒性。酪胺的毒性次之,过量也会引起头痛和高血压等反应。尸胺和腐胺的自身毒性较小,但是能抑制组胺和酪胺相关代谢酶的活性,而增加组胺和酪胺的数量。另外,腐胺、尸胺、精胺和亚精胺能够与亚硝酸盐反应产生致癌物质亚硝胺。精胺、亚精胺与亚硝酸盐生成亚硝基吡咯烷,尸胺、哌啶与亚硝酸盐形成亚硝基哌啶,精胺、腐胺与亚硝酸盐能生成二甲基亚硝胺。胺盐和亚硝酸盐是亚硝胺形成的两个必要前体物。亚硝酸盐与胺类物质的含量越高,一般合成亚硝胺的反应速度越快。我国传统发酵食品中存在的多胺、杂环胺与传统原料、生产工艺以及微生物生理特性密切相关。越来越多的研究表明,酿酒酵母和乳酸菌在很多传统发酵食品生产过程中积累有害的氨(胺)类物质。在发酵肉制品中,由于微生物脱羧酶的作用,能将游离氨基酸经脱羧作用形成相应的生物胺。发酵香肠中肠杆菌具有较高的脱羧酶活性,肠杆菌中的阴沟肠杆菌和沙门氏菌具有极强的产生尸胺和腐胺的能力。发酵肉制品中的胺类物质是由微生物产生的蛋白酶作用于蛋白质形成游离的氨基酸,而后经过某些微生物分泌的氨基酸脱羧酶对氨基酸脱羧而形成,具有氨基酸脱羧酶活性的微生物对生物胺的形成具有重要作用。张志伟等研究了生物胺生成量的菌株效应,结果表明乳杆菌(lactobacillus)和片球菌(staphylococcusaureus)均能产生不等量的组胺、尸胺、腐胺、酪胺、亚精胺和精胺,但都不产生色胺。lorenzo等对79株肠细菌进行了产生物胺能力的调查,结果发现75株都有鸟氨酸脱羧和赖氨酸脱羧能力,并且发现肠杆菌具有产尸胺和腐胺的能力。montel等肉葡萄球菌(staphylococcuscarnosus)有高氨基酸脱羧酶活性,并且能够产生尸胺、苯乙胺、腐胺和组胺。李蕊婷等从新疆熏马肠分离产胺优势菌株,发现木糖葡萄球菌(staphylococcusxylosus)产苯乙胺量最高为3831.50μg/ml。ganna等发现酵母具有产生物胺的能力。caruso等发现酿酒酵母(saccharomycescerevisiae)具有产色胺、苯乙胺、腐胺和组胺能力。consuelo研究了发酵剂和糖类对西班牙干香肠的影响,结果表明,腐胺和酪胺是发酵香肠主要产生的生物胺,一株能在发酵过程中迅速降低ph值的沙克乳杆菌(lactobacillussakei)k29能降低生物胺含量。目前实验证明肠菌属和梭菌属细菌具有合成亚硝胺的能力,有一些细菌能影响亚硝胺的形成。细菌能够影响硝酸盐转变为亚硝酸盐,以及蛋白质降解为胺和氨基酸的程度,通过生成酶清除亚硝基,为亚硝基化作用形成适宜的ph。目前发酵剂广泛应用于发酵香肠,发酵香肠中生物胺含量与发酵剂密切相关,接种不产生物胺的优良发酵剂也是消除微生物对亚硝胺形成的途径之一。传统发酵食品多以自然发酵为主,微生物区系较复杂,菌群结构比较复杂,参与发酵的微生物主要来源于原料本身和周边环境,导致发酵过程中优势菌群不确定。如果有害细菌在发酵过程中形成优势菌群,将导致产品的质量无法控制,甚至引起安全隐患,有害胺(氨)类物质的潜在危险(如生物胺、亚硝胺、细菌毒素)。有关这些微生物产胺(氨)的机理研究尚未明确,另外如何阻止微生物产有害胺(氨)类物质的研究有待完善,目前只有通过改变加工贮藏条件和卫生条件来减少有害胺(氨)类物质的含量,因为胺(氨)类物质的产生情况复杂多变,易受环境影响,个体差异极其明显。所以如何从根本上消除传统发酵食品中有害氨(胺)类危害物及其形成、积累尚需大量深入的研究。技术实现要素:本发明的目的克服现有技术缺陷,提供一株不产酪胺或组胺的植物乳杆菌。本发明的另一目的是提供上述不产酪胺或组胺的植物乳杆菌的应用。为了实现上述目的,本发明提供一株植物乳杆菌(l.plantarum)37x-6,该菌株于2018年8月1日保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心保藏,保藏号为cgmccno.16189。本发明还提供上述植物乳杆菌(lactobacillusplantarum)37x-6在制备发酵剂中的应用。本发明还提供上述植物乳杆菌(lactobacillusplantarum)37x-6在制备发酵香肠中的应用。特别地,本发明还提供上述植物乳杆菌(lactobacillusplantarum)37x-6在抑制发酵食品的酪胺浓度中的应用。本发明还提供一种发酵剂,所述发酵剂含有根据权利要求1所述的植物乳杆菌(lactobacillusplantarum)37x-6。本发明的植物乳杆菌37x-6通过如下方法分离得到:(1)菌种的分离称取蒙古国风干牛肉,剪碎,放入装有225ml无菌生理盐水的三角瓶中,充分混合均匀得到样品液,将样品液分别稀释为10-1、10-2、10-3、10-4、10-5,分别吸取各浓度稀释液1ml注入含有20mlmrs固体培养基中,涂布,然后在30℃环境中培养72h;从每个培养基中随机选取有溶钙圈且符合乳酸菌菌落形态特征的菌落于mrs液体培养基中,在30℃环境下培养48h,所得培养物分离到的菌株在mrs固体培养基上反复的进行划线,直到得到多株纯菌落;所得纯菌株分别进行革兰氏染色及过氧化酶实验,得到株革兰氏阳性、且过氧化氢酶阴性的待试菌株;(2)菌种的筛选待试菌株分别在mrs液体培养基中活化3代得到待测培养物,进行以下筛选实验:(2.1)菌株产酸能力的测定以重量计取2%待试培养物接种于5mlmrs液体培养基,在有氧环境中30℃培养24h,测定培养物的ph值;(2.2)耐nacl的测定以重量计取2%待试培养物接种于添加了6wt%nacl的mrs液体培养基,在有氧环境中30℃培养24h,以空白mrs液体培养基作对照,然后在600nm波长下用722分光光度计测定培养液od值,比较各菌株在不同盐浓度下的生长情况;(2.3)耐亚硝酸盐的测定以重量计取2%待试培养物接种于添加了150mg/lnano2的mrs液体培养基,在有氧环境中30℃培养24h,以空白mrs液体培养基作对照,在600nm条件下用722分光光度计测定od值,比较各菌株对亚硝酸盐的耐受能力;(2.4)葡萄糖产气实验以重量计取2%待试培养物接种于添加了以重量计1%d-葡萄糖及0.5%乙酸钠的mrs液体培养基,加入无菌小导管,在有氧环境中30℃培养24h,观察培养基的颜色是否从紫色变为黄色,同时观察小导管中是否有气泡产生;(2.5)产粘液实验以重量计取2%待试培养物划线接种于mrs固体培养基,在有氧环境中30℃培养24h,用接种环挑取菌落直接观察;(2.6)产生h2s实验以重量计取2%待试培养物接种于培养基后,用无菌镊子夹一无菌乙酸铅滤纸条悬挂于试管内,接近培养基表面而不接触,上端棉塞塞紧,置于30℃培养,观察乙酸铅滤纸条的颜色变化;(2.7)精氨酸产氨实验以重量计取2%待试培养物接种于试管中,在30℃环境下培养,在1、3、5天观察,在培养液中加1-2滴奈氏试剂,观察培养液颜色的变化;(2.8)产生物胺实验取0.1ml待试培养物涂布于固体产生物胺培养基上,分别加入以总重量计1%过滤除菌的赖氨酸、酪氨酸、精氨酸或组氨酸,未加氨基酸的一份作空白对照,37℃培养48h,取出,倒入上层显色培养基,观察颜色变化;经过以上筛选,获得一株革兰氏染色阳性、过氧化氢酶实验阴性、耐nacl、耐亚硝酸盐、不产气、不产粘液、不产h2s、精氨酸产氨实验不产nh3且不产生物胺菌株,经验证为植物乳杆菌(lactobacillusplantarum),命名为植物乳杆菌(lactobacillusplantarum)37x-6。进一步地,本发明通过微生物法、pcr和hplc法,确认植物乳杆菌(lactobacillusplantarum)37x-6的代谢产物中不含酪胺或组胺。进一步地,以含有植物乳杆菌(lactobacillusplantarum)37x-6的发酵剂制备发酵香肠,测定香肠样品的ph值、水分活度、色差以及生物胺含量。其中,实验证实发酵香肠在腌制结束时(0d),植物乳杆菌37x-6组无组胺检出,在腌制结束(0d)和发酵结束(3d)时均无酪胺检出,尽管在干燥阶段(6d)产品中存在少量酪胺,但显著低于对照组,表明发酵剂中的植物乳杆菌37x-6对酪胺形成有抑制作用。综上所述,本发明提供了一株不产生物胺、特别是酪胺和组胺的植物乳杆菌37x-6,该菌可应用于食品发酵剂,特别是香肠发酵剂,所得发酵香肠在腌制或发酵过程中不产生生物胺,且香肠成熟后,其酪胺浓度显著低于现有技术,即植物乳杆菌37x-6是理想的发酵香肠的发酵剂。本发明筛选获得的植物乳杆菌(lactobacillusplantarum)37x-6于2018年8月1日保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心保藏,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏号为cgmccno.16189。附图说明图1:菌株37x-6生长24hod值变化情况;图2:菌株37x-6生长24hph值变化情况;图3:微生物学法检测菌株37x-6产酪胺的结果;图4:菌株37x-6的系统发育树;图5:退火温度对组氨酸脱羧酶引物的影响;图6:退火温度对酪氨酸脱羧酶引物的影响;图7:组氨酸脱羧酶基因pcr扩增结果;图8:酪氨酸脱羧酶基因pcr扩增结果;图9:组胺含量标准曲线;图10:酪胺含量标准曲线。【具体实施方式】下面结合附图和实施例对本发明作进一步说明,以下实施例仅为说明性的,本发明并不受这些实例的限制。在本发明中,如无特殊说明,表明浓度的“%”均为重量百分比,“:”均为重量比,“份”均为重量份。本发明涉及以下培养基:mrs固体培养基:大豆蛋白胨10g、牛肉膏5g、酵母粉4g、葡萄糖20g、吐温801ml、磷酸二氢钠2g、无水乙酸钠5g、柠檬酸三胺2g、硫酸锰0.02g、硫酸镁0.1g,蒸馏水1l,调节ph至6.2左右,琼脂15g,121℃、15min灭菌;mrs液体培养基:大豆蛋白胨10g、牛肉膏5g、酵母粉4g、葡萄糖20g、吐温801ml、磷酸二氢钠2g、无水乙酸钠5g、柠檬酸三胺2g、硫酸锰0.02g、硫酸镁0.1g,蒸馏水1l,调节ph至6.2左右,121℃、15min灭菌;产生物胺培养基:分为底层显色培养基和上层培养基;底层显色培养基:酵母膏0.5%,牛肉膏0.5%,胰化蛋白胨0.5%,nacl0.25%,葡萄糖0.05%,吐温-800.1%,mgso4·7h2o0.02%,mnso4·4h2o0.005%,feso40.04%,柠檬酸三铵0.2%,caco30.01%,vb60.005%,k2hpo40.2%,琼脂2.0%,ph值5.5,121℃灭菌15min;上层培养基:溴甲酚紫0.006%,琼脂2.0%,ph值5.5,121℃灭菌15min。实施例1菌株的分离与筛选(1)菌种的分离称取25g蒙古国风干牛肉,剪碎,放入装有225ml无菌生理盐水的三角瓶中,充分混合均匀得到样品液,将样品液分别稀释为10-1、10-2、10-3、10-4、10-5,分别吸取各浓度稀释液1ml注入含有20mlmrs固体培养基中,涂布,然后在30℃环境中培养72h。从每个培养基中随机选取有溶钙圈且符合乳酸菌菌落形态特征的菌落(菌落数量为15-150个),并从中挑取菌落于mrs液体培养基中,在30℃环境下培养48h。所得培养物分离到的菌株在mrs固体培养基上反复的进行划线,直到得到31株纯菌落。所得纯菌株分别进行革兰氏染色及过氧化酶实验,得到23株革兰氏阳性、且过氧化氢酶阴性的待试菌株,且这些菌株均不形成芽孢,初步判断为乳酸菌。所得菌株在其培养液中加入甘油,使甘油的最终浓度为30%(v/v),贮藏于-80℃待用。其中,革兰氏染色实验是本领域常规实验操作,步骤包括:(1)涂片固定;(2)草酸铵结晶紫染1分钟;(3)自来水冲洗涂片;(4)加碘液覆盖涂面染约1分钟;(5)蒸馏水冲洗涂片,用吸水纸吸去水分;(6)滴加95vol%酒精,并轻轻摇动进行脱色,20秒后水洗,吸去水分;(7)蕃红染色液(稀)染1分钟后,冲洗;(8)干燥,根据镜检获得染色结果。过氧化氢酶实验是参考刘灵芝文献进行测定的(2010)。(2)菌种的筛选将上述分离到的23株待试菌顺序编号,分别在mrs液体培养基中活化3代得到待测培养物,进行以下筛选实验:(2.1)菌株产酸能力的测定以重量计取2%待试培养物接种于5mlmrs液体培养基,在有氧环境中30℃培养24h,测定培养物的ph值。结果发现23株菌在经过24h培养后,培养液ph值均低于5.0。(2.2)耐nacl的测定以重量计取2%待试培养物接种于添加了6wt%nacl的mrs液体培养基,在有氧环境中30℃培养24h,以空白mrs液体培养基作对照,然后在600nm波长下用722分光光度计测定培养液od值,比较各菌株在不同盐浓度下的生长情况。结果显示其中22株菌能够耐受6wt%nacl。(2.3)耐亚硝酸盐的测定以重量计取2%待试培养物接种于添加了150mg/lnano2的mrs液体培养基,在有氧环境中30℃培养24h,以空白mrs液体培养基作对照,在600nm条件下用722分光光度计测定od值,比较各菌株对亚硝酸盐的耐受能力。结果显示23株菌均耐受150mg/lnano2。(2.4)葡萄糖产气实验以重量计取2%待试培养物接种于添加了以重量计1%d-葡萄糖及0.5%乙酸钠的mrs液体培养基,加入无菌小导管,在有氧环境中30℃培养24h,观察培养基的颜色是否从紫色变为黄色,同时观察小导管中是否有气泡产生。结果显示23株菌中有8株的培养基均呈红色或者紫色,即为阳性,表明代谢过程中产生生物胺,另外15株的培养基呈黄色,即为阴性,表明代谢不产生生物胺。另外,无菌小导管中均没有气泡,表明所有菌株在分解葡萄糖时均不产气。(2.5)产粘液实验以重量计取2%待试培养物划线接种于mrs固体培养基(其中,以5wt%的蔗糖代替葡萄糖),在有氧环境中30℃培养24h,用接种环挑取菌落直接观察。观察发现23株菌株均不产生粘液。(2.6)产生h2s实验以重量计取2%待试培养物接种于培养基后,用无菌镊子夹一无菌乙酸铅滤纸条悬挂于试管内,接近培养基表面而不接触,上端棉塞塞紧,置于30℃培养,观察乙酸铅滤纸条的颜色变化。结果发现只有其中一株菌株对应的乙酸铅滤纸条不变色,表明没有h2s产生。(2.7)精氨酸产氨实验以重量计取2%待试培养物接种于试管中,在30℃环境下培养,在1、3、5天观察,在培养液中加1-2滴奈氏试剂,观察培养液颜色的变化。结果表明其中14株菌的培养液不变色,表明没有nh3产生。(2.8)产生物胺实验取0.1ml待试培养物涂布于固体产生物胺培养基上,分别加入以总重量计1%过滤除菌的赖氨酸、酪氨酸、精氨酸或组氨酸,未加氨基酸的一份作空白对照,37℃培养48h,取出,倒入上层显色培养基,观察颜色变化;结果表明其中15株菌的培养基不变色,表明没有生物胺产生。经过以上筛选,获得一株具备所有特性的菌株,命名为37x-6株。表1为各项筛选的结果汇总。表1分离自蒙古国风干牛肉中乳酸菌的筛选结果实施例2菌株37x-6生长性能的测定(1)菌株37x-6对不同浓度氯化钠的耐受能力以实施例1步骤(2.2)的方法测定菌株37x-6对氯化钠的耐受能力,区别在于mrs液体培养基中分别添加以总重量计3%、6%、7.5%、9%和12%的nacl,不含nacl的mrs液体培养基作为对照,分别在有氧环境中30℃培养24h,然后在600nm波长下用722分光光度计测定培养液od值,比较各菌株在不同盐浓度下的生长情况,如表2所示。表2菌株37x-3对不同浓度氯化钠的耐受能力浓度菌株37x-6浓度菌株37x-60%2.0833±0.0038a7.5%1.3140±0.0017d3%1.7423±0.0051b9%0.7390±0.006e6%1.5888±0.0015c12%0.1113±0.0055f所得数据均通过spss软件进行显著性分析。由表2可知,菌株37x-6随着氯化钠浓度的增加,生长能力显著下降(p<0.05)。当氯化钠浓度达到12%时,菌株37x-6的od值为0.1113,即乳酸菌几乎不能生长,由此可知,高浓度氯化钠对乳酸菌的生长有抑制作用。在含有较低浓度(3%~7.5%)氯化钠的mrs液体培养基中,菌株37x-6生长良好。(2)菌株37x-6对不同浓度亚硝酸盐的耐受能力以实施例1步骤(2.3)的方法测定菌株37x-6对亚硝酸钠的耐受能力,区别在于mrs液体培养基中分别添加以0%、0.05%、0.1%、0.5%、1%、5%的nano2,分别在有氧环境中30℃培养24h,然后在600nm波长下用722分光光度计测定培养液od值,比较各菌株在不同浓度亚硝酸盐下的生长情况,如表3所示。表3菌株37x-6对不同浓度亚硝酸盐的耐受能力所得数据均通过spss软件进行显示性分析。由表3可知,菌株37x-6对不同浓度亚硝酸盐耐受能力均很强,且高浓度(0.5%~5%)亚硝酸盐对乳酸菌生长有抑制作用。(3)菌株37x-6的生长能力测定菌株37x-6接种于mrs液体培养基,在有氧环境中30℃培养24h,每小时分别在600nm条件下用722分光光度计测定od值,比较od值与培养时间的关系,结果如图1所示。由图1可以看出,菌株37x-6在24h之间各个时间点的生长情况差异不显著,在6h-18h生长迅速,18h之后逐渐趋于平缓。(4)菌株37x-6的产酸曲线测定菌株37x-6接种于mrs液体培养基,在有氧环境中30℃培养24h,每小时分别测定培养基的ph值,结果如图2所示。由图2可以看出,37x-6在24h之间各个时间点的产酸情况差异不显著,10小时ph降到4.25,在之后的培养中ph继续下降,最后降到4.1以下。综上所述,通过对来源于蒙古国风干牛肉的待试菌株的分离筛选,筛选出一株适用于食品发酵的菌株37x-6。这株菌在发酵过程中不产生物胺,不产过氧化氢、氨、co2、h2s,不产粘液,它符合发酵香肠的菌株筛选的基本要求。进一步通过生长性能测定结果表明:这株乳酸菌对0.1%亚硝酸盐和6%氯化钠的耐受能力较强,特别地,该菌株在高浓度的亚硝酸盐中生长能力无显著性差异,且菌株24h产酸能力和生长能力均无显著性差异,初步证实了这株菌可以适应发酵香肠的环境,可以用作香肠发酵剂。实施例3菌株不产生物胺的确认(1)微生物学法检测菌株37x-6产生物胺以2%的接种量将菌株37x-6接种于mrs液体培养基中,30℃培养24h,传代3代后进行纯化,挑一环菌液划线接种于mrs固体培养基中,30℃培养24h。将纯化后的菌液稀释,取0.1ml涂布于产生物胺培养基上,37℃培养48h,取出,倒入上层显色培养基,观察颜色变化,并以空白作为对照,结果如图3所示。图3显示,图片右侧两个培养基中的微生物通过代谢产生生物胺,产生的生物胺呈碱性,使上层培养基中的指示剂显色,表现为红色或紫色。而图片左侧的两个菌株37x-6的培养基显黄色,为阴性,表明代谢产物中不含生物胺。(2)pcr法检测菌株37x-6产生物胺按照细菌基因组dna提取试剂盒(tianampbacteriadnakit),提取菌株37x-6基因组dna。以te缓冲液为空白校正仪器,取1μldna溶液进行浓度测定,单位为ng/μl。dna浓度的测定结果如下:通过测定dna浓度,各菌株dna浓度均在90-183ng/μl之间,od260/od280的比值为1.7-2.0,说明菌株dna浓度较纯,可以进行后续试验。根据hdc和tdc序列,使用vectorntiadvance10软件进行同源比对,找出保守序列,结合primerpremier5.0引物设计软件设计了引物hisdec-217-1f/hisdec-719-1r和pt3-f/pt3-r,分别用于hdc和tdc基因的检测。引物由上海生物工程公司合成。采用16srrna通用引物f27/r1492进行pcr扩增,并进行测序,利用maga5.0软件制作系统发育树,比较其同源性。25μl反应体系:pcr反应条件:通过对37x-6菌株基因组dna的提取,以细菌dna为模板对v6-v8区域进行pcr扩增,分别对v6-v8区域扩增产物进行测序,测序结果上ncbi软件上进行blast比对,37x-6与lactobacillusplantarumstrainky744456基因序列高度同源,同源性可达到99%,说明这株菌可能是植物乳杆菌,系统发育树如图4所示。考察退火温度对组氨酸脱羧酶引物的影响:以阳性对照基因组dna为模板,对组氨酸脱羧酶引物:jv17hc(5'-agaccatacaccataaccttg-3');jv16hc(5'-agatggtattgtttctttg-3')进行温度梯度优化,退火温度梯度为51℃、52℃、53℃、54℃、55℃、56℃八个,考察退火温度对组氨酸脱羧酶引物的引物,如图5所示。从图中可以看出,前四个退火温度均有两个条带出现,而后两个退火温度均有一条清晰明亮的特异性条带出现,扩增效果良好,55℃与56℃这两个退火温度对组氨酸脱羧酶引物并无显著影响,故选择55℃作为hdc引物pcr扩增的退火温度,用于检测菌株是否产组胺。图7给出了组氨酸脱羧酶基因pcr扩增结果,其中,泳道18为菌株37x-6。结果显示,以各菌株作为dna模板,进行pcr扩增,结果只有植物乳杆菌37x-6扩增不到相应的目标条带,表明产物中不含组胺。进一步,考察退火温度对酪氨酸脱羧酶引物的影响:以阳性对照基因组dna为模板,对酪氨酸脱羧酶引物:td5(5'-caaatggaagaagaagtagg-3');td2(5'-acttagtcaaccatrttgaa-3')进行温度梯度优化,退火温度梯度为46℃、48℃、52℃、54℃、56℃、58℃八个,考察退火温度对酪氨酸脱羧酶引物的影响,如图6所示。从图中可以看出,退火温度为54℃有两个条带出现,退火温度为54℃、56℃时出现一条不清晰的条带,而退火温度为56℃、58℃均有一条清晰明亮的特异性条带出现,扩增效果良好,56℃与58℃这两个退火温度对酪氨酸脱羧酶引物并无显著影响,故选择56℃作为tdc引物pcr扩增的退火温度,用于检测菌株是否产酪胺。图8给出了酪氨酸脱羧酶基因pcr扩增结果,其中,泳道18为菌株37x-6。结果显示,以各菌株作为dna模板,进行pcr扩增,只有植物乳杆菌37x-6扩增不到相应的目标条带,表明植物乳杆菌37x-6的产物中不含酪胺。(3)高效液相色谱法检测菌株37x-6产生物胺参照gb5009.208-2016食品安全国家标准进行测定:将10ml菌液3600r/min离心10min,吸取上层清液+400μl100mg/ml的内标+nacl至饱和,5mol/l的naoh调节ph到12.0,取1ml于5ml的试管中+1ml正丁醇/三氯甲烷(1+1),漩涡震荡5分钟,3600转/分离心2分钟,取出上层清液(重复2次)+1滴1mol/lhcl混合。40℃氮气吹干+1ml0.1mol/lhcl溶解。待衍生。其中,高效液相色谱条件为:梯度洗脱程序为:综上所述,通过微生物法、pcr和hplc法均确认菌株37x-6的产物中不含酪胺或组胺。实施例4菌株37x-6在制备发酵香肠中的应用(1)制备发酵剂在mrs液体培养基中活化至3代,37℃培养,将活化3代的菌液置于离心管中,4℃、4000r、离心10min,加10倍体积的生理盐水,离心,重复三次,得到菌泥备用。(2)制备发酵香肠取羊肉,去除筋腱及腱膜,然后绞碎或切丁,加入调味腌制剂和107cfu的发酵剂,搅拌均匀后在4℃腌制12h,然后灌入洁净肠衣内,排气并打结。在24℃、湿度85%环境下发酵3d,然后在14℃、湿度75%环境下干燥3天,再在14℃、湿度70%环境下成熟3d。分别在灌肠后(0天)、发酵结束(3天)、干燥结束(6天)、成熟结束(9天)时取香肠样品,测定ph值、水分活度、色差以及生物胺含量。其中,ph值的测定是称取10g去肠衣发酵香肠剁碎+90ml0.85%生理盐水,磁力搅拌器震荡10-15min,测其ph值,结果如下表:通过对发酵羊肉香肠腌制结束(0d)、发酵结束(3d)、干燥结束(6d)、成熟(9d)ph值的测定,从上表可以看出,在羊肉发酵香肠制作过程中,整体ph值呈先下降后上升的趋势。腌制结束时(0d),ph值均在5.6左右,无显著差异。发酵结束时(3d),发酵香肠的ph值均有所下降,在发酵香肠中添加乳酸菌,乳酸菌在发酵过程中会大量产生乳酸和有机酸,使酸度上升,从而ph值下降。在干燥期间(6d),ph值均有所回升;发酵香肠成熟时(9d),植物乳杆菌37x-6组稍有下降,有效抑制杂菌的生长,保证发酵香肠的安全性。因发酵香肠需要经过后熟过程才可食用,ph的回升更加适合口感,不至于酸涩。水分活度的测定方法是将发酵香肠去肠衣剁碎,铺满测量皿底部,,然后用全自动水分活度仪测定,并进行对照,结果如下表:通过对羊肉发酵香肠的水分活度的测定,在羊肉发酵香肠加工制作过程中,整体水分活度呈下降趋势。在腌制结束时(0d),水分活度在0.9左右,无显著性差异。在发酵结束时(3d),水分活度稍有降低,均在0.92左右。在干燥过程中,水分活度迅速下降,37x-6植物乳杆菌组从0.917显著降低到0.872(p<0.05),对照组下降较缓慢一些,对照组从0.919下降到0.911,在干燥期间发酵香肠的制作工艺的湿度为70%左右,导致发酵香肠水分不断扩散,水分活度迅速下降。实验组的水分活度值显著低于对照组(p<0.05),在发酵香肠成熟过程中,实验组和对照组均在0.85左右。色差的测定方法是将发酵香肠去除肠衣切碎混匀,用色差计测定:通过对羊肉发酵香肠l*亮度值、a*红度值、b*黄度值的测定,反应发酵香肠在加工过程中色差的变化。从表中可以看出,腌制结束时(0d),对照组红度值a*、黄度值b*显著低于试验组(p<0.05),对照组红度值a*为8.49显著低于试验组11.07(p<0.05);发酵结束时(3d),对照组的亮度值l*显著高于试验组(p<0.05),对照组为51.28,试验组在42.83-51.37之间,差异显著(p<0.05);而对照组的红度值a*显著低于试验组(p<0.05);干燥结束时(6d),对照组的红度值a*、黄度值b*、亮度值l*均显著低于试验组(p<0.05),成熟结束时(9d),对照组的红度值a*10.340显著低于试验组19.28左右(p<0.05)。e值计算公式如下e=a*/l*+a*/b*。从表中可以看出,整体呈先上升后下降的趋势,在腌制结束时(0d),各组e值均无显著差异。发酵结束时(3d),各组e值迅速上升;干燥和成熟时(9d),试验组的e值显著高于对照组(p<0.05),试验证明,此发酵剂对于香肠的色泽存在影响,添加乳酸菌发酵剂有护色功能,可以防止肌红蛋白进一步被氧化。从而做出的香肠感官更佳,色泽均匀鲜亮,更能吸引消费者。生物胺含量的测定是参照gb5009.208-2016食品安全国家标准食品中生物胺的测定进行的,结果如图9-10及下表所示:通过高效液相色谱仪测定了发酵香肠中的组胺和酪胺的含量,分别以1.25、2.5、5、7.5、12.5μg/ml的顺序进样,以标准系列溶液的质量(μg/ml)为纵坐标,以组胺、酪胺和内标的峰面积比为横坐标,得出回归方程、决定系数。结果显示,样品中的组胺和酪胺的线性关系良好,决定系数均大于0.99。说明通过该方法可以准确测定出样品中组胺的含量变化,如下表:注:以不添加发酵剂作为对照组通过对羊肉发酵香肠组胺含量的测定,确认在成熟结束时(9d),植物乳杆菌37x-6组无组胺检出。根据相同的计算方法,酪胺的按量变化如下表:通过对羊肉发酵香肠在加工期间酪胺含量的测定,在腌制结束(0d)和发酵结束(3d)实验组和对照组均无酪胺检出,从干燥阶段(6d)对照组有酪胺检出,表明发酵剂中的植物乳杆菌37x-6对酪胺形成有较大影响。在成熟过程中,实验组和对照组的酪胺含量均显著上升(p<0.05),对照组为1.417mg/kg显著高于试验组0.235、mg/kg(p<0.05)。综上所述,本发明提供了一株不产生物胺、特别是酪胺和组胺的植物乳杆菌37x-6,该菌可应用于食品发酵剂,特别是香肠发酵剂,所得发酵香肠在腌制或发酵过程中不产生生物胺,且香肠成熟后,其酪胺浓度显著低于现有技术,即植物乳杆菌37x-6是理想的发酵香肠的发酵剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1