一种牛骨胶原蛋白肽及制备方法和用途与流程
本发明涉及食品工程学和生物
技术领域:
,尤其涉及一种牛骨胶原蛋白肽及制备方法和用途。
背景技术:
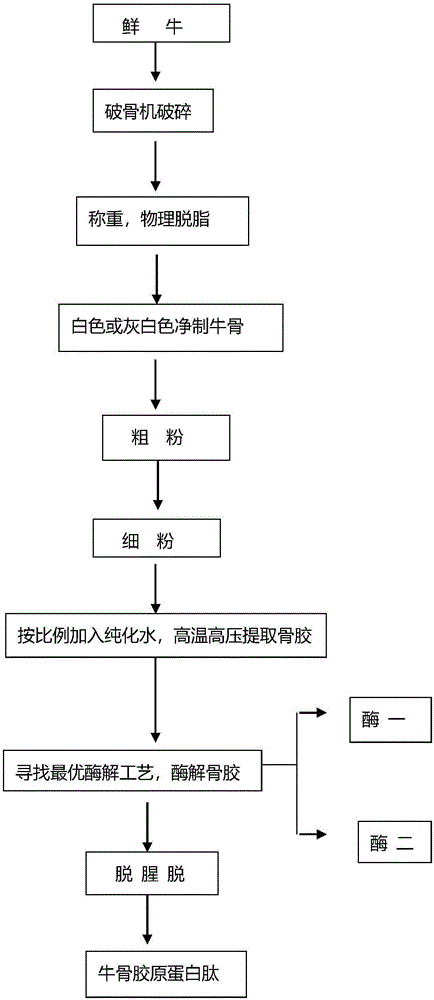
:目前,人口老龄化已经成为全球性的现象,伴随着人口的老龄化,骨质疏松患者的数量也急剧增加,骨质疏松已成为世界性的严重问题。骨质疏松症是一种全身骨量减少,骨显微结构遭到破坏使骨脆性增加,导致在很小创伤时易发生骨折的疾病。骨质疏松(osteoporosis)一词,是pommer于1885年首先提出来的,其意思为骨质减少的一种疾病。骨质减少是随着年龄的增加出现的生理性老化的一个特征,骨是由钙离子和磷所构成的结晶沉着于由胶原组成的基质上而形成的,骨基质与骨矿质之比呈一定状态。骨基质不变化而骨矿质减少或者骨钙化障碍的状态称为骨软化症,骨基质和骨矿质化学组成无变化而量减少的状态称为骨质疏松症,有学者认为骨质疏松会导致骨组织显微结构改变和骨折危险度增加。研究认为骨量每降低一个标准差,骨折危险性增加1.5-3倍,女性比男性更危险,终身危险性是男性的3倍。男性与女性之间的这个差异与女性骨量峰值比男性低,绝经后又发生快速骨丢失及女性比男性长寿,女性比男性更易跌跤等因素有关。1999年中国步入老年型人口国家行列,老年人口占世界老年人口的21%左右,是世界上老年人口最多的国家。截至2017年底我国60岁及以上老龄人口已达2.4亿,占全国总人口的17.3%以上,预计到2030年,我国老龄人口超过总人口的20%而进入高度老龄化阶段,2040年以后,我国老年人将超过4亿。老年人口这样快速的增加和高龄化,使骨质疏松症和伴随发生骨质疏松性骨折的发生率也大幅度提高。因此,各个国家在预防和治疗骨质疏松性骨折的费用额度巨大,骨质疏松症和骨质疏松性骨折严重影响个人和家庭的生活质量,所以提前预防骨质疏松,提早修复骨关节出现的问题显得尤为重要,市场上补钙增加骨密度的药品,保健品应运而生。牛骨为牛科动物黄牛或水牛的骨骼,据《本草纲目》记载,“牛骨,甘,温,无毒。”我国一直都有牛骨头熬汤的饮食习惯,尤其是孕妇、老年人及骨头损伤的病人等。常有骨折后饮食骨头汤的习惯,以期补充钙质,使骨折早日愈合,在骨折愈合的中、晚期即原始骨痂形成期及骨痂改造塑型期,由于有机纤维的骨样组织逐渐钙化形成新生骨,加强改造,形成正常骨,骨样组织的骨化需要充分的钙、磷质,此时补食骨头汤是很有益处的。早在70年代,日本和西欧等国家就有专门利用猪骨、牛骨和鱼骨等畜禽骨做骨泥(西欧称骨酱),产品向全世界出售。80年代,我国也开始自行研制骨泥机,生产口感细腻,味道鲜美的骨泥,用来做火腿香肠、肉酱。用骨泥制备的骨浸膏,可以作为各种口味独特,鲜香的调味品,汤品基料。还有利用骨头酶解或是酸碱水解,制得动物水解蛋白等调味品的配料。牛骨早在中国唐朝就有入药的记载,①治水谷痢疾:牛骨灰同曲炒,等分,为末,饮服方寸匕(张文仲);②治鼻中生疮:牛、狗骨烧灰,以腊月猪脂共同敷之(《千金方》);③治疳疮蚀入口鼻:牛骨烧灰,同猪脂涂(《十便良方》)。牛骨,在日常生活中熬汤作为食物,在食品加工中牛骨粉碎作为食品加工原料使用。牛骨既可以作为食品和食品辅料,也可以用作药物,现多作为食品使用。文献报道[1]牛骨中含有丰富的蛋白质、脂肪、软骨素,钙、铁、磷、锌等矿物质及维生素。骨可以以全骨的方式,如骨泥、骨粉等形式被利用,也可以以提取物的形式,如骨素、骨胶、骨油、钙磷制品等形式被利用。牛骨中蛋白质含量约为20%左右,不同品种的牛,蛋白含量略有差异。牛骨中含有17中氨基酸,且羟脯氨酸含量丰富,羟脯氨酸是胶原蛋白的标志性成分。胶原蛋白是动物结缔组织(骨、软骨、皮肤、腔、韧等)的主要成分,在脊椎动物中约占总蛋白质的1/3,形成一种十分独特的三股超螺旋结构,性质十分稳定,一般的加工温度及短时间加热都不能使其分解。胶原蛋白多肽是胶原蛋白或明胶降解后制得的低分子量产物,不仅具有很好的消化吸收特性,还具有不同于胶原的特殊生理功能。国内外研究表明,胶原蛋白多肽具有保护胃黏膜、抗溃疡、抑制血压上升,促进骨形成、皮肤胶原代谢等营养及生理功能。酶解牛骨获取胶原蛋白肽,研究表明,胶原多肽可以在肠道中被直接吸收,因此经常食用含胶原多肽的食品能有效地增加皮肤组织细胞的储水能力,增强和维持肌肤良好的弹性,强化肌肤的韧性,延缓机体的衰老,同时还可强筋健骨、增强体质。胶原蛋白是一种重要的功能性蛋白质,它与细胞增生、分化、运动、免疫、关节润滑、伤口愈合等密切相关,直接或间接地影响着我们人体的生长、衰老以及健康等。胶原蛋白有多样性和组织分布特异性,是与各器官组织有关的功能性蛋白。此外,由于其抗原性较弱,生物相容性较好,一些蛋白质表面具有抗原特性,很多人食用后出现过敏症状,这大大降低了蛋白质的适用范围及营养价值。因此就大大降低了蛋白原料的利用率造成原料的损失,也进而影响了蛋白质类产品的产量。有关研究报道指出,蛋白经蛋白酶水解后得到的蛋白肽,其抗原性远低于纯蛋白的抗原性,经临床试验证明,与蛋白引起的机体过敏反应相比多肽引起的过敏反应显著减弱。因此,在保证蛋白的营养需求的基础上减弱蛋白的抗原性,用低抗原性的蛋白肽,满足对蛋白过敏人群的需要。婴幼儿时期的儿童抵抗力低,更容易对蛋白为主的食品过敏,因此低抗原性的蛋白肽也很适用于生产婴儿食品、保健食品、医疗用品等。胶原蛋白家族包括19种胶原蛋白及10种以上胶原样蛋白[4]。在结缔组织中,不同类型的胶原具有不同的功能。几种常见的胶原蛋白有:ⅰ型胶原蛋白、ⅱ型胶原、ⅲ型胶原、ⅳ型胶原、ⅴ型胶原。其中与增加骨密度密切相关的是ⅰ型胶原蛋白。ⅰ型胶原是纤维形成胶原,约占有机成分80%~90%,约占总蛋白质质量的20%,是多细胞生物细胞外基质的主要结构大分子,能活化上皮细胞,促进上皮细胞增生,也可促进胶原酶生成,使皮肤有张力和弹性。ⅰ型胶原蛋白对维持骨结构的完整及骨生物力学特性非常重要。骨质疏松主要特征表现为全身骨量减少和骨组织微细结构退化,引起骨脆性增加和骨密度降低的代谢性骨病。胶原蛋白(主要指ⅰ型)结构、含量及稳定性异常与骨质疏松症的发生、发展、严重程度密切相关。ⅰ型胶原多存在骨骼中,因此可以从牛骨中提取ⅰ型胶原蛋白肽来提高骨密度,胶原肽白肽在体内起到骨架支持作用。中国发明专利申请(cn201610001744.4)公开了一种牛骨胶原蛋白的制备方法,包括工艺步骤:清洗牛骨,粉碎牛骨,脱脂、脱钙处理牛骨粉,对牛骨粉进行酶解,100℃下进行灭酶处理,过滤获取胶原蛋白溶液,活性炭脱色处理,浓缩处理获取胶原蛋白。该方法采用牛骨粉直接进行酶解,胶原蛋白获取量不够,杂质多。中国发明专利申请(cn201510556199.0)公开了一种牛骨胶原蛋白肽的制备方法,它涉及一种蛋白肽的制备方法。本发明的主要目的是通过对牛骨先后采用两次破碎、二次复煮、高温蒸煮和超滤膜浓缩技术并结合特定的复合酶制剂,解决现有生产工艺制备牛骨胶原蛋白肽提取率低下,易褐变,能耗大,生产周期长的问题。方法:一、筛选;二、一次破碎;三、二次破碎;四、清洗;五、高温提取;六、二次复煮;七、过滤分离;八、液液分离;九、酶解;十、杀菌灭酶;十一、固液分离;十二、超滤膜浓缩,十三、喷雾干燥;十四、包装,即得到牛骨胶原蛋白肽。中国发明专利申请(cn201710823158.2)公开了牛骨胶原蛋白肽提取方法。包含如下步骤,一、破骨;二、上料清洗;三、上料蒸煮、排汤;四、水解过滤;五、浓缩;六、干燥喷粉。上述的方法获得的牛骨胶原蛋白肽提取率不够,而且小分子活性多肽不足。技术实现要素:为了解决上述的技术问题,本发明的目的是提供了一种牛骨胶原蛋白肽的制备方法,提高了牛骨胶原蛋白的提取率,水解牛骨粉煎煮液得到的多肽分子量<1000da。本发明获得牛骨胶原蛋白肽既可以提高骨密度,又可以增加骨骼韧性、弹性,是一个骨骼保护的营养剂。为了实现上述的目的,本发明采用了以下的技术方案:一种牛骨胶原蛋白肽的制备方法,该方法包括以下的步骤:1)、取一定量的经检验检疫合格的新鲜牛骨,破碎,清洗,加入等体积的水,蒸煮0.5-2h;2)、将步骤1)得到的牛骨蒸煮液弃掉,取出牛骨,去除骨骼上附着的肉,筋膜,及骨骼腔内的油脂,然后热水清洗2-3遍,至骨头呈白色或乳白色、无肉眼可见油脂为止,得到干净的牛骨;3)、将步骤2)中得到的牛骨,粉碎,过100目标准筛,得到牛骨细粉;4)、将步骤3)中得到的牛骨细粉,加入5-10倍质量的水,高温高压40min~2h,过滤取上清,得到牛骨胶原蛋白液体;5)、将步骤4)中得到的牛骨胶原蛋白液,加入1%-3%的胰蛋白酶,调节ph值为7.0-8.0,温度40-50℃,酶解4-7h,将酶灭活;6)、将步骤5)中的酶解液加入0.5%-2.5%的碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物,调节ph值为5.0-6.0,温度40-50℃,酶解4-7h,将酶灭活;得到牛骨肽原液。作为进一步改进,步骤3)将牛骨粉碎,烘箱中烘干,粗粉碎牛骨粉再次烘干,进一步粉碎,得到牛骨细粉。作为进一步改进,步骤3)中的牛骨细粉的粒径为10-150μm。作为进一步改进,步骤5)、步骤6)酶灭活采用高温蒸煮或高温保温。作为进一步改进,步骤6)碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物的质量比为:1~10:1~10:1~5。作为进一步改进,步骤6)得到的牛骨胶原肽原液,加入酶解液重量0.2-0.5%活性炭于酶解液中,通过硅藻土分离,脱色并去除腥味,得到酶解液。本发明还公开了所述的方法制备得到的牛骨胶原蛋白肽。该牛骨胶原蛋白肽的多肽分子量分布为:序号分子量范围分子量占比1<150da5~15%2150-600da60~80%3600-1000da10~20%4>1000da1~10%。本发明还公开了所述的牛骨胶原蛋白肽用于制备调节骨质疾病的药品、保健品或食品中的用途。在本发明中,创立了一种牛骨胶原蛋白多肽的制备方法。本发明使用物理脱脂去筋膜的方法处理牛棒骨,又将牛骨制成牛骨细粉,提高牛骨胶原蛋白的提取率,之后用胰蛋白酶,和复配蛋白酶—一种碱性蛋白酶,中性蛋白酶及麦芽糊精的混合物,按先后顺序,分别水解牛骨粉煎煮液得到的多肽分子量<1000da。牛骨胶原肽在人体骨骼中起网状黏连作用,黏连钙磷等无机物,构成骨基质。本发明既可以提高骨密度,又可以增加骨骼韧性、弹性,是一个骨骼保护的营养剂。与现有技术相比,本发明的有益效果为:(1)在制备工艺上,牛骨前处理没有使用任何化学试剂,用完全物理方法进行牛骨前处理,安全无污染,且制得的牛骨粉,可通过100目标准筛的牛骨细粉,相比其他工艺,可以最大程度上提取胶原蛋白,;在多种蛋白酶中筛选出适宜的两种水解酶,通过正交试验,得到酶解最佳工艺,确定酶解先后顺序,通过此工艺得到的牛骨肽分子量小活性高,分子量<1000da,相比其他酶解工艺,此工艺简单,操作简便,由于所选择的生物酶和底物的适宜性,酶解后得到的小肽,不用经过分离,分子量就相对集中且<1000da。(2)本发明提供的组合物的制备工艺精简,生产周期短,采用完全物理方式进行生产加工,加工废料又可被用作动物饲料,是一种绿色环保的且极适于规模化生产的加工方式。附图说明图1为本发明实施例1的制备流程图。图2、图3为本发明实施例1的制备牛骨胶原多肽质谱图。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。实施例1制备方法:(1)、取一定量的经检验检疫合格的新鲜牛骨,破碎,清洗,加入等体积的水,蒸煮0.5h。(2)、将步骤(1)得到的牛骨蒸煮液弃掉,取出牛骨,去除骨骼上附着的肉,筋膜,及骨骼腔内的油脂,然后热水清洗2遍,至骨头呈白色或乳白色、无肉眼可见油脂为止,得到干净的牛骨。(3)、将步骤(2)中得到的牛骨,粉碎,过100目标准筛,得到牛骨细粉。(4)、将步骤(3)中得到的牛骨细粉,加入5倍质量的水,高温高压40min,过滤取上清,得到牛骨胶原蛋白液体。(5)、将步骤(4)中得到的牛骨胶原蛋白液,加入2%的胰蛋白酶,调节ph值为8.0,温度40℃,酶解5h,将酶灭活。(6)、将步骤(5)中的酶解液加入2%的复配蛋白酶—具有碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物,碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物的质量比为:2:2:1,调节ph值为6.0,温度40℃,酶解5h,将酶灭活。得到牛骨肽原液。(7)、将步骤(6)得到的牛骨肽原液,过膜,得到分子量<1000da的小肽。酶解后多肽分布情况序号分子量范围分子量占比1<150da10%2150-600da70%3600-1000da15%4>1000da5%实施例2制备方法:(1)、取一定量的经检验检疫合格的新鲜牛骨,破碎,清洗,加入等体积的水,蒸煮1h。(2)、将步骤(1)得到的牛骨蒸煮液弃掉,取出牛骨,去除骨骼上附着的肉,筋膜,及骨骼腔内的油脂,然后热水清洗3遍,至骨头呈白色或乳白色、无肉眼可见油脂为止,得到干净的牛骨。(3)、将步骤(2)中得到的牛骨,粉碎,过100目标准筛,得到牛骨细粉。(4)、将步骤(3)中得到的牛骨细粉,加入6倍质量的水,高温高压40min,过滤取上清,得到牛骨胶原蛋白液体。(5)、将步骤(4)中得到的牛骨胶原蛋白液,加入0.5%的胰蛋白酶,调节ph值为7.0,温度50℃,酶解7h,将酶灭活。(6)、将步骤(5)中的酶解液加入0.5%的复配蛋白酶—具有碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物,碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物的质量比为:2:3:1,调节ph值为5.0,温度50℃,酶解4h,将酶灭活。得到牛骨肽原液。(7)、将步骤(6)得到的牛骨肽原液,过膜,得到分子量<1000da的小肽。实施例3制备方法:(1)、取一定量的经检验检疫合格的新鲜牛骨,破碎,清洗,加入等体积的水,蒸煮1.5h。(2)、将步骤(1)得到的牛骨蒸煮液弃掉,取出牛骨,去除骨骼上附着的肉,筋膜,及骨骼腔内的油脂,然后热水清洗3遍,至骨头呈白色或乳白色、无肉眼可见油脂为止,得到干净的牛骨。(3)、将步骤(2)中得到的牛骨,粉碎,过100目标准筛,得到牛骨细粉。(4)、将步骤(3)中得到的牛骨细粉,加入10倍质量的水,高温高压2h,过滤取上清,得到牛骨胶原蛋白液体。(5)、将步骤(4)中得到的牛骨胶原蛋白液,加入1.5%的胰蛋白酶,调节ph值为7.5,温度55℃,酶解6h,将酶灭活。(6)、将步骤(5)中的酶解液加入1.5%的具有复配蛋白酶—碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物,碱性蛋白酶、中性蛋白酶和麦芽糊精的混合物的质量比为:2:1:1,调节ph值为5.5,温度55℃,酶解7h,将酶灭活。得到牛骨肽原液。(7)、将步骤(6)得到的牛骨肽原液,过膜,得到分子量<1000da的小肽实施例4组合物1配方:按体积:实施例1牛骨肽原液110份,按重量:硫酸软骨素1.5份,d-氨基葡萄糖4份、乳酸钙1.5份,酪蛋白磷酸肽0.3份。组合物2配方:按体积:牛骨肽原液100份,按重量:硫酸软骨素1.8份,d-氨基葡萄糖3.6份、乳酸钙1.2份,酪蛋白磷酸肽0.2份。组合物3配方:按体积:牛骨肽原液120份,按重量:硫酸软骨素2份,d-氨基葡萄糖6份、乳酸钙2份,酪蛋白磷酸肽0.4份。取制得的组合物,加入组合物重量的0.02%的黄原胶,0.04%cmc-na,0.1%edta-2na,混匀,再加入组合物重量的0.02%浓缩果汁,5%蜂蜜,制成均一稳定的口服液。实验例一、动物实验将上述制备得到的组合物进行实验验证,考察其效果。实验动物与分组:出生四周的断乳wistar雄性大鼠,适应一周后,禁食12小时,按体重随机分组,每组10只。给药方案:每组大鼠按设定剂量连续灌胃给药3个月,给药期间饮用去离子水,饲喂低钙鼠粮。每周测一次体重,按新体重给予受试药物。各组给药类型和剂量安排见下表。朗迪碳酸钙d3颗粒,otc,北京康远制药有限公司生产,生产批号20171207,批准文号:国药准字h20090334表1各组小鼠给药情况表1、股骨重量测定大鼠喂养3个月后处死,剥离出右侧股骨,于105℃烘箱中,烘干至恒重,称量骨干重量。各组实验大鼠右侧表2各组药物对实验大鼠股骨重量及长度的影响注:*与m组(模型组)比较,p<0.05;#与con组(对照组)比较,p<0.05与m组(低钙模型组)对比,阳性药碳酸钙d3颗粒对大鼠股骨长度,股骨重量的影响,具有显著性差异,组合物1、组合物2、组合物3均有显著性差异;与con组(正常饲养对照组)相比,阳性药组、组合物2、组合物3组的受试药物对大鼠股骨长度和股骨重量的影响具有显著性差异。2、股骨强度测定及钙离子含量测定用骨骼强度仪器,使用北京众实迪创科技发展有限责任公司自主研发的yls-16a小动物骨骼强度测定仪测定股骨中点的骨骼强度。股骨中点测量点的确定:测量股骨全长,通过其中点,沿横截面方向画一直线,此为股骨中点测量点(截面)。骨骼中钙离子含量的测定,依照gb5009.92-2016检测方法——第二法edta滴定法测定2.1实验原理在适当的ph范围内,钙与edta(乙二胺四乙酸二钠)形成金属络合物。以edta滴定,在达到当量点时,溶液呈现游离指示剂的颜色。根据edta用量,计算钙的含量。2.2试剂氢氧化钾(koh)。硫化钠(na2s)。柠檬酸钠(na3c6h5o7·2h2o)。乙二胺四乙酸二钠(edta,c10h14n2o8na2·2h2o)。盐酸(hcl):优级纯。钙红指示剂(c21o7n2sh14)。硝酸(hno3):优级纯。高氯酸(hclo4):优级纯。2.3试剂配制2.3.1氢氧化钾溶液(1.25mol/l):称取70.13g氢氧化钾,用水稀释至1000ml,混匀。2.3.2硫化钠溶液(10g/l):称取1g硫化钠,用水稀释至100ml,混匀。gb5009.92—20162.3.3柠檬酸钠溶液(0.05mol/l):称取14.7g柠檬酸钠,用水稀释至1000ml,混匀。2.3.4edta溶液:称取4.5gedta,用水稀释至1000ml,混匀,贮存于聚乙烯瓶中,4℃保存。使用时稀释10倍即可。2.3.5钙红指示剂:称取0.1g钙红指示剂,用水稀释至100ml,混匀。2.3.6盐酸溶液(1+1):量取500ml盐酸,与500ml水混合均匀。2.4标准品碳酸钙(caco3,cas号471-34-1):纯度>99.99%,或经国家认证并授予标准物质证书的一定浓度的钙标准溶液。2.5标准溶液配制钙标准储备液(100.0mg/l):准确称取0.2496g(精确至0.0001g)碳酸钙,加盐酸溶液(1+1)溶解,移入1000ml容量瓶中,加水定容至刻度,混匀。2.6分析步骤2.6.1试样消解湿法消解:准确称取固体试样0.2g-3g(精确至0.001g)或准确移取液体试样0.500ml-5.00ml于带刻度消化管中,加入10ml硝酸、0.5ml高氯酸,在可调式电热炉上消解(参考条件:120℃/0.5h-120℃/1h、升至180℃/2h-180℃/4h、升至200℃-220℃)。若消化液呈棕褐色,再加硝酸,消解至冒白烟,消化液呈无色透明或略带黄色。取出消化管,冷却后用水定容至25ml,再根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/l),使其在最终稀释液中的浓度为1g/l,混匀备用,此为试样待测液。同时做试剂空白试验。亦可采用锥形瓶,于可调式电热板上,按上述操作方法进行湿法消解。2.6.2滴定度(t)的测定吸取0.500ml钙标准储备液(100.0mg/l)于试管中,加1滴硫化钠溶液(10g/l)和0.1ml柠檬酸钠溶液(0.05mol/l),加1.5ml氢氧化钾溶液(1.25mol/l),加3滴钙红指示剂,立即以稀释10倍的edta溶液滴定,至指示剂由紫红色变蓝色为止,记录所消耗的稀释10倍的edta溶液的体积。根据滴定结果计算出每毫升稀释10倍的edta溶液相当于钙的毫克数,即滴定度(t)。2.6.3试样及空白滴定分别吸取0.100ml-1.00ml(根据钙的含量而定)试样消化液及空白液于试管中,加1滴硫化钠溶液(10g/l)和0.1ml柠檬酸钠溶液(0.05mol/l),加1.5ml氢氧化钾溶液(1.25mol/l),加3滴钙红指示剂,立即以稀释10倍的edta溶液滴定,至指示剂由紫红色变蓝色为止,记录所消耗的稀释10倍的edta溶液的体积。2.7分析结果的表述试样中钙的含量按式(1)计算:式中:x——试样中钙的含量,单位为毫克每千克或毫克每升(mg/kg或mg/l);t——edta滴定度,单位为毫克每毫升(mg/ml);v1——滴定试样溶液时所消耗的稀释10倍的edta溶液的体积,单位为毫升(ml);v0——滴定空白溶液时所消耗的稀释10倍的edta溶液的体积,单位为毫升(ml);v2——试样消化液的定容体积,单位为毫升(ml);1000——换算系数;m——试样质量或移取体积,单位为克或毫升(g或ml);v3——滴定用试样待测液的体积,单位为毫升(ml)。表3各组药物对实验大鼠股骨强度及骨骼钙离子含量的影响注:*与m组(模型组)比较,p<0.05;#与con组(对照组)比较,p<0.05与m组(低钙模型组)对比,阳性药碳酸钙d3颗粒对大鼠左右股骨强度的影响,均具有显著性差异,组合物1、组合物2、组合物3均有显著性差异;与con组(正常饲养对照组)相比,阳性药组、组合物2、组合物3组的受试药物对大鼠左右股骨强度的影响具有显著性差异;与m组(低钙模型组)对比,阳性药碳酸钙d3颗粒对大鼠骨骼中钙离子含量的影响具有显著性差异,组合物2、组合物3也具有显著性差异,组合物1,比低钙模型组骨骼中钙离子含量高,但是在p<0.05时不具有显著性差异;与con组(正常饲养对照组)相比,阳性药碳酸钙d3颗粒对大鼠骨骼中钙离子含量的影响具有显著性差异,组合物3也具有显著性差异,组合物2无显著性差异,但是钙离子含量比con组(正常饲养对照组)高,组合物1与con组(正常饲养对照组)相比没有明显差异。通过以上动物实验数据分析结果可知,组合物1、2、3……可以促进大鼠钙离子的吸收,表现为大鼠体重,骨骼重量,骨骼长度,骨骼中钙离子含量及骨骼强度明显高于低钙模型组,和正常饮食组。以上为对本发明组合物的描述,通过对所公开的组合物的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些组合物的多种修改对本领域的专业技术人员来说将是显而易见的。本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它组合物中实现。因此,本发明将不会被限制于本文所示的这些实施列,而是要符合与本文所公开的原理和新颖点相一致的最宽的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1