用于检测黄嘌呤的荧光探针及其制备方法和应用与流程
本发明属于分析化学领域,尤其涉及一种新型荧光探针的合成及其在真实尿液中检测黄嘌呤的应用。
背景技术:
黄嘌呤(xanthine)是一种广泛分布于人和其他生物体的器官和体液中的嘌呤碱,其正常的生理浓度在血清中为0.5~2.5μmol/l,在尿液中为40~160μmol/l。同时,黄嘌呤也是嘌呤代谢的产物,在黄嘌呤氧化酶的作用下转化为尿酸,最终随尿液排出体外。当体内缺乏黄嘌呤氧化酶时,黄嘌呤不能被转换而是在体内积累。导致血液和尿液中黄嘌呤浓度急剧上升,最终发展成黄嘌呤尿症。患有黄嘌呤尿症的病人可能会出现例如疲劳性肌肉疼痛,肌肉痛性痉挛或肌痉挛性尿频等症状。
茶和咖啡中含有大量由黄嘌呤衍生而来的温和的兴奋剂,如咖啡因和茶碱。然而,咖啡中的咖啡因可能诱发冠心病,这会增加高血压患者的血压和心率。此外,食品工业对肉类的新鲜程度要求很高。鱼死亡后,体内的atp被降解为黄嘌呤,其含量随着储存时间的增加而增加。因此,鱼肉中黄嘌呤的含量也可用于评估鱼肉的新鲜程度。总而言之,黄嘌呤的检测无论是在食品领域还是在医疗领域都非常重要。
通常,用于检测黄嘌呤的方法包括比色法,电化学法,高效液相色谱法和毛细管柱气相色谱法。然而,这些方法复杂,耗时且灵敏度低。而且,在这些方法中,预处理步骤复杂并且仪器设备昂贵。众所周知,荧光探针检测方法因其设备简单,操作简便,分析速度快等优点,被广泛应用于许多领域。尤其是荧光探针法通常灵敏度高,选择性好以及检测限低。因此,开发一种能快速且准确的检测黄嘌呤的荧光探针是非常必要的。
技术实现要素:
本发明的目的之一是设计合成可用于有效检测黄嘌呤的新型荧光探针。
本发明的目的之二是提供一种操作简单,成本低,敏感快速,且选择性好的检测黄嘌呤的方法。
本发明采用的技术方案是:用于检测黄嘌呤的荧光探针,制备方法包括如下步骤:
1)将二乙三胺五乙酸、乙酸酐和吡啶混合均匀,在65℃下搅拌回流24h,冷却至室温,减压抽滤,依次用乙酸酐和无水乙醚洗涤,60℃下干燥,得二乙三胺五乙酸二酐(dtpaa)。优选的,按摩尔比,二乙三胺五乙酸:乙酸酐:吡啶=1:4:6。
2)将二乙三胺五乙酸二酐、三乙胺、无水dmf、腺嘌呤和/或胞嘧啶混合均匀,在100℃下搅拌回流24-48h,冷却至室温,旋转蒸发,依次用乙腈和无水乙醚洗涤,减压抽滤,于50℃干燥,得中间产物。优选的,按摩尔比,二乙三胺五乙酸二酐:三乙胺:腺嘌呤=1:3:2;二乙三胺五乙酸二酐:三乙胺:胞嘧啶=1:3:2;二乙三胺五乙酸二酐:三乙胺:腺嘌呤:胞嘧啶=1:3:1:1。
3)取步骤2)获得的中间产物和tb(no3)3·6h2o,加去离子水溶解,于60℃搅拌加热2-3h,冷却,得到用于检测黄嘌呤的荧光探针。优选的,按摩尔比,中间产物:tb(no3)3·6h2o=1:1。
上述的用于检测黄嘌呤的荧光探针在定性和定量检测黄嘌呤中的应用。
优选的,用于检测黄嘌呤的荧光探针在定性和定量检测尿液中黄嘌呤的应用。方法如下:
定性检测尿液中黄嘌呤的方法:取尿液,加入上述用于检测黄嘌呤的荧光探针的水溶液,充分混合,进行荧光检测,观察荧光光谱的变化。
定量检测尿液中黄嘌呤的方法:取50μl浓度是5.0×10-3mol/l的上述用于检测黄嘌呤的荧光探针的水溶液于10ml比色管中,用尿液定容至5ml,进行荧光检测。
本发明的有益效果是:
1.本发明针对被检测物黄嘌呤的结构特点,利用碱基互补配对原则对dtpa进行修饰,设计合成了三种新型的荧光探针。
2.通过本发明的方法,三种探针都可以对黄嘌呤进行灵敏且特异性检测。与其它检测黄嘌呤的方法相比,具有简单,快速,成本低,选择性好,不受外界电磁场影响等优点。
附图说明
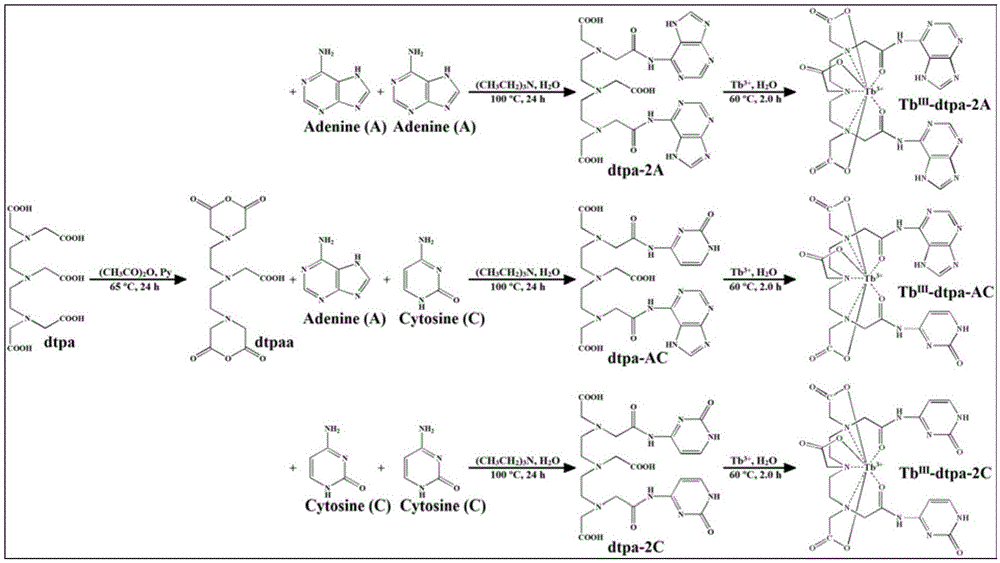
图1是荧光探针tbш-dtpa-2a,tbш-dtpa-2c和tbш-dtpa-ac的合成路线图。
图2a是dtpa的傅里叶变换红外光谱(ft-ir)图。
图2b是腺嘌呤(adenine)的傅里叶变换红外光谱(ft-ir)图。
图2c是胞嘧啶(cytosine)的傅里叶变换红外光谱(ft-ir)图。
图2d是dtpa-2a的傅里叶变换红外光谱(ft-ir)图。
图2e是dtpa-2c的傅里叶变换红外光谱(ft-ir)图。
图2f是dtpa-ac的傅里叶变换红外光谱(ft-ir)图。
图3a是tb3+,dtpa-2a,tbш-dtpa-2a和tbш-dtpa-2a+黄嘌呤的紫外吸收光谱图。
图3b是tb3+,dtpa-2c,tbш-dtpa-2c和tbш-dtpa-2c+黄嘌呤的紫外吸收光谱图。
图3c是tb3+,dtpa-ac,tbш-dtpa-ac和tbш-dtpa-ac+黄嘌呤的紫外吸收光谱图。
图4a-1是荧光探针tbш-dtpa-2a对黄嘌呤检测的荧光光谱图。
图4a-2是荧光探针tbш-dtpa-2a对黄嘌呤检测的荧光光谱对比柱状图。
图4b-1是荧光探针tbш-dtpa-2c对黄嘌呤检测的荧光光谱图。
图4b-2是荧光探针tbш-dtpa-2c对黄嘌呤检测的荧光光谱图对比柱状图。
图4c-1是荧光探针tbш-dtpa-ac对黄嘌呤检测的荧光光谱图。
图4c-2是荧光探针tbш-dtpa-ac对黄嘌呤检测的荧光光谱图对比柱状图。
图5a是荧光探针tbш-dtpa-2a对黄嘌呤分别与不同物质混合的干扰荧光光谱对比图。
图5b是荧光探针tbш-dtpa-2c对黄嘌呤分别与不同物质混合的干扰荧光光谱对比图。
图5c是荧光探针tbш-dtpa-ac对黄嘌呤分别与不同物质混合的干扰荧光光谱对比图。
图6a是荧光探针tbш-dtpa-2a对实际尿样(ur)中黄嘌呤检测的荧光光谱对比图。
图6b是荧光探针tbш-dtpa-2c对实际尿样(ur)中黄嘌呤检测的荧光光谱对比图。
图6c是荧光探针tbш-dtpa-ac对实际尿样(ur)中黄嘌呤检测的荧光光谱对比图。
具体实施方式
实施例1
二乙三胺五乙酸二酐(dtpaa)的制备:称取7.8670g(0.02mol)二乙三胺五乙酸(dtpa),乙酸酐16.0ml(0.08mol),吡啶10.0ml(0.12mol)置于三颈圆底烧瓶中,在65℃下缓慢搅拌加热,冷凝回流24h。停止加热和搅拌,冷却至室温后将产物减压抽滤,依次用乙酸酐和无水乙醚分别洗涤三次(3×10ml),并减压抽滤,将产物于干燥箱中60℃干燥,即得二乙三胺五乙酸二酐(dtpaa)。
(一)用于检测黄嘌呤的荧光探针——铽-二乙三胺五乙酸-双(腺嘌呤)(tbш-dtpa-2a)
1、二乙三胺五乙酸-双(腺嘌呤)(dtpa-2a)的制备:取二乙三胺五乙酸二酐(dtpaa)1.9635g(5.5mmol),2.334ml的三乙胺(16.5mmol),无水dmf(50ml),腺嘌呤(a)1.4864g(11mmol),于三颈圆底烧瓶中。恒温100℃条件下,快速搅拌,冷凝回流24h。反应完全后静置,冷却到室温后,旋转蒸发除去溶剂,得乳白色固体物质,减压抽滤,依次用乙腈和无水乙醚分别洗涤三次(3×10ml)。于50℃条件下干燥,即得二乙三胺五乙酸-双(腺嘌呤)(dtpa-2a)。
2、tbш-dtpa-2a的制备:称取0.7838g(1.25mmol)二乙三胺五乙酸-双(腺嘌呤)(dtpa-2a)于三颈圆底烧瓶中,加30ml去离子水溶解。同时称取0.5663g的tb(no3)3·6h2o(1.25mmol)置于烧杯中,加30ml去离子水溶解后转移至圆底烧瓶中,于60℃搅拌加热2h。将反应后的溶液冷却至室温,得到tbш-dtpa-2a。合成过程如图1所示。
(二)用于检测黄嘌呤的荧光探针——铽-二乙三胺五乙酸-双(胞嘧啶)(tbш-dtpa-2c)
1、二乙三胺五乙酸-双(胞嘧啶)(dtpa-2c)的制备:取二乙三胺五乙酸二酐(dtpaa)1.9635g(5.5mmol),2.334ml的三乙胺(16.5mmol),无水dmf(50ml),胞嘧啶(c)1.2210g(11mmol),于三颈圆底烧瓶中。恒温100℃条件下,快速搅拌,冷凝回流24h。反应完全后静置,冷却到室温后,旋转蒸发除去溶剂,得浅黄色固体物质,减压抽滤,依次用乙腈和无水乙醚分别洗涤三次(3×10ml)。于50℃条件下干燥,即得二乙三胺五乙酸-双(胞嘧啶)(dtpa-2c)。
2、tbш-dtpa-2c的制备:称取0.7288g(1.25mmol)二乙三胺五乙酸-双(胞嘧啶)(dtpa-2c)于三颈圆底烧瓶中,加30ml去离子水溶解。同时称取0.5663g的tb(no3)3·6h2o(1.25mmol)置于烧杯中,加30ml去离子水溶解后转移至圆底烧瓶中,于60℃搅拌加热2h。将反应后的溶液冷却至室温,得到tbш-dtpa-2c。合成过程如图1所示。
(三)用于检测黄嘌呤的荧光探针——铽-腺嘌呤-二乙三胺五乙酸-胞嘧啶(tbш-dtpa-ac)
1、腺嘌呤-二乙三胺五乙酸-胞嘧啶(dtpa-ac)的制备:取二乙三胺五乙酸二酐(dtpaa)1.9635g(5.5mmol),2.334ml的三乙胺(16.5mmol),无水dmf(50ml),腺嘌呤(a)0.7432g(5.5mmol),于三颈圆底烧瓶中。恒温100℃条件下,快速搅拌,冷凝回流24h。向上述反应液中再加入胞嘧啶0.6105g(5.5mmol),继续在恒温100℃条件下快速搅拌,冷凝回流24h。反应完全后静置,冷却到室温后,旋转蒸发除去溶剂,得乳白色固体物质,减压抽滤,依次用乙腈和无水乙醚分别洗涤三次(3×10ml)。于50℃条件下干燥,即得腺嘌呤-二乙三胺五乙酸-胞嘧啶(dtpa-ac)。
2、tbш-dtpa-ac的制备:称取0.7563g(1.25mmol)腺嘌呤-二乙三胺五乙酸-胞嘧啶(dtpa-ac)于三颈圆底烧瓶中,加30ml去离子水溶解。同时称取0.5663g的tb(no3)3·6h2o(1.25mmol)置于烧杯中,加30ml去离子水溶解后转移至圆底烧瓶中,于60℃搅拌加热2h。将反应后的溶液冷却至室温,得到tbш-dtpa-ac。合成过程如图1所示。
(四)检测
1、dtpa、腺嘌呤、胞嘧啶、dtpa-2a、dtpa-2c和dtpa-ac的ft-ir图如图2a,2b,2c,2d,2e,2f所示。与dtpa,腺嘌呤和胞嘧啶的红外光谱相比,dtpa-2a,dtpa-2c和dtpa-ac的红外光谱中相应吸收峰的位置显示出明显的变化。尤其是dtpa-2a,dtpa-2c和dtpa-ac的红外光谱中酰胺键的c=o吸收峰分别出现在1638cm-1,1648cm-1和1638cm-1处。与dtpa中1752cm-1处的羧基c=o的吸收峰相比,它们分别移动114cm-1,104cm-1和114cm-1。另外,dtpa-2a,dtpa-2c和dtpa-ac中酰胺键的nh伸缩振动峰分别出现在3395cm-1和2933cm-1(dtpa-2a),3378cm-1和2928cm-1(dtpa-2c)和3378cm-1和2931cm-1(dtpa-ac)处。与腺嘌呤和胞嘧啶中-nh2的3294cm-1,3117cm-1和3382cm-1,3169cm-1相比,可以看出发生了明显的变化。这些特征峰的移动都说明酰胺键的形成,即三种荧光探针被成功合成。
实施例2用于检测黄嘌呤的荧光探针在检测黄嘌呤中的应用
取一定量的黄嘌呤用去离子水配置成浓度为5.0×10-3mol/l的溶液,作为黄嘌呤储备液。
分别取实施例1制备的tbш-dtpa-2a、tbш-dtpa-2c和tbш-dtpa-ac,用去离子水配置成浓度为5.0×10-3mol/l的tbш-dtpa-2a、tbш-dtpa-2c和tbш-dtpa-ac的储备液。
(一)荧光探针的紫外吸收光谱
1、方法
取9支比色管分为tbш-dtpa-2a组,tbш-dtpa-2c组和tbш-dtpa-ac组共三组,进行紫外吸收光谱检测。
tbш-dtpa-2a组分为:dtpa-2a,tbш-dtpa-2a和tbш-dtpa-2a+黄嘌呤(tbш-dtpa-2a+xanthine);
tbш-dtpa-2c组分为:dtpa-2c,tbш-dtpa-2c和tbш-dtpa-2c+黄嘌呤(tbш-dtpa-2c+xanthine);
tbш-dtpa-ac组分为:dtpa-ac,tbш-dtpa-ac和,tbш-dtpa-ac+黄嘌呤(tbш-dtpa-ac+xanthine);
2、检测
dtpa-2a,dtpa-2c,dtpa-ac,tbш-dtpa-2a,tbш-dtpa-2c,tbш-dtpa-ac和tbш-dtpa-2a+黄嘌呤(tbш-dtpa-2a+xanthine),tbш-dtpa-2c+黄嘌呤(tbш-dtpa-2c+xanthine),tbш-dtpa-ac+黄嘌呤(tbш-dtpa-ac+xanthine)的紫外吸收光谱图如图3a,3b,3c所示。
从图3a中可以看出,tb3+在219nm处具有弱的吸收。合成的dtpa-2a在219nm和264nm处有两个吸收峰。当dtpa-2a与tb3+络合并形成tbiii-dtpa-2a时,219nm和264nm处的两个吸收峰的强度略微增强。然而,再向tbiii-dtpa-2a溶液中加入黄嘌呤后,tbiii-dtpa-2a的两个吸收峰的吸光度显着降低。这表明黄嘌呤的加入可以明显改变tbiii-dtpa-2a的吸收光谱。同时可以推测,加入黄嘌呤后,tbiii-dtpa-2a的荧光光谱会发生很大的变化。表明tbiii-dtpa-2a有作为荧光探针检测黄嘌呤的潜力。
从图3b可以看出,dtpa-2c分别在221nm和270nm处具有两个吸收峰,但吸光度均较弱。当与tb3+络合形成tbiii-dtpa-2c时,与dtpa-2c的吸收光谱相比几乎没有变化。然而,在加入黄嘌呤后,tbiii-dtpa-2c的两个吸收峰明显增强。表明tbiii-dtpa-2c同样有作为荧光探针来检测黄嘌呤的可能。
从图3c可以看出,dtpa-ac和tbiii-dtpa-ac的吸收光谱几乎相同。然而,在将黄嘌呤加入tbiii-dtpa-ac溶液后,其两个吸收峰均明显增加。这也表明tbiii-dtpa-ac具有作为荧光探针检测黄嘌呤的潜力。
(二)荧光探针对黄嘌呤检测的荧光光谱
方法:取9支10ml比色管分为tbш-dtpa-2a组,tbш-dtpa-2c组和tbш-dtpa-ac组共三组。每组第1支加入150μl黄嘌呤储备液。第2支加入50μl浓度为5.0×10-3mol/l的荧光探针储备液。第3支加入50μl浓度为5.0×10-3mol/l的荧光探针储备液和150μl黄嘌呤储备液。然后每支比色管都用去离子水定容至5ml。分别在280nm,330nm,340nm波长光的激发下观察荧光光谱的变化。结果如图4a-1,4a-2,4b-1,4b-2,4c-1和4c-2所示。
从图4a-1中可以看出,在280nm波长光的激发下,tbiii-dtpa-2a在320nm处发射出强荧光,而黄嘌呤在320nm处几乎不发出荧光。当把黄嘌呤加入到tbiii-dtpa-2a溶液中后,tbiii-dtpa-2a的荧光被明显猝灭。图4a-2能更直观的比较320nm处荧光强度的差别。
从图4b-1中可以看出,在330nm波长光的激发下,tbiii-dtpa-2c在372nm处发射出较弱荧光,而黄嘌呤在372nm处也发射出一定的荧光。当把黄嘌呤加入到tbiii-dtpa-2c溶液中后,tbiii-dtpa-2c的荧光强度明显增加。从图4b-2中能更直观的比较372nm处荧光强度的差别。
从图4c-1中可以看出,在340nm波长光的激发下,tbiii-dtpa-ac在381nm处发射出中等强度的荧光,而黄嘌呤在381nm处发射出弱的荧光。当把黄嘌呤加入到tbiii-dtpa-ac溶液中后,tbiii-dtpa-ac的荧光强度略微增加。从图4c-2中可以清楚的看出381nm处荧光强度的差别。
(三)不同共存物质与黄嘌呤混合对荧光探针tbш-dtpa-2a,tbш-dtpa-2c和tbш-dtpa-ac检测的影响
方法:取15支比色管分为tbш-dtpa-2a组,tbш-dtpa-2c组和tbш-dtpa-ac组共三组。每组5支比色管中分别加入1.5ml浓度为5.0×10-4mol/l的马尿酸(hipa),抗坏血酸(aa),组氨酸(his),肌酸酐(cre)和葡萄糖(glucose)溶液。然后tbш-dtpa-2a组每支比色管再分别加50μltbш-dtpa-2a储备液及150μl黄嘌呤储备液,tbш-dtpa-2c组每支比色管分别加50μltbш-dtpa-2c储备液及150μl黄嘌呤储备液,tbш-dtpa-ac组每支比色管分别加50μltbш-dtpa-ac储备液及150μl黄嘌呤储备液。最后分别用去离子水定容至5ml。此时溶液中探针的浓度均为5.0×10-5mol/l,黄嘌呤及其他共存物质溶液的浓度为1.5×10-4mol/l。在280nm,330nm,340nm波长光的激发下观察荧光光谱的变化。结果如图5a,5b,5c和表1-3所示。
从图5a中可以看出,在280nm波长光的激发下,tbш-dtpa-2a溶液在320nm处发出强荧光,当加入黄嘌呤后,tbш-dtpa-2a的荧光明显被猝灭。然而当马尿酸,抗坏血酸,组氨酸,肌酸酐,葡萄糖等共存物质分别加入tbш-dtpa-2a和黄嘌呤的混合溶液中后,除了抗坏血酸之外其他物质几乎不影响混合溶液的荧光。这说明,尿液中除抗坏血酸外其他与黄嘌呤共存的物质不会干扰探针对黄嘌呤的检测。看起来抗坏血酸的存在可能会影响黄嘌呤的检测,但是,事实上,尿液中抗坏血酸的含量与前一两天的饮食有关。也就是说,可以通过控制饮食来减少尿液中抗坏血酸的含量,从而使黄嘌呤的检测不会受到干扰。从表1中可以更加清楚的观察荧光强度的变化。
表1
从图5b中可以看出,在330nm波长光的激发下,tbiii-dtpa-2c溶液在372nm处发射出弱荧光。把黄嘌呤加入到tbiii-dtpa-2c溶液后,tbiii-dtpa-2c的荧光强度明显增加。当分别在tbiii-dtpa-2c+黄嘌呤的混合溶液中进一步加入马尿酸,抗坏血酸,组氨酸,肌酸酐,葡萄糖时,除抗坏血酸之外,其他物质几乎不影响混合溶液的荧光。抗坏血酸使tbiii-dtpa-2c+黄嘌呤混合溶液的荧光强度略微降低,但是在抗坏血酸的存在下tbiii-dtpa-2c+黄嘌呤混合溶液的荧光强度仍然高于tbiii-dtpa-2c。因此可以认为由于黄嘌呤的存在tbiii-dtpa-2c的荧光强度显著增加。从表2中可以更加直观的观察荧光强度的变化。
表2
从图5c中可以看出,在340nm波长光的激发下,tbiii-dtpa-ac在381nm处发射中等强度的荧光。加入黄嘌呤后,tbiii-dtpa-ac的荧光强度略有增加。尽管荧光强度的增加不明显,但仍可以看出加入黄嘌呤前后荧光强度的变化。在tbiii-dtpa-ac+黄嘌呤的混合溶液中进一步加入马尿酸,抗坏血酸,组氨酸,肌酸酐,葡萄糖后,混合溶液的荧光强度几乎没有变化。从表3中可以更清楚的观察荧光强度的变化。
表3
上述实验结果说明,本发明的tbш-dtpa-2a,tbш-dtpa-2c和tbш-dtpa-ac作为荧光探针检测黄嘌呤均有良好的抗干扰能力。
(四)荧光探针tbш-dtpa-2a,tbш-dtpa-2c,tbш-dtpa-ac在实际尿样中检测黄嘌呤
方法:取18支10ml比色管分为tbш-dtpa-2a组,tbш-dtpa-2c组和tbш-dtpa-ac组共三组。每组第1支为空白尿样,第2支加入150μl黄嘌呤储备液,第3支加入50μl荧光探针储备液,第4-6支分别加入50μl荧光探针储备液之后在分别加入50μl,100μl,150μl的黄嘌呤储备液,然后用尿样定容至5ml。分别在280nm,330nm,340nm波长光的激发下观察荧光光谱的变化。结果如图6a,6b,6c所示。
从图6a中可以看出,在280nm波长光的激发下,纯尿液在390nm处发出相对强的荧光。当向尿液中加入黄嘌呤(最终浓度为150μmol/l)时,尿液的荧光强度显著降低。这表明当尿液中含有大量黄嘌呤时,尿液的荧光强度可能会明显降低。但是,这种方法用于判断尿液中是否产生大量黄嘌呤是不准确的。当将tbiii-dtpa-2a加入尿液中(终浓度为50μmol/l)时,它在320nm处发射出强荧光。由于纯尿液的荧光在320nm处较弱,因此认为尿液的荧光不会干扰tbiii-dtpa-2a的荧光。然后,将黄嘌呤逐渐加入到tbiii-dtpa-2a溶液中,随着黄嘌呤浓度的增加,tbiii-dtpa-2a的荧光强度逐渐降低。这表明用tbiii-dtpa-2a作为荧光探针可准确的检测尿液中的黄嘌呤。从表4中可以更加清楚的观察荧光强度的变化。
表4
从图6b中可以看出,在330nm波长的光激发下,纯尿液在372nm处发射出非常弱的荧光。当把黄嘌呤加入到尿液中时(最终浓度为150μmol/l),尿液的荧光强度略微增加。将tbiii-dtpa-2c加入到尿液中后,可以看出tbiii-dtpa-2c在尿液中于372nm处具有明显的荧光发射。然后,进一步向上述溶液中加入黄嘌呤,随着黄嘌呤浓度的增加,tbiii-dtpa-2c的荧光强度也逐渐增加。可以看出,黄嘌呤的存在可以明显增加tbiii-dtpa-2c的荧光强度。同时表明,tbiii-dtpa-2c作为荧光探针也可以准确的检测尿液中的黄嘌呤。更为直观的荧光强度变化可以从表5中观察到。
表5
从图6c中可以看出,在340nm波长光的激发下,纯尿液发射出微弱的荧光。向尿液中加入黄嘌呤(最终浓度为150μmol/l)后,尿液的荧光强度略有增加。将tbiii-dtpa-ac加入尿液中时,在340nm波长的光激发下,tbiii-dtpa-ac在381nm处发出相对强的荧光。进一步加入黄嘌呤,tbiii-dtpa-ac的荧光强度随着黄嘌呤浓度的增加而逐渐增加。这表明,tbiii-dtpa-ac同样可以作为荧光探针用于检测尿液中的黄嘌呤。荧光强度变化可以从表6中看出。
表6
上述实验结果说明,本发明的tbш-dtpa-2a,tbш-dtpa-2c和tbш-dtpa-ac作为荧光探针定量检测黄嘌呤。
- 还没有人留言评论。精彩留言会获得点赞!