一种制备右旋糖酐酶酶制剂的方法与流程
本发明涉及酶制剂制备技术领域,具体涉及一种制备右旋糖酐酶酶制剂的方法。
背景技术:
在蔗糖和白砂糖生产过程中,原料夹带的泥土即空气中细菌是糖汁中微生物主要来源。常见微生物主要由酵母、霉菌和细菌三类。部分微生物能够分泌出蔗糖转化酶,将蔗糖转化成糖酐,其中最严重的是肠膜明串珠菌,大量消耗蔗糖生成右旋糖酐。右旋糖酐是白砂糖酸性絮凝物的主要成分,右旋糖酐粘性高,糖液中含有右旋糖酐会增加糖液粘度,影响煮糖与分离过程,增加后期分离操作成本;同时,右旋糖酐在糖汁中的积累会混淆转光度,造成糖汁的纯度虚假上升,影响生产分析管理;此外,右旋糖酐使蔗糖结晶时生成异常形态的晶体,增加了制糖成本。右旋糖酐导致制糖工艺蔗糖的损失率高达0.07%,所以消除制备工艺中产生的右旋糖酐是制糖工业亟需解决的问题。
右旋糖酐酶属于糖酐水解酶,可以将右旋糖酐水解为低分子糖类,低分子糖类对制糖生产影响甚微。在西印度,添加3个酶活单位的右旋糖酐酶至100ml蔗汁中,在40℃下振荡反应20min,可除去68.5%的右旋糖酐,因此,右旋糖酐酶的加入能够改善蔗糖生产工艺。根据右旋糖酐的水解方式不同,将右旋糖酐酶分为内切右旋糖酐酶和外切右旋糖苷酶两种。外切右旋糖酐酶主要从右旋糖酐酶链的非还原端降解键,释放出葡萄糖。内切右旋糖酐酶主要水解右旋糖酐链内部的α(1-6)键,生成系列中低分子量多糖,大多数内切右旋糖苷酶只有在多个连贯的α-(1-6)葡萄糖苷键存在时才能发挥其催化作用,但也有不需要多个连贯的α-(1-6)葡萄糖苷键存在既能够发挥水解作用的内切右旋糖苷酶,例如wynter等报道的一株厌氧嗜热细菌rt364,它产生的右旋糖苷酶能水解淀粉中单一的α-(1-6)葡萄糖苷键。
由于右旋糖苷酶降解右旋糖酐的高效性,开发一种安全来源的右旋糖苷酶成为近年来的研究热点。
技术实现要素:
(一)解决的技术问题
针对现有技术的不足,本发明提供了一种制备右旋糖酐酶酶制剂的方法,制备出高活性右旋糖酐酶酶制剂,作为蔗糖生产工业添加剂。
(二)技术方案
为实现以上目的,本发明通过以下技术方案予以实现:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸30-45min,滤去红薯块,得到滤液补足至1.5l,向红薯滤液中添加碳源、氮源、铁源、磷源、镁源和钾源,调节初始ph值为5.0-6.0,然后将产生右旋糖酐酶的菌株接种到该液态培养基中,将接种后的液态培养基置于28℃恒温培养箱中培养20-30h;
(2)发酵培养:配制发酵培养基,具体操作如步骤(1)制备红薯滤液,加入氮源、碳源、磷源、铁源、镁源和钾源,将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的2-4%;调节初始ph值为5.0-6.0,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为85-100h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机离心分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液;
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5h,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
优选地,上述步骤(1)中氮源加入量为红薯滤液质量的0.75%,碳源加入量为红薯滤液质量的1.53%,磷源加入量为红薯滤液质量的0.06%,镁源加入量为红薯滤液质量的0.011%,铁源加入量为红薯滤液质量的0.0005%,钾源加入量为红薯滤液质量的0.03%;上述步骤(2)中氮源加入量为红薯滤液质量的1.2%,碳源加入量为红薯滤液质量的2.67%,磷源加入量为红薯滤液质量的0.13%,镁源加入量为红薯滤液质量的0.021%,铁源加入量为红薯滤液质量的0.0011%,钾源加入量为红薯滤液质量的0.06%。
优选地,上述氮源为酵母膏,所述碳源为葡萄糖,上述磷源为磷酸二氢钾,上述镁源为硫酸镁,所述铁源为硫酸铁,上述钾源为氯化钾。
优选地,上述菌种为细丽毛壳经诱变筛选的高产菌株。
优选地,上述步骤(1)中菌种接种量为种子液态培养基质量的1-3%;上述步骤(2)中接种量为发酵培养基体积分数的2-4%。
优选地,上述步骤(4)中离心力为6000-7000g,离心操作时间为15-25min。
(三)有益效果
本发明提供了一种制备右旋糖酐酶酶制剂的方法。该方法经过细丽毛壳经诱变筛选的高产菌株作为右旋糖酐酶发酵菌,通过菌种培养、发酵、离心和提纯制备出活性为20000-50000u/g的右旋糖酐酶酶制剂。本发明对细丽毛壳菌菌种培养基和发酵培养基氮源、碳源、磷源、铁源、镁源和钾源的物质种类和用量进行优选,对初始ph值进行优选,对菌种和发酵时间进行优选,得出活性最佳的细丽毛壳菌种;通过对分离和提纯工艺进行优选,最终得到活性非常高的右旋糖酐酶酶制剂。
附图说明
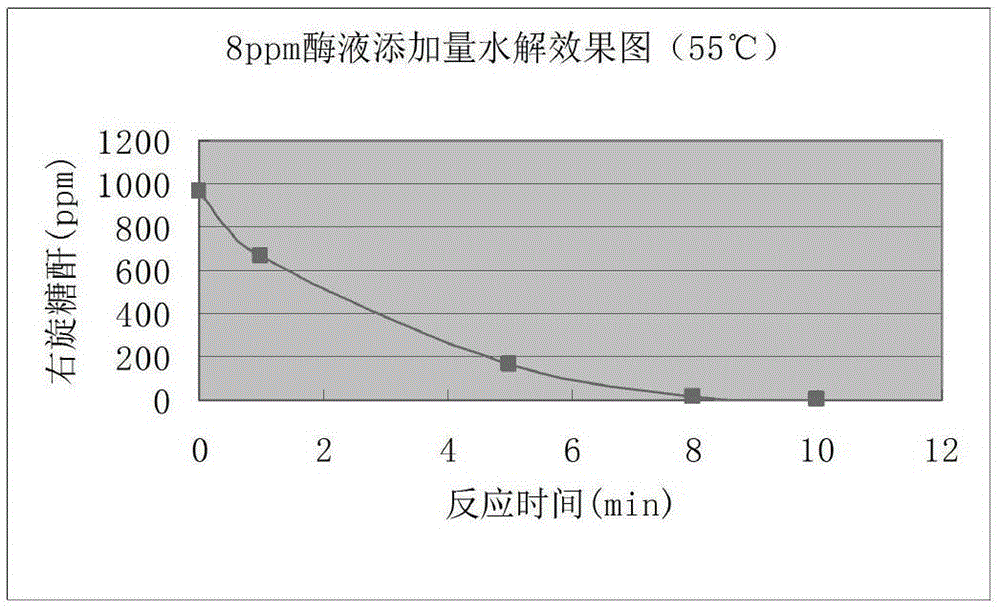
图1为右旋糖酐酶酶制剂水解效果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸35min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为5.5;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的2%;将接种后的液态培养基置于28℃恒温培养箱中培养20h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的2%;调节初始ph值为5.0,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为85h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6000g,离心操作时间为15min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为35654u/g。将酶制剂稀释至酶活力为10000u/g,在含有1000ppm右旋糖酐浓度的蔗汁中,添加10ppm酶液,其水解情况如说明书附图中图1所示。
实施例2:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸45min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为6.0;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的3%;将接种后的液态培养基置于28℃恒温培养箱中培养30h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的4%;调节初始ph值为5.0,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为100h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为7000g,离心操作时间为25min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为8%,加样体积为15ml,电流为32ma,在ph为7.0时电泳5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为45346u/g。
实施例3:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸35min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为6.5;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的2%;将接种后的液态培养基置于28℃恒温培养箱中培养22h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的3%;调节初始ph值为5.5,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为90h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6200g,离心操作时间为20min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为29876u/g。
实施例4:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸40min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为5.5;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的2%;将接种后的液态培养基置于28℃恒温培养箱中培养24h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的3%;调节初始ph值为5.5,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为95h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6400g,离心操作时间为20min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为28769u/g。
实施例5:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸40min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为5.0;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的2%;将接种后的液态培养基置于28℃恒温培养箱中培养26h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的3%;调节初始ph值为5.5,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为90h;接种量为发酵培养基体积分数3%。
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6800g,离心操作时间为20min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为7%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为46783u/g。
实施例6:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸38min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为6.0;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的1%;将接种后的液态培养基置于28℃恒温培养箱中培养30h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的2%;调节初始ph值为6.0,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为100h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6900g,离心操作时间为20min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为47238u/g。
实施例7:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸40min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为5.5;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的1%;将接种后的液态培养基置于28℃恒温培养箱中培养28h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的4%;调节初始ph值为5.5,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为98h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6100g,离心操作时间为18min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为27684u/g。
实施例8:
一种制备右旋糖酐酶酶制剂的方法,所述方法包括以下步骤:
(1)菌种培养:配制种子液态培养基,具体操作为选取250g红薯,去皮洗净,切成1-3cm方块,加水1.5l,水开后继续煮沸42min,滤去红薯块,得到滤液补足至1.5l;向红薯滤液中添加葡萄糖、酵母膏、硫酸铁、磷酸二氢钾、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的0.75%,葡萄糖加入量为红薯滤液质量的1.53%,磷酸二氢钾加入量为红薯滤液质量的0.06%,硫酸镁加入量为红薯滤液质量的0.011%,硫酸铁加入量为红薯滤液质量的0.0005%,氯化钾加入量为红薯滤液质量的0.03%;调节初始ph值为5.0;然后将细丽毛壳经诱变筛选的高产菌株接种到该液态培养基中,接种量为种子液态培养基质量的2%;将接种后的液态培养基置于28℃恒温培养箱中培养20-30h。
(2)发酵培养:配制发酵培养基,具体操作为如步骤(1)制备红薯滤液,加入酵母膏、葡萄糖、磷酸二氢钾、硫酸铁、硫酸镁和氯化钾,酵母膏加入量为红薯滤液质量的1.2%,葡萄糖加入量为红薯滤液质量的2.67%,磷酸二氢钾加入量为红薯滤液质量的0.13%,硫酸镁加入量为红薯滤液质量的0.021%,硫酸铁加入量为红薯滤液质量的0.0011%,氯化钾加入量为红薯滤液质量的0.06%;将步骤(1)中制备的含有菌种的液态培养基混合液加入发酵培养基进行接种,接种量为发酵培养基液体体积分数的3%;调节初始ph值为5.5,然后置于28℃,转速为200r/min的恒温摇床中进行培养,培养时间为98h;
(3)粗酶液分离:将微生物发酵液采用转鼓式真空吸滤机在离心力为6900g,离心操作时间为20min进行分离,除去菌体,得到富含右旋糖酐酶的上清液作为粗酶液。
(4)酶制剂纯化:采用聚丙烯酰胺凝胶电泳法对步骤(4)制备出的粗酶液进行提纯,具体操作为用除脂板框电泳仪制备一定尺寸的凝胶板,胶浓度为6-8%,加样体积为10-15ml,电流为24-32ma,在ph为7.0时电泳4-5小时,从凝胶板两侧各切下3mm的胶条,立即置于0.1%的考马斯亮蓝g250溶液中染色,待蓝色区带出现后,将胶条用去离子水冲洗干净放回原位,将凝胶板上剩余部分切下来,用4ml蒸馏水在4℃抽提,静置一夜后过滤除去凝胶,洗涤后常温干燥,得到右旋糖酐酶酶制剂,将右旋糖酐酶酶制剂存放于4-5℃冷藏保存。
将制备出的右旋酐酶酶制剂活性为43562u/g。
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!