含氮环状化合物和包含其的色彩转换膜的制作方法
本申请要求于2017年11月10日向韩国知识产权局提交的韩国专利申请第10-2017-0149750号的优先权和权益,其全部内容通过引用并入本文。
本说明书涉及含氮环状化合物以及包含其的色彩转换膜、背光单元和显示器件。
背景技术:
现有的发光二极管(led)是通过将绿色磷光体和红色磷光体与蓝色发光二极管混合或者将黄色磷光体和蓝-绿色磷光体与发射紫外光的发光二极管混合而获得的。然而,在该方法中,难以控制色彩,并因此显色性不好。因此,色域劣化。
为了克服色域劣化并降低生产成本,近来尝试了通过使用产生膜形式的量子点并将其与蓝色led结合的方法来实现绿色和红色的方法。然而,基于镉的量子点具有安全性问题,而其他量子点的效率比基于镉的量子点的效率低得多。此外,量子点对氧和水具有低的稳定性,并且具有在量子点聚集时其性能显著劣化的缺点。此外,在生产量子点时,难以恒定地保持其尺寸,因此生产成本高。
技术实现要素:
技术问题
本说明书提供了含氮化合物以及包含其的色彩转换膜、背光单元和显示器件。
技术方案
本说明书的一个示例性实施方案提供了由下式1表示的化合物。
[式1]
在式1中,
p为2或更大的整数,以及括号中的结构彼此相同或不同,
l1和l2彼此相同或不同,并且各自独立地为直接键;-sir101r102-;-so2-;-o-;-nr103-;-c(=o)o-;经取代或未经取代的亚烷基;经取代或未经取代的亚环烷基;经取代或未经取代的亚芳基;或者经取代或未经取代的二价杂环基,
r1和r2彼此相同或不同,并且各自独立地为氢;氘;卤素基团;氰基;硝基;羰基;羧基(-cooh);醚基;羟基;-c(=o)nr104r105;-c(=o)or106;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的芳氧基;经取代或未经取代的烯基;经取代或未经取代的胺基;经取代或未经取代的烷基胺基;经取代或未经取代的芳基胺基;经取代或未经取代的芳基;经取代或未经取代的卤代烷基;经取代或未经取代的甲硅烷基;或者经取代或未经取代的杂环基,或者相邻基团可以彼此键合以形成环,
m为0至6的整数,并且当m为2或更大时,r1彼此相同或不同,
n为0至3的整数,并且当n为2或更大时,r2彼此相同或不同,
r101至r107彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的烷基;经取代或未经取代的氟烷基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,以及
x1和x2彼此相同或不同,并且各自独立地为卤素基团;氰基;经取代或未经取代的烷基;经取代或未经取代的炔基;经取代或未经取代的烷氧基;经取代或未经取代的醚基;经取代或未经取代的-c(=o)or107;经取代或未经取代的芳基;经取代或未经取代的芳氧基;或者经取代或未经取代的芳烷基。
本说明书的另一个示例性实施方案提供了色彩转换膜,其包含:树脂基体;和分散在树脂基体中的由式1表示的化合物。
本说明书的又一个示例性实施方案提供了包括色彩转换膜的背光单元。
本说明书的再一个示例性实施方案提供了包括背光单元的显示器件。
有益效果
根据本说明书的一个示例性实施方案的化合物比相关技术中具有氮杂-bodipy结构的化合物具有更好的可加工性和耐光性。因此,通过使用本说明书中所述的化合物作为色彩转换膜的荧光材料,可以提供具有优异的亮度和色域以及优异的耐光性的色彩转换膜。
附图说明
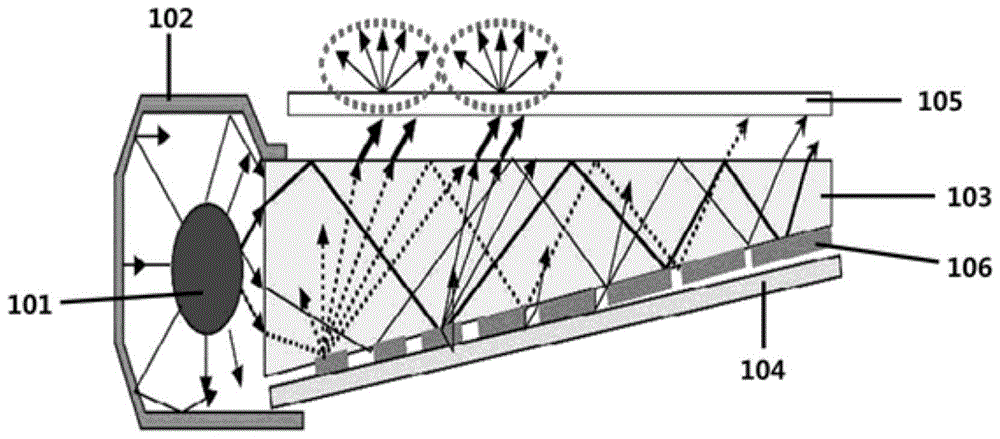
图1是将根据本说明书的一个示例性实施方案的色彩转换膜应用于背光的示意图。
101:侧链型光源
102:反射板
103:导光板
104:反射层
105:色彩转换膜
106:光散射图案
具体实施方式
下文中,将更详细地描述本申请。
本说明书的一个示例性实施方案提供了由化学式1表示的化合物。
在本说明书中,当一部分“包括”一个构成要素时,除非另有具体描述,否则这并不意指排除另外的构成要素,而是意指还可以包括另外的构成要素。
在本说明书中,当一个构件设置在另一构件“上”时,这不仅包括一个构件与另一构件接触的情况,而且还包括在这两个构件之间存在又一构件的情况。
以下将描述本说明书中的取代基的实例,但不限于此。
术语“取代”意指与化合物的碳原子键合的氢原子变为另一个取代基,并且取代位置没有限制,只要该位置是氢原子被取代的位置(即,取代基可以取代的位置)即可,并且当两个或更多个被取代时,两个或更多个取代基可以彼此相同或不同。
在本说明书中,术语“经取代或未经取代的”意指被选自以下的一个或两个或更多个取代基取代:氘;卤素基团;氰基;硝基;羰基;羧基(-cooh);醚基;酯基;羟基;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的芳氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的芳基;和经取代或未经取代的杂环基,或者被以上例示的取代基中的两个或更多个取代基连接的取代基取代,或者没有取代基。例如,“两个或更多个取代基连接的取代基”可为联苯基。即,联苯基也可以是芳基,并且可以被解释为两个苯基连接的取代基。
在本说明书中,
在本说明书中,卤素基团的实例可以为氟、氯、溴或碘。
在本说明书中,羰基的碳原子数没有特别限制,但是优选为1至30。
在本说明书中,对于醚基,醚的氧可以被具有1至25个碳原子的直链、支链或环状烷基;或者具有6至30个碳原子的单环或多环芳基取代。
在本说明书中,对于酯基,酯基的氧可以被具有1至25个碳原子的直链、支链或环状烷基;或者具有6至30个碳原子的单环或多环芳基取代。
在本说明书中,烷基可以为直链的或支链的,并且其碳原子数没有特别限制,但优选为1至30。其具体实例包括甲基、乙基、丙基、正丙基、异丙基、丁基、正丁基、异丁基、叔丁基、仲丁基、1-甲基-丁基、1-乙基-丁基、戊基、正戊基、异戊基、新戊基、叔戊基、己基、正己基、1-甲基戊基、2-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、庚基、正庚基、1-甲基己基、环戊基甲基、环己基甲基、辛基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、1-乙基-丙基、1,1-二甲基-丙基、异己基、2-甲基戊基、4-甲基己基、5-甲基己基等,但不限于此。
在本说明书中,环烷基没有特别限制,但优选具有3至30个碳原子,并且其具体实例包括环丙基、环丁基、环戊基、3-甲基环戊基、2,3-二甲基环戊基、环己基、3-甲基环己基、4-甲基环己基、2,3-二甲基环己基、3,4,5-三甲基环己基、4-叔丁基环己基、环庚基、环辛基等,但不限于此。
在本说明书中,烷氧基可以为直链、支链或环状的。烷氧基的碳原子数没有特别限制,但优选为1至30。其具体实例包括甲氧基、乙氧基、正丙氧基、异丙氧基(isopropoxy)、异丙基氧基(i-propyloxy)、正丁氧基、异丁氧基、叔丁氧基、仲丁氧基、正戊氧基、新戊氧基、异戊氧基、正己氧基、3,3-二甲基丁氧基、2-乙基丁氧基、正辛氧基、正壬氧基、正癸氧基、苄氧基、对甲基苄氧基等,但不限于此。
在本说明书中,烯基可以为直链或支链的,并且其碳原子数没有特别限制,但优选为2至30。其具体实例包括乙烯基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、3-甲基-1-丁烯基、1,3-丁二烯基、烯丙基、1-苯基乙烯基-1-基、2-苯基乙烯基-1-基、2,2-二苯基乙烯基-1-基、2-苯基-2-(萘基-1-基)乙烯基-1-基、2,2-双(二苯基-1-基)乙烯基-1-基、茋基、苯乙烯基等,但不限于此。
在本说明书中,胺基可以选自-nh2、单烷基胺基、二烷基胺基、n-烷基芳基胺基、单芳基胺基、二芳基胺基、n-芳基杂芳基胺基、n-烷基杂芳基胺基、单杂芳基胺基和二杂芳基胺基,并且其碳原子数没有特别限制,但优选为1至30。胺基的具体实例包括甲基胺基、二甲基胺基、乙基胺基、二乙基胺基、苯基胺基、萘基胺基、联苯基胺基、蒽基胺基、9-甲基-蒽基胺基、二苯基胺基、二甲苯基胺基、n-苯基甲苯基胺基、三苯基胺基、n-苯基联苯基胺基、n-苯基萘基胺基、n-联苯基萘基胺基、n-萘基芴基胺基、n-苯基菲基胺基、n-联苯基菲基胺基、n-苯基芴基胺基、n-苯基三联苯基胺基、n-菲基芴基胺基、n-联苯基芴基胺基等,但不限于此。
在本说明书中,甲硅烷基的具体实例包括三甲基甲硅烷基、三乙基甲硅烷基、叔丁基二甲基甲硅烷基、乙烯基二甲基甲硅烷基、丙基二甲基甲硅烷基、三苯基甲硅烷基、二苯基甲硅烷基、苯基甲硅烷基等,但不限于此。
在本说明书中,芳基没有特别限制,但优选具有6至30个碳原子,并且芳基可以为单环或多环的。
当芳基为单环芳基时,其碳原子数没有特别限制,但优选为6至30。单环芳基的具体实例包括苯基、联苯基、三联苯基等,但不限于此。
当芳基为多环芳基时,其碳原子数没有特别限制,但优选为10至30。多环芳基的具体实例包括萘基、蒽基、菲基、三苯基、芘基、苝基、
在本说明书中,芴基可以被取代,并且相邻取代基可以彼此键合以形成环。
当芴基被取代时,取代基可以为
在本说明书中,芳氧基的芳基与芳基的上述实例相同。具体地,芳氧基的实例包括苯氧基、对甲苯氧基、间甲苯氧基、3,5-二甲基-苯氧基、2,4,6-三甲基苯氧基、对叔丁基苯氧基、3-联苯氧基、4-联苯氧基、1-萘氧基、2-萘氧基、4-甲基-1-萘氧基、5-甲基-2-萘氧基、1-蒽氧基、2-蒽氧基、9-蒽氧基、1-菲氧基、3-菲氧基、9-菲氧基等,芳基硫基的实例包括苯基硫基、2-甲基苯基硫基、4-叔丁基苯基硫基等,芳基磺酰基的实例包括苯磺酰基、对甲苯磺酰基等,但实例不限于此。
在本说明书中,杂环基包含一个或更多个除碳之外的原子,即一个或更多个杂原子,具体地,杂原子可以包括选自o、n、se、s等中的一个或更多个原子。其碳原子数没有特别限制,但优选为2至30,并且杂芳基可以为单环或多环的。杂环基的实例包括噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、
在本说明书中,杂环基可以为单环或多环的,可以为芳族环、脂族环、或者芳族环和脂族环的稠环,并且可以选自杂环基的实例。
在本说明书中,“相邻”基团可以意指对与相应取代基所取代的原子直接连接的原子进行取代的取代基、空间上最接近相应取代基布置的取代基、或者对相应取代基所取代的原子进行取代的另一取代基。例如,在苯环的邻位上取代的两个取代基和脂族环中取代同一个碳的两个取代基可理解为彼此“相邻”的基团。
在本说明书中,取代基中的“相邻基团彼此键合以形成环”意指取代基与相邻基团键合而形成经取代或未经取代的烃环;或者经取代或未经取代的杂环。
在本说明书的一个示例性实施方案中,式1由下式2至11中的任一者表示。
[式2]
[式3]
[式4]
[式5]
[式6]
[式7]
[式8]
[式9]
[式10]
[式11]
在式2至11中,
l11和l12与式1的l1的限定相同,
l22与式1的l2的限定相同,
r11、r12、r21和r22的限定与式1的r1和r2的限定相同,
m1和m2的限定与式1的m的限定相同,
n1和n2的限定与式1的n的限定相同,以及
x11至x14的限定与式1的x1和x2的限定相同。
在本说明书的一个示例性实施方案中,l1和l2彼此相同或不同,并且各自独立地为直接键;-sir101r102-;-so2-;-o-;-nr103-;-c(=o)o-;经取代或未经取代的具有1至20个碳原子的亚烷基;经取代或未经取代的具有3至20个碳原子的亚环烷基;经取代或未经取代的具有6至30个碳原子的亚芳基;或者经取代或未经取代的具有2至30个碳原子的二价杂环基。
在本说明书的一个示例性实施方案中,l1和l2彼此相同或不同,并且各自独立地为直接键;-sir101r102-;-so2-;-o-;-nr103-;-c(=o)o-;经取代或未经取代的亚甲基;经取代或未经取代的亚乙基;经取代或未经取代的亚丙基;经取代或未经取代的亚丁基;经取代或未经取代的亚戊基;经取代或未经取代的亚环己基;经取代或未经取代的亚苯基;经取代或未经取代的亚联苯基;经取代或未经取代的亚萘基;经取代或未经取代的亚蒽基;经取代或未经取代的亚菲基;经取代或未经取代的亚芘基;经取代或未经取代的亚芴基;经取代或未经取代的亚螺二芴基;经取代或未经取代的亚吡啶基;经取代或未经取代的亚嘧啶基;经取代或未经取代的亚吡咯基;经取代或未经取代的亚呋喃基;经取代或未经取代的亚噻吩基;经取代或未经取代的亚
在本说明书的一个示例性实施方案中,l1和l2彼此相同或不同,并且各自独立地为直接键;-sir101r102-;-so2-;-o-;-nr103-;-c(=o)o-;经苯基取代的亚甲基;亚乙基;亚丙基;亚丁基;亚戊基;亚环己基;未经取代或者经卤素基团、羧基、烷氧基、氰基或氟烷基取代的亚苯基;亚萘基;未经取代或经芳基取代的亚蒽基;亚菲基;亚芘基;未经取代或者经烷基、芳基或烷基芳基取代的亚芴基;亚螺二芴基;亚吡啶基;亚吡咯基;亚呋喃基;亚噻吩基;亚
在本说明书的一个示例性实施方案中,l1和l2彼此相同或不同,并且各自独立地为直接键;-sir101r102-;-so2-;-o-;-nr103-;-c(=o)o-;经苯基取代的亚甲基;亚乙基;亚丙基;亚丁基;亚戊基;亚环己基;未经取代或者经氟、羧基、甲氧基或氰基取代的亚苯基;亚萘基;未经取代或经苯基取代的亚蒽基;亚菲基;亚芘基;未经取代或者经甲基、己基、辛基、苯基或丁基苯基取代的亚芴基;亚螺二芴基;亚吡啶基;亚吡咯基;亚呋喃基;亚噻吩基;亚
在本说明书的一个示例性实施方案中,r101至r103彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至20个碳原子的烷基;或者经取代或未经取代的具有6至30个碳原子的芳基。
在本说明书的一个示例性实施方案中,r101至r103彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的具有1至5个碳原子的烷基;或者经取代或未经取代的具有6至20个碳原子的芳基。
在本说明书的一个示例性实施方案中,r101至r103彼此相同或不同,并且各自独立地为氢;氘;经取代或未经取代的甲基;或者经取代或未经取代的苯基。
在本说明书的一个示例性实施方案中,r101至r103彼此相同或不同,并且各自独立地为氢;氘;甲基;或者苯基。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为卤素基团;氰基;醚基;-c(=o)or107;经取代或未经取代的烷基;经取代或未经取代的炔基;经取代或未经取代的烷氧基;经取代或未经取代的芳氧基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,或者x1和x2彼此键合而形成经取代或未经取代的环。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为卤素基团;氰基;醚基;-c(=o)or107;经取代或未经取代的具有1至20个碳原子的烷基;经取代或未经取代的具有2至20个碳原子的炔基;经取代或未经取代的具有1至20个碳原子的烷氧基;经取代或未经取代的具有6至30个碳原子的芳氧基;经取代或未经取代的具有6至30个碳原子的芳基;或者经取代或未经取代的具有2至30个碳原子的杂环基,或者x1和x2彼此键合而形成经取代或未经取代的具有3至30个碳原子的环。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为卤素基团;氰基;经取代或未经取代的具有6至30个碳原子的芳氧基;经取代或未经取代的具有1至20个碳原子的烷氧基;经取代或未经取代的具有6至30个碳原子的芳基;经取代或未经取代的具有2至20个碳原子的炔基;或-c(=o)or107,r107为氢;氘;经取代或未经取代的具有1至20个碳原子的烷基;或者经取代或未经取代的具有1至20个碳原子的氟烷基。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为卤素基团;氰基;经取代或未经取代的芳氧基;经取代或未经取代的烷氧基;经取代或未经取代的芳基;经取代或未经取代的炔基;或-c(=o)or107,r107为氢;氘;烷基;或者氟烷基。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为氟;氯;氰基;经取代或未经取代的苯氧基;经取代或未经取代的苯基;或-c(=o)or107,r107为氢;氘;烷基;或者氟烷基。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为氟;氯;氰基;未经取代或经硝基取代的苯氧基;苯基;或者-c(=o)or107,r107为三氟甲基。
在本说明书的一个示例性实施方案中,x1和x2彼此相同或不同,并且各自独立地为氟;氯;氰基;经硝基取代的苯氧基;苯基;或者-c(=o)or107,r107为三氟甲基。
在本说明书的一个示例性实施方案中,p为2。
在本说明书的一个示例性实施方案中,n为0或1。
在本说明书的一个示例性实施方案中,n为0。
在本说明书的一个示例性实施方案中,m为0、1或2。
在本说明书的一个示例性实施方案中,r1为氢;氘;卤素基团;氰基;硝基;羰基;羧基(-cooh);醚基;羟基;-c(=o)nr104r105;-c(=o)or106;经取代或未经取代的烷基;经取代或未经取代的环烷基;经取代或未经取代的烷氧基;经取代或未经取代的芳氧基;经取代或未经取代的烯基;经取代或未经取代的甲硅烷基;经取代或未经取代的胺基;经取代或未经取代的烷基胺基;经取代或未经取代的芳基胺基;经取代或未经取代的芳基;或者经取代或未经取代的杂环基,或者相邻基团可以彼此键合以形成环。
在本说明书的一个示例性实施方案中,r1和r2彼此相同或不同,并且各自独立地为氢;氘;氟;羧基;羟基;氰基;-c(=o)nr104r105;-c(=o)or106;经取代或未经取代的芳氧基;经取代或未经取代的胺基;经取代或未经取代的芳基胺基;经取代或未经取代的芳基;经取代或未经取代的烷基;经取代或未经取代的甲硅烷基;经取代或未经取代的烷氧基;或者经取代或未经取代的杂环基。
在本说明书的一个示例性实施方案中,r1和r2彼此相同或不同,并且各自独立地为氢;氘;氟;羧基;羟基;氰基;-c(=o)nr104r105;-c(=o)or106;经取代或未经取代的苯氧基;经取代或未经取代的丁基胺基;经取代或未经取代的二苯基胺基;经取代或未经取代的苯基;经取代或未经取代的萘基;经取代或未经取代的蒽基;经取代或未经取代的芘基;经取代或未经取代的联吡啶基;经取代或未经取代的咔唑基;经取代或未经取代的三氟甲基;经取代或未经取代的甲基;经取代或未经取代的甲硅烷基;经取代或未经取代的芴基;未经取代或者被经取代或未经取代的螺二芴基取代的乙氧基;经取代或未经取代的吲哚基;经取代或未经取代的三氮杂茚基;经取代或未经取代的三唑基;经取代或未经取代的二氢吖啶基;经取代或未经取代的呫吨基;或者经取代或未经取代的二氢蒽基。
在本说明书的一个示例性实施方案中,r1和r2彼此相同或不同,并且各自独立地为氢;氘;氟;羧基;羟基;氰基;-c(=o)nr104r105;-c(=o)or106;苯氧基;丁基胺基;二苯基胺基;未经取代或者经卤素基团、羧基、芳基烷基、烷基、氟烷基或杂环基取代的苯基;萘基;蒽基;芘基;联吡啶基;未经取代或经烷基取代的咔唑基;三氟甲基;未经取代或经芳基取代的甲基;未经取代或者经烷基或芳基取代的甲硅烷基;未经取代或者经烷基或芳基取代的芴基;螺二芴基;未经取代或经杂环基取代的乙氧基;未经取代或经羧基取代的吲哚基;三氮杂茚基;经芳基取代的三唑基;未经取代或经烷基取代的二氢吖啶基;未经取代或经烷基取代的呫吨基;或者未经取代或经烷基取代的二氢蒽基。
在本说明书的一个示例性实施方案中,r1和r2彼此相同或不同,并且各自独立地为氢;氘;氟;羧基;羟基;氰基;-c(=o)nr104r105;-c(=o)or106;苯氧基;丁基胺基;二苯基胺基;未经取代或者经氟基、苯乙基、羧基、咔唑基、丁基或三氟甲基取代的苯基;萘基;蒽基;芘基;联吡啶基;未经取代或经丁基取代的咔唑基;三氟甲基;四苯基甲基;四苯基甲硅烷基;三苯基甲硅烷基;二甲基芴基;螺二芴基;经咔唑基取代的乙氧基;未经取代或经羧基取代的吲哚基;三氮杂茚基;经苯基取代的三唑基;二甲基二氢吖啶基;二甲基呫吨基;或者四甲基二氢蒽基。
在本说明书的一个示例性实施方案中,r104和r106彼此相同或不同,并且各自独立地为氢、或者经取代或未经取代的芳基。
在本说明书的一个示例性实施方案中,r104至r106彼此相同或不同,并且各自独立地为氢、或者经取代或未经取代的具有1至20个碳原子的烷基。
在本说明书的一个示例性实施方案中,r104至r106彼此相同或不同,并且各自独立地为氢、经取代或未经取代的甲基、经取代或未经取代的乙基、经取代或未经取代的丙基、或者经取代或未经取代的丁基。
在本说明书的一个示例性实施方案中,r104至r106彼此相同或不同,并且各自独立地为氢、甲基、乙基、丙基、或者丁基。
在本说明书的一个示例性实施方案中,r104至r106彼此相同或不同,并且各自独立地为氢;丙基;或者丁基。
在本说明书的一个示例性实施方案中,式1由以下结构式表示。
根据本说明书的一个示例性实施方案的化合物可以通过下面将描述的制备方法来制备。
例如,式1的化合物的核心结构可以如以下反应式1中来制备。取代基可以通过本领域已知的方法键合,并且取代基的种类和位置或取代基的数量可以根据本领域已知的技术来改变。
[反应式1]
在反应式1中,
r1、r2、x1和x2与式1的限定相同。
[反应式2]
在反应式2中,
l与式1中的l1和l2的限定相同,
r11、r12、r21和r22与式1中的r1和r2的限定相同,
x1和x2与式1中的l1和l2的限定相同,
n1、n2、m1和m2与式1中的n和m的限定相同。
本说明书的一个示例性实施方案提供了色彩转换膜,其包含:树脂基体;和分散在树脂基体中的由式1表示的化合物。
色彩转换膜中由式1表示的化合物的含量可以在0.001重量%至10重量%的范围内。
色彩转换膜可以包含由式1表示的化合物中的一者或两者或更多者。
除由式1表示的化合物以外,色彩转换膜还可以包含另外的荧光材料。当使用发射蓝光的光源时,优选色彩转换膜包含发射绿光的荧光材料和发射红光的荧光材料二者。此外,当使用发射蓝光和绿光的光源时,色彩转换膜可以仅包含发射红光的荧光材料。然而,色彩转换膜不限于此,并且即使在使用发射蓝光的光源时,在堆叠有包含发射绿光的荧光材料的单独膜的情况下,色彩转换膜也可以仅包含发射红光的化合物。相反地,即使在使用发射蓝光的光源时,在堆叠有包含发射红光的荧光材料的单独膜的情况下,色彩转换膜也可以仅包含发射绿光的化合物。
色彩转换膜还可以包含树脂基体;和附加层,所述附加层包含分散在树脂基体中并发射波长与由式1表示的化合物的波长不同的光的化合物。发射波长与由式1表示的化合物的波长不同的光的化合物也可以为如式1表示的化合物,也可以为另一公知的荧光材料。
优选用于树脂基体的材料为热塑性聚合物或热固性聚合物。具体地,作为用于树脂基体的材料,可以使用聚(甲基)丙烯酸类材料如聚甲基丙烯酸甲酯(pmma)、基于聚碳酸酯(pc)的材料、基于聚苯乙烯(ps)的材料、基于聚亚芳基(par)的材料、基于聚氨酯(pu)的材料、基于苯乙烯-丙烯腈(san)的材料、基于聚偏二氟乙烯(pvdf)的材料、基于改性聚偏二氟乙烯(改性pvdf)的材料等。
根据本说明书的一个示例性实施方案,根据上述示例性实施方案的色彩转换膜另外包含光扩散颗粒。通过使光扩散颗粒分散在色彩转换膜中来代替相关技术中使用的光扩散膜以提高亮度,与使用单独的光扩散膜的情况相比,可以省略附接过程并且可以表现出更高的亮度。
作为光扩散颗粒,可以使用折射率高于树脂基体的颗粒,并且可以使用例如tio2;二氧化硅;硼硅酸盐;氧化铝;蓝宝石;空气或其他气体;填充有空气或气体的中空珠或颗粒(例如,填充有空气/气体的玻璃或聚合物);聚合物颗粒,包括聚苯乙烯、聚碳酸酯、聚甲基丙烯酸甲酯、丙烯酸树脂(acryl)、甲基丙烯酸甲酯、苯乙烯、三聚氰胺树脂、甲醛树脂、或三聚氰胺和甲醛树脂;或者其任意适当的组合。
光扩散颗粒的粒径可以在0.1μm至5μm的范围内,例如在0.3μm至1μm的范围内。光扩散颗粒的含量可以根据需要来确定,并且基于100重量份树脂基体,可以例如在约1重量份至约30重量份的范围内。
根据上述示例性实施方案的色彩转换膜的厚度可以为2μm至200μm。特别地,色彩转换膜即使在2μm至20μm的小厚度下也可以表现出高亮度。这是因为单位体积内包含的荧光材料分子的含量高于量子点的含量。
可以在根据上述示例性实施方案的色彩转换膜的一个表面上设置基材。在制备色彩转换膜时,基材可以起支撑物的作用。基材的种类没有特别限制,并且基材的材料或厚度没有限制,只要基材是透明的并且可以起支撑物的作用即可。在此,透明意指可见光的透射率为70%或更大。例如,作为基材,可以使用pet膜。
上述色彩转换膜可以通过以下来制备:将其中溶解有上述由式1表示的化合物的树脂溶液涂覆在基材上并干燥树脂溶液,或者将上述由式1表示的化合物与树脂一起挤出以生产膜。
由于上述由式1表示的化合物溶解在树脂溶液中,故由式1表示的化合物均匀地分布在溶液中。这与需要单独的分散过程的量子点膜制备方法不同。
其中溶解有由式1表示的化合物的树脂溶液的制备方法没有特别限制,只要上述由式1表示的化合物处于其中树脂溶解在溶液中的状态即可。
根据一个实例,其中溶解有由式1表示的化合物的树脂溶液可以通过包括以下的方法来制备:将由式1表示的化合物溶解在溶剂中以制备第一溶液,将树脂溶解在溶剂中以制备第二溶液,以及将第一溶液与第二溶液混合。当将第一溶液和第二溶液混合时,优选均匀地混合所述溶液。然而,所述方法不限于此,并且可以使用将由式1表示的化合物和树脂同时添加到溶剂中以溶解化合物和树脂的方法;将由式1表示的化合物溶解在溶剂中并随后向其中添加树脂以溶解树脂的方法;将树脂溶解在溶剂中并随后向其中添加由式1表示的化合物以溶解化合物的方法;等等。
作为溶液中包含的树脂,可以使用上述树脂基体材料、可通过树脂基体材料固化的单体、或其混合物。可通过树脂基体材料固化的单体的实例包括(甲基)丙烯酸类单体,并且所述单体可以通过uv固化由树脂基体材料形成。当如上所述使用可固化单体时,可以根据需要进一步添加固化所需的引发剂。
溶剂没有特别限制,并且没有特别限制,只要溶剂不对涂覆过程产生不利影响并且可以通过后续的干燥除去即可。作为溶剂的非限制性实例,可以使用甲苯、二甲苯、丙酮、氯仿、各种基于醇的溶剂、甲基乙基酮(mek)、甲基异丁基酮(mibk)、乙酸乙酯(ea)、乙酸丁酯、二甲基甲酰胺(dmf)、二甲基乙酰胺(dmac)、二甲基亚砜(dmso)、n-甲基-吡咯烷酮(nmp)等,并且可以使用一种或者两种或更多种的混合物。当使用第一溶液和第二溶液时,各溶液中包含的溶剂也可以彼此相同或不同。即使当在第一溶液和第二溶液中使用不同溶剂时,也优选这些溶剂具有相容性以便彼此混合。
对于将其中溶解有由式1表示的化合物的树脂溶液涂覆在基材上的方法,可以使用辊对辊法。例如,辊对辊法可以通过以下过程来进行:从其上卷绕有基材的辊上展开基材,将其中溶解有由式1表示的化合物的树脂溶液涂覆在基材的一个表面上,干燥树脂溶液,然后将基材再次卷绕在辊上。当使用辊对辊法时,优选将树脂溶液的粘度确定在可以实施所述方法的范围内,并且粘度可以确定在例如200cps至2,000cps的范围内。
作为涂覆方法,可以使用各种公知的方法,并且例如,还可以使用模涂机,并且还可以使用各种棒涂法,例如,逗号涂覆机(commacoater)和反向逗号涂覆机(reversecommacoater)。
在涂覆之后,进行干燥过程。干燥过程可以在除去溶剂所需的条件下进行。例如,在涂覆过程期间基材前进的方向上,通过在靠近涂覆机的烘箱中在使溶剂充分蒸发的条件下进行干燥,可以在基材上获得具有期望厚度和浓度的包含含有由式1表示的化合物的荧光材料的色彩转换膜。
当使用可通过树脂基体材料固化的单体作为溶液中包含的树脂时,可以在干燥之前或者与干燥同时进行固化,例如,uv固化。
在将由式1表示的化合物与树脂挤出以生产膜时,可以使用本领域已知的挤出方法,例如,可以通过将由式1表示的化合物与树脂(例如,基于聚碳酸酯(pc)的树脂、聚(甲基)丙烯酸类树脂和基于苯乙烯-丙烯腈(san)的树脂)挤出来制备色彩转换膜。
根据本说明书的一个示例性实施方案,色彩转换膜的至少一个表面上可以设置有保护膜或阻挡膜。作为保护膜和阻挡膜,可以使用本领域已知的膜。
本说明书的一个示例性实施方案提供了包括上述色彩转换膜的背光单元。背光单元可以具有本领域已知的背光单元构造,不同之处在于背光单元包括所述色彩转换膜。图1示出了根据一个实例的背光单元结构的示意图。根据图1的背光单元包括侧链型光源101、围绕光源的反射板102、引导直接从光源发射的光或由反射板反射的光的导光板103、设置在导光板的一个表面上的反射层104、以及设置在与导光板的面向反射层的表面相对的表面上的色彩转换膜105。在图1中表示为灰色的部分是导光板的光散射图案106。入射到导光板内的光由于光学过程(例如反射、全反射、折射和透射)的反复而具有不规则的光分布,并且可以使用二维光散射图案以引导不规则的光分布具有均匀的亮度。然而,本发明的范围不限于图1,并且作为光源,不仅可以使用侧链型光源,而且还可以使用直接型光源,并且根据需要,可以省略反射板或反射层或者也可以用另一构造代替,并且根据需要可以进一步设置另外的膜,例如光扩散膜、集光膜、增亮膜等。
本说明书的一个示例性实施方案提供了包括背光单元的显示器件。所述显示器件没有特别限制,只要显示器件为包括所述背光单元的显示器件即可,并且可以包括在tv、计算机显示器、便携式计算机、移动电话等中。
下文中,将参照用于具体描述本说明书的实施例详细地描述本说明书。然而,根据本说明书的实施例可以被修改成多种形式,并且本申请的范围不应被解释为限于以下详细描述的实施例。提供本申请的实施例是为了向本领域普通技术人员更完整地说明本说明书。
具体实施方式
<制备例>
根据本申请的一个示例性实施方案的化合物可以通过下面将描述的制备方法制备。
例如,在式1的化合物中,核心结构可以如以下反应式1和2中来制备。取代基可以通过本领域已知的方法键合,并且取代基的种类和位置或取代基的数量可以根据本领域已知的技术来改变。
[反应式1]
在反应式1中,
r1、r2、x1和x2与式1的限定相同。
将1当量苯并[c,d]吲哚-2(1h)-酮和1.5当量氨基嘧啶放入溶剂中,将所得混合物在氮气下在90℃下加热并搅拌。在苯并[c,d]吲哚-2(1h)-酮消失之后,将产物冷却。在将水倒入产物中并将所得产物搅拌30分钟之后,通过使用氯仿进行萃取,用无水硫酸镁除去水分。通过在减压下蒸馏使剩余物浓缩后,将所得产物溶解在甲苯中,在搅拌下将tea和bf3oet2放入其中,并将所得混合物在120℃下搅拌。当反应终止时,将所得产物冷却并用chcl3进行萃取,用无水硫酸镁除去水分,然后通过在减压下蒸馏使剩余物浓缩,并通过重结晶或柱色谱法纯化。
[反应式2]
在反应式2中,
l与式1中的l1和l2的限定相同,
r11、r12、r21和r22与式1中的r1和r2的限定相同,
x1和x2与式1中的l1和l2的限定相同,
n1、n2、m1和m2与式1中的n和m的限定相同。
通过与一般suzukic-c交叉偶联相同的方法合成产物。
制备例1.<化合物1>
1)化合物1b的合成
将2.00g(6.14mmol,1当量)化合物1a、2当量双(频哪醇)二硼和3当量乙酸钾在1,4-二
2)化合物1的合成
将2.00g(4.76mmol,1当量)化合物1b、1当量化合物1c和1当量化合物1d在甲苯和乙醇溶剂下搅拌,将5当量碳酸钾溶解在水中,并将所得溶液添加到其中。在氮气气氛下通过使用0.1当量四三苯基膦作为催化剂进行反应。在反应终止之后,将所得产物冷却至室温,通过将水倒入产物中使产物沉淀为固体。在通过过滤器将产生的固体与溶液分离之后,通过柱纯化可以获得1.07g(产率30%)化合物1。
c44h24b2f4n6o(m+)的hrlc/ms/msm/z计算值:750.2134;实测值:750.2136
制备例2.<化合物2>
1)化合物2c的合成
将6.00g(23.8mmol,1当量)化合物2a和1.5当量化合物2b在四氢呋喃溶剂下搅拌,将3当量碳酸钾溶解在水中,并将所得溶液添加到其中。在氮气气氛下在80℃下通过使用0.1当量四三苯基膦作为催化剂进行反应。在反应终止之后,将所得产物冷却至室温,将水倒入产物中。通过使用氯仿进行萃取,用无水硫酸镁除去水分。在通过在减压下蒸馏将剩余物浓缩之后,通过柱纯化可以获得3.95g(产率40%)化合物2c。
2)化合物2e的合成
使用1.00g(5.91mmol,1当量)化合物2d和1.5当量化合物2c,通过[反应式1]的方法,可以获得3.26g(产率90%)化合物2e。
3)化合物2的合成
通过以与化合物1的合成中相同的方式基于2.00g(4.76mmol,1当量)化合物1b进行合成,不同之处在于使用化合物2e代替化合物1c,并使用化合物2f代替化合物1d,可以获得1.04g(产率22%)化合物2。
c62h35b2f4n7o(m+)的hrlc/ms/msm/z计算值:991.3025;实测值:993.3030
制备例3.<化合物3>
1)化合物3b的合成
通过以与化合物1b的合成中相同的方式进行合成,不同之处在于使用2.00g(6.14mmol,1当量)化合物3a代替使用化合物1a,可以获得1.05g(产率35%)化合物3b。
2)化合物3的合成
将1.00g(2.05mmol,1当量)化合物3b和2.4当量化合物3c在甲苯和乙醇溶剂下搅拌,将5当量碳酸钾溶解在水中,并将所得溶液添加到其中。在氮气气氛下通过使用0.1当量四三苯基膦作为催化剂进行反应。在反应终止之后,将所得产物冷却至室温,通过将水倒入产物中使产物沉淀为固体。在通过过滤器将产生的固体与溶液分离之后,通过柱纯化可以获得1.22g(产率73%)化合物3。
c50h36b2f4n6(m+)的hrlc/ms/msm/z计算值:818.3124;实测值:818.3126
制备例4.<化合物4>
1)化合物4b的合成
在将2.00g(16.8mmol,1当量)化合物4a和1.2当量n-溴代琥珀酰亚胺在乙腈溶剂下搅拌的同时,在室温下进行反应。在反应终止之后,将水倒入其中。通过使用氯仿进行萃取,用na2s2o3(水溶液)洗涤萃取物,然后用无水硫酸镁除去水分。通过经由在减压下蒸馏将剩余物浓缩,可以获得3.16g(产率95%)化合物4b。
2)化合物4f的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物4d代替使用化合物2b,可以获得2.27g(产率90%)化合物4f。
3)化合物4g的合成
使用2.00g(6.38mmol,1当量)化合物4f和1.5当量化合物4b,通过[反应式1]的方法,可以获得2.93g(产率90%)化合物4g。
4)化合物4的合成
通过以与化合物3的合成中相同的方式使用1.00g(2.05mmol,1当量)化合物3b进行合成,不同之处在于使用化合物4f代替化合物3c,可以获得1.85g(产率78%)化合物4。
c66h40b2f10n8(m+)的hrlc/ms/msm/z计算值:1156.3402;实测值:1156.3417
制备例5.<化合物5>
1)化合物5b的合成
通过以相同方式进行合成,不同之处在于如在化合物1b的合成中,使用2.00g(4.10mmol,1当量)化合物5a代替使用化合物1a,可以获得1.7g(产率70%)化合物5b。
2)化合物5d的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物5c代替使用化合物2b,可以获得2.93g(产率75%)化合物5d。
3)化合物5f的合成
使用2.00g(6.38mmol,1当量)化合物5d和1.5当量化合物5e,通过[反应式1]的方法,可以获得2.62g(产率92%)化合物5e。
4)化合物5的合成
通过以与化合物3的合成中相同的方式进行合成,不同之处在于使用化合物5f代替化合物3c,并使用1.00g(1.72mmol,1当量)化合物5b代替化合物3b,可以获得1.33g(产率50%)化合物5。
c108h66b2f4n6(m+)的hrlc/ms/msm/z计算值:1544.5471;实测值:1544.5465
制备例6.<化合物6>
1)化合物6b的合成
通过以与化合物1b的合成中相同的方式进行合成,不同之处在于使用2.00g(4.22mmol,1当量)化合物6a代替使用化合物1a,可以获得1.68g(产率70%)化合物6b。
2)化合物6d的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物6c代替使用化合物2b,可以获得3.86g(产率95%)化合物6d。
3)化合物6e的合成
使用2.00g(6.38mmol,1当量)化合物6d和1.5当量化合物5e,通过[反应式1]的方法,可以获得2.38g(产率85%)化合物6e。
4)化合物6的合成
通过以与化合物3的合成中相同的方式进行合成,不同之处在于使用化合物6e代替化合物3c,并使用1.00g(1.76mmol,1当量)化合物6b代替化合物3b,可以获得1.65g(产率60%)化合物6。
c105h68b2f4n6si2(m+)的hrlc/ms/msm/z计算值:1566.5166;实测值:1566.5170
制备例7.<化合物7>
1)化合物7b的合成
通过以与化合物1b的合成中相同的方式进行合成,不同之处在于使用2.00g(4.22mmol,1当量)化合物7a代替使用化合物1a,可以获得1.68g(产率70%)化合物7b。
2)化合物7d的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物7c代替使用化合物2b,可以获得3.59g(产率92%)化合物7d。
3)化合物7e的合成
使用2.00g(4.14mmol,1当量)化合物7d和1.5当量化合物5e,通过[反应式1]的方法,可以获得2.47g(产率87%)化合物7e。
4)化合物7的合成
通过以与化合物3的合成中相同的方式进行合成,不同之处在于使用化合物7e代替化合物3c,并使用1.00g(1.76mmol,1当量)化合物7b代替化合物3b,可以获得1.34g(产率50%)化合物7。
c107h60b2f4n6(m+)的hrlc/ms/msm/z计算值:1526.5002;实测值:1526.5007
制备例8.<化合物8>
1)化合物8的合成
通过以与化合物7的合成中相同的方式使用1.00g(1.76mmol,1当量)化合物7b进行合成,不同之处在于使用化合物5f代替化合物7e,可以获得1.21g(产率45%)化合物8。
c107h64b2f4n6(m+)的hrlc/ms/msm/z计算值:1530.5315;实测值:1530.5319
制备例9.<化合物9>
1)化合物9b的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物9a代替使用化合物2b,可以获得3.19g(产率70%)化合物9b。
2)化合物9c的合成
使用2.00g(3.54mmol,1当量)化合物9b和1.5当量化合物5e,通过[反应式1]的方法,可以获得2.50g(产率92%)化合物9c。
3)化合物9的合成
通过以与化合物7的合成中相同的方式使用1.00g(1.75mmol,1当量)化合物7b进行合成,不同之处在于使用化合物9c代替化合物7e,可以获得2.08g(产率70%)化合物9。
c117h74b2f4n8(m+)的hrlc/ms/msm/z计算值:1688.6159;实测值:1688.6165
制备例10.<化合物10>
1)化合物10b的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物10a代替使用化合物2b,可以获得2.24g(产率73%)化合物10b。
2)化合物10c的合成
使用2.00g(3.54mmol,1当量)化合物10b和1.5当量化合物5e,通过[反应式1]的方法,可以获得2.63g(产率86%)化合物10c。
3)化合物10的合成
通过以与化合物7的合成中相同的方式使用1.00g(1.76mmol,1当量)化合物7b进行合成,不同之处在于使用化合物10c代替化合物7e,可以获得1.68g(产率72%)化合物10。
c73h36b2f16n6(m+)的hrlc/ms/msm/z计算值:1322.2932;实测值:1322.2933
制备例11.<化合物11>
1)化合物11b的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(11.5mmol,1当量)化合物5e代替化合物2a,并使用化合物11a代替使用化合物2b,可以获得2.42g(产率88%)化合物11b。
2)化合物11c的合成
通过以与化合物4b的合成中相同的方式进行合成,不同之处在于使用2.42g(10.2mmol,1当量)化合物11b代替使用化合物4a,可以获得3.20g(产率99%)化合物11c。
3)化合物11d的合成
使用2.00g(5.25mmol,1当量)化合物10b和1.5当量化合物11c,通过[反应式1]的方法,可以获得3.28g(产率85%)化合物11d。
4)化合物11的合成
通过以与化合物7的合成中相同的方式使用1.00g(1.76mmol,1当量)化合物7b进行合成,不同之处在于使用化合物11d代替化合物7e,可以获得1.47g(产率52%)化合物11。
c87h42b2f22n6(m+)的hrlc/ms/msm/z计算值:1610.3306;实测值:1610.3310
制备例12.<化合物12>
1)化合物12b的合成
通过以与化合物1b的合成中相同的方式进行合成,不同之处在于使用2.00g(3.65mmol,1当量)化合物12a代替使用化合物1a,可以获得1.71g(产率73%)化合物12b。
2)化合物12c的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(11.5mmol,1当量)化合物5e代替化合物2a,并使用化合物10a代替使用化合物2b,可以获得3.18g(产率90%)化合物12c。
3)化合物12d的合成
通过以与化合物4b的合成中相同的方式进行合成,不同之处在于使用3.18g(10.4mmol,1当量)化合物12c代替使用化合物4a,可以获得3.92g(产率98%)化合物12d。
4)化合物12e的合成
使用2.00g(5.25mmol,1当量)化合物10b和1.5当量化合物12d,通过[反应式1]的方法,可以获得3.51g(产率84%)化合物12e。
5)化合物12的合成
通过以与化合物3的合成中相同的方式进行合成,不同之处在于使用化合物12e代替化合物3c,并使用1.00g(1.56mmol,1当量)化合物12b代替化合物3b,可以获得1.62g(产率57%)化合物12。
c93h66b2f28n6(m+)的hrlc/ms/msm/z计算值:1820.5088;实测值:1820.5084
制备例13.<化合物13>
1)化合物13b的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物13a代替使用化合物2b,可以获得2.76g(产率83%)化合物13b。
2)化合物13c的合成
使用2.00g(4.85mmol,1当量)化合物13b和1.5当量化合物5e,通过[反应式1]的方法,可以获得2.54g(产率85%)化合物13c。
3)化合物13的合成
通过以与化合物3的合成中相同的方式进行合成,不同之处在于使用化合物13c代替化合物3c,并使用1.00g(1.56mmol,1当量)化合物12b代替化合物3b,可以获得1.23g(产率54%)化合物13。
c97h84b2f4n8(m+)的hrlc/ms/msm/z计算值:1458.6941;实测值:1458.6937
制备例14.<化合物14>
1)化合物14b的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替化合物2a,并使用化合物14a代替使用化合物2b,可以获得2.85g(产率86%)化合物14b。
2)化合物14c的合成
使用1.40g(3.41mmol,1当量)化合物14b和1.5当量化合物5e,通过[反应式1]的方法,可以获得1.86g(产率89%)化合物14c。
3)化合物14e的合成
使用1.40g(3.41mmol,1当量)化合物14b和1.5当量化合物14d,通过[反应式1]的方法,可以获得1.82g(产率87%)化合物14e。
4)化合物14的合成
通过以与化合物1的合成中相同的方式进行合成,不同之处在于使用化合物14c代替使用化合物1c,使用1.00g(1.56mmol,1当量)化合物12b代替使用化合物1b,并使用化合物14e代替使用化合物1d,可以获得0.454g(产率20%)化合物14。
c97h80b2f4n8(m+)的hrlc/ms/msm/z计算值:1454.6628;实测值:1454.6621
制备例15.<化合物15>
1)化合物15b的合成
以与化合物1b的合成中相同的方式进行合成,不同之处在于使用2.00g(6.10mmol,1当量)化合物15a代替使用化合物1a。可以获得2.21g(产率86%)化合物15b。
2)化合物15的合成
以与化合物14的合成中相同的方式进行合成,不同之处在于使用1.00g(2.37mmol,1当量)化合物15b代替使用化合物12b。可以获得0.527g(产率18%)化合物15。
c80h48b2f4n8o(m+)的hrlc/ms/msm/z计算值:1234.4073;实测值:1234.4070
制备例16.<化合物16>
1)化合物16的合成
通过以与化合物10的合成中相同的方式进行合成,不同之处在于使用1.00g(3.27mmol,1当量)化合物16a代替化合物7b,可以获得2.60g(产率65%)化合物16。
c60h30b2f16n6o2s(m+)的hrlc/ms/msm/z计算值:1224.2082;实测值:1224.2095
制备例17.<化合物17>
1)化合物17的合成
通过以与化合物16的合成中相同的方式使用1.00g(3.27mmol,1当量)化合物16a进行合成,不同之处在于使用化合物12e代替化合物10c,可以获得2.60g(产率52%)化合物17。
c60h30b2f16n6o2s(m+)的hrlc/ms/msm/z计算值:1648.2203;实测值:1648.2199
制备例18.<化合物18>
1)化合物18c的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用6.00g(23.8mmol,1当量)化合物18a代替使用化合物2a,并使用化合物18b代替使用化合物2b,可以获得3.40g(产率42%)化合物18c。
2)化合物18d的合成
使用2.00g(5.25mmol,1当量)化合物10b和1.5当量化合物18c,通过[反应式1]的方法,可以获得3.07g(产率78%)化合物18d。
3)化合物18的合成
通过以与化合物16的合成中相同的方式使用1.00g(3.27mmol,1当量)化合物16a进行合成,不同之处在于使用化合物18d代替化合物10c,可以获得2.30g(产率45%)化合物18。
c84h42b2f16n6o4s(m+)的hrlc/ms/msm/z计算值:1556.2919;实测值:1556.2927
制备例19.<化合物19>
1)化合物19b的合成
通过以与化合物1b的合成中相同的方式进行合成,不同之处在于使用2.00g(8.48mmol,1当量)化合物19a代替使用化合物1a,可以获得2.74g(产率98%)化合物19b。
2)化合物19c的合成
通过以与化合物2c的合成中相同的方式使用12.0g(47.6mmol,1当量)化合物2a进行合成,不同之处在于使用化合物6c代替使用化合物2b,可以获得9.17g(产率38%)化合物19c。
3)化合物19d的合成
使用2.00g(11.8mmol,1当量)化合物2e和1.5当量化合物19c,通过[反应式1]的方法,可以获得7.18g(产率86%)化合物19d。
4)化合物19e的合成
使用2.00g(11.8mmol,1当量)化合物2e和1.5当量化合物12d,通过[反应式1]的方法,可以获得5.51g(产率80%)化合物19e。
5)化合物19的合成
通过以与化合物1的合成中相同的方式进行合成,不同之处在于使用化合物19d代替使用化合物1c,使用0.50g(1.52mmol,1当量)化合物19b代替使用化合物1b,并使用化合物19e代替使用化合物1d,可以获得0.329g(产率18%)化合物19。
c70h42b2f10n6si(m+)的hrlc/ms/msm/z计算值:1206.3267;实测值:1206.3261
制备例20.<化合物20>
1)化合物20b的合成
通过以与化合物2c的合成中相同的方式进行合成,不同之处在于使用2.00g(8.06mmol,1当量)化合物4c代替使用化合物2a,并使用化合物20a代替使用化合物2b,可以获得1.49g(产率70%)化合物20b。
2)化合物20c的合成
使用1.49g(5.64mmol,1当量)化合物20b和1.5当量化合物4b,通过[反应式1]的方法,可以获得2.98g(产率80%)化合物20c。
3)化合物20e的合成
将2.00g(11.6mmol,1当量)化合物14d、10当量苯酚和5当量碳酸钾在nmp溶剂下搅拌。将温度调节至90℃,并在氮气气氛下进行反应。在反应终止之后,将温度冷却至室温,通过将hcl(水溶液)倒入其中而形成固体。在将形成的固体通过过滤器从溶液中分离之后,将固体溶解在氯仿溶液中,通过使用水进行萃取。在用无水硫酸镁除去有机层中残留的水分之后,通过在减压下蒸馏将剩余物浓缩,通过柱纯化可以获得1.94g(产率90%)化合物20e。
4)化合物20f的合成
通过以与化合物4b的合成中相同的方式进行合成,不同之处在于使用1.94g(10.4mmol,1当量)化合物20e代替使用化合物4a,可以获得1.93g(产率70%)化合物20f。
5)化合物20g的合成
使用0.50g(2.96mmol,1当量)化合物2e和1.5当量化合物20f,通过[反应式1]的方法,可以获得1.23g(产率90%)化合物20g。
6)化合物20的合成
通过以与化合物19的合成中相同的方式使用0.50g(1.52mmol,1当量)化合物19b进行合成,不同之处在于使用化合物20c代替使用化合物19e,并使用化合物20g代替使用化合物19f,可以获得0.252g(产率19%)化合物20。
c51h28b2f5n7(m+)的hrlc/ms/msm/z计算值:871.2462;实测值:871.2463
制备例21.<化合物21>
1)化合物21a的合成
使用2.00g(5.25mmol,1当量)化合物10b和1.5当量化合物14d,通过[反应式1]的方法,可以获得2.51g(产率82%)化合物21a。
2)化合物21b的合成
通过以与化合物19的合成中相同的方式使用1.00g(3.03mmol,1当量)化合物19b进行合成,不同之处在于使用化合物12e代替使用化合物19d,并使用化合物21a代替使用化合物19e,可以获得0.786g(产率20%)化合物21b。
3)化合物21的合成
将0.786g(0.606mmol,1当量)化合物21b溶解在无水二氯甲烷中,在n2气氛下向其中放入10当量三甲基甲硅烷基氰化物,并向其中缓慢添加2当量三氟硼烷乙醚。通过hplc确认反应,在反应终止之后,用碳酸氢钠溶液洗涤产物。在用氯仿和水进行萃取之后,用无水硫酸镁从有机层中除去水分。通过在减压下蒸馏除去溶剂,通过用氯仿溶剂进行重结晶,可以获得0.602g(产率75%)化合物21。
c66h28b2f18n10(m+)的hrlc/ms/msm/z计算值:1324.2397;实测值:1324.2392
化合物1至21的物理特性如下表1中所示。
[表1]
在甲苯溶剂下以10-5m的浓度制备各化合物之后,测量物理特性。
吸光度和光致发光分别缩写为abs和pl。在表中,“溶液abs”和“溶液pl”的数值表示最大强度下的波长值。
abs.通过使用由scincoco.,ltd.制造的mega-2100设备测量,pl通过使用由scincoco.,ltd.制造的fs-2设备测量。
实施例
<实施例1>
将1.5重量份制备例3中制备的化合物3(在甲苯溶液中的最大吸收波长456nm,最大发光波长499nm,半高全宽56nm)溶解在溶剂丙二醇单甲醚乙酸酯(pgema)中,使得33.9重量份丙烯酸类粘合剂、59.3重量份多官能单体(季戊四醇三丙烯酸酯,nipponkayakuco.,ltd.)、2.3重量份粘合助剂和表面活性剂(kbm503,shinetsu)、以及3.0重量份光引发剂(
<实施例2>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物5(在甲苯溶液中的最大吸收波长466nm,最大发光波长526nm,半高全宽69nm)代替在实施例1中的化合物3。
<实施例3>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物7(在甲苯溶液中的最大吸收波长487nm,最大发光波长547nm,半高全宽68nm)代替在实施例1中的化合物3。
<实施例4>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物8(在甲苯溶液中的最大吸收波长474nm,最大发光波长529nm,半高全宽63nm)代替在实施例1中的化合物3。
<实施例5>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物9(在甲苯溶液中的最大吸收波长504nm,最大发光波长601nm,半高全宽86nm)代替在实施例1中的化合物3。
<实施例6>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物10(在甲苯溶液中的最大吸收波长467nm,最大发光波长513nm,半高全宽51nm)代替在实施例1中的化合物3。
<实施例7>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物11(在甲苯溶液中的最大吸收波长468nm,最大发光波长515nm,半高全宽58nm)代替在实施例1中的化合物3。
<实施例8>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物12(在甲苯溶液中的最大吸收波长463nm,最大发光波长513nm,半高全宽61nm)代替在实施例1中的化合物3。
<实施例9>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物16(在甲苯溶液中的最大吸收波长461nm,最大发光波长507nm,半高全宽64nm)代替在实施例1中的化合物3。
<实施例10>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物17(在甲苯溶液中的最大吸收波长459nm,最大发光波长507nm,半高全宽72nm)代替在实施例1中的化合物3。
<实施例11>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物18(在甲苯溶液中的最大吸收波长463nm,最大发光波长509nm,半高全宽70nm)代替在实施例1中的化合物3。
<实施例12>
以与实施例1中相同的方式进行实验,不同之处在于,使用化合物21(在甲苯溶液中的最大吸收波长461nm,最大发光波长507nm,半高全宽65nm)代替在实施例1中的化合物3。
<比较例1>
以与实施例1中相同的方式进行实验,不同之处在于,使用以下染料<a>(chem.eur.j.2015,21,12996-13003.)代替在实施例1中的化合物3。
根据实施例1至12和比较例1的各色彩转换膜的薄膜发光波长、量子效率和abs强度比示于下表2中。
[表2]
薄膜发光波长通过使用由scincoco.,ltd.制造的fs-2设备测量,以及量子效率通过使用由hamamatsucorp.制造的quantaurus-qy设备测量。abs强度比是表示将在比较例1的最大吸收波长处的强度设定为1时的比率的数值,并使用由scincoco.,ltd制造的mega-2100设备。
当将作为氮杂bodipy单分子的比较例1中的最大光吸收强度设定为1时,可以看出包含两个氮杂bodipy发色团的本合成化合物的最大光吸收强度为约两倍强。通过实现由等摩尔数的分子增强的光吸收强度和发光强度,可以提供具有改善的亮度和色域的色彩转换膜。
- 还没有人留言评论。精彩留言会获得点赞!