一种固定重组人精氨酸酶的制备方法与流程
本发明涉及生物技术领域,具体涉及一种固定重组人精氨酸酶的制备方法。
背景技术:
精氨酸酶(arginase,ec3.5.3.1)是催化水解l-精氨酸生成鸟氨酸与尿素的反应的酶,一般含于产生尿素的动物(哺乳类、板鳃鱼类、两栖类、海龟类)的肝脏、肾脏、精巢中,作为尿素循环的一个环节而起作用。精氨酸酶是催化哺乳动物尿素循环途径中尿素形成最终步骤的酶,将精氨酸转化为鸟氨酸和尿素。在大多数哺乳动物中,人精氨酸酶家族包括精氨酸酶i和精氨酸酶ii。精氨酸酶i主要在肝脏细胞表达,精氨酸酶ii在肾脏和红细胞表达为主。精氨酸酶可通过两种途径获得,一是从产生它的生物体中分离提取获得,但该方法获得的产物存在着可能携带各种宿主生物体病毒残留的风险;另一种是通过基因工程技术重组获得。采用基因工程技术重组生产精氨酸酶存在无病毒等生物残留,易于产业化,可大规模进行制备的优越性。
目前精氨酸酶的应用主要包含以下两个方面。一方面在治疗与精氨酸酶相关的疾病中的应用,us7951366b2公开了一种利用精氨酸剥夺来治疗人恶性肿瘤的药物组合物及方法,其中使用了重组人精氨酸酶i;另一方面是在工业中利用精氨酸酶水解精氨酸来制备l-鸟氨酸的应用。
在生物体内,鸟氨酸主要参与尿酸循环,对于体内氨态氮的排出有重要作用。鸟氨酸在医药上除作为试剂与注射液外,通常与精氨酸一起用于配置恢复疲劳的发泡饮料。l-鸟氨酸还可作为原料与门冬氨酸缩合为门冬氨酸鸟氨酸,门冬氨酸鸟氨酸在临床上用于治疗肝炎。根据现有文献报道,l-鸟氨酸生产工艺主要有三种:
1、化学法:目前工业上常用的生产方法是采用化学法碱水解l-精氨酸制备l-鸟氨酸,1966年shellint.rearsch采用丙烯酰胺和氯化钠作为主要原料化学合成产物l-鸟氨酸。(gb1020492)产物d-鸟氨酸及l-鸟氨酸都有,不好分离,故已被淘汰。
2、发酵法:用某些菌如escherichia.coil,corynebacteriumglutamicum,bacillusthuringiensis等的突变菌株进行发酵生产l-鸟氨酸,产量在约10~55g/l。发酵法生产的鸟氨酸,全是l型,产品以鸟氨酸的盐酸盐形式存在,此法简便易行,只要选择合适的菌种,可以达到较高的产量,适用于工业化规模生产。但发酵法也存在菌种的不稳定性、发酵液中l-鸟氨酸的分离提取过程复杂的问题。
3、酶法:makryaleas等人研究了精氨酸酶制备l-鸟氨酸的操作条件,在ph8.0~10.0时转化率可达99%。
2005年,焦庆才等又对精氨酸酶固定化生产l-鸟氨酸进行了研究,该方法l-鸟氨酸转化率达到95%。固定化酶法相对于传统酶法水解,在产物与催化剂的分离和工业化生产的连续控制等方面具有明显的优势。
固定化酶技术是将游离的酶通过物理或者化学手段将其束缚或限制于一定区域内,使其仍然能进行特有的催化反应并能回收重复使用的一种技术。固定化酶有吸附法、包埋法、共价键结合法、肽键结合法和交联法这几类。其中应用于精氨酸酶的方法有焦庆才等人的固定化酶技术为包埋法;张奇等人的固定化酶技术是戊二醛交联法,均存在酶活性较低等特点。
现有的生物酶法转化尽管可达到一定高的转化率,但采用可溶性酶催发反应,产物回收难度大、成本较高;而采用现有固定化方法,大多参入大量的化学试剂,对酶活力影响较大且污染相对严重。
技术实现要素:
为了实现上述目的,本发明提供了一种一种固定重组人精氨酸酶的制备方法,这种方法改变了现有固定化方法对酶活性的影响,克服了现有技术固定化酶易受污染的问题;本发明的另一目的在于提供本发明的固定化重组人精氨酸酶在工业中的应用,使用这种固定化重组人精氨酸酶催化生产l-鸟氨酸,具有良好的产业应用前景。
为实现上述目的,本发明采用了如下的技术方案:
一种固定重组人精氨酸酶的制备方法,包括以下步骤:
s1:对共价载体一和离子载体二进行前处理;
s2:对重组人精氨酸酶进行处理;
s3:经前处理的共价载体一与重组人精氨酸酶充分混合,进行重组人精氨酸酶固定化反应;
s4:再向s3的反应液中加入前处理后的离子载体二,进行固定化反应;
s5:保存s4所得的重组人固定化精氨酸酶。
所述重组人精氨酸包括氨基酸序列的n端或c端特异性引入含6×his的短肽如seqidno:1、seqidno:2所示。
所述重组人精氨酸酶c端或n端含有组氨酸标签可以为3~10个组氨酸。
共价载体一包括nhs-sepharoseff;离子载体二包括co-agaroseresin或ni-nta。
步骤s1所述的前处理包括用缓冲盐进行缓冲,所述缓冲盐包括磷酸盐缓冲、碳酸盐缓冲、mes缓冲、乙酸钠缓冲中的一种或多种且缓冲盐的ph为3~11。
步骤s3、s4中固定化反应的条件包括在2℃~45℃共价载体一和离子载体二与重组人精氨酸酶充分混合。
步骤s5中固定化酶的保存条件包括液体保存、固体保存,所述液体保存包括将步骤s5制得的重组人固定化精氨酸酶在5~30%甘油缓冲液中,-70~25℃下保存;所述固体保存包括将步骤s5制得的重组人固定化精氨酸酶冷冻干燥,并在低于-10℃条件下保存。
一种固定化重组人精氨酸酶,根据所述制备方法制备所得。
一种制备l-鸟氨酸的方法,方法包括使用权利要求8所述的固定化重组人精氨酸酶作为催化剂,应用于制备l-鸟氨酸。
本发明与现有技术相比,具有如下有益效果:
本发明以重组人精氨酸酶为酶源,采用共价结合与离子螯合结合方法将其固定在载体上,且最大限度的保留了酶的活性,具有高活性、高稳定性、更耐用的特点。在工业中制备l-鸟氨酸及其附属产品具有良好的产业化前景。
附图说明
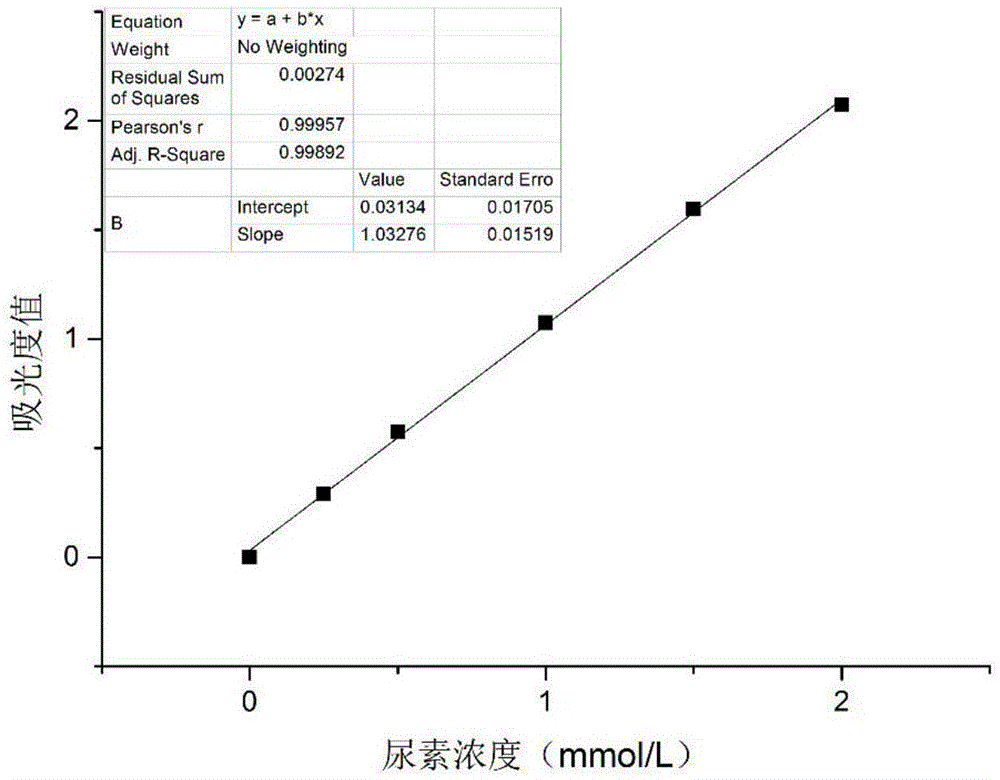
图1酶活性测定实验中尿素的标准曲线图。
图2固定化重组人精氨酸酶应用次数酶活保留率图。
具体实施方式
下面通过具体实施方式对本发明作进一步详细的说明:
一种固定重组人精氨酸酶的制备方法,其特征在于:包括以下步骤:
s1:对共价载体一和离子载体二进行前处理;
s2:对重组人精氨酸酶进行处理;
s3:经前处理的共价载体一与重组人精氨酸酶充分混合,进行重组人精氨酸酶固定化反应;
s4:再向s3的反应液中加入前处理后的离子载体二,进行固定化反应;
s5:保存s4所得的重组人固定化精氨酸酶。
所述重组人精氨酸包括氨基酸序列的n端或c端特异性引入含6×his的短肽如seqidno:1、seqidno:2所示。
所述重组人精氨酸酶n端或c端含有组氨酸标签可以为3~10个组氨酸。
共价载体一包括nhs-sepharoseff;离子载体二包括co-agaroseresin或ni-nta。
步骤s1所述的前处理包括用缓冲盐进行缓冲,所述缓冲盐包括磷酸盐缓冲、碳酸盐缓冲、mes缓冲、乙酸钠缓冲中的一种或多种且缓冲盐的ph为3~11,优选5~9,进一步选择8.3。
步骤s3、s4中固定化反应的条件包括在2℃~45℃共价载体一和离子载体二与重组人精氨酸酶充分混合,优选为4℃~30℃。
步骤s5中固定化酶的保存条件包括液体保存和固体保存,所述液体保存包括将步骤s5制得的重组人固定化精氨酸酶在5~30%甘油缓冲液中,-70~25℃下保存;所述固体保存包括将步骤s5制得的重组人固定化精氨酸酶冷冻干燥,并在低于-10℃条件下保存。
一种固定化重组人将氨酸酶,根据本发明公开的一种固定重组人精氨酸酶的制备方法制备所得。
一种制备l-鸟氨酸的方法,方法包括本发明公开的固定化重组人精氨酸酶作为催化剂,应用于制备l-鸟氨酸。
在本发明实施例中,采用紫外显色法检测尿素的含量,采用质谱法检测精氨酸的含量。
实例1.重组人精氨酸酶固定化
取200mg重组人精氨酸酶(seqidno:2)用20ml偶联缓冲液(0.2mol/lnahco3,0.5mol/lnacl,ph8.3)溶解。取10mlnhs-sepharoseff,用50ml的偶联缓冲液分三次清洗去除保存液,之后立即加入到重组人精氨酸酶偶联溶液中,2~8℃振荡偶联过夜。取10mlni-nta,用50ml偶联缓冲液分三次清洗去除保存液,之后立即加入到精氨酸酶偶联nhs-sepharoseff溶液中,25℃振荡偶联1~2h。将上述溶液过滤,收集流出液,检测蛋白含量,再用80ml偶联缓冲液清洗偶联后的固定化重组人精氨酸酶,之后用40ml蒸馏水清洗,抽干,分成2份。一份保存在10%甘油缓冲中,-20℃保存;另一份冷冻干燥,-20℃保存。用lowry法检测流出液的含量为0.16mg/ml,共20ml,计算固化偶联率为98.4%。用紫外法显色法检测偶联前后的重组人精氨酸酶i的酶活。见表1。
实例2.紫外法测定固定化前后重组人精氨酸酶活性
精密称取1gl-精氨酸,溶于10ml测活缓冲(0.1mol/ltrisph9.5)中即为10%的精氨酸溶液;精密称取尿素0.06g,用10ml样品测活稀释液溶解即为0.1mol/l尿素溶液。用样品测活稀释液将100mmol/l的尿素稀释至2.0、1.5、1.0、0.5、0.25、0mmol/l后各取0.2ml加入到含0.3ml终止液(v(h2so4):v(h3po4):v(h2o)=16:7:77)的试管中待显色。在10ml西林瓶中加入10%精氨酸溶液10.0ml,37℃预热5min后加入0.1g(干重计)实施例1得到的固定化重组人精氨酸酶,在37℃恒温培养箱里磁力搅拌100rpm/min反应10min,取样0.2ml立即加入到0.3ml终止液里混匀终止反应,用纯化水稀释相应倍数后,取0.5ml再加显色液(1%二乙酰一肟、0.06%氨基硫脲)0.05ml,混匀后置于100℃金属浴上反应10min,冷却至室温,于530nm处测定吸光度值。同法测定固定化前重组人精氨酸酶的活性。见表1、图1。
表1:重组人精氨酸酶i固定化前后的活性比较
实例3.固定化重组人精氨酸酶转化精氨酸制备l-鸟氨酸
以实施例1得到的固定化重组人精氨酸酶为酶源,在每升反应体系中加入底物l-精氨酸为150g;转化温度为37℃;转化ph值为9.5;转化时间为15~17h,固定化酶添加量为2%。转化结束后,过滤,收集上清液,采用质谱法lc-ms检测产物l-鸟氨酸和底物l-精氨酸的含量,并计算l-精氨酸的转化率。转化率达到99%以上。再将转化后的上清液采用重结晶方法制备l-鸟氨酸,可得l-鸟氨酸白色粉末约110g。
实例4.固定化重组人精氨酸酶的稳定性考察
单次催化反应结束后过滤分离固定化酶和产物l-鸟氨酸,回收的固定化酶重复用于下一次催化反应。反复使用30次,固定化酶的重复实验结果表明:反复使用30次固定化精氨酸酶的活性保留率均可达85%以上,且前20次的活性保留率均在90%以上,见表2、图2。
表2固定化重组人精氨酸酶应用次数酶活保留数据
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!