一种利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法与流程
本发明涉及一种利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法。
背景技术:
酵母是重要的食品和工业微生物,我国有丰富的酵母资源。酵母细胞壁由多糖、蛋白质以及少量的脂类、几丁质组成。两种主要的多糖分别是,β-d-葡聚糖,约占细胞壁干重的50-55%,分布于细胞壁的内侧,构成细胞壁的交联骨架结构;甘露聚糖蛋白分布于细胞壁的外侧,约占细胞壁干重的40-45%,赋予细胞生物学活性和控制细胞壁孔径。β-葡聚糖和甘露聚糖蛋白均具有丰富的生物学功能。酵母β-葡聚糖具有独特的三股螺旋结构,能与机体的免疫细胞受体特异性结合,刺激其处于高度活性状态。酵母β-葡聚糖通过与巨噬细胞受体结合,激活的巨噬细胞,起到抗肿瘤、抗菌、抗氧化和伤口愈合的作用。甘露糖蛋白由5-10%蛋白质和80-90%甘露聚糖组成,具有促进动物体液免疫和细胞免疫能力。甘露糖蛋白可以调节肠道菌群平衡,结合吸附外源性病原菌和毒素,并具有抗辐射、抗氧化、抗肿瘤等活性功能。在食品加工方面,甘露糖蛋白能够有效地减少红酒在贮藏过程中酒石酸沉淀的产生,维持红酒的澄清,减弱葡萄酒中单宁的收敛性,促进红酒芳香物质的释放。此外,甘露糖蛋白还具有一定的乳化稳定作用和延长蔬菜瓜果货架期的能力。
酵母β-葡聚糖和甘露糖蛋白可以从酵母中提取,目前实验室及工业制备工艺主要有酸碱提取法、热水浸提法、酶法以及以上方法的复合使用。franziskusk等(1999)提出酸法提取甘露聚糖,将洗净湿酵母置于乙醇、硫酸和水(2:1:1,v/v/v)的混合物中,加热离心,取上清冷冻干燥得甘露聚糖,产物含蛋白质4.15%,总糖90.10%,其中甘露糖73.2%。cn101117358a披露了一种碱法制备甘露聚糖的方法,包括使用0.5-1.5mol/l的naoh处理酵母细胞壁,经过12-20%的ctab溶液和0.3-0.8%的硼酸钠-乙酸钠溶液去除蛋白,将上清液进行干燥得到甘露聚糖。酸碱提取法多使用高浓度的强酸、强碱,既会导致多糖活性降低,又会污染环境。刘红芝等(2009)确定了水提法制备酵母甘露聚糖的最佳条件,以废弃酿酒酵母为原料,在ph6.5、质量分数为3%的nacl、温度为50℃、搅拌速率为120r/min的条件下振荡自溶24h;然后高温120℃处理3h;最后经过去蛋白、凝胶色谱柱分离得到纯度达到92.6%的甘露糖蛋白产品。热水浸提法成本低廉、操作简单,但是所得产品含有可溶性的氨基酸、色素等杂质,产品纯度低,需采用离子交换柱和电泳等方法进一步纯化。
酶法制备β-酵母多糖的方法中,普遍采用的是利用自溶或者溶菌酶、昆布多糖酶等方法破坏细胞壁,接着应用淀粉酶、碱性蛋白酶、中性蛋白酶进一步纯化酵母多糖产物。liu等(2011)提出了一种温和处理制备酵母β-葡聚糖的方法,主要步骤包括:诱导自溶、高温抽提、均质破壁、回流脱脂和生物酶解,最终β-d-葡聚糖得率达到11%,纯度高达93%。cn102603917披露了一种酶法制备酵母葡聚糖的方法,包括利用α-淀粉酶、糖化酶、甘露糖酶和中性蛋白酶,经过脱盐、脱脂和烘干得到高纯度的β-1,3-葡聚糖。cn104862355a披露了一种酶法利用酵母细胞壁联产葡聚糖、甘露糖蛋白的方法,包括加入碱性蛋白酶酶解高压均质处理的酵母细胞壁,离心重液干燥得到葡聚糖,离心轻液通过碱纳滤膜过滤,截留液浓缩干燥得到甘露糖蛋白。此外,cn1940084a是国内专利中唯一提出利用β-1,3-葡聚糖苷酶、β-1,6-葡聚糖苷酶、几丁质酶联合酶解,并且经过热解制备葡萄酒添加剂酿酒酵母甘露糖蛋白。酶法制备能够保持酵母多糖的天然结构和活性功能,但是酶法提取产物,蛋白含量高、纯度低,需采用离子交换柱和电泳等方法进一步纯化,而且酶价格昂贵,成本较高。
基于目前酵母多糖活性组分提取的主要问题,本发明是在cn105524934a中涉及的粘细菌β-1,6-葡聚糖酶的基础上对于该酶在酵母细胞综合利用应用上的进一步保护。β-1,6-葡聚糖酶glum是从corallococcussp.egb胞外上清液中纯化得到一个具有能专一性的切割以葡萄糖为组成单元、以β-1,6-糖苷键连接的葡聚糖。该β-1,6-葡聚糖酶glum的比酶活力高达24000u·mg-1。而β-1,6-糖苷键是酵母细胞壁中的重要交联结构,将长链的β-1,3-葡聚糖和外层甘露聚糖交联成网状结构,β-1,6-糖苷键的破坏将导致整个细胞壁的裂解。此外,真菌来源的β-1,6-葡聚糖酶也可以起到类似的作用。而cn1940084a中利用了能够断裂酵母细胞壁整体结构连接的三个生物酶,其酶学活力和成本未可知。
本发明只利用其中起到破坏交联结构的β-1,6-葡聚糖酶,并结合低廉、市场产品成熟的木瓜蛋白酶,即可高效、有针对性的促进甘露糖蛋白和酵母葡聚糖的释放,同时充分利用酵母细胞资源,得到酵母葡聚糖、酵母甘露糖蛋白和酵母提取物三个重要的活性组分。
技术实现要素:
为了解决上述背景技术中存在的问题,本发明提供一种生物酶法,即利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法。
为了实现上述目的,本发明采用的技术方案为:
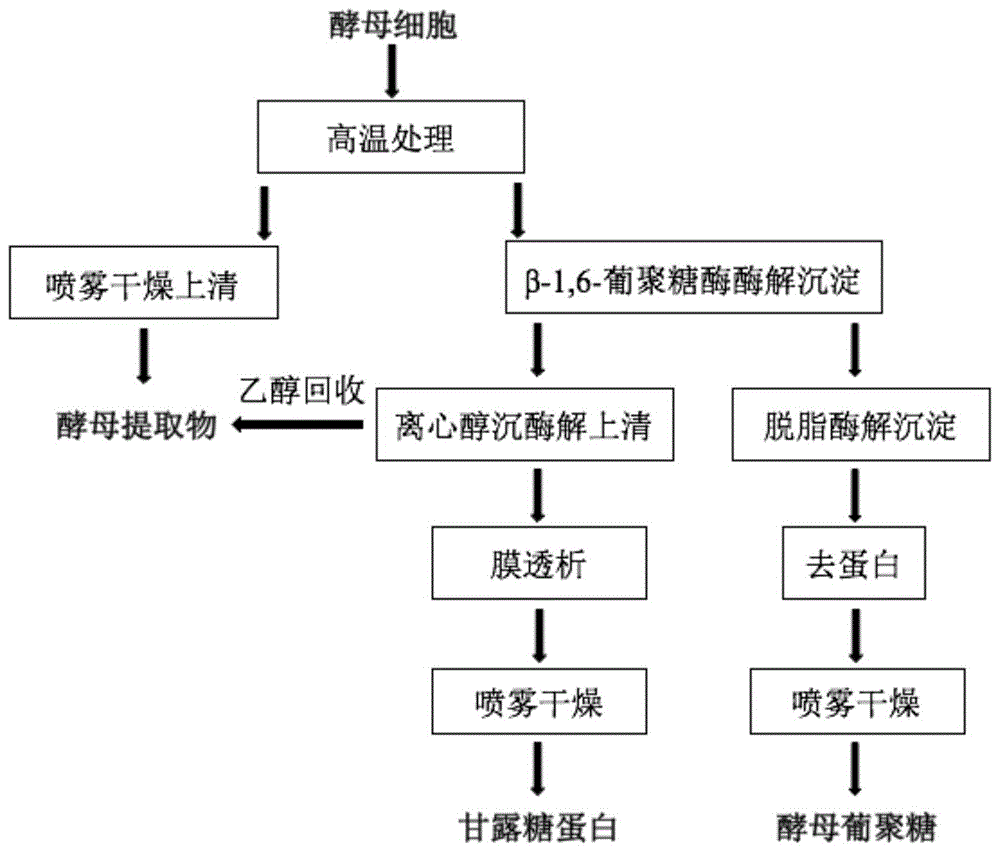
一种利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法,以酵母细胞为原料,通过对酵母细胞进行高温灭活处理,离心、干燥上清得到酵母提取物;利用β-1,6葡聚糖酶酶解酵母细胞壁,离心分别得到的酶解液上清和酶解沉淀,酶解液上清经乙醇沉淀、离心分离、干燥得到甘露糖蛋白;乙醇经回收后,剩余液体部分经浓缩、喷雾干燥得到酵母提取物;酶解沉淀依次经脱脂、蛋白酶处理、喷雾干燥得到酵母葡聚糖。
本发明技术方案所得的酵母提取物产品为淡黄色、粉末状固形物;甘露糖蛋白产品为白色、疏松状固形物;酵母葡聚糖产品为灰褐色、粉末状固形物。
本发明所述的利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法,优选包括以下步骤:
(1)以酵母细胞为原料,对酵母细胞进行高温灭活处理,离心分别收集沉淀和上清:沉淀为处理后的酵母细胞壁;上清浓缩、喷雾干燥得到酵母提取物;
(2)向步骤(1)所得的酵母细胞壁中加入β-1,6-葡聚糖酶液,进行酶解反应,离心,收集上清;
(3)将步骤(2)所得的酶解液上清,加入乙醇进行醇沉,离心,收集沉淀;
(4)将步骤(3)所得沉淀,加入去离子水溶解,进行膜透析,收集截留液;
(5)将步骤(4)所得截留液进行喷雾干燥,得到甘露糖蛋白;
(6)将步骤(2)所得酶解液沉淀,加入石油醚,加热回流,离心,收集沉淀;
(7)将步骤(6)所得沉淀,加入蛋白酶,进行酶解反应,离心,收集沉淀;
(8)将步骤(7)所得沉淀进行喷雾干燥,得到酵母葡聚糖。
(9)将步骤(3)所得的液体部分进行乙醇回收,回收后剩余液体经浓缩、喷雾干燥后得到酵母提取物。
所述步骤(1)中,酵母细胞优选面包酵母细胞、酿酒酵母细胞、废弃工业酿酒酵母细胞中的任意一种或多种。
所述步骤(1)中,废弃工业酿酒酵母细胞需进行前处理,包括:废弃工业酿酒酵母细胞配制成质量百分浓度为3-15%的悬浮液,经过孔径为80-120目的筛网,蒸馏水离心洗涤3-5遍,离心转速为10000-15000rpm,离心时间为10-15min。
所述步骤(1)中优选,酵母细胞配制成质量百分浓度为6-15%的悬浮液,在温度为110-130℃,时间为20-40min,压强为0.1mpa的条件下高温处理。
所述步骤(2)中,收集酶液离心转速为10000-15000rpm,离心时间为10-15min。
,所述步骤(2)中,β-1,6-葡聚糖酶优选genbankno.mh747076,genbankno.np596461或genbankno.xp024773174所示的β-1,6-葡聚糖酶。
所述步骤(2)中,β-1,6-葡聚糖酶优选来源于保藏编号为cctccno:m2012528的corallococcussp.egb(β-1,6-葡聚糖酶的登录号为genbankno.mh747076),或来源于栗酒裂殖酵母(schizosaccharomycespombe,β-1,6-葡聚糖酶的genbankno.np596461)或哈茨木霉(trichodermaharzianum,β-1,6-葡聚糖酶的genbankno.xp024773174)的发酵上清;进一步优选来源于保藏编号为cctccno:m2012528的corallococcussp.egb(β-1,6-葡聚糖酶的登录号为genbankno.mh747076)。
所述步骤(2)中,β-1,6-葡聚糖酶来源于保藏编号为cctccno:m2012528的corallococcussp.egb,所述的corallococcussp.egb接种于vy/4液体产酶培养基,发酵培养,离心收集上清,得到步骤(2)中所述的β-1,6葡聚糖酶。
corallococcussp.egb在vy/4液体培养基配方为:0.40%酵母细胞壁、0.1%cacl2、0.1%酵母提取物(w/v),ph7.0,转速为150-250rpm,发酵温度为20-40℃,培养时间为2-5天,离心去除菌体,所得上清即为β-1,6-葡聚糖酶酶液,该酶液用于后续酵母细胞处理。
利用来源于保藏编号为cctccno:m2012528的corallococcussp.egb的β-1,6葡聚糖酶酶解酵母细胞壁的酶解条件为:酶用量为2-10u/g酵母,酶解体系ph为6-8,时间为12-24h,温度为30-50℃,搅拌速率为150-250rpm。
所述步骤(3)中优选,乙醇的用量为所得上清的两倍至四倍体积,温度为0-4℃,过夜;离心收集沉淀,所述的离心转速为6000-10000rpm,离心时间为5-10min,或通过板框压滤获得沉淀。
所述步骤(4)中优选,将步骤(3)所得沉淀,加入去离子水溶解配制成质量浓度为2-8%的待透析溶液,透析膜的截留分子量5-10kda,优选7kda,温度为0-4℃。
所述步骤(6)中优选,石油醚用量5-40ml/g,回流温度为60-95℃,回流时间为2-4h。
所述步骤(7)中酶解条件优选为:选用木瓜蛋白酶,酶用量为5000-60000u/g,时间为5-15h,温度为50-70℃,搅拌速率为150-250rpm。
在本发明的一个实施例中,所述步骤(1)中所得酵母提取物产品为淡黄色、粉末状固形物,得率为56.5%(以酵母细胞干重为基准,下同)。
在本发明的一个实施例中,所述步骤(6)中所得甘露糖蛋白产品为白色、疏松状固形物,得率为11.1%,纯度为90.66%。
在本发明的一个实施例中,所述步骤(9)中所得酵母葡聚糖产品为灰褐色、粉末状固形物,得率为17.4%,纯度为85.36%。
本发明所述的corallococcussp.egb发酵液中的β-1,6-葡聚糖酶具有裂解酵母细胞壁的能力。本发明同时选择不同微生物来源的β-1,6-葡聚糖酶和不同制备方法的β-1,6-葡聚糖酶,如粟酒裂殖酵母(s.pombe(
与现有技术相比,本发明具有的优点和效果如下:
1.β-1,6-葡聚糖是酵母细胞壁中的重要交联结构,将长链的β-1,3-葡聚糖和外层甘露聚糖交联成网状结构,而β-1,6-葡聚糖的破坏将导致整个细胞壁的裂解。因此利用高比酶活的β-1,6-葡聚糖酶作用于酵母细胞壁中的β-1,6-糖苷键,能够高效地、特异性地酶解酵母细胞壁,促进细胞壁上的酵母葡聚糖和甘露糖蛋白的释放,提高酵母葡聚糖和甘露糖蛋白的得率。
2.本发明采用β-1,6-葡聚糖酶处理酵母细胞提取酵母甘露糖蛋白可以避免长时间高温水提及蛋白酶处理对酵母甘露糖蛋白的破坏,同时水提醇沉的方法可以简单快速的得到酵母甘露糖蛋白,避免使用纳滤膜等技术带来的设备及操作复杂性,提高酵母甘露糖蛋白的纯度。
3.本发明利用corallococcussp.egb分泌的β-1,6葡聚糖酶即可实现酵母细胞壁的充分酶解,同时无需后续复杂的纯化步骤,极大降低了规模化生产的成本。
4.本发明利用高温灭活、生物酶解和喷雾干燥技术相结合,所采用的设备均可以实现工业化生产的需要,不涉及强酸、强碱等试剂,对环境没有污染,易于工业规模化生产。
5.本发明以酵母细胞为原料,联产得到酵母葡聚糖、甘露糖蛋白和酵母提取物三种重要的酵母活性组分,充分发挥酵母细胞的附加值。
综上所述,本发明首次利用β-1,6葡聚糖酶有效促进酵母细胞壁中酵母葡聚糖和甘露糖蛋白的释放,高效制备高纯度和高得率的甘露糖蛋白和酵母葡聚糖。同时,酶法制备工艺简便、避免复杂的工艺流程,节约成本,避免使用强酸、强碱,减少了对环境的污染,这对提升酵母细胞产品的附加值,带动酿酒产业的发展,提高规模化酶应用产业的经济利益有着重要的作用。
附图说明
图1为本发明的工艺流程图;
图2为本发明所得产品酵母葡聚糖酸水解后的高效液相色谱图;
图3为本发明所得产品甘露糖蛋白酸水解后的高效液相色谱图;
图4为本发明所得产品酵母葡聚糖的红外光谱图;
图5为本发明所得产品甘露糖蛋白的红外光谱图;
图6为本发明所的产品酵母葡聚糖的扫描电镜图片。
图7为本发明所的产品酵母葡聚糖的扫描电镜图片。
具体实施方式
下面结合具体实施例进一步阐明本发明,本具体实施方式在本发明技术方案为前提下进行实施,应理解这些方式仅用于说明本发明而不用于限制本发明的范围。
实施例1一种利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法,以面包酵母为原料,包括如下步骤(如图1所示):
(1)以面包酵母为原料,将酵母细胞配制成质量百分浓度为9%的悬浮液,在温度为110℃,时间为20min,压强为0.1mpa的条件下进行高温灭活处理,将悬浮液离心,转速8000rpm,时间10min,分别收集沉淀和上清:沉淀为处理后的酵母细胞壁;上清浓缩、喷雾干燥得到酵母提取物;
(2)corallococcussp.egb接种于vy/4液体产酶培养基(0.40%酵母细胞壁、0.1%cacl2、0.1%酵母提取物(w/v),ph7.0),发酵培养2天,离心收集酶液,离心转速为12000rpm,离心时间为15min,得到β-1,6-葡聚糖酶酶液;
(3)将步骤(1)所得的酵母细胞壁加入步骤(2)所得的β-1,6葡聚糖酶液,在酶用量为8u/g酵母,酶解体系ph7,时间24h,温度37℃,搅拌速率为220rpm的条件下进行酶解。酶解结束,离心收集上清,离心转速为8000rpm,离心时间为10min;
(4)将步骤(3)所得的酶解液上清,加入三倍体积乙醇进行醇沉,温度为4℃,过夜,离心收集沉淀,离心转速为8000rpm,离心时间为10min;
(5)将步骤(4)所得沉淀,加入去离子水配制成质量分数为5%的溶液,用截留分子量为7kda膜进行膜透析,温度为4℃,2天后收集截留液;
(6)将步骤(5)所得截留液进行喷雾干燥,即得酵母甘露糖蛋白。
(7)将步骤(3)所得酶解液沉淀,加入石油醚20ml/g,加热回流3h,温度为60℃,离心收集沉淀,转速8000rpm,时间10min,;
(8)将步骤(7)所得沉淀,加入木瓜蛋白酶40000u/g,酶解时间为10h,温度为65℃,搅拌速率为180rpm,离心收集沉淀,转速8000rpm,时间10min;
(9)将步骤(8)所得沉淀进行喷雾干燥,得到酵母β-葡聚糖。
(10)将步骤(4)所得的液体部分进行乙醇回收,回收后剩余液体经浓缩、喷雾干燥后得到酵母提取物。
本实施例得到的酵母提取物为淡黄色、粉末状固形物,得率为56.5%;甘露糖蛋白为白色、疏松状固形物,得到的酵母甘露糖蛋白得率为11.1%,纯度为90.66%;酵母葡聚糖为灰褐色粉末状固形物,得率为17.4%,纯度为85.36%。
实施例2
称取实施例1中所得的酵母葡聚糖和甘露糖蛋白20mg左右,加入10ml三氟乙酸(4m),100℃水解4h。水解液在80℃下旋蒸,用4mnaoh调节至中性。吸取150μl水解液加入150μl0.6mnaoh,再加入200μl0.5mpmp(1-苯基-3-甲基-5-吡唑啉酮)甲醇溶液,70℃水浴反应90min。反应结束,冷却至室温,反应液中加入0.3mhcl调节至中性,去离子水补足至1ml。加入1ml氯仿抽提pmp,12000rpm离心1min,反复抽提三次。上层水相溶液过0.22μm水相滤膜,取20μl上机。衍生后的样品采用c18色谱柱,紫外检测器od230,流动相为pbs和乙腈混合溶液(pbs为0.02m,ph6.7,pbs:乙腈体积比为83:17),流速为1.0ml/min,柱温30℃。
从图2可知,标准品的高效液相色谱图显示甘露糖标准品的保留时间为25.5min,葡萄糖标准品的保留时间为41.3min,而保留时间为18.3min的色谱峰代表的是单糖衍生化溶剂pmp。酵母葡聚糖的高效液相色谱图显示只有两种单糖的色谱峰,保留时间为25.5min的色谱峰为酵母葡聚糖产品水解后产生的甘露糖,保留时间为41.1min的峰为酵母葡聚糖产品酸水解后产生的葡萄糖,但是葡萄糖的峰面积占总峰面积94.92%,而甘露聚糖的峰面积占总峰面积5.07%。因此采用本发明所述方法制备的酵母葡聚糖产品纯度较高。从图3可知,样品的高效液相色谱图显示只有一种单糖的色谱峰,保留时间为25.5min的色谱峰为实施例1中甘露糖蛋白产品酸水解后产生的甘露糖的峰。因此采用本发明所述方法制备的甘露糖蛋白产品纯度高,无其他杂糖。
实施例3
测定实施例1中所得的酵母葡聚糖和甘露糖蛋白的各项组分含量。粗蛋白和灰分的测定采用aoac法(1990);总糖的测定采用蒽酮-硫酸法;酵母葡聚糖和甘露糖蛋白的测定参见实施例2,采用外标法定量。
结果如表1所示,酵母细胞主要由多糖和蛋白质组成,总糖含量为34.32%(其中,葡聚糖占细胞干重的20.56%,甘露聚糖占13.32%),蛋白质含量59.31%。本发明所述方法制备的甘露糖蛋白得率为11.1%,纯度为90.66%;酵母葡聚糖得率为17.44%,纯度为85.36%。
表1酵母和酵母多糖组分分析
实施例4
采用红外光谱测定实施例1所得的酵母葡聚糖和甘露糖蛋白,将无水样品5mg至于探头下方,用bio-radwin-ir在500-4500cm-1范围内进行扫描。
如附图4所示,1076cm-1、1427/1460cm-1的吸收峰,为多糖的特征峰;890cm-1附近的特征峰证明是β-d-吡喃糖c-h的变角振动的特征吸收峰,表明该组分含有β-d-吡喃葡萄糖环,分子以β-糖苷键连接;1255/1252cm-1、1375/1372cm-1、2923cm-1的特征峰说明其是具有β-(1-3)键的葡聚糖。如附图5所示,3400/3435cm-1的吸收峰为多糖上的-o-h形成分子间、分子内氢键;2900/2930cm-1的吸收峰为c-h伸缩振动,是糖类的特征峰;1645/1652cm-1为酰胺基特征吸收峰,可以推断样品中的蛋白质可能为糖结合蛋白;810/820cm-1的吸收峰为α-甘露糖吡喃构型特征峰。综上结果表明,所测样品具有甘露糖蛋白特征吸收峰。综上结果表明,所测样品具有酵母葡聚糖特征吸收峰。
实施例5
实施例1中得到的酵母提取物为黄色、粉末状固形物。本发明所得酵母提取物的各项理化指标测定根据国标gb/t23530-2009所述方法。
表2酵母提取物理化指标
实施例6
取少量干燥的酵母葡聚糖和甘露聚糖样品粘着于样品台上,置真空喷度仪内镀一层导电膜(金)后,使用扫描电镜进行观察。
如附图6和附图7所示,酵母细胞经过高温灭活,β-1,6葡聚糖酶酶解,酶解上清经水提醇沉、膜透析和喷雾干燥得到的甘露糖蛋白;酶解沉淀经脱脂、蛋白酶处理、喷雾干燥得到的酵母葡聚糖的扫描电镜图显示,呈现多糖特征性胶联、多孔态。
实施例7
一种利用β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法,以废弃工业酿酒酵母为原料,包括如下步骤:
(1)以废弃工业酿酒酵母细胞为原料,将酵母细胞配制成质量百分浓度为5%的悬浮液,经过孔径为100目的筛网,蒸馏水离心洗涤5遍,转速为10000rpm,离心时间为10min。
(2)将上述洗净去除杂质的酵母细胞配制成质量百分浓度为9%的悬浮液,在温度为120℃,时间为30min,压强为0.1mpa的条件下高温灭活处理,将悬浮液离心,时间15min,转速8000rpm,分别收集沉淀和上清:沉淀为处理后的酵母细胞壁;上清浓缩、喷雾干燥得到酵母提取物;
(3)corallococcussp.egb接种于vy/4液体产酶培养基,发酵培养3天,离心收集酶液,离心转速为10000rpm,离心时间为10min,得到β-1,6葡聚糖酶液;
(4)将步骤(1)所得的酵母细胞壁加入步骤(2)所得的β-1,6葡聚糖酶,在酶用量为10u/g酵母,酶解体系ph7.5,时间为24h,温度为40℃,搅拌速率为250rpm的条件下进行酶解。酶解结束,离心收集上清,离心转速为9000rpm,离心时间为15min;
(5)将步骤(3)所得的酶解液上清,加入三倍体积乙醇进行醇沉,温度为4℃,过夜,离心收集沉淀,离心转速为10000rpm,离心时间为15min;
(6)将步骤(4)所得沉淀,加入去离子水配制成质量分数为8%的溶液,截留分子量为7kda膜进行膜分离,温度为4℃,1天后收集截留液;
(7)将步骤(5)所得截留液进行喷雾干燥,即得甘露糖蛋白。
(8)将步骤(3)所得酶解液沉淀,加入石油醚40ml/g,加热回流2h,温度为65℃,离心收集沉淀,转速8000rpm,时间10min;
(9)将步骤(7)所得沉淀,加入木瓜蛋白酶20000u/g,酶解时间为15h,温度为40℃,搅拌速率为220rpm,离心收集沉淀,转速8000rpm,时间10min,;
(10)将步骤(8)所得沉淀进行喷雾干燥,得到酵母葡聚糖。
(11)将步骤(5)所得的液体部分进行乙醇回收,回收后剩余液体经浓缩、喷雾干燥后得到酵母提取物。
本实施例得到的酵母提取物为淡黄色、粉末状固形物,得率为58.9%;甘露糖蛋白为白色、疏松状固形物,得到的甘露糖蛋白得率为9.5%,纯度为89.24%;酵母葡聚糖为灰褐色粉末状固形物,得率为16.3%,纯度为81.32%。
实施例8一种利用栗酒酒裂殖酵母s.pombe来源的β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法。
栗酒裂殖酵母s.pombe来源的β-1,6葡聚糖酶(nm001922380.2)的异源表达和分离纯化,方法参照cn105524934a。以s.pombe的基因组为模板,进行β-1,6葡聚糖酶基因全长的pcr扩增,并与pmd19-tvector进行过夜酶连。将酶连产物转化e.colidh5α感受态细胞,挑选单克隆培养,并送测序验证序列正确。将上述提取的重组质粒与pet-29a(+)用ecori和hindiii双酶切,酶连。将验证正确的pet-29a(+)-exg转化到e.colibl21(de3)感受态细胞,构建表达菌株,挑取单克隆诱导培养。收集菌体,超声处理破碎菌体细胞,离心所得上清即为β-1,6-葡聚糖酶粗酶液。对产生的β-1,6-葡聚糖酶粗酶液进行硫酸铵分级沉淀,并结合吸附解吸等纯化手段,对重组β-1,6-葡聚糖酶进行纯化,并对纯化的β-1,6-葡聚糖酶进行透析处理,保存备用。
以面包酵母为原料,利用s.pombe来源的异源表达的β-1,6葡聚糖酶联产甘露糖蛋白、酵母葡聚糖和酵母提取物,包括如下步骤:
(1)以面包酵母为原料,将酵母细胞配制成质量百分浓度为9%的悬浮液,在温度115℃,时间为20min,压强为0.1mpa的条件下高温灭活处理,将酵母悬浮液离心,转速8000rpm,时间15min,分别收集沉淀和上清:沉淀为处理后的酵母细胞壁;上清浓缩、喷雾干燥得到酵母提取物;
(2)将步骤(1)所得的酵母细胞壁加入上述得到s.pombe来源的β-1,6葡聚糖酶,在酶用量为12u/g酵母,酶解体系ph7,时间24h,温度37℃,搅拌速率为220rpm的条件下进行酶解。酶解结束,离心收集上清,离心转速为8000rpm,离心时间为10min;
(3)将步骤(4)所得的酶解液上清,加入三倍体积乙醇进行醇沉,温度为4℃,过夜,离心收集沉淀,离心转速为8000rpm,离心时间为10min;
(4)将步骤(5)所得沉淀,加入去离子水配制成质量分数为5%的溶液,截留分子量为7kda膜进行膜分离,温度为4℃,2天后收集截留液;
(5)将步骤(6)所得截留液进行喷雾干燥,即得酵母甘露糖蛋白。
(6)将步骤(2)所得酶解液沉淀,加入石油醚30ml/g,加热回流3h,温度为60℃,离心收集沉淀,转速8000rpm,时间10min,;
(7)将步骤(6)所得沉淀,加入木瓜蛋白酶40000u/g,酶解时间为10h,温度为65℃,搅拌速率为180rpm,离心收集沉淀,转速8000rpm,时间10min,;
(8)将步骤(7)所得沉淀进行喷雾干燥,得到酵母葡聚糖。
(9)将步骤(3)所得的液体部分进行乙醇回收,回收后剩余液体经浓缩、喷雾干燥后得到酵母提取物。
本实施例得到的酵母提取物为淡黄色、粉末状固形物,得率为54.3%;甘露糖蛋白为白色、疏松状固形物,得到的酵母甘露糖蛋白得率为10.9%;酵母葡聚糖为灰褐色粉末状固形物,得率为16.5%。
实施例9一种利用哈茨木霉(t.harzianum)来源的β-1,6葡聚糖酶联产酵母葡聚糖、甘露糖蛋白和酵母提取物的方法。
哈茨木霉(t.harzianum)来源的β-1,6葡聚糖粗酶液的发酵培养。t.harzianum接种于pda液体培养基,28℃发酵培养48h。之后用无菌水清洗菌体转接于产酶培养基(配方:0.5g/lmgso4,0.01g/lfeso4,0.425g/lkcl,0.115g/lmgcl2,2.1g/lnh4cl,0.92g/lnah2po4,5g/l酵母细胞壁),28℃发酵培养48h,得到t.harzianum来源的β-1,6葡聚糖酶酶。
以面包酵母为原料,利用哈茨木霉(t.harzianum)的来源的β-1,6葡聚糖酶酶液处理酵母细胞壁联产甘露糖蛋白、酵母葡聚糖和酵母提取物,包括如下步骤:
(1)以面包酵母为原料,将酵母细胞配制成质量百分浓度为9%的悬浮液,在温度为115℃,时间为20min,压强为0.1mpa的条件下高温灭活处理,将酵母悬浮液离心,转速8000rpm,时间10min,分别收集沉淀和上清:沉淀为处理后的酵母细胞壁;上清浓缩、喷雾干燥得到酵母提取物;
(2)将步骤(1)所得的酵母细胞壁加入上述得到t.harzianum来源的β-1,6葡聚糖酶液,在酶用量为40u/g酵母,酶解体系ph7,时间24h,温度37℃,搅拌速率为220rpm的条件下进行酶解。酶解结束,离心收集上清,离心转速为8000rpm,离心时间为10min;
(3)将步骤(4)所得的酶解液上清,加入三倍体积乙醇进行醇沉,温度为4℃,过夜,离心收集沉淀,离心转速为8000rpm,离心时间为10min;
(4)将步骤(5)所得沉淀,加入去离子水配制成质量分数为5%的溶液,截留分子量为7kda膜进行膜分离,温度为4℃,2天后收集截留液;
(5)将步骤(6)所得截留液进行喷雾干燥,即得酵母甘露糖蛋白。
(6)将步骤(2)所得酶解液沉淀,加入石油醚20ml/g,加热回流3h,温度为60℃,离心转速8000rpm,时间10min,收集沉淀;
(7)将步骤(6)所得沉淀,加入木瓜蛋白酶50000u/g脱脂后沉淀,酶解时间为10h,温度为65℃,搅拌速率为180rpm,离心转速8000rpm,时间10min,收集沉淀;
(8)将步骤(7)所得沉淀进行喷雾干燥,得到酵母葡聚糖。
(9)将步骤(3)所得的液体部分进行乙醇回收,回收后剩余液体经浓缩、喷雾干燥后得到酵母提取物。
本实施例得到的酵母提取物为淡黄色、粉末状固形物,得率为52.5%;甘露糖蛋白为白色、疏松状固形物,得到的酵母甘露糖蛋白得率为10.5%;酵母β-葡聚糖为灰褐色粉末状固形物,得率为21.3%。
由结果可知,不同来源和不同制备方法的β-1,6-葡聚糖酶均可裂解酵母细胞壁,实现酶法温和制备酵母甘露糖蛋白和酵母葡聚糖的功能。
- 还没有人留言评论。精彩留言会获得点赞!