一种尿液小细胞外囊泡的改良提取方法与流程
本发明属于生物医学技术领域,涉及外囊泡分离提取技术,具体涉及一种尿液小细胞外囊泡的改良提取方法。
背景技术:
随着尿液细胞外囊泡的发现和研究,尿液已被视为一种能反映疾病动态的样本。细胞外囊泡是脂质膜结构的纳米颗粒,可分为三类:外泌体,微泡和凋亡小体。其形成机制分别为:多泡体与质膜融合释放外泌体;细胞膜出芽直接形成微泡;从垂死细胞中脱落的囊泡形成凋亡小体。外泌体直径为40~100nm,微泡的直径为100~1,000nm,通常比外泌体大,但较小的微泡与外泌体大小相似,凋亡小体尺寸不一(直径800~5,000nm),外观各异,但通常比其他类型的细胞外囊泡大。在它们形成期间,尿液细胞外囊泡可以转移各种细胞特异性成分(蛋白质,脂质和核酸)到靶细胞。随着方法学研究越来越严谨,分离、纯化和表征方法的优化有了进一步的发展,细胞外囊泡用于治疗疾病已经受到了极大的关注,这些研究正促进着人们认识到尿液细胞外囊泡在肾脏病理和生理中充当重要媒介。
细胞外囊泡的提取方法有试剂沉淀法、超离法、超滤法、层析排阻法和密度梯度离心法。试剂沉淀方法已经被较多研究证实其提取的纯度不高,而单纯使用超离法、超滤法或层析排阻法获得的提取物中也含有较多的杂蛋白和非囊泡核酸。同时,肾病患者尿液含有大量可溶性蛋白质,干扰尿液细胞外囊泡蛋白的检测,需要增加额外的提纯步骤去除可溶性蛋白质。目前,超离法结合密度梯度离心仍然是提取细胞外囊泡的最有效的方法,该方法提取的囊泡含有外泌体纯度较高,通常把密度梯度离心法提取的细胞外囊泡称为小细胞外囊泡。然而密度梯度离心耗时长,传统密度梯度离心至少需要14小时,阻碍了其临床应用。
尿调素(也称为tamm-horsfall尿糖蛋白(thp))是一种只在髓袢升支粗段合成的膜蛋白,是生理条件下尿液中含量最丰富的蛋白质。除了干扰囊泡蛋白检测,尿调节素可以形成网状捕获尿液细胞外囊泡,改变小细胞外囊泡密度,使其在梯度液中分布不集中,从而降低了小细胞外囊泡的提取量和纯度。
因此,为了进一步适应临床应用和科学研究的需要,需要开发一种针对尿液标本的小细胞外囊泡的改良密度梯度离心方法,既能高产量和高纯度的提取尿液中小细胞外囊泡,又能缩短提取时间,为临床和科研提取尿液小细胞外囊泡提供更实用、简便而又严谨可靠的方法。
技术实现要素:
本发明的目的在于解决现有尿液细胞外囊泡提取技术存在的样本用量大,提取时间长,提取产量低或纯度不高等问题,本发明提供的方法能显著提高提取产量,减少样本用量,并能大幅缩短提取耗时,与差速离心和超滤法结合能显著提高提取纯度,临床使用更简便、更可靠、更快捷。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种尿液小细胞外囊泡的改良提取方法,按照如下方法进行密度梯度离心:将不同浓度梯度的蔗糖溶液按照浓度从低至高的顺序依次垫加入试管底部,形成自上而下浓度依次增加的梯度液,在梯度液最上层缓慢加注粗囊泡重悬液,离心;
其中所述蔗糖溶液是ph8.4~8.8的20mmtris-hcl蔗糖重水溶液,所述粗囊泡重悬液是将粗囊泡重悬于ph8.4~8.8的20mmtris-hcl水溶液中制得。
本发明采用特定ph范围的20mmtris-hcl蔗糖重水溶液对粗囊泡进行密度梯度离心,与传统的提取方法,例如以某一浓度的蔗糖重水溶液垫法离心或者以pbs蔗糖重水溶液密度梯度离心等相比,该法能显著提高尿液中小细胞外囊泡的提取产量,并能减少样本使用量,临床制备和使用更为方便。
作为本发明优选的实施方案,所述蔗糖溶液是ph8.6的20mmtris-hcl蔗糖重水溶液,所述粗囊泡重悬液是将粗囊泡重悬于ph8.6的20mmtris-hcl水溶液中制得。该碱性条件下,能减少th蛋白聚集程度,从而减少其对胞外囊泡的捕获,保持囊泡的本来密度,使小细胞外囊泡集中于一段特定梯度层,以获得最大产量的小细胞外囊泡。
作为本发明优选的实施方案,所述梯度液在试管中自上而下的浓度依次为5%、10%、20%、40%和60%,该浓度梯度有利于小细胞外囊泡在中间层的富集,有利于后续提取工作的进行。
作为本发明优选的实施方案,所述离心是在25℃离心5小时。本发明与传统方法的区别在于,传统密度梯度离心需要在4℃离心至少14小时才能获得一定产量的小细胞外囊泡,而本发明由于采用了20mmtris-hcl蔗糖重水溶液,因此仅需要在25℃离心5小时就能获得更大产量的小细胞外囊泡,极大地缩短了提取耗时。应当理解,本发明所述25℃,允许在仪器设定的精度内有一定误差,一般误差为±2℃,在该波动范围内的温度也纳入本发明的保护当中。
作为本发明优选的实施方案,所述粗囊泡是将尿液样品在常温下通过差速离心法提取获得。所述差速离心法是先以低速离心去除死亡的细胞和大的细胞碎片,再高速离心去除可溶性蛋白质、蛋白质聚集体及其他与细胞外囊泡共沉淀的杂质,从而分离得到微囊泡和外泌体,其方法是本领域技术人员所公知的。通常差速离心法是在4℃的低温条件下进行,而本发明将差速离心法和20mmtris-hcl蔗糖重水溶液密度梯度离心相结合时发现,在常温进行差速离心更有利于提高小细胞外囊泡的提取产量。
本发明所述常温是指18~28℃。在常温下使用差速离心法是指在18~28℃进行差速离心。
优选的,所述差速离心法具体为:常温下,将尿液样品以500g离心,去沉淀,上清液以2,000g离心,去沉淀,上清液以16,000g离心,去沉淀,上清液使用超速离心机以200,000g离心力离心1小时,得到沉淀物粗囊泡。
作为本发明优选的实施方案,所述差速离心过程中获得的上清液经过超滤浓缩。超滤法是依靠超滤膜两侧的压力差作为动力来分离外泌体的方法,其方法是本领域技术人员所公知的。本发明申请人研究发现,差速离心法结合超滤法,能去除大量杂蛋白,在保证产量的同时提高小细胞外囊泡的纯度。
作为本发明优选的实施方案,所述超滤是在100kd超滤管内超滤浓缩,可最大限度的获得高纯度的小细胞外囊泡。
本发明还提供了一种更为具体的尿液小细胞外囊泡的改良提取方法,所述方法包括以下步骤:
(1)差速离心法提取粗囊泡:常温下,将尿液样品以500g离心,去沉淀,上清液以2,000g离心,去沉淀,上清液加入100kd超滤管中,在2,000离心力下将上清液浓缩10倍,然后将浓缩后的液体以16,000g离心,去沉淀,上清液使用超速离心机以200,000g离心力离心1小时,得到沉淀物粗囊泡,将粗囊泡重悬于ph8.6的20mmtris-hcl水溶液中得到粗囊泡重悬液;
(2)密度梯度离心提取小细胞外囊泡:使用平头针注射器依次向试管底部加注浓度5%、10%、20%、40%、60%的ph8.6的20mmtris-hcl蔗糖重水溶液各1ml,将粗囊泡重悬液缓慢加在已配置好的梯度液最上层,在25℃以110,000g离心力离心5小时后,梯度液自上而下分为12层,取出富集小细胞外囊泡的6、7、8、9层,分别加入超离管,使用ph8.6的20mmtris-hcl水溶液稀释至8ml,分别在4℃下200,000g离心1小时,得到沉淀物。
上述改良提取方法以差速离心法结合超滤法提取粗囊泡,以20mmtris-hcl蔗糖重水溶液进行密度梯度离心,能获得最大纯度的小细胞外囊泡。
综上,与现有技术相比,本发明具有的有益效果为:
本发明对传统密度梯度离心法进行改良,能最大程度的排除尿调素等对提取尿液小细胞外囊泡所产生的干扰,减少样本使用量,显著提高尿液小细胞外囊泡的提取产量,并极大地缩短了提取耗时,基于该改良法,对常温下差速离心(不结合使用盐析和超滤法)获得的粗囊泡进行本发明改良的密度梯度离心提取,能获得最大产量的小细胞外囊泡;对常温下差速离心结合100kd超滤法获得的粗囊泡进行本发明改良的密度梯度离心提取,则能获得最大纯度的小细胞外囊泡。
附图说明
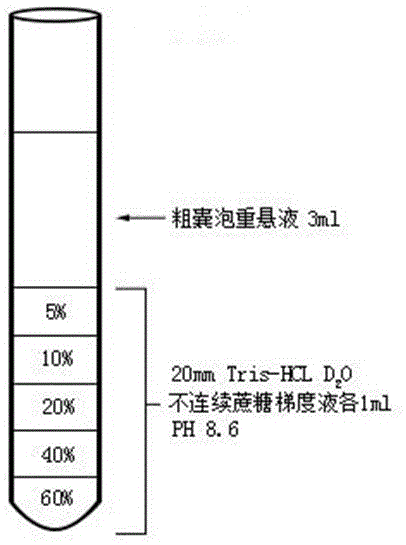
图1为本发明实施例1中20mmtris-hcl蔗糖重水溶液密度梯度(改良法)离心前试管内部成分分层示意图;
图2为本发明实施例1中20mmtris-hcl蔗糖重水溶液密度梯度(改良法)离心后试管内部成分分层示意图;
图3为本发明实施例1中传统法和改良法离心后各层梯度液中小细胞外囊泡标志物分布差异图;
图4为本发明实施例2中试验例d小细胞外囊泡最大产量提取方案流程图(a)和试验例h小细胞外囊泡最大纯度提取方案流程图(b);
图5为本发明实施例2中试验例a~h获取的小细胞外囊泡透射电镜图;
图6为本发明实施例2中试验例b~h获取的小细胞外囊泡标志物westernblot鉴定图(a)、纳米颗粒trps计数结果(b)和小细胞外囊泡纯度结果(c)。
具体实施方式
下面结合具体实施例对本发明作进一步的详细描述。但不应将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明内容所实现的技术均属于本发明的范围。除了特别指明,以下实施例中所使用的技术手段和操作方法为本领域技术人员所熟知的常规手段和方法,所使用原料均为市售商品。
实施例1
不同蔗糖重水溶液密度梯度离心法的比较
1、蔗糖重水溶液配置
(1)pbs蔗糖重水溶液的配置
称取0.03gpbs粉剂和1.5g蔗糖于试管中,加入重水定容至30ml,调ph至7.4,混匀溶解后得到5%的pbs蔗糖重水溶液。称取0.02gpbs粉剂和12g蔗糖于试管中,加入重水定容至20ml,调ph至7.4,混匀溶解后得到60%的pbs蔗糖重水溶液。10%、20%和40%蔗糖重水溶液用上述两种浓度的溶液按比例混合配置。
(2)20mmtris-hcl蔗糖重水溶液的配置
称取0.07gtris粉剂和1.5g蔗糖于试管中,加入重水定容至30ml,加入浓盐酸调ph至8.6,混匀溶解后得到5%的20mmtris-hcl蔗糖重水溶液。称取0.05gtris粉剂和12g蔗糖于试管中,加入重水定容至20ml,加入浓盐酸至ph8.6,混匀溶解后得到60%的20mmtris-hcl蔗糖重水溶液。10%、20%和40%蔗糖重水溶液用上述两种浓度的溶液按比例混合配置。
2、差速离心法提取粗囊泡
将尿液样品以500g离心10分钟,去除沉淀,上清液以2,000g离心20分钟,去沉淀,随后将2,000g离心后的上清液在固定角转子中以16,000g离心20分钟。使用beckmanxl-80超速离心机(beckmancoulter)将16,000g上清液以200,000g离心力在sw41ti水平转子中以最大的加速度和较低的减速度下离心1小时,获得粗囊泡沉淀物。
3、尿液小细胞外囊泡的提取
将差速离心法提取得到的沉淀(粗囊泡)分别重悬于3mlph7.4的pbs(传统法)水(h2o)溶液中或ph8.6的20mmtris-hcl(改良法)水(h2o)溶液中,使用平头针注射器依次向试管底部加注5%、10%、20%、40%、60%的ph7.4的pbs(传统法)蔗糖重水溶液或ph8.6的20mmtris-hcl(改良法)蔗糖重水溶液各1ml,将粗囊泡重悬液使用加样枪缓慢加在已配置好的梯度液最上层(改良法离心前试管内部成分分层见附图1),分别在4℃和25℃下,在110,000g离心力下离心5小时后,将梯度液自上而下分12层(改良法离心后试管内部成分分层见附图2)取出加入超离管,使用ph7.4的pbs水溶液(传统法)或ph8.6的20mmtris-hcl水溶液(改良法)稀释至8ml,分别在4℃下200,000g离心1小时,沉淀使用westernblot检测12层馏分中小细胞外囊泡标志物alix和tsg101蛋白以确定小细胞外囊泡层。鉴定并记录小细胞外囊泡所在分层,以后的小细胞外囊泡提取将这些含小细胞外囊泡的分层一同取出,无需再次鉴定。
pbs(传统法)4℃密度梯度离心、pbs(传统法)25℃密度梯度离心、20mmtris-hcl(改良法)4℃密度梯度离心和20mmtris-hcl(改良法)25℃密度梯度离心获得的各小细胞外囊泡中标志物的分布差异结果(见附图3)表明,使用本发明的改良法蔗糖梯度液在25℃下超速离心比其他三种方案能获得更集中的小细胞外囊泡分布层,主要集中于第6、7、8、9层。
实施例2
不同差速离心方案结合tris-hcl(改良法)蔗糖重水溶液密度梯度离心的比较
1、尿液小细胞外囊泡的提取
试验例a:30%蔗糖垫法
在常温下按照实施例1所述差速离心法获得粗囊泡,将粗囊泡重悬于6ml20mmtris-hcl水(h2o)溶液(ph8.6)中,使用平头针注射器依次向试管底部加注粗囊泡重悬液、30%和60%的20mmtris-hcl蔗糖重水溶液(ph8.6)各1ml,25℃在110,000g离心力下离心5小时后,取出1ml30%的蔗糖重水溶液层加入超离管,使用20mmtris-hcl水溶液(ph8.6)稀释至8ml,在4℃下200,000g离心1小时,沉淀为富含细胞外囊泡的样品。
试验例b:常温下差速离心结合盐析及改良密度梯度离心法
(1)差速离心法结合盐析提取粗囊泡
在常温下按照实施例1所述的差速离心法提取粗囊泡,区别在于在2,000g离心后,取上清液加入氯化钠使其浓度为0.58m,室温放置2小时,2,000g离心20分钟,得到上清液后再进行16,000g的离心。
(2)尿液小细胞外囊泡的提取
将步骤(1)获得的粗囊泡按照下述方法提取尿液小细胞外囊泡:将粗囊泡重悬于3mlph8.6的20mmtris-hcl(改良法)水(h2o)溶液中,使用平头针注射器依次向试管底部加注5%、10%、20%、40%、60%的ph8.6的20mmtris-hcl(改良法)蔗糖重水溶液各1ml,将粗囊泡重悬液使用加样枪缓慢加在已配置好的梯度液最上层(见附图1),25℃下在110,000g离心力下离心5小时后,将小细胞外囊泡富集层取出加入超离管,使用ph8.6的20mmtris-hcl水溶液稀释至8ml,分别在4℃下200,000g离心1小时,得到沉淀物。
试验例c:4℃下差速离心结合改良密度梯度离心法
在4℃下按照实施例1所述的差速离心法提取粗囊泡,并按照试验例b步骤(2)所述方法提取小细胞外囊泡。
试验例d:常温下差速离心结合改良密度梯度离心法(见附图4a)
在常温下按照实施例1所述的差速离心法提取粗囊泡,并按照试验例b步骤(2)所述方法提取小细胞外囊泡。
试验例e:4℃下差速离心结合30kd超滤及改良密度梯度离心法
(1)差速离心法结合超滤法提取提取粗囊泡
在4℃下按照实施例1所述的差速离心法提取粗囊泡,区别在于在2,000g离心后,取上清液加入30kd的超滤管中,在2,000g离心力下将上清液浓缩10倍,再进行16,000g的离心。
(2)尿液小细胞外囊泡的提取
按照试验例b步骤(2)所述方法提取小细胞外囊泡。
试验例f:常温下差速离心结合30kd超滤及改良密度梯度离心法
(1)差速离心法结合超滤法提取提取粗囊泡
在常温下按照实施例1所述的差速离心法提取粗囊泡,区别在于在2,000g离心后,取上清液加入30kd的超滤管中,在2,000g离心力下将上清液浓缩10倍,再进行16,000g的离心。
(2)尿液小细胞外囊泡的提取
按照试验例b步骤(2)所述方法提取小细胞外囊泡。
试验例g:4℃下差速离心结合100kd超滤及改良密度梯度离心法
(1)差速离心法结合超滤法提取提取粗囊泡
在4℃下按照实施例1所述的差速离心法提取粗囊泡,区别在于在2,000g离心后,取上清液加入100kd的超滤管中,在2,000g离心力下将上清液浓缩10倍,再进行16,000g的离心。
(2)尿液小细胞外囊泡的提取
按照试验例b步骤(2)所述方法提取小细胞外囊泡。
试验例h:常温下差速离心结合100kd超滤及改良密度梯度离心法(见附图4b)
(1)差速离心法结合超滤法提取提取粗囊泡
在常温下按照实施例1所述的差速离心法提取粗囊泡,区别在于在2,000g离心后,取上清液加入100kd的超滤管中,在2,000g离心力下将上清液浓缩10倍,再进行16,000g的离心。
(2)尿液小细胞外囊泡的提取
按照试验例b步骤(2)所述方法提取小细胞外囊泡。
上述试验例a~h的试验内容及操作条件见下表。
2、尿液小细胞外囊泡的检验
使用透射电镜(tem)观察每组试验例得到的小细胞外囊泡(见附图5),透射电镜图中实心箭头示th蛋白,空心箭头示与th蛋白粘附的细胞外囊泡。研究结果表明,tris-hcl不连续密度梯度离心(试验例b~h)比单独使用30%tris蔗糖垫离心(试验例a)能去除更多的th蛋白。
使用考马斯法检测每组试验例得到的小细胞外囊泡总蛋白含量,westernblot鉴定图(见附图6a)比较每组外泌体标志蛋白差异,可调电阻脉冲传感(trps)计数每组纳米颗粒数量差异,结果以每毫升尿量提取到的纳米颗粒数计算(见附图6b)。以提取到的小细胞外囊泡样本的纳米颗粒数和总蛋白量比值计算小细胞外囊泡纯度(见附图6c)。结果表明,tem透射电镜结果(见附图5)和westernblot鉴定结果(见附图6a)显示,试验例b和d在常温下差速离心而不结合超滤,能提取到更多的细胞外囊泡和囊泡标志物alix、tsg101和syntenin-1,trps纳米颗粒计数结果(见附图6b)表明试验例d在常温下差速离心而不结合超滤和盐析法的情况下能获得最大量的纳米颗粒数,因此,试验例d是小细胞外囊泡最大产量提取方案(其流程图见附图4a);以纳米颗粒数/总蛋白量计算纯度(见附图6c)结果发现,试验例h在常温下差速离心结合100kd超滤能获得最大纯度的小细胞外囊泡,是小细胞外囊泡最大纯度提取方案(其流程图见附图4b)。
- 还没有人留言评论。精彩留言会获得点赞!