一种光响应性多功能化学交联剂及其制备方法与应用与流程
本发明属于蛋白质及其功能研究技术领域,特别涉及一种光响应性多功能化学交联剂及其制备方法与应用。
背景技术:
蛋白质是基因表达的承载者,直接影响着生物的生命过程。在基因组学中,人们发现对基因的研究并不能满足对生命过程的探究需求,而研究蛋白质,则加深对生命过程的理解有重要的作用。因此,蛋白质组学在后基因时代成为重要的研究对象。近年来,用传统生物学方法对蛋白质组学进行研究,渐渐不能满足科学工作者的需求。随着化学合成工艺的成熟,人们发现化学小分子作为一种新兴的工具,是对传统生物学方法(如蛋白质印记westernblot、酶联免疫吸附elisa等)和生物学研究工具(如冷冻电镜)的重要补充。
对蛋白质组学的研究中,蛋白交联、修饰和标记是研究蛋白结构和相互作用的常用技术。其中,通过小分子进行蛋白质交联并利用交联质谱解析逐渐发展成为研究蛋白质结构与相互作用的重要研究方法,其优势较传统生物学方法更为直观。蛋白质交联剂是一类小分子化合物,具有2个或者更多的针对特殊基团(-nh2、-cooh、-hs、-oh等)的反应性末端,可以和2个或者更多的蛋白质分别偶联。70年代时人们普遍使用戊二醛作为蛋白质交联剂连接抗体和指示剂(如酶类),但其缺点是由于交联基团是随机的,容易形成杂乱的多聚体。最近,ruediaebersold等使用氨基特异性的双琥珀酰亚胺辛二酸酯(dss)这一经典的小分子交联剂,对蛋白磷酸酶家族进行交联质谱分析,成功解析了其相互作用网络(herzog,f.,etal.(2012).science337(6100):1348-1352.)。这一工作堪称化学交联剂研究蛋白质相互作用的经典。随后,类似的小分子交联剂应运而生,并实现商业化,包括dss系列物、bs3、dsso(a.sinz(2017).analbioanalchem409(1):33-44.)等。这些小分子交联剂虽然可以通过引入不同反应活性基团实现异源特异性交联,但是交联过程是不可控的,在处理蛋白样品中会带来很多假阳性的结果,特别是蛋白的自交联,很大程度上限制了其对蛋白相互作用的研究与进一步的应用。
光反应由于具有时空可控性被引入小分子交联剂体系中,它可以首先利用不稳定的热反应活性基团与一种蛋白进行交联,然后通过紫外光来交联第二种蛋白,从而避免蛋白自交联的干扰,大大降低了传统化学交联带来的局限性。现有的应用到交联剂上的光响应基团主要有苯叠氮(tanaka,y.,etal.(2008).molbiosyst4(6):473-480.)、二苯甲酮(majmudar,c.y.,etal.(2009).jamchemsoc131(40):14240-14242.)、双吖丙叮(suchanek,m.,etal.(2005).natmethods2(4):261-267.)三种,其中很多产品也实现了商业化。但是,这种光响应交联虽然实现了时空的可控性,但是反应机理都是通过自由基c-h或n-h的插入反应,对基团没有选择性,不能明确在蛋白上的反应位点,从而丧失交联的特异性。另外,大部分光响应的交联剂虽然结构简单,但是相应衍生物的制备合成比较困难,使得其价格昂贵。
因此,寻找一种新的、易于制备的、具有特异性反应活性的光响应性基团,并将其引入小分子化学交联剂体系,就有望解决现有交联剂的缺陷。
技术实现要素:
本发明的第一个目的是提供一种光响应性多功能化学交联剂。
本发明的第二个目的是提供一种所述光响应性多功能化学交联剂的制备方法。
本发明的第三个目的是提供一种所述光响应性多功能化学交联剂的用途。
为了实现上述目的,本发明采用的技术方案如下:
本发明的第一个方面提供了一种光响应性多功能化学交联剂,结构如通式i所示:
其中,r1、r2、r3、r4分别独立地选自氢、卤原子、羟基、巯基、胺基、硝基、氰基、醛基、酮基、酯基、酰胺基、膦酸基、膦酸酯基、磺酸基、磺酸酯基、砜基、亚砜基、芳基、杂芳基、烷基、烷氧基、亚烷基或改性烷基;
r’是传统化学反应基团,选自以下结构中的一种:
r”选自生物素及其衍生物、烷基烯及其衍生物、烷基炔及其衍生物等可用于磁珠富集技术的基团或氢原子;进一步选自荧光素及其衍生物、罗丹明及其衍生物、1,8-萘二甲酰亚胺等具有荧光识别功能的基团;
特别的,当r”选自氢原子时,光响应性多功能化学交联剂i是光响应双功能交联剂。
特别的,当r”选自生物素、烷基烯及其衍生物、烷基炔及其衍生物等可用于磁珠富集技术的基团时,光响应性多功能化学交联剂i是光响应三功能交联剂。
其中x与r1、r2、r3、r4中的一个连接,x选自芳基、杂芳基、烷基、亚烷基、改性烷基、改性亚烷基、醚键、酯键、碳酸酯键、酰胺键、脲键以及以上所述自由组合。
所述芳基为5~10元芳香单环或芳香稠合双环结构;
所述杂芳基为环上含有选自o、s、n或si中的至少一种杂原子的5~10元芳香单环或芳香稠合双环结构;
所述烷基为具有1~30个碳原子的饱和或不饱和脂肪族直链或支链的烷基;
所述亚烷基为具有1~30个碳原子的饱和或不饱和脂肪族直链或支链的亚烷基;
所述改性烷基为烷基的任意碳原子被选自卤原子、-oh、-sh、-no2、-cn、-cho、-cooh、酯基、芳基、-co-、-o-、-s-、-so-、-so2-、伯氨基、仲胺基、叔胺基或季铵盐基替代,所述改性烷基具有1~30个原子,其碳碳单键可任意地被碳碳双键或碳碳叁键替换;
所述改性亚烷基为亚烷基的任意碳原子被选自卤原子、-oh、-sh、-no2、-cn、-cho、-cooh、酯基、芳基、-co-、-o-、-s-、-so-、-so2-、伯氨基、仲胺基、叔胺基或季铵盐基替代,所述改性亚烷基具有1~30个原子,其碳碳单键可任意地被碳碳双键或碳碳叁键替换;
所述醚键选自以下结构中的一种:
-o(ch2)x-、-(ch2)xo(ch2)y-、-(ch2ch2o)x、-(ch2ch2o)x(ch2)y-,其中x和y≥0且为整数;
所述酯键选自以下结构中的一种:
-coo(ch2)x-、-oco(ch2)x-、-(ch2)xcoo(ch2)y-、-(ch2)xoco(ch2)y-,其中x和y≥0且为整数;
所述碳酸酯键选自以下结构中的一种:
-co3(ch2)x-、-(ch2)xco3(ch2)y-,其中x和y≥0且为整数;
所述酰胺键选自以下结构中的一种:
-nhco(ch2)x-、-conh(ch2)x-、-(ch2)xnhco(ch2)y-、-(ch2)xconh(ch2)y-,其中x和y≥0且为整数;
所述脲键选自以下结构中的一种:
-nhconh(ch2)x-、-(ch2)xnhconh(ch2)y-,其中x和y≥0且为整数;
所述烷基烯及其衍生物为具有1~30个碳原子的不饱和脂肪族直链或支链的烷基,在其中非特定位点含有不限定数量的碳碳双键;
所述烷基炔及其衍生物为具有1~30个碳原子的不饱和脂肪族直链或支链的烷基,在其中非特定位点含有不限定数量的碳碳三键;
所述荧光素及其衍生物为荧光素、氨基荧光素、羧基荧光素、异硫氰酸酯荧光素;
所述罗丹明及其衍生物为罗丹明、氨基罗丹明、羧基罗丹明、异硫氰酸酯罗丹明。
本发明优选的化合物为,光响应性多功能化学交联剂的结构通式为:
r’是传统化学反应基团,选自以下结构中的一种:
r”为氢原子,x选自以下结构中的一种:
其中n1是1~6的整数,n2是1~10的整数,n3是1~4的整数,n4是1~6的整数,n5是0~6的整数,上述光响应性多功能化学交联剂即为光响应双功能交联剂;
r”选自生物素及其衍生物,x为以下结构:
其中n是2~6的整数,上述光响应性多功能化学交联剂即为光响应三功能交联剂。
本发明更优选的化合物为,光响应性多功能化学交联剂的结构通式为:
nbs-1、sulfo-nbs-1中n是1~6的整数,
nbs-2、sulfo-nbs-2中n是1~10的整数,
nbm、sulfo-nbm中n是0~6的整数,
nbnco中n是1~6的整数,nbpm中n是1~4的整数,
tri-nb中n是2~6的整数。
本发明最优选的化合物为,光响应性多功能化学交联剂的结构为以下结构中的一种:
本发明的第二个方面提供了一种所述光响应性多功能化学交联剂的制备方法,包括以下步骤:
nbs-1、sulfo-nbs-1中n是1~6的整数,
nbnco中n是1~6的整数,
第一步,将摩尔比为1:(3~5):(1.5~2.5)的化合物4、碳酸钾和n-boc溴乙胺溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯得到化合物5;
第二步,将第一步制备的化合物5溶于溶剂和过量的三氟乙酸的混合溶液中,室温反应,反应结束后旋干除去溶剂,剩余物真空抽干2h,将抽干后的剩余物溶于溶剂中,缓慢滴加含有双琥珀酰亚胺酯的溶液,双琥珀酰亚胺酯与化合物5的摩尔比为(1~1.5):1,加入催化量的三乙胺,常温反应,反应结束后,旋干除去溶剂,柱层析提纯,得到化合物nbs-1;
或,缓慢滴加含有双琥珀酰亚胺酯磺酸钠的溶液,双琥珀酰亚胺酯磺酸钠与化合物5的摩尔比为(1~1.5):1,加入催化量的三乙胺,常温反应,反应结束后,旋干除去溶剂,柱层析提纯,得到化合物sulfo-nbs-1;
或,缓慢滴加含有异氰酸酯的溶液,异氰酸酯与化合物5的摩尔比为(1~1.5):1,加入催化量的三乙胺,常温反应,反应结束后,旋干除去溶剂,柱层析提纯,得到化合物nbnco;
nbs-2、sulfo-nbs-2中n是1~10的整数,
第一步,将摩尔比为1:(1.1~3):(1.1~4)的化合物4、溴丁酸甲酯和碳酸钾溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,乙醇重结晶,得到化合物6;
第二步,将第一步制备的化合物6溶于溶剂中,加入过量的氢氧化钾常温反应,反应结束后,旋干除去溶剂,水溶解,调ph直至4为止,产生黄色沉淀,过滤取滤饼,得到化合物7;
第三步,将第二步制备的摩尔比为1:(1~1.5):(1~1.5)的化合物7、羟基丁二酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶于溶剂中,常温反应,反应结束后,二氯甲烷和水萃取,取有机相,旋干除去溶剂,柱层析提纯,得到化合物nbs-2;
或,将第二步制备的摩尔比为1:(1~1.5):(1~1.5)的化合物7、羟基丁二酰亚胺磺酸钠和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶于溶剂中,常温反应,反应结束后,二氯甲烷和水萃取,取有机相,旋干除去溶剂,柱层析提纯,得到化合物sulfo-nbs-2;
nbm、sulfo-nbm中n是0~6的整数,
第一步,将摩尔比为1:(1.1~3):(1.1~4)的化合物4、二溴代烷基和碳酸钾溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯,得化合物10;
第二步,将第一步制备的摩尔比为1:(1.1~3):(1.1~4)的化合物10、马来酰亚胺和碳酸钾溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯,得到化合物nbm;
或,将第一步制备的摩尔比为1:(1.1~3):(1.1~4)的化合物10、马来酰亚胺磺酸钠和碳酸钾溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯,得到化合物sulfo-nbm;
nbpm中n是1~4的整数,
第一步,将摩尔比为1:(1.1~3):(1.1~4)的化合物4、二溴代缩聚乙二醇和碳酸钾溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯,得化合物11;
第二步,将第一步制备的摩尔比为1:(1.1~3):(1.1~4)的化合物11、马来酰亚胺和碳酸钾溶于溶剂中,回流反应,反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯,得化合物nbpm;
n是2~6的整数,
第一步,将摩尔比为1:(1.1~3)的化合物nbs-2-4c、n-boc氨基酸溶于溶剂中,常温反应,反应结束后,旋干除去溶剂,柱层析提纯得化合物12;
第二步,将第一步制备的化合物12溶于溶剂和过量的三氟乙酸的混合溶液中,室温反应,反应结束后旋干除去溶剂,剩余物真空抽干2h,将抽干后的剩余物溶于溶剂中,加入琥珀酰亚胺生物素,琥珀酰亚胺生物素与化合物12的摩尔比为(1.1~3):1,反应结束后,旋干除去溶剂,柱层析提纯得化合物13;
第三步,将第二步制备的摩尔比为1:(1.1~3):(1.1~3)的化合物13、羟基丁二酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶于溶剂中,常温反应,反应结束后,二氯甲烷和水萃取,取有机相旋干除去溶剂,柱层析提纯得到化合物tri-nb。
所述双琥珀酰亚胺酯为双琥珀酰亚胺戊二酸酯、双琥珀酰亚胺戊二酸酯。
所述双琥珀酰亚胺酯磺酸钠为双琥珀酰亚胺辛二酸酯磺酸钠、双琥珀酰亚胺戊二酸酯磺酸钠。
所述异氰酸酯为1,8-辛二异氰酸酯、1,6-己二异氰酸酯。
所述溴丁酸甲酯为4-溴丁酸甲酯、8-溴辛酸甲酯。
所述二溴代烷基为1,4-二溴己烷、1,4-二溴丁烷。
所述二溴代缩聚乙二醇为1-溴-2-(2-(2-(2-溴乙氧基)乙氧基)乙氧基)乙烷、1,2-双(2-溴乙氧基)乙烷。
所述n-boc氨基酸为n-boc赖氨酸。
所述化合物4的制备方法包括以下步骤:
第一步,将摩尔比为1:(1.5~3):(1.1~1.5)的香草醛、碳酸钾和苄溴溶于溶剂中,回流反应,反应结束过滤、旋干、重结晶获得化合物1;
第二步,将第一步制备的化合物1研磨成粉末,缓慢加入过量的硝酸,冰浴反应,反应结束后,将反应液倒入冰水中搅拌过滤,重结晶得到化合物2;
第三步,将第二步制备的化合物2溶于过量的三氟乙酸中,室温反应,反应结束后,旋干除去溶剂,将剩余物完全溶于氢氧化钠水溶液和乙酸乙酯混合液中,调ph值到弱酸性,萃取有机相,旋干除去溶剂,剩余物中加入石油醚,过滤取滤饼,重复3次,得化合物3;
第四步,将第三步制备的化合物3溶于溶剂中,缓慢加入化合物3摩尔数1.5~2.5倍的硼氢化钠,室温反应,反应结束后,萃取有机相,调ph值到弱酸性,旋干除去溶剂,得化合物4。
所述溶剂为二甲基甲酰胺、乙腈、二氯甲烷、乙醇、水、甲醇、丙酮。
本发明的第三个方面提供了一种所述光响应性多功能化学交联剂在蛋白质相互作用中的应用。
所述光响应性多功能化学交联剂在蛋白质相互作用中的应用包括以下步骤:
第一个方法:将所述光响应性多功能化学交联剂加入到单一目标蛋白溶液中孵育,用365nm光照实现对蛋白的交联,然后进行蛋白电泳(sds-page)、蛋白质印记(westernblot)、蛋白质交联质谱(lc-ms/ms)分析;
第二个方法:将所述光响应性多功能化学交联剂加入到一组具有特异性相互作用的蛋白溶液中孵育,用365nm光照实现交联相互作用的蛋白,捕获蛋白质相互作用,然后进行蛋白电泳(sds-page)、蛋白质印记(westernblot)、蛋白质交联质谱(lc-ms/ms)分析;
第三个方法:将所述光响应性多功能化学交联剂加入到单一目标蛋白溶液中孵育,然后进行透析,得到带有所述光响应性多功能化学交联剂的目标蛋白,将带有所述光响应性多功能化学交联剂的目标蛋白与其相互作用蛋白孵育,用365nm光照实现对蛋白相互作用对的交联,然后进行蛋白电泳(sds-page)、蛋白质印记(westernblot)、蛋白质交联质谱(lc-ms/ms)分析;
所述第一个方法中单一目标蛋白是链霉亲和素(sa)作为模型蛋白。
所述第二个方法中一组具有特异性相互作用的蛋白是金黄色葡萄球菌蛋白a(spa)和小鼠免疫球蛋白g(igg)作为模型蛋白。
所述第三个方法中单一目标蛋白是金黄色葡萄球菌蛋白a(spa),与其相互作用蛋白是小鼠免疫球蛋白g(igg)。
本发明以香草醛为原料,经过酚羟基保护、硝化、酚羟基去保护得到一个中间体,该中间体经过和溴代化合物反应,可以在酚羟基引入一个具有不同长度的间隔臂,再进一步在另一端通过相应的反应引入传统化学基团(琥珀酰亚胺、马来酰亚胺、异氰酸酯等),即具有了化学交联剂的作用,通过改变反应原料投料比、反应温度、反应溶剂等条件,得到了具有不同功能、不同长度的化学交联剂。
本发明提出利用邻硝基苄醇结构构建光响应性多功能化学交联剂并用于对蛋白质组学的研究,该结构具有光响应性,在365nm光照射下即可对蛋白质上赖氨酸侧链上的游离氨基进行特异性反应,形成稳定的共价交联。因为邻硝基苄醇的光响应性,该结构具有时空可控性,在引入不同臂长、不同化学反应基团后,可以实现对不同蛋白质相互作用,进行时空可控的分析。
由于采用上述技术方案,本发明具有以下优点和有益效果:
本发明的光响应性多功能化学交联剂利用邻硝基苄醇结构,实现时空可控的氨基偶联标记,相比其他光响应基团,具有更高的效率和特异性;利用邻硝基苄醇结构构建的蛋白异功能交联剂,相比于传统化学交联剂,在蛋白质组学中具有时空可控的优势,用蛋白电泳和蛋白质交联质谱解析,可以更准确的捕获蛋白质相互作用信息;以香草醛为原料,经过一系列简单的合成,即可制备该分子,综合产率在50%以上,原料价格便宜,反应简单高效,具有商业价值。
本发明的光响应性多功能化学交联剂制备方法简单、成本低廉,是首例基于邻硝基苄醇光交联反应的交联剂,通过光生醛基与氨基发生偶联反应来交联蛋白:在所述交联剂中,光反应基团对含-nh2的氨基酸残基具有很高的交联效率和选择性;通过与其它传统交联剂中所用的功能基团组合,得到具有光响应的异功能交联剂,实现异源蛋白特异性交联,在蛋白组学研究中具有重大潜在应用。
附图说明
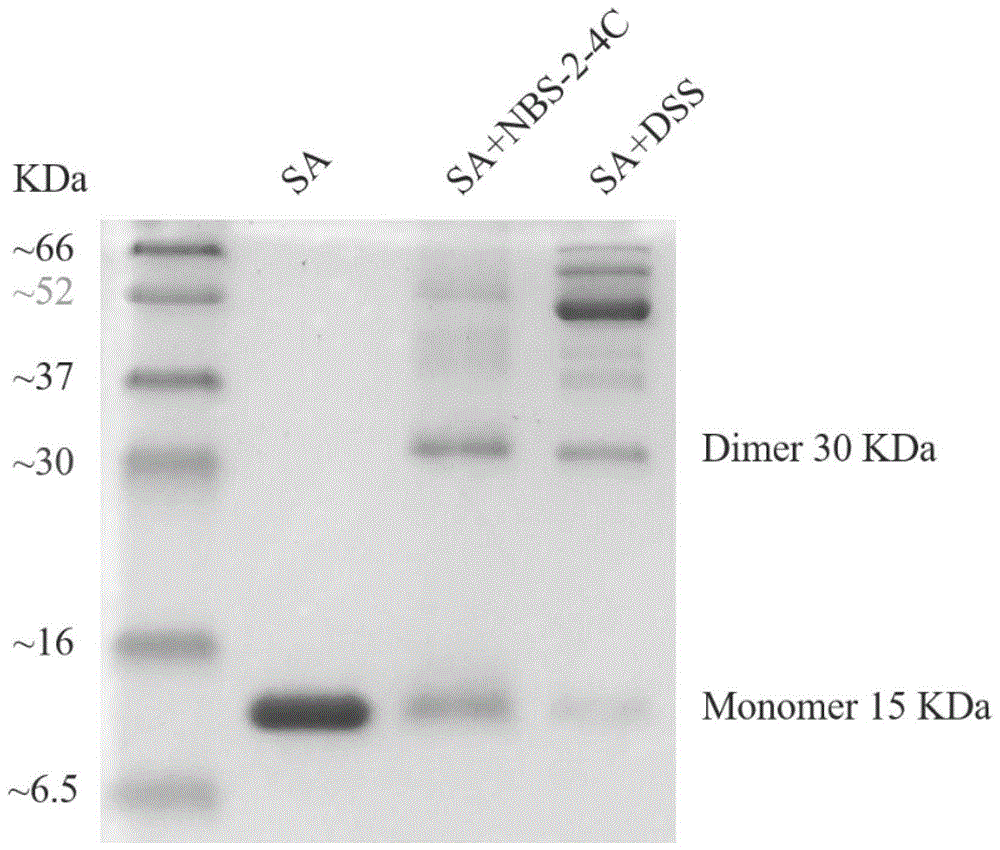
图1是实施例18中的链霉亲和素光交联电泳的示意图。
图2是实施例19中的金黄色葡萄球菌蛋白a和小鼠免疫球蛋白g相互作用的电泳示意图。
图3是实施例20中的金黄色葡萄球菌蛋白a和小鼠免疫球蛋白g相互作用的电泳示意图。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
以下实施例中合成用原料试剂分别购买于安耐吉化学、百灵威科技有限公司和阿拉丁试剂有限公司等试剂公司,所有购买的试剂除另外说明的未经进一步纯化,购买后直接使用;反应溶剂如二甲基甲酰胺、二氯甲烷、乙腈等均经过蒸馏干燥处理,反应过程均在氩气保护条件下实施。
实施例1
第一步,将香草醛(50g,328mmol)、碳酸钾(82.8g、600mmol)和苄溴(76.9g,450mmol)溶于乙腈1000ml中,80℃回流9h,点板监控(tlc监测反应),待反应结束,过滤取滤液,旋干除去溶剂,得浅黄色粘稠液体。将液体溶于乙醇,加热至澄清透明,加入少量石油醚,冷却至室温,重结晶过夜,析出白色晶体,过滤取滤饼,得67g白色晶体为化合物1,产率84%。1hnmr(400mhz,cdcl3),δ(ppm):9.81(s,1h);7.45-7.37(m,7h);7.01(d,j=8.6hz,1h);5.24(s,2h);3.94(s,3h).13cnmr(100mhz,cdcl3),δ(ppm):190.9,153.6,150.1,136.0,130.3,128.8,128.2,127.2,126.6,112.4,109.3,70.8,56.1.ms(esi):m/z:calcd.forc15h14o3na+[m+na]+:265.2.found:265.2.
第二步,
将第一步制备的化合物1(8g,33mmol)研磨成粉末,缓慢加入含有30ml硝酸的圆底烧瓶中,待反应冒出红棕色气体时,给反应加冰浴,点板监控。反应结束后,将反应液倒入1.5l冰水中搅拌,过滤取滤饼,乙醇重结晶,得8g黄色晶体化合物2,产率84%。1hnmr(400mhz,cdcl3),δ(ppm):10.44(s,1h),7.67(s,1h),7.45-7.36(m,6h),5.26(s,2h),4.01(s,3h).13cnmr(100mhz,cdcl3),δ(ppm):187.8,153.7,151.4,134.8,128.8,127.6,125.7,110.0,108.8,71.5,56.7.ms(esi):m/z:calcd.forc15h14no5+[m+h]+:288.2.found:288.2.
第三步,
将第二步制备的化合物2(10g,35mmol)溶于100ml三氟乙酸中,室温反应9h,点板监控。反应结束后,旋干除去溶剂。将剩余物完全溶于氢氧化钠水溶液和乙酸乙酯混合液,调ph值到弱酸性,萃取有机相。旋干除去溶剂,剩余物中加入少量石油醚,过滤取滤饼,重复3次,得6.5g土黄色粉末化合物3,产率95%。1hnmr(400mhz,dmso-d6),δ(ppm):11.12(s,1h),10.16(s,1h),7.51(s,1h),7.36(s,1h),3.95(s,3h).13cnmr(100mhz,dmso-d6),δ(ppm):188.3,151.7,150.9,143.7,123.3,111.0,110.5,56.3.ms(esi):m/z:calcd.forc8h7no5na+[m+na]+:220.0.found:220.0.
第四步,
将第三步制备的化合物3(10g,51mmol)溶于二氯甲烷100ml和甲醇400ml混合溶液中,缓慢加入硼氢化钠(3.8g,100mmol),室温反应15min。反应结束后,萃取有机相,调ph值到弱酸性,旋干除去溶剂,得10g黄色粉末化合物4,产率99%。1hnmr(400mhz,dmso-d6)δ9.92(s,1h),7.56(s,1h),7.34(s,1h),4.79(s,2h),3.90(s,3h).13cnmr(101mhz,dmso-d6)δ153.30,145.42,138.84,132.89,111.71,110.42,60.62,56.43.ms(esi):m/z:calcd.forc8h9no5na+[m+na]+:222.1.found:222.1.
第五步,
将第四步制备的化合物4(5g,25mmol)、碳酸钾(13.8g,100mmol)和n-boc溴乙胺(11.2g,50mmol)溶于乙腈中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得8g黄色粉末化合物5,产率93%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.21(s,1h),4.97(s,2h),4.13(t,j=5.3hz,2h),3.99(s,3h),3.60(q,j=5.4hz,2h),1.45(s,9h).13cnmr(100mhz,cdcl3),δ(ppm):155.87,154.31,146.89,139.54,132.98,111.14,110.19,79.74,69.08,62.70,56.36,39.86,28.39.ms(esi):m/z:calcd.forc15h23n2o7+[m+h]+:343.2.found:343.2.
第六步,
将第五步制备的化合物5(5g,14.6mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml中(v:v=10:1),室温反应1h,反应结束后旋干除去溶剂,剩余物真空抽干2h,将抽干后的剩余物溶于二氯甲烷50ml中,缓慢滴加含有双琥珀酰亚胺辛二酸酯(7.4g,20mmol)的二氯甲烷溶液50ml,加入过量三乙胺,常温反应3h。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得6g淡黄色粉末化合物nbs-1-8c,产率83%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.26(s,1h),6.23(t,j=5.8hz,1h),4.97(s,2h),4.15(t,j=5.0hz,2h),3.99(s,3h),3.72(q,j=5.3hz,2h),2.84(d,j=4.2hz,4h),2.57(t,j=7.2hz,2h),2.22(t,j=7.4hz,2h),1.68(dp,j=14.0,7.1hz,4h),1.39(ddt,j=20.1,14.2,6.8hz,4h).13cnmr(100mhz,cdcl3),δ(ppm):173.75,169.36,168.62,154.24,146.73,139.49,133.30,111.05,110.31,68.67,62.55,56.42,38.67,36.30,30.85,28.41,28.21,25.61,25.23,24.36.ms(esi):m/z:calcd.forc22h30n3o10+[m+h]+:496.2.found:496.2.
实施例2
将实施例1中化合物5(5g,14.6mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml(v:v=10:1)中,室温反应1h。反应结束后旋干除去溶剂,剩余物真空抽干2h。将抽干后的剩余物溶于二氯甲烷50ml中,缓慢滴加含有双琥珀酰亚胺戊二酸酯(6.5g,20mmol)的二氯甲烷100ml溶液,加入过量三乙胺,常温反应3h。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得5.8g淡黄色粉末化合物nbs-1-5c,产率88%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.25(s,1h),6.20(t,j=5.8hz,1h),4.87(s,2h),4.05(t,j=5.0hz,2h),3.99(s,3h),3.62(q,j=5.3hz,2h),2.74(d,j=4.2hz,4h),2.47(t,j=7.2hz,2h),2.32(t,j=7.4hz,2h),1.88(dp,j=14.0,7.1hz,2h).13cnmr(100mhz,cdcl3),δ(ppm):173.75,169.36,168.62,154.24,146.73,139.49,133.30,111.05,110.31,68.67,62.55,56.42,38.67,36.30,30.85,28.21,24.36.ms(esi):m/z:calcd.forc19h24n3o10+[m+h]+:454.1.found:454.1.
实施例3
将实施例1中化合物5(5g,14.6mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml(v:v=10:1)中,室温反应1h,反应结束后旋干除去溶剂,剩余物真空抽干2h,将抽干后的剩余物溶于二氯甲烷50ml中,缓慢滴加含有双琥珀酰亚胺辛二酸酯磺酸钠(11.4g,20mmol)的二氯甲烷50ml溶液,加入过量三乙胺,常温反应3h。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得6g淡黄色粉末化合物sulfo-nbs-1-8c,产率69%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.26(s,1h),6.23(t,j=5.8hz,1h),4.97(s,2h),4.25(t,j=5.0hz,1h),4.15(t,j=5.0hz,2h),3.99(s,3h),3.72(q,j=5.3hz,2h),3.32(m,1h),3.02(m,1h),2.57(t,j=7.2hz,2h),2.22(t,j=7.4hz,2h),1.68(dp,j=14.0,7.1hz,4h),1.39(ddt,j=20.1,14.2,6.8hz,4h).13cnmr(100mhz,cdcl3),δ(ppm):173.75,169.36,168.62,154.24,146.73,139.49,133.30,111.05,110.31,68.67,62.55,59.01,56.42,38.67,36.30,30.85,28.41,28.21,25.61,24.36,20.23.ms(esi):m/z:calcd.forc22h28n3o13s-[m-na]-:574.1.found:574.1.
实施例4
将实施例1中化合物5(5g,14.6mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml(v:v=10:1)中,室温反应1h。反应结束后旋干除去溶剂,剩余物真空抽干2h。将抽干后的剩余物溶于二氯甲烷50ml中,缓慢滴加含有双琥珀酰亚胺戊二酸酯磺酸钠(10.6g,20mmol)的二氯甲烷50ml溶液,加入过量三乙胺,常温反应3h。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得5.5g淡黄色粉末化合物sulfo-nbs-1-5c,产率68%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.25(s,1h),6.20(t,j=5.8hz,1h),4.87(s,2h),4.25(t,j=5.0hz,1h),4.05(t,j=5.0hz,2h),3.99(s,3h),3.62(q,j=5.3hz,2h),3.32(m,1h),3.02(m,1h),2.47(t,j=7.2hz,2h),2.32(t,j=7.4hz,2h),1.88(dp,j=14.0,7.1hz,2h).13cnmr(100mhz,cdcl3),δ(ppm):173.75,169.36,168.62,154.24,146.73,139.49,133.30,111.05,110.31,68.67,62.55,59.01,56.42,38.67,36.30,30.85,24.36,20.23.ms(esi):m/z:calcd.forc19h22n3o13s-[m-na]-:532.1.found:532.1.
实施例5
第一步,将实施例1中化合物4(5g,20mmol)、4-溴丁酸甲酯(5.43g,30mmol)和碳酸钾(6.9g,50mmol)溶于乙腈250ml中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,乙醇重结晶,得4.8g黄色粉末化合物6-1,产率85%。1hnmr(400mhz,cdcl3),δ(ppm):7.70(s,1h),7.18(s,1h),4.96(s,2h),4.13(t,j=6.2hz,2h),3.98(s,3h),3.71(s,3h),2.57(t,j=7.2hz,2h),2.27–2.11(m,2h).13cnmr(100mhz,cdcl3),δ(ppm):173.43,154.29,147.13,139.56,132.49,111.10,109.48,68.26,62.77,56.43,51.76,30.38,24.25.ms(esi):m/z:calcd.forc13h17no7na[m+na]+:322.1.found:322.1.
第二步,将第一步制备的化合物6-1(5g,17.5mmol)溶于浓度为90%的乙醇水溶液100ml中,加入氢氧化钾(1.4g,25mmol),常温反应15min。反应结束后,旋干除去溶剂,水溶解,调ph直至4为止,产生黄色沉淀,过滤取滤饼,得4g黄色粉末化合物7-1,产率84%。1hnmr(400mhz,dmso),δ(ppm):12.20(s,1h),7.67(s,1h),7.39(s,1h),4.83(s,2h),4.07(t,j=6.5hz,2h),3.93(s,3h),2.41(t,j=7.3hz,2h),1.97(p,j=6.9hz,2h).13cnmr(100mhz,dmso),δ(ppm):174.00,153.68,145.98,138.25,134.23,109.61,108.82,67.83,60.08,56.03,29.91,24.01.ms(esi):m/z:calcd.forc12h15no7k[m+k]+:324.0.found:324.1.
第三步,将第二步制备的化合物7-1(5g,18.5mmol)、羟基丁二酰亚胺(2.3g,20mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3.8g,20mmol)溶于二氯甲烷100ml中,常温反应2h。反应结束后,二氯甲烷和水萃取,取有机相,旋干除去溶剂,柱层析提纯(二氯甲烷),得5.5g黄色粉末化合物nbs-2-4c,产率81%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.27(s,1h),4.96(s,2h),4.19(t,j=6.0hz,2h),3.99(s,3h),2.96–2.78(m,6h),2.37–2.23(m,2h).13cnmr(100mhz,cdcl3),δ(ppm):169.10,168.16,154.41,146.98,139.65,132.64,111.29,109.93,67.49,62.89,27.56,25.60,24.17.ms(esi):m/z:calcd.forc16h19n2o9[m+h]+:383.1.found:383.2.
实施例6
将实施例5中化合物7-1(5g,18.5mmol)、羟基丁二酰亚胺磺酸钠(4.3g,20mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3.8g,20mmol)溶于二氯甲烷100ml中,常温反应2h。旋干除去溶剂,乙醇重结晶,得8g黄色粉末化合物sulfo-nbs-2-4c,产率92%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.27(s,1h),4.96(s,2h),4.25(t,j=5.0hz,1h),4.19(t,j=6.0hz,2h),3.99(s,3h),3.32(m,1h),3.02(m,1h),2.96–2.78(m,2h),2.37–2.23(m,2h).13cnmr(100mhz,cdcl3),δ(ppm):169.43,168.56,154.07,146.65,139.54,132.33,111.22,109.65,67.78,62.45,59.78,27.78,25.34,24.11.ms(esi):m/z:calcd.forc16h17n2o12s-[m-na]-:461.1.found:461.2.
实施例7
第一步,将实施例1中化合物4(5g,20mmol)、8-溴辛酸甲酯(7.1g,30mmol)和碳酸钾(6.9g,50mmol)溶于乙腈100ml中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,乙醇重结晶,得5.8g黄色粉末化合物6-2,产率85%。1hnmr(400mhz,cdcl3),δ(ppm):7.70(s,1h),7.18(s,1h),4.96(s,2h),4.13(t,j=6.2hz,2h),3.98(s,3h),3.81(s,3h),2.67(t,j=7.2hz,2h),2.32–2.02(m,10h).13cnmr(100mhz,cdcl3),δ(ppm):173.43,154.29,147.13,139.56,132.49,111.10,109.48,68.26,62.77,56.43,51.76,30.38,29.45,26.78,25.34,24.78,24.25.ms(esi):m/z:calcd.forc17h25no7na[m+na]+:378.2.found:378.1.
第二步,将第一步制备的化合物6-2(5g,14.6mmol)溶于浓度为90%的乙醇水溶液100ml中,加入氢氧化钾(1.4g,25mmol),常温反应15min。反应结束后,旋干除去溶剂,水溶解,调ph直至4为止,产生黄色沉淀,过滤取滤饼,得4.2g黄色粉末化合物7-2,产率89%。1hnmr(400mhz,dmso),δ(ppm):7.70(s,1h),7.18(s,1h),4.96(s,2h),4.13(t,j=6.2hz,2h),3.98(s,3h),2.67(t,j=7.2hz,2h),2.32–2.02(m,10h).13cnmr(100mhz,dmso),δ(ppm):174.00,153.68,145.98,138.25,134.23,109.61,108.82,67.83,60.08,56.03,29.91,29.45,26.78,25.34,24.78,24.01.ms(esi):m/z:calcd.forc16h24no7[m+h]+:342.2.found:342.1.
第三步,将第二步制备的化合物7-2(4.9g,15mmol)、羟基丁二酰亚胺(2.3g,20mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3.8g,20mmol)溶于二氯甲烷100ml中,常温反应2h。反应结束后,二氯甲烷水萃取,取有机相,旋干除去溶剂,柱层析提纯(二氯甲烷),得5.5g黄色粉末化合物nbs-2-8c,产率87%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.27(s,1h),4.96(s,2h),4.19(t,j=6.0hz,2h),3.99(s,3h),2.96–2.78(m,6h),2.45–2.01(m,10h).13cnmr(100mhz,cdcl3),δ(ppm):169.10,168.16,154.41,146.98,139.65,132.64,111.29,109.93,67.49,62.89,29.91,29.45,27.56,26.78,25.60,24.78,24.17.ms(esi):m/z:calcd.forc20h27n2o9[m+h]+:439.2.found:439.2.
实施例8
将实施例7中化合物7-2(4.9g,15mmol)、羟基丁二酰亚胺磺酸钠(4.3g,20mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3.8g,20mmol)溶于二氯甲烷100ml中,常温反应2h。旋干除去溶剂,乙醇重结晶,得6.8g黄色粉末化合物sulfo-nbs-2-8c,产率87%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.27(s,1h),4.96(s,2h),4.25(t,j=5.0hz,1h),4.19(t,j=6.0hz,2h),3.99(s,3h),3.32(m,1h),3.02(m,1h),2.96–2.78(m,2h),2.37–2.23(m,10h).13cnmr(100mhz,cdcl3),δ(ppm):169.43,168.56,154.07,146.65,139.54,132.33,111.22,109.65,67.78,62.45,59.78,29.91,29.45,27.56,26.78,25.60,24.78,24.17.ms(esi):m/z:calcd.forc20h25n2o12s-[m-na]-:517.1.found:517.2.
实施例9
第一步,将实施例1中化合物4(5g,20mmol)、1,4-二溴丁烷(8.6g,40mmol)和碳酸钾(6.9g,50mmol)溶于乙腈100ml中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(二氯甲烷)。得6g黄色粉末化合物10-1,产率71%。1hnmr(400mhz,cdcl3),δ(ppm):7.70(s,1h),7.17(s,1h),4.96(s,2h),4.12(t,j=5.9hz,2h),3.99(s,3h),3.51(t,j=6.3hz,2h),2.15–1.99(m,4h).13cnmr(100mhz,cdcl3),δ(ppm):154.28,147.25,139.67,132.32,111.24,109.42,68.49,62.89,56.45,33.21,29.33,27.58.ms(esi):m/z:calcd.forc12h17no5br+[m+h]+:334.0.found:334.1.
第二步,将第一步制备的化合物10-1(5g,15mmol)、马来酰亚胺(1.9g,20mmol)和碳酸钾(4.1g,30mmol)溶于二甲基甲酰胺100ml中,50℃回流3h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得4g淡黄色粉末化合物nbm-4c,产率76%。1hnmr(400mhz,cdcl3),δ(ppm):7.68(s,1h),7.16(s,1h),6.71(s,2h),4.95(s,2h),4.09(t,j=6.0hz,2h),3.98(s,3h),3.62(t,j=6.7hz,2h),1.94–1.72(m,4h).13cnmr(100mhz,cdcl3),δ(ppm):170.83,154.30,147.29,139.70,134.14,132.26,111.28,109.50,68.71,62.92,56.43,37.42,26.22,25.20.ms(esi):m/z:calcd.forc16h19n2o7+[m+h]+:351.1.found:351.1.
实施例10
第一步,将实施例1中化合物4(5g,20mmol)、1,4-二溴己烷(9.7g,40mmol)和碳酸钾(6.9g,50mmol)溶于乙腈100ml中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(二氯甲烷),得6.5g黄色粉末化合物10-2,产率90%。1hnmr(400mhz,cdcl3),δ(ppm):7.70(s,1h),7.17(s,1h),4.96(s,2h),4.12(t,j=5.9hz,2h),3.99(s,3h),3.51(t,j=6.3hz,2h),2.15–1.99(m,8h).13cnmr(100mhz,cdcl3),δ(ppm):154.28,147.25,139.67,132.32,111.24,109.42,68.49,62.89,56.45,33.21,29.33,27.58,25.41,24.92.ms(esi):m/z:calcd.forc14h21no5br+[m+h]+:362.1.found:362.2.
第二步,将第一步制备的化合物10-2(5.4g,15mmol)、马来酰亚胺(1.9g,20mmol)和碳酸钾(4.1g,30mmol)溶于二甲基甲酰胺100ml中,50℃回流3h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得4.5g淡黄色粉末化合物nbm-6c,产率79%。1hnmr(400mhz,cdcl3),δ(ppm):7.68(s,1h),7.16(s,1h),6.71(s,2h),4.95(s,2h),4.09(t,j=6.0hz,2h),3.98(s,3h),3.62(t,j=6.7hz,2h),1.94–1.72(m,8h).13cnmr(100mhz,cdcl3),δ(ppm):170.83,154.30,147.29,139.70,134.14,132.26,111.28,109.50,68.71,62.92,56.43,37.42,26.22,25.20,25.41,24.92.ms(esi):m/z:calcd.forc18h23n2o7+[m+h]+:379.2.found:379.1.
实施例11
将实施例9中化合物10-1(5g,15mmol)、马来酰亚胺磺酸钠(4g,20mmol)和碳酸钾(4.1g,30mmol)溶于二甲基甲酰胺100ml中,50℃回流3h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得5g淡黄色粉末化合物sulfo-nbm-4c,产率74%。1hnmr(400mhz,cdcl3),δ(ppm):8.21(s,1h),7.68(s,1h),7.16(s,1h),4.95(s,2h),4.09(t,j=6.0hz,2h),3.98(s,3h),3.62(t,j=6.7hz,2h),1.94–1.72(m,4h).13cnmr(100mhz,cdcl3),δ(ppm):170.83,154.30,147.29,139.70,134.14,132.26,111.28,109.50,68.71,62.92,59.05,56.43,37.42,26.22.ms(esi):m/z:calcd.forc16h17n2o10s-[m-na]-:429.1.found:429.2.
实施例12
将实施例10中化合物10-2(5.4g,15mmol)、马来酰亚胺磺酸钠(4g,20mmol)和碳酸钾(4.1g,30mmol)溶于二甲基甲酰胺100ml中,50℃回流3h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得5.5g淡黄色粉末化合物sulfo-nbm-6c,产率76%。1hnmr(400mhz,cdcl3),δ(ppm):8.21(s,1h),7.68(s,1h),7.16(s,1h),4.95(s,2h),4.09(t,j=6.0hz,2h),3.98(s,3h),3.62(t,j=6.7hz,2h),1.94–1.72(m,8h).13cnmr(100mhz,cdcl3),δ(ppm):170.83,154.30,147.29,139.70,134.14,132.26,111.28,109.50,68.71,62.92,59.05,56.43,37.42,26.22,25.41,24.92.ms(esi):m/z:calcd.forc16h17n2o10s-[m-na]-:429.1.found:429.2.
实施例13
将实施例1中化合物5(5.1g,15mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml(v:v=10:1)中,室温反应1h。反应结束后旋干除去溶剂,剩余物真空抽干2h。将抽干后的剩余物溶于二氯甲烷50ml中,缓慢滴加含有1,6-己二异氰酸酯(3.4g,20mmol)的二氯甲烷溶液50ml,加入过量三乙胺,常温反应3h。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得5g淡黄色粉末化合物nbnco-6c,产率70%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.25(d,j=13.5hz,1h),6.20(t,j=5.8hz,1h),6.03(s,2h),4.87(s,2h),4.05(t,j=5.0hz,2h),3.99(s,3h),3.62(q,j=5.3hz,2h),3.41(t,j=5.1hz,2h),3.04(t,j=5.0hz,2h),1.73-1.45(m,8h).13cnmr(100mhz,cdcl3),δ(ppm):160.82,156.21,148.83,140.31,129.75,127.49,120.40,110.23,69.45,59.31,56.29,44.31,40.32,40.01,32.45,29.36,25.40,25.01.ms(esi):m/z:calcd.forc18h26n4o7na+[m+na]+:433.2.found:433.1.
实施例14
将实施例1中化合物5(5.1g,15mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml(v:v=10:1)中,室温反应1h。反应结束后旋干除去溶剂,剩余物真空抽干2h。将抽干后的剩余物溶于二氯甲烷50ml中,缓慢滴加含有1,8-辛二异氰酸酯(4g,20mmol)的二氯甲烷溶液50ml,加入过量三乙胺,常温反应3h。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得6.5g淡黄色粉末化合物nbnco-8c,产率83%。1hnmr(400mhz,cdcl3),δ(ppm):7.72(s,1h),7.25(d,j=13.5hz,1h),6.20(t,j=5.8hz,1h),6.03(s,2h),4.87(s,2h),4.05(t,j=5.0hz,2h),3.99(s,3h),3.62(q,j=5.3hz,2h),3.41(t,j=5.1hz,2h),3.04(t,j=5.0hz,2h),1.93-1.32(m,12h).13cnmr(100mhz,cdcl3),δ(ppm):160.82,156.21,148.83,140.31,129.75,127.49,120.40,110.23,69.45,59.31,56.29,44.31,40.32,40.01,32.45,29.36,25.40,25.01,24.84,24.32.ms(esi):m/z:calcd.forc20h30n4o7na+[m+na]+:461.2.found:461.3.
实施例15
第一步,将实施例1中化合物4(5g,20mmol)、1-溴-2-(2-(2-(2-溴乙氧基)乙氧基)乙氧基)乙烷(9.6g,30mmol)和碳酸钾(4.1g,30mmol)溶于乙腈100ml中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得7g黄色透明液体化合物11-1,产率80%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.20(s,1h),5.31(s,1h),4.96(s,2h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,2h),3.78–3.62(m,12h).13cnmr(100mhz,cdcl3),δ(ppm):154.24,146.79,139.00,133.38,110.38,109.74,72.57,70.79,70.65,70.20,69.46,68.85,62.23,56.31,53.50,32.13.ms(esi):m/z:calcd.forc16h25o8nbr+[m+h]+:438.1.found:438.2.
第二步,将第一步制备的化合物11-1(5g,11mmol)、马来酰亚胺(1.9g,20mmol)和碳酸钾(4.1g,30mmol)溶于二甲基甲酰胺100ml中,50℃回流3h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得4g淡黄色粉末化合物nbpm-4c,产率80%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.20(s,1h),6.71(s,2h),5.31(s,1h),4.96(s,2h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,2h),3.78–3.62(m,12h).13cnmr(100mhz,cdcl3),δ(ppm):170.50,154.24,146.79,139.00,136.43,133.38,110.38,109.74,72.57,70.79,70.65,70.20,69.46,68.85,62.23,56.31,53.50,40.31.ms(esi):m/z:calcd.forc20h27o10n2+[m+h]+:455.2.found:455.2.
实施例16
第一步,将实施例1中化合物4(5g,20mmol)、1,2-双(2-溴乙氧基)乙烷(8.3g,30mmol)和碳酸钾(4.1g,30mmol)溶于乙腈100ml中,80℃回流9h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:5),得6.7g黄色透明液体化合物11-2,产率85%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.20(s,1h),5.31(s,1h),4.96(s,2h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,2h),3.78–3.62(m,8h).13cnmr(100mhz,cdcl3),δ(ppm):154.24,146.79,139.00,133.38,110.38,109.74,72.57,70.79,70.65,70.20,69.46,62.23,56.31,32.13.ms(esi):m/z:calcd.forc14h21o7nbr+[m+h]+:394.1.found:394.2.
第二步,将第一步制备的化合物11-2(5g,13mmol)、马来酰亚胺(1.9g,20mmol)和碳酸钾(4.1g,30mmol)溶于二甲基甲酰胺100ml中,50℃回流3h,点板监控。反应结束后,过滤取滤液,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇=1000:1),得4.7g淡黄色粉末化合物nbpm-3c,产率89%。1hnmr(400mhz,cdcl3),δ(ppm):7.71(s,1h),7.20(s,1h),6.71(s,2h),5.31(s,1h),4.96(s,2h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,2h),3.78–3.62(m,8h).13cnmr(100mhz,cdcl3),δ(ppm):170.50,154.24,146.79,139.00,136.43,133.38,110.38,109.74,70.79,70.20,69.46,68.85,62.23,56.31,53.50,40.31.ms(esi):m/z:calcd.forc18h23o9n2+[m+h]+:411.1.found:411.2.
实施例17
第一步,将实施例5制备的化合物nbs-2-4c(5g,13mmol)和n-boc赖氨酸(4.9g,20mmol)溶于二甲基甲酰胺250ml中,点板监控反应,反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇:乙酸=1000:50:10),得4g黄色液体化合物12-1,产率60%。1hnmr(400mhz,cdcl3),δ(ppm):12.66(s,1h),7.82(m,1h),7.71(s,1h),7.42(d,1h),7.20(s,1h),5.31(s,1h),4.96(s,2h),4.52(d,1h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,4h),1.52–2.22(m,6h),1.42(s,9h),1.25(m,2h).13cnmr(100mhz,cdcl3),δ(ppm):174.71,172.66,155.95,154.64,148.56,140.31,129.24,127.11,113.24,79.54,68.67,60.23,57.44,56.11,39.22,32.81,30.53,29.76,28.44,24.98,22.77.ms(esi):m/z:calcd.forc23h36n3o10+[m+h]+:514.2.found:514.2.
第二步,将第一步制备的化合物12-1(5g,10mmol)溶于二氯甲烷和三氟乙酸的混合溶液100ml(v:v=10:1)中,室温反应1h。反应结束后旋干除去溶剂,剩余物真空抽干2h。将抽干后的剩余物溶于二甲基甲酰胺100ml中,加入nhs-生物素(5.1g,15mmol),点板监控。反应结束后,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇:乙酸=1000:80:10),得5g黄色固体粉末化合13-1,产率78%。1hnmr(400mhz,cdcl3),δ(ppm):12.66(s,1h),10.86(s,2h),7.82(m,1h),7.71(s,1h),7.42(d,1h),7.20(s,1h),5.31(s,1h),4.96(s,2h),4.61(m,2h),4.52(d,1h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,4h),3.30–2.85(m,3h),1.52–2.22(m,12h),1.25(m,4h).13cnmr(100mhz,cdcl3),δ(ppm):174.71,173.92,172.65,164.74,154.92,148.65,140.22,129.23,127.12,113.25,68.22,63.77,62.45,60.43,56.44,56.11,55.65,41.11,39.22,36.55,32.83,30.61,29.77,28.44,25.22,24.99,24.44,22.77.ms(esi):m/z:calcd.forc28h42n5o10s+[m+h]+:640.3.found:640.3.
第三步,将第二步制备的化合物13-1(5g,7.8mmol)、羟基丁二酰亚胺(2.3g,20mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(3.8g,20mmol)溶于二氯甲烷100ml中,常温反应2h。反应结束后,二氯甲烷水萃取,取有机相,旋干除去溶剂,柱层析提纯(v二氯甲烷:v甲醇:=1000:80),得5g黄色粉末化合物tri-lys-nb,产率87%。1hnmr(400mhz,cdcl3),δ(ppm):10.86(s,2h),7.82(m,1h),7.71(s,1h),7.42(d,1h),7.20(s,1h),5.31(s,1h),4.96(s,2h),4.61(m,2h),4.52(d,1h),4.26–4.19(m,2h),3.94(s,3h),3.98–3.87(m,4h),3.30–2.85(m,3h),2.64(s,4h),1.52–2.22(m,12h),1.25(m,4h).13cnmr(100mhz,cdcl3),δ(ppm):174.71,173.92,172.65,169.11,164.74,154.92,148.65,140.22,129.23,127.12,113.25,68.22,63.77,62.45,60.43,56.44,56.11,55.65,41.11,39.22,36.55,32.83,30.61,29.77,28.44,25.68,25.22,24.99,24.44,22.77.ms(esi):m/z:calcd.forc32h45n6o12s+[m+h]+:737.3.found:737.3.
光响应性多功能化学交联剂应用于蛋白质组学分析,具体如以下实施例:
实施例18
蛋白质相互作用中的应用:
1)选取链霉亲和素(sa)作为模型蛋白,将实施例5制备的化合物nbs-2-4c溶于二甲基亚砜中配制成溶液(52mg/ml,136mm),将商业化交联剂双琥珀酰亚胺辛二酸酯(dss)溶于二甲基亚砜中配制成溶液(50mg,136mm),sa溶液(1mg/ml)用磷酸盐缓冲液(10mm,ph=7.0)配制;取样蛋白溶液,对应泳道sa。
2)在sa溶液(1ml)中加入化合物nbs-2-4c的溶液(10ul)(第1)配制而成的溶液),摇床避光孵育2h(37℃,150rad/min),取样蛋白溶液,对应泳道sa+nbs-2-4c;在sa溶液(1ml)加入dss溶液(10ul)(第1)配制而成的溶液),摇床避光孵育2h(37℃,150rad/min);取样蛋白溶液,对应泳道sa+dss。
3)将以上所有取样蛋白溶液在365nm波长、10mw/cm2下光照2min,随后摇床避光孵育2h(37℃,150rad/min)。结束后,进行常规sds-page,上样量为每泳道10ul,使用分离胶浓度为15%。结果如图1所示,图1是实施例18中的链霉亲和素光交联电泳的示意图,从中可以看出,dimer30kda是交联剂作用下链霉亲和素产生的二聚体条带,monomer15kda是链霉亲和素单体条带,实施例5制备的化合物nbs-2-4c能实现对链霉亲和素的四个亚基进行交联得到二聚体,能达到和商业化交联剂dss同样的效果。
实施例19
蛋白质相互作用中的应用:
1)选取金黄色葡萄球菌蛋白a(spa)和小鼠免疫球蛋白g(igg)作为模型蛋白,spa和igg是已知的一组具有特异性相互作用的蛋白。将实施例5制备的化合物nbs-2-4c溶于二甲基亚砜中配制成溶液(52mg/ml,136mm),将商业化交联剂双琥珀酰亚胺辛二酸酯(dss)溶于二甲基亚砜中配制成溶液(50mg,136mm),spa(1mg/ml)溶液和igg(1mg/ml)溶液均用磷酸盐缓冲液(10mm,ph=7.0)配制。
2)取等体积的spa溶液和igg溶液混合,摇床避光孵育2h(37℃,150rad/min),取样蛋白溶液,对应spa+igg泳道;各取混合液100ul,分别加入nbs-2-4c溶液和dss溶液各10ul,取样蛋白溶液,分别对应spa+igg+nbs-2-4c、spa+igg+dss泳道。
3)将以上所有取样蛋白溶液在365nm波长、10mw/cm2下光照2min,随后摇床避光孵育2h(37℃,150rad/min)。结束后,进行常规sds-page,上样量为每泳道10ul,使用分离胶浓度为10%。结果如图2所示,图2是实施例19中的金黄色葡萄球菌蛋白a和小鼠免疫球蛋白g相互作用的电泳示意图,从中可以看出,cross-linkchain是交联剂作用下金黄色葡萄球菌蛋白a和小鼠免疫球蛋白g交联产生的条带,igg-heavychain50kda是小鼠免疫球蛋白g的重链条带,spa33.4kda是金黄色葡萄球菌蛋白a条带,igg-lightchain25kda是小鼠免疫球蛋白g的轻链条带,实施例5制备的化合物nbs-2-4c能交联相互作用的蛋白,捕获蛋白质相互作用,并接近商业化交联剂dss的效果。
实施例20
蛋白质相互作用中的应用:
1)选取金黄色葡萄球菌蛋白a(spa)和小鼠免疫球蛋白g(igg)作为模型蛋白,spa和igg是已知的一组具有特异性相互作用的蛋白。将实施例5制备的化合物nbs-2-4c溶于二甲基亚砜中配制成溶液(52mg/ml,136mm),将商业化交联剂双琥珀酰亚胺辛二酸酯(dss)溶于二甲基亚砜中配制成溶液(50mg,136mm),spa(1mg/ml)溶液和igg(1mg/ml)溶液均用磷酸盐缓冲液(10mm,ph=7.0)配制。
2)取spa溶液1ml加入实施例5制备的化合物nbs-2-4c溶液100ul,摇床避光孵育2h(37℃,150rad/min)。结束后,用磷酸盐缓冲液透析12h,得spa(nbs-2-4c)溶液。取等体积透析后spa(nbs-2-4c)溶液和igg溶液混合,摇床避光孵育2h(37℃,150rad/min),取样蛋白溶液,对应spa(nbs-2-4c)+igg(nohv)泳道;取样蛋白溶液,在365nm波长、10mw/cm2下光照2min,随后摇床避光孵育2h(37℃,150rad/min),对应spa(nbs-2-4c)+igg泳道,按实施例19的方法,制备spa+igg+nbs-2-4c泳道。
3)进行常规sds-page,上样量为每泳道10ul,使用分离胶浓度为10%。结果如图3所示,图3是实施例20中的金黄色葡萄球菌蛋白a和小鼠免疫球蛋白g相互作用的电泳示意图,从中可以看出,cross-linkchain是交联剂作用下金黄色葡萄球菌蛋白a和小鼠免疫球蛋白g交联产生的条带,igg-heavychain50kda是小鼠免疫球蛋白g的重链条带,spa/spa(nbs-2-4c)33.4kda是金黄色葡萄球菌蛋白a被交联剂标记后的条带,igg-lightchain25kda是小鼠免疫球蛋白g的轻链条带,实施例5制备的化合物nbs-2-4c能交联相互作用的蛋白,捕获蛋白质相互作用;通过此种技术方法,可以实现对不参与蛋白相互作用的igg轻链不进行交联,以此降低假阳性交联结果。
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!