一种抗肿瘤补骨脂多糖及其提取分离方法和在制备抗肿瘤药物方面的应用与流程
本发明属于中药提取技术领域,具体涉及一种抗肿瘤活性补骨脂多糖、提取分离方法和在制备抗肿瘤药物方面的应用。
背景技术:
随着人口老龄化加剧、生态环境遭受破坏、不健康生活方式及食品安全问题等凸现,肿瘤发病率和死亡率持续上升,给人们生活、健康及社会带来严重危害。常见的肿瘤药物及放疗、化疗等虽然具有一定的治疗效果,但副作用较大。中药是我国的医学宝库,中药往往具有多靶点、低毒性、作用持久等特点,中医单独或辅助西药治疗肿瘤在提高机体免疫力、延长生存期、降低复发转移率及减轻副作用等方面有着积极的意义。因此以传统中药为来源研发新型天然抗肿瘤药物,是抗肿瘤药物研究的一个重点方向。
补骨脂为豆科植物补骨脂psoraleacorylifolial.的干燥成熟果实,为传统中药。按照《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号)中执行,补骨脂为可用于保健食品的物品。现代研究表明,补骨脂含有香豆素类、黄酮类、单萜类等多种成分,显示出抗炎、抗菌、抗氧化、降血糖等多种功效。关于补骨脂多糖的研究,目前仅国内几位学者对补骨脂粗多糖的含量及其免疫活性进行了初步研究,未见对补骨脂粗多糖的进一步分离纯化,得到单一的多糖组分,对其进行结构分析及抗肿瘤活性研究。
技术实现要素:
本发明目的在于克服现有技术缺陷,提供一种从补骨脂中提取分离得到、具有抗肿瘤活性的补骨脂多糖。
本发明还提供了上述补骨脂多糖的提取分离方法和在制备抗肿瘤药物方面的应用。
为实现上述目的,本发明采用如下技术方案:
一种抗肿瘤补骨脂多糖的制备方法,其包括如下步骤:
1)制备粗多糖:补骨脂粉碎,先用石油醚室温浸提脱脂,残渣挥干石油醚,再用70±5%乙醇室温浸提以除去色素及小分子成分,残渣挥发至无乙醇味,然后用超纯水于85±5℃加热提取,提取结束后趁热用布氏漏斗抽滤,滤液浓缩获得浓缩液,然后向浓缩液中加入无水乙醇使终浓度为70-75%,静置,收集沉淀,依次无水乙醇、丙酮洗涤沉淀,挥干溶剂即得补骨脂粗多糖;
2)制备脱蛋白的补骨脂粗多糖:将补骨脂粗多糖用超纯水完全溶解获得补骨脂粗多糖溶液,采用sevag法脱蛋白,将得到的上清液减压浓缩后加入无水乙醇至终浓度为75±2%,静置,离心,取沉淀物,干燥,即得脱蛋白的补骨脂粗多糖;
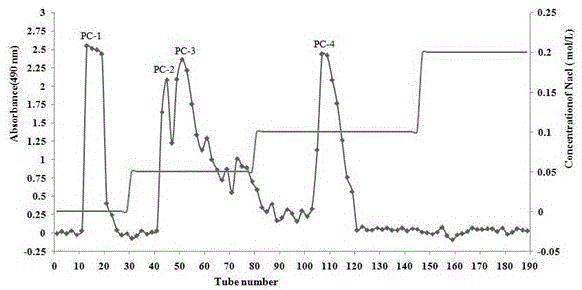
3)取脱蛋白的补骨脂粗多糖,超纯水溶解,离心除去不溶物,然后上样到deae-52纤维素色谱柱,依次用超纯水、0.05、0.1、0.2、0.3mol/lnacl溶液进行梯度洗脱,洗脱液采用苯酚-硫酸法进行检测,测定490nm处的吸光度,以洗脱管数为横坐标,吸光度为纵坐标,绘制多糖洗脱曲线,合并同一洗脱峰的多糖样品、浓缩,透析、冷冻干燥;其中,蒸馏水的洗脱峰为组分pc-1,0.2mol/lnacl溶液的洗脱峰为组分pc-4;
4)组分pc-1用超纯水溶解,上样到sephadexg-100葡聚糖凝胶柱色谱,用超纯水洗脱,采用苯酚-硫酸法进行检测,测定490nm处的吸光度,以洗脱管数为横坐标,吸光度为纵坐标,绘制多糖洗脱曲线,合并同一洗脱峰的多糖样品,浓缩、透析、冷冻干燥后得到的多糖组分命名为pcp-1;
组分pc-4采用与组分pc-1相同的方法进行洗脱,合并同一洗脱峰的多糖样品,浓缩、透析、冷冻干燥后得到的多糖组分命名为pcp-4;
pcp-1和/或pcp-4即为抗肿瘤补骨脂多糖。
具体的,步骤1)中,用石油醚室温浸提脱脂3-5次,每次2-4d;用70±5%乙醇室温浸提3-5次,每次2-4d;超纯水加热提取2-4次,每次3-5h。
具体的,步骤2)中,sevag法脱蛋白时,所用sevag试剂由体积比为4:1的氯仿和正丁醇组成;sevag试剂添加量为补骨脂粗多糖溶液体积的1/4到1/2,优选1/3。
本发明还提供了采用上述方法制备得到的抗肿瘤补骨脂多糖。
本发明还提供了上述补骨脂多糖在制备抗肿瘤药物或食品中的应用。
进一步的,优选上述补骨脂多糖在制备抗肺癌药物或食品中的应用。
和现有技术相比,本发明的有益效果:
本发明采用特殊的提取分离方法从补骨脂中分离得到多糖组分pcp-1和pcp-4,并以非小细胞肺癌a549细胞为例对该多糖组分的抗肿瘤作用进行考察,试验结果表明:该补骨脂多糖能有效抑制a549细胞的活性,说明其具有良好的抗肿瘤作用,可用于制备抗肿瘤药物,尤其是可用于制备抗肺癌药物或食品。
附图说明
图1补骨脂粗多糖deae-52纤维素色谱柱洗脱曲线;
图2组分pc-1和pc-4经sephadexg-100凝胶柱色谱洗脱曲线;
图3标准单糖混合物的gc色谱图;
图4pcp-1的水解物gc色谱图;
图5pcp-4的水解物gc色谱图。
具体实施方式
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
实施例1
1、一种抗肿瘤补骨脂多糖的制备方法,其具体包括如下步骤:
1)制备粗多糖:补骨脂(4.4kg)粉碎,用石油醚室温浸提3次,每次3d,进行脱脂处理。提取后的残渣挥干石油醚,再用70%乙醇室温浸提4次,每次3d,提取后的残渣挥发至无乙醇味(石油醚、70%乙醇添加量以浸没补骨脂为宜)。然后用超纯水于85℃加热提取2次(加热提取时料液比约为1g:20ml),每次5h;提取结束后趁热用布氏漏斗抽滤,合并滤液,滤液旋转蒸发浓缩至原体积的1/4左右,获得浓缩液。向浓缩液中加入无水乙醇使终浓度为70%(体积百分比,下同),室温静置12h,离心弃去上清液,收集沉淀,依次无水乙醇、丙酮洗涤沉淀,挥干溶剂即得补骨脂粗多糖。
2)上述制备的补骨脂粗多糖,用超纯水完全溶解获得补骨脂粗多糖溶液,采用sevag法脱蛋白,具体为:按照补骨脂粗多糖溶液体积的1/3加入sevag试剂,磁力搅拌震荡30min,4000r/min离心5min,除去中间变性蛋白质和下层有机溶剂,将上清液继续重复上述操作,直至无变性蛋白层出现;sevag试剂由体积比为4:1的氯仿和正丁醇组成。将最终得到的上清液减压浓缩后加入无水乙醇至最终乙醇浓度为70%,室温静置12h,离心,取沉淀物,干燥,即得脱蛋白的补骨脂粗多糖。
3)取上述脱蛋白后补骨脂粗多糖1.0g,用10ml超纯水溶解,高速离心除去不溶物,然后上样到deae-52纤维素色谱柱,依次用蒸馏水、0.05、0.1、0.2、0.3mol/lnacl溶液进行梯度洗脱,分别洗脱400、800、800、800、700ml,流速控制在1.0ml/min,每5min收集一管,洗脱液采用苯酚-硫酸法进行检测,用酶标仪测定490nm处的吸光度,以洗脱管数为横坐标,吸光度为纵坐标,绘制多糖洗脱曲线(洗脱曲线如图1所示)。合并同一洗脱峰的多糖溶液,50℃减压浓缩,透析(室温、截留分子量为8000-14000,刚开始每隔3h换一次水,共计三次,随后每隔12h换一次水,共计两次)、冷冻干燥机中冷冻干燥,其中,蒸馏水的洗脱峰为组分pc-1,0.2mol/lnacl溶液的洗脱峰为组分pc-4。
4)取200mg组分pc-1,用2ml超纯水溶解,上样到sephadexg-100葡聚糖凝胶色谱柱(1.5×100cm)进一步分离纯化,用超纯水洗脱,流速控制在0.8ml/min,每5min收集一管,采用苯酚-硫酸法进行检测,测定490nm处的吸光度,以洗脱管数为横坐标,吸光度为纵坐标,绘制多糖洗脱曲线(洗脱曲线如图2所示),合并同一洗脱峰的多糖样品,减压浓缩(50℃),透析(室温、截留分子量为8000-14000,刚开始每隔3h换一次水,共计三次,随后每隔12h换一次水,共计两次),冷冻干燥机中冷冻干燥后得到的多糖组分命名为pcp-1;
组分pc-4采用与组分pc-1相同的方法进行洗脱(洗脱曲线如图2所示),合并同一洗脱峰的多糖样品,浓缩、透析、冷冻干燥后得到的多糖组分命名为pcp-4;
pcp-1和/或pcp-4即为抗肿瘤补骨脂多糖。
补骨脂多糖分子量测定:
具体制备步骤如下:取多糖组分pcp-1和pcp-4送至北京市理化分析测试中心分析检测,按照《中国药典》(2015年版)收录的分子排阻色谱法测定其分子量。结果显示,pcp-1和pcp-4的分子量分别为2.721×104和2.850×104g/mol,详见表1。
表1pcp-1和pcp-4的分子量
、补骨脂多糖单糖组成成分测定。
3.1多糖的水解
准确称取多糖pcp-1和pcp-4各10mg,加入5ml安瓿瓶中,加入3ml4mol/l的三氟乙酸,氮气封管。在110℃下水解3h,旋转蒸发除去三氟乙酸溶液,加入少量甲醇溶解残渣,旋转蒸发至干燥,如此重复3次,得到水解产物,备用。
3.2单糖的衍生化
向水解产物中加入盐酸羟胺10mg,加入吡啶0.5ml,振荡混匀,放入90℃水浴中加热反应30min。取出冷却至室温,加入醋酸酐0.5ml,在90℃下继续反应30min以进行乙酰化,反应产物经0.22μm滤膜过滤后注入气相色谱进行分析;用相同方法处理标准单糖,并制成标准单糖衍生物混合液。
3.3气相色谱条件
色谱柱:hp(30m×0.35mm,0.25μm);进样温度:250℃;检测器温度:280℃;色谱柱升温程序:初始温度100℃保持1min,然后以4℃/min的速度由100℃升至240℃,保持10min;载气:高纯氮气,流速2ml/min;进样量为2µl。
3.4单糖组成分析结果
标准单糖混合物的gc色谱图见图3(1.l-鼠李糖;2.l-阿拉伯糖3.d-木糖;4.d-甘露糖;5.d-葡萄糖;6.d-半乳糖),图4和图5分别为pcp-1和pcp-4经水解后的单糖gc色谱图,通过和标准单糖图谱中保留时间的比较可以确定样品的单糖构成,结果见表2。
表2pcp-1和pcp-4的单糖组成
由表2可以看出:pcp-1和pcp-4均为杂多糖,至少由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,且摩尔比不同;pcp-1含有较高的半乳糖和阿拉伯糖,pcp-4主要由鼠李糖、木糖和半乳糖组成。
抗肿瘤补骨脂多糖pcp-1和pcp-4的活性分析
将对数生长期的非小细胞肺癌a549细胞铺于96微孔板(2×104),培养24h后加药处理,分别加入不同浓度的pcp-1和pcp-4及阳性对照顺铂,作用48h,然后采用mtt法检测细胞存活情况。数值统计采用spss19.0软件单因素方差分析法(one-wayanova)比较其显著性差异。测定结果见表3和表4。
表3不同浓度pcp-1处理a549细胞48h后细胞存活率
表4不同浓度pcp-4处理a549细胞48h后细胞存活率
由表3和表4可以看出,随着培养基中pcp-1和pcp-4浓度的增大,a549细胞的存活率呈下降趋势,且这两种多糖的抗肿瘤活性具有一定的差异,这可能与两种多糖组分中单糖的组成和含量有关。当pcp-1和pcp-4浓度达到100μm时,平均细胞存活率依次仅为48.77%,51.87%,说明pcp-1和pcp-4对a549细胞的存活有明显的抑制作用(ic50=64.84和126.3μm),相对来讲,其活性低于阳性对照顺铂(ic50=11μm)。
上述试验结果表明:本发明补骨脂多糖能有效抑制a549细胞的活性,说明其具有良好的抗肿瘤作用,可用于制备抗肿瘤药物,尤其是可用于制备抗肺癌药物或食品。
- 还没有人留言评论。精彩留言会获得点赞!