一种抗PD-L1抗体或其功能性片段及其用途的制作方法
本申请属于生物医药领域,涉及抗pd-l1抗体的以下方面:一种抗pd-l1抗体或其功能性片段;编码本申请所述抗体或其功能性片段的核酸分子,用于表达所述抗体或其功能性片段的表达载体和宿主细胞;本申请所述抗pd-l1抗体或其功能性片段的制备方法;包含本申请所述抗pd-l1抗体或其功能性片段的免疫缀合物以及其药物组合物;以及本申请所述抗pd-l1抗体或其功能性片段在制备用于治疗t细胞功能失调性疾病的药物的用途。
背景技术:
程序性死亡配体1(programmeddeath-ligand1,pd-l1),也称为分化簇274(clusterofdifferentiation274,cd274)或者b7同源蛋白1(b7homolog1,b7-h1),属于肿瘤坏死因子超家族,是由290个氨基酸残基组成的i型跨膜糖蛋白,包含一个igv样区、一个igc样区、一个跨膜疏水区和一个30个氨基酸的胞内尾部,完整分子量为40kda。几乎所有组织中,pd-l1mrna都有表达,但pd-l1蛋白只在少部分组织中持续表达,例如,肝脏、肺脏、扁桃体以及免疫特赦组织诸如眼、胎盘等。pd-l1也表达于活化的t细胞、b细胞、单核细胞、树突状细胞、巨噬细胞等。
pd-l1的受体为程序性死亡受体1(programmeddeath1,pd-1)。pd-1主要表达于cd4+t细胞、cd8+t细胞、nkt细胞、b细胞和活化的单核细胞等免疫细胞表面。pd-l1与pd-1结合可以启动pd-1胞浆区免疫受体酪氨酸抑制基序(immunoreceptortyrosine-basedinhibitorymotif,itim),酪氨酸残基的磷酸化,促使酪氨酸磷脂酶与shp2结合,活化shp2,使下游syk和pi3k发生去磷酸化从而传递终止信号,限制抗原呈递细胞或者树突状细胞与t细胞的相互作用。这种结合还可以进一步抑制t细胞的代谢,抑制抗凋亡蛋白bcl-x2的分泌,减少效应细胞因子人白细胞介素-2(interleukin-2,il-2)以及r-干扰素(interferon-r,ifn-r)的分泌,诱导t细胞耗竭和凋亡,从而降低免疫t细胞参与的免疫应答,行使负性免疫调节功能。
pd-l1在肿瘤组织高表达,例如,胃癌、肺癌、肝癌、肝内胆管癌、结肠癌、胰腺癌、卵巢癌、乳腺癌、子宫颈癌、头颈鳞状细胞癌、鼻咽癌、食管癌、膀胱癌、肾细胞癌、皮肤癌、口腔鳞状细胞癌等。肿瘤部位pd-l1的表达可以通过多种途径保护肿瘤细胞免受伤害,pd-l1的负性免疫调节功能在肿瘤免疫中发挥着重要作用。因此,以pd-1/pd-l1为靶点的免疫调节对抗肿瘤有重要的意义,而且多种慢性和急性病毒也利用pd-l1信号逃避人体免疫检测。
近年来,越来越多的临床前和临床研究结果表明,靶向免疫检查点正在成为最有希望的治疗癌症患者的方法。pd-1是免疫检查点蛋白之一,通过在活化的t细胞上表达的pd-1与在肿瘤细胞上表达的pd-l1的相互作用对免疫应答起负性调节并减弱抗肿瘤免疫力pd-l1在肿瘤上的表达,其与食管癌、胰腺癌和其它多种类型的癌症的生存率下降相关,该通路已作为新的有前途的肿瘤免疫治疗靶点。有制药公司已经开发了多种针对pd-1/pd-l1通路的药物,且临床试验的数据表明这类药物在多种肿瘤类型的患者中持久的临床活性和良好的安全性。
然而,现有的治疗方法不都是尽如人意,仍然需要新的抗pd-l1的人源抗体。
技术实现要素:
鉴于现有技术的上述不足和抗pd-l1抗体的临床应用需求,本申请的发明者一个方面旨在提供一种抗人pd-l1的抗体和其功能性片段;另一方面,旨在提供所述抗体或其功能性片段在治疗t细胞功能失调性疾病方面的用途;再一方面,旨在提供所述抗体的制备方法及检测方法。
为了达到上述目的,第一方面,本申请提供了一种抗pd-l1全人源抗体,所述抗pd-l1抗体为单克隆抗体,所述抗pd-l1抗体至少包括重链高变区cdr1、cdr2和cdr3中的一种或多种,和/或轻链高变区cdr1、cdr2和cdr3中的一种或多种;其中:
所述轻链高变区cdr1的氨基酸序列为seqidno.3所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.3所示的序列具有同等功能的氨基酸序列,所述轻链高变区cdr2的氨基酸序列为seqidno.4所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.4所示的序列具有同等功能的氨基酸序列,和所述轻链高变区cdr3的氨基酸序列为seqidno.5所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.5所示的序列具有同等功能的氨基酸序列;以及
所述重链高变区cdr1的氨基酸序列为seqidno.6所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.6所示的序列具有同等功能的氨基酸序列,所述重链高变区cdr2的氨基酸序列为seqidno.7所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.7所示序列具有同等功能的氨基酸序列,和所述重链高变区cdr3的氨基酸序列为seqidno.8所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.8所示的序列具有同等功能的氨基酸序列。
其中:所述经替换、缺失或添加一个或多个氨基酸形成的与序列表中seqidno.3-8中任一所示序列具有同等功能的氨基酸序列中是指与本申请所述抗pd-l1抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸替换而形成的多肽。这种变体的序列与其来源序列有至少有95%、96%、97%、98%或99%的一致性。
进一步地,所述抗pd-l1抗体的轻链可变区的氨基酸序列至少包括seqidno.1所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.1所示序列具有同等功能的氨基酸序列,重链可变区的氨基酸序列至少包括seqidno.2所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.2所示序列具有同等功能的氨基酸序列。
进一步地,所述抗pd-l1抗体的轻链框架区(frameworkregion,fr)包括fr1、fr2和fr3中的一种或多种,其中,所述轻链fr1的氨基酸序列为seqidno.9所示的序列或该序列经替换、缺失或添加一个或多个氨基酸形成的与seqidno.9所示序列具有同等功能的氨基酸序列,所述轻链fr2的氨基酸序列为seqidno.10所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.10所示序列具有同等功能的氨基酸序列,和所述轻链fr3的氨基酸序列为seqidno.11所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.11所示序列具有同等功能的氨基酸序列;
进一步地,所述重链框架区包括fr1、fr2和fr3中的一种或多种,其中,所述重链fr1的氨基酸序列为seqidno.12所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.12所示序列具有同等功能的氨基酸序列,所述重链fr2的氨基酸序列为seqidno.13所示的序列或经替换、缺失或添加一个或多个氨基酸形成的具有与seqidno.13所示序列同等功能的氨基酸序列,和所述重链fr3的氨基酸序列为seqidno.14或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.14所示序列具有同等功能的氨基酸序列。
优选地,所述抗pd-l1抗体中的编码轻链可变区的核苷酸序列为seqidno.15所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.15所示序列具有同等功能的核苷酸序列,所述抗pd-l1抗体中的编码重链可变区的核苷酸序列为seqidno.16所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.16所示序列具有同等功能的核苷酸序列。
第二方面,本申请还提供了一种表达载体,所述表达载体至少包含下述氨基酸序列中的一种:seqidno.15所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.15所示序列具有同等功能的核苷酸序列;以及seqidno.16所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.16所示序列具有同等功能的核苷酸序列。同时,本申请还提供了一种宿主细胞,所述宿主细胞包含上述表达载体。优选地,所述宿主细胞选用哺乳动物细胞。
第三方面,本申请还提供了所述抗pd-l1抗体或其功能性片段的制备方法。
第四方面,本申请还提供了包含所述抗pd-l1抗体或其功能性片段的免疫缀合物以及其药物组合物。
第五方面,本申请所述抗pd-l1抗体或其功能性片段在制备用于治疗t细胞功能失调性疾病的药物的用途。
在本申请第一方面的一种实施方式中,所述人源化抗pd-l1抗体是单克隆抗体,所述抗体的轻链高变区cdr1、cdr2和cdr3的氨基酸序列分别为seqidno.3、seqidno.4、seqidno.5所示的序列;所述抗体的重链高变区cdr1、cdr2和cdr3的氨基酸序列分别为seqidno.6、seqidno.7、seqidno.8所示的序列。
进一步地,所述抗体的轻链可变区的氨基酸序列为seqidno.1所示的序列,或该序列经替换、缺失或添加一个或多个氨基酸形成的与seqidno.1所示序列具有同等功能的氨基酸序列;所述抗体的重链可变区的氨基酸序列为seqidno.2所示的序列,或该序列经替换、缺失或添加一个或多个氨基酸形成的与seqidno.2所示序列具有同等功能的氨基酸序列。
所述抗体的轻链框架区fr1、fr2和fr3的氨基酸序列分别为seqidno.9、seqidno.10、seqidno.11所示的序列;所述抗体的重链框架区fr1、fr2和fr3的氨基酸序列分别为seqdno.12、seqidno.13、seqidno.14所示的序列。
在本申请第二方面的实施方式中,本申请提供了两种dna片段。所述这些dna片段编码如上文第一方面所述的抗pd-l1抗体。所述dna片段包含轻链可变区编码序列和重链可变区编码序列;编码所述轻链可变区和所述重链可变区的核苷酸序列分别如seqidno.15、seqidno.16所示。
在本申请第三方面的实施方式中,本申请还提供了两种表达载体,所述表达载体包含至少一个拷贝的如上文第二方面中的所述dna片段。同时,本申请提供了一种宿主细胞,所述宿主细胞包含如上文第三方面所述的表达载体。
在本申请第四方面的实施方式中,本申请还提供了包含所述抗pd-l1抗体或其功能性片段的免疫缀合物以及其药物组合物。优选地,所述药物组合物还包括毒素、放射性同位素、药物或细胞毒剂。在其他实施方式中,本申请还涉及包含所述抗pd-l1抗体或其功能性片段以及可药用载体的药物组合物。所述药物组合物至少含有有效剂量的所述抗pd-l1抗体或其功能性片段以及其药学上可接受的载体。
在本申请第五方面的实施方式中,本申请提供了所述抗pd-l1抗体或其功能性片段在制备用于治疗t细胞功能失调性疾病的药物的用途。具体地,通过消除、抑制或降低pd-l1活性来预防或治疗疾病或缓解病症的方法包括向有此需要的对象施用有效剂量的所述抗pd-l1抗体或其功能性片段、核酸、表达载体、宿主细胞、免疫缀合物或药物组合物。进一步地,本申请所述用途包括所述抗pd-l1抗体或其功能性片段、以及相应地核酸、表达载体、宿主细胞、免疫缀合物或药物组合物在制备用于治疗疾病或病症的药物中的用途。
本申请所述抗pd-l1抗体来源于人体,所述抗体与pd-l1的亲和力kd小于或等于1.0x10-8m。具体地,所述抗pd-l1抗体以约9x10-9m或更小、约8x10-9m或更小、约7x10-9m或更小、约6x10-9m或更小、约5x10-9m或更小、约4x10-9m或更小、约3x10-9m或更小、约2x10-9m或更小、约10-9m或更小的结合亲和力kd中的任一kd值特异性地与人pd-l1结合。其中,在一个实施例中,所述抗pd-l1抗体与pd-l1的亲和力kd为7.1nm,其能够很好的抑制pd-l1与pd-1的结合,通过消除、抑制或降低pd-l1活性来预防或治疗疾病或病症,促进t细胞增殖、分泌il-2和ifn-γ,能够增强t细胞的功能,从而上调细胞介导的免疫应答用于治疗t细胞功能失调性疾病。
【附图说明】
图1a示出了facs检测所述抗pd-l1抗体与hek293pd-l1的结合反应。
图1b示出了facs检测所述pd-l1抗体与hek293pd-l1的结合反应中不同抗体浓度的平均荧光强度。
图2示出了alphalisa检测所述抗pd-l1抗体抑制pd-l1与pd-1结合。
图3示出了混合淋巴细胞反应中所述抗pd-l1抗体促进t细胞分泌il-2的结果。
图4示出了混合淋巴细胞反应中所述抗pd-l1抗体促进t细胞分泌ifn-γ的结果。
图5示出了混合淋巴细胞反应中所述抗pd-l1抗体促进t细胞增殖的结果。
【具体实施方式】
为更清楚的了解本申请的发明构思和技术方案,下文将通过具体实施例和附图进一步解释本申请,其中关于实施方式中的技术方案仅是优选的实施方式,不应被解释为限制本申请的范围。对于本领域技术人员来说,在不脱离本申请的技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为落入本申请的保护范围之中。
除非另有定义,本文使用的所有科技术语应视为具有本领域普通技术人员所理解的相同含义。关于本领域的定义及术语,专业人员具体可参考currentprotocolsinmolecularbiology(ausubel)。氨基酸残基的缩写是本领域中所用的指代20个常用l-氨基酸的标准3字母和/或1字母代码。
本申请中提及的“全人源”或“人源化”抗体或其功能性片段或抗原结合片段时,是指所述抗体或抗原结合片段具有某氨基酸序列或由所述氨基酸序列组成,所述氨基酸序列对应于由人或人免疫细胞生产的、或从例如利用人源抗体库的转基因非人动物等非人来源衍生的抗体的氨基酸序列,或者其他编码人源抗体的序列。在某些实施方式中,全人源抗体不包含来源于非人抗体的氨基酸残基(特别是抗原结合残基)。
本申请中提及的轻链高变区或重链高变区,其中“高变区”又被称之为互补决定区(complementarity-determiningregion,cdr)。
本申请中提及的“序列”可以指包含某些生物学功能等同的氨基酸序列或“保守性替代”,“其它序列”可以包含功能非等同的氨基酸或“非保守性替代”,其经基因工程改造以改进cdr或含cdr抗体的特性。在不实质性地影响抗体活性的前提下,本领域技术人员可以对本申请中的序列进行操作,即替换、添加和/或缺失一个或多个(例如1、2、3、4、5、6、7、8、9或10个或多个)氨基酸,以获得所述抗体或其功能性片段序列的变体。它们应被视为包括在本申请保护的范围内。例如,在可变区将具有类似性质的氨基酸进行替换。本申请中提及的变体的序列可以与其来源序列有至少有95%、96%、97%、98%或99%的一致性。序列一致性可以使用序列分析软件测量。例如使用缺省参数的计算机程序blast,尤其是blastp或tblastn。本文所述的多种氨基酸序列详见序列表。
本申请中提及的抗体为人源单克隆抗体。所述抗pd-l1抗体包括单链抗体、双链抗体、嵌合抗体或其衍生物。所述抗pd-l1抗体或其抗原结合片段,能够很好的结合人pd-l1。所述抗体可以是全长的(例如,igg1或igg4抗体)或可仅包含抗原结合部分(例如,fab、f(ab’)2或scfv片段),或可以被修饰以影响功能。本申请中所述抗体还包括具有修饰的糖基化模式的抗pd-l1抗体。在一些应用中,开可以进行修饰以除去不期望的糖基化位点,例如,在寡糖链上不存在岩藻糖部分,以增强抗体依赖性细胞介导的细胞毒作用(antibody-dependentcell-mediatedcytotoxicity,adcc)功能的抗体。在另一些应用中,可进行半乳糖基化修饰以改变补体依赖性细胞毒性补体依赖的细胞毒性(complementdependentcytotoxicity,cdc)。
本文所使用的术语“功能性片段”尤其是指抗体片段,如fv、scfv(sc指单链)、fab、f(ab’)2、fab’、scfv-fc片段、双抗体(diabody)、或者通过化学修饰或通过掺入脂质体中能够增加半衰期的任何片段,其中,这些化学修饰,例如,添加聚(亚烷基)二醇,如聚乙二醇(“聚乙二醇化,即peg化”),经化学修饰的片段被称为fv-peg、scfv-peg、fab-peg、f(ab')2-peg或fab'-peg的聚乙二醇化片段),所述片段具有表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)结合活性。优选地,所述功能性片段将由其来源抗体的重或轻可变链的部分序列构成或者包含它们,该部分序列足以保留与其来源抗体相同的结合特异性和充分的亲和力。对于pd-l1,优选至少等于或大于其来源抗体亲和力的1/100,在更优选方式中至少等于或大于其来源抗体亲和力的1/10。这种功能性片段将包含最少5个氨基酸,优选其来源的抗体序列的10、15、25、50和100个连续氨基酸。
本文使用的术语“药物组合物”包括至少一种药物以及任选的可药用载体或辅料,以实现某种特定目的。在一些实施方式中,所述药物组合物还包括在这些成分在时间和/或空间上分开的组合,只要其能够共同作用以实现本申请的目的。例如,所述药物组合物中所含的成分(例如,根据本申请中所述抗体、核酸分子、核酸分子组合和/或缀合物)可以以整体施用于对象,或者分开施用于对象。当所述药物组合物中所含的成分分开地施用于对象时,所述成分可以同时或依次施用于对象。优选地,所述可药用载体是水、缓冲水溶液、等渗盐溶液如pbs(磷酸盐缓冲液)、葡萄糖、甘露醇、右旋葡萄糖、乳糖、淀粉、硬脂酸镁、纤维素、碳酸镁、0.3%甘油、透明质酸、乙醇或聚亚烷基二醇如聚丙二醇、甘油三酯等。具体地,选用的可药用载体的类型是根据本申请的组合物是否配制用于口服、鼻、皮内、皮下、肌内或静脉施用而不同。根据本申请的组合物可包含润湿剂、乳化剂或缓冲液作为添加剂。本申请的药物组合物可通过任何适宜的途径施用,例如可口服、鼻、皮内、皮下、肌内或静脉内施用。
本申请提及的“通过消除、抑制或降低pd-l1活性来预防或治疗疾病或缓解病症”表示由pd-l1表达所导致或者以pd-l1表达为症状/特征的疾病或病症。在一些实施方式中,所述疾病或病症选自癌症或炎性疾病。
本申请提及的“核苷酸序列”详见序列表。通过采用本申请所述的多核苷酸,能够有效地合成抗pd-l1抗体或抗原结合片段。能够上文所述多核苷酸有效地合成本申请所述抗pd-l1抗体或抗原结合片段。所述抗体的制备方法可以采用本领域技术人员熟知的技术进行,在此不做特殊限制。
考虑到密码子的简并性,例如,可在其编码区,在不改变氨基酸序列的条件下,对编码上述抗体的基因序列进行改造,获得编码具有相同功能的抗体的基因。本领域技术人员可以根据表达抗体宿主的密码子偏爱性,人工合成改造基因,以提高抗体的表达效率。
进一步地,本申请将所述抗pd-l1抗体的轻链可变区和重链可变区进行重组,可获得分子量更小的单链抗体(scfv),该抗体同样能够结合pd-l1。该单链抗体穿透力强,易于进入局部组织发挥作用。可将上述编码抗体的基因、scfv基因克隆到表达载体中,进而转化或转染宿主细胞,获得所述抗体以及单链抗体。此外,可将前面所述抗体的轻链可变区编码基因和重链可变区基因克隆到全抗表达载体中,并导入宿主细胞中,获得表达抗pd-l1的完全免疫球蛋白。
第一方面,本申请中抗pd-l1全人源抗体为单克隆抗体,该抗pd-l1抗体至少包括重链高变区cdr1、cdr2和cdr3中的一种或多种,和/或轻链高变区cdr1、cdr2和cdr3中的一种或多种;其中:
轻链高变区cdr1的氨基酸序列为seqidno.3所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.3所示的序列具有同等功能的氨基酸序列,轻链高变区cdr2的氨基酸序列为seqidno.4所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.4所示的序列具有同等功能的氨基酸序列,和轻链高变区cdr3的氨基酸序列为seqidno.5所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.5所示的序列具有同等功能的氨基酸序列;以及
重链高变区cdr1的氨基酸序列为seqidno.6所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.6所示的序列具有同等功能的氨基酸序列,重链高变区cdr2的氨基酸序列为seqidno.7所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.7所示序列具有同等功能的氨基酸序列,和重链高变区cdr3的氨基酸序列为seqidno.8所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.8所示的序列具有同等功能的氨基酸序列。
其中:经替换、缺失或添加一个或多个氨基酸形成的与序列表中seqidno.3-8中任一所示序列具有同等功能的氨基酸序列中是指与本申请抗pd-l1抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸替换而形成的多肽。这种变体的序列与其来源序列有至少有95%、96%、97%、98%或99%的一致性。
进一步地,该抗pd-l1抗体的轻链可变区的氨基酸序列至少包括seqidno.1所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.1所示序列具有同等功能的氨基酸序列,重链可变区的氨基酸序列至少包括seqidno.2所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.2所示序列具有同等功能的氨基酸序列。
进一步地,该抗pd-l1抗体的轻链框架区(frameworkregion,fr)包括fr1、fr2和fr3中的一种或多种,其中,该轻链fr1的氨基酸序列为seqidno.9所示的序列或该序列经替换、缺失或添加一个或多个氨基酸形成的与seqidno.9所示序列具有同等功能的氨基酸序列,该轻链fr2的氨基酸序列为seqidno.10所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.10所示序列具有同等功能的氨基酸序列,和该轻链fr3的氨基酸序列为seqidno.11所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.11所示序列具有同等功能的氨基酸序列;
进一步地,该重链框架区包括fr1、fr2和fr3中的一种或多种,其中,该重链fr1的氨基酸序列为seqidno.12所示的序列或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.12所示序列具有同等功能的氨基酸序列,该重链fr2的氨基酸序列为seqidno.13所示的序列或经替换、缺失或添加一个或多个氨基酸形成的具有与seqidno.13所示序列同等功能的氨基酸序列,和该重链fr3的氨基酸序列为seqidno.14或经替换、缺失或添加一个或多个氨基酸形成的与seqidno.14所示序列具有同等功能的氨基酸序列。
优选地,该抗pd-l1抗体中的编码轻链可变区的核苷酸序列为seqidno.15所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.15所示序列具有同等功能的核苷酸序列,该抗pd-l1抗体中的编码重链可变区的核苷酸序列为seqidno.16所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.16所示序列具有同等功能的核苷酸序列。
第二方面,本申请还提供了一种表达载体,该表达载体至少包含下述氨基酸序列中的一种:seqidno.15所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.15所示序列具有同等功能的核苷酸序列;以及seqidno.16所示的序列或该序列经替换、缺失或添加一个或多个核苷酸形成的与seqidno.16所示序列具有同等功能的核苷酸序列。同时,本申请还提供了一种宿主细胞,该宿主细胞包含上述表达载体。优选地,该宿主细胞为哺乳动物细胞。
第三方面,本申请还相应地提供了该抗pd-l1抗体或其功能性片段的制备方法。
第四方面,本申请还提供了包含该抗pd-l1抗体或其功能性片段的免疫缀合物以及其药物组合物。
第五方面,本申请该抗pd-l1抗体或其功能性片段在制备用于治疗t细胞功能失调性疾病的药物的用途。
在本申请第一方面的一种实施方式中,该人源化抗pd-l1抗体是单克隆抗体,该抗体的轻链高变区cdr1、cdr2和cdr3的氨基酸序列分别为seqidno.3、seqidno.4、seqidno.5所示的序列;该抗体的重链高变区cdr1、cdr2和cdr3的氨基酸序列分别为seqidno.6、seqidno.7、seqidno.8所示的序列。
进一步地,该抗体的轻链可变区的氨基酸序列为seqidno.1所示的序列,或该序列经替换、缺失或添加一个或多个氨基酸形成的与seqidno.1所示序列具有同等功能的氨基酸序列;该抗体的重链可变区的氨基酸序列为seqidno.2所示的序列,或该序列经替换、缺失或添加一个或多个氨基酸形成的与seqidno.2所示序列具有同等功能的氨基酸序列。
该抗体的轻链框架区fr1、fr2和fr3的氨基酸序列分别为seqidno.9、seqidno.10、seqidno.11所示的序列;该抗体的重链框架区fr1、fr2和fr3的氨基酸序列分别为seqdno.12、seqidno.13、seqidno.14所示的序列。
在本申请第二方面的实施方式中,本申请提供了两种dna片段。该这些dna片段编码如上文第一方面该的抗pd-l1抗体。该dna片段包含轻链可变区编码序列和重链可变区编码序列;编码该轻链可变区和该重链可变区的核苷酸序列分别如seqidno.15、seqidno.16所示。
在本申请第三方面的实施方式中,本申请还提供了两种表达载体,该表达载体包含至少一个拷贝的如上文第二方面中的该dna片段。同时,本申请提供了一种宿主细胞,该宿主细胞包含如上文第三方面描述的表达载体。
在本申请第四方面的实施方式中,本申请还提供了包含该抗pd-l1抗体或其功能性片段的免疫缀合物以及其药物组合物。优选地,该药物组合物还包括毒素、放射性同位素、药物或细胞毒剂。在其他实施方式中,本申请还涉及包含该抗pd-l1抗体或其功能性片段以及可药用载体的药物组合物。该药物组合物至少含有有效剂量的该抗pd-l1抗体或其功能性片段以及其药学上可接受的载体。
在本申请第五方面的实施方式中,本申请提供了该抗pd-l1抗体或其功能性片段在制备用于治疗t细胞功能失调性疾病的药物的用途。具体地,通过消除、抑制或降低pd-l1活性来预防或治疗疾病或缓解病症的方法包括向有此需要的对象施用有效剂量的该抗pd-l1抗体或其功能性片段、核酸、表达载体、宿主细胞、免疫缀合物或药物组合物。进一步地,本申请所述用途包括该抗pd-l1抗体或其功能性片段、以及相应地核酸、表达载体、宿主细胞、免疫缀合物或药物组合物在制备用于治疗疾病或病症的药物中的用途。
实施例1.人pd-l1胞外结构区-6his蛋白制备
实施例1.1.化学合成人pd-l1胞外区-6his基因
化学合成人pd-l1胞外区-6his基因(ncbireferencesequence:nm_014143.4),克隆至真核表达质粒pcdna3.1中,pei转染hek293细胞,6天后,收集培养基上清液,并通过镍柱亲和层析纯化人pd-l1胞外区蛋白。
人pd-l1胞外区-6his氨基酸序列:mrifavfifmtywhllnaftvtvpkdlyvveygsnmtieckfpvekqldlaalivywemedkniiqfvhgeedlkvqhssyrqrarllkdqlslgnaalqitdvklqdagvyrcmisyggadykritvkvnapynkinqrilvvdpvtseheltcqaegypkaeviwtssdhqvlsgkttttnskreeklfnvtstlrintttneifyctfrrldpeenhtaelvipelplahppnerhhhhhh
实施例1.2.生物素化抗原bio-pd-l1-6his制备:
使用nhs-peg4-biotin对人pd-l1胞外区-6his分子进行生物素化,得到生物素化后的抗原bio-pd-l1-6his。
实施例2.人pd-1胞外结构区-6his蛋白制备
实施例2.1.化学合成人pd-1胞外区-6his基因
化学合成人pd-1胞外区-6his基因(ncbireferencesequence:nm_005018.3),克隆至真核表达质粒pcdna3.1中,pei转染hek293细胞,6天后,收集培养基上清液,通过镍柱亲和层析纯化人pd-1胞外区蛋白。
人pd-1胞外区-6his氨基酸序列:mqipqapwpvvwavlqlgwrpgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvhhhhhh
实施例2.2.生物素化蛋白bio-pd-1-6his制备:
使用nhs-peg4-biotin对pd-l1胞外区-6his分子进行生物素化,得到生物素化后的抗原bio-pd-l1-6his。
实施例3.人scfv噬菌体库的建立
收集20份健康人外周血,密度梯度离心分离获得5×109淋巴细胞,triziol提取总rna,按照参考文献(andris-widhopf,j.,steinberger,p.,fuller,r.,rader,c.,&barbas,c.f.,3rd.(2011).generationofhumanscfvantibodylibraries:pcramplificationandassemblyoflight-andheavy-chaincodingsequences.coldspringharbprotoc,2011(9).doi:10.1101/pdb.prot065573)方法,构建人scfv噬菌体库,噬菌体初级库库容达2×109。
实施例4.磁珠法筛选抗人pd-l1scfv
选取表达全人单链抗体的噬菌体抗体库200μl(含有噬菌体1×1012个/ml)与5μg生物素化的bio-pd-l1-6his抗原混合,室温孵育30min,然后加入50μl的链霉亲和素磁珠,与抗原结合的噬菌体被链霉亲和素磁珠捕获,未结合的噬菌体经0.5%tween-20的pbs溶液(磷酸缓冲液)漂洗后被去除,用盐酸甘氨酸(ph2.2)溶液将与磁珠稳定结合的噬菌体洗脱待用。
接种xl1-blue细菌200ml,待od600nm(600nm波长处的吸光值)接近0.6后,加入上述洗脱的噬菌体,与xl1-blue细菌在37℃静置30min,菌液涂在氨苄青霉素抗性平板上,第二天洗脱收集氨苄青霉素抗性平板上的菌体,在侵染1×1012pfu/ml的vcsm13辅助噬菌体后,扩增后进行下一轮筛选,共进行3轮筛选。
将侵染噬菌体的xl1-blue菌液充分稀释,然后将此菌液涂布于直径为15cm氨苄青霉素抗性的lb固体培养基平板,每个平板上有100-500个克隆,挑取单克隆抗体,通过噬菌体酶联免疫反应对筛选后的各轮噬菌体库进行验证。
噬菌体酶联免疫反应
将转染噬菌体的xl1-blue单克隆菌接种到2ml的96孔细菌培养板中,加入500μl含有四环素抗性的sb培养基,200rpm转速下37℃摇床4-6h,检测od600nm值接近0.6后,加入1μl的辅助噬菌体,在30℃下摇床过夜,第二天3000g离心取上清待用。
取酶联免疫微孔板,包被抗原4℃过夜,pbst洗涤后封闭,然后加入上一步制备好的噬菌体上清,室温孵育2h,pbst再加入anti-m13hrp抗体孵育30min,后用pbst洗3次,加入50μl显影液abts[2,2'-边氮基-双(3-乙基苯并噻吡咯啉-6磺酸)]。检测od405nm值。
经过3轮筛选后,表达与抗原特异性结合抗体的噬菌体被富集。从筛选后的第3轮库中挑取700个单克隆进行酶联免疫反应验证,最后,确定酶联免疫反应的读值是对照组两倍以上的克隆作为阳性克隆。100个阳性克隆测序分析,经过比对分析,挑取重复数最多的阳性克隆。对所得的克隆噬菌粒进行测序,分析其重链可变区和轻链可变区的核苷酸序列信息,编码重链可变区和轻链可变区的核苷酸序列分别如序列表中seqidno.15和seqidno.16所示,对应氨基酸序列如seqidno.1和seqidno.2所示。
抗体可变区dna序列
该抗体轻链可变区核酸序列如序列表中seqidno.15所示。该述抗体重链可变区核酸序列如序列表中seqidno.16所示。
抗体可变区氨基酸序列
抗体轻链可变区的氨基酸序列如seqidno.1所示。抗体重链可变区的氨基酸序列如seqidno.2所示。
实施例5.完全抗体的表达
实施例5.1.构建抗pd-l1全长抗体的表达载体
依据重链可变区序列合成引物,两端加上限制性内切酶bamh1和bglii酶切位点,以上述实验例中筛选得到的抗体的重链可变区核苷酸编码序列为模板,常规pcr扩增,然后,通过酶切连接的方法将片段接入pfusess-chig-hg1表达载体,由此获得本申请的全长抗体重链的pfuse-igg1表达载体。
依据轻链可变区序列合成引物,两端带上ecori和avrii酶切位点,以实验例中筛选得到的抗体的轻链可变区核苷酸编码序列为模板,常规pcr扩增,通过酶切连接方法插入轻链pfuse2ss-clig-hl2载体,由此获得本申请的全长抗体轻链的pfuse-clig表达载体。
实施例5.2.抗pd-l1全人源单克隆抗体的制备
将293fectin转染试剂与上述获得的2个真核抗体表达载体按照体积:质量比为30μl:30μg:30μg的比例混合,加入30毫升的293freestyle悬浮细胞,在125rpm转速下37℃摇床过夜,离心后收集上清,采用hitrapproteinahpcolumns在äktapurifier100蛋白纯化仪上进行抗体蛋白纯化,最后,参照bca法蛋白定量试剂盒的说明书检测抗体浓度。
实施例6.srp法检测抗体与pd-l1的结合
通过多循环动力学的方法检测抗体与抗原亲和力与动力学特征。抗体固定采用捕获法进行:先将抗pd-l1全人源单克隆抗体偶联在proteina芯片上,然后将pd-l1样品梯度稀释后流过芯片表面,稀释的起始浓度为40nm,稀释倍数为2倍,共稀释6个浓度点,pd-l1就会被已经偶联的抗pd-l1全人源单克隆抗体所捕获,抗原与抗体结合后信号被检测并记录,最后,使用再生试剂(ph1.5的甘氨酸溶液)将proteina芯片表面的抗体和抗原样品全部洗脱,并进行新一轮检测。
通过biacore检测抗pd-l1全人源单克隆抗体与pd-l1蛋白之间的相互作用,经测定,本申请的抗pd-l1全人源单克隆抗体的kd为7.1nm。
实施例7.细胞水平检测抗pd-l1抗体与pd-l1的结合
化学合成人pd-l1全长基因(ncbireferencesequence:nm_014143.4),克隆至嘌呤霉素(puromycin)筛选体系中真核表达质粒中,pei转染hek293细胞。转染24小时后,通过puromycin(2μg/ml)进行筛选,直至形成293fpd-l1稳转细胞库。同时通过有限稀释法,按每孔0.8个细胞,铺96孔板,15天后,挑选出hek293pd-l1单克隆,并进行传代,形成表达pd-l1的hek293pd-l1稳转细胞株。
消化hek293pd-l1稳转细胞株,离心重悬到facsbuffer中,按细胞量为大约2.5×104、体积为50μl加入到1.5mlep管中,加入50μl不同浓度的抗体稀释液混匀,室温孵育30min;抗体起始浓度0.15ug/ml,5倍浓度梯度稀释,共8个浓度。
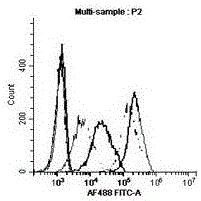
流式细胞荧光分选技术(fluorescenceactivatedcellsorting,facs)检测抗体与pd-l1表达细胞的结合反应。用facsbuffer洗涤细胞两次后加入100μlgoatanti-humanigg-fitc抗体,避光孵育30min;用facsbuffer洗涤两次后进行facs检测8个浓度值的抗体,检测结果如图1a和图1b所示。图1a和图1b表明本申请的抗pd-l1抗体可以与hek293细胞上的pd-l1特异性结合。
实施例8.alphalisa检测抗pd-l1全人源单克隆抗体抑制pd-l1与pd-1的结合
将待检测的抗pd-l1全人源单克隆抗体以3倍稀释倍数进行浓度梯度稀释,起始浓度值为5μg/μl,共计稀释10个浓度值。检测反应体系分别为待检样品抗体蛋白或抑制剂5μl,生物素化pd-15μl,pd-l1-6his5μl,链霉亲和素供体珠和受体珠(sa-donorbeadsandacceptorbeads)混合物5μl,合计20μl。首先配制1x稀释液,然后,按照说明书将各个试剂用稀释液配制,分别为4x组氨酸标签pd-l1(20nm),4x生物素化pd-1(20nm),4x抗-6x组氨酸alphalisa®受体珠(anti-6xhisalphalisa®acceptorbeads)(40μg/ml)和链霉亲和素标记的供体珠(streptavidindonorbeads)(80μg/ml)混合液。将上述四种液体按照20μl反应体系混合到一起,室温避光孵育90min,在envision上读取在615nm下的数值,结果如图2所示。图2结果表明,本申请的抗pd-l1抗体能够抑制pd-1/pd-l1的结合,ic50为37.18ng/ml。
实施例9.人抗pd-l1抗体在混合淋巴细胞反应中对细胞增殖和细胞因子产生的影响
采用混合淋巴细胞反应(mixedlymphocytereaction,mlr)检测pd-l1抗体对cd4+t淋巴细胞的增殖及ifn-γ和il-2产生的影响。
实施例9.1.细胞的分离、培养及诱导
从健康志愿者的新鲜血液中,通过利用ficoll-paque进行密度梯度离心分离得到人外周血单个核细胞(humanperipheralbloodmononuclearcell,pbmcs)。pbmc培养于含10%胎牛血清和1%青霉素-链霉素的rpmi-1640完全培养液中,同时加入100u重组人il-2。
使用人单核细胞富集试剂盒将单核细胞从pbmc中分离,并培养于含10%胎牛血清和1%青霉素-链霉素的rpmi-1640完全培养液中,调整细胞密度至2×106/ml。同时在培养液中加入重组人gm-csf和il-4,终浓度分别为800u/ml和50ug/ml。将细胞以每孔2.5ml接种于6孔板,培养5-7天后诱导其成为树突状细胞(dendriticcells,dc)。期间每2-3天弃去一半培养液,并补充含有细胞因子的新鲜培养液。于混合淋巴反应的前18-24小时在培养液中加入1ug/mllps,培养得到成熟树突状细胞(maturedc,mdc)。
使用人cd4+t细胞富集试剂盒将cd4+t淋巴细胞从pbmcs中分离。
实施例9.2.混合淋巴反应
纯化的cd4+t淋巴细胞与异体来源的mdc细胞共培养。其中cd4+t淋巴细胞以1×105或2×105/孔的密度加入50μl(分别用于检测ifn-γ和il-2),随后加入50μl不同浓度的抗体。然后,加入不同比例的mdc100μl,将96孔板置于37℃,5%co2培养箱中。培养体系中抗体起始浓度为10μg/ml,以3倍稀释倍数进行浓度梯度稀释。设置平行的96孔板,培养3天的96孔板的上清用于il-2的elisa检测,培养5天的96孔板中的上清用于ifn-γ的elisa检测。共同培养5天后的细胞用3h-tdr检测cd4+t淋巴细胞细胞增殖。
实施例9.3.细胞因子的检测
用elisa检测上清中的人ifn-γ和il-2水平。标准品重组人ifn-γ和il-2分别用于标准浓度曲线的测定。用人ifn-γ的特异性抗体或il-2的抗体预先包被酶标板,次日用含2%bsa的pbs溶液封闭1小时。于各反应孔中加入100μl标准品和待测样品,室温下孵育2小时。洗涤后加入生物素标记的ifn-γ抗体或il-2抗体孵育1小时。洗涤后加入链霉亲和素标记的hrp(horseradishperoxidase)在室温下孵育30分钟。再次洗涤后加入tmb底物显色,待反应产物的颜色由浅变深后,用2mhcl终止反应。在15分钟内用酶标仪(moleculardevicesspectramaxm5eplatereader)在450nm波长处读取光吸收值。根据标准曲线计算待测上清中的细胞因子含量,检测结果如图3和图4所示,结果表明,本申请的抗pd-l1抗体可以促进t细胞分泌il-2和ifn-γ。
实施例9.4.细胞增殖的检测
用0.9%nacl溶液以20倍体积稀释3h-thymidine,加入96孔板,使其终浓度为0.5uci/well。将96孔板继续置于5%co2、37℃的培养箱中培养16-18小时。培养结束后,离心并去除gf/b板中上清液,然后,用双蒸水洗涤一次。将96孔板置于细胞收集器(perkinelmer)上,真空抽滤后用预冷的双蒸水洗涤5次,置于45℃烤箱中烘干。每孔加入50μl闪烁液并用液体闪烁计数仪(topcountnxthtsreader)计数,检测结果如图5所示,结果表明,本申请的抗pd-l1抗体可以促进t细胞增殖。
以上结果显示,本申请的抗pd-l1全人源单克隆抗体以浓度依赖的方式促进il-2分泌、ifn-γ分泌和t细胞增殖。基于实施例中的结果,本领域人员可以确定地实现该抗体在上文所述第四方面和第五方面,尤其在制备用于治疗t细胞功能失调性疾病的药物中的用途。
除非另有说明,本发明的实践采用了在本领域普通技术人员能力范围内的化学、分子生物学、微生物学、重组dna技术和化学方法的常规技术。尽管已经在此详细公开了本申请的特定实施方式,但是这仅是通过示例的方式实施,并且仅出于说明的目的。上述实施方式并非旨在限制所附权利要求的范围,也不意味着本申请必须依赖上述详细结构特征才能实施。
本领域技术人员应该知晓,对本申请的任何等同替换或改进,例如对本申请所选用方法、序列、试剂等的任何等效替换或改进以及辅助部分的增加、具体方式的选择等,均落在本申请的保护范围和公开范围之内。上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本申请对各种可能的组合方式不再另行说明。
sequencelisting
<110>上海甲贝生物医药技术股份有限公司
<120>一种抗pd-l1抗体或其功能性片段及其用途
<130>2018591-1
<160>18
<170>patentinversion3.5
<210>1
<211>110
<212>prt
<213>artificialsequence
<220>
<223>抗体可变区轻链可变区氨基酸序列
<400>1
glnseralaleuthrglnproalaservalserglyserproglygln
151015
serilethrilesercysthrglythrserseraspvalglysertyr
202530
asnleuvalsertrptyrglnglnhisproglylysalaprolysleu
354045
metiletyrgluvalthrlysargproserglyvalserasnargphe
505560
serglyserlysserglyasnthralaserleuthrileserglyleu
65707580
glnalagluaspglualaasptyrtyrcyssersertyralaglyser
859095
asnasnleuvalpheglyglyglythrlysvalthrvalleu
100105110
<210>2
<211>119
<212>prt
<213>artificialsequence
<220>
<223>抗体可变区重链可变区氨基酸序列
<400>2
glnvalglnleuvalglnserglyglygluleulysargproglyser
151015
servallysvalsercyslysalaserglyglythrphesersertyr
202530
alailesertrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyargileileproilepheglythralaasntyralaglnlysphe
505560
glnglyargvalthrilethralaaspgluserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alasersersertyrarghisphealapheaspiletrpglyglngly
100105110
thrthrvalthrvalserser
115
<210>3
<211>9
<212>prt
<213>artificialsequence
<220>
<223>轻链可变区cdr1氨基酸序列
<400>3
serseraspvalglysertyrasnleu
15
<210>4
<211>3
<212>prt
<213>artificialsequence
<220>
<223>轻链可变区cdr2氨基酸序列
<400>4
gluvalthr
1
<210>5
<211>10
<212>prt
<213>artificialsequence
<220>
<223>轻链可变区cdr3氨基酸序列
<400>5
sersertyralaglyserasnasnleuval
1510
<210>6
<211>8
<212>prt
<213>artificialsequence
<220>
<223>重链可变区cdr1氨基酸序列
<400>6
glyglythrphesersertyrala
15
<210>7
<211>8
<212>prt
<213>artificialsequence
<220>
<223>重链可变区cdr2氨基酸序列
<400>7
ileileproilepheglythrala
15
<210>8
<211>12
<212>prt
<213>artificialsequence
<220>
<223>重链可变区cdr3氨基酸序列
<400>8
alasersersertyrarghisphealapheaspile
1510
<210>9
<211>25
<212>prt
<213>artificialsequence
<220>
<223>轻链可变区fr1氨基酸序列
<400>9
glnseralaleuthrglnproalaservalserglyserproglygln
151015
serilethrilesercysthrglythr
2025
<210>10
<211>17
<212>prt
<213>artificialsequence
<220>
<223>轻链可变区fr2氨基酸序列
<400>10
valsertrptyrglnglnhisproglylysalaprolysleumetile
151015
tyr
<210>11
<211>36
<212>prt
<213>artificialsequence
<220>
<223>轻链可变区fr3氨基酸序列
<400>11
lysargproserglyvalserasnargpheserglyserlyssergly
151015
asnthralaserleuthrileserglyleuglnalagluaspgluala
202530
asptyrtyrcys
35
<210>12
<211>25
<212>prt
<213>artificialsequence
<220>
<223>重链可变区fr1氨基酸序列
<400>12
glnvalglnleuvalglnserglyglygluleulysargproglyser
151015
servallysvalsercyslysalaser
2025
<210>13
<211>17
<212>prt
<213>artificialsequence
<220>
<223>重链可变区fr2氨基酸序列
<400>13
ilesertrpvalargglnalaproglyglnglyleuglutrpmetgly
151015
arg
<210>14
<211>38
<212>prt
<213>artificialsequence
<220>
<223>重链可变区fr3氨基酸序列
<400>14
asntyralaglnlyspheglnglyargvalthrilethralaaspglu
151015
serthrserthralatyrmetgluleuserserleuargsergluasp
202530
thralavaltyrtyrcys
35
<210>15
<211>330
<212>dna
<213>artificialsequence
<220>
<223>抗体可变区dna序列轻链可变区
<400>15
cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60
tcctgcactggaaccagcagtgatgttgggagttataaccttgtctcctggtaccaacag120
cacccaggcaaagctcccaaactcatgatttatgaggtcactaagcggccctcaggggtt180
tctaatcgcttctctggctccaagtctggcaacacggcctccctgaccatctctgggctc240
caggctgaggacgaggctgattattactgcagttcatatgcaggcagcaacaatttggtc300
tttggcggagggaccaaggtcaccgtccta330
<210>16
<211>357
<212>dna
<213>artificialsequence
<220>
<223>重链可变区核酸序列
<400>16
caggtgcagctggtgcaatctggaggtgagctgaagcggcctgggtcttcggtgaaggtc60
tcctgcaaggcttctggaggcaccttcagcagctatgctatcagctgggtgcgacaggcc120
cctggacaagggcttgagtggatgggaaggatcatccctatctttggtacagcaaactac180
gcacagaagttccagggcagagtcacgattaccgcggacgaatccacgagcacagcctac240
atggagctgagcagcctgagatctgaggacacggccgtgtattactgtgcgagtagtagt300
taccggcattttgcttttgatatctggggccaagggaccacggtcaccgtctcctca357
<210>17
<211>244
<212>prt
<213>artificialsequence
<220>
<223>人pd-l1胞外区-6his氨基酸序列
<400>17
metargilephealavalpheilephemetthrtyrtrphisleuleu
151015
asnalaphethrvalthrvalprolysaspleutyrvalvalglutyr
202530
glyserasnmetthrileglucyslyspheprovalglulysglnleu
354045
aspleualaalaleuilevaltyrtrpglumetgluasplysasnile
505560
ileglnphevalhisglyglugluaspleulysvalglnhisserser
65707580
tyrargglnargalaargleuleulysaspglnleuserleuglyasn
859095
alaalaleuglnilethraspvallysleuglnaspalaglyvaltyr
100105110
argcysmetilesertyrglyglyalaasptyrlysargilethrval
115120125
lysvalasnalaprotyrasnlysileasnglnargileleuvalval
130135140
aspprovalthrsergluhisgluleuthrcysglnalagluglytyr
145150155160
prolysalagluvaliletrpthrserserasphisglnvalleuser
165170175
glylysthrthrthrthrasnserlysarggluglulysleupheasn
180185190
valthrserthrleuargileasnthrthrthrasngluilephetyr
195200205
cysthrpheargargleuaspproglugluasnhisthralagluleu
210215220
valileprogluleuproleualahisproproasngluarghishis
225230235240
hishishishis
<210>18
<211>176
<212>prt
<213>artificialsequence
<220>
<223>人pd-1胞外区-6his氨基酸序列
<400>18
metglnileproglnalaprotrpprovalvaltrpalavalleugln
151015
leuglytrpargproglytrppheleuaspserproaspargprotrp
202530
asnproprothrpheserproalaleuleuvalvalthrgluglyasp
354045
asnalathrphethrcysserpheserasnthrsergluserpheval
505560
leuasntrptyrargmetserproserasnglnthrasplysleuala
65707580
alapheprogluaspargserglnproglyglnaspcysargphearg
859095
valthrglnleuproasnglyargaspphehismetservalvalarg
100105110
alaargargasnaspserglythrtyrleucysglyalaileserleu
115120125
alaprolysalaglnilelysgluserleuargalagluleuargval
130135140
thrgluargargalagluvalprothralahisproserproserpro
145150155160
argproalaglyglnpheglnthrleuvalhishishishishishis
165170175
- 还没有人留言评论。精彩留言会获得点赞!