一种萘环类化合物在制备防治口腔细菌的产品中的用途的制作方法
技术领域:
本发明涉及萘环类化合物在制备防治口腔细菌方面的产品中的用途,属于生物医药技术领域。
背景技术:
:
龋病是一种发生于牙体硬组织的慢性进行性疾病,其发生发展可能与牙菌斑生物膜的生态失衡密切相关。唾液蛋白或糖蛋白在牙面形成获得性膜,浮游细菌定植并迅速繁殖形成牙菌斑生物膜,生物膜内部微生物代谢产酸,牙体组织局部脱矿,最终发生牙体组织的缺损。在牙菌斑生物膜的形成和致龋过程中,变异链球菌(streptococcusmutans,s.m)是目前较公认的最重要的致龋细菌之一。变异链球菌是一种革兰阳性兼性厌氧菌,在物理吸附的基础上,通过表面毒力因子(如产酸耐酸、体外黏附、合成细胞外多糖)对牙齿表面产生粘附作用,最终不断聚集形成致龋生物膜。血链球菌(streptococcussanguinis,s.s)和格氏链球菌(streptococcusgordonii,s.g)是公认的口腔中的共生菌。与浮游细菌相比,常用抗菌剂如氯己定(chx)对口腔生物膜的作用较为局限,难以渗透入生物膜内部,作用于生物膜内部的口腔病原微生物。同时,氯己定已被以往研究证明存在容易产生耐药性和对牙面染色、黏膜过敏的问题。因此,对口腔生物膜的有效的控制,维持健康的口腔生态环境仍是目前的研究热点。
根管治疗是治疗牙髓坏死以及根尖周病最有效、最彻底的一种方法。即使经过完善的根管治疗,仍有4%~15%的患牙临床症状无法消除。残留在根管内的微生物及根管内被感染的牙本质是造成根管治疗失败的主要原因。粪肠球菌(enterococcusfaecalis,e.f)是一种革兰氏阳性兼性厌氧菌,是治疗失败根管内最常分离到的细菌,在治疗失败病例中的检出率达24%~77%,具有牙本质渗透性,被认为是引发根管持续感染和再感染的重要微生物。粪肠球菌能在营养物质缺乏、高碱性以及抗菌药物存在的恶劣环境中生存,同时在乏氧和低营养的根管环境内,侵入牙本质小管并形成粪肠球菌生物膜。目前临床根管治疗术最常用的根管消毒冲洗液为0.5%~5.25%浓度的次氯酸钠溶液,它具有良好的抗菌作用和组织溶解作用,但毒性较大,对于牙本质小管深层的生物膜仍难以清除。
因此,对于口腔内致龋性生物膜以及根管内粪肠球菌生物膜的有效控制仍是目前研究的热点及难点,寻求新的化合物在龋病及根尖周病的控制中具有重要意义。
技术实现要素:
:
本发明的目的在于提供一种具有抗口腔常见致病菌活性的萘环类化合物,其次在于提供该化合物在制备防治口腔细菌的产品中的用途。
本发明第一个目的在于提供了式(i)所示的化合物:
式(i)所示化合物的分子式为c25h26f6n2o,中文名称为(r/s)-1-((3,5-二(三氟甲基)苯基)氨基)-3-((2-甲基-1-(萘-2-基)丙烷-2-基)氨基)丙烷-2-醇,英文名称为(r/s)-1-((3,5-bis(trifluoromethyl)phenyl)amino)-3-((2-methyl-1-(naphthalen-2-yl)propan-2-yl)amino)propan-2-ol,分子量为484.4864。
本发明包括式(i)所示的化合物、光学异构体以及同时含有两种光学异构体的混合物、溶剂合物、前药、药学上可接受的盐以及其各种晶型。
本发明第二个目的在于提供一种组合物,其包含式(i)所述的化合物及其顺反异构体以及同时含有两种光学异构体的混合物、溶剂合物、前药以及药学上可接受的盐。所述包含可以理解为式(i)化合物或其光学异构体以及同时含有两种光学异构体的混合物、溶剂合物、前药及其药学上可接受的盐作为组合物中的成分起辅助作用或者作为主要活性成分起主要作用。所述组合物可以包含药学上可以接受的载体、辅料和/或赋形剂。
本发明第三个目的在于提供一种用途,具体为包含式(i)所述的化合物及其光学异构体以及同时含有两种光学异构体的混合物、溶剂合物、前药、药学上可接受的盐以及其组合物在制备防治口腔常见致病菌的产品中的用途。其中致病菌为变异链球菌(streptococcusmutans)以及粪肠球菌(enterococcusfaecalis)。其中产品为用于抑制和/或杀伤变异链球菌(streptococcusmutans)和/或粪肠球菌(enterococcusfaecalis)的浮游菌和/或生物膜的药物制剂、清洁用品。
优选地,所述药物制剂为固体制剂、液体制剂、喷剂或外用制剂;所述清洁用品为漱口水、牙膏、消毒液或冲洗液。
本发明化合物或含有它的药物组合物可以单位剂量形式给药。给药剂型可以是液体剂型、固体剂型、外用制剂、喷剂等等。液体剂型可以是真溶液类、胶体类、微粒剂型、乳剂剂型、混旋剂型。其他剂型例如片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、栓剂、冻干粉针剂、包合物、填埋剂、贴剂、擦剂等。
此外,本发明化合物或含有它的药物组合物也可以制成如牙膏、固体漱口水、口香糖、含片、口腔贴片等;外用喷剂或液体制剂也可以制成如漱口水、冲洗液等。
漱口水或冲洗液可由抗菌剂、清香剂、甜味剂、溶剂组成。其中抗菌剂为式(i)所述的化合物及其顺反异构体以及同时含有两种顺反异构体的混合物、溶剂合物、前药、药学上可接受的盐以及其组合物;清香剂包括薄荷油、橙皮油、绿茶提取物、蜂胶提取物中的一种或几种;甜味剂包括甜菊苷、木糖醇、山梨醇中的一种或几种;溶剂为去离子水。
漱口水或冲洗液中还可包括以下组分中的一种或几种:甘露醇、甘油、聚乙二醇、羧甲基茯苓多糖、海藻糖、甘氨酸、芦荟胶、氯化钠、海藻酸钠、柠檬酸钠等。
本发明中的式(i)化合物对变异链球菌(streptococcusmutans)的浮游菌mic值以及mbc值分别为1.95μg/ml及15.63μg/ml;对变异链球菌(streptococcusmutans)的生物膜的mbic值以及mbrc值分别为3.91μg/ml及62.5μg/ml。对粪肠球菌(enterococcusfaecalis)浮游菌的mic值及mbc值分别为3.91μg/ml及7.81μg/ml;对粪肠球菌(enterococcusfaecalis)生物膜的mbic值及mbrc值分别为3.91μg/ml及31.25μg/ml。
本发明中的式(i)化合物在短时间(5min)暴露对能接触到的口腔细胞ic50值远小于其对粪肠球菌(enterococcusfaecalis)的mic、mbic、mbrc值。在抗菌活性浓度下的细胞毒性较naclo及氯已定更低。
附图说明:
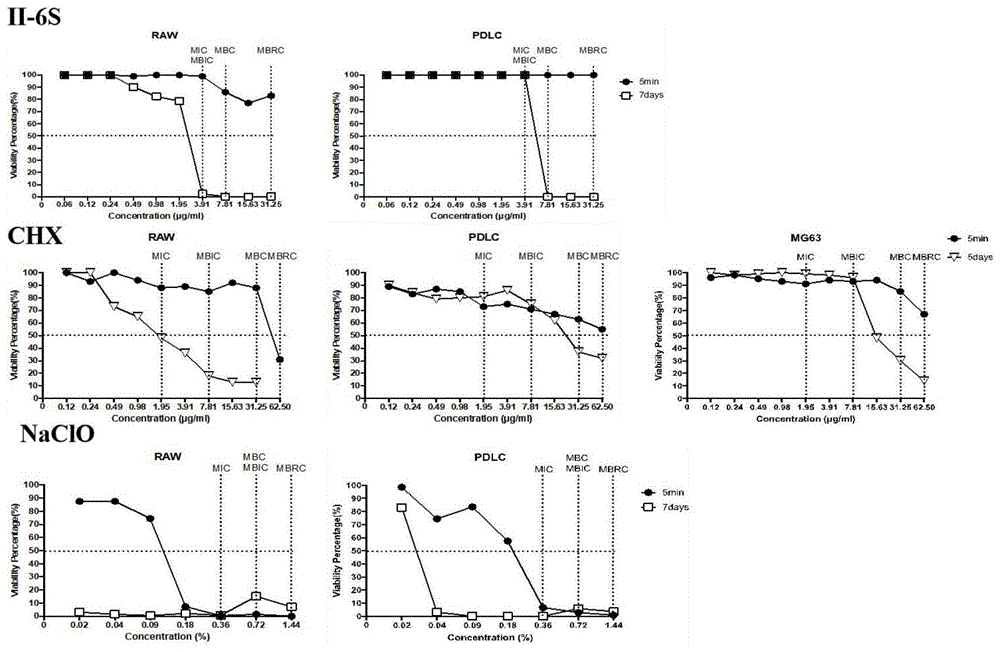
以下,结合附图来说明本发明中式(i)化合物的毒性的相关参数。其中:
图1为不同浓度下的式(i)化合物(即ii-6s)、氯已定(即chx)以及naclo对口腔正常细胞的存活率曲线。说明了式(i)化合物(即图中编号ii-6s)相较于naclo以及短时间作用下相较于氯已定具有更低的毒性。
具体实施方式:
实施例1.式(i)化合物的体外抗菌活性实验
本实验中所用粪肠球菌菌株atcc29212和式(i)化合物的准备如下:
本实验所使用的粪肠球菌atcc29212菌株为模式菌株。在ncbi数据库(www.ncbi.nlm.nih.gov/)中的参考基因组编号对应nc_004668。其最适的培养基优选脑心浸液(brainheartinfusion)培养基(braininfusionsolids12.5g/l,beefheartinfusionsolids5.0g/l,proteosepeptone10.0g/l,glucose2.0g/l,sodiumchloride5.0g/l,di-sodiumphosphate2.5g/l,ph7.4±0.2),在37℃,厌氧培养的最适宜条件下静置培养。
培养粪肠球菌的培养基为脑心浸液(brainheartinfusion)培养基(品牌oxoid,货号cm1135),培养基主要成分为braininfusionsolids12.5g/l,beefheartinfusionsolids5.0g/l,proteosepeptone10.0g/l,glucose2.0g/l,sodiumchloride5.0g/l,di-sodiumphosphate2.5g/l,ph7.4±0.2。如需配置成固体,需要添加琼脂粉15g/l。115℃灭菌30min,冷却后待用。
培养粪肠球菌生物膜的培养基为脑心浸液-蔗糖培养基,即在脑心浸液中添加终浓度为1%的蔗糖。蔗糖需事先配成20%贮存液并用0.22μm的无菌滤器过滤除菌。
用无菌接种环将粪肠球菌atcc29212模式菌株在含有脑心浸液琼脂固体培养基的平板上进行划线,倒置于37℃的厌氧培养箱中培养直至出现明显的单菌落。
用无菌的移液枪枪尖刮取粪肠球菌atcc29212,转接到装有脑心浸液液体培养基的试管中,在37℃的厌氧培养箱中静置,培养至液体浑浊。
用紫外可见光分光光度计检测粪肠球菌在600nm下的吸光度值(od600nm)。
用分析天平精准称量式(i)化合物,加入dmso将其溶解,然后用孔径0.22μm的无菌滤器过滤除菌,配成终浓度为100mg/l的贮存液,存放于4℃待用。
实验方法如下:
将粪肠球菌培养至对数期,浓度调至1×106cfu/ml待用。
采用微量肉汤稀释法检测式(i)化合物对粪肠球菌atcc29212的最小抑菌浓度,即将倍比稀释后不同浓度的式(i)化合物溶液分别加到无菌的96孔板中,第1至第10孔为加药液的实验组,第11孔为不加药的生长对照组,第12孔为不加菌液及药液的空白对照组,每孔粪肠球菌液终浓度为1×105cfu/ml。此时,第1至第11孔药物浓度分别为62.50、31.25、15.63、7.81、3.91、1.95、0.98、0.49、0.24、0.12、0μg/ml。培养24小时后,用紫外可见光分光光度计检测粪肠球菌在600nm下的吸光度值(od600nm)。以(实验组-空白对照组)/(生长对照组-空白对照组)小于等于10%的最低浓度为最小抑菌浓度(mic90)。
将小孔内的菌液均匀涂布到脑心浸液琼脂固体培养基上后,在37℃厌氧培养箱中倒置培养24小时,以没有细菌生产的最低浓度定位最小杀菌浓度(mbc)。
采用结晶紫染色法检测式(i)化合物对粪肠球菌atcc29212的最小生物膜抑制浓度,即将倍比稀释后不同浓度的式(i)化合物溶液分别加到无菌的96孔板中,第1至第10孔为加药液的实验组,第11孔为不加药的生长对照组,每孔200ul,第1至第11孔药物浓度分别为62.50、31.25、15.63、7.81、3.91、1.95、0.98、0.49、0.24、0.12、0μg/ml;第12孔为不加菌液及药液的空白对照组。每孔加入粪肠球菌atcc29212的终浓度为1×104cfu/ml。培养24小时后,采用结晶紫染色法对每孔内生物膜染色后,脱色液用紫外可见光分光光度计检测粪肠球菌在590nm下的吸光度值(od590nm)。具体为,将每个孔中的浮游细胞移走,并用大量的pbs冲洗未吸附的细胞。向每个孔中加入0.1%的结晶紫溶液200μl,在室温的条件下静置5min进行染色,然后移除结晶紫溶液,并用大量水冲洗掉除去未吸附的结晶紫。向每个孔中加入33%的乙酸溶液200ul溶解吸附的结晶紫,然后使用酶标仪检测od590nm下的吸光度值。以(实验组-空白对照组)/(生长对照组-空白对照组)小于等于10%的最低浓度为最小生物膜抑制浓度(mbic90)。
采用结晶紫染色法检测式(i)化合物对粪肠球菌atcc29212的最小生物膜清除浓度。在无菌96孔板中先形成粪肠球菌atcc2921224小时生物膜后再加入倍比稀释后不同浓度的式(i)化合物溶液处理。即每孔加入150μl脑心浸液培养基与50μl上述配置好的对数期粪肠球菌atcc29212菌液,培养24小时后,吸出上清液,加入倍比稀释后不同浓度的式(i)化合物溶液分别加到无菌的96孔板中,第1至第10孔为加药液的实验组,第11孔为不加药的生长对照组,每孔200ul;第1至第11孔药物浓度分别为62.50、31.25、15.63、7.81、3.91、1.95、0.98、0.49、0.24、0.12、0μg/ml;第12孔为不加菌液及药液的空白对照组。培养24小时后,采用结晶紫染色法对每孔内生物膜染色后,脱色液用紫外可见光分光光度计检测粪肠球菌在600nm下的吸光度值(od600nm)。以突然增高的od值的前一孔的最低浓度为最小生物膜清除浓度(mbrc90)。
以上实验有效重复3次。
按照上述方法对变异链球菌ua159(s.mutans)在相同条件下进行了测试,实验结果如表1所示。
表1.式(i)化合物粪肠球菌atcc29212浮游细胞的活性检测(单位μg/ml)
mic:最小抑菌浓度;mbc:最小杀菌浓度;mbic:最小生物膜抑制抑菌浓度;mbrc:最小生物膜清除浓度。
从表1可以看出,式(i)化合物对粪肠球菌具有很好的抑菌活性和杀伤活性,能有效抑制和清除其生物膜,其抗菌活性较阳性对照药氯己定、次氯酸钠的抗菌活性更高。
实施例2.式(i)化合物对人口腔细胞的毒性实验
人巨噬细胞raw、人牙周膜成纤维细胞pdlc、人成骨肉瘤细胞mg63和式(i)化合物的准备如下:
本实验所使用的人巨噬细胞raw、人牙周膜成纤维细胞pdlc、人成骨肉瘤细胞mg63均为细胞系。所用培养基为dmem高糖培养基(含l-谷氨酰胺,110mg/l丙酮酸钠)+10%胎牛血清+1%青链霉素混合液
按照实施例1中描述的方法准备式(i)化合物。
培养人巨噬细胞raw、人牙周膜成纤维细胞pdlc、人成骨肉瘤细胞mg63的培养基为dmem高糖(含l-谷氨酰胺,110mg/l丙酮酸钠)培养基(品牌gibco,货号c11995500bt)加入10%胎牛血清和1%青链霉素混合液配成完全培养基。
上述细胞传代时,吸出培养皿内培养基后,加入0.25%胰酶(品牌hyclone,货号sh30042.01b)1ml,消化至倒置显微镜观察到细胞形态变圆后加入完全培养基终止消化,使用1000rpm离心5min,吸去上清液后加入1ml完全培养基重悬,根据细胞量决定传代比例。
实验方法如下:
将人巨噬细胞raw培养后,同上述传代所述方法,重悬后计数,稀释至1×105个/ml,加入无菌96孔板中使得每孔内细胞量为10000个,在37℃,5%co2培养箱中培养24h。
采用微量肉汤稀释法和cck8法检测式(i)化合物的细胞毒性。吸出(1)中完全培养基,用pbs冲洗一次后加入倍比稀释后不同浓度的式(i)化合物溶液,第1至第9孔为加药液的实验组,第10孔为不加药的生长对照组,第11孔为只加完全培养基空白对照组,第1至第10孔药物浓度分别为62.50、31.25、15.63、7.81、3.91、1.95、0.98、0.49、0.24、0.12、0μg/ml。加入药液处理5min后,pbs冲洗一次,加入200μl完全培养基、10μlcck8(cellcountingkit-8品牌日本东仁),放入37℃,5%co2培养箱中培养1-1.5h后使用酶标仪检测od450nm下的吸光度值。计算细胞存活率以(实验组-空白对照组)/(生长对照组-空白对照组)小于50%对应的式(i)化合物最低浓度为ic50。以上实验重复3次,所得结果如图1所示。
按照以上实验方法对人牙周膜成纤维细胞pdlc、人成骨肉瘤细胞mg63进行相同条件下5min和7天细胞毒性测试。当药物处理时间为7天时,每1天更换新的含药培养基。
从图1可看出,式(i)化合物(即图中编号ii-6s)作为漱口水、根管冲洗液(暴露时间5min)对可能接触到的口腔细胞,如人巨噬细胞raw、人牙周膜成纤维细胞pdlc、人成骨肉瘤细胞mg63的细胞毒性低于目前临床常用的氯己定和次氯酸钠,在有效浓度范围内,其细胞存活率大于50%,证明其安全性可靠。
- 还没有人留言评论。精彩留言会获得点赞!