假臭草苯丙素类化合物及其应用的制作方法
本发明属于医药技术领域,尤其涉及假臭草苯丙素类化合物及其应用。
背景技术:
炎症是具有血管系统的活体组织对损伤因子所产生的防御反应。大多数疾病都伴有炎症的发生,炎症会加重疾病的发生和发展,有些慢性炎症甚至会导致肿瘤的发生,因此,对炎症的控制和治疗具有非常重要的意义。
天然药物尤其是来源于植物的药物具有化学结构多样性和生物活性多样性,一直是人类预防和治疗疾病的主要来源。临床上应用的许多药物都直接或间接来源于天然产物,天然产物不仅可以作为药物半合成的前体物,而且可以作为药物化学合成的模板,为新药设计提供新思路。天然产物已成为发现新药物或先导化合物的主要源泉之一。
假臭草(praxelisclematidea(griseb.)r.m.king&h.robinson.),为一年多生或短命的多年生草本植物,属于菊科(compositae)泽兰属(eupatorium)植物,具有独特的蓝紫色簇状的花。将假臭草压碎后有像猫尿液一样强烈的气味,故又被称作猫腥菊。假臭草的适应力极强,可于多种气候地区生长(如:热带、热带雨林、热带草原、亚热带和地中海气候等)。
事实上,假臭草被认定为一种入侵的有害杂草,近年来迅速入侵了中国南部、澳大利亚,昆士兰北部、佛罗里达州等全球多个地区,且影响了当地的生态系统和自然环境,造成了严重的经济损失和环境破坏。假臭草常生长在树林、果园、荒地和灌木丛林等地方,由于其生长及繁殖能力极其迅速,能够极大地消耗土壤中的养分,对土壤的可耕性有强破坏性,且其气味较大,影响牲畜觅食和农作物的生长,故对很多地区的农业、林业和畜牧业有着不利的影响,成为对当地经济发展具有破坏潜力的入侵恶性杂草。由于假臭草具有化感作用,对入侵地的其他草本植物有着排斥作用,从而对其他生物物种的生存和繁殖造成了极大威胁,导致当地生物的多样性和丰富度严重下降。
假臭草中主要的化学成分要包括黄酮类、萜类、甾体类等。研究发现,假臭草由于含有丰富的黄酮类化合物而具有一定的抗菌活性,假臭草中所含的化感物质(倍半萜类等)有可能被用于合成新型的植物源农药,用来治理农田的其他杂草和病虫害。由于现有研究对假臭草的化学成分研究仍不够彻底,因而其化学成分具体结构及药学功能值得进一步研究和开发利用,从而为这种外来恶性杂草的资源化利用提供新途径。
技术实现要素:
本发明的目的在于确认假臭草的化学成分及药学功效,提供一种假臭草苯丙素类化合物,并提供该假臭草苯丙素类化合物在治疗与炎症相关的病症中的应用。
本发明提供的假臭草苯丙素类化合物具有如下式i或式ii的结构式:
式i:
本发明还提供上述假臭草苯丙素类化合物及其互变异构体、药学可接受的衍生物在制备抗炎药物中的应用。
进一步,所述炎症为神经炎症、肺炎、肝炎、乳腺炎、胃炎、滑囊炎、血栓闭塞性脉管炎、心肌炎中的任意一种。
进一步,所述抗炎药物的药物剂型为片剂、散剂、颗粒剂、胶囊剂、乳剂或糖浆剂。
进一步,所述抗炎药物的药物剂型为注射剂。
进一步,所述具有式i结构式的假臭草苯丙素类化合物及其互变异构体、药学可接受的衍生物的起效浓度不低于40μm。
进一步,所述假臭草苯丙素类化合物药学可接受的衍生物选自其药用盐、药用酯、酰基化化合物、烷基化化合物、活性代谢产物、光学异构体。
本发明还提供上述假臭草苯丙素类化合物及其互变异构体、药学可接受的衍生物在制备治疗阿尔兹海默病药物中的应用。
本发明从假臭草中提取出新型的苯丙素类化合物,动物药效学试验表明该新型的苯丙素类化合物具有良好的体外抗炎活性,可用于研发新的抗炎药物。
附图说明
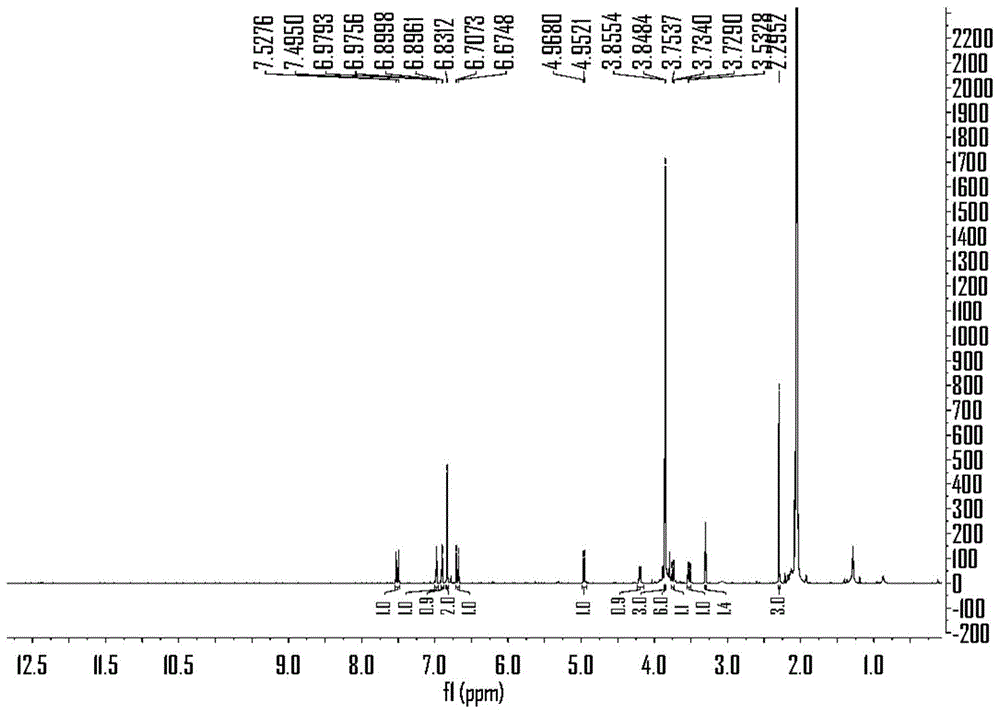
图1为化合物1的1h-nmr谱图;
图2为化合物1的13c-nmr谱图;
图3为化合物1的ir谱图;
图4为化合物2的1h-nmr谱图;
图5为化合物2的13c-nmr谱图;
图6为化合物2的ir谱图;
图7表示化合物1对蛋白表达的抑制作用,其中(a)为不同浓度的化合物1对lps诱导的bv-2细胞inos和cox-2的蛋白表达图,(b)为对(a)的蛋白表达量量化图。
具体实施方式
以下结合具体实施例来进一步说明本发明的技术方案。
实施例1
本实施例1从假臭草中提取分离得到2种化合物,对其进行鉴定,确认了2种化合物的具体结构,其中的提取分离方法包括以下步骤:
(1)将10kg自然阴干的假臭草全株剪碎,采用75%乙醇在60℃条件下回流提取4次,每次2小时,得到提取浓缩液(10l)。
(2)依次用等体积的环己烷、氯仿、乙酸乙酯和正丁醇对提取浓缩液分别进行3次萃取,得到氯仿层(74.68g)。
(3)将氯仿部分(74.68g)进行硅胶柱层析,利用二氯甲烷-甲醇进行梯度洗脱(100:0、50:1、20:1、10:1、5:1、3:1、0:100;v/v),取体积比为50:1的二氯甲烷-甲醇洗脱液为有效部分x和y;
(4)将有效部分x部分经硅胶柱层析,以环己烷-乙酸乙酯混合液梯度洗脱(20:1~1:1;v/v),分为11个部分,通过反相薄层分析后,将第10部分(环己烷和乙酸乙酯溶液的体积比为1:1的洗脱部分)进行中低压ods柱层析,用乙醇水溶液(10%~100%;v/v)进行梯度洗脱后;通过反相和硅胶薄层色谱分析后,对其中第5个流份(50%;v/v,甲醇-水洗脱部分)再进行半制备hplc(40%甲醇水,tr=27.0分钟),获得化合物1。
(5)将y经硅胶柱层析,以环己烷-乙酸乙酯梯度洗脱(50:1~1:1,v/v),分为13个部分,通过反相薄层分析,对其第10部分(环己烷和乙酸乙酯溶液的体积比为2:1的洗脱部分)进行中低压ods柱层析,以甲醇水溶液(10%~100%)进行梯度洗脱后,通过硅胶和反相薄层分析,对其中第1个流份(10%甲醇水洗脱部分),再进行半制备hplc(40%甲醇水,tr=43.6分钟),获得化合物2。
通过理化常数和现代波谱学手段(hr-esi-ms,1dnmr,2dnmr)鉴定以上2个化合物,结果如下:
化合物1:
化合物1为黄色无定型粉末,易溶于丙酮、甲醇,紫外245nm下呈紫色荧光,经硅胶薄层层析(10%硫酸-乙醇)在105℃加热显色后由黄色转为灰蓝色。旋光度为
化合物1的1h-nmr、13c-nmr和ir谱图依次如图1~3所示,其1h-nmr和13c-nmr数据见表1。
hr-esi-ms(positive)显示出m/z417.1552[m+h]+(calcd.forc22h24o8,417.1549),故确定分子式为c22h23o8。
红外吸收光谱ir在3407cm-1和1684cm-1处有强吸收,表明有羟基和芳香基团存在。
1h-nmr(acetone-d6,500mhz)中,芳香区δh6.98(1h,d,j=1.8hz)和6.90(1h,d,j=1.8hz)根据偶合情况推断为一个1,3,4,5四取代模式的苯环片段;δh6.83(2h,s)的单峰推断为一个1,3,4,5四取代,且3,5位为相同取代基的苯环片段;δh7.51(1h,d,j=16.3hz)、6.96(1h,d,j=16.3hz)为一对反式双键上的质子信号。高场区δh4.96(1h,d,j=8.0hz)和4.19(1h,ddd,j=8.0,4.3,2.5hz)推测为两个相连的连氧次甲基上的氢信号,δh3.74(1h,dd,j=12.4,2.5hz)、3.52(1h,dd,j=12.4,4.3hz)根据偶合情况推测为与上述次甲基相连的连氧亚甲基上的两个氢信号,δh3.86(3h,s)、3.85(6h,s)为苯环上三个甲氧基的氢信号,δh2.29(3h,s)为一个甲基的氢信号。
13c-nmr(acetone-d6,126mhz)谱共给出22个碳信号。低场区δc197.8推测为一个酮羰基的碳信号。芳香区给出14个碳信号,除去1h-nmr提示的两个芳环上的12个碳,其余两个碳信号位于δc143.9、126.5,为双键上的两个碳信号。在δc79.3、77.7、61.7为三个连氧烷基的碳信号,δc56.8、56.4为芳环上的三个甲氧基的碳信号,δc27.44为一个甲基碳信号。结合氢谱,可推测该化合物的母核为3′,7环氧-8,4′-氧新木脂烷类化合物。在hmbc中,δh2.29(h-10')与δc197.8(c-9')、126.5(c-8')远程相关,可确定甲基与酮羰基相连,且酮羰基与双键相连。δh7.51(h-7')与δc197.8(c-9')、127.8(c-1')、126.5(c-8')、111.2(c-2')远程相关,确定双键与c-1相连。δh4.96(h-7)与δc106.4(c-2,6)、79.3(c-8)、61.7(c-9)远程相关,推断c-1′与ch(o)ch(o)ch2oh片段c-7相连。根据noesy谱分析h-7与h-8并不存在noe效应且h-7′与h-8′的偶合常数(j7,8=8.0hz),可判断该化合物为threo构型。在圆二色谱中,在240nm处出现正的cotton效应,在280nm出现负的cotton效应,据此可知该化合物的绝对构型为7s,8s。通过1h-nmr、13c-nmr(dept)、hsqc、hmbc及1h-1hcosy谱并结合文献可以对该化合物的碳及氢信号进行全面归属。
综合以上信息,化合物1可推断为苯丙素类化合物,具体鉴定为4-[(3s)-(4-hydroxy-3,5-dimethoxyphenyl)-(2s)-hydroxymethyl-8-methoxy-2,3-dihydrobenzo-[1,4]dioxin-6-yl]-(3e)-buten-2-one,即(7s,8s,7′e)-4-羟基-3,5,5′-三甲氧基-3′,7-环氧-8,4′-氧新木脂烷-7′-烯-9′-甲基酮,结构式为:
化合物2:
化合物2为无色膏状物,易溶于丙酮、甲醇。旋光度为
化合物2的1h-nmr、13c-nmr和ir谱图依次如图4~6所示,其1h-nmr和13c-nmr数据见表1。
hr-esi-ms(positive)显示准分子离子峰m/z309.1343[m+h]+(calcd.forc16h21o6,309.1338),确定其分子式为c16h20o6。
红外吸收光谱ir在3425cm-1和1683cm-1处有强吸收,表明存在芳香基团和羟基。
1h-nmr(600mhz,acetone-d6)中,芳香区δh7.35(1h,d,j=1.9hz)、7.14(1h,dd,j=8.2,1.9hz)和6.87(1h,d,j=8.2hz)根据偶合情况推测为一个abx自旋系统的苯环片段,δh7.58(1h,d,j=15.9hz)、6.37(1h,d,j=15.9hz)为一个反式双键上的两个质子信号,δh4.78(1h,m)、3.86(1h,m)和3.66(1h,m)推测为三个连氧的次甲基的氢信号,δh3.93(3h,s)为一个甲氧基的氢信号。
13c-nmr(150mhz,acetone-d6)中,共给出了16个碳信号。δc166.9为一个酯羰基的碳信号,在芳香区δc150.0(c-4′)、148.8(c-3′)、127.5(c-1′)、124.0(c-6′)、116.0(c-2′)和111.3(c-5′)为苯环上的6个碳信号,δc145.5和116.3为双键上的两个碳信号。δc71.4、70.3和8.5为三个连氧次甲基的碳信号,δc35.3、28.0和25.7为三个亚甲基的碳信号。利用hsqc、hmbc图谱进一步归属,δh7.58(h-7′)与δc166.9(c-9′)、127.5(c-1′)、124.0(c-6′)、116.0(c-2′)和111.3(c-5′)远程相关,可推断该化合物是以c6-c3单元为母核的苯丙酸类化合物;由δh1.97(h-3a)与δc68.5(c-2)相关,δh1.81(h-3b)与δc71.4(c-4)相关,δh1.86(h-6b)与δc70.3(c-1)相关,δh1.71(h-5a)与δc71.4(c-4)、35.3(c-3)和28.0(c-6)相关,确定为一个1,2,4位取代了三个连氧基团的六元环片段。
综上所述,化合物2为苯丙素类化合物,可被鉴定为(e)-3-(4-hydroxy-3-methoxyphenyl)prop-2-enoicacid-(1,2-dihydroxycyclohexyl)-4-ester,即(e)-3-(4-羟基-3-甲氧基苯基)-2-烯-丙酸-(1,2-二羟基-环己基)-4-酯,结构式为:
表1本发明化合物1和2的1h-nmr和13c-nmr谱数据(acetone-d6)
实施例2
本实施例采用lps(脂多糖)诱导bv-2(小鼠小胶质细胞)细胞,建立体外炎症模型。通过mtt测试样品的细胞毒性,通过griess测定no生成量,考察上述化合物1和2对经脂多糖诱导后的bv-2细胞释放炎症介质no的影响,并以抗炎药米诺环素作为阳性对照。
1、mtt实验
将lps诱导的bv-2细胞接种于96孔板中,培养24h。设立样品组、阴性对照组和空白对照组,其中样品组为在细胞悬浮液中加入待测供试品;阴性对照组为单纯的细胞悬液;空白对照组则没有细胞悬浮液也不加待测供试品。继续培养24h后用mtt法测定样品对细胞增殖的抑制率。每组实验重复3次。细胞增殖抑制率=(阴性对照组od值平均值-样品组od值平均值)/(阴性对照组od值平均值-空白对照组od值平均值)×100%;并用calcusyn软件计算被测试样品的半数抑制浓度(ic50)。
2、griess实验
将lps诱导的bv-2细胞接种于96孔板中,培养24h后,加入待测供试品,再培养24h后,吸取各孔培养液50μl,加入50μlgriessa试剂和50μlgriessb试剂混匀,用酶标仪于546nm处测定od值。另外设置模型对照组和阴性对照组,其中模型对照组为lps诱导的bv2细胞,阴性对照组为正常的bv-2细胞。每组实验重复3次。计算对no产生的抑制率,no抑制率=(模型对照组od值平均值-样品组od值平均值)/(模型对照组od值平均值-阴性对照组od值平均值)×100%,并用calcusyn软件计算被测试样品的半数抑制浓度(ic50)。
上述mtt实验和griess实验的结果见表2。
表2本发明化合物1和2对bv-2细胞释放炎症介质no的抑制作用
从表2的实验数据可知,假臭草中分离得到的2个化合物对lps诱导的bv-2细胞产生的炎症介质no均表现出较好的抑制作用,尤其是化合物1对炎症介质no的抑制作用最为显著,ic50=27.54±8.08μm,其抗炎效果与抗炎药米诺环素的抑制效果相当。在mtt实验中,2个化合物在0~100μm的浓度范围内对bv-2小鼠神经小胶质细胞均没有显示出细胞毒性。
3、westernblot实验
将处于指数生长期的细胞种于96孔板中,加入lps后,分别加入不同浓度的化合物1(10.0、20.0、40.0μm),经刺激后,于相应时间点提取各组总蛋白,在10%的聚丙烯酰胺凝胶中电泳,再转到nc膜上,封闭,孵育,采用ecl试剂盒显影并成像。每组实验重复3次。另外设置不加lps和化合物1、加入lps但不加化合物1的实验组作为对照。
实验结果见图7,图7a的蛋白表达图和图7b的柱状图中的横坐标从左向右依次表示不加lps和化合物1、加入lps但不加化合物1、加入lps以及三种不同浓度的化合物1(10.0、20.0、40.0μm),“*”表示lps相对于ctl的显著性,“#”表示苯丙素类化合物相对于肌动蛋白(capdh)的显著性,###p<0.001;**p<0.01。
由图7可知,化合物1对lps诱导的bv-2细胞的inos蛋白表达具有一定的抑制作用,且该抑制作用随着化合物1浓度的增加而增强。当化合物1浓度为40μm时,能显著下调lps诱导的bv-2细胞的inos蛋白表达,说明本发明化合物1能够通过抑制inos的表达,从而下调no的生物合成,最终表现出抗炎作用。同时可以推测,化合物1的抗炎起效浓度为40μm及以上。
上述结果说明,本发明提取的假臭草苯丙素类化合物可抑制炎症因子no的产生,并抑制inos蛋白的表达,具有良好的抗炎作用,说明本发明提取的假臭草苯丙素类化合物及其互变异构体、及其药学可接受的衍生物(其药用盐、药用酯、酰基化化合物、烷基化化合物、活性代谢产物、光学异构体)具有用于制备新型抗炎药物的可观优势,用于治疗神经炎症、肺炎、肝炎、乳腺炎、胃炎、滑囊炎、血栓闭塞性脉管炎、心肌炎等炎症。在使用本发明的假臭草苯丙素类化合物及其互变异构体、药学可接受的衍生物制备抗炎药物时,可将药物制成片剂、散剂、颗粒剂、胶囊剂、乳剂或糖浆剂等口服给药型,或制成注射剂之类的非口服给药型。
另外,由于阿尔兹海默病药物的发生与发展伴随着炎症,尤其与bv-2细胞的inos蛋白表达相关,因此本发明的假臭草苯丙素类化合物及其互变异构体、药学可接受的衍生物也可用于制备治疗阿尔兹海默病的药物。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!