一种SHP2小分子选择性抑制剂及其在制备抗肺癌药物中的应用的制作方法
本发明属于药物制备领域,具体涉及一种shp2小分子选择性抑制剂及其在制备抗肺癌药物中的应用。
背景技术:
蛋白酪氨酸磷酸酶(srchomologyphosphotyrosylphosphatase2,shp2)是由ptpn11基因编码的一种广泛分布在人体许多组织的非受体型蛋白酪氨酸磷酸酶。shp2含有两个sh2结构域(分别为n-sh2和c-sh2)和催化(ptp)结构域。ptp结构域具有催化活性,两个sh2结构域作为磷酸酪氨酸结合结构域,调节ptp与其底物的相互作用。与磷酸化酪氨酸残基结合改变了n-sh2结构域的构象,阻碍了其与ptp结构域的结合,引起shp2活化。生物化学与遗传学研究表明shp2在很多生长因子、细胞因子以及ras信号转导中具有重要作用,并参与细胞增殖、迁移、侵袭的调控。shp2在ras-mapk通路活化的作用及其作为jak-stat信号通路重要的负调节剂使shp2成为某些类型白血病和一些实体肿瘤病理过程中的关键癌基因。目前,在已经许多肿瘤中发现shp2的异常表达,在幼年型骨髓单核细胞白血病,儿童骨髓增生异常综合征,b细胞急性淋巴细胞白血病和急性髓性白血病中发现了ptpn11基因增益型突变体;在约35%散发性青少年粒单核细胞白血病中发现ptpn11基因突变;此外,shp2的突变也导致了50%的努南综合征。与此同时,在胃癌、肝癌、乳腺癌、胰管腺癌和肺癌等实体肿瘤中也发现了ptpn11突变基因。多数shp2突变增加了该蛋白的催化活性,其主要减弱了n-sh2的自抑制作用。
蛋白酪氨酸磷酸酶(srchomologyphosphotyrosylphosphatase2,shp2),是一种由ptpn11编码,它是第一个发现的致癌酪氨酸磷酸酶,shp2参与许多细胞信号通路的调控。小分子化合物靶向shp2可能是一种极具前景的治疗手段。
研究发现,抑制shp2的活性能够明显抑制肿瘤的生长,因此,小分子化合物靶向shp2可能是肿瘤化学治疗中一种极具前景的治疗手段。然而,由于shp2与shp1的ptp结构域上70%的同源序列,开发特异性抑制shp2的ptp抑制剂是一项极具困难的工作。
筋骨草属植物包括约301种,主要分布在亚洲,非洲,澳大利亚,欧洲和北美洲。该属植物用于民间药物,特别是用于治疗发热、牙痛、痢疾、高血压、糖尿病、胃肠疾病、驱虫等,其同时也具有抗菌、抗真菌、消炎、防虫、抗肿瘤等作用。
但是,筋骨草属植物抗肿瘤的药效物质基础至今未明,迄今为止,国内外学者对筋骨草属植物的化学成分亦研究不足。因此,研究筋骨草属植物中的化学成分,寻找一种新的特异性shp2抑制剂,在制备抗肿瘤药物中具有非常重要的意义。
技术实现要素:
本发明的目的在于提供一种shp2小分子选择性抑制剂及其在制备抗肺癌药物中的应用。
本发明提供了一种式i所示化合物、或其盐、或其光学异构体、或其立体异构体、或其溶剂合物、或其氘代物:
其中,r1选自氢、卤素、取代或未取代的c1-8烷基、取代或未取代的c1-8烷氧基、-nh-r2、-s-r2;所述c1-8烷基、c1-8烷氧基上的取代基各自独立地选自卤素、羟基、氨基、羧基、c1-8烷氧基,r2选自c1-8烷基。
进一步地,所述化合物的结果如式ii所示:
本发明还提供了上述式ii所示化合物的制备方法,所述方法包括以下步骤:
(1)取筋骨草属植物,经干燥、粉碎,用醇类溶液提取后,将提取液浓缩,然后用酯类溶剂萃取,取酯类溶剂部位;
(2)将步骤(1)所得酯类溶剂部位经过mci柱等度洗脱,所得体系命名为fr.0,所用洗脱剂为90%甲醇;
(3)将步骤(2)所得体系fr.0采用硅胶柱进行梯度洗脱,洗脱剂为石油醚:乙酸乙酯体积比=100:0-1:1的混合溶液,收集洗脱剂为石油醚:乙酸乙酯体积比=90:10时的部分,命名为fr.3;
(4)将步骤(3)所得fr.3采用sephadexlh-20进行等度洗脱,洗脱剂为chcl2:meoh体积比为4:6的混合溶液,所得体系命名为fr.3.2;
(5)将步骤(4)所得fr.3.2采用半制备hplc进行梯度洗脱,洗脱剂为75%-100%甲醇,收集洗脱剂为80-90%甲醇的部分,减压浓缩,再经过sephadexlh-20等度洗脱,洗脱剂为甲醇,即得。
进一步地,所述为圆叶筋骨草ajugaovalifoliabur.,优选为美花圆叶筋骨草ajugaovalifoliavar.calantha;
所述醇类溶剂为85%~99%乙醇,优选为95%乙醇;
所述酯类溶剂为乙酸乙酯;
所述提取的方式选自渗漉提取、超声提取、回流提取,优选为渗漉提取;所述提取的次数为1~5次,优选为3次。
本发明还提供了上述化合物、或其盐、或其光学异构体、或其立体异构体、或其溶剂合物在制备shp2抑制剂中的用途。
本发明还提供了上述化合物、或其盐、或其光学异构体、或其立体异构体、或其溶剂合物在制备治疗和/或预防癌症药物中的用途。
进一步地,所述癌症选自白血病、儿童骨髓增生异常综合征、努南综合征、胃癌、肝癌、乳腺癌、胰管腺癌或肺癌;
优选地,所述白血病为b细胞急性淋巴细胞白血病、急性髓性白血病或粒单核细胞白血病。
进一步地,所述癌症为肝癌或肺癌,优选为肺癌。
进一步地,所述药物能够与shp2通过氢键和疏水作用对接;
所述药物能够抑制shp2磷酸化,并特异性抑制shp2活性。
进一步地,所述药物能够提高凋亡相关蛋白cleavedcaspase-3,cleavedcaspase-8,cleavedcaspase-9以及cleaved-parp的表达;
所述药物能够抑制shp2-akt,shp2-erk通路;
所述药物能够抑制癌细胞增殖,诱导癌细胞凋亡,抑制癌细胞侵袭。
本发明还提供了一种药物组合物,所述药物组合物是以权利要求1或2所述的化合物、或其盐、或其光学异构体、或其立体异构体、或其溶剂合物为活性成分,加上药物上可接受的辅料制得的。
“渗漉提取”是指将适度粉碎的药材置渗漉筒中,由上部不断添加溶剂,溶剂渗过药材层向下流动过程中浸出药材成分的方法。
实验结果表明,本发明化合物3-ag与shp2能够通过形成氢键以及疏水作用进行对接,能够抑制shp2磷酸化,并特异性抑制shp2活性,对肺癌a549细胞增殖具有明显的特异性抑制作用。同时,本发明化合物能够显著提高凋亡相关蛋白cleavedcaspase-3,cleavedcaspase-8,cleavedcaspase-9以及cleaved-parp的表达,诱导a549细胞凋亡,抑制a549细胞侵袭。所以,本发明化合物在制备shp2抑制剂、以及治疗和/或预防癌症的药物,特别是治疗和/或预防肺癌的药物中具有非常好的应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
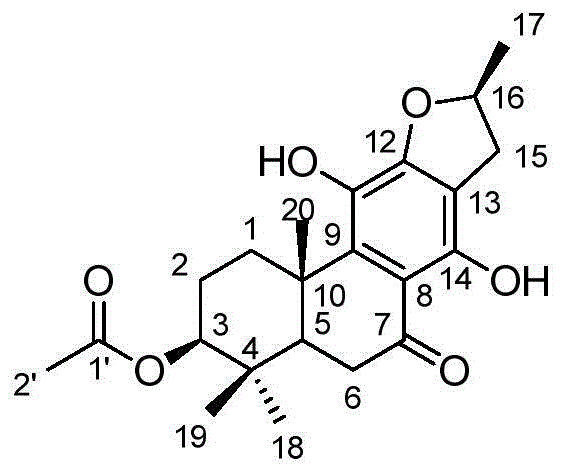
图1为化合物3-ag的结构。
图2为化合物3-ag的cosy,hmbc,noesy相关信号。
图3为化合物3-ag的cd图谱。
图4为化合物3-ag的细胞毒性实验数据,其中,a为化合物3-ag的结构,b、c、d依次为化合物3-ag对huh-7细胞、a549细胞、mrc5细胞的浓度-反应曲线。
图5为化合物3-ag抑制shp2活性与表达的实验数据,其中,a为化合物3-ag对shp1的活性影响结果,b为化合物3-ag对shp2的活性影响结果,c为化合物3-ag对a549细胞中shp2和p-shp2表达的影响。
图6为化合物3-ag与shp2的分子对接示意图。
图7为抑制erk1/2,akt磷酸化和a549细胞侵袭的实验结果,其中,a为化合物3-ag对erk1/2,akt,stat3,磷酸化erk1/2,磷酸化akt,磷酸化stat3的影响;b为不同浓度的化合物3-ag对a549细胞侵袭的显微镜观察结果;c为不同浓度的化合物3-ag对a549细胞活力的影响。
图8:a为化合物3-ag诱导a549细胞凋亡的流式检测结果,b为a中凋亡细胞的定量数据,c为不同浓度的化合物3-ag对cleavedcaspase-8,cleavedcaspase-9,cleavedcaspase-3和cleaved-parp水平的影响结果,d为不同浓度的化合物3-ag对caspase-3的活性影响结果。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
其中,美花圆叶筋骨草ajugaovalifoliavar.calantha于2017年7月采收于四川阿坝红原县邛溪镇,经四川省草原科学研究院的赵文吉鉴定为唇形科(labiate)筋骨草属(ajuga)美花圆叶筋骨草ajugaovalifoliabur.var.calantha(diels)c.y.wu。
半制备hplc色谱柱(250mm×10mm,5μm,ods-a,ymc公司),sephadexlh–20(瑞士pharmacia公司),mci(75~150μm,日本三菱化学公司),薄层色谱硅胶gf254和柱色谱硅胶(200~300目,青岛海洋化工厂)。
实施例1、本发明化合物3-ag的制备
美花圆叶筋骨草的干燥全草,粉碎至粗粉(4kg),经95%乙醇渗漉提取3次(每次采用的95%乙醇量为30l),将提取液减压浓缩后,经乙酸乙酯萃取。取其中乙酸乙酯部位(200g)经过mci柱脱色素(90%甲醇等度洗脱)后,经过200~300目硅胶柱层析(洗脱剂为石油醚:乙酸乙酯体积比=100:0-1:1的混合溶液)梯度洗脱,利用薄层色谱(tlc)检测合并主斑点,减压回收溶剂,得到9个组分(fr.1-fr.9),收集洗脱剂为石油醚:乙酸乙酯体积比=90:10时的部分,命名为fr.3。取fr.3(1.4g)经sephadexlh-20(洗脱剂为chcl2/meoh=4:6,等度洗脱)分离得到5个部分(fr.3.1-fr.3.5),收集组分命名为fr.3.2。取fr.3.2(100mg)经过半制备hplc(洗脱剂为75%-100%甲醇)梯度洗脱,收集洗脱剂为80-90%甲醇的部分,减压回收溶剂,然后经过sephadexlh-20(洗脱剂为meoh,等度洗脱)进一步纯化分离,得到黄色固体,命名为化合物3-ag(8mg)。
以下为化合物3-ag的结构表证。
1hnmr和13cnmr数据见表1,主要cosy,hmbc,noesy相关信号见图2,cd图谱见图3。
表1化合物3-ag的nmr数据
根据上述表征数据,hr-esi-msm/z411.1788[m+na]+提示分子式为c22h28o6(c22h28o6na计算值为411.1784),不饱和度为9。uv在352nm、299nm、215nm处有最大吸收,提示结构中含有苯环。ir在3223cm-1、1642cm-1、1612cm-1和1460cm-1处有吸收,说明结构中有羟基、共轭酮羰基和苯环。在1hnmr谱中显示四个和季碳相连的甲基信号δh:1.00(3h,s,h-19)、0.94(3h,s,h-18)、1.37(3h,s,h-20)、2.07(3h,s,h-2')和一个与叔碳相连的甲基δh:1.50(3h,d,j=6.3hz,h-17);δh:5.12(1h,m,h-16)为一个连氧次甲基;δh:2.83(1h,dd,j=15.3,7.4hz,h-15β)和3.34(1h,m,h-15α)提示有一个不对称的亚甲基。化合物3-ag的13cnmr谱结合hsqc显示出22个碳信号,包括两个羰基碳原子信号δc:204.0和171.0;六个苯环碳原子信号δc:110.2、111.1、131.2、138.5、156.0和156.1;五个甲基信号δc:16.7、18.3、21.4、22.1和28.2;四个亚甲基信号δc:24.4、34.5、34.6和35.1;三个次甲基信号δc:49.4、79.8和83.5;两个季碳δc:38.1和40.1。1h-1hcosy显示存在c-1-c-2-c-3和c-15-c-16-c-17片段信息,提示为松香烷二萜骨架中主要质子偶联序列。结合以上谱图数据,化合物3-ag与已知化合物villosina(cas:128286-76-0)具有极强的相似性,其唯一区别是化合物3-ag拥有乙酰氧基。在hmbc谱图中,观察到h-2'到c-3(或者h-3到c-2')远程相关,确定了乙酰氧基连接在c-3上;通过h-18、h-19与c-3、c-4、c-5,h-20与c-1、c-5、c-9和h-17与c-16的相关,确定了c-4、c-10、c-16位上的甲基取代。在noesy谱图上,通过h-5和h-3α、h-18的相关,h-17和h-15β的相关,h-20与h-1β、h-19相关、与h-5无关,说明了h-17、h-19、h-20为β构型,h-5为α构型。同时化合物3-ag的绝对构型通过与已有单晶数据的化合物villosina(ccdc-1482639)的实验cd谱确定,因此,该化合物的结构确定为(3s,5r,10s,16s)-12,16-epoxy-3-acetoxyl-11,14-dihydroxy-17(15→16)-abeo-abieta-8,11,13-trien-7-one,命名为3-acetoxylteuvincenoneg(3-ag),结构如下所示:
以下通过实验例证明本发明化合物的有益效果。
1实验材料与方法
1.1细胞培养与试剂
人肝癌细胞(huh-7),肺癌细胞(a549),正常人肺成纤维细胞(mrc-5)购于中国科学院上海细胞资源库,并培养在含有10%胎牛血清的高糖培养基中。cck-8、annexinv-fitc细胞凋亡检测试剂盒购于碧云天。fluorogenic6,8-difluoro-4-methylumbelliferylphosphate(difmup)购于invitrogen。
1.2细胞活力检测
分别把6×103个/孔的huh-7,a549和mrc-5细胞接种在96孔板中,过夜培养。加入不同浓度3-ag,以及溶剂对照(dmso),继续培养72h。药物处理结束后,每孔加入10μl的cck-8,37℃孵育1h,使用酶标仪检测545nm处吸光度。
1.3shp1和shp2的活性检测
通过escherichiacolibl21表达gst-tagshp1和shp2,并通过亲和色谱法纯化shp1与shp2[18]。每一个反应总体积100μl,包括反应缓冲液、20nmshp1或者shp2蛋白,5μl3-ag或dmso,并在37℃孵育30min。加入10mm的difmup触发实验,在355nm和460nm的激发和发射波长下检测荧光。
1.4蛋白免疫印迹实验
3-ag处理a549细胞72h后,使用ripa裂解细胞,并使用bca蛋白测定试剂盒检测蛋白浓度。将等量的蛋白加入sds-page,分离后,将目标蛋白转移到nc膜上,通过特异性一抗检测p-shp2/shp2,tubulin,p-erk/erk,p-akt/akt,p-stat3/stat3,cleavedcaspase-3,cleavedcaspase-8,cleavedcaspase-9和cleavedparp,并用gapdh作为内参。
1.5热迁移实验
将收集到的a549细胞在冷的并含cocktail的pbs清洗两次,通过液氮与37℃水浴循环裂解细胞3次,在15,000×g,4℃,离心15min,收集上清。将收集到的上清液分为均等的两份,每部分50μl。其中一份加入3-ag处理,另一份中加入等体积的dmso,在室温下孵育30min,然后在50℃至62℃范围内加热3min,室温冷却3min。将收集到的样品混匀,离心,加入5×loadingbuffer,100℃煮沸5min。通过westernblotting检测所有样品。
1.6分子对接实验
使用蛋白质数据库(pbdid:3b7o)中的shp2的晶体结构(无n-sh2和c-sh2端的ptp催化结构域)进行3-ag分子对接,使用autodocktools对shp2和3-ag进行加氢,去除水分子。所有模拟均采用autodock4.2和autodockvina1.1实现。基于对接的自由能和抑制常数来预测最佳对接构象。
1.7细胞侵袭实验
将a549细胞接种于无血清的matrigel预包被的transwell小室中,在下室中加入含有5%胎牛血清的培养基。待细胞沉降2h后,分别加入dmso或3-ag,孵育24h后,将细胞用4%多聚甲醛固定20min,用0.1%结晶紫染色10分min,并在显微镜下观察,拍照。
1.8细胞凋亡检测
3-ag处理72h后,将收集到的a549细胞用预冷的pbs洗两次。使用流式细胞仪通过fitcannexinv和pi双染色检测凋亡细胞的百分比。
1.9caspase-3活性检测
用荧光底物ac-devd-afc来检测caspapse-3的活性。将药物处理72h的a549细胞裂解,收集上清,然后在37℃下与100μmac-devd-afc孵育1h,使用激发波长为405nm,发射波长为510nm测定caspase-3活性。
1.10统计分析
使用graphpadprism6.0软件进行统计学分析。所有数据均表示为三次重复的平均值±标准偏差,并通过单因素方差分析和随后的dunnett事后检验进行比较。两种方法之间的差异被认为是统计学上显着的概率<0.05。
2实验结果
2.1化合物3-ag特异性抑制a549细胞增殖的实验
从图4看出,本发明化合物3-ag对人肝癌细胞(huh-7),肺癌细胞(a549),正常人肺成纤维细胞(mrc-5)的ic50分别为23.79,10.7与77.45μm,说明本发明化合物3-ag对正常肺成纤维细胞mrc5增殖的影响较小,同时能够明显抑制huh-7、a549细胞增殖,特别是对a549细胞增殖的抑制效果最显著。这些结果表明本发明化合物3-ag在较低浓度时对a549细胞增殖就具有明显的特异性抑制作用。
2.2化合物3-ag抑制shp2活性与表达的实验
从图5a和图5b看出,化合物3-ag对shp1活性没有抑制作用,却能够明显抑制shp2活性,其对shp2活性的抑制具有浓度依赖性,其ic50为8.79±0.13μm。说明本发明化合物3-ag能够特异性的抑制shp2活性。
从图5c看出,化合物3-ag能够特异性抑制a549细胞中shp2蛋白表达,并且抑制作用具有浓度依赖性。
上述实验结果表明,本发明化合物3-ag能够直接作用于shp2,并特异性抑制shp2的活性。
2.3化合物3-ag与shp2的分子对接实验
结果如图6所示。化合物3-ag的羰基和shp2上的氨基酸残基lys260上两个氨基形成两个氢键,芳环上的酚羟基氢和shp2上的氨基酸残基lys492上的双键氧原子形成氢键。此外,蛋白和配体的结合位点周围残基gln256、gln257、cys259、tyr263、glu313、gln495、met496、arg498、ser499形成疏水口袋与3-ag形成多个疏水相互作用,加强结合稳定性。shp2与3-ag的对接能量为-32.5kj/mol(远低于现有的通过与lys260或者lys492残基形成氢键、抑制shp2活性的小分子化合物的对接能量-1032.5kj/mol),抑制常数是2.01um,进一步说明本发明化合物3-ag能够与shp2稳定结合。
2.4化合物3-ag抑制erk1/2,akt磷酸化和a549细胞侵袭的实验
从图7a看出,化合物3-ag能够明显抑制a549细胞中erk1/2的磷酸化水平。此外,化合物3-ag能够浓度依赖性的抑制pi3k-akt和stat-3通路的激活。同时,从图7b和图7c可以看出,化合物3-ag在不影响a549细胞活力的浓度下,能够显著抑制a549细胞侵袭。
上述实验结果表明,本发明化合物3-ag能够通过下调shp2磷酸化来抑制shp2-akt,shp2-erk通路,进而抑制a549抑制a549细胞侵袭。
2.5化合物3-ag诱导a549细胞凋亡实验
如图8a和8b所示,化合物3-ag处理a549细胞72h后,早期与晚期凋亡细胞明显增多,说明化合物3-ag能够显著诱导a549细胞的凋亡。此外,通过图8c可知,化合物3-ag能够激活凋亡相关蛋白cleavedcaspase-8,cleavedcaspase-9,cleavedcaspase-3和cleavedparp,同时,从图8d看出,化合物3-ag明显上调了caspase-3的水平。
上述实验结果表明,本发明化合物3-ag能够激活凋亡相关蛋白cleavedcaspase-8,cleavedcaspase-9,cleavedcaspase-3和cleavedparp通路,诱导a549细胞凋亡。
综上,本发明首次从美花圆叶筋骨草ajugaovalifoliavar.calantha.的全草中提取分离出一种结构新颖的松香烷二萜,即化合物3-ag。本发明化合物与shp2能够通过形成氢键以及疏水作用进行对接,本发明化合物能够抑制shp2磷酸化,并特异性抑制shp2活性,对肺癌a549细胞增殖具有明显的特异性抑制作用。同时,本发明化合物能够显著提高凋亡相关蛋白cleavedcaspase-3,cleavedcaspase-8,cleavedcaspase-9以及cleaved-parp的表达,诱导a549细胞凋亡,抑制a549细胞侵袭。所以,本发明化合物在制备shp2抑制剂、以及治疗和/或预防癌症的药物,特别是治疗和/或预防肺癌的药物中具有非常好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!