用于治疗糖尿病的胰腺细胞及其生成方法与流程
相关申请
本申请根据美国法典第35款第119(e)条要求2018年2月9日提交的美国临时申请62/628,470的优先权,其全部内容通过引用并入本文。
本公开总体上涉及细胞生物学、干细胞和细胞分化领域。更具体地,本公开提供了用于生成胰腺细胞的方法、用于基于细胞的疗法的鉴定细胞的方法以及用于治疗糖尿病的相关方法。
背景技术:
提供下面的讨论以帮助读者理解本公开,并且不允许描述或构成本公开的现有技术。
糖尿病和胰岛素
糖尿病(diabetesmellitus)(即糖尿病(diabetes))是一种其中身体产生或响应胰岛素激素的能力受损,导致碳水化合物的异常代谢以及血液和尿液中升高的葡萄糖水平的疾病。该疾病被细分为若干种亚型,可替代地被描述为1型糖尿病、胰岛素依赖型糖尿病(iddm)、青年人中的成人发病型糖尿病(mody)、潜伏性成人糖尿病(lada)、脆性糖尿病、消瘦型糖尿病、1.5型糖尿病、2型糖尿病、3型糖尿病、肥胖相关的糖尿病、妊娠糖尿病以及本领域接受的其他命名法。
通常,患有胰岛素依赖型糖尿病的受试者需要施用外源性胰岛素以充分地降低血糖。非胰岛素依赖型受试者可以通过药物干预充分地降低血糖,所述药物干预包含增强对胰岛素敏感性或葡萄糖排泄的药物种类。患有胰岛素依赖型糖尿病的受试者可能会受益于细胞替代疗法,其中将胰岛素产生细胞植入到受试者中,无论该疾病是否被标记为1型糖尿病、mody、lada、脆性糖尿病、消瘦型糖尿病、1.5型糖尿病、2型糖尿病、3型糖尿病、肥胖相关的糖尿病或其任意组合。
i型糖尿病通常在儿童和青年人中诊断,并且以前被称为青少年糖尿病。只有5-10%的患有糖尿病的人具有这种形式的疾病。成人发病型糖尿病是该疾病最常见的形式,并且其是由于胰岛素产生β细胞的损伤或破坏、胰岛素抗性的发展或胰岛素产生β细胞的损伤和胰岛素抵抗的发展两者而产生的。由于遗传和环境因素的结合,糖尿病可以在非肥胖的成人和儿童中出现。在肥胖的成人和儿童中,胰腺可能试图制造附加胰岛素以便控制血糖,但随着时间的推移,其无法保持并维持血糖在正常水平。身体对产生的胰岛素也可能变得不太敏感。分泌胰岛素的β细胞的长期过度活动可能导致β细胞功能障碍和死亡。
糖尿病的症状根据受试者的血糖波动多少而变化。一些人(尤其是那些患有前驱糖尿病或非胰岛素依赖型糖尿病的人)最初可能不会出现症状。在i型糖尿病中,症状倾向于很快出现,并且更加严重。
i型糖尿病和ii型糖尿病的一些体征和症状包含但不限于增加的口渴;尿频;极度饥饿;无法解释的体重减轻;在尿液中存在酮(酮是在没有足够的可用胰岛素时发生的肌肉和脂肪分解的副产物);疲劳;易怒;模糊的视力;伤口愈合缓慢;频繁感染,诸如牙龈或皮肤感染和阴道感染。
用于治疗糖尿病的基于细胞的疗法
胰岛素依赖型糖尿病患者可以潜在地通过移植新的胰岛素产生细胞来治愈,但是这种方法迄今为止已经受到限制,因为这些细胞难以以足够的数量和质量获得。参见,例如pagliucafw,etal.cell,154(2):428-439(2014)。因此,长期以来,生物医学研究的目标是以更有效和更可预测的方式从人类干细胞中生成胰岛素产生β细胞。id.为了实现这一目标,必须建立生成统一的β细胞群体的方案,该β细胞群体在暴露于葡萄糖时产生胰岛素。然而,这样的方案仍然难以达成。许多研究小组已经提出了各种方案,这些方案使用不同的细胞系产生了不同的结果。功能性β细胞的这种不一致的产生增加了获得治疗益处所需的总细胞剂量,因此增加了潜在疗法的成本,并且由于可变的结果而限制了临床适用性。
从人类干细胞生成胰岛素产生β细胞的大多数既定方案产生高度可变的细胞群体。参见,例如pagliucafw,etal.cell,154(2):428-439(2014)。实际上,在本领域中,通常的做法是针对特定的细胞系调整给定的分化方案,从而阻止了本领域中分化的任何标准化。从各种分化方案中提高β细胞产量的方法通常包含以反复试错类型的方法测试影响分化途径的许多因素的组合。参见,例如pagliucafw,etal.cell,154(2):428-439(2014);rezeniaa.etal.nat.biotech.,32:1121-33(2014);schulztcetal.plosone,7:e37004(2012).chettys.etal.nat.methods,10:553-556(2012)。因此,用于从一个起始干细胞群体制备β细胞的特定方案可能对分化不同的起始群体是无效的。
此外,所产生的分化的细胞群体中的不一致性已经影响了任何所提出的疗法的临床应用,因为该领域的研究人员一直在努力获得具有持续高百分比的胰岛素产生细胞的分化群体。这不仅降低了治疗糖尿病的基于细胞的疗法的潜在功效,而且还引起了对关于含有异源细胞群体的细胞移植的致瘤潜力的担忧。此外,细胞批次之间的低再现性直接影响产生细胞的成本,并且限制了该方案向临床的转化。
在采用不同的分化方案中的这种可变性中的一些可以追溯到起始细胞系。例如,已经显示多能细胞系在分化成某些谱系的能力上可以有很大差异。参见bockcetal.cell,144:439-452(2011);limhetal.j.vis.exp.,(90):e51755(2014);osafuneketal.nat.biotechnol.,26:313-315(2008)。单个人类干细胞在其对目前使用的分化方案的反应中的这种不同能力已被证明是难以克服的障碍,因为研究人员没有迹象表明给定的细胞系或起始细胞最终产生治疗性细胞的潜力。
此外,当使用具有稍微不同遗传背景的细胞系时,由现有技术提供的指导实际上可能适得其反。例如,从多能干细胞生成胰岛素产生细胞的既定方案的一致特征是限制暴露于视黄酸和环巴胺。参见nostroetal.stemcellreports,4:1-14(2015)。来自现有技术的另一个一致的指导是,为了胰腺细胞的适当成熟,需要在悬浮的三维培养物中开始分化。参见pagliucafw,etal.cell,154(2):428-439(2014),rezaniaetal.naturebiotechnology,32(11):1121-33(2014)。如下面更详细地讨论的,遵循这样的指导实际上可以抑制胰岛素分泌细胞从各种干细胞系的分化。
因此,仍然需要生成用于治疗糖尿病的治疗性的胰岛素产生细胞的改进的和可预测的方法。本公开满足了这些需求。
技术实现要素:
本文描述了产生胰岛素并且可以用于治疗糖尿病的细胞和细胞组合物,以及其制备和鉴定方法。
在一个方面,本公开提供了产生哺乳动物胰岛素分泌细胞的方法,其包括:粘附培养哺乳动物干细胞,从而使哺乳动物干细胞自发地形成三维结构;和悬浮培养所述三维结构;其中培养步骤包括至少20天暴露于视黄酸和环巴胺,并且不包括将三维结构的干细胞暴露于wnt3a。
在另一个方面,本公开提供了产生胰岛素分泌细胞的方法,其包括:在包括激活素-a和渥曼青霉素的第一培养基中,在粘性基底上培养哺乳动物干细胞,其中哺乳动物干细胞不暴露于wnt3a;在包括视黄酸和环巴胺的至少一种附加培养基中进一步培养细胞;以及当细胞形成三维细胞结构时,将细胞转移到悬浮培养物中;其中细胞被暴露于视黄酸和环巴胺至少20天。
在前述方面的一些实施例中,哺乳动物干细胞可以是人类干细胞,而在一些实施例中,哺乳动物干细胞可以是非人灵长类干细胞。在前述方面的一些实施例中,哺乳动物干细胞来源于细胞系。
在一个方面,本公开提供了产生哺乳动物胰岛素分泌细胞的方法,其包括在包括内胚层诱导因子的第一培养基中培养哺乳动物干细胞,从而将哺乳动物干细胞分化为内胚层细胞;以及在包括内分泌诱导因子的第二培养基中培养内胚层细胞,从而将内胚层细胞分化为内分泌细胞;其中哺乳动物干细胞在分化成内胚层细胞之前没有暴露于角质细胞生长因子(kgf)。
在一些实施例中,哺乳动物干细胞可以是人类干细胞、非人灵长类干细胞或来源于另一种哺乳动物(包含但不限于猪、牛、羊、马、狗或猫)的干细胞。
在一些实施例中,内胚层诱导因子包括激活素-a、视黄酸和/或环巴胺。在一些实施例中,第一培养基可以进一步包括渥曼青霉素。在一些实施例中,第一培养基不包括wnt3a。在一些实施例中,细胞在第一培养基中培养1-3天。
在一些实施例中,第二培养基可以包括noggin和/或kgf。在一些实施例中,第二培养基可以包括视黄酸和环巴胺。在一些实施例中,细胞在第二培养基中培养1-4天。
该方面的一些实施例可以包括在包括kgf的第三培养基中进一步培养内分泌细胞,从而将内分泌细胞分化为胰腺祖细胞。在一些实施例中,第三培养基包括noggin和/或表皮生长因子(egf)。在一些实施例中,第三培养基包括视黄酸和环巴胺。在一些实施例中,细胞在第三培养基中培养1-4天。
该方面的一些实施例可以包括在包括noggin、egf、γ-分泌酶抑制剂xxi和/或alk5iii的第四培养基中进一步培养胰腺祖细胞。在一些实施例中,第四培养基可以包括t3。在一些实施例中,第四培养基可以包括视黄酸和环巴胺。在一些实施例中,细胞在第四培养基中培养1-4天。
该方面的一些实施例可以包括在包括alk5iii和/或视黄酸的第五培养基中进一步培养胰腺祖细胞。在一些实施例中,第五培养基可以包括t3。在一些实施例中,第五培养基可以包括视黄酸和环巴胺。在一些实施例中,细胞在第五培养基中培养1-5天。
该方面的一些实施例可以包括在包括alk5iii、烟酰胺和/或胰岛素样生长因子(igf)-i的第六培养基中进一步培养胰腺祖细胞。在一些实施例中,第六培养基可以包括t3和/或bmp4。在一些实施例中,第六培养基可以包括视黄酸和环巴胺。在一些实施例中,第六培养基可以包括胰高血糖素。在一些实施例中,细胞在第六培养基中培养1-9天。
在另一个方面,本公开提供了产生胰岛素分泌胰腺细胞的方法,其包括在包括激活素-a和渥曼青霉素的第一培养基中培养人类干细胞,从而将人类干细胞分化为内胚层细胞,其中人类干细胞在分化为内胚层细胞之前没有被暴露于角质细胞生长因子(kgf);以及在包括视黄酸和环巴胺的第二培养基中培养内胚层细胞,从而将内胚层细胞分化为内分泌细胞;在包括kgf、noggin和egf的第三培养基中培养内分泌细胞,从而将内分泌细胞分化为胰腺祖细胞;以及在包括noggin、egf、γ-分泌酶抑制剂xxi和alk5iii的第四培养基中培养胰腺祖细胞,从而将胰腺祖细胞分化为胰岛素产生胰腺细胞。
在该方面的一些实施例中,第二培养基进一步包括kgf。在一些实施例中,人类干细胞来源于胰腺原代组织。在一些实施例中,第四培养基可以包括甲状腺激素,诸如t3。
在该方面的一些实施例中,第三培养基和第四培养基都可以包括视黄酸和环巴胺。
该方面的一些实施例可以包括在第五培养基和/或第六培养基中进一步培养细胞,其中第五培养基包括alk5iii和视黄酸以及任选地环巴胺,并且其中第六培养基包括alk5iii、烟碱胺、igf-i以及任选地视黄酸和环巴胺。在一些实施例中,第六培养基可以包括胰高血糖素。
在前述方面的一些实施例中,细胞可以培养30天或更少。
在另一个方面,本公开提供了用于治疗糖尿病的基于细胞的组合物,其包括替代胰腺细胞的群体和用于植入到需要其的人类受试者中的合适的载体,其中至少66%的替代胰腺细胞是胰岛素产生胰腺细胞。
在一些实施例中,至少66%的替代胰腺细胞表达neurod1,而在一些实施例中,至少68%的替代胰腺细胞表达nkx6.1。
在一些实施例中,胰岛素产生胰腺细胞根据以下方法获得,所述方法包括在包括内胚层诱导因子的第一培养基中,在粘性基底上培养人类干细胞的群体,其中哺乳动物干细胞不暴露于wnt3a;在至少一种包括视黄酸和环巴胺的附加培养基中进一步培养细胞;以及当细胞形成三维细胞结构时,将细胞转移到悬浮培养物中;其中细胞被暴露于视黄酸和环巴胺至少20天。
在一些实施例中,内胚层诱导因子包括激活素-a和/或渥曼青霉素。在一些实施例中,所述至少一种附加培养基可以包括kgf、noggin、egf和/或甲状腺激素(诸如t3)。
在一些实施例中,替代胰腺细胞可以被包封在大胶囊中。例如,细胞可以被包封在包括海藻酸盐、硫酸纤维素、葡甘露聚糖或其组合的大胶囊中。
在前述方面的一些实施例中,人类干细胞来源于胰腺原代组织,是人胚胎干细胞,是诱导的多能干细胞,或者是非多能重编程细胞。在一些实施例中,重编程细胞来源于胰腺原代组织,例如,通过表达重编程基因而不将重编程基因掺入到细胞的基因组中。在一些实施例中,重编程基因可以在至少一个附加体表达质粒上编码,该质粒不掺入到基因组中。在一些实施例中,重编程基因包括oct4、sox2、klf4和l-myc。
在另一个方面,本公开提供了鉴定优先分化成内胚层谱系的未分化的细胞的方法,其包括评估未分化的细胞中bhmt2和nap1l1的表达,并且如果bhmt2的表达相对于对照细胞下调并且nap1l1的表达相对于对照细胞上调,则将该细胞鉴定为具有分化成内胚层谱系的偏好。
该方面的一些实施例进一步包括评估未分化的细胞中cox7a1和hspb2的表达,并且如果cox7a1和hspb2的表达都相对于对照细胞下调,则将该细胞鉴定为具有分化成内胚层谱系的偏好。在一些实施例中,对照细胞可以是多能细胞,其不表现出向内胚层谱系的优先分化或基本上不能向中胚层谱系分化。
在一些实施例中,当所评估的未分化的细胞优先地分化成内胚层谱系时,bhmt2的表达相对于对照细胞下调至少2个对数,并且nap1l1的表达相对于对照细胞上调至少2个对数。在一些实施例中,当评估的未分化的细胞优先地分化成内胚层谱系时,cox7a1和hspb2的表达相对于对照细胞都下调至少2个对数。
该方面的一些实施例进一步包括评估glis2、ccdc58、mtx3和c7orf29的表达。例如,在一些实施例中,当所评估的未分化的细胞优先地分化成内胚层谱系时,glis2、ccdc58和mtx3的表达相对于对照细胞可以上调,并且c7orf29的表达相对于对照细胞可以下调。
在一些实施例中,表达的水平通过q-pcr和/或通过微阵列分析来评估。
以下详细描述是示例性和解释性的,并且旨在提供对本发明的进一步解释。
附图说明
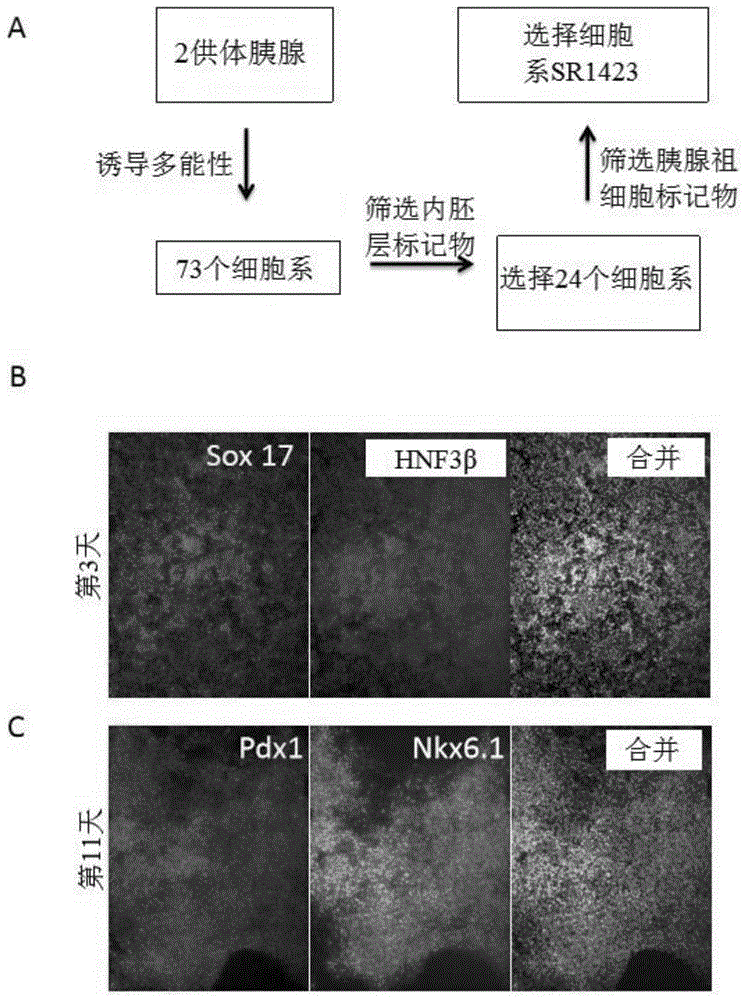
图1a-1c示出了从朗格汉斯岛中选择诱导的多能干细胞(ipsc)系sr1423。图1a示出了sr1423的选择方案。图1b表示免疫染色,随后通过荧光显微镜检查显示在分化第3天内胚层标记物sox17(左)和hnf3β(中)的sr1423表达。图1c示出了在sr1423细胞分化的第11天胰腺标记物pdx1(左)和nkx6.1(中)的免疫染色。合并的图像示出了标记物与核染色组合的共同染色。这些图像是以40倍的放大率拍摄的。
图2示出了sr1423细胞较差地分化为中胚层谱系。sr1423对sox17(内胚层)、brachyury(中胚层)或otx2(外胚层)进行免疫染色。核染色(在中胚层框架中明显)显示总的细胞数。该图表明,sr1423细胞具有成为内胚层和外胚层的能力(如通过sox17和otx2的几乎一致的标记所指示的),但较差地分化为中胚层,如通过不能表达brachyury所指示的。
图3a-3d示出了sr1423细胞具有多能干细胞的典型特征。图3a示出了sr1423细胞表达多能性标记物oct4、tra-1-81、tra-1-60、sox2、ssea。图3b示出了,在培养中40代后,sr1423细胞的核型是正常的。图3c示出了如通过单串联重复分析(str)评估的dna指纹。图3d示出了sr1423细胞倍增时间。
图4a-4b示出了sr1423细胞具有与向内胚层谱系的优先分化相关的基因表达模式。图4a示出了sr1423、b、c和d的基因表达谱聚类分析。表现出向内胚层的优先分化的两个系(sr1423和b)和未显示优先分化的两个系(c、d)之间的表达谱的相关性通过无监督的分级聚类分析来证明。上调的基因以红色显示,并且下调的基因以绿色显示。基于强度过滤器从该聚类分析中选择差异表达基因的子集,该强度过滤器识别在条件之间具有较大表达差异的基因。代表了250个具有最大表达差异的基因。图4bqrt示出了在a中鉴定的上调和下调的基因的子集的pcr验证。
图5a-5b示出了sr1423细胞产生健壮的胰腺的激素分泌细胞群体。图5a示出了在28天后sr1423的分化,其中在上面一行中对pdx(左)、nkx6.1(中)和合并(右)进行了免疫染色。下面一行示出了对胰岛素(左)、胰高血糖素(中)和合并(右)的免疫染色。“合并”图像包含核染色。所有图像均在分化28天后在40倍原始放大率下拍摄(n=10)。图5b示出了群体中胰腺细胞的平均纯度的量化。发现68%的细胞表达nkx6.1,并且66.5%的细胞表达胰岛素。
图6a-6c示出了通过排除kgf可以跨多种细胞系改善分化。图6a示出了在分化后在有kgf或没有kgf的情况下sr1423细胞的pdx(左)和nkx6.1(中)的免疫荧光染色。图6b示出了在分化后在有kgf或没有kgf的情况下bgo1v细胞的pdx(左)和nkx6(中)的免疫荧光染色。图6c将所公开的方案与公布的将早期内胚层细胞暴露于hdc57和bgo1v细胞中的kgf的方案进行了比较。通过原始掺入密度(n=10)测量表达水平,并与-kgf方案和+kgf方案进行比较。图像是以40倍的放大率收集的。误差棒代表平均sd;*p<0.05;****p<0.0001;ns,无意义。
图7示出了sr1423分化产生具有高水平的激素分泌的培养物。这是通过比较sr1423细胞和hdc57细胞响应于葡萄糖的胰岛素和胰高血糖素分泌来确定的。胰岛素和胰高血糖素的水平通过c肽(作为胰岛素的替代物)或胰高血糖素elisa来评估。
图8示出了动物模型中糖尿病的逆转。植入的细胞在植入到链脲佐菌素诱导的正常小鼠后调节血糖。在第0天植入包封的细胞。显示的结果是三只小鼠的平均值。误差棒是标准偏差。
图9a-9f示出了来源于非人灵长类(nhp)组织的干细胞系的代表性示例。来自nhp供体a的未分化的系a1.3表达多能性标记物oct4、ssea4、tra-1-80和tra-1-60(a-d)。这些细胞在分化的第4天表达内胚层标记物sox17和hnf2β(e),并且在第12天表达胰腺标记物pdx1和nkx6.1(f)。细胞核被染色。
图10a-b示出了暴露于胰高血糖素减少了共表达胰岛素和胰高血糖素的细胞的量。
具体实施方式
本文描述了可以用于治疗糖尿病的胰岛素分泌细胞和生成产生人胰岛素的β细胞的纯治疗性细胞群体的改进的方法。更具体地,本公开提供了产生哺乳动物胰岛素分泌细胞的方法,其包括用具有向内胚层谱系分化的偏好或倾向的干细胞系开始培养,使得简单的分化方案可以产生胰岛素分泌细胞的纯群体,其显示出响应葡萄糖分泌胰岛素的成熟表型。在其他步骤中,所公开的方案可以包含将干细胞(特别是对内胚层谱系表现出偏好或倾向的干细胞)长期(例如,至少20天)暴露于视黄酸和环巴胺(或化学类似物)。培养可以在粘附中开始,允许细胞自然和自发地形成三维结构;然后将三维结构转移到悬浮培养物中。在培养期间,细胞可能不暴露于wnt3a,无论是粘附生长还是悬浮生长。此外,本公开还提供了用于鉴定适合于细胞疗法且具有向内胚层谱系分化的倾向的细胞群体的方法。
i.定义
如本文中所使用的,术语“约”将被本领域普通技术人员理解,并且将根据其使用的上下文在一定程度上变化。如果给定其使用的上下文的该术语的使用对于本领域普通技术人员来说不清楚,则“约”将意味着该特定术语的最多正或负10%。
如本文中所使用的,术语“基本上不含”将指的是没有加入组合物基本上不含的药剂,但不排除存在痕量的药剂。
如本文中所使用的,术语“胰岛细胞”是指终末分化的胰腺内分泌细胞以及任何致力于形成通常被分类为胰腺内分泌的子代的前体细胞。胰岛细胞表现出胰岛细胞谱系典型的一些形态特征和表型标记物(举例如下)。成熟的α细胞分泌胰高血糖素;成熟的β细胞分泌胰岛素;成熟的δ细胞分泌生长抑素;pp细胞分泌胰腺多肽。
如本文中所使用的,“胰腺祖细胞”、“胰腺前体细胞”或“胰腺干细胞”是不能有意义地分泌内分泌激素的胰腺细胞或胰岛细胞,但是这些细胞可以增殖并产生能够分泌内分泌激素(例如胰岛素)的终末分化的细胞。早期胰腺祖细胞是多能的,这意味着其至少能够形成胰腺内分泌和胰腺外分泌细胞。
如本文中所使用的,术语“干细胞”表示能够分化成特化细胞(例如,胰岛素产生胰腺细胞)的未分化的细胞。为了本申请的目的,术语“干细胞”可以包含来源于受精后的胚胎前、胚胎或胎儿组织的多能细胞,其能够产生所有三个胚层(即内胚层、中胚层和外胚层)的祖细胞;诱导的多能细胞(即已经被重编程基因转导的细胞,并且能够产生所有三个胚层的祖细胞);和多能细胞,例如重编程细胞(即,已经被重编程基因转导的细胞),其可以分化为仅一个或两个胚层,或者优先分化为特定的胚层(例如,优先地分化为外胚层或内胚层细胞类型的重编程细胞)。该术语包含以所描述的方式多能性(pluripotent)或多能性(multipotent)的各种干细胞(包含从原始组织获得的细胞)的两种已建立的系。
如本文中所使用的,术语“诱导的多能细胞”或“诱导的多能干细胞”(“ips细胞”)是指通过遵循本领域公认的标准方法(例如,体细胞核移植、用重编程基因转导、化学诱导(参见delosetal.,cellresearch,23:1337-1338(2013);federationetal.,trendsincellbiology,24:179-187(2013))等)对成人体细胞、生殖细胞、多能细胞或其他细胞类型进行重编程而获得的多能细胞。该术语同时包含已建立的诱导的多能干细胞和以所述方式从原代组织获得的细胞。
如本文中所使用的,术语“非多能重编程细胞”或“多能的重编程细胞”表示通过用已知的重编程方法(诸如重编程基因的转导/表达和上述其他方法)对成人体细胞、生殖细胞、多能细胞或其他细胞类型进行重编程而获得的细胞。与诱导的多能细胞不同,“非多能重编程细胞”或“多能的重编程细胞”可能仅分化成一个或两个胚层,或者具有分化成特定胚层的偏好(例如,优先地分化成外胚层或内胚层细胞类型,但不能有效地分化成中胚层细胞的重编程细胞)。该术语同时包含已建立的诱导的多能细胞(例如sr1423)和以所述方式被重编程为多能的从原代组织获得的细胞。
如本文中所使用的,术语“重编程基因”表示本领域通常用于诱导分化的细胞的多能性(pluripotency)或多能性(multipotency)的已知基因和转录因子。示例性的重编程基因包含但不限于oct4(即oct-3/4或pou5f1);sox家族转录因子,诸如sox1、sox2、sox3、sox15和sox18;klf家族转录因子,诸如klf4、klf1、klf2和klf5;myc家族转录因子,诸如c-myc、n-myc和l-myc;nanog;lin28和glis1。本领域技术人员将理解,所公开的重编程基因以及本领域已知的其他重编程基因可以以各种方式组合,以便诱导多能性(pluripotency)或多能性(multipotency)。例如,yuetal.,science,318(5858):1917-20(2007)证明了lin28、oct4、sox2和nanog的组合可以用于生成ips细胞,而maekawaetal.,nature,474(7350):225-29(2011)证明了glis1、oct-3/4、sox2和klf4的组合可以用于生成ips细胞。
如本文中所使用的,术语“分化(differentiate)”或“分化(differentiation)”表示细胞类型从较不特异性的细胞到较特异性的细胞的变化。例如,任何已经离开多能状态并沿着发育途径向确定的生殖系发展的细胞都经历了分化。术语“分化的”是相对的术语,因此正在进行分化的细胞在其向成熟的功能细胞类型发展途径期间可以处于不同的阶段。因此,处于发育进程后期的细胞可以说比处于早期的细胞被更好地分化。
如本文中所使用的,如在本公开中使用的“分化诱导因子”是指在本发明的培养系统中用于诱导干细胞分化为胰岛谱系的分化细胞(包含前体细胞和终末分化细胞)的化合物的集合之一。对于化合物的作用方式没有限制。例如,药剂可以通过诱导或协助表型的改变、促进具有特定表型的细胞生长或延缓其他细胞的生长来辅助分化过程。其也可以充当其他因子的抑制剂,这些因子可能存在于培养基中,或者由细胞群体合成,否则会导致沿着途径直接分化为不想要的细胞类型。在“分化诱导因子”的类别内,本领域普通技术人员将理解,已知某些因子在整个分化过程中诱导某些步骤。例如,本领域普通技术人员将理解,“内胚层诱导因子”可以包含但不限于单独的或组合的激活素-a和/或渥曼青霉素。类似地,“内分泌诱导因子”可以包含但不限于单独的或组合的视黄酸和/或环巴胺。
如本文中所使用的,“长期”当用于与基于细胞的疗法/植入物中使用的外来治疗性细胞的存活和功能相关时,是指至少六个月或更长的时间。
如本文中所使用的,短语“治疗有效量”是指移植到受试者体内的包封的细胞的量,其提供移植细胞的特定药理作用,即产生胰岛素和调节血糖。需要强调的是,治疗有效量的包封的细胞并不总是能有效地治疗给定受试者的糖尿病,即使本领域技术人员认为这样的浓度是治疗有效量。仅为方便起见,下面提供了示例性的量。
本领域技术人员可以根据治疗特定受试者所需的标准实践来调整这样的量。治疗有效量可以根据植入的部位、受试者的年龄和体重和/或受试者的状况(包含受试者疾病的严重程度、受试者的饮食和/或受试者的整体健康状况)而变化。
如本文所使用的关于糖尿病的术语“治疗(treatment)”或“治疗(treating)”是指以下中的一种或多种:减少、改善或消除糖尿病的一种或多种症状或合并症,诸如高血糖和低血糖、心脏病、肾病、肝病、视网膜病、神经病、不愈合溃疡、牙周病;减少受试者对外源性胰岛素调节血糖的依赖,在不使用外源性胰岛素的情况下调节受试者的血糖;降低受试者的糖化血红蛋白或hba1c水平的百分比;和/或减少受试者对其他药物干预的依赖,诸如胰岛素增敏剂、葡萄糖排泄增强剂和本领域已知的其他治疗方式。
术语“个体”、“受试者”和“患者”在本文中可互换使用,并且是指任何个体哺乳动物受试者,例如非人灵长类、猪、牛、犬、猫、马或人。
ii.基于细胞的疗法的细胞的鉴定
常规的基于细胞的疗法的一个限制是不同的细胞具有不同的分化成成熟的细胞类型的倾向。例如,已经报道,起始细胞群体的表观遗传特征可以在重编程细胞中持续存在,这种现象被称为“表观遗传记忆”。结果,ips细胞和其他重编程细胞可能优先分化为属于其来源的同一胚层的细胞。因此,在一些实施例中,在所公开的用于生成胰岛素产生细胞的方法中使用的干细胞可以来源于成熟的内胚层细胞,其已经被重编程为多能的(pluripotent)或多能的(multipotent)干细胞。在一些实施例中,在所公开的方法中使用的干细胞可以来源于已经被重编程的人胰腺细胞。这样的供体胰腺细胞可以来自正在接受糖尿病治疗的受试者(即自体供体),或者来自未接受糖尿病治疗的人(即同种异体供体)。在一些实施例中,在所公开的方法中使用的干细胞可以是来自同意的健康成人供体胰腺的朗格汉斯岛的重编程原代细胞(参见,例如图1a)。
随着时间的推移,在细胞培养中生长的原代细胞可以变得同源并且丧失功能成熟特性,这可能是适应人工培养条件或遗传漂移的结果。因此,当原代细胞被用作起始细胞群体时,在例如细胞收获或分离的7天、6天、5天、4天、3天、2天或1天内对原代细胞重编程可能是有利的。例如,分离的原代细胞可以在细胞收获5天内用重编程基因转导。
本领域普通技术人员将理解,当使用重编程基因对原代细胞进行重编程时,存在可以使用的重编程基因的许多组合。在一些实施例中,原代细胞可以通过用oct4、sox2、klf4和l-myc转导而被重编程。在一些实施例中,原代细胞可以通过用oct4、sox2、klf4和c-myc转导而被重编程。在一些实施例中,原代细胞可以通过用lin28、oct4、sox2和nanog转导而被重编程。在一些实施例中,原代细胞可以通过用glis1、oct-3/4、sox2和klf4转导而被重编程。这些示例性的组合不旨在是限制性的,因为重编程基因的其他组合在本领域中是已知的,并且可以用于所公开的方法的目的。
在一些实施例中,在所公开的分化和治疗方法中使用的细胞可能具有向一个生殖系分化而不是向另一个生殖系分化的偏好。例如,在一些实施例中,原代细胞或干细胞(例如,sr1423)可以有效地分化为外胚层或内胚层谱系,但是基本上不能分化为中胚层谱系。这可以通过,例如,采用分化方案或试剂盒将干细胞推向特定的生殖系,但未能检测到生殖系标记物(例如,对于外胚层为otx2、对于有内胚层为sox17或对于中胚层为brachyury)来确定。
在一些实施例中,沿着内胚层谱系优先地分化的干细胞或原代细胞可以通过某些分子标记物来鉴定。例如,沿着内胚层谱系优先地分化的干细胞或原代细胞可以表达多能性的典型标记物(参见,例如,图3a)和正常的核型(参见,例如,图3b),然而即使表达了多能性的典型标记物,干细胞也可以是多能的或全能的,并且因此不符合多能性的公认标准。
沿内胚层谱系优先地分化的干细胞或原代细胞也可以具有独特的基因表达谱。例如,在一些实施例中,相对于对照水平或对照细胞,沿着内胚层谱系优先地分化的干细胞或原代细胞可以下调bhmt2、cox7a1和hspb2的表达。在一些实施例中,相对于对照水平或对照细胞,沿着内胚层谱系优先地分化的干细胞或原代细胞可以上调nap1l1的表达。此外,相对于对照细胞,沿着内胚层谱系优先地分化的细胞可以上调glis2、ccdc58和mtx3的表达,并且下调c7orf29的表达。表达水平可以通过本领域已知的任何手段(诸如qrt-pcr或微阵列分析)来确定,并且用作比较标准的对照细胞可以包含多能细胞,其不显示出向内胚层谱系的优先分化或基本上不能分化为中胚层谱系,诸如在nih登记中发现的标准胚胎干细胞系。虽然不受理论的束缚,但据信至少bhmt2和nap1l1在dna修饰中起作用,并且可能有助于表观遗传记忆。
在一些实施例中,bhmt2、cox7a1、hspb2和/或nap1l1的差异表达相对于多能细胞或者满足多能性的标准的干细胞可以是至少约1个对数、至少约2个对数或至少约3个对数增加(对于bhmt2、cox7a1和hspb2)或减少(对于nap1l1),所述多能细胞不显示出向内胚层谱系的优先分化并且基本上不能分化为中胚层谱系。
用所公开的表达谱鉴定干细胞表明分化成内胚层谱系并且然后分化成胰岛素产生细胞的偏好。对向特定生殖层的分化偏好的直接测试提高了生成倾向于特定命运的细胞系的效率,并且因此适合于基于细胞的疗法。
iii.用于生成胰岛素产生β细胞的方案
已经表明,哺乳动物干细胞(例如,ips细胞、胚胎干细胞和重编程细胞)可以通过模拟胚胎胰腺发育被分化为胰岛素产生β细胞。参见例如borowiakm.etal.curropincellbiol.,21:727-32(2009)。多能细胞分阶段分化为胰腺细胞。第一阶段是向内胚层谱系的分化。内胚层细胞进一步分化为多能胰腺祖细胞,其然后可以被分化为胰岛细胞,并且然后胰岛细胞可以被分化为β细胞,β细胞在葡萄糖暴露时产生胰岛素。目前的分化方案试图在体外模拟这些阶段;然而,这些分化方案的临床适应性的效率和成功差异很大。参见,例如pagliucafw,etal.cell,154(2):428-439(2014)。事实上,目前的分化方案必须经常根据其所应用的单个细胞进行调整。迄今为止,这阻碍了普遍的、标准化的分化方案的建立。事实上,来自当前分化方案的一些一致的指导可能抑制来自不同遗传背景的干细胞系的分化。本文公开的改进的方法解决了本领域中的这一缺陷。例如,在一些实施例中,与可能是细胞特异性的其他分化方案相比,所公开的方案可以从多种细胞来源稳健地生成胰岛素产生β细胞。
生成胰岛素产生细胞的常规手段包括培养和分化干细胞。对于所公开的方案,细胞来源可以包含但不限于人类胚胎干细胞、诱导的多能干细胞、非多能重编程细胞(例如,sr1423)和本领域中已知的其他常规细胞来源。
所公开的从干细胞生成胰岛素产生细胞的方法包括多步骤过程,其中首先开始内胚层分化,随后分化为胰腺谱系,随后分化为内分泌谱系,并且最后是胰岛素产生细胞的成熟过程。内胚层分化通常通过使干细胞与内胚层诱导剂诸如激活素-a或渥曼青霉素或其组合接触而开始。当已经达到足够数量的内胚层细胞时,细胞与内分泌诱导剂诸如视黄酸或环巴胺或其组合接触,以进一步将细胞分化为胰腺祖细胞。通过暴露于进一步的分化因子(这将在下面更详细地讨论),胰腺祖细胞可以成熟为胰岛素产生细胞,该细胞可以用于基于细胞的疗法以治疗糖尿病。
在一些实施例中,干细胞在包括内胚层诱导剂的第一培养基中培养。在一些实施例中,内胚层诱导剂至少包括激活素-a。在一些实施例中,内胚层诱导剂包括激活素-a和渥曼青霉素。在一些实施例中,所公开的方法不使用或包含使用wnt信号传导的激活剂,诸如chir-99021(一种wnt信号传导的小分子激活剂)和/或生长因子wnt3a。干细胞暴露于内胚层诱导剂导致细胞分化为内胚层细胞。
与获得胰岛素产生细胞的常规方法相反,在一些实施例中,所公开的分化方法不使用wnt信号传导的激活剂。与常规方法相反,在一些实施例中,所公开的分化方法使细胞长期暴露于视黄酸(ra)。与常规方法相反,在一些实施例中,所公开的分化方案使细胞长期暴露于环巴胺或化学类似物。与常规方法相反,在一些实施例中,所公开的分化方案不采用通过粘附培养物的分离和悬浮细胞的再聚集来产生三维悬浮培养物。
在一些实施例中,所公开的分化方法不将干细胞暴露于角质细胞生长因子(kgf)。长期以来,kfg被认为是促进胰腺祖细胞向β细胞分化的必要成分。参见,例如,movassatj.,diabetologia,46:822-829(2003)。据报道,kgf在体内促进β细胞的分化,特别是在胎儿胰腺组织中,其中胰管细胞在kgf和noggin的存在下形成。因此,在培养的内胚层分化的早期步骤期间应用kgf在先前方案的开发中是合理的假设。在一些实施例中,所公开的分化方法可以包含将干细胞暴露于kgf。
但是在本文中,本发明人意外地发现,为了使kgf有效,胰腺祖细胞必须已经通过视黄酸(ra)信号传导被建立。事实上,已经确定在没有其他因素的情况下,用kgf处理对β细胞分化产生了负面影响。同样,本公开表明,从早期内胚层阶段排除kgf并在晚期胰腺祖细胞阶段添加kgf提高了来自多种细胞来源的β细胞产量,并且导致产生几乎同源的胰岛素产生细胞的培养物。因此,在一个方面,本公开提供了用于获得胰岛素产生细胞的新的分化方法,其中干细胞在内胚层诱导剂之前或同时不与kgf接触。相反,细胞只在分化的后期与kgf接触。例如,可以在细胞与ra接触的同时或在随后的培养步骤中向细胞中引入kgf,但是在此之前不向细胞中引入kgf。
因此,在一些实施例中,正在分化的细胞仅在内胚层分化的晚期阶段(诸如在细胞已经分化成内分泌细胞之后)与kgf接触。在此阶段之前,干细胞不应与kgf接触。因此,用于将干细胞分化为内胚层细胞的培养基可以包括激活素-a和/或渥曼青霉素,但其不应包含kgf。在一些实施例中,用于将干细胞分化为内胚层细胞的培养基可以包括激活素-a、渥曼青霉素和/或wnt信号传导的激活剂(诸如chir-99021(一种wnt信号传导的小分子激活剂))和/或生长因子wnt3a以及其组合,但是其不应该包含kgf。
在一些实施例中,将干细胞分化为内胚层细胞的步骤可以包括在有或没有kgf的情况下在包括激活素-a、渥曼青霉素及其组合的培养基中培养细胞1-4天。例如,干细胞可以在这些内胚层诱导剂的存在下培养约1天、约2天、约3天或约4天,从而将干细胞分化成内胚层细胞。
在一些实施例中,干细胞在浓度为约1至约200ng/ml、约25至约175ng/ml、约50至约150ng/ml或约75至约125ng/ml的激活素a的存在下分化成内胚层细胞。例如,激活素a的浓度可以是约1ng/ml、约10ng/ml、约20ng/ml、约40ng/ml、约50ng/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml或约200ng/ml。
在一些实施例中,干细胞在浓度为约0.1至约2.0μm、约0.25至约1.75μm、约0.5至约1.5μm或约0.75至约1.25μm的渥曼青霉素的存在下分化成内胚层细胞。例如,渥曼青霉素的浓度可以是约0.1μm、约0.5μm、约1.0μm、约1.5μm或约2.0μm。
在一些实施例中,用于将内胚层细胞分化为内分泌细胞的培养基可以包括kgf,但是在一些实施例中,用于将内胚层细胞分化为内分泌细胞的培养基可以包括视黄酸、noggin或环巴胺及其组合而没有kgf。
在一些实施例中,将内胚层细胞分化为内分泌细胞的步骤可以包括在有或没有kgf的情况下在包括视黄酸、环巴胺和/或noggin的培养基中培养细胞1-5天。例如,可以在这些内分泌诱导剂的存在下将内胚层细胞培养约1天、约2天、约3天、约4天或约5天,从而将内胚层细胞分化为内分泌细胞。
在一些实施例中,细胞在浓度为约0.05μm、约0.1μm、约0.5μm、约1.0μm、约1.5μm或约2.0μm的视黄酸的存在下分化至少二十(20)天。
在一些实施例中,细胞在浓度为约0.05μm、约0.1μm、约0.25μm或约0.5μm的环丙胺的存在下分化至少二十(20)天。
在一些实施例中,细胞在浓度为约0.05μm、约0.1μm、约0.25μm或约0.5μm的环巴胺的化学类似物sant-1((4-苄基-哌嗪-1-基)-(3,5-二甲基-1-苯基-1h-吡唑-4-基亚甲基)-胺)的存在下分化。
在一些实施例中,在浓度为约1.0至约10.0μm、约2.0至约8.0μm或约3.0至约5.0μm的视黄酸的存在下,将内胚层细胞分化成内分泌细胞。例如,视黄酸的浓度可以为约1.0μm、约1.5μm、约2.0μm、约2.5μm、约3.0μm、约3.5μm、约4.0μm、约4.5μm、约5.0μm、约5.5μm、约6.0μm、约6.5μm、约7.0μm、约7.5μm、约8.0μm、约8.5μm、约9.0μm、约9.5μm或约10.0μm。
在一些实施例中,在浓度为约0.1至约1.0μm或约0.25至约0.75μm的环巴胺的存在下,将内胚层细胞分化成内分泌细胞。例如,环巴胺的浓度可以为约0.1μm、约0.2μm、约0.25μm、约0.3μm、约0.4μm、约0.45μm、约0.5μm、约0.55μm、约0.6μm、约0.7μm、约0.75μm、约0.8μm、约0.9μm或约1.0μm。
在一些实施例中,在浓度为约1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的noggin的存在下,将内胚层细胞分化成内分泌细胞。例如,noggin的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml或约100ng/ml。
在一些实施例中,在浓度为1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的kgf的存在下,将内胚层细胞分化成内分泌细胞。例如,kgf的浓度可以为约1ng/ml、约10ng/ml、约20ng/ml、约40ng/ml、约50ng/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml或约100ng/ml。在一些实施例中,直到细胞从内胚层细胞分化为内分泌细胞后,才将细胞暴露于kgf。
在一些实施例中,可以在附加生长因子和/或激素的存在下进一步培养内分泌细胞,以便将内分泌细胞分化成胰腺祖细胞,并且然后最终分化成胰岛素产生细胞。在一些实施例中,在暴露于内分泌诱导剂诸如视黄酸和/或环巴胺之后,可以在包括kgf的培养基中培养内分泌细胞,从而将内分泌细胞分化成胰腺祖细胞。在一些实施例中,在暴露于内分泌诱导剂诸如视黄酸和/或环巴胺之后,可以在包括kgf、noggin和/或表皮生长因子(egf)或其组合的培养基中培养内分泌细胞。
在一些实施例中,将内分泌细胞分化为胰腺祖细胞的步骤可以包括在包括kgf、noggin和/或表皮生长因子(egf)或其组合的培养基中培养细胞1-5天。在一些实施例中,将内分泌细胞分化为胰腺祖细胞的步骤可以包括在包括kgf、noggin和/或表皮生长因子(egf)或其组合并且进一步包括视黄酸和/或环巴胺(例如环巴胺kaad)的培养基中培养细胞1-5天。例如,内胚层细胞可以在这些药剂的存在下培养约1天、约2天、约3天、约4天或约5天,从而将内分泌细胞分化成胰腺祖细胞。
在一些实施例中,在浓度为1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的kgf的存在下,将内分泌细胞分化成胰腺祖细胞。例如,kgf的浓度可以为约1ng/ml、约10ng/ml、约20ng/ml、约40ng/ml、约50ng/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml或约100ng/ml。
在一些实施例中,在浓度为约1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的noggin的存在下,将内分泌细胞分化成胰腺祖细胞。例如,noggin的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml或约100ng/ml。
在一些实施例中,在浓度为约1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的egf的存在下,将内分泌细胞分化成胰腺祖细胞。例如,egf的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml或约100ng/ml。
在一些实施例中,在浓度为约1至约200ng/ml、约50至约200ng/ml或约75至约125ng/ml的视黄酸的存在下,将内分泌细胞分化成胰腺祖细胞。例如,视黄酸的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml、约105ng/ml、约110ng/ml、约115ng/ml、约120ng/ml、约125ng/ml、约130ng/ml、约135ng/ml、约140ng/ml、约145ng/ml、约150ng/ml、约155ng/ml、约160ng/ml、约165ng/ml、约170ng/ml、约175ng/ml、约180ng/ml、约185ng/ml、约190ng/ml、约195ng/ml或约200ng/ml。
在一些实施例中,在浓度为约0.1至约1.0μm或约0.25至约0.75μm的环巴胺的存在下,将内分泌细胞分化成胰腺祖细胞。例如,环巴胺的浓度可以为约0.1μm、约0.2μm、约0.25μm、约0.3μm、约0.4μm、约0.45μm、约0.5μm、约0.55μm、约0.6μm、约0.7μm、约0.75μm、约0.8μm、约0.9μm或约1.0μm。
在一些实施例中,可以在附加生长因子和/或激素的存在下进一步培养胰腺祖细胞,以便将胰腺祖细胞分化为胰腺谱系,并且最终分化为胰岛素产生细胞。在一些实施例中,可以在包括noggin、egf、γ-分泌酶抑制剂xxi、alk5iii和/或t3及其组合的培养基中培养胰腺祖细胞。在一些实施例中,可以在包括noggin、egf、γ-分泌酶抑制剂xxi、alk5iii和/或t3及其组合并且进一步包括视黄酸和/或环巴胺(例如环巴胺kaad)的培养基中培养胰腺祖细胞。在一些实施例中,在该分化阶段,在培养基中可以不包含t3。例如,胰腺祖细胞可以在这些药剂的存在下培养约1天、约2天、约3天、约4天或约5天,从而将胰腺祖细胞分化成胰腺谱系。
在一些实施例中,在浓度为约1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的noggin存在下进一步培养胰腺祖细胞。例如,noggin的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml或约100ng/ml。
在一些实施例中,在浓度为约1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的egf的存在下进一步培养胰腺祖细胞。例如,egf的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml或约100ng/ml。
在一些实施例中,在浓度为约0.1至约2.0μm、约0.25至约1.75μm、约0.5至约1.5μm或约0.75至约1.25μm的γ-分泌酶抑制剂xxi的存在下进一步培养胰腺祖细胞。例如,γ-分泌酶抑制剂xxi的浓度可以为约0.1μm、约0.5μm、约1.0μm、约1.5μm或约2.0μm。
在一些实施例中,在浓度为约1.0至约50.0μm、约5至约25μm或约10至约20μm的alk5iii的存在下进一步培养胰腺祖细胞。例如,alk5iii的浓度可以为约0.1μm、约1.0μm、约5.0μm、约10μm、约20μm、约30μm、约40μm或约50μm。
在一些实施例中,在浓度为约0.1至约2.0μm、约0.25至约1.75μm、约0.5至约1.5μm或约0.75至约1.25μm的t3的存在下进一步培养胰腺祖细胞。例如,t3的浓度可以为约0.1μm、约0.5μm、约1.0μm、约1.5μm或约2.0μm。
在一些实施例中,在浓度为约1至约200ng/ml、约50至约200ng/ml或约75至约125ng/ml的视黄酸的存在下进一步培养胰腺祖细胞。例如,视黄酸的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml、约105ng/ml、约110ng/ml、约115ng/ml、约120ng/ml、约125ng/ml、约130ng/ml、约135ng/ml、约140ng/ml、约145ng/ml、约150ng/ml、约155ng/ml、约160ng/ml、约165ng/ml、约170ng/ml、约175ng/ml、约180ng/ml、约185ng/ml、约190ng/ml、约195ng/ml或约200ng/ml。
在一些实施例中,在浓度为约0.1至约1.0μm或约0.25至约0.75μm的环巴胺的存在下进一步培养胰腺祖细胞。例如,环巴胺的浓度可以为约0.1μm、约0.2μm、约0.25μm、约0.3μm、约0.4μm、约0.45μm、约0.5μm、约0.55μm、约0.6μm、约0.7μm、约0.75μm、约0.8μm、约0.9μm或约1.0μm。
在一些实施例中,可以在附加生长因子和/或激素的存在下进一步培养胰腺细胞,以便最终将细胞分化为胰岛素产生细胞。在一些实施例中,可以在包括alk5iii、t3和/或视黄酸及其组合的培养基中培养胰腺祖细胞。在一些实施例中,可以在包括alk5iii、t3和/或视黄酸及其组合并且进一步包括环巴胺(例如环巴胺kaad)的培养基中培养胰腺祖细胞。在一些实施例中,在该分化阶段,在培养基中可以不包含t3。例如,胰腺祖细胞可以在这些药剂的存在下培养约1天、约2天、约3天、约4天或约5天,从而使胰腺细胞分化为胰岛素产生细胞类型。
在一些实施例中,在浓度为约1.0至约50.0μm、约5至约25μm或约10至约20μm的alk5iii的存在下进一步培养胰腺细胞。例如,alk5iii的浓度可以为约0.1μm、约1.0μm、约5.0μm、约10μm、约20μm、约30μm、约40μm或约50μm。
在一些实施例中,在浓度为约0.1至约2.0μm、约0.25至约1.75μm、约0.5至约1.5μm或约0.75至约1.25μm的t3的存在下进一步培养胰腺细胞。例如,t3的浓度可以为约0.1μm、约0.5μm、约1.0μm、约1.5μm或约2.0μm。
在一些实施例中,在浓度为约1至约200μm、约25至约175μm、约50至约150μm或约75至约125μm的视黄酸的存在下进一步培养胰腺细胞。例如,视黄酸的浓度可以为约1μm、约10μm、约20μm、约40μm、约50μm、约60μm、约70μm、约80μm、约90μm、约100μm、约110μm、约120μm、约130μm、约140μm、约150μm、约160μm、约170μm、约180μm、约190μm或约200μm。在一些实施例中,在浓度为约1至约200ng/ml、约50至约200ng/ml或约75至约125ng/ml的视黄酸的存在下进一步培养胰腺祖细胞。例如,视黄酸的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml、约105ng/ml、约110ng/ml、约115ng/ml、约120ng/ml、约125ng/ml、约130ng/ml、约135ng/ml、约140ng/ml、约145ng/ml、约150ng/ml、约155ng/ml、约160ng/ml、约165ng/ml、约170ng/ml、约175ng/ml、约180ng/ml、约185ng/ml、约190ng/ml、约195ng/ml或约200ng/ml。
在一些实施例中,在浓度为约0.1至约1.0μm或约0.25至约0.75μm的环巴胺的存在下进一步培养胰腺祖细胞。例如,环巴胺的浓度可以为约0.1μm、约0.2μm、约0.25μm、约0.3μm、约0.4μm、约0.45μm、约0.5μm、约0.55μm、约0.6μm、约0.7μm、约0.75μm、约0.8μm、约0.9μm或约1.0μm。
在一些实施例中,可以在附加生长因子和/或激素的存在下进一步培养胰腺细胞,以便最终将细胞分化为胰岛素产生细胞。在一些实施例中,可以在包括alk5iii、t3、烟酰胺、胰岛素样生长因子(igf)-i和/或bmp4及其组合的培养基中培养胰腺祖细胞。在一些实施例中,可以在包括alk5iii、t3、烟酰胺、胰岛素样生长因子(igf)-i和/或bmp4及其组合并且进一步包括视黄酸和/或环巴胺(例如,环巴胺kaad)的培养基中培养胰腺祖细胞。在一些实施例中,在分化的该阶段,在培养基中可以不包含t3和/或bmp4。例如,胰腺祖细胞可以在这些药剂的存在下培养约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天或约10天,从而将胰腺细胞分化为胰岛素产生细胞。
在一些实施例中,在浓度为约1.0至约50.0μm、约5至约25μm或约10至约20μm的alk5iii的存在下进一步培养胰腺细胞。例如,alk5iii的浓度可以为约0.1μm、约1.0μm、约5.0μm、约10μm、约20μm、约30μm、约40μm或约50μm。
在一些实施例中,在浓度为约0.1至约2.0μm、约0.25至约1.75μm、约0.5至约1.5μm或约0.75至约1.25μm的t3的存在下进一步培养胰腺细胞。例如,t3的浓度可以为约0.1μm、约0.5μm、约1.0μm、约1.5μm或约2.0μm。
在一些实施例中,在浓度为约1.0至约50.0mm、约5至约25mm或约10至约20mm的烟酰胺的存在下进一步培养胰腺细胞。例如,烟酰胺的浓度可以为约0.1mm、约1.0mm、约5.0mm、约10mm、约20mm、约30mm、约40mm或约50mm。
在一些实施例中,在浓度为约1至约100ng/ml、约25至约75ng/ml或约60至约70ng/ml的igf-i存在下进一步培养胰腺祖细胞。例如,igf-i的浓度可以约为1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml或约100ng/ml。
在一些实施例中,在浓度为约1.0至约50.0ng/ml、约5至约25ng/ml或约10至约20ng/ml的bmp4的存在下进一步培养胰腺细胞。例如,bmp4的浓度可以为约0.1ng/ml、约1.0ng/ml、约5.0ng/ml、约10ng/ml、约20ng/ml、约30ng/ml、约40ng/ml或约50ng/ml。
在一些实施例中,在浓度为约1至约200ng/ml、约50至约200ng/ml或约75至约125ng/ml的视黄酸的存在下进一步培养胰腺祖细胞。例如,视黄酸的浓度可以为约1ng/ml、约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml、约105ng/ml、约110ng/ml、约115ng/ml、约120ng/ml、约125ng/ml、约130ng/ml、约135ng/ml、约140ng/ml、约145ng/ml、约150ng/ml、约155ng/ml、约160ng/ml、约165ng/ml、约170ng/ml、约175ng/ml、约180ng/ml、约185ng/ml、约190ng/ml、约195ng/ml或约200ng/ml。
在一些实施例中,在浓度为约0.1至约1.0μm或约0.25至约0.75μm的环巴胺的存在下进一步培养胰腺祖细胞。例如,环巴胺的浓度可以为约0.1μm、约0.2μm、约0.25μm、约0.3μm、约0.4μm、约0.45μm、约0.5μm、约0.55μm、约0.6μm、约0.7μm、约0.75μm、约0.8μm、约0.9μm或约1.0μm。
在一些实施例中,细胞在由玻连蛋白和/或层粘连蛋白和/或胶原蛋白组成的粘性基底上分化。在一些实施例中,自发和自然地形成三维结构的细胞被收集并转移到悬浮培养物中。
在一些实施例中,细胞被包封在水凝胶中,并且当细胞被包封在水凝胶中时,分化可以进一步进行。在这些实施例中,分化方案与未被包封的细胞相同(即,分化方案可以包括与所公开的分化方法相同的试剂和孵育时间)。也就是说,即使在被包封在水凝胶中之后,细胞仍然可以在所公开的培养基中孵育以产生胰岛素产生细胞。在一些实施例中,包封细胞的水凝胶可以包括或由海藻酸钠组成。在一些实施例中,细胞在分化的第12天左右被包封在水凝胶中。例如,细胞可以在分化的第8天、第9天、第10天、第11天、第12天、第13天、第14天或第15天被包封在水凝胶中。因此,在细胞已经在包括noggin和/或egf的培养基(即如本文所公开的“第三培养基”)中孵育后,细胞可以被包封在水凝胶中。在一些实施例中,在第14天左右、第16天左右、第18天左右、第20天左右、第22天左右、第24天左右、第26天左右或第28天左右的分化的后期将这些细胞包封在水凝胶中。
在一些实施例中,在所公开的分化方法中使用的干细胞来自胰腺原代组织。在一些实施例中,在所公开的分化方法中使用的干细胞是胚胎干细胞。在一些实施例中,在所公开的分化方法中使用的干细胞是诱导的多能干细胞。在一些实施例中,在所公开的分化方法中使用的干细胞是非多能重编程细胞。在一些实施例中,干细胞是人类干细胞。
为了本公开的目的,可能期望通过在细胞中表达重编程基因而不将重编程基因掺入到细胞的基因组中来对细胞进行重编程。本领域普通技术人员将认识到,转导的基因可以在细胞中表达,而无需使用例如附加体表达质粒将这些基因掺入到基因组中。重编程基因可以在至少1个、至少2个、至少3个或至少4个或更多个附加体表达质粒上表达。如上所述,多个重编程基因在本领域中是已知的,并且可以用于所公开方法的目的,但是在一些实施例中,重编程基因包括oct4、sox2、klf4和l-myc。
在一些实施例中,将细胞从干细胞分化为胰岛素产生细胞所需的总培养时间可以是约30天或更少。例如,细胞可以培养约30天、约29天、约28天、约27天、约26天、约25天或更少。
本领域技术人员还将理解,每个分化步骤中的总培养时间可以变化。因此,在一些实施例中,本公开提供了一种产生胰岛素分泌胰腺细胞的方法,其包括(a)在包括激活素-a和渥曼青霉素的第一培养基中培养人类干细胞,其中人类细胞在分化为内胚层细胞之前没有暴露于wnt3a,并且任选地没有暴露于角质细胞生长因子(kgf),从而将人类干细胞分化为内胚层细胞;(b)在包括视黄酸和环巴胺并且任选地包括kgf的第二培养基中培养来自(a)的内胚层细胞,从而将内胚层细胞分化为内分泌细胞;(c)在包括kgf的第三培养基中培养来自(b)的内分泌细胞,从而将内分泌细胞分化为胰腺祖细胞;(d)在包括noggin、egf、γ-分泌酶抑制剂xxi、alk5iii和t3的第四培养基中培养来自(c)的胰腺祖细胞;(e)在包括alk5iii、t3和视黄酸的第五培养基中培养来自(d)的细胞;和(f)在包括alk5iii、t3、烟酰胺、胰岛素样生长因子(igf)-i和bmp4的第六培养基中培养。
在一些实施例中,本公开提供了一种产生胰岛素分泌胰腺细胞的方法,其包括(a)在包括激活素-a和渥曼青霉素的第一培养基中培养人类干细胞,其中人类细胞在分化为内胚层细胞之前没有暴露于wnt3a,并且任选地没有暴露于角质细胞生长因子(kgf),从而将人类干细胞分化为内胚层细胞;(b)在包括视黄酸、noggin和环巴胺并且任选地包括kgf的第二培养基中培养来自(a)的内胚层细胞,从而将内胚层细胞分化为内分泌细胞;(c)在包括kgf、noggin、视黄酸和环巴胺的第三培养基中培养来自(b)的内分泌细胞,从而将内分泌细胞分化为胰腺祖细胞;(d)在包括noggin、egf、γ-分泌酶抑制剂xii、alk5iii、视黄酸和环巴胺的第四培养基中培养来自(c)的胰腺祖细胞;(e)在包括alk5iii、t3、视黄酸和环巴胺的第五培养基中培养来自(d)的细胞;和(f)在包括alk5iii、烟酰胺、igf-i、视黄酸和环巴胺的第六培养基中培养。
在一些实施例中,第六培养基可以包括胰高血糖素,其在降低共表达胰岛素和胰高血糖素的内分泌细胞的比例方面具有有益效果。胰高血糖素的浓度可以是例如约40ng/l、约70ng/l、约110ng/l或约140ng/l。
在一些实施例中,步骤(a)-(f)的总培养时间可以是30天或更少。例如,细胞可以培养约30天、约29天、约28天、约27天、约26天、约25天或更少。在一些实施例中,步骤(a)可以包括培养的第1-3天,步骤(b)可以包括培养的第4-7天,步骤(c)可以包括培养的第8-11天,步骤(d)可以包括培养的第12-15天,步骤(e)可以包括培养的第16-19天,并且步骤(f)可以包括培养的第20-28天。因此,在一些实施例中,步骤(a)可以包括1-4天的培养,步骤(b)可以包括1-5天的培养,步骤(c)可以包括1-5天的培养,步骤(d)可以包括1-5天的培养,步骤(e)可以包括1-5天的培养,并且步骤(f)可以包括1-10天的培养。
如本文所公开的,在较早的内胚层阶段将分化细胞暴露于kgf可能阻碍胰岛素产生β细胞的生成,并且因此添加该组分是任选的,并且可以根据精确的方案而变化。为了制备胰岛素产生细胞的目的,因此在一些实施例中,将kgf从内胚层分化的早期阶段或者直到至少其中正在分化的细胞已经暴露于视黄酸的培养时间排除可能是有益的。
在一些实施例中,本公开提供了一种产生胰岛素分泌胰腺细胞的方法,其包括(a)在包括激活素-a和渥曼青霉素的第一培养基中培养人类干细胞,其中人类细胞没有暴露于wnt3a,从而将人类干细胞分化为内胚层细胞;(b)在随后的培养步骤期间将细胞暴露于视黄酸至少二十(20)天;(c)在随后的培养步骤期间将细胞暴露于环巴胺或化学类似物至少二十(20)天;(d)在粘性基底上开始细胞培养;和(e)将自然和自发地形成三维结构的细胞转移到悬浮培养物中;和任选地(f)在胰高血糖素的存在下培养细胞。
在一些实施例中,本公开提供了产生哺乳动物胰岛素分泌细胞的方法,其包括:粘附培养哺乳动物干细胞,从而允许哺乳动物干细胞自发地形成三维结构;和悬浮培养三维结构;其中培养步骤包括至少20天暴露于视黄酸和环巴胺,并且不包括将三维结构的干细胞暴露于wnt3a。
在一些实施例中,本公开提供了产生胰岛素分泌细胞的方法,其包括:在包括激活素-a和渥曼青霉素的第一培养基中,在粘性基底上培养哺乳动物干细胞,其中哺乳动物干细胞不暴露于wnt3a;在至少一种包括视黄酸和环巴胺的附加培养基中进一步培养细胞;以及当细胞形成三维细胞结构时,将细胞转移到悬浮培养物中;其中细胞暴露于视黄酸和环巴胺至少20天。
在一些实施例中,可能优选的是选择优先地分化或倾向于分化为内胚层谱系的起始干细胞或非多能祖细胞。与传统方法相比,这可以允许更简单的分化,并且可以获得更纯和更成熟的胰岛素分泌细胞的培养物。
为了目前公开的方法的目的,已经确定,当细胞最初在粘附中生长或者培养在粘性基底(例如,带正电的表面或者包被有玻连蛋白或基质凝胶的表面)上开始时,胰岛素分泌细胞的产生是最佳的,因此允许细胞自然和自发地形成三维结构(例如,细胞的聚集体)。这些由粘附的细胞组成的三维结构然后可以在所公开的方法的持续时间内悬浮培养。
因此,在一些实施例中,起始干细胞群体粘附生长,而培养的后期悬浮进行。为了本公开的目的,短语“粘附生长”或“粘附培养”是指标准细胞培养,其中细胞粘附到培养皿的表面。在一些情况下,培养皿可以包被有基底以促进粘附,并且在一些情况下,培养皿可以被给予净正电荷以促进粘附。一般来说,干细胞(诸如ips细胞)的培养需要粘性基底,并且各种促进粘附的基底在本领域中是已知的。例如,一种玻连蛋白或基质凝胶可以应用于细胞培养瓶以促进粘附,但是基质凝胶是从小鼠肉瘤细胞中收获的,并且因此不优选用于临床应用。在一些实施例中,分化是通过用内胚层诱导培养基培养起始干细胞群开始的,并且粘附生长。随着分化的进行,在基底/板上形成3d结构(例如,分化的/正在分化的细胞的聚集体)可以逐渐发生。到约第15天,3d结构开始从板上脱离,并且这些3d结构可以被转移到没有包被有粘性基底(例如,玻连蛋白)的血管中,使得3d结构在自由漂浮的悬浮液中培养。从粘附培养到悬浮培养的这种转变是新颖的,并且允许更自然地分化成胰岛素分泌细胞。
还已经确定,与常规实践相反,用于开始培养的干细胞不需要与wnt3a接触以便促进分化。事实上,在所公开的方法中,wnt3a在任何时候都不是必需的。
最后,已经确定,即使在产生胰岛素分泌细胞的整个过程中交换各种分化培养基,当细胞与至少一定浓度的视黄酸和环巴胺保持接触至少约20天时,分化似乎是最有效的。例如,在一些实施例中,细胞优选地暴露于视黄酸和环巴胺至少约16天、至少约17天、至少约18天、至少约19天、至少约20天、至少约21天、至少约22天、至少约23天、至少约24天、至少约25天、至少约26天、至少约27天或至少约28天。在一些实施例中,这种持续暴露于视黄酸和环巴胺可以在起始干细胞群体已经被迫向内胚层谱系转移后(例如,在起始干细胞群体在激活素a和渥曼青霉素的存在下已经培养约1天、约2天、约3天、约4天或约5天后)开始。
本领域技术人员将理解,所公开的方法通常可以应用于哺乳动物干细胞,诸如人类干细胞和非人灵长类干细胞。然而,附加哺乳动物细胞(诸如猪、牛、马、羊、狗或猫的干细胞)也可以根据所公开的方法进行分化。此外,本领域技术人员将认识到,所公开的方法可以采用各种形式的细胞培养物,包含例如贴壁培养物和/或悬浮培养物。
所公开的用于生成胰岛素产生细胞的方案提高了来自人胚胎干细胞和重编程胰腺组织两者的胰岛素产生β细胞的产量。与产生胰岛素产生细胞的常规方法相反,本文公开的方案产生了几乎同源的胰岛素产生细胞的群体。产生同源细胞群体不仅对治疗效果是重要的,而且对安全性也是重要的,因为干细胞在移植时可以形成畸胎瘤,并且具有致瘤潜力。由所公开的分化方法提供的高度分化和均一性意味着更少的具有致瘤潜力的细胞,这在开发有用的细胞疗法中是必不可少的。
在采用所公开的分化方法之前,可以根据本申请第ii节中公开的方法鉴定优先地分化成内胚层细胞的干细胞。这可以提高分化过程的整体效率以及增加胰岛素产生细胞的产量。
iv.基于细胞的组合物和治疗方法
本文公开的胰岛素产生细胞可以用于治疗需要其的受试者的糖尿病。在一些实施例中,需要治疗的受试者是哺乳动物,例如,患有胰岛素依赖型糖尿病的人类受试者。
本公开提供了用于产生基本同源的胰岛素产生细胞的群体的方法,该细胞可以被掺入到用于治疗糖尿病的基于细胞的组合物中。因此,本文提供了用于治疗糖尿病的基于细胞的组合物,其包括替代胰腺细胞的群体和用于植入到需要其的人类受试者中的合适的载体,其中至少66%的细胞是胰岛素产生胰腺细胞。在一些实施例中,基于细胞的组合物可以包括至少约67%、至少约68%、至少约69%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%的胰岛素产生胰腺细胞。
用于植入治疗性细胞的合适的载体在本领域中是已知的,并且可以包含但不限于水凝胶、天然和合成聚合物支架、细胞外基质(其可以包括例如胶原蛋白、层粘连蛋白、纤连蛋白等)、透明质酸、仿生支架、聚丙交酯(pla)支架、聚乙交酯(pga)支架、pla-pga共聚物(plga)支架以及羟基磷灰石支架和大孔冷冻凝胶。在一些实施例中,适合于移植的载体可以包括将胰岛素产生细胞包封在大胶囊中,诸如包括海藻酸盐、硫酸纤维素、葡甘露聚糖或其组合的大胶囊。
在一些实施例中,至少66%的替代胰腺细胞表达neurod1。在一些实施例中,至少约67%、至少约68%、至少约69%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%的替代胰腺细胞表达neurod1。
在一些实施例中,至少68%的替代胰腺细胞表达nkx6.1。在一些实施例中,至少约67%、至少约68%、至少约69%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%的替代胰腺细胞表达nkx6.1。
用于治疗糖尿病的基于细胞的组合物可以根据本文公开的方法制备。例如,基于细胞的组合物的胰岛素产生胰腺细胞可以例如根据以下方法获得,所述方法包括:(a)在包括内胚层诱导因子的第一培养基中培养人类干细胞的群体,从而将人类干细胞分化为内胚层细胞,其中在分化为内胚层细胞之前,人类干细胞没有暴露于角质细胞生长因子(kgf);(b)在包括内分泌诱导因子的第二培养基中培养来自(a)的内胚层细胞,从而将内胚层细胞分化为内分泌细胞;(c)在包括kgf的第三培养基中培养来自(b)的内分泌细胞,从而将内分泌细胞分化为胰腺祖细胞;和(d)在包括甲状腺激素的第四培养基中培养来自(c)的胰腺祖细胞,从而将胰腺祖细胞分化为胰岛素产生胰腺细胞。
在一些实施例中,基于细胞的组合物的胰岛素产生胰腺细胞可以例如根据以下方法获得,所述方法包括:(a)在包括内胚层诱导因子的第一培养基中培养人类干细胞的群体,从而将人类干细胞分化为内胚层细胞,其中人类干细胞没有暴露于wnt3a;(b)在随后的培养步骤期间将细胞暴露于视黄酸至少二十(20)天;(c)在随后的培养步骤期间将细胞暴露于环巴胺或化学类似物至少二十(20)天;(d)在粘性基底上开始细胞培养;和(e)将自然和自发地形成三维结构的细胞转移到悬浮培养物中。
在一些实施例中,基于细胞的组合物的胰岛素产生胰腺细胞可以例如根据以下方法获得,所述方法包括:在包括内胚层诱导因子的第一培养基中,在粘性基底上培养人类干细胞的群体,其中哺乳动物干细胞不暴露于wnt3a;以及在包括视黄酸和环巴胺的至少一种附加培养基中进一步悬浮培养细胞,其中细胞暴露于视黄酸和环巴胺至少20天。在一些实施例中,内胚层诱导因子包括激活素-a和/或渥曼青霉素。在一些实施例中,所述至少一种附加培养基可以包括kgf、noggin、egf和/或甲状腺激素(诸如t3)。
各种内胚层诱导因子在本领域中是已知的,包含但不限于激活素-a和渥曼青霉素。同样,各种内分泌诱导因子在本领域中是已知的,包含但不限于视黄酸和环巴胺。
在一些实施例中,第二培养基包括kgf,而在一些实施例中,细胞直到步骤(b)之后才与kgf接触。在一些实施例中,在步骤(a)的培养基中可以包含kgf。
在一些实施例中,第三培养基包括noggin和/或表皮生长因子(egf)。在一些实施例中,第三培养基包括视黄酸和/或环巴胺。在一些实施例中,甲状腺激素可以是t3。
用于制备所公开的基于细胞的组合物的干细胞的来源没有特别限制;然而,如本文所公开的,选择优先地分化成内胚层谱系的细胞/细胞系可以增加胰岛素产生细胞的产量并提高分化效率。因此,在一些实施例中,在用于制备基于细胞的组合物的所公开的分化方法中使用的干细胞来源于胰腺原代组织。在一些实施例中,在所公开的分化方法中使用的干细胞是胚胎干细胞。在一些实施例中,在所公开的分化方法中使用的干细胞是诱导的多能干细胞。在一些实施例中,在所公开的分化方法中使用的干细胞是非多能重编程细胞。在一些实施例中,干细胞是人类干细胞。
为了本公开的目的,当制备用于掺入到用于治疗糖尿病的基于细胞的组合物中的胰岛素产生细胞时,可能期望通过在细胞中表达重编程基因而不将重编程基因掺入到细胞的基因组中来重编程细胞。本领域普通技术人员将认识到,转导的基因可以在细胞中表达,而无需使用例如附加体表达质粒将这些基因掺入到基因组中。重编程基因可以在至少1个、至少2个、至少3个或至少4个或更多个附加体表达质粒上表达。如上所述,多个重编程基因在本领域中是已知的,并且可以用于所公开方法的目的,但是在一些实施例中,重编程基因包括oct4、sox2、klf4和l-myc。
在一些实施例中,基于细胞的组合物被包封在例如微胶囊或大胶囊中。
本公开还提供了使用所公开的基于细胞的组合物治疗糖尿病的方法。治疗糖尿病的方法通常包括将治疗有效量的包封的胰岛素产生细胞植入到需要其的受试者体内。治疗有效量的胰岛素产生细胞可以是基于细胞的组合物的形式,例如微包封的或大包封的替代胰腺细胞的群体。
因此,在一些实施例中,所述方法包括将治疗有效量的包封在大胶囊中的胰岛素产生细胞植入到需要其的个体中。对大胶囊的组成没有特别限制,并且本领域技术人员将理解,各种材料可以用于包封胰岛素产生细胞。例如,胶囊可以包括海藻酸盐、硫酸纤维素、葡甘露聚糖或其组合。在一些实施例中,大胶囊可以包括至少一个屏障,其中外屏障由硫酸纤维素和葡甘露聚糖组成。在一些实施例中,大胶囊可以形成为圆柱形管的形状,其包括海藻酸盐的内胶囊和硫酸纤维素和葡甘露聚糖的外胶囊。
在一些实施例中,所述方法包括将治疗有效量的包封在所公开的大胶囊中的胰岛素产生细胞植入到需要其的个体中,约每年一次、每两年一次、每三年一次、每四年一次、每五年一次或更多。在一些实施例中,植入的细胞将在植入后存活至少六个月。因此,在一些实施例中,受试者可能只需要一个植入物。在一些实施例中,基于细胞的组合物可能需要每6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月或18个月更换一次,每1年、2年、3年、4年或5年或更长时间更换一次,或者直到受试者具有复发性高血糖症或恢复到糖尿病状态。
在一些实施例中,基于细胞的组合物可以被植入到受试者的较大的网膜中。较大的网膜(也被称为大网膜(greatomentum)、大网膜(omentummajus)、胃结肠网膜、大网膜(epiploon)或大网膜(caul))是内脏腹膜的大围裙状皱襞,其从胃垂下,并从胃的较大曲度向后延伸且上扬至横结肠,然后到达后腹壁。因此,基于细胞的组合物可以被植入到由网膜手术形成的袋中。
在一些实施例中,将基于细胞的组合物植入到腹膜腔中。在一些实施例中,将基于细胞的组合物植入到腹膜腔中并锚定到网膜上。在一些实施例中,将基于细胞的组合物植入到网膜袋中。
胰岛素产生细胞的示例性的剂量可以根据待治疗的个体的体型和健康状况而变化。例如,在一些实施例中,包封在所公开的基于细胞的组合物中的细胞的示例性的植入物可以包括每千克体重500万个细胞至1000万个细胞。
此外,除了包封的治疗性细胞之外,所公开的治疗方法还可以另外包括第二治疗剂的给药。例如,在一些实施例中,附加治疗化合物可以包含但不限于胰岛素注射剂、二甲双胍、磺酰脲类、格列奈类、噻唑烷二酮类、dpp-4抑制剂、glp-1受体激动剂和sglt2抑制剂。
包括植入包括胰岛素产生细胞的基于细胞的组合物的特定治疗方案可以根据其是否将改善给定患者的结果来评估,这意味着其将有助于稳定或正常化受试者的血糖水平或降低与糖尿病相关的症状或合并症的风险或发生,包含但不限于低血糖发作、糖化血红蛋白水平(hba1c水平)的升高、心脏病、视网膜病、神经病、肾病、肝病、牙周病和不愈合溃疡。在一些实施例中,基于细胞的组合物将被包封在例如包括海藻酸盐、硫酸纤维素、葡甘露聚糖或其组合的胶囊中。
因此,为了本公开的目的,如果获得一个或多个有益或期望的结果(包含期望的临床结果),则受试者被治疗。例如,有益或期望的临床结果包含但不限于以下中的一种或多种:减少由糖尿病引起的一种或多种症状,提高患有糖尿病的患者的生活质量,减少治疗糖尿病所需的其他药物的剂量,延迟或预防与糖尿病相关的并发症,和/或延长个体的生存期。
此外,虽然所述方法的受试者通常是患有糖尿病的受试者,但是患者的年龄不受限制。所公开的方法可用于治疗跨所有年龄组和群组的糖尿病。因此,在一些实施例中,受试者可以是小儿受试者,而在其他实施例中,受试者可以是成人受试者。
本领域技术人员将容易地理解,本公开很好地适于实现所述目的并获得所提及的目的和优点以及其中固有的目的和优点。本领域技术人员将想到其中的修改和其他用途。这些修改包含在本公开的精神内。给出以下实例来说明本发明。然而,应该理解,本发明不限于这些实例的具体条件或细节。
实例
实例1-材料和方法
胰岛收获:从登记的器官捐赠中获得适当同意和匿名的整个人胰腺。用胶原酶p(roche#1129002001)注射小叶,且胶原p重悬于1.4mg/ml的胰岛分离溶液(含有0.35g的nahco3/l和1%人血清白蛋白(rochea9731)汉克斯平衡盐溶液(invitrogen#14065-056))中。将膨胀的小叶在37℃在温和的搅拌下孵育15-25分钟。将消化物用冷的胰岛分离溶液稀释,并且以1500rpm离心5分钟。丢弃上清液,并在剧烈研磨下在冷的胰岛分离溶液中洗涤沉淀。将该溶液通过420μm筛(bellcoglass,inc,cat#1985-00040)过滤并离心。将沉淀重悬于1.100g/ml的histopaque(sigma#10771,sigma#11191)中,并以1200rpm离心30分钟。收集上清液,在胰岛分离溶液中稀释2倍,并以1500rpm离心5分钟。将沉淀在胰岛分离溶液中冲洗,离心,并在37℃和5%co2的加湿培养箱中在e8培养基(gibco#a1517001)中培养。第二天,将胰岛以1500rpm离心5分钟,并且重悬于未稀释的trypleselect10x(lifetechnologies#a12177)中,并在37℃孵育10分钟。将分离的胰岛在e8培养基中稀释,离心,重悬于补充有100ng/ml的氢化可的松(sigma#h0135)、1u/ml的凝血酶(sigma#t9326)和100ng/ml的egf(sigmae5036)的e8中。按照制造商的说明,将细胞在包被有玻连蛋白(lifetechnologies#a14700)的培养皿上培养。
重编程:将细胞用pbs(gibco#14190144)冲洗,并在trypleselect1x中在37℃孵育5分钟。用e8培养基终止消化,并将细胞以1000rpm离心5分钟。将细胞以2e6个细胞/200μl重悬浮于btx电穿孔溶液(vwr#89130-542)中,并加入到含有20μg的重编程质粒的电穿孔比色皿中。在内部构建了2个重编程质粒,其包括ebna附加体表达序列、氨苄青霉素抗性以及在cmv启动子控制下的重编程基因oct4、sox2、klf4和l-myc。使用基因脉冲器xl(bio-rad)对电穿孔比色皿进行脉冲化。将细胞转移到补充有100ng/ml的bfgf(lifetechnologies#phg6015)和1μm的氢化可的松的e6培养基(lifetechnologies#a1516401)中的玻连蛋白包被的培养皿中。将细胞在具有5%co2的加湿培养箱中在37℃培养。在24小时后,用补充有100ng/ml的bfgf、和1μm的氢化可的松和100μm的丁酸钠(sigma#p1269)的e6更换培养基,并且每隔一天更换一次。手动分离干细胞集落,并转移至e8培养基中玻连蛋白包被的培养皿中。在暴露于内胚层诱导剂激活素-a和渥曼青霉素4天后,初步筛选了由两个供体的原代组织生成的73个系表达内胚层标记物的能力。选择具有最高比例的表达内胚层标记物的细胞的培养物。经过第一个筛选的二十四个细胞系随后在暴露于12天的胰腺分化方案后筛选表达胰腺标记物的能力。始终生成最高比例的胰腺细胞的细胞系被命名为sr1423,被储存并用于所有后续实验。
细胞系表征:sr1423表达多能细胞典型的标记物(图3a)并且具有正常的核型(图3b)。sr1423的dnastr谱证实其是与供体组织匹配的单个细胞系(图3c)。此外,sr1423以多能细胞系的典型速率生长(图3d)。观察到来自同一供体的其他诱导的多能干细胞(在下文中被称为“ipsc”)系和重编程实验也显示出优先分化。ipsc系“b”也很好地分化为内胚层,而系“c”和“d”对内胚层谱系的分化没有偏爱(数据未显示)。为了确定在基因表达谱与ipsc无法分化为特定谱系之间是否存在相关性,对sr1423以及系b、c和d的表达基因进行了全基因组微阵列分析。参见,例如koyanagi-aoim.etal.proc.natl.acad.sci.110(2013)。基于至少log2的倍数变化表达的无监督的分级聚类分析表明,sr1423与细胞系b聚在一起,但不与细胞系c和d聚在一起。这确定了与内胚层谱系稳健且优先分化相关的基因表达模式(图4a)。在10个差异最大的表达基因中,bhmt2、cox7a1、hspb2和nap1l1与使用qrt-pcr度量形成内胚层的能力显著相关(图4b)。
干细胞培养:未分化的ips细胞按照制造商的说明保存在包被有玻连蛋白xf(stemcelltechnologies#07180)或17μg/cm2的geltrex(lifetechnologies#a1413301)的6孔组织培养板(greinerbio-one#657160)中,并且每天用e8培养基喂养。每3-5天用0.5mmedta(lifetechnologies#15575)以75-85%的融合度传代培养物,并以7x103个细胞/cm2接种。
分化:将第一批sr1423细胞以2.3x104个细胞/cm2接种,并允许生长18-24小时。然后用dpbs(-mg2+/-ca2+)洗涤细胞,并按照28天的时间表更换培养基,该时间表包括如下6种培养基配方:第1天、第2天、第3天:dmem/f-12培养基(lifetechnologies#10565018)、0.2%的hsa、1xb27补充剂(lifetechnologies#a1486701)、100ng/ml的激活素a和1μm的渥曼青霉素;第4天、第5天、第6天、第7天:dmem(lifetechnologies#10567014)、0.2%的hsa、1xb27补充剂、4μm的视黄酸、50ng/ml的kgf、50ng/ml的noggin、0.25μm的环巴胺kaad;第8天、第10天:dmem、0.2%的hsa、1xb27补充剂、50ng/ml的kgf、50ng/ml的noggin、50ng/ml的egf;第12天、第14天:dmem、0.2%的hsa、1xb27补充剂、50ng/ml的noggin、50ng/ml的egf、1μm的γ-分泌酶抑制剂xxi、10μm的alk5iii、1μm的t3;第16天、第18天:dmem、0.2%的hsa、1xb27补充剂、10μm的alk5iii、1μm的t3、100nm的视黄酸;第20天、第22天、第24天、第26天、第28天:cmrl(lifetechnologies#11530037)、0.2%的hsa、1xb27补充剂、1xglutamax(lifetechnologies#35050061)、10μm的alk5iii、1μm的t3、10mm的烟酰胺、50ng/ml的igf-i、10ng/ml的bmp4。为了通过添加第二阶段使用kgf进行分化,将在第4天、第5天、第6天具有dmem、0.2%的bsa、1xb27补充剂和50ng/ml的kgf的培养基插入到时间表中,在三天后转移剩余阶段。该实施例的方案在分化的第28天生成了高纯度的内分泌胰腺细胞的群体(图5a)。代表性图像的量化揭示了由细胞组成的群体,其中68%表达内分泌胰腺标记物nkx6.1(图5a,在5e中定量),66.8%表达晚期胰腺标记物neurod1(图5b,在5e中定量),并且66.5%表达胰岛素(图5d,在5e中定量)。从正在分化的内胚层细胞中排除kgf的这种方法提高了胰腺衍生的干细胞和已建立的人类胚胎干细胞两者的产量。图6。
如上所述,第二批sr1423细胞以6.3x104接种,并且允许生长18-24小时。然后用dpbs(-mg2+/-ca2+)洗涤细胞,并按照28天的时间表更换培养基,该时间表包括如下6种培养基配方:第1天、第2天、第3天:dmem/f-12培养基(lifetechnologies#10565018)、0.2%的hsa、1xb27补充剂(lifetechnologies#a1486701)、100ng/ml的激活素a(peprotech#af-120-14e)和1μm的渥曼青霉素(sigma#w3144);第4天、第5天、第6天、第7天:dmem(lifetechnologies#10567014)、0.2%的hsa、1xb27补充剂、2μm的视黄酸(sigma#r2625)、50ng/ml的kgf(peprotech#af-100-19)、50ng/ml的noggin(peprotech#120-10c)、0.25μm的环巴胺kaad(millipore#239804);第8天、第10天:dmem、0.2%的hsa、1xb27补充剂、50ng/ml的kgf、50ng/ml的noggin、50ng/ml的egf(peprotech#af-100-15)、100nm的视黄酸(sigma#r2625)、0.25μm的环巴胺kaad(millipore#239804);第12天、第14天:dmem、0.2%的hsa、1xb27补充剂、50ng/ml的noggin、50ng/ml的egf、1μm的γ-分泌酶抑制剂xxi(millipore#565790)、10μm的alk5iii(axxora,#alx-270-445)、100nm的视黄酸(sigma#r2625)、0.25μm的环巴胺kaad(millipore#239804);第16天、第18天:dmem、0.2%的hsa、1xb27补充剂、10μm的alk5iii、100nm的视黄酸、0.25μm的环巴胺kaad(millipore#239804);第20天、第22天、第24天、第26天、第28天:cmrl(lifetechnologies#11530037)、0.2%的hsa、1xb27补充剂、1xglutamax(lifetechnologies#35050061)、10μm的alk5iii、10mm的烟酰胺(sigma#n0636)、50ng/ml的igf-i(peprotech#100-11)、100nm的视黄酸(sigma#r2625)、0.25μm的环巴胺kaad(millipore#239804)和胰高血糖素(sigma#g2044)。
测试葡萄糖刺激的胰岛素分泌:在暴露于葡萄糖溶液之前,将细胞在具有1g/dl的葡萄糖、10μm的alk5iii+1μm的t3+10mm的烟酰胺+50ng/ml的igf-i+10ng/ml的bmp4的cmrl、0.2%的hsa、1xb27补充剂、1xglutamax(lifetechnologies#35050061)中培养两小时。将细胞在krebs(alfaaesar#j67591-ap)中的2mm的葡萄糖中孵育30分钟,并收集上清液。将缓冲液换成在krebs中的20mm葡萄糖30分钟,并收集上清液。将缓冲液换成在krebs中的20mm葡萄糖、30mm的kcl30分钟,并收集上清液。使用超敏c肽或胰高血糖素elisa(mercodia#10-1141-01)和genios微孔板读数器(tecan)确定每种上清液中c肽的浓度。使用magellan软件(tecan)一式两份测量吸光度读数。在该程序之后,观察到使用c肽作为胰岛素(图7)和胰高血糖素(未显示)的替代物,从sr1423分化的细胞分泌胰岛素。
实例2-结果
细胞系衍生。通过将重编程基因引入到成熟细胞的核中来产生ipsc系。这些基因(通常为oct4、sox2、klf4和c-myc)诱导细胞的一部分,以采用胚胎干细胞的基因表达模式、形态和行为。据报道,起始细胞群体的表观遗传特征在重编程的细胞中持续存在,这种现象称为“表观遗传记忆”,尽管这种作用的持续时间未知。为了最大化生成有效地分化为胰腺谱系的ipsc系的潜力,从同意的健康成人供体胰腺的朗格汉斯岛中选出原代细胞(图1a)用于重编程。
随着时间的推移,在细胞培养物中生长的原代细胞可以变得同源并且丧失功能成熟特性,这可能是由于适应人工培养条件的结果。为了避免起始细胞群体中遗传多样性的丧失,重编程基因在细胞收获后的五天内完成。通过两个附加体表达质粒的电穿孔将重编程基因oct4、sox2、klf4和l-myc引入到原代细胞中。相对于c-myc选择l-myc,以减少引入致癌基因的可能性。在暴露于内胚层诱导剂激活素-a和渥曼青霉素4天后,最初筛选了从两个供体的原代组织产生成的73个系表达内胚层标记物的能力。选择具有最高比例的表达内胚层标记物的细胞的培养物。经过第一个筛选的二十四个细胞系随后在暴露于12天的胰腺分化方案后筛选表达胰腺标记物的能力。始终生成最高比例的胰腺细胞的细胞系被命名为sr1423,被储存并用于所有后续实验。该细胞系产生了定型内胚层(图1b)和胰腺祖细胞(图1c)的几乎同源的培养物。值得注意的是,sr1423表现出向外胚层和内胚层分化的强大能力(分别由otx2和sox17指示),但在使用市售试剂盒进行分化时无法表达中胚层标记物brachyury(图2)。由于未达到所有三个胚层,因此sr1423不符合ipsc的多能性的公认标准,并且相反可以视为多能性的或非多能性的。
细胞系表征。sr1423表达多能细胞典型的标记物(图3a),并且具有正常的核型(图3b)。其dnastr谱证实了与供体组织匹配的单个细胞系(图3c),并且在nih、atcc和dsmz数据库中的所有指纹中都是唯一的。此外,sr1423以多能细胞系的典型速率生长(图3d)。观察到来自相同供体和重编程实验的其他ipsc细胞系也显示出优先分化。ipsc系“b”也很好地分化为内胚层,而ipsc系“c”和“d”没有显示出向内胚层谱系的分化的偏好(数据未示出)。在sr1423以及系b、c和d上进行了表达基因的全基因组微阵列分析。通过这种比较,消除了由于供体或重编程的方法导致的基因表达的差异。基于至少log2的倍数变化表达的无监督的分级聚类分析显示,sr1423与细胞系b聚在一起,但与c和d不同。这确定了与向内胚层谱系的稳健且优先分化相关的基因表达模式(图4a)。在10个差异最大的表达基因中,bhmt2、cox7a1、hspb2和nap1l1与使用qrt-pcr度量形成内胚层的能力显著相关(图4b)。这些结果表明,定义的基因子集的基因表达可以用于鉴定具有治疗用途的特定ipsc系。
细胞分化。报道从多能干细胞群体产生胰腺细胞的其他小组使用独特的细胞培养方案结合独特的干细胞群体。这意味着每种方案都针对特定的起始细胞群体定制,这使起始细胞群体是分化潜力的主要决定因素的概念得到了证实。
在大多数方法中,β细胞的生成通过胚胎胰腺发育的已知阶段通过多能细胞的进行性分化而发生。这种进展始于定形内胚层的形成,随后过渡到胰腺祖细胞、内分泌型胰腺、并且最后是表达激素的胰腺细胞。传统上,表达sox17和hnf3β的定形内胚层细胞的产生是通过暴露于激活素a和wnt3a(参与哺乳动物的内胚层模式化的信号传导分子)来实现的。胰腺祖细胞(通过胰腺十二指肠同源盒1(pdx1)的表达鉴定)在用视黄酸激活hox基因后出现,同时用环巴胺抑制hedgehog信号传导。表达pdx1和nkx6.1两者的内分泌细胞在模式化蛋白noggin的存在下通过激活kgf信号传导由胰腺祖细胞形成,kgf信号传导参与胰管细胞的形成。通过甲状腺激素来促进向激素表达表型的成熟。已经做出了巨大的努力来用小分子替代分化方案中使用的生长因子和激素。
所公开的方法能够驱动sr1423和其他干细胞分化为β细胞表型。所公开的方案在分化的第28天生成了高纯度的内分泌胰腺细胞的群体(图5a)。代表性图像的量化揭示了由细胞组成的群体,其中68%表达内分泌胰腺标记物nkx6.1,66.8%表达晚期胰腺标记物neurod1,并且66.5%表达胰岛素(图5b)。
在培养的第4-7天在抑制或不抑制tgfβri激酶抑制的情况下,本方案不提供定形内胚层细胞暴露于wnt3a,并且任选地不将定形内胚层暴露于kgf(fgf7)。检查了kgf在分化早期的影响,并且显示出胰腺和胰岛素产生细胞的产量的显著降低(图6a)。为了确定该结果是否仅限于sr1423细胞系,将所公开的方案与使用具有匹配结果的参考胚胎干细胞系bgo1v的已知方案进行比较(图6b,在6c中量化)。并排使用,所公开的方案在这些细胞系中生成了更多的胰岛素产生细胞。
按照所公开的方案从sr1423分化的细胞将胰岛素(图7)和胰高血糖素(未显示)分泌到培养基中。sr1423的顺序分化显示出一致的、可重复的高水平的c肽检测(图7),并且当用我们的方案分化时显示出更高的水平。这些细胞可以以葡萄糖响应的方式分泌胰岛素(未示出)。因此,这些分泌激素的细胞可能是细胞替代疗法的理想候选者。此外,通过向培养基中添加胰高血糖素,可以实现成熟的胰岛素和胰高血糖素表达细胞的最佳平衡,这具有减少共表达胰岛素和胰高血糖素的细胞的量的益处(图10a-c)。
实例3-在动物模型中用所公开的治疗性细胞治疗糖尿病
海藻酸盐包封:使用细胞提升器手动释放sr1423的分化平面培养物,并在6孔悬浮培养皿中以95rpm摇动过夜。将形成的簇在130mm的nacl、10mm的mopsph7.4中冲洗,并且以2e6个细胞/ml的密度重悬浮在2%的pronovaupmvg海藻酸盐(novamatrix)中。将海藻酸盐/细胞混合物装入注射器中,并且通过0.24μm喷嘴以4ml/分钟和7kv通过nisco静电液滴发生器进料,或者手动滴入20mm的bacl2、130mm的nacl、10mm的mops的聚合浴中。将珠冲洗四次,并返回到分化培养基中直至移植。
小鼠中糖尿病的诱导:使用8-10周龄的具有免疫能力的cd1小鼠以用链脲佐菌素(stz,vwr#102515-840)诱导糖尿病。将stz腹膜内(200mg/kg)注射到小鼠中。通过测量血糖水平来确认stz诱导的糖尿病。
海藻酸盐包封的分化的sr1423细胞的移植:将stz诱导的糖尿病小鼠用20mg/kg的三溴乙醇(sigma#776557888)麻醉,并将其腹部剃毛并用异丙醇灭菌。在胸骨下方的腹部中央制作垂直切口。将海藻酸盐珠植入到腹膜中,并用缝合线闭合切口。手术后,给予小鼠酮洛芬(2.5mg/kg,thermofisher#p08d009)3天。在移植后定期观察小鼠。每周两次通过使用商用血糖仪从尾静脉获取一小滴血液来监测血糖水平。较低的血糖在移植的48小时内是明显的,并且维持了数周时间(图8)。
在动物模型中糖尿病的逆转。用于移植的免疫保护胰岛细胞的常用方法是将细胞包埋在含海藻酸盐的微珠中。包埋在海藻酸盐内并植入到腹膜中的替代胰腺细胞可以显示糖尿病的短期逆转,并且为概念验证提供了良好的基础。由改性的海藻酸盐形成的具有较低的刺激纤维化趋势的微珠在正常啮齿动物中能够逆转糖尿病长达6个月。为了证明sr1423生成的细胞在免疫保护装置中逆转糖尿病的能力,我们将分化的细胞包埋在海藻酸盐珠中,并且将其植入到患有化学诱导的糖尿病的正常小鼠的腹膜中。在移植的48小时内较低的血糖是明显的,并且维持了数周时间(图8)。
实例4-使用所公开的方法培养非人灵长类细胞
所公开的用于分离多能干细胞并将干细胞有效地分化成胰岛素产生胰腺谱系的方法在以非人组织开始和以非胰腺组织开始时也是有效的。从恒河猴物种的三种非人灵长类动物(nhp)的皮肤活检中收获成纤维细胞,并且如针对人类细胞所描述的相同方式进行培养(即,实例1的培养和分化步骤)。重编程基因oct4、sox2、klf4和l-myc通过两个附加体表达质粒的电穿孔被引入原代成纤维细胞中。从nhp供体的原代组织生成的干细胞系表达多能性标记物oct4、ssea4、tra-1-80和tra-1-60。在暴露于内胚层诱导剂激活素-a和渥曼青霉素4天后,筛选这些细胞系表达内胚层标记物的能力。从每个nhp供体中选择具有最高比例的表达内胚层标记物的细胞的培养物,并且随后在暴露于12天的胰腺分化方案后筛选表达胰腺标记物的能力。来自所有三个nhp供体的组织产生了至少一种干细胞系,该干细胞系在暴露于所述的12天分化方案后有效地生成胰腺内胚层细胞。图9示出了衍生自nhp供体的这些系之一的代表性实例。
实例5-用所公开的治疗性细胞治疗成人糖尿病
该实例说明了使用所公开的方案生成治疗性细胞以治疗成人的i型糖尿病的方法。
患有胰岛素依赖型糖尿病的成人受试者接受移植物,所述移植物包括治疗有效量的组合物,所述组合物包括进入受试者的网膜袋或腹膜腔中的所公开的大包封的胰岛素产生细胞。评价受试者的血糖水平。在植入治疗有效数量的大包封的细胞后,对受试者进行监测,以确保受试者的血糖水平已经稳定。进一步筛查受试者的糖化血红蛋白,以及随时间推移的糖尿病的合并症。
*****
- 还没有人留言评论。精彩留言会获得点赞!