用于诱导从体细胞脱分化为诱导性多能干细胞的组合物及利用其的脱分化诱导方法与流程
本发明在韩国科学技术信息通信部的支持下完成,课题号为2017m3a9c6027001,上述课题的研究管理机关为韩国研究财团,研究事业的名称为“生物医疗技术开发事业”,研究课题名为“直接交叉分化人类神经干细胞培养生产技术优化及安全性研究”,主管机关为高丽大学,研究期间为2017年4月1日至2021年3月31日。本发明涉及用于诱导从体细胞脱分化为诱导性多能干细胞(inducedpluripotentstemcell;ips)的组合物及利用其的脱分化诱导方法,更详细地,涉及可通过刺激作为人类体细胞受体的cxc趋化因子受体2(cxcr2,cxcchemokinereceptor2)来促进或抑制脱分化效率的脱分化诱导用组合物及利用其的脱分化诱导方法。
背景技术:
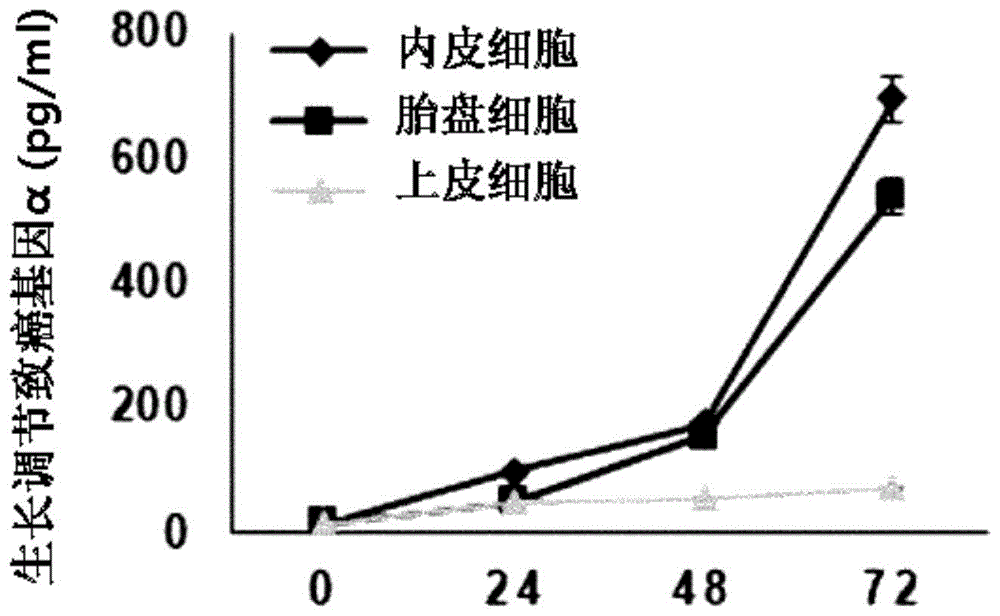
:为了生产干细胞治疗剂,必须实现作为供给源的干细胞的大量体外培养,使其安全且价格低廉才可以在临床上作为细胞治疗剂来使用。但是,现在为了人类全能干细胞的增殖培养,使用动物源性支持细胞或者在涂敷包含动物源性产物的特殊凝胶的容器中培养,因此,会发生因异种蛋白污染引起的安全性隐患,在使用昂贵的特殊凝胶的情况下,在经济层面上不适于大量生产。为了提高脱分化干细胞生产效率以使其将来适用于临床,现在正在进行利用多种病毒、化学物质、细胞因子等来提高脱分化干细胞生产效率的研究。例如,有利用仙台病毒不使融合(integration)于宿主染色体,或者转导融合蛋白,或者利用信使核糖核酸(mrna)的研究。另外,有关于现有的通过重编程(reprogramming)的诱导性多能干细胞的制备方法,从5×104个人类皮肤成纤维细胞只能获取约10个诱导性多能干细胞,因这种效率低问题而受到限制。技术实现要素:技术问题因此,本发明人确认,在通过在体细胞中对cxc趋化因子受体2的配体(ligand)进行转化来脱分化并在通过转化增加cxc趋化因子受体2的表达量的体细胞中进行脱分化的情况下,诱导脱分化为诱导性多能干细胞的效率优良。因此,本发明的目的在于,提供一种包含cxc趋化因子受体2或其配体的用于诱导从体细胞脱分化为诱导性多能干细胞的组合物。本发明的再一目的在于,提供一种包含cxc趋化因子受体2或其配体的用于诱导从体细胞脱分化为诱导性多能干细胞的胎盘源性细胞条件培养基。本发明的另一目的在于,提供一种用于诱导从体细胞脱分化为诱导性多能干细胞的方法,包括:体细胞转化步骤,增加cxc趋化因子受体2的表达;以及体细胞培养步骤,培养转化的体细胞。本发明的还有一目涉及包含cxc趋化因子受体2的配体的细胞培养组合物在诱导从体细胞脱分化为诱导性多能干细胞中的用途。技术方案本发明涉及用于诱导从体细胞脱分化为诱导性多能干细胞的组合物及利用其的脱分化诱导方法,根据本发明的用于诱导从体细胞脱分化为诱导性多能干细胞的组合物以及利用其的脱分化诱导方法通过刺激作为人类体细胞受体的cxc趋化因子受体2来增加从体细胞脱分化为诱导性多能干细胞的效率。经本发明确认,在包含cxc趋化因子受体2的配体的培养基中培养体细胞及通过转化来增加cxc趋化因子受体2的表达的情况下,虽然脱分化为诱导性多能干细胞的效率增加,但在减少cxc趋化因子受体2的表达的体细胞的情况下,脱分化为诱导性多能干细胞的效率减少。以下,对本发明进行更详细的说明。本发明的一实施方式涉及包含cxc趋化因子受体2或其配体的用于诱导从体细胞脱分化为诱导性多能干细胞的组合物。cxc趋化因子受体2为与细胞膜蛋白质进行特异性结合反应的细胞因子的cxc趋化因子家族中的一种。其中,cxc趋化因子受体2为与具有与cxc基序相邻的e-l-r氨基酸基序的cxc趋化因子的认知密切相关的受体。趋化因子为细胞因子蛋白质的一种,其介导趋化作用。上述cxc趋化因子受体2的配体可以为选自由生长调节致癌基因α(gro-α,growth-regulatedoncogene-α)、生长调节致癌基因β(gro-β,growth-regulatedoncogene-β)、生长调节致癌基因γ(gro-γ,growth-regulatedoncogene-γ)、粒细胞趋化蛋白2(gcp-2,granulocytechemotacticprotein-2)、中性粒细胞活化肽2(nap-2,neutrophilactivatingpeptide-2)、上皮中性粒细胞活化肽78(ena-78,epithelialneutrophil-activatingprotein-78)以及白细胞介素8(il-8,interleukin-8)组成的组中的一种以上,例如,可以为生长调节致癌基因α或白细胞介素8,但不限于此。上述体细胞可以为选自由内皮细胞、上皮细胞以及胎盘细胞组成的组中的一种以上。本发明的再一实施方式涉及包含cxc趋化因子受体2的配体的用于诱导从体细胞脱分化为诱导性多能干细胞的胎盘源性细胞条件培养基。在本说明书中,术语“胎盘源性细胞条件培养基”是指将胎盘源性细胞接种到涂敷明胶的孔培养板上并加入细胞培养液培养上述胎盘源性细胞后只回收培养液来制备的培养基。在使用人类胎盘源性支持细胞的情况下,查明可以保持人类胚胎干细胞的未分化状态来表现其效用。上述cxc趋化因子受体2的配体可以为选自由生长调节致癌基因α、生长调节致癌基因β、生长调节致癌基因γ、粒细胞趋化蛋白2、中性粒细胞活化肽2、上皮中性粒细胞活化肽78以及白细胞介素8组成的组中的一种以上,例如,可以为生长调节致癌基因α或白细胞介素8,但不限于此。上述体细胞可以为选自由内皮细胞、上皮细胞以及胎盘细胞组成的组中的一种以上。上述胎盘源性细胞可以为从人类绒毛膜板分离并培养的胎盘源性纤维细胞样细胞。上述胎盘源性细胞条件培养基可以包含在细胞生长培养基中培养的人类胎盘源性细胞。本发明的另一实施方式涉及用于诱导从体细胞脱分化为诱导性多能干细胞的方法,包括:体细胞转化步骤,增加cxc趋化因子受体2的表达;以及体细胞培养步骤,培养转化的体细胞。上述体细胞转化步骤中可以使用crispr/cas核酸酶系统或慢病毒激活粒子(lentiviralactivationparticles)。在本发明中,术语“慢病毒”为作为核糖核酸病毒的逆转录病毒(retrovirus)的一种,通过向宿主的细胞核移动并插入于脱氧核糖核酸中表达基因来制备病毒粒子。利用这样的机制,将其作为载体(vector)用于调节基因表达等。在本发明的一实例中,在上述体细胞转化步骤中,可以通过使体细胞感染cxc趋化因子受体2慢病毒激活粒子来转化,以增加cxc趋化因子受体2的表达。上述体细胞可以为选自由内皮细胞、上皮细胞以及胎盘细胞组成的组中的一种以上。上述培养可以在胎盘源性细胞条件培养基中进行。上述胎盘源性细胞可以为从人类绒毛膜板分离并培养的胎盘源性纤维细胞样细胞。上述胎盘源性细胞条件培养基可以包含在细胞生长培养基中培养的人类胎盘源性细胞。上述脱分化诱导方法还可以包括从在体细胞培养步骤中形成的细胞集落中分离干细胞的干细胞分离步骤。发明的效果本发明涉及用于诱导从体细胞脱分化为诱导性多能干细胞的组合物及利用其的脱分化诱导方法,上述用于诱导从体细胞脱分化为诱导性多能干细胞的组合物以及利用其的脱分化诱导方法通过刺激作为人类体细胞受体的cxc趋化因子受体2来增加诱导从体细胞脱分化为诱导性多能干细胞的效率,因此,可以将其有效用于脱分化为诱导性多能干细胞的诱导。附图说明图1a为在培养内皮细胞、上皮细胞以及胎盘细胞时随着时间通过酶联免疫测定法检测生长调节致癌基因α的表达量的结果。图1b为在培养内皮细胞、上皮细胞以及胎盘细胞时随着时间通过酶联免疫测定法检测白细胞介素8的表达量的结果。图1c为培养内皮细胞、上皮细胞以及胎盘细胞后,对各生长调节致癌基因α的表达进行比较的免疫荧光染色结果。图1d为培养内皮细胞、上皮细胞以及胎盘细胞后,对各白细胞介素8的表达进行比较的信使核糖核酸水平的检测结果。图2a为从内皮细胞、上皮细胞以及胎盘细胞诱导脱分化后用于确认诱导性多功能干细胞特性的碱性磷酸酶染色结果照片。图2b为从内皮细胞、上皮细胞以及胎盘细胞诱导脱分化后用于确认诱导性多功能干细胞特性的碱性磷酸酶染色结果柱状图。图3a为在从人类内皮细胞脱分化为干细胞的过程中从形成细胞集落的细胞表达的进行免疫荧光法的结果照片。图3b为在从人类上皮细胞脱分化为干细胞的过程中在形成细胞集落的细胞中表达的进行免疫荧光法的结果照片。图3c为在从人类胎盘细胞脱分化为干细胞的过程中在形成细胞集落的细胞中表达的进行免疫荧光法的结果照片。图4a为从利用短发夹核糖核酸(shrna)来抑制cxc趋化因子受体2的表达的内皮细胞诱导脱分化来检测cxc趋化因子受体2蛋白质水平的进行蛋白质印迹法的结果。图4b为从利用短发夹核糖核酸来抑制cxc趋化因子受体2的表达的内皮细胞诱导脱分化来检测cxc趋化因子受体2核糖核酸表达量的柱状图。图5a是为了确认从利用短发夹核糖核酸来抑制cxc趋化因子受体2的表达的内皮细胞脱分化为诱导性多能干细胞的效率而进行碱性磷酸酶染色的结果照片。图5b是示出为了确认从利用短发夹核糖核酸来抑制cxc趋化因子受体2的表达的内皮细胞脱分化为诱导性多能干细胞的效率而进行的碱性磷酸酶染色结果的柱状图。图5c是在诱导从利用短发夹核糖核酸来抑制cxc趋化因子受体2的表达的内皮细胞脱分化为诱导性多能干细胞时确认cxc趋化因子受体2、哺乳动物雷帕霉素靶蛋白(mtor)以及β-连环蛋白的表达量和诱导性多能干细胞的标示因子表达量的蛋白质印迹法结果。图6a为从利用慢病毒激活粒子来过度表达cxc趋化因子受体2的上皮细胞诱导脱分化来检测cxc趋化因子受体2蛋白质水平的进行蛋白质印迹法的结果。图6b为从利用慢病毒激活粒子来过度表达cxc趋化因子受体2的上皮细胞诱导脱分化来检测cxc趋化因子受体2的表达量的柱状图。图6c为示出从利用慢病毒激活粒子来过度表达cxc趋化因子受体2的上皮细胞诱导脱分化而生成的诱导性多能干细胞的照片。图6d为检测从利用慢病毒激活粒子来过度表达cxc趋化因子受体2的上皮细胞诱导脱分化而生成的诱导性多能干细胞的细胞集落数的柱状图。具体实施方式本发明涉及包含cxc趋化因子受体2或其配体的用于诱导从体细胞脱分化为诱导性多能干细胞的组合物、脱分化诱导用胎盘源性细胞条件培养基以及通过转化cxc趋化因子受体2来过度表达的脱分化诱导方法。发明的实施方式以下,通过下述实施例更详细地说明本发明。但这些实施例只是用于例示本发明,而不是通过这些实施例限制本发明的范围。实施例1:在内皮细胞、上皮细胞及胎盘细胞中的生长调节致癌基因α及白细胞介素8的表达确认从atcc公司购入原代人脐静脉内皮细胞(primaryumbilicalveinendothelialcells,huvec)用作人类内皮细胞,并购入包含2%的胎牛血清(fetalbovineserum;fbs)及血管内皮生长因子(vascularendothelialgrowthfactor;vegf)的内皮细胞培养基(endothelialcellgrowthmedium,lonza)来使用,在37℃、5%的co2的培养箱(incubator)中进行培养。从atcc公司购入原代皮肤成纤维细胞(primarydermalfibroblasts,hdf)用作人类上皮细胞,使用包含90%的达尔伯克改良伊格尔培养基(dulbecco'smodifiedeagle'smedium;dmem)和10%的胎牛血清的培养基,在37℃、5%的co2的培养箱中进行培养。将从绒毛膜的绒毛组织分离的细胞(hpc)用作人类胎盘细胞,将分离的胎盘细胞在包含10%的胎牛血清的达尔伯克改良伊格尔培养基中在37℃、5%的co2的培养箱中进行培养。为了检测在三种细胞中生长调节致癌基因-细胞及白细胞介素8的分泌量,将内皮细胞、上皮细胞及胎盘细胞在培养皿中各培养24小时、48小时及72小时后,回收培养基,通过酶联免疫测定法检测随时间的生长调节致癌基因α及白细胞介素8的分泌量。具体地,实验使用试剂盒(humanelisakit,abcam公司)进行。实验顺序为将100μl的样品各在4℃的温度下进行过夜反应,加入生物素抗体(biotinantibody)后培养1小时。使用链霉亲和素溶液和试剂(tmbone-stepsubstratereagent)进行反应后,使用50μl的终止溶液(stopsolution)来终止反应,使用酶标仪(microplatereader)在450nm下检测吸光度。正如可以在图1a及表1中确认的,相比于上皮细胞,在胎盘细胞及内皮细胞中,尤其是在内皮细胞中表现出生长调节致癌基因α的高表达。表1时间(小时)内皮细胞(huvec)上皮细胞(hpc)胎盘细胞(hdf)015.1315.9113.692495.6447.9149.6048173.52152.3553.8172693.35538.4070.92正如可以在图1b及表2中确认的,相比于上皮细胞及内皮细胞,在胎盘细胞中表现出白细胞介素8的高表达。表2时间(小时)内皮细胞(huvec)上皮细胞(hpc)胎盘细胞(hdf)00.000.000.00240.192.110.00480.363.170.00721.454.420.00通过荧光染色法验证在培养皿中培养的内皮细胞、上皮细胞及胎盘细胞的生长调节致癌基因α的表达。具体地,向培养的细胞添加4%的福尔马林溶液在常温下固定10分钟,使用0.1%的聚乙二醇辛基苯基醚(tritonx-100)/磷酸缓冲盐溶液(pbs)渗透10分钟后,在4℃的温度下使用生长调节致癌基因α一次抗体(abcam公司,#ab86436)进行过夜反应。次日,在常温下将alexa488用作二次抗体反应1小时,使用4',6-二脒基-2-苯基吲哚(dapi)处理后,在黑暗条件下放置5分钟后,使用荧光显微镜检测细胞中生长调节致癌基因α的表达。正如可以在图1c中确认的,相比于上皮细胞及胎盘细胞,在内皮细胞中显出生长调节致癌基因α的高表达。通过实时聚合酶链式反应来比较分析内皮细胞、上皮细胞以及胎盘细胞中白细胞介素8基因的表达。从利用试剂盒(qiagenrneasykit,qiagenhilden公司,德国)诱导分化的细胞分离核糖核酸,利用2μg的核糖核酸、oligo(dt)以及逆转录酶(superscriptiireversetranscriptase,gibco公司)来合成互补脱氧核糖核酸(cdna)。向合成的各互补脱氧核糖核酸放入白细胞介素8基因的引物和反应混合物(iqsybrgreenqpcrmastermix),使用仪器(bio-radicycleriqsystem,bio-radlaboratories公司,美国)进行分析。分析值利用甘油醛-3-磷酸脱氢酶(gapdh)基因进行正常化,为了统计学上有意义,使用p值(pvalue)(*p=0.05)。用于分析白细胞介素8基因表达的引物如以下表3所示。表3序列号名称序列1白细胞介素8正向引物ctggccgtggctctcttg2白细胞介素8反向引物ccttggcaaaactgcacctt正如可以在图1d及表4中确认的,相比于上皮细胞及胎盘细胞,在内皮细胞中显出生长调节致癌基因α的高表达。表4结果可以确认,在内皮细胞中生长调节致癌基因α和白细胞介素8的表达非常高,从而刺激cxc趋化因子受体2,表现出比在上皮细胞及胎盘细胞中更高的脱分化效率。实施例2:在内皮细胞、上皮细胞以及胎盘细胞中的脱分化效率比较通过碱性磷酸酶染色并利用从实施例1的体细胞诱导的脱分化干细胞确认是否表现出诱导性多能干细胞的特性的自体再生能力。使用试剂盒(escellcharacterizationkit,chemiconinternational公司)进行碱性磷酸酶染色(alp)。正如可以在表5、图2a及图2b中确认的,可以确认在人类内皮细胞中表现出比在上皮细胞或胎盘细胞中高出约7倍至10倍的脱分化效率(**p=0.01)。表5细胞种类细胞接种量(cells/ml)细胞集落/孔效率(%)人类内皮细胞(huvec)1×1054043±0.214.043胎盘细胞(hpc)1×105380±0.030.381上皮细胞(hdf)1×105553±0.030.553实施例3:从内皮细胞、上皮细胞以及胎盘细胞脱分化的干细胞中的cxc趋化因子受体2、哺乳动物雷帕霉素靶蛋白以及β-连环蛋白的表达验证通过免疫荧光法并利用从实施例1中的体细胞诱导的脱分化干细胞验证表达cxc趋化因子受体2、哺乳动物雷帕霉素靶蛋白以及β-连环蛋白的部位。已经通过先行研究确认人类全能干细胞的cxc趋化因子受体2及哺乳动物雷帕霉素靶蛋白的抑制会使β-连环蛋白的活性度降低,在胎盘源性条件培养基中培养的人类脱分化干细胞通过cxc趋化因子受体2/哺乳动物雷帕霉素靶蛋白/to连环蛋白机制调节人类全能干细胞的特征及增殖。由此,预计在利用胎盘源性条件培养基形成诱导性多能干细胞的过程中,通过cxc趋化因子受体2刺激,通过哺乳动物雷帕霉素靶蛋白和β-连环蛋白的机制会使其具有作为脱分化干细胞的活性,并进行确认。将上皮细胞、内皮细胞以及胎盘细胞用作人类体细胞,购入仙台病毒脱分化因子(oct4、sox2、c-myc以及klf4(lifetechnologies公司,cytotuneips2.0仙台病毒重编程试剂盒(cytotuneips2.0sendaireprogrammingkit))),通过感染kos5感染复数(moi,multiplicityofinfection)、c-myc5感染复数以及kif43感染复数的病毒来转化后,提供生长培养基培养7天。上皮细胞和胎盘细胞的生长培养基为包含10%的胎牛血清、100u/ml的青霉素(penicillin)以及100g/ml的链霉素(streptomycin)的达尔伯克改良伊格尔培养基,购入培养基(ebm-2培养基,lonza公司,cc-3162)用作内皮细胞的生长培养基。将转化的体细胞移植到涂敷有0.1%的明胶(gelatin)的新的培养容器中,提供胎盘源性细胞条件培养基进行培养。在从此开始到形成细胞集落的过程中每天进行荧光染色法。具体地,使用4%的多聚甲醛固定细胞10分钟后,使用0.1%的聚乙二醇辛基苯基醚对细胞进行渗透,将作为一次抗体的cxc趋化因子受体2(abcam公司,#ab14935)、nanog(santacruz公司,sc-293121)、29连环蛋白(thermoscientific公司,#ma1-2001)、p-哺乳动物雷帕霉素靶蛋白(cellsignaling公司,#5536)各稀释为1:1000进行处理后,在4℃的温度下培养过夜。次日,在常温下用二次抗体处理1小时,使用4',6-二脒基-2-苯基吲哚处理后,在黑暗条件下放置5分钟后,使用荧光显微镜进行观察。正如可以在图3a至图3c中确认的,只有干细胞脱分化的过程中形成的细胞集落的细胞表达了cxc趋化因子受体2、哺乳动物雷帕霉素靶蛋白以及β-连环蛋白,因此,可以判断通过施加在体细胞的cxc趋化因子受体2刺激,通过哺乳动物雷帕霉素靶蛋白以及β-连环蛋白的机制,使其具有作为脱分化干细胞的活性。实施例4:利用短发夹核糖核酸的cxc趋化因子受体2表达抑制诱导对于与实施例2中一样表现出cxc趋化因子受体2的高表达量的内皮细胞,确认在利用短发夹核糖核酸抑制cxc趋化因子受体2的表达时,脱分化干细胞的效率显著降低。为了慢病毒感染,在12孔培养板中以1×105/well的方式培养内皮细胞,第二天在包含6mg/ml的聚凝胺(polybrene)的培养基放置15分钟后,使用插入1×106tu/ml的短发夹核糖核酸的慢病毒(cxc趋化因子受体2短发夹核糖核酸慢病毒粒子(cxcr2shrnalentiviralparticles),santacruz公司,#sc-40028-v)进行感染。24小时后,将培养基更换为没有添加聚凝胺的细胞生长培养基,从第二天开始使用2μg/ml的嘌呤霉素(puromycin)筛选并回收感染病毒4天至7天的细胞后,来确认cxc趋化因子受体2的表达与否。在慢病毒感染中使用的cxc趋化因子受体2短发夹核糖核酸慢病毒粒子的核酸序列如下述表6所示。表6以未使用插入短发夹核糖核酸的慢病毒处理的组、使用对照组慢病毒处理的组以及使用cxc趋化因子受体2慢病毒处理的组为对象,以蛋白质以及核糖核酸(rna)水平基准检测cxc趋化因子受体2的表达量。具体地,为了以蛋白质水平检测表达量,使用凉的磷酸缓冲盐溶液洗涤细胞后,使用溶解缓冲液(20mm的氯化钾(kcl)、150mm的氯化钠(nacl)、1%的乙基苯基聚乙二醇(np-40)、50mm的氟化钠(naf)、1mm的二硫苏糖醇(dtt)、1mm乙二醇双(2-氨基乙基醚)四乙酸(egta)、1×的蛋白酶抑制剂、10%的丙三醇以及50mm的三(羟甲基)氨基甲烷(tris-hcl),ph7.5)在冰上搅拌15分钟,在4℃的温度下以14000rpm的转速对溶解的细胞进行15分钟的离心分离。通过考马斯亮蓝法(bradford)(bio-radlaboratories公司,赫拉克勒斯,加拿大)对上层液中蛋白质的浓度进行确认。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecylsulfate-polyacrylamidegelelectrophoresis)分析总蛋白质(30μg),使用硝化纤维(nitrocellulose)膜转移(gehealthcarelifesciences公司,小查尔方特,英国)。将cxc趋化因子受体2一次抗体(abcam公司,#ab65968)稀释为1:1000并在4℃的温度下过夜后,将接合有辣根过氧化物酶的二次抗体稀释为1:2000,培养1小时后,使用电化学发光(ecl)(gehealthcarelifesciences公司)检测信号。通过实时聚合酶链式反应来检测核糖核酸水平。利用甘油醛-3-磷酸脱氢酶基因进行正常化,为了统计学上有意义而使用p值(*p=0.05,**p=0.01)用于分析cxc趋化因子受体2基因表达的引物如下述表7所示。表7正如可以在图4a、图4b及表8中确认的,使用插入短发夹核糖核酸的慢病毒(shcxcr2)处理,从内皮细胞诱导的细胞中cxc趋化因子受体2的表达被抑制。表8实施例5:通过抑制cxc趋化因子受体2表达的脱分化诱导效率减少当与实施例4一样抑制cxc趋化因子受体2的表达时,为了确认从体细胞脱分化为诱导性多能干细胞的效率,进行碱性磷酸酶染色。正如可以在表9、图5a及图5b中确认的,在内皮细胞中通过shcxcr2慢病毒抑制cxc趋化因子受体2的表达后,随着脱分化被诱导,脱分化为诱导性多能干细胞的效率也减少(****p=0.0001)。表9感染条件细胞接种量细胞集落/孔效率(%)未感染的对照组1×1051974±501.973shcontrol慢病毒1×105946±89.20.946shcxcr2慢病毒1×1054±2.700.004正如可以在图5c中确认的,在内皮细胞中减少cxc趋化因子受体2的表达时,在从其诱导脱分化的诱导性多能干细胞中,不仅cxc趋化因子受体2、哺乳动物雷帕霉素靶蛋白及β-连环蛋白的表达量减少,诱导性多能干细胞标示因子的表达量也减少。实施例6:通过诱导cxc趋化因子受体2过度表达的脱分化诱导效率增加在上皮细胞中利用慢病毒激活粒子使cxc趋化因子受体2过度表达。具体地,将1×105cells的上皮细胞在12孔培养板中进行培养,24小时后使用6μg/ml的聚凝胺处理15分钟,使用10感染复数的cxc趋化因子受体2慢病毒激活粒子(il-8rblentiviralactivationparticles(h),santacruz公司,#sc-401404-lac)进行感染。第二天更换不含有聚凝胺的培养基培养一天。使用5μg/ml的嘌呤霉素(puromycin)选择性地只筛选感染cxc趋化因子受体2慢病毒激活粒子的细胞进行培养。之后,通过蛋白质印迹法和实时聚合酶链式反应检测过度表达状态。以与实施例4相同的方法检测cxc趋化因子受体2的表达量。正如在图6a、图6b及表10中确认的,通过利用慢病毒激活粒子,使从上皮细胞诱导的细胞的cxc趋化因子受体2的表达增加。表10因此,在为了确认从体细胞脱分化为诱导性多能干细胞的效率而常用的多功能干细胞培养基(tesr)和胎盘源性条件培养基中各分为过度表达cxc趋化因子受体2的组和对照组来培养细胞后,以与实施例5相同的方式进行碱性磷酸酶染色。正如可以在表11、图6c及图6d中确认的,在从上皮细胞中过度表达cxc趋化因子受体2的情况下,从其诱导脱分化的诱导性多能干细胞比对照组多。表11在胎盘源性条件培养基中的脱分化干细胞比在多功能干细胞培养基(tesr)中的多,确认将过度表达cxc趋化因子受体2的上皮细胞在胎盘源性条件培养基中培养的组诱导了非常多的脱分化干细胞。产业上的可利用性本发明涉及用于诱导从体细胞脱分化为诱导性多能干细胞的组合物及利用其的脱分化诱导方法,更详细地,涉及可通过刺激作为人类体细胞受体的cxc趋化因子受体2来促进或抑制脱分化效率的脱分化诱导用组合物及利用其的脱分化诱导方法。序列表<110>industry-universitycooperationfoundationkoreauniversity<120>用于诱导从体细胞脱分化为诱导性多能干细胞的组合物及利用其的脱分化诱导方法<130>pp190015<160>7<170>kopatentin2.0<210>1<211>18<212>dna<213>人工序列<220><223>人工序列<400>1ctggccgtggctctcttg18<210>2<211>20<212>dna<213>人工序列<220><223>人工序列<400>2ccttggcaaaactgcacctt20<210>3<211>57<212>dna<213>shrna慢病毒粒子<400>3gatccgtctactcatccaatgttattcaagagataacattggatgagtagacttttt57<210>4<211>57<212>dna<213>shrna慢病毒粒子<400>4gatcccctcaagattctagctatattcaagagatatagctagaatcttgaggttttt57<210>5<211>57<212>dna<213>shrna慢病毒粒子<400>5gatccgccactaaattgacacttattcaagagataagtgtcaatttagtggcttttt57<210>6<211>23<212>dna<213>人工序列<220><223>人工序列<400>6caatgaatgaatgaatggctaag23<210>7<211>25<212>dna<213>人工序列<220><223>人工序列<400>7aaagttttcaaggttcgtccgtgtt25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1