一种大规模快速纯化质粒DNA的方法与流程
本发明属于生物领域,具体涉及一种大规模快速纯化质粒dna的方法。
背景技术:
随着细胞免疫治疗领域的兴起,基因治疗药物的上市,非病毒基因治疗和dna疫苗接种对遗传性和获得性疾病的治疗和预防具有很大的潜力。市面上抽提试剂盒可以提供微克至数毫克级的质粒,足以满足科研需求;如果需要大规模制备病毒载体,试剂盒的质粒产量还是杯水车薪。此外,包装病毒通常需要三个质粒或四个质粒,每个质粒大小、序列都不一样,上游表达量也有区别,甚至稳定性都有差异。
2007年fda指导意见的要求:超螺旋质粒%:大于80%;内毒素:小于40eu/mg;宿主dna:小于1%;宿主蛋白质:小于1%。现行的细胞免疫治疗临床研究都比上述标准高,面对高质量的质粒标准,我们急需开发一种可工业化生产且适用多种质粒的纯化工艺来提高产品质量和生产效率。目前市面上的大规模纯化工艺有超速离心法和色谱层析纯化法:1)超速离心法:利用超速离心机通过离心的方式进行纯化,处理过程再还会用到有毒试剂(氯化铯),有机溶剂(乙醇/异丙醇),外源性的酶(如rnase)等,其最大的缺点是每次离心处理的体积有限,操作耗时长,而且需要昂贵超速离心机,生产工艺较难放大,在大规模质粒dna制备时已不适用;2)层析色谱纯化方法:应用的纯化工艺大同小异,广泛采用的是三步层析,其操作流程复杂,生产工艺耗时长,耗材成本昂贵;其中还会应用分子筛色谱层析,而分子筛色谱层析纯化的通量受到样本体积的限制,最大上样体积为层析柱体积的30%,很大程度上限制了大规模工艺生产需求。
此外,用于基因治疗、细胞免疫治疗领域的临床研究用质粒dna必须符合国家生物制品制剂的药用质量标准,对其生产工艺有严格法律法规约束。因此,开发一种新的高效率、高质量的生产药用级质粒dna的工艺,是市场应用的必然需求。
技术实现要素:
本发明的目的在于提供一种用于大规模快速纯化质粒dna的方法,以克服现有技术的不足之处,该方法采用离子交换膜层析和亲和层析相结合的方式,二步纯化工艺即可得到高纯度的质粒dna,并符合生物制品药用标准。本纯化方法操作方便快捷、成本低廉、回收效率高,可满足工业化大生产需求。
具体的,为了达到上述目的,本发明的技术方案如下:
本发明第一个方面公开了一种大规模快速纯化质粒dna的方法,包括以下步骤:
s1:采用碱裂解方法对含有质粒dna的细菌进行裂解,得到混合液;
s2:过滤s1获得的混合液,得到澄清液;
s3:将s2获得的澄清液上样到离子交换层析柱,收集含质粒dna的洗脱液;
s4:将s3获得的含质粒dna的洗脱液上样到亲和层析介质柱,洗脱得到含质粒dna的洗脱峰;
s5:将s4获得的洗脱峰进行超滤浓缩和换液,得到药用级质粒dna。
应该理解,本发明不限于上述步骤,还可以包含其他的步骤,例如在步骤s1之前、步骤s1和s2之间、步骤s2和s3之间、步骤s3和s4之间、步骤s4和s5之间、步骤s5之后,还包含其他额外的步骤,而不超出本发明的保护范围。
优选的,在s1中,所述质粒dna大小为2-20kb。
优选的,所述s2采用分步过滤的方法:首先使用8-30μm的滤膜进行第一步过滤澄清,然后使用0.22-0.65μm的滤膜进行第二步过滤澄清。
应当理解,上述滤膜的孔径并不限于上述范围,本领域技术人员可以根据需要选择任意合适的滤膜来完成本发明,且均在本发明的保护范围之内。
在本发明的一些具体实施例中,先使用8-20μm的滤器(sartoporepp3)进行第一步过滤澄清,然后使用0.22-0.65μm进行第二步过滤澄清,得到可以直接进行层析纯化的澄清液。
所述膜孔径为8-20μm的滤器型号为赛多利斯sartoporepp3,其中pp3是一种全新的经过改良的聚丙烯材料。
优选的,在s3中,所述离子交换层析柱为阴离子交换层析柱。更优选的,所述阴离子交换层析柱选自以下种类:
阴离子交换填料:source15q、source30q、captoqimpres、captoq、captodeae、qsepharosehp、qsepharoseff、deaesepharoseff、qsepharose4ff、macrocapq、qsepharosexl、qsepharose、、
阴离子交换膜层析:natriflotmhd-q、sartobindq、mustangq。
应当理解,上述离子交换层析柱并不限于阴离子交换层析柱,进一步的,并不限于上述列举的阴离子交换层析柱种类,本领域技术人员可以根据需要选择任意合适的离子交换层析柱来完成本发明,且均在本发明的保护范围之内。
优选的,在s3中,平衡阴离子交换层析柱缓冲液中edta浓度为10-100mm,tri-cl浓度为10-100mm,ph值为7-9。
在本发明的一些具体实施例中,将澄清液上样到预先平衡过的阴离子交换(sartobindq)膜层析柱,平衡阴离子交换层析柱缓冲液edta浓度为10-100mm,tri-cl浓度为10-100mm,ph值为7-9,先用浓度为0.1-0.6m/l氯化钠洗脱液洗去杂质,再用浓度为0.5-2.0m/l氯化钠洗脱液后,收集第二个洗脱峰,即含目的质粒dna的洗脱峰。
优选的,s3得到的含质粒dna的洗脱液经硫酸铵调节浓度至1.5-2.5m后,再上样到亲和层析介质柱。
在本发明的一些具体实施例中,将阴离子交换层析的洗脱液经硫酸铵调解浓度至1.5-2.5m/l后,过预平衡好的plasmidselectxtra亲和层析柱,平衡亲和层析柱缓冲液硫酸铵浓度为1.5-2.5m/l,edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8;用硫酸铵浓度为1.5-2.5m/l,氯化钠浓度为0.1-0.6m/l洗脱液洗脱,该洗脱液的edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8,收集洗脱峰。
优选的,在s5中,使用膜包或中空纤维式设备进行超滤浓缩。更优选的,其中超滤膜截留分子量是50-300kd。
优选的,在s5中,浓缩后将质粒dna换液到pbs缓冲液中。
优选的,在s5之后还包括过滤除菌步骤,即将s5得到的样品用孔径为0.22um的滤器过滤,得到无菌的质粒dna。
在本发明的一些优选实施例中,在s3中,首先使用浓度为0.1-0.6m/l的氯化钠洗脱离子交换层析柱以去掉杂质,再用0.5-2.0m/l的氯化钠洗脱液进行洗脱得到含质粒dna的洗脱峰。
在本发明的一些优选实施例中,s3得到的含质粒dna的洗脱液经硫酸铵调节电导率为100-300ms/cm之后,再上样到亲和层析介质柱。
本发明第二个方面公开了上述的方法得到的质粒dna。
本发明第三个方面公开了上述的方法或上述的质粒dna在生物工程技术领域中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,而不超出本发明的构思与保护范围。
本发明相对于现有技术具有如下的显著优点及效果:
本发明提供了一种用于大规模快速纯化质粒dna的方法,该方法采用离子交换膜层析和亲和层析相结合的方式,仅仅二步纯化工艺即可得到高纯度的质粒dna,并且得到的质粒dna符合生物制品药用标准。该纯化方法操作方便快捷、成本低廉、回收效率高,可满足工业化大生产需求。
附图说明
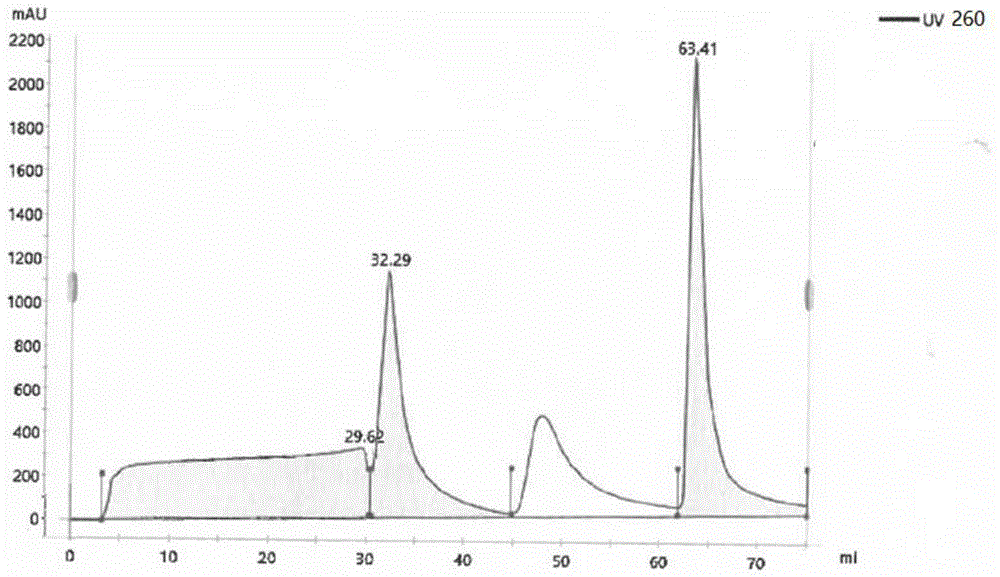
图1为本发明实施例1中的阴离子交换层析纯化图谱(图中uv260指紫外在260nm处的吸收值);
图2为本发明实施例1中的亲和层析纯化图谱(图中uv260指紫外在260nm处的吸收值);
图3为本发明实施例1中公开的方法的提取的得到的质粒的琼脂糖凝胶电泳图(图中:m:marker条带;1:实施案例1中的最终得到的质粒的电泳条带;2:实施案例1中的最终得到的质粒稀释10倍后的电泳条带)。
具体实施方式
下面结合附图和实施例对本发明的技术方案进行详细描述,但并不因此将本发明限制在所述的实施例范围之中。
下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。本发明所用试剂和原料均市售可得。
实施例1
本发明大规模快速纯化质粒dna方法的一种实施例,包括以下步骤:
1)将40g含有8.89kb质粒dna的大肠杆菌菌体通过分子克隆指南所述方法进行碱裂解,裂解后先使用20μm的滤器(sartoporepp3)进行第一步过滤澄清,然后使用0.65或0.45μm的滤器进行第二步过滤澄清,得到可以直接进行层析纯化的澄清液;
2)阴离子交换层析:将二步过滤澄清后的裂解液,上样到预先平衡过的阴离子交换(sartobindq)膜层析柱,平衡阴离子交换层析柱缓冲液edta浓度为10-100mm,tri-cl浓度为10-100mm,ph值为7-9,先用浓度为0.1-0.6m/l氯化钠洗脱液洗去杂质,再用浓度为0.5-2.0m/l氯化钠洗脱液后,收集第二个洗脱峰,即含目的质粒dna的洗脱峰,阴离子交换层析纯化图谱如图1所示,洗脱峰体积100ml,质粒dna浓度为800μg/ml;
3)亲和层析:将阴离子交换层析的洗脱液调整硫酸铵浓度至1.5-2.5m后,过预平衡好的plasmidselectxtra亲和层析柱,平衡亲和层析柱缓冲液硫酸铵浓度为1.5-2.5m,edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8;用硫酸铵浓度为1.5-2.5m,氯化钠浓度为0.1-0.6m洗脱液洗脱,该洗脱液的edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8,收集洗脱峰得到样品40ml,质粒dna浓度为300μg/ml,亲和层析纯化图谱如图2所示;
4)步骤3)得到的样品,使用膜包或中空纤维式超滤装置进行浓缩,超滤膜截留分子量是50-300kd,再更换到pbs缓冲液中,质粒dna浓度为1300μg/ml,得到质粒dna体积10ml;
5)步骤4)得到的样品,使用孔径0.22um除菌过滤器过滤,再用1ml无菌pbs缓冲液润洗,此时质粒dna体积为11ml。
6)步骤5)得到的样品,取5μl,加入1μl6xloadingbuffer,跑1%琼脂糖凝胶电泳,电压120v,25min;然后用eb染色15min,使用成像仪进行拍照显示,如图3所示。
本实施例质粒dna纯化流程的总回收率是50.6%,可满足工业化大生产需求。
实施例2
本发明大规模快速纯化质粒dna方法的一种实施例,包括以下步骤:
1)将100g含有5.82kb质粒dna的大肠杆菌菌体通过分子克隆指南所述方法进行碱裂解,裂解后先使用20μm的滤器(sartoporepp3)进行第一步过滤澄清,然后使用0.65或0.45μm的滤器进行第二步过滤澄清,得到可以直接进行层析纯化的澄清液;
2)阴离子交换层析:将二步过滤澄清后的裂解液,上样到预先平衡过的阴离子交换(sartobindq)膜层析柱,平衡阴离子交换层析柱缓冲液edta浓度为10-100mm,tri-cl浓度为10-100mm,ph值为7-9,先用浓度为0.1-0.6m/l氯化钠洗脱液洗去杂质,再用浓度为0.5-2.0m/l氯化钠洗脱液后,收集第二个洗脱峰,即含目的质粒dna的洗脱峰,洗脱峰体积2560ml,质粒dna浓度为810μg/ml;
3)亲和层析:将阴离子交换层析的洗脱液调整硫酸铵浓度至1.5-2.5m/l后,过预平衡好的plasmidselectxtra亲和层析柱,平衡亲和层析柱缓冲液硫酸铵浓度为1.5-2.5m/l,edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8;用硫酸铵浓度为1.5-2.5m/l,氯化钠浓度为0.1-0.6m/l洗脱液洗脱,该洗脱液的edta浓度为10mm,tris浓度为100mm,ph值为7-8,收集洗脱峰得到样品100ml,质粒dna浓度为300μg/ml;
4)步骤3)得到的样品,使用膜包或中空纤维式超滤装置进行浓缩,超滤膜截留分子量是50-300kd,再更换到pbs缓冲液中,质粒dna浓度为1400μg/ml,得到质粒dna体积25ml;
5)步骤4)得到的样品,使用孔径0.22um除菌过滤器过滤,再用1ml无菌pbs缓冲液润洗,此时质粒dna体积为11ml。
本实施例质粒dna纯化流程的总回收率是51.6%,可满足工业化大生产需求。
实施例3
本发明大规模快速纯化质粒dna方法的一种实施例,包括以下步骤:
1)将120g含有13.1kb质粒dna的大肠杆菌菌体通过分子克隆指南所述方法进行碱裂解,裂解后先使用20μm的滤器(sartoporepp3)进行第一步过滤澄清,然后使用0.65或0.45μm的滤器进行第二步过滤澄清,得到可以直接进行层析纯化的澄清液;
2)阴离子交换层析:将二步过滤澄清后的裂解液,上样到预先平衡过的阴离子交换(sartobindq)膜层析柱,平衡阴离子交换层析柱缓冲液edta浓度为10-100mm,tri-cl浓度为10-100mm,ph值为7-9,先用浓度为0.1-0.6m/l氯化钠洗脱液洗去杂质,再用浓度为0.5-2.0m/l氯化钠洗脱液后,收集第二个洗脱峰,即含目的质粒dna的洗脱峰,洗脱峰体积260ml,质粒dna浓度为900μg/ml;
3)亲和层析:将阴离子交换层析的洗脱液调整硫酸铵浓度至1.5-2.5m/l后,过预平衡好的plasmidselectxtra亲和层析柱,平衡亲和层析柱缓冲液硫酸铵浓度为1.5-2.5m/l,edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8;用硫酸铵浓度为1.5-2.5m/l,氯化钠浓度为0.1-0.6m/l洗脱液洗脱,该洗脱液的edta浓度为10-100mm,tris浓度为10-100mm,ph值为7-8,收集洗脱峰得到样品46ml,质粒dna浓度为800μg/ml;
4)步骤3)得到的样品,使用膜包或中空纤维式超滤装置进行浓缩,超滤膜截留分子量是50-300kd,再更换到pbs缓冲液中,质粒dna浓度为1420μg/ml,得到质粒dna体积26ml;
5)步骤4)得到的样品,使用孔径0.22um除菌过滤器过滤,再用1ml无菌pbs缓冲液润洗,此时质粒dna体积为11ml。
本实施例质粒dna纯化流程的总回收率是58.1%,可满足工业化大生产需求。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!