一种工业发酵生产辅酶Q10的方法与流程
本发明涉及一种辅酶q10的制备方法,具体涉及一种工业发酵生产辅酶q10的方法。
背景技术:
辅酶q10(coenzymeq10,coq10)又称泛醌,是一种类维生素物质,以极低的含量存在于动物、植物、微生物等细胞内。由于辅酶q10是细胞自身合成的天然抗氧化剂和细胞代谢激活剂,能保护蛋白、dna分子等免受由自由基诱导氧化作用的侵害而被广泛应用于药物、化妆品、食品等行业。目前辅酶q10在医学上是一种很好的临床生化药物,常用于肝病、心血管疾病、癌症的综合治疗与提高机体的免疫力。在食品领域作为一种新型食品营养添加剂,具有增强体能与提高免疫力的作用。同时辅酶q10对延缓衰老和提高机体免疫力有着不可代替的作用,被广泛应用于女性化妆品领域。
辅酶q10的生产方法一般分为直接提取法、化学合成法、微生物发酵法等。直接提取法主要从大豆、烟叶或动物内脏中进行分离和提取。提取法制备工艺较简单,但提取成本高,且受原料及季节等的限制,不适合于现代化工业大生产。化学合成法主要分为不以茄尼醇作为原料的全化学合成法和以茄尼醇作为原料的半化学合成法。化学合成法合成过程反应复杂、步骤多、转化效率低、往往还存在许多副产物,这些因素都影响了其产业化发展。微生物发酵法是目前生产辅酶q10的主要方法。该方法由于原料廉价丰富,产物分离过程相对简单,产物为天然品,不存在化合物手性问题,生物活性好,易被人体吸收,且可以通过发酵罐实现规模化工业化生产,因此成为最具发展潜力的辅酶q10生产方法。
辅酶q10正常发酵周期较长,发酵过程为了满足菌体生长需求,需要对碳源、氮源等营养物质进行补充。但随着补料的增加,发酵罐内料液体积逐渐增加存在料液满溢的情况。为提高发酵罐的设备利用率,需要定期进行三次的中间带放。带放低单位发酵液体积约占单批总产量的四分之一。带放料液菌体未到衰老期,培养液中还含有部分未代谢完全的营养物质,如新补如的料液会随带放排出,造成原辅料的浪费。从发酵周期考虑,前两次带放处于菌体的对数生长期,第三次带放正处于q10累计高峰期。所以原工艺3次带放会损失部分效价。同时由于原工艺3次带放的发酵液周期较短,发酵液中培养基消耗不完全且杂质含量高,有效单位低,导致提炼收率低,且工业盐质量不容易控制,低单位菌丝多造成低产量高排污,排放物中未利用的有机物多造成cod排放超标,从而增加了环保成本。因此提高低单位发酵液的利用率对增大产量,提高技术指标,降低成本意义重大。
技术实现要素:
为了解决上述现有技术中的问题,本发明提供一种工业发酵生产辅酶q10的方法。主要是将发酵液带放罐中的带放无菌料液的收集至接收罐进行二次发酵。带放料液需提供部分培养基用于新菌丝的生长繁殖和代谢产物的合成。通过对发酵过程指标的检测及时对补料时机和补料量进行调控,使菌丝保持良好的生产环境,即达到延长生长期提高发酵液产量的目的。由于带放的发酵液都处于生长旺盛期,起步效价高,在较短时间可获得较高的产量。同时由于带放的发酵液在培养罐中继续运转一定周期,使培养基中营养物质进一步被消耗利用,同时因为菌丝质量稳定过滤收率能显著提高,对产品质量的稳定起到一定作用。
为实现上述目的,本发明提供一种工业发酵生产辅酶q10的方法,技术方案如下:
本发明采用菌种为类球红细菌(rhodobactersphaeroides),已于2018年10月24日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏中心登记入册编号为cgmccno.16625。
本发明所提供的方法包括如下步骤:
s1:菌种的平板培养:将菌种接种于平板,放入温度32.0±0.5℃、湿度35%-45%的培养箱中培养5-7天;
s2:菌种的斜面培养;从s1中选择培养成熟的菌种,放入温度32.0±0.5℃、湿度35%-45%的培养箱中培养,培养周期为5-7天;
s3:20l种子培养;从s2中选择斜面培养成熟的菌种,放入灭菌后的20l种子罐中,培养条件为0-12h转速控制60~80rpm,13h后转速为160~200rpm,空气流量为0.6±0.2m3/h,温度32.0±1℃,培养22~30h;
s4:一级种子罐培养:待s3中种子液培养成熟后利用压差法按接种量0.1~0.5%接入一级种子罐中,一级种子罐培养条件为罐压0.03~0.05mpa,通气量100±20m3/h,罐温为32~34℃,转速180~200rpm,培养周期24~32h;
s5:二级种子培养:将s4中培养成熟的一级种子液利用压差法按接种量8~20%接入二级种子罐中,二级种子罐培养条件为罐压0.03~0.05mpa,通气量400±200m3/h,罐温为32~34℃,转速120~160rpm,培养周期18~26h;
s6:三级发酵培养:将s5中培养成熟的二级种子液利用压差法按接种量20~30%接入三级发酵罐中,三级发酵罐培养条件为罐压0.03~0.05mpa,发酵前40h通气量控制800±200m3/h,40h后至结束通气量控制1000±200m3/h,转速控制80~100rpm,罐温为32~34℃,发酵过程需要进行3次补料;
s7:倒种再培养发酵:选取s6中培养至50~65h符合纯种培养标准的1批或1批以上给出罐发酵液,将其转入同一个灭菌完成的接收罐中继续培养,接收罐的罐压0.03~0.05mpa,发酵前40h通气量控制800±200m3/h,40h后至结束通气量控制1000±200m3/h,转速控制80~100rpm,罐温为32~34℃,发酵过程需要进行3次补料。
进一步地,所述s1平板培养和步骤s2斜面培养所用的培养基配方为:酵母粉1.0-10.0g/l,磷酸二氢钾0.1-2.5g/l,硫酸镁1.0-5.0g/l,硫酸亚铁0.1-1.0g/l,氯化钠0-5.0g/l,硫酸铵1.5-3.5g/l,谷氨酸钠0.5-3.0g/l,玉米浆干粉0.5-3.0g/l,葡萄糖5-20g/l,琼脂15-20g/l,ph=6.5-7.3。
进一步地,所述s3中20l种子培养的培养罐培养基配方为:葡萄糖30-60g/l,硫酸铵10-30g/l,玉米浆干粉5-10g/l,谷氨酸钠1-10g/l,一水硫酸镁0.1-0.5g/l,酵母浸粉5-20g/l,工业盐15-30g/l,磷酸氢二钾5-10g/l,磷酸二氢钾5-10g/l,七水硫酸镁10-30g/l,七水硫酸亚铁1-10g/l,ph=6.5-7.3。
进一步地,所述s4中一级种子罐培养基配方为:葡萄糖0.1-0.4%,硫酸铵0.2-0.5%,磷酸氢二钾0.03-0.06%,磷酸二氢钾0.03-0.06%,七水硫酸镁0.1-0.3%,七水硫酸亚铁0.01-0.03%,工业盐0.1-0.4%,碳酸钙0.5-1.0%,消泡剂0.01-0.05%,玉米浆干粉0.03-0.08%,谷氨酸钠0.03-0.08%,一水硫酸镁0.001-0.005%,六水氯化钴0.0001-0.0005%,酵母浸粉0.1-0.5%,ph=6.5-7.3。
进一步地,所述s5中二级种子罐培养基配方为:葡萄糖1-2%,硫酸铵0.1-0.5%,磷酸氢二钾0.05-1.0%,磷酸二氢钾0.05-1.0%,七水硫酸镁0.1-0.5%,七水硫酸亚铁0.01-0.04%,工业盐0.1-0.5%,碳酸钙0.5-1.0%,消泡剂0.01-0.05%,玉米浆干粉0.05-0.15%,谷氨酸钠0.05-0.1%,一水硫酸镁0.005-0.015%,六水氯化钴0.0001-0.0005%,酵母浸粉0.1-0.5%,ph=6.5-7.3。
进一步地,所述s6中三级发酵培养中三级发酵罐培养基配方为:硫酸铵0.2-0.6%,磷酸二氢钾0.01-0.06%,七水硫酸镁1.0-1.5%,七水硫酸亚铁0.1-0.5%,工业盐0.1-0.5%,消泡剂0.01-0.05%,氯化钙0.005-0.01%,玉米浆干粉0.3-0.8%,谷氨酸钠0.1-0.5%,一水硫酸镁0.005-0.01%,ph=6.5-7.3。
进一步地,所述s4中发酵终点判断标准为:发酵液od≥5.0,还原糖浓度降至0~0.5g/l。
进一步地,所述s5中发酵终点判断标准为:发酵液od≥10.0,还原糖浓度降至0~0.5g/l。
进一步地,所述s6和s7中接种后每隔4h取样测定糖、磷、镜检观察菌形并监测染菌情况。
进一步地,所述s6的三级发酵和s7的倒种再培养发酵前40h控制糖浓度0.8~1.2%,发酵中期40~80h控制糖浓度0.5~0.8%,80h后至结束糖浓度控制在0.2%左右,发酵前4~40h控制补磷速度35~40l/h,40~65h补磷速度控制10~15l/h,65~80h补磷速度控制在25~30l/h。
进一步地,所述s6的三级发酵和s7的倒种再培养发酵过程需要进行3次补料,第一次补料时间为20-30h,第二次补料时间为40-50h,第三次补料时间为倒种前,培养周期90~105h。
进一步地,所述s6的三级发酵和s7的倒种再培养发酵过程补料配方为:硫酸铵0.5-1.0%,磷酸二氢钾0.1-0.5%,七水硫酸镁1.5-3.5%,七水硫酸亚铁0.1-0.5%,消泡剂0.1-0.3%,氯化钙0.01-0.03%,玉米浆干粉1.0-3.0%,谷氨酸钠0.5-1.0%,一水硫酸镁0.01-0.03%。
本发明所获得的有益效果:
1)简化工艺流程,降低染菌风险:现有工艺分别是第三次补料前(55h)、60小时左右、70小时左右。而采用带放再培养工艺将原工艺的3次带放简化为1次带放,同时减少了种子培养的过程。既精简工艺流程,又减少种子液和发酵料液的转移次数降低了染菌概率。
2)节约发酵成本,提升发酵产量:原工艺的三次带放都是直接带放到提取工段进行提取。而这三次带放会导致培养基的利用不充分,如新补如的料液会随带放排出,造成原辅料的浪费。从发酵周期考虑,前两次带放处于菌体的对数生长期,第三次带放正处于q10累计高峰期。所以原工艺3次带放会损失部分效价。通过采用带放再培养工艺,既可以节省原带放工艺物料损失,又可以通过培养带放延长菌株代谢生长期提高发酵效价。
3)有利于环保:因为原工艺3次带放的发酵液周期较短,发酵液中培养基消耗不完全且杂质含量高,有效单位低,导致提炼收率低,且工业盐质量不容易控制,低单位菌丝多造成低产量高排污,排放物中未利用的有机物多造成cod排放超标,从而增加了环保成本。通过采用带放再培养工艺则可以对以上问题进行改善。
4)增加工艺储备,增加排产:带放再培养工艺的开发为车间增加工艺选择,便于根据发酵实际情况选择合适工艺。同时带放再培养工艺的实施利于车间排产,一定程度上可以增加单月生产批次。
附图说明
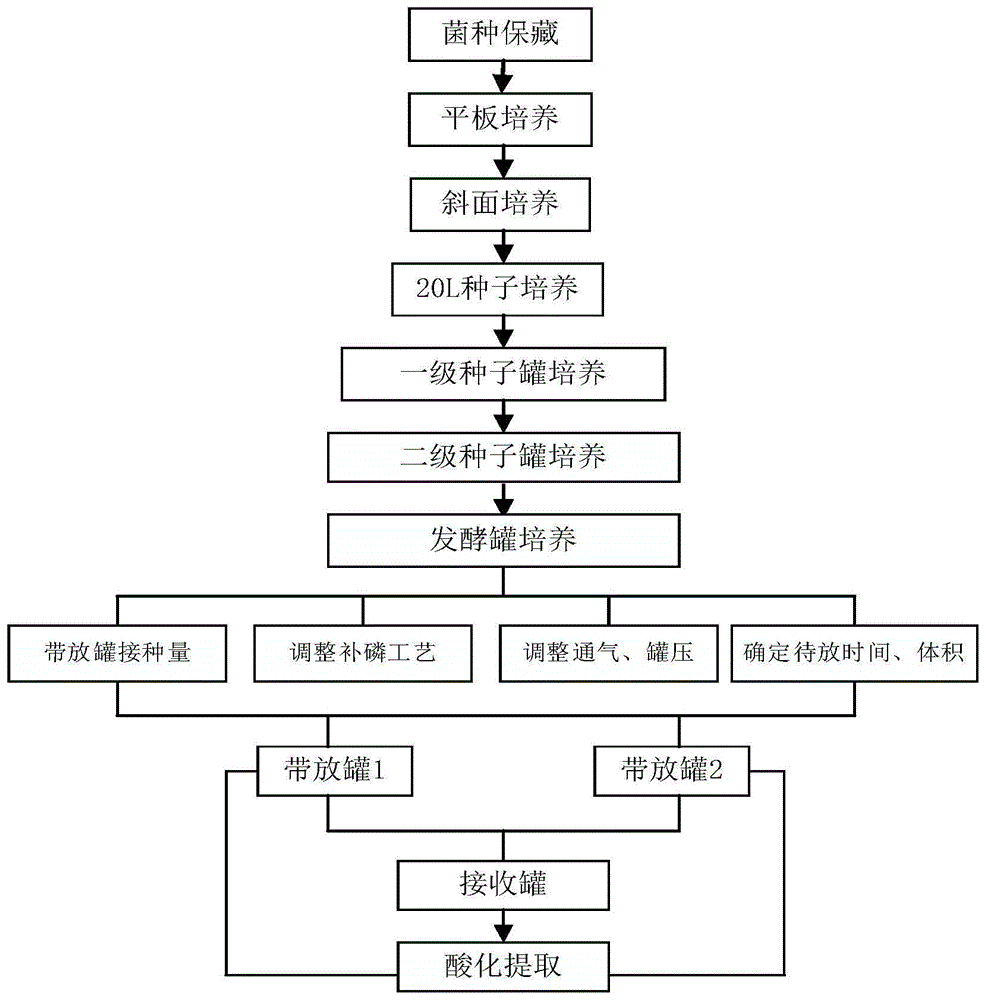
图1.本发明发酵工艺流程图;
图2.实施例1中“一带二”倒种工艺与原工艺发酵指标对比图;
图3.实施例2中“二带三”倒种工艺与原工艺发酵指标对比图。
具体实施方式
下面结合具体实施例对本发明作进一步描述,但本发明的保护范围并不仅限于此。
本发明发酵工艺流程图如图1所示。
本发明采用菌种为类球红细菌(rhodobactersphaeroides),已于2018年10月24日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏中心登记入册编号为cgmccno.16625。
实施例1-2中用到的培养基配方如下:
平板和斜面培养基(培养基a):酵母粉10.0g/l,磷酸二氢钾2.5g/l,硫酸镁2.0g/l,硫酸亚铁0.02g/l,硫酸锰0.03g/l,氯化钠2.0g/l,硫酸铵2.0g/l,谷氨酸钠1.0g/l,玉米浆干粉2.0g/l,葡萄糖10g/l,琼脂15-20g/l。
20l种子罐培养基(培养基b):葡萄糖50g/l,硫酸铵20g/l,玉米浆干粉5g/l,谷氨酸钠5g/l,一水硫酸镁0.3g/l,酵母浸粉10g/l,工业盐20g/l,磷酸氢二钾5.0g/l,磷酸二氢钾5.0g/l,七水硫酸镁20g/l,七水硫酸亚铁1.0g/l。
一级种子罐培养基(培养基c):葡萄糖0.4%,硫酸铵0.25%,磷酸氢二钾0.05%,磷酸二氢钾0.05%,七水硫酸镁0.2%,七水硫酸亚铁0.01%,工业盐0.2%,碳酸钙0.8%,消泡剂0.03%,玉米浆干粉0.05%,谷氨酸钠0.05%,一水硫酸镁0.003%,六水氯化钴0.0001%,酵母浸粉0.1%。
二级种子罐培养基(培养基d):葡萄糖1.5%,硫酸铵0.3%,磷酸氢二钾0.08%,磷酸二氢钾0.08%,七水硫酸镁0.35%,七水硫酸亚铁0.02%,工业盐0.2%,碳酸钙0.8%,消泡剂0.02%,玉米浆干粉0.1%,谷氨酸钠0.08%,一水硫酸镁0.01%,六水氯化钴0.00015%,酵母浸粉0.2%。
三级发酵罐培养基(培养基e):硫酸铵0.415%,磷酸二氢钾0.05%,七水硫酸镁1.3%,七水硫酸亚铁0.14%,工业盐0.25%,消泡剂0.015%,氯化钙0.008%,玉米浆干粉0.4%,谷氨酸钠0.3%,一水硫酸镁0.006%。
补料配方:硫酸铵0.65%,磷酸二氢钾0.2%,七水硫酸镁2.3%,七水硫酸亚铁0.21%,消泡剂0.1%,氯化钙0.01%,玉米浆干粉2.0%,谷氨酸钠0.6%,一水硫酸镁0.01%。
以上培养基的灭菌条件均为121℃灭菌30min。
补糖灭菌条件:60%液糖使用115.5±0.5℃灭菌25min。
液磷灭菌条件:0.08g/l磷酸二氢钾121±1℃灭菌30min。
实施例1“一带二”倒种工艺方法
s1菌种的平板培养:按照培养基a配方配制培养基并灭菌后,无菌条件下倒平板。用移液枪吸取1ml甘油菌悬液加入装有9ml无菌水的试管中,在漩涡振荡器上震荡、打散混匀,再用移液枪倍比稀释。用稀释度为10-5的菌悬液接种平板,每个平板内放入200-300μl菌悬液后,用已灭菌的涂布器涂布均匀。将涂布均匀的平板放入温度32.0±0.5℃、湿度35%-45%的培养箱中培养5-7天。
s2菌种的斜面培养:同上按照培养基a配方配制培养基并灭菌后,无菌条件下倾倒斜面。从培养成熟的母平板上,用接种铲挑选饱满、凸起、大小均匀的单菌落数颗,移入装有9ml无菌水的试管中,在漩涡振荡器上震荡、打散混匀,再用移液枪倍比稀释至10-5。用0.5ml吸管吸取菌悬液均匀涂布于试管内。放入温度32.0±0.5℃、湿度35%-45%的培养箱中培养,培养周期为5-7天。
s3:20l种子培养:取1-3支斜面并将试管外壁用酒精棉消毒后,用接种铲挑选饱满、凸起、大小均匀的单菌落数颗,移入装有50-60ml无菌水试管充分打散,然后将菌悬液移入灭菌后的20l种子罐中,培养条件为0-12h转速控制60~80rpm,13h后转速为160~200rpm,空气流量为0.6±0.2m3/h,温度32.0±1℃,培养22~30h。
s4:一级种子罐培养:待20l种子液培养成熟后利用压差法按接种量0.1~0.5%接入一级种子罐中,一级种子罐培养条件为罐压0.03~0.05mpa,通气量100±20m3/h,罐温为32~34℃,转速180~200rpm,培养周期24~32h。发酵终点判断标准:发酵液od≥5.0,还原糖浓度降至0~0.5g/l。
s5:二级种子培养:将培养成熟且无杂菌的一级种子液利用压差法按接种量8~20%接入二级种子罐中,二级种子罐培养条件为罐压0.03~0.05mpa,通气量400±200m3/h,罐温为32~34℃,转速120~160rpm,培养周期18~26h。发酵终点判断标准:发酵液od≥10.0,还原糖浓度降至0~0.5g/l。
s6:“一带二”倒种再培养工艺:将培养成熟且无杂菌的二级种子液利用压差法按接种量20~30%接入三级发酵罐中,选取发酵培养45~48h且检测符合纯种培养标准的发酵罐作为发酵液给出罐,将其中的发酵液均分转入另一个灭菌完成的接收罐中继续培养。通过附图2可以看出,“一带二”倒种工艺与原工艺放罐效价基本持平。因“一带二”倒种工艺发酵过程未进行3次带放,故放罐体积相比原工艺少30m3,相应放罐总亿略低于原工艺,间接印证了原工艺三次带放料液辅酶q10含量较低。同时与原工艺相比,“一带二”倒种工艺在糖单耗基本一致的情况下,每两批可减少一批各级种子罐的培养及一批发酵罐基础料的配制,平均每批的补磷、补氨量相对减少,降低工作量的同时减少成本。同时带放再培养工艺的实施利于车间排产,一定程度上可以增加单月生产批次,极大的提升设备利用率和发酵产量。
具体工艺控制见下表。
“一带二”倒种工艺控制
实施例2“二带三”倒种工艺实施
前期“平板种子-斜面种子-20l种子-一级种子-二级种子”发酵工艺控制基本一致。“二带三”倒种再培养工艺时,选取发酵培养45~65h且检测符合纯种培养标准的发酵罐作为发酵液给出罐,将其中的发酵液均分转入另一个灭菌完成的接收罐中继续培养。通过附图3可以看出,“二带三”倒种工艺放罐效价略高于原工艺,主要为两只带放罐倒种后,发酵液体积减少有效改善了发酵罐装料系数,提升发酵溶氧水平,从而促进放罐效价的提高。同样因“二带三”倒种工艺发酵过程未进行3次带放,故放罐体积相比原工艺少27m3,相应放罐总亿略低于原工艺,间接印证了原工艺三次带放料液辅酶q10含量较低。与原工艺相比,“二带三”倒种工艺在糖单耗基本一致的情况下,每三批可减少一批各级种子罐的培养及一批发酵罐基础料的配制,同时平均每批的补磷、补氨量相对减少,降低工作量的同时减少成本。同时带放再培养工艺的实施利于车间排产,一定程度上可以增加单月生产批次,极大的提升设备利用率和发酵产量。
具体工艺控制见下表。
- 还没有人留言评论。精彩留言会获得点赞!