一种增强大肠杆菌表面机械强度的方法与流程
本发明属于生物技术领域,涉及一种增强大肠杆菌表面机械强度的方法。
背景技术:
大肠杆菌是人和哺乳动物肠道中常见细菌,多为条件致病菌,可引起胃肠道感染、腹泻和尿路感染等。其广泛应用于各种生物学研究,如药物的抗菌性、毒性研究。大肠杆菌主要呈短杆棒状结构,长约2.5μm、宽约0.8μm,细胞壁由交联的聚合肽组成,可以承受住外界环境的渗透压,具有一定的硬度,能够保护大肠杆菌免于机械的碰撞,提高细菌的存活率。基于碰撞生存理论,在培养基中,细菌经常与其它细菌或细小颗粒发生碰撞,这些碰撞会导致剧烈的机械应力,从而损伤甚至杀死细菌。因此,为了维持细菌的整体形状和满足细胞的后续生长,细菌的细胞壁必须足够坚硬。
大肠杆菌表面机械强度的增强在许多科学研究中具有重要意义,如分子生物学,基因改造工程等。更硬的大肠杆菌具有更强的抗压能力,它可以让大肠杆菌抵御一定的机械损伤,特别是对于一些特殊类型的大肠杆菌,例如增长的大肠杆菌,具有更大的意义。此类特殊的大肠杆菌由于具有更大的体积,在振荡培养过程中更容易受到机械碰撞的损伤。因此,增强大肠杆菌的表面机械强度具有重要价值。
近年来,随着原子力显微镜(afm)在科学研究中的应用与发展,研究人员逐渐将afm技术应用到定量化测量细胞表面硬度。sarah等通过afm测量癌细胞的硬度,sullivan等用afm检测细胞壁缺失的大肠杆菌的机械强度,hsieh等通过afm观察细胞表面的超微结构并测量细胞表面的弹力和硬度。目前,大肠杆菌的硬度主要通过检测细胞壁的杨氏模量与弹性系数来测定。据报道可以通过原子力显微镜测定大肠杆菌的杨氏模量和细菌弹性系数,来量化大肠杆菌细胞壁的硬度。该方法主要是先将大肠杆菌表面指定位置靠近显微镜(原子力显微镜)尖端,然后在轻敲模式下通过afm扫描测得力曲线,测量并计算出细菌表面所有区域数据的平均数,包括中心区域和边缘区域,最后通过afm自带软件模块对曲线进行拟合,得到大肠杆菌细胞壁的杨氏模量和弹性系数。然而,对于如何增强细胞表面硬度的方法还在研究中,到目前为止,尚无有效的增强大肠杆菌表面机械强度的方法和报道。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种增强大肠杆菌表面机械强度的方法。
本发明的另一目的在于提供通过上述方法制备得到的高表面机械强度的大肠杆菌。
本发明的再一目的在于提供上述高表面机械强度的大肠杆菌的应用。
本发明的目的通过下述技术方案实现:一种增强大肠杆菌表面机械强度的方法,包括如下步骤:
(1)将大肠杆菌接种到培养基中,培养,稀释,再培养;
(2)向步骤(1)再培养后的大肠杆菌的培养基中加入表面活性剂,培养,得到表面机械强度增强的大肠杆菌。
步骤(1)中所述的大肠杆菌包括普通大肠杆菌和经过特殊处理得到的大肠杆菌。
步骤(1)中所述的大肠杆菌的品系优选为e.colitop10、e.colipd1b10、e.colibl21、e.colimg1655中的一种;更优选为e.colitop10。
所述的经过特殊处理得到的大肠杆菌为采用头孢氨苄(cex)处理得到的超长大肠杆菌。
步骤(1)中所述的培养基为lb培养基,其配制:10g/l氯化钠、5g/l酵母提取物和10g/l胰蛋白胨,双蒸水补至1l;调节ph至7.0,在0.1mpa、121℃下灭菌30min。
步骤(1)中所述的培养为37℃、200rpm培养12h。
步骤(1)中所述的稀释是将培养得到的菌液以培养基调节至od600=0.5,之后稀释1000倍。
步骤(1)中所述的再培养为37℃、200rpm培养2h。
步骤(2)中所述的表面活性剂优选为阳离子表面活性剂ctab、阴离子表面活性剂sds和非离子表面活性剂tween中的一种。
所述的非离子表面活性剂tween优选为tween-20。
所述的表面活性剂为ctab时,其用量为按其在培养基中浓度为质量比0.0006-0.0015%配比;优选为按其在培养基中浓度为质量比0.001%配比。
所述的表面活性剂为sds时,其用量为按其在培养基中浓度为质量比0.07-0.15%配比;优选为按其在培养基中浓度为质量比0.1%配比。
所述的表面活性剂为tween-20时,其用量为按其在培养基中浓度为质量比0.5-1.5%配比;优选为按其在培养基中浓度为1%配比。
步骤(2)中所述的培养为37℃培养4-8h;优选为37℃培养4h。
步骤(2)中所述的培养的转速:当大肠杆菌为普通大肠杆菌时转速为200rpm;当大肠杆菌为经过特殊处理得到的大肠杆菌时转速为60rpm。
一种高表面机械强度的大肠杆菌,通过上述方法制备得到。
上述高表面机械强度的大肠杆菌在生物科学研究中的应用。
上述高表面机械强度的大肠杆菌在细菌检测中的应用。
本发明相对于现有技术,具有如下的优点及效果:
1、本发明的方法制备的大肠杆菌表面机械强度高,具有更强的抗机械损伤能力,且具有良好的生物学活性,因此,本发明的方法在生物科学研究中具有重要价值。
2、本发明的方法对于特殊处理的大肠杆菌,如超长大肠杆菌同样适用,具有广阔的市场前景。
附图说明
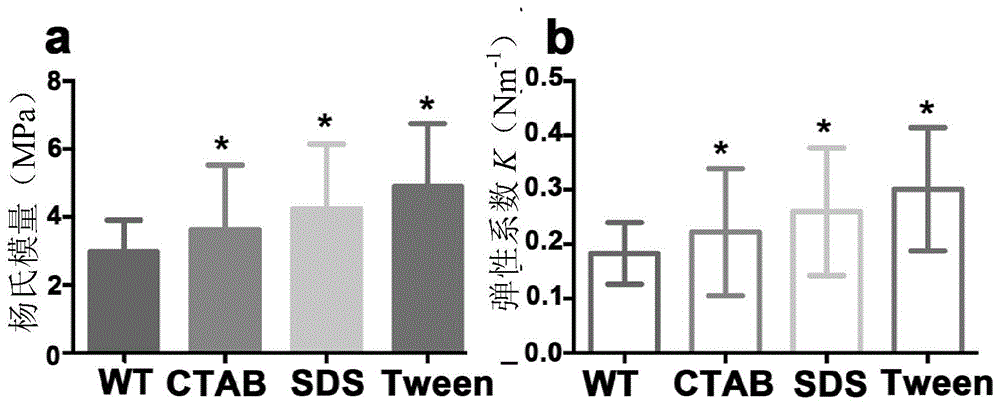
图1是表面活性剂对普通大肠杆菌细胞壁硬度的影响结果图;其中,a是杨氏模量统计结果;b是弹性系数统计结果。
图2是实施例1采用ctab处理后的大肠杆菌电镜图。
图3是表面活性剂对普通大肠杆菌生长状况的影响结果图。
图4是表面活性剂对超长大肠杆菌细胞壁硬度的影响结果图;其中,a是杨氏模量统计结果;b是弹性系数统计结果。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。
本发明中未标注的试剂和原料均为市场上购买所得。
实施例1ctab增强普通大肠杆菌表面机械强度
①用分析天平称取1.0g氯化钠、0.5g酵母提取物和1.0g胰蛋白胨溶于100ml双蒸水中,配制lb培养基,并调节ph至7.0,在0.1mpa、121℃下灭菌30min。
②选择大肠杆菌e.colitop10作为试验用菌株,接种于lb培养基,移至锥形瓶中(采用250ml锥形瓶,下同),在37℃、200rpm有氧条件下振荡培养12h。
③大肠杆菌过夜培养12h后,使用分光光度计测定菌液在600nm波长下的吸光度,并用lb培养基调节吸光度至0.5。
④将吸光度为0.5的菌液用培养基稀释1000倍,并接种至lb培养基,移至锥形瓶中,在37℃、200rpm有氧条件下,再培养2h。
⑤向④再培养后的菌液中加入采用水配制的ctab溶液(至其在培养基中的浓度为0.001%(w/w)),在37℃、200rpm有氧条件下振荡培养4h,培养结束。
实施例2sds增强普通大肠杆菌表面机械强度
①用分析天平称取1.0g氯化钠、0.5g酵母提取物和1.0g胰蛋白胨溶于100ml双蒸水中,配制lb培养基,并调节ph至7.0,在0.1mpa、121℃下灭菌30min。
②选择大肠杆菌e.colitop10作为试验用菌株,接种于lb培养基,移至锥形瓶中(采用250ml锥形瓶,下同),在37℃、200rpm有氧条件下振荡培养12h。
③大肠杆菌过夜培养12h后,使用分光光度计测定菌液在600nm波长下的吸光度,并用lb培养基调节吸光度至0.5。
④将吸光度为0.5的菌液用培养基稀释1000倍,并接种至lb培养基,移至锥形瓶中,在37℃、200rpm有氧条件下再培养2h。
⑤向④再培养后的菌液加入sds溶液(至其在培养基中的浓度为0.1%(w/w)),在37℃、200rpm有氧条件下振荡培养4h,培养结束。
实施例3tween-20增强普通大肠杆菌表面机械强度
①用分析天平称取1.0g氯化钠、0.5g酵母提取物和1.0g胰蛋白胨溶于100ml双蒸水中,配制lb培养基,并调节ph至7.0,在0.1mpa、121℃下灭菌30min。
②选择大肠杆菌e.colitop10作为试验用菌株,接种于lb培养基,移至锥形瓶中(采用250ml锥形瓶,下同),在37℃、200rpm有氧条件下振荡培养12h。
③大肠杆菌过夜培养12h后,使用分光光度计测定菌液在600nm波长下的吸光度,并用lb培养基调节吸光度至0.5。
④将吸光度为0.5的菌液用培养基稀释1000倍,并接种至lb培养基,移至锥形瓶中,在37℃、200rpm有氧条件下再培养2h。
⑤向④再培养后的菌液加入tween-20溶液(至其在培养基中的浓度为1%(w/w)),在37℃、200rpm有氧条件下振荡培养4h,培养结束。
实施例4超硬大肠杆菌的表征
(1)大肠杆菌表面机械强度的测定
大肠杆菌的细胞壁由交联的聚合肽组成,来承受住外界环境的渗透压和维持细菌的整体形状。采用原子力显微镜测定大肠杆菌的细胞壁硬度,通过杨氏模量和细菌弹性系数来量化大肠杆菌细胞壁的硬度。杨氏模量是通过afm尖端压入细胞壁而获得的,当afm尖端与细胞壁一起移动时,计算细菌弹性系数。杨氏模量值越大,大肠杆菌细胞壁的硬度就越高。
①将20μl(107cfu/ml)实施例1-3获得的大肠杆菌溶液(实施例1中未经过表面活性剂处理的再培养大肠杆菌作为未处理组wt)分别置于云母表面,力常数为3n/m。
②不断将大肠杆菌表面指定位置靠近显微镜尖端,在轻敲模式下通过afm扫描测得力曲线。
③测量并计算出细菌表面所有区域数据的平均数,包括中心和边缘区域。采用afm自带软件模块对曲线进行拟合,得到大肠杆菌细胞壁的杨氏模量和弹性系数。
结果如图1所示。不同表面活性剂处理的大肠杆菌杨氏模量都有显著增强效果(图1a),未处理大肠杆菌的杨氏模量为2.985mpa,其中,经tween-20处理的细菌杨氏模量值最高,是未处理组的1.67倍;其次是sds处理的大肠杆菌,约为未处理组的1.42倍;而经ctab处理的大肠杆菌杨氏模量值最低,是未处理组的1.24倍。不同表面活性剂处理的大肠杆菌弹性系数与杨氏模量一样显著性增大(图1b),未处理大肠杆菌弹性系数仅为0.1832n/m,其中,经tween-20处理的弹性系数最大,是未处理组的1.64倍;其次是sds处理的大肠杆菌,是未处理组的1.45倍;最小的是ctab处理的大肠杆菌,是未处理组的1.20倍。
以上普通大肠杆菌表面机械强度的测定说明,相比于未处理组的大肠杆菌,三种不同表面活性剂的处理均能增加普通大肠杆菌的表面机械强度;其中,1%(w/w)tween-20对大肠杆菌硬度的增强效果最好,是未处理组的1.67倍;其次是0.1%(w/w)sds;而0.001%(w/w)ctab对大肠杆菌硬度的增强效果是未处理组的1.24倍。图2是实施例1经ctab处理获得的大肠杆菌的表面电镜图。
(2)表面活性剂对大肠杆菌生长影响的测定
①分别收集实施例1-3不同表面活性剂处理4h获得的大肠杆菌菌液(实施例1中未经过表面活性剂处理的再培养大肠杆菌作为未处理组wt)。
②使用分光光度计在波长600nm下测定①中收集菌液的吸光度,来表征表面活性剂对大肠杆菌生长状况的影响。每组重复测量三次,取平均值。
结果如图3所示,不同表面活性剂对普通大肠杆菌的生长有显著性差异,0.001%(w/w)ctab对细菌的生长有很强的抑制作用,大肠杆菌的生长被抑制了约80%;而0.1%(w/w)sds和1%(w/w)tween-20处理后对大肠杆菌的生长无明显影响。
实施例5ctab增强特殊大肠杆菌表面机械强度
本实施例采用经过特殊处理而长度增加的超长大肠杆菌为例说明本申请的广泛适用性。
①用分析天平称取1.0g氯化钠、0.5g酵母提取物和1.0g胰蛋白胨溶于100ml双蒸水中,配制lb培养基,并调节ph至7.0,在0.1mpa、121℃下灭菌30min。
②选择大肠杆菌e.colitop10作为试验用菌株,接种于lb培养基,移至锥形瓶中(采用250ml锥形瓶,下同),在37℃、200rpm有氧条件下振荡培养12h。
③大肠杆菌过夜培养12h后,使用分光光度计测定菌液在600nm波长下的吸光度,并用lb培养基调节吸光度至0.5。
④将吸光度为0.5的菌液用培养基稀释1000倍,并接种至lb培养基,移至锥形瓶中,在37℃、200rpm有氧条件下,再振荡培养2h。
⑤向④再培养后的菌液加入90μg/ml头孢氨苄制作超长大肠杆菌。
⑥之后向⑤中加入ctab(至其在培养基中的浓度为0.001%(w/w)),在37℃、60rpm有氧条件下振荡培养4h,培养结束。
实施例6sds增强特殊大肠杆菌表面机械强度
本实施例采用经过特殊处理而长度增加的超长大肠杆菌为例说明本申请的广泛适用性。
①用分析天平称取1.0g氯化钠、0.5g酵母提取物和1.0g胰蛋白胨溶于100ml双蒸水中,配制lb培养基,并调节ph至7.0,在0.1mpa、121℃下灭菌30min。
②选择大肠杆菌e.colitop10作为试验用菌株,接种于lb培养基,移至锥形瓶中(采用250ml锥形瓶,下同),在37℃、200rpm有氧条件下振荡培养12h。
③大肠杆菌过夜培养12h后,使用分光光度计测定菌液在600nm波长下的吸光度,并用lb培养基调节吸光度至0.5。
④将吸光度为0.5的菌液用培养基稀释1000倍,并接种至lb培养基,移至锥形瓶中,在37℃、200rpm有氧条件下,再振荡培养2h。
⑤向④再培养后的菌液加入90μg/ml头孢氨苄制作超长大肠杆菌。
⑥之后向⑤中加入sds(至其在培养基中的浓度为0.1%(w/w)),在37℃、60rpm有氧条件下振荡培养4h,培养结束。
实施例7tween-20增强特殊大肠杆菌表面机械强度
本实施例采用经过特殊处理而长度增加的超长大肠杆菌为例说明本申请的广泛适用性。
①用分析天平称取1.0g氯化钠、0.5g酵母提取物和1.0g胰蛋白胨溶于100ml双蒸水中,配制lb培养基,并调节ph至7.0,在0.1mpa、121℃下灭菌30min。
②选择大肠杆菌e.colitop10作为试验用菌株,接种于lb培养基,移至锥形瓶中(采用250ml锥形瓶,下同),在37℃、200rpm有氧条件下振荡培养12h。
③大肠杆菌过夜培养12h后,使用分光光度计测定菌液在600nm波长下的吸光度,并用lb培养基调节吸光度至0.5。
④将吸光度为0.5的菌液用培养基稀释1000倍,并接种至lb培养基,移至锥形瓶中,在37℃、200rpm有氧条件下,再振荡培养2h。
⑤向④再培养后的菌液加入90μg/ml头孢氨苄制作超长大肠杆菌。
⑥之后向⑤中加入tween-20(至其在培养基中的浓度为1%(w/w)),在37℃、60rpm有氧条件下振荡培养4h,培养结束。
实施例8
采用实施例4相同的方法测定实施例5-7获得的大肠杆菌的表面机械强度。
表面机械强度测定结果如图4所示。头孢氨苄处理的超长大肠杆菌杨氏模量为4.323mpa,其中,1%tween-20处理的超长大肠杆菌(90μg/ml头孢氨苄处理)杨氏模量最高,约为头孢氨苄单独处理时的1.41倍;其次是0.1%sds处理的超长大肠杆菌(90μg/ml头孢氨苄处理),约为头孢氨苄单独处理时的1.34倍;而经0.001%ctab处理的超长大肠杆菌(90μg/ml头孢氨苄处理)杨氏模量最低,约为头孢氨苄单独处理时的1.13倍(图4a)。
不同表面活性剂处理的超长大肠杆菌弹性系数与杨氏模量一样显著性增大(图4b),其中,1%tween-20处理的超长大肠杆菌(90μg/ml头孢氨苄处理)弹性系数最大,约为头孢氨苄单独处理时的1.41倍;其次是0.1%sds处理的超长大肠杆菌(90μg/ml头孢氨苄处理),约为头孢氨苄单独处理时的1.34倍;而经0.001%ctab处理的超长大肠杆菌(90μg/ml头孢氨苄处理)弹性系数最小,约为头孢氨苄单独处理时的1.13倍。
以上超长大肠杆菌表面机械强度的测定说明,相比头孢氨苄处理产生的超长大肠杆菌,三种表面活性剂均能增加其表面机械强度,其中,1%(w/w)tween-20的增强效果最好,为超长大肠杆菌的1.41倍;其次是0.1%(w/w)sds,为超长大肠杆菌的1.34倍;而0.001%(w/w)ctab对大肠杆菌硬度的增强效果为超长大肠杆菌的1.13倍。特殊处理后的大肠杆菌仍然可以通过本方法增加机械强度。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!