一种大规模发酵铁蛋白的方法与流程
本发明涉及生物医学工程技术领域,具体涉及一种大规模发酵铁蛋白的方法。
背景技术:
铁蛋白是一类广泛存在于动物、植物及微生物中的天然铁贮存蛋白。在人体或其他哺乳动物体内分离的铁蛋白通常由两种不同的铁蛋白亚基(h亚基和l亚基)构成,h亚基和l亚基的分子质量分别为21kda和19kda。典型的铁蛋白结构是由24个h亚基/l亚基自组装形成的笼状结构,外径12nm,内部形成直径8nm的内腔结构。笼状结构容纳包含多达4500个铁原子的铁核。
由于铁蛋白其具有可包裹药物的笼状结构、显著的稳定性、较小且均一的尺寸,本领域已经尝试将铁蛋白用作药物载体以递送药物,例如可见ferritin-baseddrugdeliverysystems:hybridnanocarriersforvascularimmunotargeting,makankhoshnejadet.al,journalofcontrolledrelease282(2018)13-24。
wo2015180325a1描述了由重组方法制备获得的仅由h亚基自组装成的铁蛋白(hfn),由于其能够与受体tfr1结合而靶向肿瘤细胞,从而可以用作肿瘤特异性给药的药物载体。wo2018153372a1则教导了hfn可用作能够穿越血脑屏障的纳米药物载体。此外,重组铁蛋白还可作为医学成像、延长活性药物半衰期、诊断检测等用途。
与其他纳米药物载体相比,铁蛋白由于来自生物体内,是一种天然存在的蛋白质,不具备免疫原性,且其空腔内载药量大,加上hfn的主动肿瘤靶向性,因此具有广阔的作为药物递送载体的应用前景。
采用基因工程方法可以获得重组的铁蛋白。但是,目前通过重组技术制备铁蛋白的方法多处于实验室或小试阶段,缺乏大规模发酵培养的成熟工艺。如中国专利申请cn101921798a公开了一种基因重组人铁蛋白轻链的制备方法,该专利申请使用lb培养基进行摇瓶培养,是实验室规模的小量培养方式,发酵效率低,该发酵方法不适合包载药物,不适用于大规模发酵培养。cn104017089a公开了一种hfn纳米粒子的制备方法和用途,其同样是采用lb培养基摇瓶小规模培养,且其重点在于铁蛋白亚基的复性而非发酵工艺的研究。
另外,由于发酵过程中一系列因素的影响,使得制备的铁蛋白纯化难度大,费用高,导致载药量低、杂质多、稳定性差等问题。如中国专利申请cn1257931a公开了一种可用于人体补铁的铁蛋白及其制备方法和应用,但其发酵过程中菌体生长速率较低,而且制备的铁蛋白是补铁用的菌剂,包载药物的效果较差。
因此,本领域需要开发一种适宜大规模制备铁蛋白,即发酵效率高、成本低、铁蛋白质量均一、稳定、易纯化的铁蛋白发酵方法。
技术实现要素:
本发明的目的是克服现有技术的不足而提供一种发酵效率高、成本低、易于规模化操作、工艺稳定性优异的铁蛋白的发酵方法。
本发明的一个方面,是提供一种发酵制备铁蛋白的方法,所述方法包括如下步骤:
(1)将包含铁蛋白编码基因的重组大肠杆菌的种子液接种于发酵培养基中进行培养;
(2)发酵培养至od600在30-60时,加入诱导剂,得到发酵液;
(3)收集发酵液中的菌体;
(4)破碎收集的菌体,离心,取上清液,即得。
所述的发酵培养基由如下组分组成:酵母蛋白胨、酵母抽提物、氯化钠、氯化铵、十二水合磷酸氢二钠、磷酸二氢钾、七水合硫酸镁和葡萄糖。
优选地,所述的发酵培养基由如下组分组成:酵母蛋白胨10-20g/l、酵母抽提物8-16g/l、氯化钠0.5-2g/l、氯化铵0.5-3g/l、十二水合磷酸氢二钠8-16g/l、磷酸二氢钾1-4g/l、七水合硫酸镁0.1-1g/l和葡萄糖10-20g/l。
更优选地,所述的发酵培养基由如下组分组成:酵母蛋白胨14-18g/l、酵母抽提物10-14g/l、氯化钠0.5-2g/l、氯化铵0.5-3g/l、十二水合磷酸氢二钠10-14g/l、磷酸二氢钾1-4g/l、七水合硫酸镁0.1-1g/l和葡萄糖12-16g/l。
优选地,所述诱导剂为阿拉伯糖或异丙基-β-d-硫代半乳糖苷(iptg)。
更优选地,所述诱导剂为阿拉伯糖。
更优选地,所述阿拉伯糖的浓度为2-10g/l,所述iptg的浓度为0.02-0.1g/l。
所述铁蛋白可选自来源于哺乳动物来源的铁蛋白、两栖类动物来源的铁蛋白、细菌来源的铁蛋白或植物来源的铁蛋白,优选为哺乳动物来源或细菌来源的铁蛋白单体。
所述哺乳动物来源的铁蛋白包括人源性铁蛋白、鼠源性铁蛋白或马脾脏铁蛋白,优选人源性铁蛋白。
所述细菌来源的铁蛋白包括幽门螺杆菌铁蛋白、大肠杆菌铁蛋白或激烈火球菌铁蛋白,优选激烈火球菌铁蛋白。
所述铁蛋白的来源包括天然提取产物、人工合成产物或基因工程技术产物。
所述铁蛋白还包括铁蛋白突变体及铁蛋白衍生物。铁蛋白突变体指在铁蛋白氨基酸序列的基础上,进行氨基酸的置换、截短、延长等操作,但仍具有与铁蛋白相同包载功能的蛋白。铁蛋白衍生物指包含经过人工改造的(经修饰的)铁蛋白亚基的铁蛋白。本领域已知多种经人工改造的铁蛋白亚基,该衍生物适用于其中一个或多个氨基酸残基是相应的天然氨基酸的人工化学类似物的氨基酸聚合物,以及适用于天然氨基酸的聚合物。人工改造(经修饰)的形式,包括但不限于糖基化、脂质连接、硫酸盐化、谷氨酸残基的γ羧化、羟化和adp-核糖基化。
优选地,所述步骤(1)包括如下步骤:将含有铁蛋白编码基因的重组大肠杆菌接种在lb培养基中,得到种子液,当培养至所述种子液的od600在1.0~3.0时,将所述种子液接种于发酵培养基中进行培养。
更优选地,所述步骤(1)包括如下步骤:将含有铁蛋白编码基因的重组大肠杆菌菌种按0.5-3%接种在含有0-50mg/l硫酸链霉素的lb培养基中,得到种子液,当所述种子液的od600在1.5~2.5时,按0.5-1.5%的接种量接种于发酵培养基中进行培养。
本发明中的接种百分数没有特殊说明,均为体积百分数。
优选地,所述步骤(2)包括如下步骤:
在适宜大肠杆菌生长的条件下进行发酵培养,发酵培养od600至30-60时,加入诱导剂,诱导10-20h后终止发酵,得到发酵液。
更优选地,所述适宜大肠杆菌生长的条件为:ph6.5-7.5,温度25-40℃,维持所述发酵培养基的溶氧浓度(do)20%以上。
更优选地,所述溶氧浓度为30-60%。
优选地,步骤(2)中还包括补料培养的步骤。所述补料培养是当所述发酵培养基中的碳源耗尽时进行补料。
更优选地,当所述发酵培养基中的碳源耗尽时进行补料,补料培养至od600在30-60,优选45-55时,加入诱导剂,诱导10-20h后终止发酵,得到发酵液。
更优选地,当所述发酵培养基中的碳源耗尽时进行第一次补料,od600在45-55时,停止补料,而后加入诱导剂,5-20min后进行第二次补料,诱导10-20h后终止发酵,得到发酵液。
更优选地,所述步骤(2)包括如下步骤:
所述发酵培养基的溶氧浓度20%以上,ph6.5-7.5,温度28-38℃,当所述发酵培养基中的碳源耗尽后开始第一次补料,od600在45-55时,停止补料,加入诱导剂,5-20min后再次开始第二次补料,诱导10-20h后终止发酵,得到发酵液。
更优选地,所述补料的培养基配方如下:酵母提取物60-200g/l,葡萄糖300-500g/l,七水合硫酸镁5-15g/l。
更优选地,所述第一次补料期内通过调控补料速率维持菌体的比生长速率为0.08~0.16h-1。
更优选地,所述第二次补料期内通过调控补料速率维持菌体的比生长速率为0.02~0.08h-1。
例如,第一次补料方式为:0-1h的补料速率为3-5ml/l/h,1h以后的补料速率为5-6ml/l/h;第二次补料方式为:0-6h的补料速率为5-6ml/l/h,6h以后的补料速率为6-7ml/l/h。
优选地,所述步骤(3)包括如下步骤:以离心方式收集菌体。
更优选地,将所述发酵液在2-25℃条件下,以离心方式,收集菌体。
优选地,所述步骤(4)包括如下步骤:裂解收集的菌体,离心取上清液,即得。
更优选地,取步骤(3)收集的菌体用缓冲液重悬,裂解2-4次,离心,取上清液,即得。
更优选地,所述缓冲液为10-50mmtris-hcl(ph7.5~8.5)缓冲液。
更优选地,所述裂解采用高压均质机裂解。
更优选地,所述离心条件为5000-12000rpm离心15-25min。
更优选地,所述发酵培养铁蛋白的方法包括如下步骤:
(1)将含有铁蛋白编码基因的重组大肠杆菌菌种按0.5-3%接种在含有0-50mg/l硫酸链霉素的lb培养基中,得到种子液,当所述种子液的od600在1.5~2.5时,按0.5-1.5%接种于发酵培养基中;
(2)在ph6.5-7.5,温度28-38℃条件下发酵培养,维持所述发酵培养基的溶氧浓度(do)20%以上,当所述发酵培养基中的碳源耗尽时,进行第一次补料,od600在45-55时,停止补料,加入诱导剂,5-20min后进行第二次补料,诱导10-20h后终止发酵,得到发酵液;
(3)将所述发酵液在2-8℃以5000-12000rpm离心15-30min,收集留样菌体;
(4)取所述留样菌体用15-25mm缓冲液重悬,高压均质机裂解2-4次,离心,取上清液,在-80℃保存,即得。
本发明的第二方面,是提供一种适合大规模发酵铁蛋白的发酵培养基,所述发酵培养基由如下组分组成:酵母蛋白胨、酵母抽提物、氯化钠、氯化铵、十二水合磷酸氢二钠、磷酸二氢钾、七水合硫酸镁和葡萄糖。
优选地,所述的发酵培养基由如下组分组成:酵母蛋白胨10-20g/l、酵母抽提物8-16g/l、氯化钠0.5-2g/l、氯化铵0.5-3g/l、十二水合磷酸氢二钠8-16g/l、磷酸二氢钾1-4g/l、七水合硫酸镁0.1-1g/l和葡萄糖10-20g/l。
更优选地,所述的发酵培养基由如下组分组成:酵母蛋白胨14-18g/l、酵母抽提物10-14g/l、氯化钠0.5-2g/l、氯化铵0.5-3g/l、十二水合磷酸氢二钠10-14g/l、磷酸二氢钾1-4g/l、七水合硫酸镁0.1-1g/l和葡萄糖12-16g/l。
本发明的第三个方面,还涉及上述的发酵培养基在制备铁蛋白中的应用。
本发明的第四个方面,还涉及由上述的发酵方法或发酵培养基发酵获得的铁蛋白。
本发明的第五个方面,还涉及由上述的发酵方法和/或发酵培养基获得的铁蛋白在包载药物中的应用。
本发明的有益效果是:
1、本发明优化配制的发酵培养基中不包含微量元素,与使用微量元素的无机盐培养基以及传统的lb培养基相比,发酵效率和包载效果显著提升。
2、本发明在发酵过程中进行两次补料,提供了优化的补料方式,发酵效率和包载效果进一步提高。
3、本发明提供了优化的补料培养基配方,进一步提高了发酵效率和包载效果。
4、本发明优化了发酵步骤及参数,明显提高了发酵效率和包载效果。
附图说明
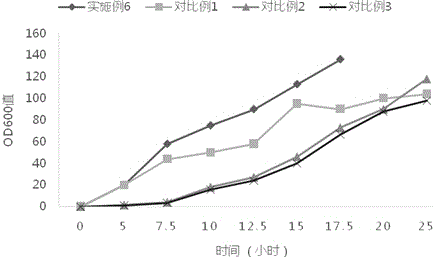
图1为实施例6和对比例1-3菌体生长过程曲线。
图2为实施例1-6和对比例1-3诱导表达蛋白的sds-page图。
图3为10l放大发酵菌体生长和蛋白表达曲线。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1
(1)种子培养:从-80℃冰箱取出一支冻存种子(包含人hfn编码基因的大肠杆菌bw25113,其通过将人hfn编码基因序列,即核苷酸序列(序列1)插入质粒psb1s的ncoi/xhoi位点构建,转化大肠杆菌bw25113获得),于室温解冻,将1ml种子按0.5%(v/v)接种在含有40mg/l硫酸链霉素的lb培养基的锥形瓶(500ml)中,得到种子液,当种子液的od600在1.6时,按0.5%接种量将种子液以火焰接种法接种于含有发酵培养基的发酵罐中。
发酵培养基由如下组分组成:酵母蛋白胨14g/l、酵母抽提物10g/l、氯化钠0.5g/l、氯化铵0.5g/l、十二水合磷酸氢二钠10g/l、磷酸二氢钾1g/l、七水合硫酸镁0.1g/l和葡萄糖12g/l。
(2)发酵培养:
维持发酵培养基的溶氧浓度(do)23%,在ph6.5,温度35℃条件下发酵;当od600在45时,加入2g/l阿拉伯糖启动目的蛋白的表达,诱导10h后终止发酵,得到发酵液。发酵液中碳源检测方法为每4h取发酵样,检测od600、ph及残糖量。
(3)菌体收集:取20ml发酵液在2℃以5000rpm离心15min,收集菌体;
(4)样品制备:取收集的菌体用15mmtris-hcl(ph8.0)缓冲液重悬至20ml,于高压均质机900bar裂解2次,于8000rpm离心15min,取上清液,在-80℃保存,即得。
实施例2
(1)种子培养:从-80℃冰箱取出一支冻存种子,于室温解冻,将1ml种子按3%(v/v)接种在含有60mg/l硫酸链霉素的lb培养基的锥形瓶(500ml)中,得到种子液,当种子液的od600在2.2时,按1.5%接种量将种子液以火焰接种法接种于含有发酵培养基的发酵罐中。
发酵培养基由如下组分组成:酵母蛋白胨18g/l、酵母抽提物14g/l、氯化钠2g/l、氯化铵2g/l、十二水合磷酸氢二钠14g/l、磷酸二氢钾4g/l、七水合硫酸镁1g/l和葡萄糖16g/l。
(2)发酵培养:
维持发酵培养基的溶氧浓度(do)35%,在ph7.3,温度40℃条件下发酵;当od600在55时,加入10g/l阿拉伯糖启动目的蛋白的表达,诱导20h后终止发酵,得到发酵液。
(3)菌体收集:取20ml发酵液在6℃以6500rpm离心25min,收集菌体;
(4)样品制备:收集的菌体用25mmtris-hcl(ph8.0)缓冲液重悬至20ml,于高压均质机1000bar裂解4次,于12000rpm离心25min,取上清液,在-80℃保存,即得。
实施例3
(1)种子培养:从-80℃冰箱取出一支冻存种子,于室温解冻,将1ml种子按1%(v/v)接种在含有50mg/l硫酸链霉素的lb培养基的锥形瓶(500ml)中,得到种子液,当种子液的od600在1.9时,按1%接种量将种子液以火焰接种法接种于含有发酵培养基的发酵罐中。
发酵培养基由如下组分组成:酵母蛋白胨20g/l、酵母抽提物16g/l、氯化钠1.2g/l、氯化铵1.2g/l、十二水合磷酸氢二钠16g/l、磷酸二氢钾2g/l、七水合硫酸镁0.5g/l和葡萄糖16g/l。
(2)发酵培养:
维持发酵培养基的溶氧浓度(do)32%,在ph6.8,温度38℃条件下发酵;当od600在48时,加入5g/l阿拉伯糖启动目的蛋白的表达,诱导12h后终止发酵,得到发酵液。
(3)取20ml发酵液在4℃以5900rpm离心20min,收集菌体;
(4)样品制备:收集的菌体用20mmtris-hcl(ph8.0)缓冲液重悬至20ml,于高压均质机950bar裂解3次,于9500rpm离心20min,取上清液,在-80℃保存,即得。
实施例4
与实施例3的区别仅在于步骤(2)不同,具体如下:
维持发酵培养基的溶氧浓度(do)32%,在ph6.8,温度38℃条件下发酵;当发酵培养基中的碳源耗尽后进行第一次补料,0-1h的补料速率为3ml/l/h,1h以后的补料速率为5ml/l/h,控制菌体比生长速率为0.1h-1。当od600在48时,进入诱导表达期。进入诱导表达期后停止补料,加入5g/l阿拉伯糖启动目的蛋白的表达,5min后进行第二次补料,0-6h的补料速率为5ml/l/h,6h以后的补料速率为6ml/l/h,控制菌体比生长速率为0.03h-1。诱导12h后终止发酵,得到发酵液;
第一次和第二次补料的培养基配方如下:酵母提取物180g/l,葡萄糖450g/l,七水合硫酸镁5g/l。
实施例5
与实施例3的区别仅在于步骤(2)不同,具体如下:
维持发酵培养基的溶氧浓度(do)32%,在ph6.8,温度38℃条件下发酵;当发酵培养基中的碳源耗尽后进行第一次补料,0-1h的补料速率为5ml/l/h,1h以后的补料速率为6ml/l/h,控制菌体比生长速率为0.16h-1。当od600在48时,进入诱导表达期。进入诱导表达期后停止补料,加入5g/l阿拉伯糖启动目的蛋白的表达,20min后进行第二次补料,0-6h的补料速率为6ml/l/h,6h以后的补料速率为7ml/l/h,控制菌体比生长速率为0.07h-1。诱导12h后终止发酵,得到发酵液;
第一次和第二次补料的培养基配方如下:酵母提取物220g/l,葡萄糖550g/l,七水合硫酸镁15g/l。
实施例6
与实施例3的区别仅在于步骤(2)不同,具体如下:
维持发酵培养基的溶氧浓度(do)32%,在ph6.8,温度38℃条件下发酵;当发酵培养基中的碳源耗尽后进行第一次补料,0-1h的补料速率为4ml/l/h,1h以后的补料速率为5.5ml/l/h,控制菌体比生长速率为0.14h-1。当od600在48时,进入诱导表达期。进入诱导表达期后停止补料,加入5g/l阿拉伯糖启动目的蛋白的表达,10min后进行第二次补料,0-6h的补料速率为5.5ml/l/h,6h以后的补料速率为6.5ml/l/h,控制菌体比生长速率为0.06h-1。诱导12h后终止发酵,得到发酵液;
第一次和第二次补料的培养基配方如下:酵母提取物180g/l,葡萄糖520g/l,七水合硫酸镁10g/l。
对比例1
与实施例6的区别仅在于发酵培养基不同,且在发酵培养基中添加微量元素,其余条件均相同,具体如下:
发酵培养基由如下组分组成:酵母蛋白胨16g/l、酵母抽提物11g/l、氯化钠1.2g/l、氯化铵1.2g/l、十二水合磷酸氢二钠13g/l、磷酸二氢钾2g/l、七水合硫酸镁0.5g/l、葡萄糖14g/l和微量元素1ml/l。
发酵培养基中微量元素的组成如下:hcl100ml/l,na2moo4·2h2o2g/l,h3bo30.5g/l,cacl20.76g/l,cocl2·6h2o2g/l,mncl2·4h2o2.3g/l,fecl2·4h2o2.3g/l,cucl2·2h2o1.25g/l,zncl21.3g/l。
对比例2
与实施例6的区别在于使用无机盐发酵培养基进行发酵,即发酵和补料培养基中均包含微量元素,其余条件与实施例6相同,具体如下:
发酵培养基由如下组分组成:柠檬酸1.7g/l、磷酸二氢钾14g/l、磷酸氢二铵4g/l、硫酸钠2g/l、七水合硫酸镁0.6g/l、葡萄糖20g/l、微量元素5ml/l。
发酵培养基中微量元素的组成如下:edta840ml/l,cocl2·6h2o250mg/l,mncl2·4h2o1500mg/l,cucl2·2h2o150mg/l,h3bo3300mg/l,na2moo4·2h2o250mg/l,zn(ch3coo)2·2h2o1300mg/l,fe(ⅲ)柠檬酸10g/l。
第一次和第二次补料的培养基组成为:葡萄糖600g/l、微量元素5ml/l、七水合硫酸镁2g/l。
补料培养基中的微量元素的组成如下:edta1300ml/l,cocl2·6h2o400mg/l,mncl2·4h2o2350mg/l,cucl2·2h2o250mg/l,h3bo3500mg/l,na2moo4·2h2o400mg/l,zn(ch3coo)2·2h2o1600mg/l,fe(ⅲ)柠檬酸4g/l。
对比例3
与实施例6的区别在于使用加糖的lb培养基进行发酵,发酵和补料培养基中均含糖,其余条件与实施例6相同,具体如下:
发酵培养基由如下组分组成:酵母粉7.5g/l、胰蛋白胨15g/l、氯化钠10g/l、葡萄糖5g/l。
第一次和第二次补料的培养基组成为:酵母粉75g/l、胰蛋白胨37.5g/l、葡萄糖250g/l。
测试例1
在不同发酵时间点抽样进行od600检测,对比实施例6和对比例1-3的菌体生长情况,菌体生长过程曲线如图1所示。
结果表明,采用本发明不含微量元素的复方培养基配方培养的菌体的生长速度更快。
测试例2
将实施例1-6和对比例1-3的样品采用sds-page法检测发酵和诱导表达的铁蛋白浓度。
用于sds-page检测的样品的制备方法为:取等体积的各实施例和对比例制备的上清液加入5μl5×loadingbuffer混匀,95℃孵育5min,此为上样样品。sds-page结果如图2所示。
用imagej灰度分析软件对图2中对比例3和实施例6的目的蛋白(hfn)进行灰度分析,得到上述样本的灰度平均值如下表1所示:
表1对比例3和实施例6目的蛋白平均灰度值
以上结果表明,与对比例相比,本发明使用的发酵方法获得的总蛋白浓度和目标蛋白(hfn)的含量都高于对比例,即采用本发明的培养方法(培养基配方和培养/诱导方法)能够获得更多的目的蛋白。
测试例3
实施例3、实施例6和对比例1制备的上清液按照cn102127166a中实施例2的方法进行纯化,而后冻干作为包载药物的样品。
使用阿霉素(dox)作为包载药物,包载方法为:用8m脲(sinnopharmchemicalreagentco.ltd.)稀释上述冻干的重组铁蛋白,至浓度为1mg/ml,并在室温条件下以轻轻震荡的方式保证完全溶解。阿霉素(dox)被加入到该溶液中,其终浓度为1mg/ml。避光孵育10min后,混合溶液转移到透析袋中(截留分子量为3000da,termoscientific),透析液为含有1mg/ml的dox的梯度脲缓冲液(7m、5m、3m、2m、1m和0m,每个浓度4h),让dox在4℃条件缓慢进入重新组装的铁蛋白笼中。产物然后采用生理盐水透析过夜,终止反应并去除游离的dox。dox包被到h铁蛋白笼中的终浓度采用superdex20010/300gl柱(ge公司)连接sec系统(amershamparmaciabiotech)来测定(流动相:50mmtrisbuffer,ph7.0)。h铁蛋白在280nm的uv条件有吸收峰,而dox在485nm下有吸收峰。比值越小,表明阿霉素装载量越高。
另外,用hplc-sec检测制备的铁蛋白的单体纯度,检测方法为:分别取1ml蛋白浓度为1mg/ml的待测铁蛋白样品,置于干净的1.5mlep管中,取10微升样品在高效液相层析系统通过凝胶过滤层析柱sec分析铁蛋白单体和聚体峰,流动相:50mmtrisbuffer,ph7.0。
结果如表2所示。
表2不同发酵工艺hfn的药物包载结果
结果表明,本发明的发酵培养基菌体表达量高,蛋白制品单体纯度高,包载效果好,包载不易产生沉淀。且补料工艺与未补料工艺相比,目标蛋白表达量更高,铁蛋白单体纯度更高。
实施例7大规模发酵优化工艺放大
实施例1-6均在2l发酵罐进行发酵,为验证在更大规模的发酵条件下本发明的发酵工艺是否可行,采用实施例6的发酵方法在10l发酵罐上进行放大,体积依赖型参数进行等比例放大(发酵培养基体积等)、非体积依赖参数保持不变(如温度、do、ph、诱导od、诱导周期等),检测了两个平行样本。其中,实施例6(样本1)为2l发酵规模,放大工艺(样本2)为10l发酵规模。结果表明:菌体的生长和蛋白表达能保持较高的一致性和重现性(图3),发酵结束时的od600在120±15范围内,hfn单体表达量在6.5±1.0g/l范围内,诱导周期为12h±1h,发酵总周期为22±2h。
发酵获得的铁蛋白包载阿霉素(dox)的结果如表3所示,发酵工艺放大后生产的hfn的药物包载结果能够重现小试工艺筛选的结果,由此,证明优化后的发酵工艺能够持续稳定生产出能够用于药物包载的hfn,该发酵工艺稳定可控,重现性好。
表3放大的hfn药物包载结果
上述详细说明是针对本发明其中之一可行实施例的具体说明,该实施例并非用以限制本发明的专利范围,凡未脱离本发明所为的等效实施或变更,均应包含于本发明技术方案的范围内。
序列表
<110>昆山新蕴达生物科技有限公司
<120>一种大规模发酵铁蛋白的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>549
<212>dna
<213>人重链铁蛋白(homosapiens)
<400>1
atgaccacggctagtacctcacaggttcgtcagaattatcatcaggatagtgaagcagcc60
attaatcgccagatcaatctggaactgtatgcgagctatgtgtatctgagtatgtcttat120
tattttgatcgcgatgatgttgccctgaaaaattttgccaaatattttctgcatcagtct180
catgaagaacgcgaacatgccgaaaaactgatgaaattacagaatcagcgtggcggtcgt240
atctttcttcaggatattaaaaaaccggattgtgatgattgggaaagcggcctgaatgct300
atggaatgcgccttacatttagaaaaaaatgttaatcagagcctgctggaactgcataaa360
ctggcaacggataaaaatgatccgcatctgtgtgattttatcgaaacacattatttaaat420
gaacaggttaaagcaatcaaagaactgggcgatcatgttaccaatttacgcaaaatgggt480
gctccggaaagtggcctggccgaatatctgtttgataaacatacgttaggcgatagcgat540
aatgaatct549
- 还没有人留言评论。精彩留言会获得点赞!