一种两组分偶联制备2-羟乙基苯基酮的方法与流程
[0001]
本发明属于药物中间体制备领域,涉及一种两组分偶联制备2-羟乙基苯基酮的方法。
背景技术:
[0002]
2-羟乙基苯基酮是一类重要的药物合成中间体,2-羟乙基苯基酮及其衍生物通常在医药化学中用于合成苯二氮卓类和苯并二硫杂环庚烷类化合物——神经保护剂gyki52466的类似物和相关的ly300164和托非索泮(acta pharm.sin.b 2015,5,500;eur.j.med.chem.2016,111,103),这些化合物在治疗癫痫、痉挛、慢性疼痛和神经退行性疾病等方面具有巨大潜力。
[0003]
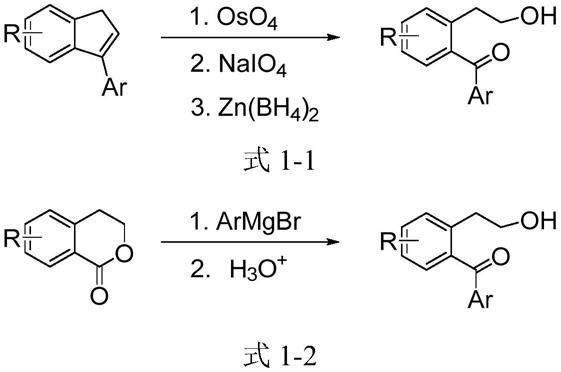
目前报道的关于2-羟乙基苯基酮的制备方法的例子非常有限。早期使用四氧化锇联合高碘酸盐氧化裂解烯烃化合物的双键而获得(如式1-1所示)(j.am.chem.soc.2008,130,7198),该方法所用原料难以获得,且四氧化锇剧毒,对环境危害极大。
[0004]
另一条途径是使用异色酮与格氏试剂加成水解反应制得(如式1-2所示)(tetrahedron 2010,66,3147),但该方法所用原料异色酮制备复杂,且需要昂贵的催化剂。
[0005][0006]
后来1-芳基取代的异色满作为原料制备2-羟乙基苯基酮被报道。如2016年r.bernini通过漆酶催化氧化1-芳基取代的异色满制备获得2-羟乙基苯基酮(如式1-3所示)(new j.chem.2016,40,3314)。该方法使用酶催化氧化异色满衍生物,引入了复杂的助剂,反应效率受苯环上aco取代基影响较大,且只适用于1-位为芳基的底物。2019年xiao jianliang课题组通过铁配合物催化氧气氧化1-芳基取代的异色满制备获得2-羟乙基苯基酮(如式1-4所示)(chem.eur.j.2019,25,4345-4357)。在此方法中,铁配合物中所用配体昂贵,且催化体系对水敏感,产率较低,同样此方法只适用于1-位为芳基的底物。
[0007][0008]
特别是,在上述方法中所使用的原料1-芳基取代的异色满需要复杂的制备工艺或昂贵的催化剂。例如,式1-5所示,苯并吡喃与芳环及其取代物在氧化剂的存在下反应制得1-芳基取代的异色满。此过程通常工艺复杂,需使用有毒的氧化剂才能完成。另外,将醇和醛通过oxa-pictet-spengler缩合反应获得1-位取代异色满化合物的改进方法(如式1-6所示)。然而反应需要昂贵的金属lewis酸催化剂,且反应条件苛刻。
[0009]
技术实现要素:
[0010]
针对现有技术中存在的问题,本发明提供一种两组分偶联制备2-羟乙基苯基酮的方法,所用原料简单易得,反应步骤短,反应条件温和、高效,原子经济性高,无需昂贵或有毒的催化剂和复杂的原料,避免了多步骤的合成过程,降低环境的污染。
[0011]
本发明是通过以下技术方案来实现:
[0012]
一种两组分偶联制备2-羟乙基苯基酮的方法,将式(1)所示的β-苯乙醇类化合物与醛acho溶于有机溶剂中,然后加入酸混合均匀,加热反应,得到式(2)所示的2-羟乙基苯基酮;
[0013][0014]
其中,a=ar或r,ar为苯基、萘基、对甲苯基、邻甲苯基、间甲苯基、对叔丁基苯基、对氯苯基、对溴苯基、对氟苯基、对硝基苯基、对甲氧基苯基、对三氟甲基苯基、间氯苯基和间硝基苯基中的任意一种,r为c1~c6的烷基、苯乙烯基、对甲苯乙烯基、对氯苯乙烯基和对硝基苯乙烯基中的任意一种;b、c为h和och3中的任意一种。
[0015]
本发明的进一步的改进在于:所述的酸为:c1~c8烷基磺酸、全氟代烷基磺酸、芳基磺酸、樟脑磺酸、方酸与三氟乙酸中的任意一种。
[0016]
本发明的进一步的改进在于:所述β-苯乙醇类化合物与醛acho的摩尔比为1:(1~4)。
[0017]
本发明的进一步的改进在于:所述的有机溶剂为二氯乙烷、一氯甲烷、二氯甲烷、氯仿、四氯化碳、二甲亚砜、乙腈、二噁烷、四氢呋喃、乙酸乙酯、环己烷、苯、甲苯和二甲苯中的任意一种。
[0018]
本发明的进一步的改进在于:所述的酸摩尔量为β-苯乙醇类化合物摩尔量的0.5~2.0倍。
[0019]
本发明的进一步的改进在于:反应温度为40~100℃,反应时间为0.5~12小时。
[0020]
与现有技术相比,本发明具有以下有益的技术效果:
[0021]
本发明在酸催化下β-苯乙醇类化合物和醛直接作用经过缩合和friedel-crafts反应首先形成中间体异色满衍生物,中间体在酸作用下1-位氢发生脱氢氧化形成碳正离子中间体,再与水结合,形成半缩酮,进而开环形成产物2-羟乙基苯基酮(如式1-7所示)。
[0022][0023]
本发明改进现有合成方法,将β-苯乙醇或其取代物与醛直接偶联形成2-羟乙基苯基酮,所用原料β-苯乙醇类化合物和醛简单易得,成本低,无需分离异色满衍生物中间体,反应步骤短,避免了多步骤的合成过程,操作简单,原子经济性高,无需昂贵或有毒的催化剂,降低环境的污染。
[0024]
本发明合成的2-羟乙基苯基酮化合物可作为药物合成中间体,用于合成苯二氮卓类和苯并二硫杂环庚烷类化合物——神经保护剂gyki52466的类似物和相关的ly300164和托非索泮,此类化合物在治疗癫痫、痉挛、慢性疼痛和神经退行性疾病等方面具有巨大潜力。
[0025]
进一步的,本发明反应条件温和,反应温度低、反应时间短,效率高。
具体实施方式
[0026]
下面结合具体的实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。
[0027]
本发明所述的酸主要为有机中强酸,这是反应历程中的friedel-crafts反应和脱氢氧化反应所需要的。
[0028]
本发明中酸为:c1~c8烷基磺酸、全氟代烷基磺酸、芳基磺酸、樟脑磺酸、方酸与三氟乙酸中的任意一种。
[0029]
本发明中的有机溶剂可以为二氯乙烷、一氯甲烷、二氯甲烷、氯仿、四氯化碳、二甲亚砜、乙腈、二噁烷、四氢呋喃、乙酸乙酯、环己烷、苯、甲苯和二甲苯中的任意一种。
[0030]
实施例1
[0031]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基庚酮为例,所用原料及其制备方法如下:
[0032][0033]
在50ml反应管里加入0.055g(0.3mmol)2-(3,4-二甲氧基苯基)乙醇和0.3ml氯仿,
在室温下搅拌使原料全部溶解,再加入0.029g(0.3mmol)甲烷磺酸和84μl(0.6mmol)庚醛。在60℃下搅拌反应1小时,停止加热,向体系中加入2ml饱和碳酸氢钠水溶液,用10ml乙酸乙酯萃取三次,合并有机相,用无水硫酸钠干燥,抽滤,浓缩,粗产物进行柱层析分离(溶剂为乙酸乙酯和正己烷),得到白色粘稠固体产物,其产率为71%。所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(400mhz,cdcl3)δ7.21(s,1h),6.73(s,1h),3.91(s,3h),3.89(s,3h),3.86(t,j=6.9hz,2h),2.94(t,j=6.9hz,2h),2.86(t,j=7.4hz,2h),1.73
–
1.65(m,2h),1.38
–
1.28(m,6h),0.88(dd,j=9.1,4.6hz,3h).
13
c nmr(101mhz,cdcl3)δ202.36,151.31,146.96,132.57,130.06,114.70,112.56,63.10,56.16,55.97,36.06,33.44,31.69,29.03,24.59,22.52,14.03.
[0034]
实施例2
[0035]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基庚酮为例,所用原料及其制备方法如下:
[0036][0037]
在实施例2中,将实施例1中的所用的甲烷磺酸用三氟甲磺酸替换,酸用量替换为2-(3,4-二甲氧基苯基)乙醇的物质的量的2倍,庚醛用量替换为42μl(0.3mmol),反应温度替换为40℃,反应时间替换为12小时,其它步骤与实施例1相同,制备成白色油状固体产物,其产率为64%,所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(400mhz,cdcl3)δ7.21(s,1h),6.73(s,1h),3.91(s,3h),3.89(s,3h),3.86(t,j=6.9hz,2h),2.94(t,j=6.9hz,2h),2.86(t,j=7.4hz,2h),1.73
–
1.65(m,2h),1.38
–
1.28(m,6h),0.88(dd,j=9.1,4.6hz,3h).
13
c nmr(101mhz,cdcl3)δ202.36,151.31,146.96,132.57,130.06,114.70,112.56,63.10,56.16,55.97,36.06,33.44,31.69,29.03,24.59,22.52,14.03.
[0038]
实施例3
[0039]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基庚酮为例,所用原料及其制备方法如下:
[0040][0041]
在实施例3中,将实施例1中的所用的甲烷磺酸用对甲苯磺酸替换,酸用量改为2-(3,4-二甲氧基苯基)乙醇的物质的量的0.5倍,庚醛用量替换为168μl(1.2mmol),反应温度替换100℃,反应时间替换0.5小时,其它步骤与实施例1相同,制备成白色油状固体产物,其产率为62%,所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(400mhz,cdcl3)δ7.21(s,1h),6.73(s,1h),3.91(s,3h),3.89(s,3h),3.86
(t,j=6.9hz,2h),2.94(t,j=6.9hz,2h),2.86(t,j=7.4hz,2h),1.73
–
1.65(m,2h),1.38
–
1.28(m,6h),0.88(dd,j=9.1,4.6hz,3h).
13
c nmr(101mhz,cdcl3)δ202.36,151.31,146.96,132.57,130.06,114.70,112.56,63.10,56.16,55.97,36.06,33.44,31.69,29.03,24.59,22.52,14.03.
[0042]
实施例4
[0043]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基庚酮为例,所用原料及其制备方法如下:
[0044][0045]
在实施例4中,将实施例1中的所用的甲烷磺酸用樟脑磺酸替换,酸用量替换为2-(3,4-二甲氧基苯基)乙醇的物质的量的1倍,反应溶剂替换为苯,其它步骤与实施例1相同,制备成白色油状固体产物,其产率为67%,所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(400mhz,cdcl3)δ7.21(s,1h),6.73(s,1h),3.91(s,3h),3.89(s,3h),3.86(t,j=6.9hz,2h),2.94(t,j=6.9hz,2h),2.86(t,j=7.4hz,2h),1.73
–
1.65(m,2h),1.38
–
1.28(m,6h),0.88(dd,j=9.1,4.6hz,3h).
13
c nmr(101mhz,cdcl3)δ202.36,151.31,146.96,132.57,130.06,114.70,112.56,63.10,56.16,55.97,36.06,33.44,31.69,29.03,24.59,22.52,14.03.
[0046]
实施例5
[0047]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基环己基甲酮为例,所用原料及其制备方法如下:
[0048][0049]
在实施例5中,将实施例1中的所用的庚醛用等摩尔的环己基甲醛替换,反应温度替换为80℃。其它步骤与实施例1相同,制备成白色油状固体产物,其产率为69%,表征数据为:1h nmr(400mhz,cdcl3)δ7.12(s,1h),6.76(s,1h),3.92(s,3h),3.91(s,3h),3.86(t,j=7.0hz,2h),2.93(m,1h),2.87(t,j=7.0hz,2h),1.84(t,j=13.3hz,4h),1.71(d,j=10.7hz,1h),1.50
–
1.18(m,5h).
13
c nmr(101mhz,cdcl3)δ206.35,151.00,147.02,132.08,130.37,114.51,111.80,63.33,56.25,55.96,36.36,33.12,29.25,25.92,25.84.
[0050]
实施例6
[0051]
以制备下式化合物2-羟乙基-4,5-二甲氧基二苯甲酮为例,所用原料及其制备方法如下:
[0052][0053]
在实施例6中,将实施例1中的所用的庚醛用等摩尔的苯甲醛替换,反应温度替换为80℃。其它步骤与实施例1相同,制备成白色固体产物,其产率为82%,表征数据为:1h nmr(400mhz,cdcl3)δ7.84(d,j=7.5hz,2h),7.61(d,j=6.9hz,1h),7.50(t,j=6.9hz,2h),6.90(d,j=12.8hz,2h),3.98(s,3h),3.93
–
3.89(m,2h),3.79(s,3h),2.95(t,j=5.1hz,2h).
13
c nmr(101mhz,cdcl3)δ198.01,151.47,146.34,138.14,133.88,133.19,130.59,130.41,128.42,113.48,113.42,64.11,56.17,56.05,36.08.
[0054]
实施例7
[0055]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基对甲苯甲酮为例,所用原料及其制备方法如下:
[0056][0057]
在实施例7中,将实施例1中的所用的庚醛用对甲苯甲醛替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为89%,表征数据为:1h nmr(400mhz,cdcl3)δ7.65(d,j=8.2hz,2h),7.20(d,j=7.2hz,2h),6.80(s,1h),6.78(s,1h),3.89(s,3h),3.82(t,j=5.9hz,2h),3.70(s,3h),2.84(t,j=6.1hz,2h),2.37(s,3h).
13
c nmr(101mhz,cdcl3)δ197.72,151.29,146.30,144.19,135.45,133.58,130.79,130.71,129.14,113.39,113.24,64.07,56.14,56.03,36.03,21.71.
[0058]
实施例8
[0059]
以制备下式化合物2-羟乙基-4,5-二甲氧基苯基对氟甲酮为例,所用原料及其制备方法如下:
[0060][0061]
在实施例8中,将实施例1中的所用的庚醛用等摩尔的对氟苯甲醛替换,其它步骤与实施例1相同,制备成白色固体,其产率为80%,表征数据为:1h nmr(400mhz,cdcl3)δ7.83(dd,j=8.8,5.5hz,2h),7.13(t,j=8.6hz,2h),6.87(s,1h),6.81(s,1h),3.94(s,3h),3.86(t,j=6.0hz,2h),3.77(s,3h),3.29(s,1h),2.89(t,j=6.1hz,2h).
13
c nmr(101mhz,
cdcl3)δ196.45,151.49,146.40,133.72,133.22,133.12,130.17,115.71,115.49,113.54,113.05,64.01,56.15,56.04,36.04.
[0062]
实施例9
[0063]
以制备下式化合物2-羟乙基苯基苯丙酮为例,所用原料及其制备方法如下:
[0064][0065]
在实施例9中,将实施例1中的所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的2-苯乙醇替换,庚醛用等摩尔的苯丙醛替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为69%,表征数据为:1h nmr(400mhz,cdcl3)δ7.63(d,j=7.9hz,1h),7.40(dd,j=7.6,1.2hz,1h),7.29(t,j=7.7hz,5h),7.23(d,j=7.0hz,2h),3.88(t,j=6.9hz,2h),3.15(t,j=7.6hz,2h),2.88(t,j=6.9hz,2h),3.05(t,j=7.6hz,2h).
13
c nmr(101mhz,cdcl3)δ203.08,141.07,138.06,137.81,132.10,131.40,128.76,128.55,128.42,126.68,126.18,63.92,36.26,33.26,30.30.
[0066]
实施例10
[0067]
以制备下式化合物2-羟乙基二苯甲酮为例,所用原料及其制备方法如下:
[0068][0069]
在实施例10中,将实施例1中的所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的2-苯乙醇替换,庚醛用等摩尔的苯甲醛替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为71%,表征数据为:1h nmr(400mhz,cdcl3)δ7.82(dd,j=8.4,1.3hz,2h),7.63
–
7.58(m,1h),7.45(ddd,j=16.7,8.1,4.1hz,3h),7.37
–
7.27(m,3h),3.89(t,j=6.2hz,2h),2.95(t,j=6.2hz,2h).
13
c nmr(101mhz,cdcl3)δ198.91,139.04,138.53,137.60,133.46,131.05,131.00,130.62,129.43,128.46,125.64,63.97,36.30.
[0070]
实施例11
[0071]
以制备下式化合物2-羟乙基苯基对叔丁基苯甲酮为例,所用原料及其制备方法如下:
[0072]
[0073]
在实施例11中,将实施例1中的所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的2-苯乙醇替换,庚醛用等摩尔的叔丁基苯甲醛替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为86%,表征数据为:1h nmr(400mhz,cdcl3)δ7.76(d,j=8.5hz,2h),7.47(d,j=8.5hz,2h),7.41
–
7.27(m,4h),3.85(t,j=6.3hz,2h),2.91(t,j=6.3hz,2h),1.35(s,9h).
13
c nmr(101mhz,cdcl3)δ198.58,157.41,138.86,138.79,134.89,130.99,130.78,130.69,129.25,125.56,125.46,63.91,36.29,35.23,31.11.
[0074]
实施例12
[0075]
以制备下式化合物2-羟乙基-5-叔丁基苯基苯甲酮为例,所用原料及其制备方法如下:
[0076][0077]
在实施例12中,将实施例1中的所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的2-(4-叔丁苯基)乙醇替换,庚醛用等摩尔的苯甲醛替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为76%,表征数据为:1h nmr(400mhz,cdcl3)δ7.88
–
7.80(m,2h),7.64
–
7.58(m,1h),7.49(m,3h),7.34(dd,j=5.1,2.9hz,2h),3.87(t,j=5.6hz,2h),2.90(t,j=6.2hz,2h),1.29(s,9h);
13
c nmr(101mhz,cdcl3)δ199.22,148.59,138.11,137.70,135.87,133.39,130.72,130.65,128.44,128.04,126.45,63.99,35.84,34.48,31.19.
[0078]
实施例13
[0079]
以制备下式化合物2-羟乙基萘基苯甲酮为例,所用原料及其制备方法如下:
[0080][0081]
在实施例13中,将实施例1中的所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的α-萘乙醇替换,庚醛用等摩尔的苯甲醛替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为82%,表征数据为:1h nmr(400mhz,cdcl3)δ7.93(d,j=7.7hz,2h),7.83(dd,j=8.2,7.0hz,3h),7.69
–
7.57(m,3h),7.47(t,j=7.8hz,2h),7.39(d,j=8.4hz,1h),3.87(t,j=7.6hz,2h),2.99(t,j=7.6hz,2h).
13
c nmr(101mhz,cdcl3)δ198.69,137.55,137.38,134.24,133.52,132.37,132.32,130.41,128.96,128.54,127.37,127.05,127.04,124.81,124.54,63.92,35.92。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1