一种非酿酒酵母及用该酵母增加空心李果酒香味的发酵方法与流程
本发明涉及酿造技术领域,尤其涉及一种空心李果酒增香的发酵方法。
背景技术:
沿河沙子空心李栽培历史已逾百年,独特的地理环境依赖性使之独产、盛产于沿河自治县沙子镇,成熟后肉核分离。核内无仁而得名,其肉质甘甜,清脆爽口。空心李富含蛋白质、脂肪、碳水化合物、钙、磷、铁、胡萝卜素、核黄素、尼克酸、抗坏血酸等,尤其含有丰富的对人体有益的“硒”元素;并且具有“清热解暑、开胃养颜、延年益寿”等功效。但沙子空心李很容易发生霉变和腐烂的现象,保鲜储藏技术落后,更没有丰富的精深加工产品,导致产品附加值低。目前沙子空心李在市场上主要是以鲜果售卖为主,关于沙子空心李产品的开发现阶段集中在果脯、果酒等方面,且目前市场上的空心李果酒多采用商业化酿酒酵母酿造而成,果酒同质化问题较为突出,风味物质含量较低,获得的产品风味单一。
香气是决定空心李果酒感官品质的关键因素,是多种化合物相互作用的结果,其产生主要来源有三个:空心李果实的香气,发酵微生物代谢产生的发酵香气以及在陈酿期间所产生的陈酿香气。其中发酵香气是一个极为重要的因素,多种酵母菌株(包括酿酒酵母和非酿酒酵母)的参与不仅可将果实中的葡萄糖转化为酒精,还可产生许多对空心李果酒最终的口感和香气有重大贡献的复杂代谢产物,对空心李果酒的最终品质有决定作用。采用非酿酒酵母及酿酒酵母菌种混合发酵发酵是改善果酒品质与特异性的有效途径之一。
果酒的自然发酵过程本质上是各种微生物相互作用的结果。不同属的酵母共同参与完成了果酒的自然发酵,包括酿酒酵母和非酿酒酵母。研究发现,采用酿酒酵母和非酿酒酵母混合发酵果酒,可以产生不可预测的化合物,或不同含量的发酵产物影响果酒的香气品质。非酿酒酵母存在于果园土壤、水果表皮以及果酒酿造环境中,能够产生大量的甘油、酯类等代谢产物,通过代谢果汁中的糖和自溶以提高果酒的香气成分,参与果酒复杂的风味物质形成。在果酒发酵过程中,非酿酒酵母可以产生多种胞外酶,如果胶酶、蛋白酶、葡聚糖酶、木聚糖酶、淀粉酶、脂肪酶等,使其具有一定的胞外酶活性,这些酶作用于果汁中的相关底物中,进而影响果酒的组成成分及风味物质。同时接种不同菌种不仅可以增加酒的复杂口感和香气,还可以弥补工艺条件的不足,改善菌种的发酵能力。通过添加非酿酒酵母,进行非酿酒酵母与酿酒酵母混合发酵空心李果酒,可以改善空心李果酒的香气特性,是一种有效的空心李果酒增香的发酵方法。
但目前将非酿酒酵母和酿酒酵母混合在一起共同接种至发酵物中,使其互相竞争发酵,从而非酿酒酵母主要增加香气物质,酿酒酵母主要产生酒精等产物,但非酿酒酵母和酿酒酵母混合在一起共同接种至发酵物中会使得非酿酒酵母失活概率大,酿酒酵母启动发酵后,产生的酒精等产物会抑制非酿酒酵母的发酵进程,从而大概率导致果酒的发酵产物中香气物质含量较少,无法形成较为突出的果酒品质,通过改进发酵方式,使得果酒发酵过程既能产生酒精等产物以便符合国标,也尽可能的提升果酒的香气品质,是果酒发酵领域亟需解决的重大难题。
技术实现要素:
本发明主要是克服现有技术中的果酒发酵后果香味不足,非酿酒酵母和酿酒酵母同时混合发酵导致的香味不够突出的问题,本发明的目的在于通过非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种后发酵、终止发酵、离心和装瓶等步骤酿制空心李果酒,制得的空心李果酒色泽纯正、空心李果香突出、香气协调、酒液清澈透明,风味浓郁,酒体丰满,酸涩平衡,明显改善了空心李果酒的香气特性,达到显著增加空心李果酒香味的目的,产品香味品质突出。该酿造方法简单易操作,成本低廉,易产业化。
为达到以上技术目的,本发明采用以下技术方案:
提供一种非酿酒酵母f119,其特征在于,所述非酿酒酵母f119的保藏号为20905:
进一步的,提供一种增加空心李果酒香味的发酵方法,包括以下步骤:
(1)原料处理:将新鲜采摘的成熟空心李果实破碎进行榨汁处理,空心李汁中加入偏重亚硫酸钾或so2;
(2)发酵液调整:测定发酵液的ph值和糖度值后,调整发酵液ph值和糖;
(3)接种发酵:采用ypd固体培养活化酿酒酵母与非酿酒酵母,摇床培养方法扩大培养酿酒酵母与非酿酒酵母,将一定比例的非酿酒酵母与酿酒酵母按顺序间隔一定时间加入发酵液中,发酵启动,控制发酵温度,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于一定值时主发酵结束,加入偏重亚硫酸钾或so2;
(4)下胶澄清:发酵结束后将酒自然澄清,分离到上层酒液后,加入藻土进行下胶澄清;
(5)过滤、装瓶:将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
进一步的,所述非酿酒酵母和酿酒酵母均是以种子液形式加入的。
进一步的,所述发酵温度为18±2℃,主发酵结束的条件为糖度低于4g/l。
进一步的,所述发酵结束后将酒置于0-4℃自然澄清10天,所述加入藻土后置于0-4℃下14天进行下胶澄清。
进一步的,所述非酿酒酵母与酿酒酵母按顺序间隔一定时间加入发酵液中的方法为:接种发酵时,先接种非酿酒酵母4-7天后,再接种酿酒酵母。
进一步的,所述接种发酵时,先接种非酿酒酵母7天后,再接种酿酒酵母。
进一步的,所述接种发酵时,非酿酒酵母和酿酒酵母添加的比例为10:1-1:1。
进一步的,所述偏重亚硫酸钾或者so2的加入量为50mg/l。
进一步的,所述发酵液ph为3.5,发酵液糖度为10-30°brix。
进一步的,所述酿酒酵母与非酿酒酵母的活化方式为:将葡萄糖、蛋白胨、酵母浸粉、琼脂溶解于20-25℃的去离子水中,于立式自动压力蒸汽灭菌锅中在120℃温度下灭菌20min,于超净工作台中以划线方式接种酿酒酵母与非酿酒酵母,28℃培养48h,4℃存放备用。
进一步的,所述酿酒酵母与非酿酒酵母的扩大培养方式为:将葡萄糖、蛋白胨、酵母浸粉溶解于20-25℃的去离子水中,于立式自动压力蒸汽灭菌锅中在120℃温度下灭菌20min,于超净工作台中接种酿酒酵母与非酿酒酵母,28℃培养48h,4℃存放备用。
进一步的,所述酿酒酵母与非酿酒酵母的活化方式中,葡萄糖、蛋白胨、酵母浸粉、琼脂的用量分别为20g/l、20g/l、10g/l、20g/l。
进一步的,所述酿酒酵母与非酿酒酵母的扩大培养方式中,葡萄糖、蛋白胨、酵母浸粉的用量分别为20g/l、20g/l、20g/l。
进一步的,所述非酿酒酵母和酿酒酵母种子液的制备方法具体可为:1)菌种活化,取超低温保存的非酿酒酵母以及酿酒酵母,分别接种到ypd固体培养基,28℃培养48h,备用;2)种子液制备,将步骤1)中活化的非酿酒酵母以及酿酒酵母分别转接到ypd液体培养基中。28℃,120~180rpm,培养20~28h至对数生长期。用已灭菌的生理盐水稀释菌液浓度至600nm时吸光值为1,此时菌液浓度为108cfu/ml。
进一步的,所述过滤、装瓶步骤中灭菌方法为巴氏灭菌。
有益效果:
与现有技术相比,本发明具有以下有益效果:
本发明将非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种于空心李汁中进行发酵,达到果酒国家生产标准的同时,保持了空心李汁自然发酵的良好特性,其中,酿酒酵母消耗糖分,产生酒精;非酿酒酵母低产酒精,高产香气物质,二者相结合,既保证了果酒适宜的酒精度,显著提高酯类和醛酮类物质等香气化合物的含量,也明显改善空心李果酒的香气特性。赋予空心李果酒更加浓郁的花果香、甜香和焙烤香,有效地改善了空心李果酒的香气特性,达到了空心李果酒增香的目的。
本发明所述方法,简单易行,可以获得多种香气特性的果酒,有效的增加了空心李果酒的种类,满足不同消费者的需求,同时也避免了市场上空心李果酒的同质性恶性竞争。此外,与现有技术相比,本发明采用非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种混合发酵,既保证了发酵过程中对杂菌的抑制,又能丰富发酵产品的风味。经过gc-ms分析测定,采用非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种发酵的空心李果酒比单一商业酿酒酵母或者非酿酒酵母和酿酒酵母同时混合发酵的果酒具有更丰富浓郁的香气。
附图说明
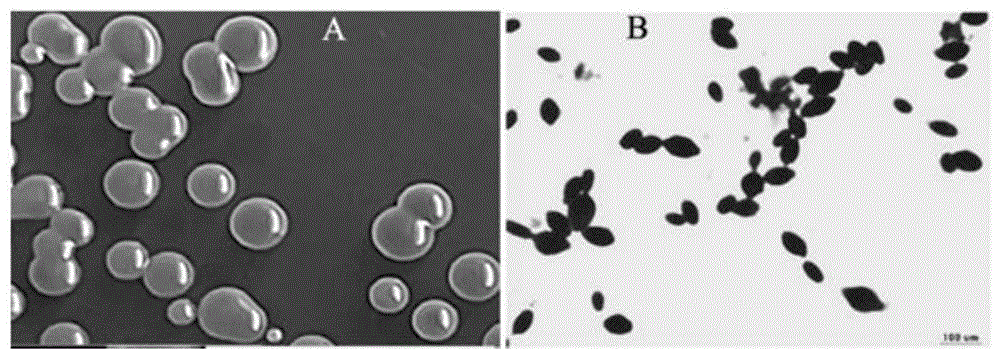
图1为非酿酒酒母f119菌落形态(a)和细胞形态(b);
图2为具体实施例中各实验组酯类物质的含量柱状图;
图3为具体实施例中各实验组醇类物质的含量柱状图;
图4为具体实施例中各实验组酸类物质的含量柱状图;
图5为具体实施例中各实验组芳香族物质的含量柱状图;
图6为具体实施例中各实验组其他类物质的含量柱状图;
图7为具体实施例中各实验组挥发性香气成分的总含量柱状图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
商业化酿酒酵母(saccharomycescerevisiae)菌株x16:公司,名称:laffort。
葡萄汁有孢汉逊酵母(hanseniasporauvarum)菌株f119:保藏号为20905;
保藏信息:
保藏单位及代码:中国微生物菌种保藏管理委员会普通微生物中心(cgmcc);
地址:北京市朝阳区北辰西路1号院3号;
是否存活:存活;
分类命名:葡萄汁有孢汉逊酵母;
保藏日期:2020年10月19日。
商业化非酿酒酵母32349:(中国工业微生物菌种保藏管理中心编号:32349)。
空心李汁的制备过程为:选取成熟新鲜的空心李果实,用清洁流水洗去表面微生物和泥沙等杂物,破碎榨汁,空心李汁中加入50mg/l偏重亚硫酸钾。
一、种子液的制备
1、菌种活化,取超低温保存的酿酒酵母x16,接种到ypd固体培养基,28℃培养48h,备用;
2、种子液制备,将步骤1中活化的酿酒酵母x16,转接到ypd液体培养基中。28℃,120~180rpm,培养20~28h至对数生长期。用已灭菌的生理盐水稀释菌液浓度至600nm时吸光值为1,此时菌液浓度为108cfu/ml。得到酿酒酵母x16种子液。
3、采用非酿酒酵母葡萄汁有孢汉逊酵母菌株f119替代酿酒酵母x16,按照步骤1和2进行操作,得到非酿酒酵母f119种子液。
4、采用非酿酒酵母32349替代酿酒酵母x16,按照步骤1和2进行操作,得到非酿酒酵母32349种子液。
二、发酵
分为如下9个组进行操作:
组1(x16单独发酵,x16):将步骤一制备的酿酒酵母x16种子液接种于空心李汁中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),发酵液的初始糖度为28°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组2(x16与f119间隔7天接种发酵,f119-f-1):将步骤一制备的酿酒酵母x16种子液接种于空心李汁中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),7天后将步骤一制备的非酿酒酵母f119种子液接种于发酵体系中(每1ml空心李汁中具体可接种108个cfu非酿酒酵母f119),发酵液的初始糖度为28°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组3(x16与32349间隔7天接种发酵,32349-f-2):将步骤一制备的酿酒酵母x16种子液接种于空心李汁中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),7天后将步骤一制备的非酿酒酵母32349种子液接种于发酵体系中(每1ml空心李汁中具体可接种108个cfu非酿酒酵母32349),发酵液的初始糖度为28°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组4(f119与x16同时接种发酵,f119-g):将步骤一制备的非酿酒酵母f119种子液与酿酒酵母x16种子液同时接种于空心李汁中(每1ml空心李汁中具体可接种108个cfu非酿酒酵母f119和107个cfu酿酒酵母x16),发酵液的初始糖度为28°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组5(32349与x16同时接种发酵,32349-g):将步骤一制备的非酿酒酵母32349种子液与酿酒酵母x16种子液同时接种于空心李汁中(每1ml空心李汁中具体可接种108个cfu非酿酒酵母32349和107个cfu酿酒酵母x16),发酵液的初始糖度为28°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组6(f119与x16间隔7天接种发酵,f119-s-1):将步骤一制备的非酿酒酵母f119种子液接种于空心李汁中(每1ml空心李汁中具体可接种107个cfu非酿酒酵母f119),7天后将步骤一制备的酿酒酵母x16种子液接种于发酵体系中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),发酵液的初始糖度为22°brix,加入60mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组7(32349与x16间隔7天接种发酵,32349-s-1):将步骤一制备的非酿酒酵母32349种子液接种于空心李汁中(每1ml空心李汁中具体可接种107个cfu非酿酒酵母32349),7天后将步骤一制备的酿酒酵母x16种子液接种于发酵体系中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),发酵液的初始糖度为22°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组8(f119与x16间隔7天接种发酵,f119-s-2):将步骤一制备的非酿酒酵母f119种子液接种于空心李汁中(每1ml空心李汁中具体可接种108个cfu非酿酒酵母f119),7天后将步骤一制备的酿酒酵母x16种子液接种于发酵体系中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),发酵液的初始糖度为22°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。
组9(32349与x16间隔7天接种发酵,32349-s-2):将步骤一制备的非酿酒酵母32349种子液接种于空心李汁中(每1ml空心李汁中具体可接种108个cfu非酿酒酵母32349),7天后将步骤一制备的酿酒酵母x16种子液接种于发酵体系中(每1ml空心李汁中具体可接种107个cfu酿酒酵母x16),发酵液的初始糖度为22°brix,加入50mg/l偏重亚硫酸钾。发酵过程:控制发酵温度为18±2℃,期间使用酒精比重计和糖度仪监测发酵进度,糖度低于4g/l时主发酵结束,加入50mg/l偏重亚硫酸钾终止发酵。发酵结束后将酒置于0-4℃自然澄清10天,分离到上层酒液后,加入藻土于0-4℃下14天进行下胶澄清。将完成下胶澄清后的酒液进行调配,稳定后过滤、灭菌、装瓶。三、酿造特性检测
1、取步骤二中各组得到的空心李果酒进行如下检测:
(1)乙醇含量:酒精计法测定(参考:gb/t15038-2006葡萄酒、果酒通用分析方法);
(2)挥发性香气化合物的种类和含量:用tq8040nx气相质谱联用仪(岛津,日本)检测。顶空固相微萃取法萃取条件为:20ml顶空瓶中,加入8ml空心李果酒样品,1.0gnacl,50μl环己酮(内标最终浓度:237.5mg/l)用于半定量,在40℃水浴中平衡15min,用1cm-50/30μmdvb/car/pdms萃取纤维头在40℃下萃取30min,萃取完成后,将萃取头插入进样口,240℃解吸附2min,进行gc-ms分析。纤维头老化温度为250℃,老化时间为30min;gc-ms分析条件为:inertcapwax毛细管柱,60m×0.25mm×0.25μm,载气为高纯(99.999%)氦气,恒定流量为1.88ml/min,升温程序:从40℃开始,保持3min,以3℃/min升温到230℃/min,保持2min,进样口温度:240℃,ms接口温度250℃,不分流进样,溶剂延迟2min,ei离子源,离子源温度200℃,电子能量70ev,扫描质荷比范围:29-500m/z。
2、空心李果酒理化指标、主要挥发性香气成分oav值计算结果
结果如表1、图2-7和表2所示。
表1各实验组酒精发酵结束后空心李酒样的乙醇含量
表2各实验组酒精发酵结束后空心李酒样的香气物质的香气活度值
由表1数据可知,各发酵实验组的基本理化指标在国标控制范围内。非酿酒酵母与酿酒酵母共同接种混合发酵降低了空心李果酒的酒精度,非酿酒酵母与酿酒酵母顺序接种混合发酵时的接种比例增大提高了空心李果酒的酒精度。
由图2可知,从挥发性香气成分的角度来看,非酿酒酵母f119、32349与酿酒酵母x16同时接种及顺序接种混合发酵空心李果酒(实验组4-9)的挥发性香气成分的总含量均高于酿酒酵母x16单独接种发酵的空心李果酒,同时远高于非酿酒酵母f119与酿酒酵母x16反向接种发酵组(组2、组3:即先接种酿酒酵母x16,启动发酵7天后,再接种非酿酒酵母f119),其中,酯类、酸类、芳香族及其他类化合物的含量均高于酿酒酵母x16单独接种发酵的空心李果酒(组1)及非酿酒酵母f119与酿酒酵母x16反向接种组(组2、组3),说明非酿酒酵母与酿酒酵母发酵空心李果酒的方式具有一定优势,其中,同时接种发酵较酿酒酵母单独接种发酵及非酿酒酵母与酿酒酵母反向接种发酵具有一定优势,与同时接种发酵方式相比,非酿酒酵母与酿酒酵母顺序接种发酵方式优势更为显著。
非酿酒酵母f119和32349参与的混合发酵方式能够有效地改善空心李果酒的香气,增加空心李果酒香气的强度和复杂性。如图2、4、5、6所示,混合发酵显著提高了酯类、酸类、芳香族及其他类化合物的含量,其中接种比例为10:1的顺序接种发酵组中酯类、酸类、芳香族及其他类化合物的含量为最高(组8和组9)。酯类和芳香族物质通常具有果香、花香和甜香等。
非酿酒酵母混合发酵空心李果汁还提高了多种对果酒香气贡献度较大的香气成分的含量,用香气活度值(odouractivityvalue,oav)来衡量香气化合物对果酒整体香气的贡献。计算公式如下:
式中:ci为化合物的含量(μg/l);oti为该化合物在9-16%酒精溶液中的嗅觉阈值(μg/l)。
由表2数据可知,组4至组9蓝莓果酒中oav>1的香气物质中,乙酸乙酯、乙酸异丁酯、己酸乙酯、辛酸甲酯、辛酸乙酯、癸酸乙酯、辛酸异戊酯、月桂酸乙酯、辛酸、癸酸、苯甲酸乙酯、苯乙酸乙酯、丁香酚和苯并噻唑的香气活度值均大于组1、组2和组3。其中己酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯、辛酸和丁香酚等化合物的oav值远大于组1、组2和组3,以上几种种香气化合物的oav值在组8和组9中为最高。说明非酿酒酵母与酿酒酵母混合发酵能有效地提高香气贡献度较大的化合物的含量,顺序接种发酵组(组8和组9)的效果尤为显著,使蓝莓果酒的香气更加浓郁。而先接种酿酒酵母启动发酵一段时间后再接种非酿酒酵母这样的发酵方式(组2、组3)却达不到果酒增香的目的。
综上所述,将非酿酒酵母与酿酒酵母进行混合发酵应用于空心李果酒发酵生产,不仅而已顺利完成酒精发酵任务使之符合国家标准,同时又能够提升空心李果酒的香气品质,改善了酿酒价目纯种发酵香气单一的现象,使空心李果酒的香气更为复杂,有层次感,尤其以非酿酒酵母f119、32349与酿酒酵母x16按10:1的接种比例顺序接种发酵空心李果酒的混合发酵方式作用最为显著,显著提高了空心李果酒中酯类化合物的含量。
本发明将非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种于空心李汁中进行发酵,达到果酒国家生产标准的同时,保持了空心李汁自然发酵的良好特性,其中,酿酒酵母消耗糖分,产生酒精;非酿酒酵母低产酒精,高产香气物质,二者相结合,既保证了果酒适宜的酒精度,显著提高酯类和醛酮类物质等香气化合物的含量,也明显改善空心李果酒的香气特性。赋予空心李果酒更加浓郁的花果香、甜香和焙烤香,有效地改善了空心李果酒的香气特性,达到了空心李果酒增香的目的。
本发明所述方法,简单易行,可以获得多种香气特性的果酒,有效的增加了空心李果酒的种类,满足不同消费者的需求,同时也避免了市场上空心李果酒的同质性恶性竞争。此外,与现有技术相比,本发明采用非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种混合发酵,既保证了发酵过程中对杂菌的抑制,又能丰富发酵产品的风味。经过各实施例中gc-ms分析测定,采用非酿酒酵母与酿酒酵母按一定比例和顺序间隔一定时间接种发酵的空心李果酒比单一商业酿酒酵母或者非酿酒酵母和酿酒酵母同时混合发酵的果酒具有更丰富浓郁的香气。
以上所述,并非对本发明作任何形式上的限制,虽然本发明已通过上述实施例揭示,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容作出些变动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!