用于提高具有二级结构的单链核酸分子的复制效率的试剂、核酸片段复制方法、应用与流程
本发明涉及分子生物学技术领域,尤其涉及一种用于提高具有分子内二级结构的单链核酸分子的复制效率的试剂、核酸片段复制方法、应用。
背景技术:
单链核酸在内部存在互补序列时,按照碱基互补配对原则可以形成分子内二级结构。首先,核酸的分子内二级结构在生物体内具有重要的生物学作用。例如,转运rna形成的三叶草状的分子内二级结构对于其在翻译过程中发挥氨基酸转运作用至关重要,而核糖体rna形成的高度复杂的分子内二级结构则是保障核糖体结构并实现其以信使rna为模板合成肽链的功能所必须的。此外,非正常的核酸分子内二级结构还与人类的一些疾病有关。例如,在基因组dna的复制过程中,(cng)n简单重复形成的分子内二级结构所造成的cng重复数的增加被认为和某些神经系统疾病相关。其次,除了生物学意义以外,核酸的分子内二级结构在科学研究和生物技术领域也有很多实际应用。分子信标(molecularbeacon)是一类可以形成茎环结构(核酸分子内二级结构的一种类型)的单链dna或rna,通常被用来作为某些核酸检测方法中的探针。适配体(aptamer)是一类人为设计的单链dna或者rna,能够形成特殊的分子内二级结构以实现对蛋白质等不同类型分子的特异性识别。最后,核酸分子内二级结构对常用的分子生物学方法的一些实际应用也有一定的影响。例如,可以形成稳定的分子内二级结构的单链dna模板对pcr反应具有一定的抑制作用。
自1988年发明以来,聚合酶链式反应(pcr)已经成为生命科学、基础医学、体外诊断、食品安全、公共卫生监测和工业生物技术等多个领域中应用最广泛的分子生物学方法之一。由于具有指数放大效应,pcr可以达到检测低丰度序列所需的高灵敏度,因此已成为大多数核酸检测技术所采用的方法。随着荧光染料或荧光探针的引入,普通pcr升级为定量pcr而进一步提高了其灵敏度和特异性。在pcr反应中,双链dna模板首先在高温下解链成两条单链,然后反应体系温度快速降低,促使引物与模板的结合以启动聚合酶对引物的延伸直至形成完整的双链dna产物。其中在降温过程中,由于动力学的原因,自身含有互补序列的单链dna模板会首先形成分子内二级结构。稳定的模板分子内二级结构对pcr反应主要有两个方面的影响,首先是加大扩增反应的错误率;其次是降低pcr的技术性能。低丰度dna的检测对检测方法的灵敏度要求很高,如体外诊断中对癌症患者外周血中的循环肿瘤dna或者低载量的病原体的检测等。由于模板中稳定的分子内二级结构造成的pcr灵敏度的降低将会大大削弱其临床应用价值。
测序技术是另一种常用的分子生物学方法,在生命科学、基础医学和体外诊断等领域均有广泛的应用。特别是在新兴的基因治疗和核酸疫苗等领域中,由于这类产品直接应用于人体,出于安全性的考虑,必须保证每一个批次产品的核酸序列都完全相同。这一验证过程只能通过测序来完成。另外,以rna为模板合成dna的逆转录反应不仅在生物界广泛存在,而且在生命科学、基础医学和体外诊断等领域同样应用广泛。逆转录反应是以rna为检测对象的体外诊断技术的一个必不可少的步骤,其反应性能对最终的检测灵敏度和特异性有着重要影响。例如,作为rna病毒,新型冠状病毒(sars-cov-2)的核酸检测离不开逆转录反应。测序技术和逆转录反应的基本原理与pcr反应相同,都是以已有核酸分子为模板、通过碱基互补配对原则由核酸聚合酶合成新的核酸分子。因此,模板中稳定的分子内二级结构同样会对这两种分
目前,对于技术性能较差的pcr反应,除了常规的优化反应条件的策略(调整pcr反应配方中不同组份的浓度以及pcr反应程序中不同步骤的温度或时长等)以外,向反应体系中加入某些添加剂也可以达到提高pcr反应性能的作用,如二甲基亚砜(dmso)、甜菜碱(betaine)或甲酰胺(formamide)等。大部分技术性能较差的pcr反应往往是由于dna模板中富含gc造成的,其原因在于g-c碱基对的热稳定性显著高于a-t碱基对,因而在单链状态下更易于形成稳定的分子内二级结构。而dmso和betaine被认为可以降低分子内二级结构的稳定性,进而提高pcr反应性能。但此类添加剂仍有它们的局限性,比如,添加剂浓度过高会抑制dna聚合酶本身的活性、降低pcr反应的特异性以及加大产物错误率等。此外,如果模板的分子内二级结构非常稳定,在不产生严重副作用的前提下,此类添加剂提升pcr反应性能的作用非常有限,甚至完全无效。基于同一原理,包含稳定的单链分子内二级结构的富含gc的dna模板的测序反应的成功率也往往大大低于不含此类二级结构的模板。尽管向此类测序反应中加入上述添加剂可以部分地提升反应成功率,但与它们在pcr反应中所起的作用一样,这些添加剂提高测序反应成功率的作用具有同样的局限性。
综上所述,对于以核酸分子为模板、通过碱基互补配对原则由核酸聚合酶合成新的核酸分子的分子生物学方法,如pcr、测序、转录反应和逆转录反应等,模板单链中潜在的稳定的分子内二级结构往往对相应方法的技术性能产生不利影响,而且至今尚没有适用广泛、机理清晰且没有副作用的消除此类不利影响的方法。
技术实现要素:
为了克服现有技术的不足,本发明提供一种用于提高具有二级结构的单链核酸分子的复制效率的试剂,破坏模板单链中潜在的稳定的分子内二级结构的稳定性,消除模板单链中潜在的稳定的分子内二级结构对相应分子生物学技术产生的不利影响。
为了实现以上目的,本发明通过以下技术方案实现。
本发明提供一种用于提高具有二级结构的单链核酸分子的复制效率的试剂,所述试剂为寡聚核苷酸链,依次包括:
特异性序列,用以自单链核酸分子模板5’端所在侧与二级结构的第一茎臂序列互补配对;
末端修饰结构,用以阻止所述特异性序列的3’端通过核酸聚合酶而延伸;
其中,所述第一茎臂序列为二级结构靠近所述模板5’端一侧茎臂全部或至少一端序列段。
优选地,所述特异性序列包括用以与所述第一茎臂序列互补配对的碱基序列、至少一段用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列。
优选地,所述末端修饰结构包括小沟结合物、倒置dna核苷酸、c3间隔区、及不与所述模板杂交的寡聚核苷酸链。
优选地,所述试剂的合成单体包括脱氧核糖核苷酸、核糖核苷酸、非天然核苷酸;若干单体间连接方式包括磷酸二酯键连接或肽键连接。
优选地,用以与所述第一茎臂序列互补配对的碱基序列总长度为4~46nt;用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列总长度为4~46nt。
本发明第二个目的是提供一种核酸片段复制方法,在具有二级结构的单链核酸模板的体外复制反应体系中添加如上所述的用于提高具有二级结构的单链核酸分子的复制效率的试剂,通过所述试剂破坏所述模板中二级结构内的碱基配对,以消减分子内二级结构对核酸聚合酶的阻碍作用。
优选地,具体包括步骤:在核酸片段复制反应开始前,向反应体系中加入所述试剂;所述试剂的反应起始浓度为0.01μm~5μm。
优选地,还包括步骤:改变试剂特异性序列总长度以调整所述试剂消减分子内二级结构对核酸聚合酶的阻碍作用。
优选地,当体外复制反应体系中包括两种互补配对的模板时,添加两种分别与两互补配对的模板相匹配的试剂或添加一种与一所述模板相匹配的试剂。
本发明第三个目的是提供如上所述的用于提高具有二级结构的单链核酸分子的复制效率的试剂或如上所述的核酸片段复制方法在pcr反应或测序反应或转录反应或逆转录反应中的应用。
相比现有技术,本发明的有益效果在于:
本发明提供一种用于提高具有二级结构的单链核酸分子的复制效率的试剂,试剂在单链核酸复制过程中通过其特异性序列与模板内互补配对的二级结构相竞争,形成特异性序列与模板二级结构部分区域的杂交产物同时解链模板中二级结构,进而在引物延伸过程中消除模板中二级结构对核酸聚合酶的阻碍作用。对于具有稳定的分子内二级结构的核酸单链模板,也能顺利开展相应的通过聚合酶合成新的核酸分子的分子生物学技术工作,消除模板单链中潜在的稳定的分子内二级结构对分子生物学技术产生的不利影响。
本上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。本发明的具体实施方式由以下实施例及其附图详细给出。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1为本发明的试剂与单链核酸模板匹配关系示意图;
图2为本发明一实施例中试剂用于pcr反应的步骤流程图;
图3为本发明一实施例中egfr靶序列与正向解链剂、反向解链剂的匹配关系图;
图4为本发明一实施例中egfr靶序列添加和不添加解链剂的荧光定量pcr实验结果;
图5为本发明一实施例中改造后的egfr靶序列与相应正向解链剂、反向解链剂的匹配关系图;
图6为本发明一实施例中以改造后的egfr靶序列为模板加入不同浓度的解链剂对后的荧光定量pcr反应结果;
图7为对图6实验的荧光定量pcr终产物进行3%琼脂糖凝胶电泳实验的结果;
图8为本发明一实施例中以改造后的egfr靶序列为模板加入不同长度的解链剂对后的荧光定量pcr反应结果;
图9为对图8实验的荧光定量pcr终产物进行3%琼脂糖凝胶电泳实验的结果;
图10为本发明一实施例中某一市售raav载体质粒itr及其周边序列经mfold软件预测的分子内二级结构;
图11为本发明一实施例中以某一市售raav载体质粒为模板、加入不同浓度的解链剂对以扩增itr序列的荧光定量pcr反应结果;
图12为对图11实验的荧光定量pcr终产物进行3%琼脂糖凝胶电泳实验的结果。
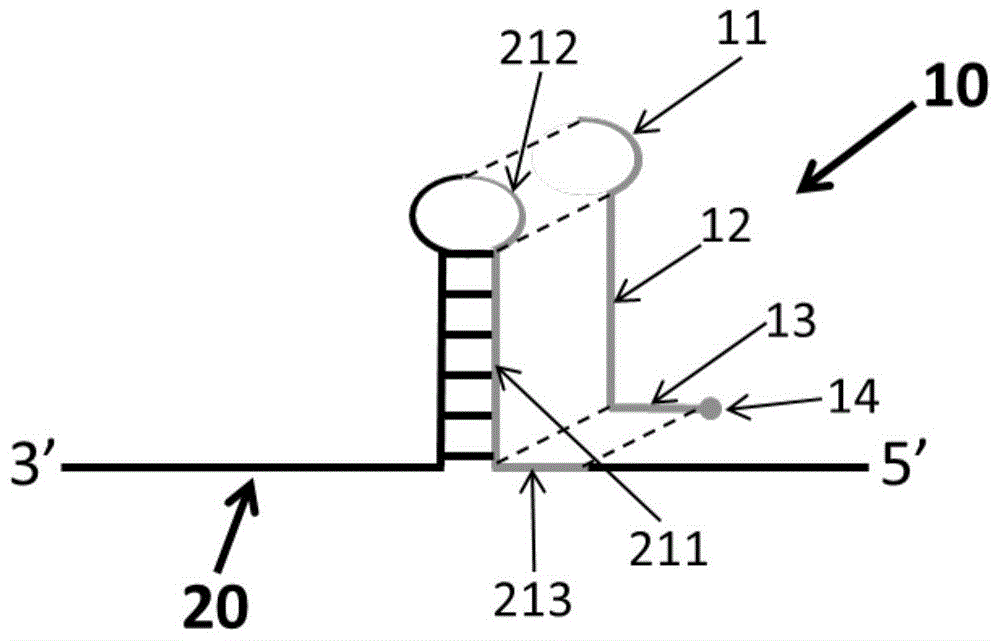
图中;10、解链剂;11、第一序列;12、第二序列;13、第三序列;14、末端修饰结构;
20、单链模板;211、第一茎臂序列;212、部分环序列;213、部分侧链序列。
具体实施方式
下面结合附图对本发明做进一步的详细说明,本发明的前述和其它目的、特征、方面和优点将变得更加明显,以令本领域技术人员参照说明书文字能够据以实施。在附图中,为清晰起见,可对形状和尺寸进行放大,并将在所有图中使用相同的附图标记来指示相同或相似的部件。在下列描述中,诸如中心、厚度、高度、长度、前部、背部、后部、左边、右边、顶部、底部、上部、下部等用词为基于附图所示的方位或位置关系。特别地,“高度”相当于从顶部到底部的尺寸,“宽度”相当于从左边到右边的尺寸,“深度”相当于从前到后的尺寸。这些相对术语是为了说明方便起见并且通常并不旨在需要具体取向。涉及附接、联接等的术语(例如,“连接”和“附接”)是指这些结构通过中间结构彼此直接或间接固定或附接的关系、以及可动或刚性附接或关系,除非以其他方式明确地说明。
下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
实施例1
在以已有核酸分子为模板、通过碱基互补配对原则由核酸聚合酶合成新的核酸分子的核酸复制工程中,作为模板的单链核酸分子中二级结构会影响核酸复制效率,当二级结构足够稳定时,也可能导致核酸复制失败。比如,在prc反应中,在反应的退火阶段,温度快速降低,模板的分子内二级结构因动力学优势进而先于引物与模板的杂交产物形成,当形成的分子内二级结构足够稳定时,在延伸阶段会阻碍核酸聚合酶对引物的延伸,造成反应的提前终止或反应效率的降低。
本发明提供一种用于提高具有二级结构的单链核酸分子的复制效率的试剂,通常情况下,当单链核酸分子在内部存在互补序列时,按照碱基互补配对原则可以形成分子内二级结构;所述试剂(英文为disruptor)为寡聚核苷酸链,依次包括:
特异性序列,用以自单链核酸分子模板5’端所在侧与二级结构的第一茎臂序列互补配对;具体地,在单链核酸复制过程中试剂的特异性序列与模板内互补配对的二级结构相竞争,形成特异性序列与模板二级结构部分区域的杂交产物同时解链模板中二级结构,进而在引物延伸过程中消除模板中二级结构对核酸聚合酶的阻碍作用;即特异性序列可以解开单链核酸分子中的二级结构的全部或局部互补配对结构,命名该试剂为解链剂;下文均以解链剂来阐述本发明所述试剂,但不可因解链剂的文字描述来限定本发明的试剂的用途;
末端修饰结构,用以阻止所述特异性序列的3’端通过核酸聚合酶而延伸;具体地,以pcr扩增反应为例,在退火阶段,引物与模板互补结合形成杂交链,然后在核酸聚合酶作用下以互补配对的方式依次将dntp加至引物的3’端,使杂交双链不断延伸以形成新的dna双链,在延伸过程中,解链剂的末端修饰结构能够防止特异性序列的3’端在核酸聚合酶作用下继续延伸;
其中,所述第一茎臂序列为二级结构靠近所述模板5’端一侧茎臂全部或至少一端序列段。如图1所示,二级结构竖向呈现时,二级结构靠近所述模板5’端的一侧茎臂,该侧茎臂记为第一侧茎,至少一端序列段表示该侧茎臂的上部分序列或下部分序列。具体地,模板的二级结构通常呈茎环结构或发夹结构,茎环结构与发夹结构形成原理相同、结构相似,在此以茎环结构为例。二级结构的茎环结构包括茎和环,茎由两个相邻的完全或部分互补的序列(二级结构两侧茎臂)形成,这两个相邻的完全或部分互补的序列彼此形成碱基对且被环的序列结构隔开。由于核酸复制从模板的3’端开始,若解链剂自单链核酸分子模板3’端所在侧与二级结构的一侧茎臂序列互补配对,核酸聚合酶会影响解链剂的性能,进而影响了解链剂对模板二级结构的破坏力度。
在一实施例中,所述特异性序列包括用以与所述第一茎臂序列互补配对的碱基序列、至少一段用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列。通过在解链剂中设计至少一段用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列,使得解链剂与模板分子内二级结构相竞争形成的杂交产物更稳固,不易再逆反应形成分子内二级结构。具体地,如图1所示,为单链模板20与解链剂10的配对关系图,二级结构竖向呈现时,在一实施例中,第一茎臂序列211为二级结构靠近所述模板5’端一侧茎臂(第一侧茎)全部或上部分序列段时,所述特异性序列依次包括第一序列11、第二序列12,第二序列12用以与第一茎臂序列211互补配对,第一序列11用以与第一茎臂序列211上部分末端延续的非互补配对序列(即部分环序列)进行配对;在又一实施例中,第一茎臂序列211为二级结构靠近所述模板5’端一侧茎臂全部或下部分序列段时,所述特异性序列依次包括第二序列12、第三序列13,第二序列12用以与第一茎臂序列211互补配对,第三序列13用以与第一茎臂序列下部分末端延续的非互补配对序列(即与二级结构相连的模板5’端侧链序列)进行配对;在又一实施例中,第一茎臂序列211为二级结构靠近所述模板5’端一侧茎臂全部序列段时,所述特异性序列依次包括第一序列11、第二序列12、第三序列13,以分别与第一茎臂序列211一侧的部分环序列212、第一茎臂序列211、第一茎臂序列另一侧的部分侧链序列213相配对。应当理解,图1为解链剂的特异性序列依次包括第一序列、第二序列、第三序列的示意图,第三序列位于解链剂3’端,还连接有末端修饰结构14。当特异性序列依次包括第一序列、第二序列或依次包括第二序列、第三序列,解链剂的结构示意图略有改变,解链剂结构设计原理如上所述。
优选地,所述末端修饰结构包括小沟结合物(minorgroovebinder)、倒置dna核苷酸(inverteddnanucleotide)、c3间隔区(c3spacer)、与所述模板不杂交的寡聚核苷酸链等可以阻止单链核酸的3’端通过核酸聚合酶而延伸的化学修饰基团。具体地,在一实施例中,小沟结合物是一种可以非共价结合到双链dna小沟中的化学基团,可以阻止所述特异性序列的3’端通过核酸聚合酶而延伸。在又一实施例中,c3间隔区即3-碳间隔区,通过在解链剂中引进一个间隔区从而阻止所述特异性序列的3’端通过核酸聚合酶而延伸。在又一实施例中,通过在特异性序列的3’端设置与所述模板不互补配对的寡聚核苷酸链,以防止核酸聚合酶延伸。
在一实施例中,所述试剂合成单体包括但不限于脱氧核糖核苷酸、核糖核苷酸、非天然核苷酸。其中,非天然核苷酸表示人工合成的、非天然存在的核苷酸,包括但不限于化学修饰的核苷酸,如锁定的核苷酸(lockednucleotide)、吗啉代核苷酸(morpholinonucleotide)、己糖醇核苷酸(hexitolnucleotide)、核酮糖核苷酸(ribulosenucleotide)、氟代核苷酸(fluorinatednucleotide)、烷基核苷酸(alkylatednucleotide)、硫代磷酸核苷酸(phosphorothioatenucleotide)等。若干单体间连接方式包括但不限于磷酸二酯键或肽键,其中,磷酸二酯键和肽键包括天然的或人工合成的。
在一实施例中,用以与所述第一茎臂序列互补配对的碱基序列总长度为4~46nt。在一实施例中,用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列总长度为4~46nt。通过限定与所述第一茎臂序列互补配对的碱基序列总长度及限定用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列总长度,以保证解链剂解链模板分子中二级结构的效率。其中,当特异性序列分别与第一茎臂序列一侧的环的序列、第一茎臂序列、第一茎臂序列另一侧的侧链序列相配对时,用以与所述第一茎臂序列末端延续的非互补配对序列进行互补配对的碱基序列总长度包括分别与第一茎臂序列一侧的环的序列、第一茎臂序列另一侧的侧链序列配对的碱基序列的长度,即为第一序列、第三序列长度总和。
实施例2
本发明提供一种核酸片段复制方法,在具有二级结构的单链核酸模板的体外复制反应体系中添加如上所述的用于提高具有二级结构的单链核酸分子的复制效率的试剂,通过所述试剂破坏所述模板中二级结构内的碱基配对,以消减分子内二级结构对核酸聚合酶的阻碍作用,即避免二级结构在延伸阶段阻碍核酸聚合酶对引物的延伸,以提高核酸片段复制效率。
具体包括步骤:在核酸片段复制反应开始前,向反应体系中加入一定浓度的所述试剂;所述试剂的反应起始浓度为0.01μm~5μm。
进一步地,还包括步骤:改变试剂特异性序列总长度以调整所述试剂消减分子内二级结构对核酸聚合酶的阻碍作用。具体地,通过增减解链剂的特异性序列总长度,找出对相应单链核酸模板匹配的解链剂的最佳长度,以提高解链剂破坏相应单链核酸模板分子内二级结构稳定性的程度。
当体外复制反应体系中包括两种互补配对的模板时,添加两种分别与两互补配对的模板相匹配的试剂或添加一种与一所述模板相匹配的试剂。当添加两种分别与两互补配对的模板相匹配的试剂时,可同时提高两种模板核酸复制效率;当添加一种与一所述模板相匹配的试剂时,可提高该模板核酸复制效率。
在一实施例中,以荧光定量pcr反应为例,具体包括以下步骤:
(1)准备所需试剂,室温融化后充分混匀;
(2)配置反应溶液,包括聚合酶、4种dntp混合物、正向引物、反向引物、正向解链剂、反向解链剂、dna模板以及pcr缓冲液;
(3)开启pcr反应。
具体地,包括步骤:提前将所需试剂取出,室温融化后充分混匀。按照已经确定的反应体系配制反应溶液:1xpcr缓冲液,4mmmg2+,0.06u/μl聚合酶,0.3mm4种dntp混合物,0.2μm正向引物,0.2μm反向引物,0.1μm荧光探针,1μm正向disruptor(解链剂)和/或1μm反向disruptor,以及10、100、1000或10000拷贝/反应的hela细胞基因组dna。pcr的反应程序为:95℃15分钟激活taq聚合酶,45个循环的95℃变性15秒和52℃退火延伸并读取荧光信号30秒,4℃降温1分钟。其中,在一实施例中,正向引物序列为seqidno:1;反向引物序列为seqidno:2;荧光探针序列为seqidno:3;正向disruptor序列为seqidno:4;反向disruptor序列为seqidno:5。所述seqidno:1具体为tctccctccctccagg。所述seqidno:2具体为agggcatgagctgcg。所述seqidno:3具体为gagctgcacggtggaggtg。所述seqidno:4具体为gggttgtccacgctggccatcacgtaggctaaaa。所述seqidno:5具体为acgtgtgccgcctgctgggcatctgcctcaaaaa。正向disruptor及反向disruptor的末端修饰结构为四个不与模板互补的碱基以阻碍相应解链剂被dna聚合酶延伸,该方法简单有效、成本低。正向disruptor及反向disruptor的特异性序列总长度均为30nt,同时覆盖模板分子内二级结构的二级结构靠近所述模板5’端一侧茎臂全部序列段及该侧茎臂两末端处延续的部分非互补配对序列。
pcr反应原理如图2所示,以一种单链模板为例,在反应体系中加入一种解链剂(disruptor)。在降温和退火阶段,引物与dna模板3’端互补配对;同时,解链剂与模板的分子内二级结构相竞争,形成特异性序列与模板二级结构部分区域的杂交产物同时解链模板中二级结构,在dna聚合酶作用下,引物继续延伸合成双链产物。引物继续延伸过程中,不同核酸聚合酶抵达disruptor和模板的配对区域时,可通过不同机制(如taq聚合酶可以通过其5’-3’外切酶活性逐步降解disruptor)打破这一配对结构,进而完成完整的双链产物的合成。
实施例3
本发明提供一种如上所述的用于提高具有二级结构的单链核酸分子的复制效率的试剂或如上所述的核酸片段复制方法在pcr反应或测序反应或转录反应或逆转录反应中的应用。具体地,对于任何以单链核酸为模板且模板具有二级结构、通过碱基互补配对原则由核酸聚合酶合成新的核酸分子的分子生物学方法中均可应用上述解链剂或上述核酸片段复制方法,通过解链剂解链模板中的二级结构,以使得上述分子生物学方法顺利进行,以免因模板二级结构的稳定性影响延伸阶段的进行。
为了阐述本文的发明,以下以具体实施例进行阐述。应当理解这些实施例仅用于说明性目的并且不应被理解为以任何方式限制本发明。
实施例4
解链剂在提高基因组dna中egfr基因靶序列的检测灵敏度中的应用
使用mfold软件分析egfr靶序列的结构,egfr靶序列如图3所示,图3模板中实线下划线标记正向引物和反向引物的互补配对序列;虚线下划线标记荧光探针的互补配对序列;模板中灰色字体标记正向和反向靶序列中分别与正向disruptor、反向disruptor互补的序列。根据预测所得的二级结构设计扩增用引物和探针,并针对分子内二级结构设计正向和反向disruptor。设计所得的各寡聚核苷酸的序列如下:正向引物序列为seqidno:1;反向引物序列为seqidno:2;荧光探针在5’端标记rox荧光基团,在3’端标记bhq2淬灭基团,序列为seqidno:3;正向disruptor序列为seqidno:4;反向disruptor序列为seqidno:5。disruptor的3’端增加了4个不与靶序列互补的碱基以阻碍其被dna聚合酶延伸,这种方法简单经济有效。正向disruptor及反向disruptor的特异性序列总长度均为30nt,同时覆盖模板分子内二级结构的二级结构靠近所述模板5’端一侧茎臂全部序列段及该侧茎臂两末端处延续的部分非互补配对序列。
荧光定量pcr反应包括步骤:提前将所需试剂取出,室温融化后充分混匀。按照已经确定的反应体系配制反应溶液:1xpcr缓冲液,4mmmg2+,0.06u/μltaq聚合酶,0.3mm4种dntp混合物,0.2μm正向引物,0.2μm反向引物,0.1μm荧光探针,1μm正向disruptor(解链剂)和/或1μm反向disruptor,以及10、100、1000或10000拷贝/反应的hela细胞基因组dna。pcr的反应程序为:95℃15分钟激活taq聚合酶,45个循环的95℃变性15秒和52℃退火延伸并读取荧光信号30秒,4℃降温1分钟。
图4为egfr靶序列在添加和不添加disruptor条件下的荧光定量pcr实验结果。*表示3个技术重复中只有2个检测出荧光信号。由图4可知,egfr靶序列的荧光定量pcr反应在未添加disruptor的条件下,10拷贝/反应模板浓度的3个技术重复均未检测到荧光信号,而且100、1000和10000拷贝/反应模板浓度的检测结果ct值也相对较高。当向反应体系中加入1μm的单个disruptor后,100、1000和10000拷贝/反应模板浓度的实验结果ct值显著降低,同时10拷贝/反应模板浓度的3个技术重复中有2个检测到荧光信号。向反应体系中同时加入各1μm的正向disruptor和反向disruptor后,4个梯度的模板浓度的实验结果ct值进一步降低,而且10拷贝/反应模板浓度的3个技术重复全部检测到荧光信号。上述结果表明,pcr反应体系中加入disruptor显著提高了对于能够形成稳定的分子内二级结构的模板序列的检测灵敏度。
实施例5
解链剂提高含有热稳定性非常高的分子内二级结构的靶序列的检测能力
egfr靶序列的改造及其结构预测:如图5所示,在实施案例4中的egfr靶序列中依据碱基互补配对原则引入6个点突变使egfr靶序列二级结构包含长15nt的两段互补序列。mfold软件对改造后的靶序列的分析验证了长15bp的分子内双链的形成。图5中实线下划线标记正向和反向引物的互补配对序列;虚线下划线标记荧光探针的互补配对序列;模板中灰色字体标记靶序列中与正向disruptor或反向disruptor互补配对的碱基对。
(一)解链剂浓度对具有分子内二级结构的靶序列的检测能力的影响
提前将所需试剂取出,室温融化后充分混匀。按照已经确定的反应体系配制反应溶液:1xpcr缓冲液,4mmmg2+,0.06u/μltaq聚合酶,0.3mm4种dntp混合物,0.2μm正向引物(seqidno:1),0.2μm反向引物(seqidno:2),0.1μm荧光探针(seqidno:3);正向disruptor(seqidno:9)和相同浓度的反向匹配disruptor(seqidno:14),所述seqidno:9具体为gggttgcgcctgctgggcatcacgtaggctaaaa;所述seqidno:14具体为acgtgtgccgcctgctgggcatctgcctcaaaaa;以及3000拷贝/反应的含有改造后的egfr基因靶序列的质粒dna。分别配置六个实验组,六个实验组中正向disruptor初始反应浓度分别为0.2μm、0.5μm、1μm、2μm、3μm、5μm。另外不加disruptor的实验作为对照组。pcr的反应程序为:95℃15分钟激活taq聚合酶,45个循环的95℃变性15秒和52℃退火延伸并读取荧光信号30秒,4℃降温1分钟。并作荧光定量pcr产物的电泳分析,混匀10μlpcr产物和1.5μl加样缓冲液,在3%的琼脂糖凝胶上于90v电压下电泳50分钟。其中,
图6为不同解链剂浓度下,以改造后的egfr靶序列为模板的荧光定量pcr反应结果。图7为图6实验的荧光定量pcr终产物进行3%琼脂糖凝胶电泳实验的结果。在反应体系中没有添加disruptor的情况下,以改造后的靶序列为模板的pcr反应没有检测到任何荧光信号,既未检出定量pcr结果ct值,在凝胶电泳实验中也观测不到产物条带。加入一对浓度相同的正向disruptor及反向disruptor之后,pcr反应不仅可以检出ct值,而且随着这一对disruptor浓度的增加,检出的ct值逐步降低,凝胶电泳实验中的产物条带也从无到有且条带亮度逐步加强。
(二)解链剂特异性序列总长度对具有分子内二级结构的靶序列的检测能力的影响(1)针对预测的改造后的egfr靶序列分子内二级结构设计长度不同的正向disruptor和匹配的反向disruptor。
具体地,在一实施例中,正向disruptorf1序列为seqidno:6;反向disruptorr1序列为seqidno:11。
所述seqidno:6具体为cgcctgctgggcatcacgtagaaaa;所述seqidno:11具体为gccgcctgctgggcatctgccaaaa。正向disruptorf1、反向disruptorr1的特异性序列总长度均为21nt,作为实验组1的解链剂。
在又一实施例中,正向disruptorf2序列为seqidno:7;反向disruptorr2序列为seqidno:12。
所述seqidno:7具体为ttgcgcctgctgggcatcacgtagaaaa;所述seqidno:12具体为tgtgccgcctgctgggcatctgccaaaa。正向disruptorf2、反向disruptorr2的特异性序列总长度均为24nt,作为实验组2的解链剂。
在又一实施例中,正向disruptorf3序列为seqidno:8;反向disruptorr3序列为seqidno:13。
所述seqidno:8具体为gggttgcgcctgctgggcatcacgtagaaaa;所述seqidno:13具体为tgtgccgcctgctgggcatctgcctcaaaaa。正向disruptorf3、反向disruptorr3的特异性序列总长度均为27nt,作为实验组3的解链剂。
在又一实施例中,正向disruptorf4序列为seqidno:9;反向disruptorr4序列为seqidno:14。
所述seqidno:9具体为gggttgcgcctgctgggcatcacgtaggctaaaa;所述seqidno:14具体为acgtgtgccgcctgctgggcatctgcctcaaaaa。正向disruptorf4、反向disruptorr4的特异性序列总长度均为30nt,作为实验组4的解链剂。
在又一实施例中,正向disruptorf5序列为seqidno:10;反向disruptorr5序列为seqidno:15。
所述seqidno:10具体为tgggggttgcgcctgctgggcatcacgtaggctaaaa;所述seqidno:15具体为cccacgtgtgccgcctgctgggcatctgcctcaaaaa。正向disruptorf5、反向disruptorr5的特异性序列总长度均为33nt,作为实验组5的解链剂。
上述各实施例与实施例4相同,相应disruptor的3’端四个不与模板互补的碱基以阻碍相应解链剂被dna聚合酶延伸,这种方法简单经济有效。特异性序列长度在21至33nt之间,同时覆盖靶序列分子内二级结构的互补配对区域和非互补配对区域。图5以正向disruptorf5、反向disruptorr5为例进行说明。
(3)荧光定量pcr反应
提前将所需试剂取出,室温融化后充分混匀。按照已经确定的反应体系配制反应溶液:1xpcr缓冲液,4mmmg2+,0.06u/μltaq聚合酶,0.3mm4种dntp混合物,0.2μm正向引物(seqidno:1),0.2μm反向引物(seqidno:2),0.1μm荧光探针(seqidno:3);2μm正向disruptor(seqidno:6至10中的一个)和相同浓度的反向匹配disruptor以分别形成实验组1至实验组5五个组别的原料;以及3000拷贝/反应的含有改造后的egfr基因靶序列的质粒dna。不加disruptor的实验作为对照组。pcr的反应程序为:95℃15分钟激活taq聚合酶,45个循环的95℃变性15秒和52℃退火延伸并读取荧光信号30秒,4℃降温1分钟。
(1)荧光定量pcr产物的电泳分析
混匀10μlpcr产物和1.5μl加样缓冲液,在3%的琼脂糖凝胶上于90v电压下电泳50分钟。
图8为在反应体系中加入浓度相同、长度不同的disruptor对的情况下,以改造后的egfr靶序列为模板的荧光定量pcr反应结果。图9为对图8实验的荧光定量pcr终产物进行3%琼脂糖凝胶电泳实验的结果。在反应体系中没有添加disruptor的情况下,以改造后的靶序列为模板的pcr反应没有检测到任何荧光信号,既未检出定量pcr结果ct值,在凝胶电泳实验中也观测不到产物条带。向反应体系中加入相同浓度但长度不同的disruptor对时可以观测到相同的趋势,pcr反应不仅可以检出ct值,而且随着disruptor长度的进一步加长,检出的ct值逐步降低,凝胶电泳实验中的产物条带也从无到有且条带亮度逐步加强。应当理解,图8、图9中的disruptor长度是指解链剂中特异性序列的总长度。
综上可知,对于同一个含有稳定的分子内二级结构的dna模板来说,在一定的disruptor长度范围内添加的disruptor长度越长或在一定的disruptor浓度范围内浓度越高,pcr反应的检测灵敏度越高。
实施例6
加入解链剂大大提高了raav的itr序列的pcr扩增效率
(1)raav载体的itr序列的分子内二级结构的确认
raav载体的两个itr分别折叠成形似t形发夹的分子内二级结构。这种t形发夹结构具有超强的热稳定性,使得覆盖该区域的pcr反应和测序反应往往成功率很低,不利于以raav为载体的科学研究和临床应用。mfold软件对于某一市售的raav载体质粒itr序列的分析确认了t形发夹结构的存在,如图10所示,图10中实线标记正向和反向引物的互补配对序列;虚线标记荧光探针的互补配对序列;模板中灰色字体标记分别与相应正向disruptor、反向disruptor互补配对的序列。
(2)设计荧光定量pcr反应的引物和探针,并针对预测的t形发夹结构设计正向和反向disruptor。
设计的各寡聚核苷酸的序列如下:正向引物序列为seqidno:16;反向引物序列为seqidno:17;荧光探针在5’端标记fam荧光基团,在3’端标记bhq1淬灭基团,荧光探针序列为seqidno:18;正向disruptor序列为seqidno:19;反向disruptor序列为seqidno:20。两个disruptor的3’端均增加了四个不与靶序列互补的碱基以阻碍其被dna聚合酶延伸,这种方法简单经济有效。如图10所示,disruptor的特异性序列总长度为36nt,同时覆盖部分t形发夹结构的互补配对区域和t形发夹结构以外的非互补配对区域。其中,seqidno:16具体为gtaaccacgtgcggaccgag;
seqidno:17具体为tgtcgagactgcaggctctag;
seqidno:18具体为tcgaaagcggccgcgactagt;
seqidno:19具体为gagcgagcgagcgcgcagagagggagtggccaactcataa;
seqidno:20具体为gagcgagcgagcgcgcagctgcctgcaggggccctaaaaa。
(3)荧光定量pcr反应:提前将所需试剂取出,室温融化后充分混匀。按照已经确定的反应体系配制反应溶液:1xpcr缓冲液,4mmmg2+,0.06u/μltaq聚合酶,0.3mm4种dntp混合物,0.3μm正向引物(seqidno:16),0.3μm反向引物(seqidno:17),0.1μm荧光探针(seqidno:18),正向disruptor(seqidno:19)和相同浓度反向disruptor(seqidno:20)以及3000拷贝/反应某市售raav载体质粒dna。分别配置六个实验组,六个实验组中正向disruptor初始反应浓度分别为0.2μm、0.5μm、1μm、2μm、3μm、5μm。另外不加disruptor的实验作为对照。pcr的反应程序为:95℃15分钟激活taq聚合酶,45个循环的95℃变性10秒、54℃退火30秒并读取荧光以及72℃延伸20秒,4℃降温1分钟。
(4)荧光定量pcr产物的电泳分析:混匀10μlpcr产物和1.5μl加样缓冲液,在3%的琼脂糖凝胶上于90v电压下电泳50分钟。
图11为在反应体系中加入不同浓度一对disruptor(seqidno:19和20)的情况下,以某一市售raav载体质粒为模板、扩增其itr序列的荧光定量pcr反应结果。图12为对图11实验的荧光定量pcr终产物进行3%琼脂糖凝胶电泳实验的结果。在disruptor浓度为5μm时,由于反应体系中寡聚核苷酸浓度过高,寡聚核苷酸之间形成了二聚体,反而对pcr反应产生了一定的抑制作用。raav载体质粒的itr序列形成具有超高热稳定性的t形发夹结构。在反应体系中没有添加disruptor的情况下,扩增该质粒的itr序列的pcr反应效果很差。定量pcr结果的ct值很高,达到42.3,在凝胶电泳实验中则观测不到产物条带。当向反应体系中加入不同浓度的同一对36ntdisruptor(seqidno:19和20)时,随着disruptor浓度逐步升高至3μm,pcr反应检出的ct值逐步降低,凝胶电泳实验中的产物条带亮度也逐步加强。但当disruptor浓度达到5μm时,与3μmdisruptor浓度的实验条件相比,ct值反而升高了,凝胶电泳实验中的产物条带亮度也有所变暗。这一结果表明对于同一个含有非常稳定的分子内二级结构的dna模板来说,在一定范围内,添加的disruptor浓度越高,pcr反应的检测效果越好。但当disruptor浓度过高时,由于反应体系中寡聚核苷酸的总浓度过高形成的寡聚核苷酸二聚体反而会抑制pcr反应。因此,利用disruptor消除模板的分子内二级结构对pcr反应的抑制作用时,加入的disruptor存在一个最佳的浓度区间,并不是disruptor浓度越高效果越好。
本发明涉及的序列如表一所示。
表一
以上,仅为本发明的较佳实施例而已,并非对本发明作任何形式上的限制;凡本行业的普通技术人员均可按说明书附图所示和以上而顺畅地实施本发明;但是,凡熟悉本专业的技术人员在不脱离本发明技术方案范围内,利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对以上实施例所作的任何等同变化的更动、修饰与演变等,均仍属于本发明的技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种开发蛋白质分子电子器件的电化学钳及其制作方法
- 包括小分子热休克蛋白(sHSPs)用于防止蛋白质降解的组合物以及利用sHSPs的二维凝胶 ...的制作方法
- 一种分子生物传感器及其对dna或蛋白质进行单分子检测的方法
- 一种双抗体复合的视黄醇结合蛋白检测试剂盒的制作方法
- 一种瓜籽多肽的制作方法
- 排斥性引导分子(rgm)蛋白质家族的蛋白的骨形态发生蛋白(bmp)-结合结构域及其功能 ...的制作方法
- 一种血清白蛋白/γ球蛋白分离纯化用装置的制作方法
- 带计量的血清白蛋白/γ球蛋白分离纯化用装置的制作方法
- 排斥性引导分子(rgm)蛋白质家族的蛋白质的结合结构域及其功能性片段和它们的用途的制作方法
- 一种肝癌转移相关蛋白质分子ck19的筛选及其应用的制作方法