一种微藻培养基及其应用
1.本申请属于微藻培养的技术领域,尤其涉及一种微藻培养基及其应用。
背景技术:
2.微藻是一类在陆地、海洋分布广泛,营养丰富、光合利用度高的自养植物,细胞代谢产生的多糖、蛋白质、色素等,使其在食品、医药、基因工程、液体燃料等领域具有很好的开发前景。藻类个体大小悬殊,其中,只有在显微镜下才能分辨其形态的微小藻类类群被人们称为微藻(microalgae),故此微藻不是一个分类学上的名称。
3.微藻体内富含多种营养成分,例如裸藻就富含多种优异成分,包括裸藻多糖、氨基酸、不饱和脂肪酸、维生素和抗氧化成分。其中裸藻多糖为线性β
‑
1,3
‑
葡聚糖构成,不易被人体消化,可以吸附人体内多余的物质并排除体外,具有极高的抗氧化功效。此外裸藻合成氨基酸的能力强,含有人类所需的所有氨基酸。在日本和欧洲,裸藻已经作为丰富的营养添加剂而广泛应用于食品和保健品中。我国在2013年批准裸藻为新食品原料,农业部也于2018年将裸藻纳入饲料原料目录。
4.采用传统的微藻培养基培养微藻过程中,存在以下问题,一方面,传统的微藻培养基成本较高,导致微藻培养的成本增加;另一方面,微藻的增值速率和多糖的产率较低,无法满足目前商业化需求。因此,研发一种廉价能显著促进微藻生物量和微藻多糖的培养基是本领域技术人员亟待解决的技术问题。
技术实现要素:
5.有鉴于此,本申请提供了一种微藻培养基及其应用,能显著促进微藻生物量和微藻多糖的积累,而且采用本申请的微藻培养基培养微藻的效率高,成本低,具有广泛的工业应用前景。
6.本申请第一方面提供了一种微藻培养基,包括:
7.碳源、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水;
8.所述碳源选自餐厨垃圾水解液和/或甘油制品。
9.更优选的,所述碳源为餐厨垃圾水解液和甘油制品。
10.作为优选,所述餐厨垃圾水解液为干燥的餐厨垃圾经酶水解后的餐厨垃圾水解液。
11.其中,餐厨垃圾中总糖含量为550.3mg/g,淀粉含量为481.1mg/g,蛋白含量为89.4mg/g,总脂含量为141.6mg/g。
12.其中,所述餐厨垃圾包括小麦、水稻、玉米、土豆、红薯及其制品,优选的,所述餐厨垃圾为小麦制品。所述餐厨垃圾的收集地点包括并不限于食堂、餐馆、家庭和市场。
13.作为优选,所述酶选自葡萄糖淀粉酶、糖化酶、γ
‑
淀粉酶和葡萄糖苷酶中的一种或多种。
14.作为优选,按照浓度计算,在所述水中,包括:
[0015][0016]
具体的,所述甘油制品为粗甘油,所述粗甘油在所述水中浓度为100
‑
400mm。
[0017]
更优选的,所述餐厨垃圾水解液的浓度为20
‑
40g/l;所述粗甘油的浓度为200
‑
400mm。最优选的,所述餐厨垃圾水解液的浓度为20g/l;所述粗甘油的浓度为200mm。
[0018]
作为优选,所述甘油制品的甘油含量为75%
‑
95%。
[0019]
其中,所述甘油制品为工业副产物来源的粗甘油。
[0020]
其中,所述甘油制品可以为粗甘油或商品化甘油,所述粗甘油包括甘油、水、灰烬、氯化钠和甲醇;按照质量份计算,75
‑
95份甘油、3.5
‑
18.5份水、0.27份灰烬、0.2份氯化钠和0.15份甲醇。
[0021]
本申请第二方面公开了所述的微藻培养基在促进微藻增值和促进微藻积累多糖中的应用。
[0022]
作为优选,所述选自裸藻、小球藻、杜氏盐藻或雨生红球藻。
[0023]
更优选的,所述选自裸藻。
[0024]
其中,根据培养的微藻来源选自海水或者淡水,例如培养裸藻时,所述水选择淡水。
[0025]
作为优选,所述应用的方法包括:将微藻接种至所述微藻培养基中进行异养或混养培养;所述微藻培养基包括碳源、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水;
[0026]
所述碳源选自餐厨垃圾水解液和/或甘油制品;
[0027]
所述水选自海水或淡水。
[0028]
作为优选,所述微藻培养基中,按照浓度计算,在所述水中,包括:
[0029][0030]
作为优选,所述应用的方法包括:将微藻接种至所述第一微藻培养基中进行异样
或混养培养,待所述微藻进入所述微藻的指数期时,将所述甘油制品加入所述第一微藻培养基中,对所述微藻继续培养,直至培养结束;所述第一微藻培养基包括餐厨垃圾水解液、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水。
[0031]
作为优选,所述第一微藻培养基中,按照浓度计算,在所述水中,包括:
[0032][0033][0034]
作为优选,所述应用的方法包括:将微藻接种至所述第二微藻培养基中进行异样或混养培养,待所述微藻进入所述微藻的指数期时,将所述餐厨垃圾水解液加入所述第二微藻培养基中,对所述微藻继续培养,直至培养结束;所述第二微藻培养基包括甘油制品、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水。
[0035]
作为优选,所述甘油制品选自粗甘油;按照浓度计算,在所述水中,包括:
[0036][0037]
其中,所述微藻的指数期为从接种第一天计算起的第2~4天。
[0038]
作为优选,所述微藻接种至所述微藻培养基中的初始密度为1
×
105‑1×
106个/ml。
[0039]
更为优选,所述微藻接种至所述微藻培养基中的初始密度为1.5
×
105个/ml。
[0040]
作为优选,所述微藻从接种开始至结束培养的培养周期为4
‑
8天。
[0041]
更为优选,所述微藻从接种开始至结束培养的培养周期为6天。
[0042]
更为优选,所述微藻的培养为异养。
[0043]
本申请第三方面公开了所述的微藻培养基的制备方法,包括:
[0044]
将碳源、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水混合,灭菌后制得微藻培养基;其中,所述碳源选自餐厨垃圾水解液和/或甘油制品。
[0045]
作为优选,所述灭菌的方法为过0.22μm膜的过滤灭菌、高温灭菌、紫外灭菌等现有常规灭菌方式。
[0046]
作为优选,所述碳源添加到所述微藻培养基的方式可以为餐厨垃圾水解液或甘油制品单独添加,或餐厨垃圾水解液和甘油制品分批添加。
[0047]
其中,所述餐厨垃圾水解液和甘油制品分批添加的方法为:
[0048]
先将餐厨垃圾水解液、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水混合,配制为第一微藻培养基后,微藻接种至所述第一培养基后,在所述微藻的指数期中添加甘油制品至所述第一培养基后继续培养,完成所述微藻培养基的配制;
[0049]
先将甘油制品、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水混合,配制为第二微藻培养基后,微藻接种至所述第二培养基后,在所述微藻的指数期中添加餐厨垃圾水解液至所述第二培养基后继续培养,完成所述微藻培养基的配制。
[0050]
本申请研发了一种新型的低成本的微藻培养基,本申请的微藻培养基包括碳源、kh2po4、mgso4·
7h2o、柠檬酸钾、维生素b1、维生素b12和水,碳源选自餐厨垃圾水解液或/和甘油制品。其中,餐厨垃圾为丢弃的垃圾,甘油制品为工业副产物,使得餐厨垃圾水解液或/和甘油制品的来源十分广泛且低廉,从而能降低微藻的培养的成本。实验结果表明,含有餐厨垃圾水解液的微藻培养基具有促进微藻生物量和促进微藻多糖积累的作用;含有甘油制品的微藻培养基具有促进微藻生物量和促进微藻多糖积累的作用;含有餐厨垃圾水解液和粗甘油的微藻培养基也具有促进微藻生物量和促进微藻多糖积累的作用。结果表明,餐厨垃圾水解液和粗甘油无论作为单独碳源或者联合碳源,都可以促进微藻进行异养代谢提高细胞分裂效率及多糖代谢,说明餐厨垃圾水解液和粗甘油能促进裸藻生物量和裸藻多糖的积累。
附图说明
[0051]
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0052]
图1为本申请实施例提供的餐厨垃圾水解过程葡萄糖含量测定结果,其中,横坐标为水解时间(单位:小时),纵坐标为葡萄糖浓度(单位:g/l);
[0053]
图2为本申请实施例提供的裸藻接种至不同的微藻培养基的生长曲线,横坐标为培养时间(单位:天),纵坐标为细胞数目(单位:106个/ml),其中,a为裸藻在不同浓度的餐厨垃圾水解液的微藻培养基中混养条件下裸藻的生长曲线,b为裸藻在不同浓度的餐厨垃圾水解液的微藻培养基中异养条件下裸藻的生长曲线,c为裸藻在不同浓度的粗甘油的微藻培养基中混养条件下裸藻的生长曲线,d为裸藻在不同浓度的粗甘油的微藻培养基中异养条件下裸藻的生长曲线;
[0054]
图3为本申请实施例提供的裸藻接种至含有餐厨垃圾水解液和粗甘油的微藻培养基的生长曲线,横坐标为培养时间(单位:天),纵坐标为细胞数目(单位:106个/ml),其中,a为接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基的裸藻混养和异养下生长曲线,b为接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基的裸藻混养和异养下生长曲线;
[0055]
图4为本申请实施例提供的裸藻接种在不同的微藻培养基培养至平台期的生物量变化,纵坐标为裸藻生物量(单位:g/l),其中,a为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基混养状态的裸藻生物量,b为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基异养状态的裸藻生物量,c为裸藻接种在含有不同浓度的粗甘油的微藻培养基混养状态的裸藻生物量,d为裸藻接种在含有不同浓度的粗甘油的微藻培养基异养状
态的裸藻生物量,e为接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的裸藻生物量,f为接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的裸藻生物量;
[0056]
图5为本申请实施例提供的裸藻接种在不同的微藻培养基培养至平台期的裸藻多糖含量变化,纵坐标为裸藻多糖占干重比例(单位:%干重),其中,a为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基混养状态的裸藻多糖含量,b为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基异养状态的裸藻多糖含量,c为裸藻接种在含有不同浓度的粗甘油的微藻培养基混养状态的裸藻多糖含量,d为裸藻接种在含有不同浓度的粗甘油的微藻培养基异养状态的裸藻多糖含量,e为接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的裸藻多糖含量,f为接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的裸藻多糖含量;
[0057]
图6为本申请实施例提供的裸藻接种在不同的微藻培养基培养至第4天裸藻eggsl1基因转录水平,纵坐标为裸藻eggsl1基因相对表达量;a为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基混养状态的裸藻eggsl1基因相对表达量,b为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基异养状态的裸藻eggsl1基因相对表达量,c为裸藻接种在含有不同浓度的粗甘油的微藻培养基混养状态的裸藻eggsl1基因相对表达量,d为裸藻接种在含有不同浓度的粗甘油的微藻培养基异养状态的裸藻eggsl1基因相对表达量,e为接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的裸藻eggsl1基因相对表达量,f为接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的裸藻eggsl1基因相对表达量;
[0058]
图7为本申请实施例提供的裸藻接种在不同的微藻培养基培养至第4天裸藻eggsl2基因转录水平,纵坐标为裸藻eggsl2基因相对表达量;a为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基混养状态的裸藻eggsl2基因相对表达量,b为裸藻接种在含有不同浓度的餐厨垃圾水解液的微藻培养基异养状态的裸藻eggsl2基因相对表达量,c为裸藻接种在含有不同浓度的粗甘油的微藻培养基混养状态的裸藻eggsl2基因相对表达量,d为裸藻接种在含有不同浓度的粗甘油的微藻培养基异养状态的裸藻eggsl2基因相对表达量,e为接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的裸藻eggsl2基因相对表达量,f为接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的裸藻eggsl2基因相对表达量。
具体实施方式
[0059]
本申请提供了一种微藻培养基及其应用,能显著促进微藻生物量和微藻多糖的积累,而且采用本申请的微藻培养基培养微藻的效率高,成本低,具有广泛的工业应用前景。
[0060]
下面将对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通
技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
[0061]
其中,以下实施例所用试剂或原料均为市售或自制。
[0062]
实施例1
[0063]
本申请实施例提供了餐厨垃圾的收集与水解试验,具体步骤如下:
[0064]
1、餐厨垃圾收集于广州暨南大学食堂,主要以面条、馒头、面包和米饭为主。收集的餐厨垃圾置于烘箱在60℃条件下过夜烘干后放置于
‑
20℃条件下保存。
[0065]
2、300g烘干后的餐厨垃圾用搅拌机搅碎后放入至2.5l的水解罐中,用纯水将反应体积调至2.0l,加入10ml商业化葡萄糖淀粉酶后在55℃、300rpm条件下水解24h,记为样品溶液。水解过程中将样品溶液采用酸调节剂ph保持在4.0左右。
[0066]
3、在酶解24h过程中,每隔一段时间从生物反应器中取样1ml进行葡萄糖含量测定;在酶解结束后同样取样1ml进行葡萄糖含量测定。葡萄糖含量测定步骤包括:将样品溶液在5000rpm条件下离心10min收集上清液,并且用0.22μm膜进行真空过滤。随后用高效液相色谱检测葡萄糖含量。色谱条件如下:色谱条件:waters高效液相色谱配备bio
‑
rad aminex hpx
‑
87h柱和waters折射率检测器。流动相为5mm硫酸,流速为0.5ml/min。流柱温和折射率检测器温度分别为65℃和35℃。以葡萄糖作为标准品制定标准曲线,计算样品溶液中的葡萄糖含量。
[0067]
4、水解过程结束后,将样品溶液采用5000rpm室温条件下离心10min获取上清液,随后采用0.22μm膜对上清液进行真空抽滤以获得无菌澄清的餐厨垃圾水解液。
[0068]
其中,餐厨垃圾水解过程中葡萄糖含量测定结果如图1,通过测定,本实施例中餐厨垃圾水解液的葡萄糖含量如图1所示,在1h时,葡萄糖淀粉酶迅速水解餐厨垃圾中淀粉含量使得葡萄糖浓度达到90g/l;经过24h水解后葡萄糖浓度可达到116g/l。图1表明餐厨垃圾酶解成高富含葡萄糖的水解液。
[0069]
实施例2
[0070]
本申请实施例提供了对餐厨垃圾及实施例1获得的餐厨垃圾水解液成分分析实验,具体步骤如下:
[0071]
餐厨垃圾及餐厨垃圾水解液的总糖成分通过苯酚
‑
硫酸法进行检测:收集2g餐厨垃圾及实施例1获得的2ml餐厨垃圾水解液利用宁波新芝冷冻干燥机冻干48h后放入50ml离心管中,向管中加入1ml的去离子水。涡旋30s后,向离心管中加入1ml5%的苯酚溶液,随后沿管壁缓慢加入5ml98%浓硫酸。在25℃条件下水浴孵育10min,随即转至30℃条件下水浴孵育20min。以商业化的纯葡萄糖作为标准品按照上述步骤操作后,将标准品反应液、餐厨垃圾反应液、餐厨垃圾水解液反应液分别加入至预先排好顺序的96孔板中,利用bio
‑
tek酶标仪检测483nm下的吸光值。根据不同标准品浓度的孔值绘制标准曲线,利用标准曲线和样品的加样体积计算出餐厨垃圾及餐厨垃圾水解液的总糖含量。
[0072]
餐厨垃圾的淀粉成分通过酶水解法进行检测:收集2g餐厨垃圾,置于含滤纸的漏斗中,首先用10ml乙醚冲洗以除去餐厨垃圾的脂肪,再用85%的乙醇冲洗以除去餐厨垃圾的可溶性糖。将残留的餐厨垃圾采用苯酚
‑
硫酸法进行检测。
[0073]
餐厨垃圾及餐厨垃圾水解液的可溶蛋白成分检测:收集2g餐厨垃圾及实施例1获得的2ml餐厨垃圾水解液利用宁波新芝冷冻干燥机冻干48h后放入5ml离心管中,加入
0.02g/l、mgso4·
7h2o 0.025g/l、维生素b12 0.5μg/l、柠檬酸钾0.04g/l、维生素b10.4mg/l的不含有碳源的微藻培养基;将餐厨垃圾水解液以10g/l的浓度加入不含有碳源的微藻培养基,制得含有餐厨垃圾水解液的第一微藻培养基,然后将裸藻接种至第一微藻培养基中,随后在第3天时加入100mm的粗甘油至第一微藻培养基中。
[0084]
含有餐厨垃圾水解液和粗甘油的微藻培养基的配制:配制包括淡水、kh2po
4 0.02g/l、mgso4·
7h2o 0.025g/l、维生素b12 0.5μg/l、柠檬酸钾0.04g/l、维生素b10.4mg/l的不含有碳源的微藻培养基;将粗甘油以100mm的浓度加入不含有碳源的微藻培养基,制得含有粗甘油的第二微藻培养基,然后将裸藻接种至第二微藻培养基中,随后在第3天时加入10g/l的餐厨垃圾水解液至第二微藻培养基中。
[0085]
实施例4
[0086]
本申请实施例提供了将裸藻接种至实施例3的不同微藻培养基的生长曲线测定,具体步骤如下:
[0087]
纤细裸藻euglena gracilis分离自广州暨南大学明湖水域。纤细裸藻的培养分为异养方式和混养方式(光自养和异养同时进行的培养),本申请实施例采用裸藻常规的异养和混养方式,均在恒温培养箱中进行无菌充气培养,无菌充气速率为3l/min,培养温度为25
±
1℃。其中异养方式下光照强度为0μmolm
‑2s
‑1;混养方式下光照强度为120
±
10μmolm
‑2s
‑1,12h/12h光暗周期。初始裸藻密度为1.5
×
105个细胞/ml。
[0088]
将裸藻接种至不同浓度的餐厨垃圾水解液的微藻培养基中,培养方式为混养和异养,裸藻的初始接种密度为1.5
×
105个细胞/ml,随后每天用浮游植物计数框对藻浓度进行计算,从而测定裸藻的生长周期,绘制生长曲线。裸藻生长曲线测定的结果如图2所示,其中,图2a和图2b的h0为实施例3配制的不含有碳源的微藻培养基,图2a和图2b的h0为对照组,其余为实验组,h10、h20、h30和h40分别为加入10g/l、20g/l、30g/l、40g/l的餐厨垃圾水解液制得含有餐厨垃圾水解液的微藻培养基。图2a所示为裸藻在含有餐厨垃圾水解液的微藻培养基中混养下的生长曲线,其初始接种密度为1.5
×
105个细胞/ml,从第2天开始,混养下对照组h0裸藻开始进入快速生长阶段,在第6天时裸藻生长平缓,接种的第1
‑
5天为裸藻对数生长期,第6天裸藻生长进入平台期,达到5.2
×
106个细胞/ml;以餐厨垃圾水解液为碳源时,裸藻生长明显好于对照组,其中以含有20g/l的餐厨垃圾水解液表现最优,从第2天开始,裸藻开始进入快速生长阶段,在第4天时裸藻生长平缓,接种的第1
‑
3天为裸藻对数生长期,第4天裸藻生长进入平台期,达到8.6
×
106个细胞/ml。本实施例中图2b所示为裸藻在含有餐厨垃圾水解液的微藻培养基中异养下的生长曲线,其初始接种密度为1.5
×
105个细胞/ml,从第2天开始,混养下对照组h0裸藻开始进入快速生长阶段,在第7天时裸藻生长平缓,接种的第1
‑
6天为裸藻对数生长期,第7天裸藻生长进入平台期,达到5.5
×
106个细胞/ml;以餐厨垃圾水解液为碳源时,裸藻生长明显好于对照组,其中以20g/l的餐厨垃圾水解液表现最优,从第2天开始,裸藻开始进入快速生长阶段,在第5天时裸藻生长平缓,接种的第1
‑
4天为裸藻对数生长期,第5天裸藻生长进入平台期,达到8.9
×
106个细胞/ml。
[0089]
将裸藻接种至不同浓度的粗甘油的微藻培养基中,培养方式为混养和异养,裸藻的初始接种密度为1.5
×
105个细胞/ml,随后每天用浮游植物计数框对藻浓度进行计算,从而测定裸藻的生长周期,绘制生长曲线。裸藻生长曲线测定的结果如图2所示,其中,图2c和图2d的h0为实施例3配制的不含有碳源的微藻培养基,图2c和图2d的h0为对照组,其余为实
验组,g100、g200、g300和g400分别为加入100mm、200mm、300mm、400mm的粗甘油制得含有粗甘油的微藻培养基。图2c所示为裸藻在含有粗甘油的微藻培养基的生长曲线,其初始接种密度为1.5
×
105个细胞/ml,从第2天开始,混养下对照组裸藻开始进入快速生长阶段,在第6天时裸藻生长平缓,接种的第1
‑
5天为裸藻对数生长期,第6天裸藻生长进入平台期,达到5.2
×
106个细胞/ml;以粗甘油为碳源时,裸藻生长明显好于对照组g0,其中以200mm粗甘油表现最优,从第2天开始,裸藻开始进入快速生长阶段,在第5天时裸藻生长平缓,接种的第1
‑
4天为裸藻对数生长期,第5天裸藻生长进入平台期,达到7.0
×
106个细胞/ml。图2d所示为裸藻在含有粗甘油的微藻培养基中异养下的生长曲线,其初始接种密度为1.5
×
105个细胞/ml,从第2天开始,异养下对照组裸藻开始进入快速生长阶段,在第7天时裸藻生长平缓,接种的第1
‑
6天为裸藻对数生长期,第7天裸藻生长进入平台期,达到5.5
×
106个细胞/ml;以粗甘油为碳源时,裸藻生长明显好于对照组,其中以200mm粗甘油表现最优,从第2天开始,裸藻开始进入快速生长阶段,在第6天时裸藻生长平缓,接种的第1
‑
5天为裸藻对数生长期,第6天裸藻生长进入平台期,达到7.4
×
106个细胞/ml。图2表明在异养状态下,裸藻平台期较混养状态明显提前,此外,以餐厨垃圾水解液或粗甘油为碳源的组别的生长状态明显高于不添加餐厨垃圾水解液或粗甘油为碳源的组别,其中分别以20g/l餐厨垃圾水解液和200mm粗甘油的效果最优。
[0090]
将裸藻先接种至含有餐厨垃圾水解液的第一微藻培养基,随后在第3天时加入100mm的粗甘油至第一微藻培养基中。图3a所示为裸藻以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基的裸藻混养和异养下生长曲线,其初始接种密度为1.5
×
105个细胞/ml,在混养下,从第2天开始,裸藻开始进入快速生长阶段,在第7天时裸藻生长平缓,接种的第1
‑
6天为裸藻对数生长期,第7天裸藻生长进入平台期,达到9.7
×
106个细胞/ml;在异养下,从第2天开始,裸藻开始进入快速生长阶段,在第8天时裸藻生长平缓,接种的第1
‑
7天为裸藻对数生长期,第8天裸藻生长进入平台期,达到1.0
×
107个细胞/ml。
[0091]
将裸藻先接种至含有粗甘油的第二微藻培养基,随后在第3天时加入10g/l的餐厨垃圾水解液至第二微藻培养基中。图3b所示裸藻以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基的裸藻混养和异养下生长曲线,其初始接种密度为1.5
×
105个细胞/ml,在混养下,从第2天开始,裸藻开始进入快速生长阶段,在第6天时裸藻生长平缓,接种的第1
‑
5天为裸藻对数生长期,第6天裸藻生长进入平台期,达到9.0
×
106个细胞/ml;在混养下,从第2天开始,裸藻开始进入快速生长阶段,在第7天时裸藻生长平缓,接种的第1
‑
6天为裸藻对数生长期,第7天裸藻生长进入平台期,达到9.2
×
106个细胞/ml。图3表明以餐厨垃圾水解液和粗甘油为碳源下裸藻生长相对于单独碳源条件下明显提高。
[0092]
实施例5
[0093]
本申请实施例提供了裸藻在不同培养条件下的平台期生物量测定,具体步骤如下:
[0094]
将实施例4中裸藻接种至含有不同浓度的餐厨垃圾水解液的微藻培养基混养和异养后;将实施例4中裸藻接种至含有不同浓度的粗甘油的微藻培养基混养和异养后;将实施例4中裸藻接种至含有餐厨垃圾水解液和粗甘油的微藻培养基混养和异养后;然后,将在不
同培养条件下处于平台期的裸藻,4℃条件下5,000rpm离心10min收集藻泥至预称重的1.5mleppendorf管中,用磷酸盐缓冲液重悬藻泥后涡旋30s,4℃条件下5,000rpm离心10min收集后重复该步骤三次。将装入藻泥的1.5ml eppendorf管中放入60℃烘箱中烘干至恒重,通过分析电子天平精准称量含有裸藻的管重并计算出最终裸藻生物量。
[0095]
裸藻生物量测定的结果如图4。图4表示不同培养条件下的平台期裸藻生物量含量,其中,图4a表示在含有不同浓度的餐厨垃圾水解液的微藻培养基混养状态的裸藻生物量,其中对照组h0生物量为3.8g/l,而以20g/l餐厨垃圾水解液为碳源的微藻培养基下表现最优,生物量达到6.3g/l;图4b表示在含有不同浓度的餐厨垃圾水解液的微藻培养基异养状态的裸藻生物量,其中对照组h0生物量为4.0g/l,而以20g/l餐厨垃圾水解液为碳源的微藻培养基下表现最优,生物量达到6.5g/l;图4c表示在含有不同浓度的粗甘油的微藻培养基混养状态的裸藻生物量,其中对照组g0生物量为3.8g/l,而以200mm粗甘油为碳源的微藻培养基下表现最优,生物量达到5.1g/l;图4d表示在含有不同浓度的粗甘油的微藻培养基异养状态的裸藻生物量,其中对照组g0生物量为4.0g/l,而以20g/l餐厨垃圾水解液为碳源下表现最优,生物量达到5.4g/l。图4e表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源的微藻培养基,并且接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的裸藻生物量,分别为7.1g/l和7.3g/l;图4f表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,并且接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的裸藻生物量,分别为6.6g/l和6.7g/l。图4表明在以餐厨垃圾水解液或者粗甘油为碳源时,裸藻生物量具有明显的提升,此外,餐厨垃圾水解液和粗甘油联合作为碳源时,裸藻生物量达到最大值,显著高于其他组别。
[0096]
实施例6
[0097]
本申请实施例提供了裸藻在不同培养条件下的平台期多糖含量测定,具体步骤如下:
[0098]
将实施例4中裸藻接种至含有不同浓度的餐厨垃圾水解液的微藻培养基混养和异养后;将实施例4中裸藻接种至含有不同浓度的粗甘油的微藻培养基混养和异养后;将实施例4中裸藻接种至含有餐厨垃圾水解液和粗甘油的微藻培养基混养和异养后;然后,将在不同培养条件下处于平台期的裸藻,4℃条件下5,000rpm离心10min收集藻泥至预称重的1.5ml eppendorf管中,用磷酸盐缓冲液重悬藻泥后涡旋30s,4℃条件下5,000rpm离心10min收集后重复该步骤三次。将藻放置于宁波新芝冷冻干燥机冻干24h后转移至5ml离心管中,向样品中加入1ml 0.5m的naoh溶液,在50℃条件下加热1h,加热期间数次反复震荡。离心后取上清液加入1ml5%的苯酚溶液,随后沿管壁缓慢加入5ml98%浓硫酸。在25℃条件下水浴孵育10min,随即转至30℃条件下水浴孵育20min。以商业化的纯葡萄糖作为标准品按照上述步骤操作后,利用bio
‑
tek酶标仪检测483nm下的吸光值。根据不同标准品浓度的孔值绘制标准曲线,利用标准曲线和样品的加样体积计算出在不同培养条件下的平台期的裸藻多糖含量。
[0099]
裸藻多糖含量测定的结果如图5。图5表示不同培养条件下的平台期裸藻多糖含量,其中,图5a表示在含有不同浓度的餐厨垃圾水解液的微藻培养基混养状态的裸藻生物量,其中对照组h0裸藻多糖含量为19.1%,而以40g/l餐厨垃圾水解液为碳源的微藻培养基
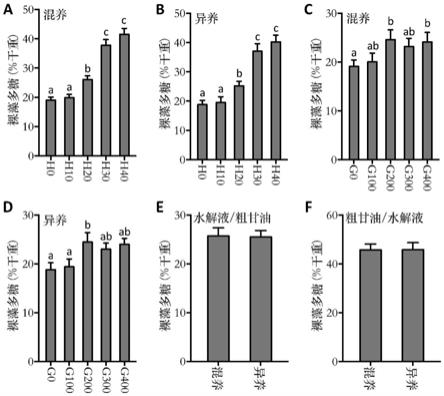
下表现最优,裸藻多糖达到41.5%;图5b表示在含有不同浓度的餐厨垃圾水解液的微藻培养基异养状态的裸藻生物量,其中对照组h0裸藻多糖含量为18.8%,而以40g/l餐厨垃圾水解液为碳源的微藻培养基下表现最优,裸藻多糖达到40.2%;图5c表示在含有不同浓度的粗甘油的微藻培养基混养状态的裸藻生物量,其中对照组g0裸藻多糖含量为19.1%,而以200mm粗甘油为碳源的微藻培养基下表现最优,裸藻多糖达到24.6%;图5d表示在含有不同浓度的粗甘油的微藻培养基异养状态的裸藻生物量,其中对照组g0裸藻多糖含量为18.8%,而以200mm粗甘油为碳源的微藻培养基下表现最优,裸藻多糖达到24.5%。图5e表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,并且接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的裸藻多糖分别为25.7%和25.5%;图5f表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源的微藻培养基,并且接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的裸藻生物量分别为45.7%和45.9%。图5表明在以餐厨垃圾水解液或者粗甘油为碳源时,裸藻多糖含量对比正常培养基具有较明显的提升。
[0100]
实施例7
[0101]
本申请实施例提供了裸藻在不同培养条件下的β
‑
1,3
‑
葡聚糖合成酶基因eggsl1(lc225614)和eggsl2(lc225615)的表达量测定,具体步骤如下:
[0102]
将实施例4中裸藻接种至含有不同浓度的餐厨垃圾水解液的微藻培养基混养和异养后;将实施例4中裸藻接种至含有不同浓度的粗甘油的微藻培养基混养和异养后;将实施例4中裸藻接种至含有餐厨垃圾水解液和粗甘油的微藻培养基混养和异养后;然后,选取培养第4天的裸藻,4℃条件下5,000rpm离心10min收集藻泥至预称重的1.5ml eppendorf管中,用磷酸盐缓冲液重悬藻泥后涡旋30s,4℃条件下5,000rpm离心10min收集后重复该步骤三次并将藻泥放入液氮中冷冻,放入
‑
80℃冰箱待用。利用omega公司plant rnakit提取裸藻rna,利用nanodrop对提取的rna质量进行检测后,采用vazyme的ii 1st strand cdna synthesis kit将rna逆转录成cdna。利用oligoarchitect在线引物设计工具设计qpcr引物,采用vazyme的aceq qpcr sybr green master mix进行qpcr实验。按照每管18μl预混液(包含rnase
‑
free water,aceq qpcr sybr green master mix,引物)的原则,将预混液加入至预先设计好排列顺序的八连管中,之后加入2μl cdna至预先排好的加样孔中,用封口板对八连管进行封口处理,整个加样过程,八连管均放置于冰上。将封口后的八连管放置bio
‑
rad cfx connect仪中进行qpcr实验。检测结束后,每个加样孔中荧光强度达到设定值所需要的循环数(ct)都被检出,qpcr结果采用2
‑
ct
算法来计算,其中ct为目的基因的ct值减去内参基因的ct值。eggsl1的引物为forward tcttaacgctggacacgg,reversegtgcctgctgacaatgct;eggsl2的引物为forward atgaaggtcttctggctcgt,reverse tgccaattaaccatcccat。裸藻β
‑
1,3
‑
葡聚糖合成酶基因测定的结果如图6和图7。
[0103]
图6表示不同培养条件下第4天裸藻eggsl1基因转录水平,其中,图6a和6b表示分别在含有不同浓度的餐厨垃圾水解液的微藻培养基混养或异养状态的裸藻eggsl1基因转录水平,以20g/l以上餐厨垃圾水解液为碳源的微藻培养基(h30和h40)裸藻eggsl1转录水平明显高于对照组h0;图6c和6d表示分别在含有不同浓度的粗甘油的微藻培养基混养或异养状态的裸藻eggsl1基因转录水平,在200mm粗甘油为碳源的微藻培养基g200裸藻eggsl1
转录水平相对于对照组g0而言明显提升;图6e表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,并且接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的eggsl1转录水平,其中混养和异养状态下的转录水平相差不大;图6f表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,并且接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的eggsl1转录水平,其中混养和异养状态下的转录水平相差不大。
[0104]
图7表示不同培养条件下第4天裸藻eggsl2基因转录水平,其中,图7a和7b表示分别在含有不同浓度的餐厨垃圾水解液的微藻培养基混养或异养状态的裸藻eggsl2基因转录水平,在20g/l以上餐厨垃圾水解液为碳源的微藻培养基(h30和h40)的裸藻eggsl2转录水平明显高于对照组h0;图7c和7d表示分别在含有不同浓度的粗甘油的微藻培养基混养或异养状态的裸藻eggsl2基因转录水平,在200mm粗甘油为碳源的微藻培养基g200裸藻eggsl2转录水平相对于对照组g0而言明显提升;图7e表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,并且接种第1天的培养基为含有餐厨垃圾水解液的第一微藻培养基,粗甘油在第3天开始加入第一微藻培养基下混养和异养状态的eggsl2转录水平,其中混养和异养状态下的转录水平相差不大;图7f表示以20g/l餐厨垃圾水解液和200mm粗甘油为联合碳源,并且接种第1天的培养基为含有粗甘油的第二微藻培养基,餐厨垃圾水解液在第3天开始加入第二微藻培养基下混养和异养状态的eggsl2转录水平,其中混养和异养状态下的转录水平相差不大。图6和7表明在以餐厨垃圾水解液或者粗甘油为碳源时,裸藻β
‑
1,3
‑
葡聚糖合成酶关键基因eggsl1和eggsl2对比正常培养基具有较明显的提升。可见,本申请的微藻培养基通过促进裸藻β
‑
1,3
‑
葡聚糖合成酶基因以促进裸藻多糖的积累。
[0105]
综上所述,以上实施例的实验数据表明,餐厨垃圾水解液和粗甘油确实能显著促进裸藻生物量积累,与正常培养基条件下的裸藻生物量相比,餐厨垃圾水解液和粗甘油均可以使裸藻生物量显著提高,其中餐厨垃圾水解液作为碳源时生物量表现更优。此外裸藻多糖结果表明,餐厨垃圾水解液和粗甘油可以提高裸藻多糖含量,其中餐厨垃圾水解液参与下会明显提升裸藻多糖含量,而且在餐厨垃圾水解液和粗甘油联合碳源条件下,裸藻多糖含量也明显提高。
[0106]
以上所述仅是本申请的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1