使用珠分离高分子量DNA的试剂盒的制作方法
本实用新型涉及使用珠分离高分子量dna的试剂盒
背景技术:
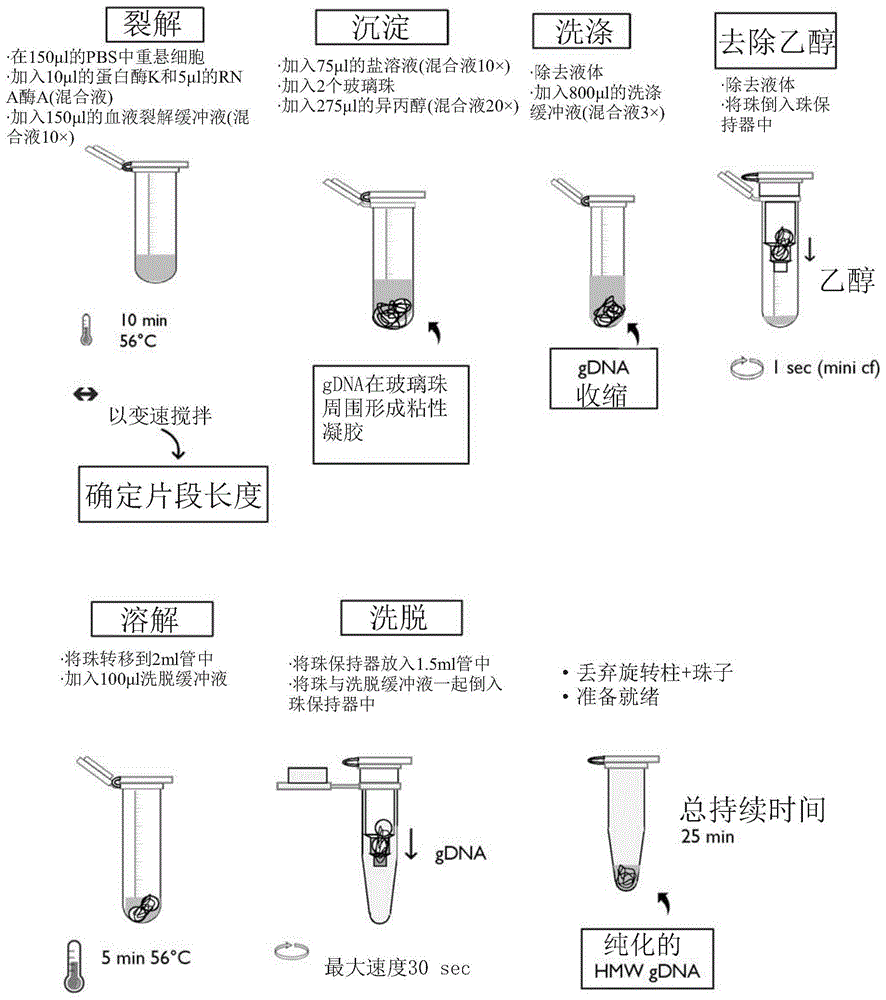
:存在数种分析长核酸分子的方法。例如,常规地使用纳米孔测序来对长度为数十至数百的千碱基的dna分子进行测序(参见例如,oxfordnanoporetechnologies,牛津英国)。一项纳米孔测序研究报告了超过两兆碱基(mb)的读长长度(payne等人,bioinformatics.201935:2193-2198)。同样,pacbio平台(pacificbioscience,melopark,加利福尼亚州)能够对长度为几十的千碱基的核酸分子进行测序。其他基因组映射平台,例如基于纳米通道阵列的方法(在lam等人,nat.biotechnology201230:771-776中描述,由加利福尼亚州圣地亚哥的bionanogenomics公司开发)也提供了分析长核酸分子的方法。如上所述的长范围基因组分析方法需要纯化的高分子量(hmw)dna作为进样。传统上,hmw基因组dna(gdna)是通过苯酚/氯仿提取和随后的乙醇沉淀同时将gdna绕在玻璃棒上而从细胞中纯化出来的。有数种从小体积样品中纯化hmwgdna的方法。这些包括磁盘、磁珠和二氧化硅过滤器。但是,每种现有方法都有一定的缺陷。一些方法导致hmwdna的剪切。其他方法需要多个处理步骤,因此不理想适合同时处理大量样品。随着用于hmw基因组分析的方法改进以及临床、诊断和研究样品的数量的增加,仍然需要提高hmwdna纯化的可靠性和效率。技术实现要素:此外,本文提供了一种利用组合物的方法,该组合物包括:(i)一个或多个珠,例如玻璃珠,例如1-50个珠,其中每个珠的最小尺寸为至少200微米(μm),优选地大于200μm,例如至少1mm,例如在1mm至6mm的范围内(例如约4mm);(ii)包括hmwdna的dna溶液,例如hmwdna的中值大小为至少35千碱基(kb),例如至少50kb;(iii)dna沉淀剂。在一些实施方式中,一个或多个珠基本山是圆形的并且最小尺寸对应于珠的直径。在一些实施方式中,在用于珠保持管的单个试剂盒或组合物中,珠大小可以变化,尽管在任何单个珠保持管中使用相同或紧密相似尺寸的珠可能是优选的。方法可以包括以下步骤中的至少一步:温育组合物以将dna粘附到一个或多个珠上;从一个或多个珠上去除未结合的材料;用洗涤缓冲液洗涤一个或多个珠;将dna从一个或多个珠上释放到洗脱缓冲液中;和将洗脱物中已释放的dna与一个或多个珠分离。dna溶液可以是预纯化的hmwdna或包括hmwdna和大分子的复杂混合物,例如细胞裂解物。dna溶液可以通过裂解细胞产生裂解物,离心裂解物并将上清液用作dna溶液而产生。可选地,dna溶液可以通过裂解细胞产生裂解物并将裂解物用作dna溶液而产生。可选地,dna溶液可以是通过在裂解缓冲液中以300rpm-2000rpm范围内的搅拌速率搅拌细胞而产生的裂解物。搅拌可能发生在至少37℃-56℃的温度下。搅拌速度决定了dna溶液中所用dna的中值长度。方法中使用的dna沉淀剂可以包括离液盐、群集剂(例如聚乙二醇(peg))和/或醇(例如乙醇或异丙醇)。离液盐和/或群集剂可以以高浓度存在于dna沉淀剂中。未结合的材料的去除可以通过倾倒或移液来实现,其中移液利用例如大口径的移液管吸头。可以包括使用含醇的洗涤缓冲液的洗涤步骤。洗涤步骤可以从粘附到珠的dna中去除残留的材料。洗涤步骤可通过在含醇的洗涤缓冲液中洗涤珠,将珠倒入珠保持管中并旋转珠保持管以除去上清液而留下粘附在珠上的dna来完成。通过用合适的洗脱缓冲液洗涤dna珠,可以将dna从珠释放到洗脱物中。可以在珠保持管中将dna珠和洗脱缓冲液合并,将其离心以允许在收集管或外管中收集洗脱物,而珠则保留在珠保持管中。在一个实例中,在离心之前将珠保持管插入收集管中。在这种构造中,珠保持管具有一个或多个出口开口,其中这些开口的大小小于一个或多个珠的最小尺寸。一个或多个出口开口可以是基本上圆形形状,并且直径小于一个或多个珠的最小尺寸。一个以上的出口开口优选地具有至少0.5mm的大小(例如直径)。珠保持管被设计成使得一个或多个珠不阻塞一个或多个出口开口,从而允许包含珠的洗脱物从含珠的管流出进入收集管。这可以通过包括一个或多个脊、凸缘或套环的珠保持管来实现,所述脊、凸缘或套环在管中的一个或多个出口开口上方支撑一个或多个珠。在一个实施方式中,出口开口为筛子或多孔网的形式,包括以网格图案布置的一系列出口开口。可选地,可将珠和dna洗脱缓冲液包含在密闭管中,并通过将上清液倒入或吸移到收集管中来除去含dna的洗脱缓冲液。释放的dna是高分子量(hmw)dna,例如其中值大小为至少25kb,例如至少35kb-50kb。还提供了组合物,其包括:一个或多个最小尺寸为200μm的珠子(例如玻璃珠);包含hmwdna的dna溶液,该hmwdna的中值大小为至少35kb或至少50kb;和dna沉淀剂,其中该沉淀剂可以包括在本领域中通常使用的高浓度的醇、和/或离液盐或群集剂。在一些实施方式中,一个或多个珠的最小尺寸为至少200μm,例如至少1mm,例如在1mm至6mm的范围内(例如约4mm)。一个或多个珠可以例如基本上是球形的,并且直径为至少200μm,例如至少1mm,例如在1mm-6mm的范围内(例如约4mm)。在一些实施方式中,一个或多个珠是1-50个珠,例如1-50个球形玻璃珠。dna溶液可以得自细胞裂解物,或者可以是细胞裂解物或组织裂解物,或者得自预先用其他方法纯化的hmwdna。当dna沉淀剂是醇时,该醇可以是乙醇或异丙醇。包括一个或多个珠、dna溶液和dna沉淀剂的组合物可以包含在珠保持管中,其中dna粘附在珠上。还提供了试剂盒,其包括:(a)一个或多个最小尺寸为至少200μm的珠(例如玻璃珠);和(b)珠保持管,其具有用于接收dna溶液的开口和一个或多个出口开口,其中每个出口开口的大小小于每个珠的最小尺寸,其中对于最小尺寸大于500μm的珠,出口开口优选为至少为500μm。珠保持管被设计成使得一个或多个出口开口不被一个或多个珠阻塞。如图4a所示,这可以通过在出口开口周围具有一个或多个脊、凸缘或套环而实现,当流体绕着珠流动并随后从离开管时,珠可位于一个或多个脊、凸缘或套环上。在一些试剂盒中,最小尺寸为至少200μm的一个或多个珠是最小尺寸为至少1mm,例如在1mm至6mm范围内(例如约4mm)的珠。一些试剂盒可进一步包括外部收集管,其中珠保持管装配到收集管中。试剂盒中使用的珠可以由具有带电表面并且优选为光滑的材料形成,尽管表面可以是粗糙的,只要它不破坏吸附的dna。在一个实例中,试剂盒中的珠由玻璃或陶瓷材料制成。珠可以具有任何期望的形状。在一个实例中,一个或多个珠是基本上球形的,并且直径为至少200μm,任选地至少1mm,例如在1mm至6mm的范围内(例如约4mm)。例如,珠可以是一个或多个球形玻璃或陶瓷珠。一个或多个珠子可以是1-50个珠,例如其中在每个珠保持管中可包括1-50个尺寸为1mm-6mm的珠子(例如1-50个直径为1mm-6mm的球形珠)。最佳的珠数量与珠的大小成反比,其中在所述尺寸范围的下端需要更多的珠。珠保持管的体积足以容纳珠。珠保持管的一个或多个出口开口的大小为至少0.5mm,只要其小于一个或多个珠的最小尺寸。因此,如果一个或多个珠子每个的最小尺寸为至少1mm(例如1-6mm),则一个或多个出口开口的直径为至少0.5mm但小于1mm。在一个实施方式中,珠保持管的一个或多个出口开口是圆形的,并且其直径小于珠的最小尺寸(例如,直径);例如,其中一个或多个珠是球形的,并且每个珠的直径为至少1mm,和一个或多个圆形出口开口的直径为至少0.5mm但小于1mm。外管可用于收集含有dna的洗脱物。当提供了外部收集管时,珠保持管可以装配入外管中。收集管可以例如具有1毫升(ml)-2ml的体积。试剂盒可进一步包含用于在dna溶液中裂解和/或纯化dna的洗脱缓冲液、含醇的洗涤缓冲液、裂解缓冲液和/或酶(例如蛋白酶k和rna酶a),其中上述试剂和缓冲液可以在相同或不同的管中提供或在包含单个试剂和/或缓冲液的管以及包含试剂和/或缓冲液的混合物的管的多种组合中提供。上述方法在至少一个实例中使用了以上概述的组合物,并且可以任选地使用以上概述的试剂盒,其中方法、组合物和试剂盒在下面进行了详细描述。附图说明附图旨在说明本文所述的组合物和/或方法的一个或多个版本。除非另有说明,否则这些并非旨在限制解释任何权利要求的范围的目的。图1a示意性地示出了使用本方法如何从哺乳动物细胞中分离和纯化hmwgdna的实例。裂解:将细胞重悬于150μl的pbs中。加入10μl蛋白酶k和5μl的rna酶a(混合液)。添加150μl血液裂解缓冲液(混合液10×),在56℃下持续10分钟。变速搅拌确定片段长度。沉淀:加入75μl盐溶液(混合液10×)。加入2个玻璃珠。加入275μl异丙醇(混合液20×),gdna在玻璃珠周围形成粘性凝胶。清洗:除去液体。加入800μl洗涤缓冲液(混合液3×)。gdna收缩。乙醇去除:去除液体,将珠倒入珠保持器中,微量离心1秒。溶解:将珠转移至2ml管中,加入100μl洗脱缓冲液,于56℃温育5分钟。洗脱:将珠保持器放入1.5ml收集管中。将带有洗脱缓冲液的珠倒入珠保持器中,最高离心30秒。收集纯化的hmwgdna。总时间=25分钟。图1b示意性地示出了如何从组织片或粉末中分离和纯化hmwgdna的实例。匀化:添加2mg-25mg冷冻的组织/粉末,用杵研磨。裂解:加入10μl蛋白酶k和300或600μl组织裂解缓冲液。56℃加热持续45分钟,选择搅拌速度。加入5μl或10μlrna酶a,并在56℃温育10分钟。蛋白质分离:添加150μl或300μl蛋白质分离溶液(倒置1分钟),以16000g离心10分钟。将上清液转移至2ml管中。沉淀:添加2个玻璃珠和275μl-550μl异丙醇(倒置20×)。gdna形成吸附至玻璃珠的粘性凝胶。图2a-图2b示出了珠保持管和收集管的实例,其中珠保持管具有至少一个出口开口。图2a示出了可以在本方法中使用的平底珠保持管,和单独地适于该方法的所有步骤的设计的收集管。图2b示出了2ml的珠保持管,其具有可以在本方法中使用的一个套环和单独地适合于用于该方法的所有步骤的设计的收集管。图3a-图3b示出了2ml的珠保持管的实例,其包含直径为4mm的珠。图3a示出了两种类型的2ml珠保持管的侧视图,其中一种具有两个套环,其包含直径为4mm的珠,和第二珠保持管具有平底且具有多个包含4mm珠的开口。图3b示出了图3a中的平底管的端视图,其示出了多个开口。图4a-图4b是图3a-图3b中所示的珠保持管的部分的图示。图4a示出了包含在收集管中的图3中的两个带套环的珠保持管。珠保持管(102)在收集管(101)内。珠保持管的主体为(103)。示出了尺寸减小的两个套环(104和109),其中出口开口(105)的直径大于0.5mm。管(106)连接的倾斜侧提供连接到较窄的套环的过渡。示出了两个脊,其中一个被标记为(107),一个或多个珠(108)位于其上,以允许洗脱物中的dna流入收集管并避免阻塞出口开口。珠保持管(111)的顶部的开口相对于管(105)的底部的出口开口相对地放置,其中该开口用于接收dna溶液和珠子。图4b示出了平的出口开口,其在图3a和图3b所示的珠收集管的底部处包含多个出口孔,每个出口孔的直径(110)为至少0.5mm。图5显示形状对于珠不是关键的,其中使用了8个不同尺寸的宝石玻璃珠(a-h),并且任何适当形式的成形珠都可以用作结合基质。结果示于表4。图6示出了在纯化之前的裂解方案期间以多种搅拌速度从人胚胎肾293(hek293)细胞分离的gdna的大小范围。根据实施例1中所述的用于培养的哺乳动物细胞的方案,从1×106个hek293细胞中分离hmwgdna。在裂解期间,以不同的搅拌速度(300rpm、900rpm、1400rpm和2000rpm)搅拌样品。使用0.5×kbb缓冲液和pippinpulsetm电泳电源(sagescience有限公司,beverly,马塞诸塞州),将300纳克(ng)的每个样品上样到0.75%脉冲场琼脂糖凝胶上。使用分子量标记物lambdapfgladder(newenglandbiolabs,ipswich,马塞诸塞州)。300rpm的搅拌速度产生最大的gdna,而2000rpm的搅拌速度产生不大于300kb的dna。具体实施方式除非另有定义,否则本文使用的所有技术和科学术语具有与本公开内容所属的相关领域的普通技术人员通常理解的相同含义。仍然,本文相对于本公开内容的实施方式并且为了清楚和易于参考而限定了某些术语。普遍理解的术语和符号的来源可以包括:标准论文和文本,例如kornberg和baker,dnareplication,第二版(w.h.freeman,纽约,1992);lehninger,biochemistry,第二版(worthpublishers,纽约,1975);strachan和read,humanmoleculargenetics,第二版(wiley-liss,纽约,1999);eckstein,编辑,oligonucleotidesandanalogs:apracticalapproach(oxforduniversitypress,纽约,1991);gait,编辑,oligonucleotidesynthesis:apracticalapproach(irlpress,牛津,1984);singleton等人,dictionaryofmicrobiologyandmolecularbiology,第二版,johnwileyandsons,纽约(1994),以及hale和markham,theharpercollinsdictionaryofbiology,harperperennial,纽约(1991)等。如本文和所附权利要求书中所使用的,单数形式“一个”、“一种”和“该”包括复数指示物,除非上下文另外明确指出。例如,术语“蛋白质”是指一种或多种蛋白质,即,单种蛋白质和多种蛋白质。当使用排他性术语(例如“单独地”、“仅仅”)与权利要求要素的叙述结合使用或指定了否定限制时,可以撰写权利要求以排除任何任选要素。可以根据实施方式、章节标题、附图、描述和实例进一步理解本公开内容的方面,这些都不应当被解释为以任何方式限制本公开的整个范围。因此,应根据本公开内容的全部广度和精神来解释以下提出的权利要求。在此描述和示出的每个单独的实施方式具有离散的部件和特征,这些部件和特征可以容易地与其他一些实施方式中的任何一个的特征分离或组合,而不脱离本教导的范围或精神。可以以叙述事件的顺序或逻辑上可能的任何其他顺序执行任何叙述的方法。数字范围包括限定范围的数字。应该理解所有数字都包含整数上下的整数的中点,即数字2包含1.5-2.5。数字2.5包含2.45-2.55等。提供样本数字值时,除非特别说明,否则每个值可以代表值范围内的中间值,并且一起可以代表范围的极限值。本文提供了分离hmwdna的方法的实例。该方法的优点包括以下中至少一项:(a)从工作流程开始到结束的30分钟至90分钟内从细胞或组织中获取纯化的hmwdna的快速方法;(b)通过260/280和260/230波长读数确定的高产量的纯hmwdna产生方法的重现性;(c)扩大进样量并仍然获得高产量的hmwdna的能力(见表1a);表1a细胞数典型产量(μg)1×1050.5-1.05×1055.5-6.51×10611.5-135×10557.5-651×107110-125(d)dna大小的可调性。这可以通过选择合适的搅拌速度来实现。搅拌速度越高,dna大小越小。以300rpm-500rpm的速度搅拌可提供mb大小范围的dna。以最大速度(例如约2000rpm)搅拌会产生50kb-250kb的dna,其最适合在牛津纳米孔测序平台(英国牛津)上进行测序;(e)用于任何期望细胞类型或组织的方法的多功能性。下面提供了用于从细菌、真核细胞和组织中获得hmw的实施方式的实例。工作流程的实例在图1a-图1b中提供。工作流程包括以下一个或多个步骤:细胞或组织的裂解、和蛋白质的去除以及具有可调大小的gdna的释放;将dna沉淀到玻璃珠上(例如,使用醇例如乙醇或异丙醇);清洗具有捕获的dna的玻璃珠;从玻璃珠上洗脱dna,并将洗脱物与玻璃珠分离以回收纯hmwdna。本方法的特征是使用珠,该珠提供合适的表面,可以在其上包裹hmwdna,并且该珠的大小大于200μm,以避免吸附dna的珠的珠间剪切。如本文所用,术语“珠”是指用于从溶液中吸附大分子的小物体或基质,并且核酸粘附至珠的表面。珠最通常的是球形,但也可以是规则或不规则的其他形状。表4和图5提供了经测试并发现有效的多种珠形状的一些实例。因此,珠可以是例如球形、卵形、盘形、圆柱形、立方体、长方体、沙漏/8形、金字塔形等。在一个实施方式中,珠是球形的。珠子最通常的是光滑的。出于成本和容易获得的原因,珠的材料优选地是玻璃。然而,可以使用带电荷的、极性的、提供dna吸附表面的任何材料。带电的表面使dna能够粘附到珠上。这样的材料包括陶瓷和粘土。此外,在实例中使用了透明的玻璃珠,但表4和图5提供了也有效工作的有色玻璃的数据。珠的大小可以根据拟纯化的dna的长度而变化。优选直径至少为1mm的珠,其原因包括可以通过镊子手动将珠放置在管中。应避免小于200μm的珠。当低于200μm,珠会相互移动,从而对吸附在其表面上的dna造成不期望的剪切损伤。当将2ml管用于样品加工时,在某些情况下,每个管或样品的珠总表面积可能在75mm2至150mm2的范围内。例如,如果选择直径为4mm的珠子,则每2ml管/样品可使用两个珠子,以提供此范围内的表面积。在该实例中,珠的总表面积为100.54mm2。如果选择较小的珠(例如直径在200μm至4mm范围内的珠子),则应当使用更多的珠子。下表描述了直径、表面积/珠、珠数量的关系,以获得总珠子表面积约100mm2的珠数量以及硼硅酸盐珠的重量(质量/体积为2.23毫克(mg)/mm3),以获得其。表1b珠子直径表面积/珠子(mm2)珠子数量0.250.25000.50.7912713.1432212.578328.274450.272578.5416113.11当期望从相对较小的细胞裂解物或组织活检的样品中纯化大分子dna的方法时,可在能够容纳约1ml-2ml的管中使用1mm至6mm范围的珠。在该实例中,选择珠数量以提供至少约100mm2的总表面积。这可以使用至多30-50个直径为1mm的珠来实现。如果珠的直径小于1mm,就可以使用更多数量的珠,只要珠的直径大于200μm。例如,为了获得100mm2的表面积,可以使用一个5mm或6mm直径的珠,可以使用两个4mm直径的珠,可以使用四个3mm直径的珠,可以使用八个2mm直径的珠,或可以使用32个1mm直径的珠。当样品的体积大于2ml时,可以相应地扩大珠保持管、收集管和珠的优选大小和数目的可用表面积。如下所述,用于方法的多个步骤的某些管可以具有一些特定的特征,这些特征对于方法的多个实施方式是有利的。例如,对于大约2ml或更少的小样品,优选的是微量离心管,因为它们可以用于微量离心机。此外,可以将具有至少一个出口开口的内管(在此称为珠保持管)插入到外管(收集管)中。外管可以是微量离心管(参见例如图2a-图2b)。方法的实施方式可以包括以下步骤:将dna沉淀到珠上,洗涤珠,然后从珠上洗脱dna。通过珠保持管底部的一个或多个出口开口,可以方便、有效地实现dna与珠的物理分离,其中可通过离心增强dna进入收集管的洗脱和分离。出口开口的大小应小于珠的大小,以使dna能够与珠分离。如果出口开口是基本上圆形的,出口开口的“大小”是出口开口的直径。珠保持管中的一个或多个出口开口每个的大小(例如直径)优选为至少0.5mm,从而避免通过这些出口开口的hmwdna的剪切。在出口开口的大小(例如直径)例如为0.5mm时,珠应当具有至少略大于0.5mm(例如至少约1mm)的最小尺寸(例如直径,如果是球形的);和在出口开口的大小(例如直径)为例如1mm时,珠应当具有至少略大于1mm(例如至少约2-6mm)的最小尺寸(例如直径,如果是球形的)。本文提供了具有至少一个出口开口的两种类型的管的实例,以用于方法步骤。第一个实例是通过开口(111)将含dna的珠(108)放入的珠保持管(102),其中珠保持管具有套环(109)和出口开口(105),如图4a所示。珠保持套环具有优选地不是锥形的形状,但是可以是圆柱形的或部分圆柱形的,并且任选地,在珠的含珠主体与出口开口之间的圆柱形套环的壁可以被部分切除。在图2a中的管上示出了一个圆柱形套环,和在图3a和图4a中示出了两个套环。在图3a和图4a中,至少最终的珠保持套环与管的含珠部分相比具有减小的直径。由于进入孔的尺寸小于珠子直径,因此防止了珠通过出口开口(105)进入最终套环(109)。可以使用具有不导致剪切dna的任何期望形状的任何数量的套环。可以用与出口开口相关的任何其他珠子保持结构代替套环,该结构允许洗脱的dna不受剪切地通过。另外,珠保持管的优选特征是,珠不阻塞出口开口。本文中,这可以通过定位在珠保持套环上或附近的多个内部突出的脊或间隔物(107)来实现,其中脊的数量可以例如包括3个或4个均匀地间隔开的凸出脊,一个或多个珠可能会位于脊上,为含dna的洗脱物流动提供空间。可以选择其他数量的脊和它们的分布或用于保持具有所选尺寸的,优选地至少为1mm的珠的其他突出结构,以允许dna洗脱物围绕珠流动并通过出口开口进入收集室。这样,含dna的洗脱物可以通过重力或借助离心步骤容易地流入收集管(101)中。珠保持管的一个或多个出口开口可具有内部隔离物或脊,该内部隔离物或脊在离心期间将珠子与出口开口隔开。套环和珠保持管(106)的含珠主体之间的界面可以是倾斜的,例如以45°角倾斜或弯曲,以使dna洗脱液进入收集管时的剪切最小化。在包含珠的珠保持管的第二个实例中,使hmwdna与珠分离可不利用带套环的出口漏斗。取而代之的是,管可以具有带网格或多个出口开口(110)的平底,每个出口开口的大小为至少0.5mm,从而允许较大尺寸的珠保留在管中,而含有dna的洗脱物流过而没有阻塞(请参阅图3a-图3b)。这与细孔膜和滤芯在基于二氧化硅的dna制备方法中的常规使用形成对比,该方法的孔径小于0.5mm,并导致不想要的hmwdna的剪切。如果使用最小尺寸小于0.55mm但至少为200μm的珠进行hmw纯化,则建议使用分批方法,其中使用不具有出口开口的管进行洗脱步骤。从珠上释放出dna后,可以使用大口径移液管吸头除去含有dna的上清液。本方法避免了用于hmwdna分子纯化的常规dna纯化方法的许多限制。本方法不需要涡旋或dna样品通过任何细孔。此外,方法不使用直径小于200μm的珠,例如商业上可获得的磁珠,从而消除了与其他方法相关的许多剪切来源(参见,例如,jakobi等人,analbiochem.,175(1):196-201,1988;美国专利6,255,477;nanaassy等人,analbiochem.,365(2),2007:240-245;steiner等人,nucleicacidresearch,23:13,2569-2570,1995;和vogelstein等,pnas,76:2,615-619,1979)。通过本方法产生的分离的gdna的中值长度为进样dna的中值长度的至少50%、至少70%或优选地至少90%。因此,例如,如果进样dna的中值长度为约50kb,则通过该方法产生的分离的gdna的中值长度为至少约25kb、35kb或45kb。该方法可用于从几乎任何类型的dna样品中纯化hmwdna,例如分离的白细胞、培养的细胞、活检细胞和细菌细胞,或先前使用其他方法提取的纯化的hmw等。通过本方法分离的gdna可以使用多种长范围分析方法中的任一种进行分析,包括长读长dna测序和基因分型。术语“长dna”和“高分子量(hmw)dna”是指通常大于30kb,例如,大于35kb,例如至少50kb,例如高达100kb、200kb、300kb、500kb或1mb的dna。尽管本实用新型的方法特别适合于获得hmwdna,但是该方法也可以用于获得较短的dna。术语“dna沉淀剂”是指:高盐浓度的离液盐;醇;和/或群集剂。尽管不希望受到理论的限制,但是由于核酸被由水分子组成的水合壳所覆盖,而水合壳维持dna在水溶液中的溶解度,因此可以使用离液剂来沉淀dna。通过向核酸添加离液离子,水合物壳的水分子的这种相对有序的结构被破坏。离液盐为dna沉淀创造了疏水环境。作为离液盐的进一步特征,各自的阳离子使珠充满正电荷,这在疏水性条件下仍可改善核酸的结合。离液盐提高了非极性物质在水中的溶解度。它们使蛋白质变性,因为它们具有破坏疏水相互作用的能力。它们不会使dna或rna变性。用于dna纯化的离液盐的实例包括氯化胍和硫氰酸胍。例如,promega描述了使用高浓度的离液盐(例如hcl氯化胍)使dna选择性地结合至二氧化硅膜。promega还提供了一种名为reliapreptm的试剂盒(promegacorporation,麦迪逊,威斯康星州),其中gdna借助群集剂(peg)结合到膜(在这种情况下为纤维素材料)。该试剂盒不使用离液盐或醇作为沉淀剂。katevatis等人,2017plosone12(5):e0176848描述了离液型硫氰酸胍(guscn)增强的dna-二氧化硅吸附。dna沉淀剂的其他实例由genelink(埃尔姆斯福德(elmsford),纽约州)提供(dna和rna沉淀方案)。加入乙醇会降低溶液的介电常数。在一些实施方式中,该方法可以涉及生产这样的组合物,该组合物包含直径为至少200μm的一个或多个珠(如上所述)(例如1-50个玻璃珠),包含中值长度为至少50kb(例如中值长度为至少50kb、至少200kb、至少500kb或至少1mb的gdna)的dna的dna溶液,和dna沉淀剂(例如高浓度的离液盐和/或乙醇或异丙醇,具有或没有盐,其中组合物中的沉淀剂的浓度和ph值会导致dna沉淀)。沉淀的dna粘附在一个或多个珠的表面,并且可能会形成松散的凝胶,将其每个珠封装起来,在沉淀后的洗涤步骤中,该松散的凝胶会与珠更紧密地结合。将dna粘附到珠子后,可以去除未结合的材料(其保留在珠周围的液体中),以避免干扰一个或多个珠。例如,这可以通过移液或抽吸来完成。接下来,在洗涤缓冲液,例如含醇的洗涤缓冲液如70%乙醇等中洗涤一个或多个珠。例如,可以通过将一定量的洗涤缓冲液添加到容器中的珠上,轻轻地倒转容器,然后小心地除去洗涤缓冲液,而不会不适当地干扰一个或多个珠来完成此步骤。如有必要,可通过离心去除任何残留的洗涤缓冲液。例如,可以通过将珠和残留的洗涤缓冲液倾析入珠保持管中,然后在珠位于珠保持管中时将珠离心来完成此操作。在这些实施方式中,残留的洗涤缓冲液会穿过柱底部的优选为至少0.5mm的多个孔,将洗涤后的具有大于0.5mm的最小直径的珠留在珠保持管中。接下来,可以将dna从珠释放到洗脱缓冲液中。这可以通过以下步骤来完成:将珠转移到另一个容器中,向珠加入一定体积的洗脱缓冲液(例如tris/edta溶液或已知释放dna的其他缓冲液(参见例如katevatis等,2017)),然后在室温或升高的温度(例如37-56℃)下温育珠,例如5分钟-10分钟,以从珠上洗脱dna。接下来,洗脱的dna与一个或多个珠分离。包含dna的珠的转移可以通过以下来实现:将含有dna的珠倾析入外部收集管中的珠保持管,添加洗脱缓冲液以释放dna并在他们在珠保持管中时进行离心。在这些实施方式中,洗脱物穿过珠保持管底部的一个或多个出口开口进入收集管。然后可以将目前在收集管中的洗脱dna进行储存,进一步加工或直接进行分析。在纯化前的初始dna样品可以是在水或缓冲液中纯化的gdna、包含dna和生物大分子的复杂混合物、细胞裂解物、组织裂解物或已经进行净化程序的细胞裂解物。可以从组织或其粉末形式提取gdna。可以用蛋白酶(例如蛋白酶k)处理dna样品以消化蛋白质。在进一步纯化之前,方法可以包括或可以不包括去除蛋白质的苯酚-氯仿提取步骤。在一些实施方式中,dna样品可以在裂解缓冲液和用蛋白酶如蛋白酶k处理的裂解物中温育。任何细胞裂解都可以在有或没有搅动的情况下进行,其中搅动的速度决定了所得的gdna的中值长度(参见例如图6)。例如,细胞裂解物(或组织裂解物)可以通过在裂解缓冲液中以300rpm-2000rpm范围内的速度在37℃-56℃范围内的温度下搅拌细胞或研磨组织来产生。以300rpm-500rpm的搅拌可提供mb大小范围的dna,而约2000rpm下的搅拌可产生50kb-250kb的dna。dna样品可以包含来自任何生物体的gdna,例如植物、动物(例如爬行动物、哺乳动物、昆虫、蠕虫、鱼等)、组织样品、细菌、真菌(例如酵母)、病毒等。在一些实施方式中,通过本方法纯化的dna可以源自哺乳动物,例如人类。在示例性实施方式中,dna样品可以包含来自哺乳动物细胞例如人、小鼠、大鼠或猴细胞的gdna。样品可以由培养的细胞或临床样品例如组织活检刮片或灌洗液的细胞制成。可以使用任何适合的方法来分析洗脱的dna。表4示出了分光光度分析的结果。图6显示了在裂解温育期间以不同速度搅拌后dna大小的凝胶。在一些实施方式中,可以使用长读长单分子测序方法例如纳米孔测序(例如,如soni等人在clinchem53:1996-20012007中所述的,并且由oxfordnanoporetechnologies开发的)或pacificbiosciences的荧光碱基切割方法(目前的读取长度为几十的千碱基,有些读长超过100kb)来对洗脱的dna进行测序。可选地,可以通过其他长范围基因组映射方法,例如基于纳米通道阵列的方法(由lam等人,在nat.biotechnol。201230:771-776描述,由bionanogenomics开发,加利福尼亚州圣地亚哥)分析洗脱的dna。组合物还提供了在方法的实践期间制成的多种组合物。例如,组合物可以包含一个或多个珠(例如1-50个珠),其中,例如,珠是球形玻璃珠。要求珠的最小尺寸为至少200μm(例如,一个或多个珠的最小尺寸为至少1mm,例如1mm至6mm的范围内)。当一个或多个珠是球形时,他们的直径为至少200μm,例如直径为至少1mm(例如1mm至6mm)。组合物进一步包括dna溶液,该dna溶液包括例如具有至少35kb或至少50kb的中值大小的hmwdna;和沉淀剂,该沉淀剂包括醇,例如乙醇或异丙醇,具有或没有盐。在这些实施方式中,组分在同一容器中,例如1.5ml或2ml微量离心管中,尽管根据样品的体积可以使用任何尺寸的管。dna溶液可以由例如细胞或组织裂解物,例如细菌或哺乳动物细胞制成。在可选的实施方式中,组合物可包含最小尺寸(例如直径,如果是球形的)为至少200μm的一个或多个珠(例如,在2ml管中的1-50个珠子)(例如,一个或多个珠的最小尺寸为至少1mm,例如在1mm至6mm的范围内)。在这些实施方式中,dna粘附至珠子的表面。在这些实施方式中,组分可以在含有珠的管内,该管具有用于接收样品和珠的顶部开口和用于将从珠上洗脱的dna水溶液释放到收集管中的出口开口。试剂盒如上所述,本公开内容还提供了用于实践本主题方法的试剂盒。在一些实施方式中,试剂盒可包含以上所列的任何一种或多种组分。例如,试剂盒可包含(a)一个或多个最小尺寸为至少200μm的捕获珠(例如,一个或多个最小尺寸为至少1mm,诸如在1mm至6mm范围内的珠),和(b)具有一个或多个出口开口的珠保持管,所述出口开口的直径小于珠,并且其中珠保持管被设计成使得在使用期间一个或多个出口开口不被一个或多个珠阻塞。上面提供了试剂盒中可能包含的珠和含珠的管的实例的详细信息。在一些实施方式中,试剂盒可另外包含外管(收集管),其中,珠保持管装配在外管中,如图1a和图4a所示。外管可以是标准的1.5ml或2ml微量离心管。另外,试剂盒可进一步包括一种或多种缓冲液,例如用于裂解含有细胞的生物样品的裂解缓冲液、蛋白质去除溶液、用于洗涤dna粘附的珠的洗涤缓冲液(例如,含醇的洗涤缓冲液)和/或用于从珠上去除dna的洗脱缓冲液。珠可以是玻璃珠。试剂盒还可以包括用于研磨组织或细菌细胞的杵和杵管。试剂盒的多种组分可以单独存在于分开的容器中,或者某些相容的组分可以根据需要预先组合到单个容器中。除上述组分外,主题试剂盒可进一步包括使用试剂盒的组分以实践主题方法的说明,即样品分析说明。本说明书中提到的所有出版物、专利和专利申请都以引用的方式并入本文,就如同每个单独的出版物、专利或专利申请被明确地和单独地指出通过引用并入一样。这包括2019年8月21日提交的美国临时申请号62/889,753和2019年8月22日提交的美国申请号16/547,844。实施例根据以下实施例,可以进一步理解本教导的方面,这些实施例不应以任何方式被解释为限制本教导的范围。实施例1:从裂解物中制备脱蛋白的dna样品(a)从细胞悬液制备hmwdna。在使用标准技术的离心后,从全血(500μl)中以沉淀形式获得淋巴细胞。将沉淀重悬于磷酸盐缓冲盐水(pbs)中。可选地,从细胞培养物中获得培养的细胞(hek293)。然后用5μlrna酶a(20mg/ml)和10μl蛋白酶k(20mg/ml)处理在150微升(μl)pbs中重悬浮的含有淋巴细胞或5×106个hek293细胞的沉淀物。加入150μldna血液裂解缓冲液(newenglandbiolabs,伊普斯维奇,马萨诸塞州),并将细胞在56℃下温育10分钟,同时根据所需dna的长度在500rpm-2000rpm下震荡。对于mb的dna,发现500rpm是最大震荡速度。对于100kb-250kb的dna,使用1400rpm-2000rpm(参见图6)。因为基本上所有的蛋白质都被消化了,所以在分离hmwdna之前不需要蛋白质去除步骤(参见图1a中的工作流程)。(b)从固体组织制备hmwdna。首先通过在微型杵(1.5ml管)中压碎制备10mg组织。加入含有蛋白酶k的裂解缓冲液(10μl的20mg/ml溶液)加上300μl的含有50mm的tris、2%的sds、100mm的nacl和20mm的edtaph8.25的缓冲液,以消化样品中的蛋白质。样品在振荡器中在56℃下温育45分钟。震荡速度如(a)中所述。加入10μlrna酶a(20mg/ml)并在56℃下温育10分钟。通过氯仿/苯酚步骤将蛋白质与dna分离。使用1000μl宽口移液器吸头回收水相(400μl),并将其转移至2ml管中以沉淀hmwdna(参见图1b)。表2:具有一些可选的量组织的实施例、裂解缓冲液的体积,蛋白酶k和dna产量的。样品类型量(mg)组织裂解缓冲液(μl)蛋白酶k(μl)预期产量(μg)肌肉/纤维组织多至10300103-4多至206002012-14脑多至10300103多至20600206富含dna/软器官的组织多至5300105-15多至106002010-30鼠尾巴多至103001010-15多至206002020-30为了从固体组织和细胞悬液中制备hmwdna,进行了两步裂解,其中破坏细胞膜释放rna,同时保持核酸完整。引入rna酶a以去除rna,然后裂解细胞核并释放gdna。在该方式中,在由于gdna的释放而使裂解物的粘度增加之前,除去了rna。(c)从微生物制备hmwdna将至少2×109个微生物沉淀并重悬于含有10μl溶菌酶(25mg/ml)的裂解缓冲液和300μl的组织裂解缓冲液(50mm的tris、2%的sds、100mm的nacl和20mm的edtaph8.25)中,并在37℃下以1400rpm-2000rpm温育3分钟-5分钟。然后加入20μl蛋白酶k,并在热混合器中以最大速度(1400rpm-2000rpm)在56℃下温育最少30分钟。然后加入10μlrna酶a,并在56℃下温育10分钟。通过氯仿/苯酚步骤将蛋白质与dna分离。使用1000μl宽口移液器吸头回收水相,并将其转移至2ml管中以浓缩hmwdna。表3:从微生物裂解物中制备脱蛋白的dna样品细菌细胞数pbs(μl)组织裂解缓冲液(μl)蛋白酶k(μl)多至2×10915015010多至5×109或未知数量30030020实施例2:高分子量dna的浓度以下方案描述了如何使用捕获珠从样品中分离hmwgdna的实例。如表4所示,对于该方案可以使用由多种dna吸附的材料制成的不同大小和形状的珠,同时避免增加dna剪切的小于200μm的珠,并避免使用任何形式的孔径小于0.5mm的过滤器。以下步骤中使用图1a中描述的样品,其包括血液样品或培养细胞的裂解物或脱蛋白的固体组织或微生物样品的非蛋白相。样品大小为400μl或800μl。在2ml管中,将两个dna玻璃捕获珠添加到每个样品中。(a)将dna与珠结合并通过洗涤除去污染物:然后将275μl异丙醇(低进样量样品)或275μl异丙醇和275μl乙醇(高进样量样品)添加到样品中,以将dna沉淀到捕获珠上。(b)洗涤珠以去除dna沉淀物和裂解物污染物:将800μl70%的乙醇添加到样品中。包含最终浓度为70%的乙醇的洗涤缓冲液使dna与珠更紧密地结合。然后倾析出洗涤缓冲液,并将珠倒入空的管插入物中,在管的底部具有出口漏斗(具有出口开口的套环)或多孔网(孔径为至少0.5mm)。设计带有出口开口的套环,以使珠不会阻塞洗脱液的流出。这是通过出口漏斗的套环上的脊实现的。将空管插入物放入空的1.5ml离心管中。可以在本方法中使用的珠保持管的实例在图2a-图2b、图3a-图3b、图4a-图4b中示出。在离心步骤中除去洗涤缓冲液,然后重复。(c)在浓缩溶液中从珠上洗脱dna:将含有hmwdna的干燥珠倒入2ml管中。加入洗脱缓冲液(例如trisedta),并在热混合器中以最低速度(300rpm)搅拌或在加热块中在56℃下温育5分钟-10分钟,以允许dna从珠上洗脱。将洗脱的dna溶液和珠转移到位于1.5ml微量离心管中的珠保持管中。然后将位于离心管中的管插入物以最大速度(>12,000×g)离心0.5分钟,以使gdna收集在离心管中。然后丢弃具有玻璃珠的管插入物。样品包含hmwdna,并保存在4℃下。分析通过该方法收集的dna的量和纯度。测试了多种硼硅酸盐珠的大小、形状和材料,并且表4中示出结果。所有珠均能很好地发挥作用以作为gdna的结合基质,从而为所有类型的玻璃珠提供相似的产量。将直径为1mm和2mm的珠收集在corning公司(纽约州康宁)的最大开口为0.5mm的平底旋转柱中。将所有较大的珠和珠宝珠收集在corning公司的最大开口直径为1.5mm的平底旋转柱中。表4·使用16分光光度计(unchainedlabs,沃本,马萨诸塞州)从2μl样品中确定dna的量如上表所示,所有大尺寸的珠都能很好地从培养细胞中分离hmwgdna。可以鉴定范围从1mm–6mm的珠是最实用的,因为它们可以放入具有大筛孔的珠保持管中,这样可以通过微量离心机中的离心方便地分离珠和含gdna的洗脱物而不会剪切gdna。另外,在这些珠保持管中,可以通过在台式微型离心机中将它们非常短暂地旋转,从玻璃珠上的gdna中除去痕量的含有乙醇的洗涤缓冲液。实施例3:测量和分析hmwdna样品纯化的hmwgdna通常是粘性的,容易结块,并且难以准确地处理和转移体积。为了测试dna样品的纯度,可使用大口径的移液器吸头或针头或通过短涡旋将样品均质化。为了获得最佳测序结果,用于牛津纳米孔测序的hmwdna的长度优选为50kb-250kb。为了获得这种大小的dna,在裂解过程中以2000rpm的速度搅拌可提供最佳结果。此外,将通过过26号针头的10-20通道(pass)用于组织和细菌样品,这些样品是从用微管杵匀化(组织)或未匀化(细菌)开始来分离的。尽管出于清楚理解的目的已经通过图示和实施例的方式详细一点地描述了前述实用新型,但是根据本实用新型的教导,对于本领域的普通技术人员来说显而易见的是,在不脱离该所附权利要求书的精神或范围的前提下,可以对其进行某些改变和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1