含海藻糖的哺乳动物细胞保存用液的制作方法
1.本发明涉及包含海藻糖或其衍生物或者它们的盐(以下,有时将它们统称为“海藻糖类”)、并且氢离子指数(ph)为6.5~8.5的哺乳动物细胞保存用液(以下,有时称为“本技术哺乳动物细胞保存用液”);使用本技术哺乳动物细胞保存用液来保存哺乳动物细胞的方法等。
背景技术:
2.近年来,由于干细胞研究的迅速发展,向再生医疗中应用的形势高涨,其知识和理解不仅在研究者中、而且在普通人中也得到了广泛普及。使用干细胞的再生医疗是以利用干细胞所具有的自复制能力和多能性、干细胞分泌的因子来恢复因各种疾病而受到损伤的细胞和组织的功能为目的的医疗。若对白血病、再生不良性贫血等血液疑难病患者进行骨髓移植,造血干细胞在患者体内成活,在几乎一生内维持造血能力成为可能。此外,近来很多研究者以使用除造血干细胞以外的干细胞的临床应用为目标,对中枢神经、末梢神经、骨髓、小肠等中的干细胞进行鉴定,已开始实践针对外伤性疾病、组织变性疾病进行组织干细胞移植治疗(非专利文献1~3)。另一方面,癌症免疫细胞疗法是将具有攻击癌症的功能的免疫细胞取出至体外,强化其功能后再次移植回体内的最先进的细胞医疗,并已实践了树突状细胞疫苗疗法、αβt细胞疗法、γδt细胞疗法、ctl疗法、自然杀伤细胞疗法(nk细胞疗法)等使用t细胞的疗法。
3.在长期保存用于移植治疗中的干细胞、t细胞的情况下,在液体中保存时无法良好地维持细胞生存率。例如,已有报道称,将人骨髓干细胞在生理盐水中冷藏保存(4℃)时,细胞生存率在48小时后降低至40%以下,在72小时后降低至20%以下(非专利文献4)。因此,长期保存移植用干细胞、移植用t细胞时,一般进行冷冻保存。但是,由于在冷冻保存液中通常添加有dmso、甘油等冷冻保存剂,因此,将经冷冻保存的干细胞、t细胞解冻之后,需要在进行移植治疗之前除去冷冻保存剂,存在耗费劳力的问题。另外,即使在冷冻保存液中添加冷冻保存剂,冷冻时水的结晶化对细胞骨架的损伤也很大,冷冻融解后的细胞生存率降低也成为问题。因此,当务之急是开发出简便性优异、且能够抑制细胞生存率降低的细胞保存液。
4.本技术的发明人报道了海藻糖具有抑制在液体中保存哺乳动物细胞时所产生的细胞生存率降低的作用(专利文献1及2)。但是,并不知晓在调节这些液体的ph时,抑制细胞生存率降低的效果进一步提高、具有抑制哺乳动物干细胞的自复制能力降低的效果。
5.现有技术文献
6.专利文献
7.专利文献1:日本特开2012
‑
115253号公报
8.专利文献2:国际公开第2014/208053号小册子
9.非专利文献
10.非专利文献1:gage,f.h.science 287:1433
‑
1438(2000)
11.非专利文献2:morrison,s.j.等人,cell 96:737
‑
749(1999)
12.非专利文献3:batle,e.等人,cell 111:251
‑
263(2002)
13.非专利文献4:lane,t.a.等人,transfusion 49:1471
‑
1481(2009)
技术实现要素:
14.发明所要解决的课题
15.本发明的课题在于提供能够对在液体中保存哺乳动物细胞时产生的细胞生存率降低、在液体中保存哺乳动物干细胞时产生的自复制能力降低进行有效地抑制,并且在将哺乳动物细胞施予至哺乳动物的生物体内时,对哺乳动物的生存状态产生不良影响的可能性低的哺乳动物细胞保存用液等。
16.用于解决课题的手段
17.本技术的发明人为了解决上述课题而持续进行了深入研究。在该过程中发现,若在包含海藻糖类和作为ph调节剂的碳酸氢盐、并且ph为6.5~8.5的液体中保存哺乳动物细胞,则即使该液体不具有ph缓冲作用的情况下,也能够有效地抑制细胞死亡,提高活细胞的比例。另外,还确认了若在该液体中保存哺乳动物干细胞,则即使该液体不具有ph缓冲作用的情况下,也可以有效地抑制哺乳动物干细胞的自复制能力降低。本发明是基于这些见解而完成的。
18.即,本发明如下所述。
19.〔1〕哺乳动物细胞保存用液,其包含海藻糖或其衍生物或者它们的盐、及作为ph调节剂的碳酸氢盐,并且ph为6.5~8.5。
20.〔2〕如上述〔1〕所述的保存用液,其中,碳酸氢盐为碳酸氢钠。
21.〔3〕如上述〔1〕或〔2〕所述的保存用液,其进一步包含多糖类或其衍生物或者它们的盐。
22.〔4〕如上述〔1〕~〔3〕中任一项所述的保存用液,其为等渗液。
23.〔5〕如上述〔4〕所述的保存用液,其中,等渗液为乳酸林格液。
24.〔6〕如上述〔3〕~〔5〕中任一项所述的保存用液,其中,多糖类为葡聚糖。
25.〔7〕如上述〔1〕~〔6〕中任一项所述的保存用液,其中,海藻糖或其衍生物或者它们的盐的浓度为2.0~6.0(w/v)%。
26.〔8〕如上述〔6〕或〔7〕所述的保存用液,其中,葡聚糖或其衍生物或者它们的盐的浓度为4.0~7.0(w/v)%。
27.〔9〕如上述〔1〕~〔8〕中任一项所述的保存用液,其用于在0~40℃保存哺乳动物细胞。
28.〔10〕如上述〔1〕~〔9〕中任一项所述的保存用液,其用于将哺乳动物细胞保存6小时~14天。
29.〔11〕如上述〔1〕~〔10〕中任一项所述的保存用液,其用于抑制哺乳动物细胞的生存率降低。
30.〔12〕如上述〔1〕~〔11〕中任一项所述的保存用液,其用于抑制哺乳动物细胞的自复制能力降低。
31.〔13〕如上述〔1〕~〔12〕中任一项所述的保存用液,其用于哺乳动物细胞的移植。
32.〔14〕如上述〔1〕~〔13〕中任一项所述的保存用液,其中,哺乳动物细胞为哺乳动物干细胞。
33.〔15〕如上述〔14〕所述的保存用液,其中,哺乳动物干细胞为哺乳动物间充质干细胞。
34.〔16〕粉末制剂,其包含海藻糖或其衍生物或者它们的盐、及作为ph调节剂的碳酸氢盐,并用于制备上述〔1〕~〔15〕中任一项所述的保存用液。
35.〔17〕如上述〔16〕所述的粉末制剂,其中,碳酸氢盐为碳酸氢钠。
36.〔18〕哺乳动物细胞的保存方法,其包括在保存用液中保存哺乳动物细胞的工序,所述保存用液包含海藻糖或其衍生物或者它们的盐、及作为ph调节剂的碳酸氢盐,并且ph为6.5~8.5。
37.〔19〕如上述〔18〕所述的保存方法,其中,碳酸氢盐为碳酸氢钠。
38.〔20〕如上述〔18〕或〔19〕所述的保存方法,其中,保存用液进一步包含多糖类或其衍生物或者它们的盐。
39.〔21〕如上述〔18〕~〔20〕中任一项所述的保存方法,其中,保存用液为等渗液。
40.〔22〕如上述〔21〕所述的保存方法,其中,等渗液为乳酸林格液。
41.〔23〕如上述〔20〕~〔22〕中任一项所述的保存方法,其中,多糖类为葡聚糖。
42.〔24〕如上述〔18〕~〔23〕中任一项所述的保存方法,其特征在于,在保存用液中将哺乳动物细胞保存6小时~14天。
43.另外,作为本发明的其他实施方式,可以举出:哺乳动物细胞的移植方法,其包括将含哺乳动物细胞的本技术哺乳动物细胞保存用液对需要移植哺乳动物细胞的对象(例如,外伤性疾病患者、组织变性疾病患者、癌症患者)进行施予的工序;哺乳动物细胞的移植方法,其包括,在含海藻糖类的液体(优选等渗液)中添加哺乳动物细胞,或者在含哺乳动物细胞的液体(优选等渗液)中添加海藻糖类,并进一步将该液体的ph调节为6.5~8.5,由此制备本技术哺乳动物细胞保存用液的工序,在制备而得的本技术哺乳动物细胞保存用液中保存哺乳动物细胞的工序,以及将包含经保存的哺乳动物细胞的本技术哺乳动物细胞保存用液对需要移植哺乳动物细胞的对象(例如,外伤性疾病患者、组织变性疾病患者、癌症患者)进行施予的工序;海藻糖类在制造本技术哺乳动物细胞保存用液中的用途、海藻糖类在用于抑制液体中的哺乳动物细胞生存率降低中的用途;含哺乳动物细胞的本技术哺乳动物细胞保存用液,其用于治疗需要哺乳动物细胞移植治疗的疾病(例如,外伤性疾病、组织变性疾病、癌症)的用途;含哺乳动物细胞的本技术哺乳动物细胞保存用液的制备方法,其包括在含海藻糖类的液体(优选等渗液)中添加哺乳动物细胞,或者在含哺乳动物细胞的液体(优选等渗液)中添加海藻糖类,并进一步将该液体的ph调节至6.5~8.5,由此制备本技术哺乳动物细胞保存用液的工序;含哺乳动物细胞的本技术哺乳动物细胞保存用液;等等。需要说明的是,就上述移植方法的保存哺乳动物细胞的工序而言,通常是在该保存用液以液体状态存在的温度条件下,保存含哺乳动物细胞的本技术哺乳动物细胞保存用液,并不包括该保存用液以固体状态进行保存的工序(例如,冷冻保存的工序、冷冻干燥保存的工序等将哺乳动物细胞以休眠状态进行保存的工序)。
44.发明的效果
45.根据本发明,通过在液体中添加海藻糖类,进一步将该液体的ph调节至6.5~8.5,
由此能够有效地抑制在液体中保存哺乳动物细胞时产生的细胞生存率降低、在液体中保存哺乳动物干细胞时产生的自复制能力降低。此外,由于海藻糖类是在施予至哺乳动物的生物体内时,对哺乳动物的生存状态产生不良影响的可能性低的二糖类,因此将哺乳动物细胞保存在本技术哺乳动物细胞保存用液中之后,可以不置换为新的移植用液,而直接向哺乳动物的生物体内进行施予。
附图说明
46.图1是示出在实施例1~3及比较例1~3中,对将源自人脂肪的间充质干细胞(had
‑
msc;human adipose tissue
‑
derived mesenchymal stem cell)在含海藻糖保存液csp
‑
01中保存各保存时期(1天、2天、4天、7天、及14天)时的细胞生存率(图1的a)及活细胞回收率(图1的b)进行测定的结果的图。
47.图2是示出在实施例6~10及比较例6中,对将had
‑
msc在含海藻糖保存液csp
‑
01中保存各保存时期(24小时、48小时、96小时、及168小时)时的细胞生存率(图2的a)及活细胞回收率(图2的b)进行测定的结果的图。
48.图3是示出在实施例11~14和比较例6及7中,对将had
‑
msc在含海藻糖保存液csp
‑
01中保存各保存时期(24小时、48小时、96小时及168小时)时的细胞生存率(图3的a)及活细胞回收率(图3的b)进行测定的结果的图。
49.图4是将对在含海藻糖保存液csp
‑
01(ph5.6未调节)、csp
‑
01(ph7.3naoh)及csp
‑
01(7.2nahco3)中,将源自人骨髓的间充质干细胞(hbm
‑
msc;human bone marrow mesenchymal stem cell)于5℃保存3天时的细胞生存率进行测定的结果与保存前(pre)的测定结果一并示出的图。
具体实施方式
50.本发明的哺乳动物细胞保存用液是特定于“用于保存哺乳动物细胞”这样的用途的、含海藻糖类且ph为6.5~8.5的液体(即,本技术哺乳动物细胞保存用液)。需要说明的是,在专利文献2中,用于保存哺乳动物细胞的含海藻糖的乳酸林格液、含海藻糖及葡聚糖的乳酸林格液分别为相当于后述的本实施例的csp
‑
01液(比较例3、4)及csp
‑
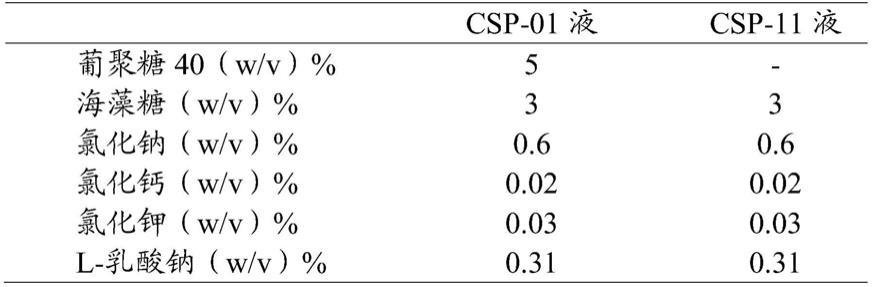
11液(比较例5、7)的ph小于6.5的液体,与本技术哺乳动物细胞保存用液不同。
51.作为本技术哺乳动物细胞保存用液中的ph,只要在6.5~8.5的范围内即可,例如可以举出:6.5~8.4;6.5~8.3;6.5~8.2;6.5~8.1;6.5~8.0;6.5~7.9;6.5~7.8;6.5~7.7;6.5~7.6;6.5~7.5;6.5~7.4;6.5~7.3;6.5~7.2;6.5~7.1;6.5~7.0;6.5~6.9;6.5~6.8;6.6~8.5;6.7~8.5;6.8~8.5;6.9~8.5;7.0~8.5;7.1~8.5;7.2~8.5;7.3~8.5;7.4~8.5;7.5~8.5;7.6~8.5;7.7~8.5;7.8~8.5;7.9~8.5;8.0~8.5;8.1~8.5;8.2~8.5;6.6~8.4;6.6~8.3;6.6~8.2;6.6~8.1;6.6~8.0;6.6~7.9;6.6~7.8;6.6~7.7;6.6~7.6;6.6~7.5;6.6~7.4;6.6~7.3;6.6~7.2;6.6~7.1;6.6~7.0;6.6~6.9;6.7~8.4;6.7~8.3;6.7~8.2;6.7~8.1;6.7~8.0;6.7~7.9;6.7~7.8;6.7~7.7;6.7~7.6;6.7~7.5;6.7~7.4;6.7~7.3;6.7~7.2;6.7~7.1;6.7~7.0;6.8~8.4;6.8~8.3;6.8~8.2;6.8~8.1;6.8~8.0;6.8~7.9;6.8~7.8;6.8~7.7;6.8~7.6;6.8~7.5;6.8~7.4;6.8~7.3;6.8~7.2;6.8~7.1;6.9~8.4;6.9~8.3;6.9~8.2;6.9~8.1;6.9~8.0;
6.9~7.9;6.9~7.8;6.9~7.7;6.9~7.6;6.9~7.5;6.9~7.4;6.9~7.3;6.9~7.2;7.0~8.4;7.0~8.3;7.0~8.2;7.0~8.1;7.0~8.0;7.0~7.9;7.0~7.8;7.0~7.7;7.0~7.6;7.0~7.5;7.0~7.4;7.0~7.3;7.1~8.4;7.1~8.3;7.1~8.2;7.1~8.1;7.1~8.0;7.1~7.9;7.1~7.8;7.1~7.7;7.1~7.6;7.1~7.5;7.1~7.4;7.2~8.4;7.2~8.3;7.2~8.2;7.2~8.1;7.2~8.0;7.2~7.9;7.2~7.8;7.2~7.7;7.2~7.6;7.2~7.5;7.3~8.4;7.3~8.3;7.3~8.2;7.3~8.1;7.3~8.0;7.3~7.9;7.3~7.8;7.3~7.7;7.3~7.6;7.4~8.4;7.4~8.3;7.4~8.2;7.4~8.1;7.4~8.0;7.4~7.9;7.4~7.8;7.4~7.7;7.5~8.4;7.5~8.3;7.5~8.2;7.5~8.1;7.5~8.0;7.5~7.9;7.5~7.8;7.6~8.4;7.6~8.3;7.6~8.2;7.6~8.1;7.6~8.0;7.6~7.9;7.7~8.4;7.7~8.3;7.7~8.2;7.7~8.1;7.7~8.0;7.8~8.4;7.8~8.3;7.8~8.2;7.8~8.1;7.9~8.4;7.9~8.3;7.9~8.2;8.0~8.4;8.0~8.3;8.1~8.3;等等。
52.作为本技术哺乳动物细胞保存用液,只要是可保存哺乳动物细胞的液体(例如,等渗液、低渗液、高渗液)即可,可以优选例示出等渗液。在本说明书中“等渗液”是指具有与体液的渗透压、细胞液的渗透压几乎相同的渗透压的液体,具体而言,是指具有250~380mosm/l范围内的渗透压的液体。另外,在本说明书中“低渗液”是指具有比体液的渗透压、细胞液的渗透压低的渗透压的液体,具体而言,是指具有小于250mosm/l的渗透压的液体。作为上述低渗液,优选细胞不会破裂的程度的低渗液(具体而言,具有100~小于250mosm/l范围内的渗透压的液体)。另外,在本说明书中“高渗液”是指具有比体液、细胞液的渗透压高的渗透压的液体,具体而言,是指渗透压超过380mosm/l(优选超过380mosm/l~1000mosm/l的范围内)。
53.作为上述等渗液,只要是通过钠离子、钾离子、钙离子等调节盐浓度、糖浓度等以使得与体液、细胞液的渗透压几乎相同的等渗液就没有特别制限,具体而言,可以举出生理盐水、具有缓冲效果的生理盐水(例如,pbs、tris缓冲生理盐水[tris buffered saline;tbs]、hepes缓冲生理盐水)、林格液、乳酸林格液、乙酸林格液、碳酸氢盐林格液、5%葡萄糖水溶液、动物细胞培养用基础培养基(例如,dmem、emem、rpmi
‑
1640、α
‑
mem、f
‑
12、f
‑
10、m
‑
199)、等渗剂(例如,葡萄糖、d
‑
山梨糖醇、d
‑
甘露糖醇、乳糖、氯化钠)等,其中优选乳酸林格液。等渗液可以是市售的,也可以是自制的。作为市售的等渗液,可以举出大塚生食注(otsuka pharmaceutical factory,inc.)(生理盐水溶液)、林格液“otsuka”(otsuka pharmaceutical factory,inc.)(林格液)、lactec(注册商标)injection(otsuka pharmaceutical factory,inc.)(乳酸林格液)、veen(注册商标)f输注液(扶桑药品工业公司制)(乙酸林格液)、大塚糖液5%(otsuka pharmaceutical factory,inc.)(5%葡萄糖水溶液)、bicanate(注册商标)输注液(otsuka pharmaceutical factory,inc.)(碳酸氢盐林格液)。
[0054]
可以通过在含海藻糖类的液体、或添加了粉状的含海藻糖类物质的液体中,添加作为ph调节剂的碳酸氢盐而将ph调节为6.5~8.5来得到本技术哺乳动物细胞保存用液。作为上述碳酸氢盐,可以举出碳酸氢铵、碳酸氢钾、碳酸氢钠、碳酸氢钙等,优选碳酸氢钠。另外,用上述碳酸氢盐调节ph而得的本技术哺乳动物细胞保存用液也可以不具有ph的缓冲作用。
[0055]
作为上述海藻糖类中的海藻糖,除了两分子的α
‑
葡萄糖以1,1
‑
糖苷键键合而成的
二糖类即α,α
‑
海藻糖以外,还可以举出α
‑
葡萄糖和β
‑
葡萄糖以1,1
‑
糖苷键键合而成的二糖类即α,β
‑
海藻糖、两分子的β
‑
葡萄糖以1,1
‑
糖苷键键合而成的二糖类即β,β
‑
海藻糖,其中,优选α,α
‑
海藻糖。上述海藻糖可以通过化学合成、利用微生物的生产、利用酶的生产等任意已知的方法来制造,也可以使用市售品。例如,可以举出α,α
‑
海藻糖(株式会社林原公司制或fujifilm wako pure chemical corporation制)等的市售品。
[0056]
作为上述海藻糖类中的海藻糖衍生物,只要为在二糖类的海藻糖上键合有1个或多个糖单元的糖基海藻糖类即可,没有特别限定,糖基海藻糖类包括葡糖基海藻糖、麦芽糖基海藻糖、麦芽三糖基海藻糖(maltotriosyltrehalose)等。
[0057]
作为上述海藻糖类中的海藻糖、其衍生物的盐,例如可以举出盐酸盐、氢溴酸盐、氢碘酸盐、磷酸盐、硝酸盐、硫酸盐、乙酸盐、丙酸盐、甲苯磺酸盐、琥珀酸盐、草酸盐、乳酸盐、酒石酸盐、乙醇酸盐、甲磺酸盐、丁酸盐、戊酸盐、柠檬酸盐、富马酸盐、马来酸盐、苹果酸盐等酸加成盐,钠盐、钾盐、钙盐等金属盐,铵盐、烷基铵盐等。需要说明的是,上述盐在使用时制成溶液来使用,其作用优选与使用海藻糖的情况效果相同。上述盐类也可以形成水合物或溶剂合物,此外,可以单独使用任一种或适当地组合使用2种以上。
[0058]
作为本技术哺乳动物细胞保存用液中的海藻糖类的浓度,只要是基于海藻糖类的细胞生存率降低的抑制效果得以发挥的浓度即可,例如,以海藻糖换算计为0.1(w/v)%以上,优选为0.3(w/v)%以上,更优选为0.6(w/v)%以上,进一步优选为1.0(w/v)%以上,最优选为2.0(w/v)%以上。另外,从避免对细胞的不良影响的观点考虑,例如,以海藻糖换算计为40(w/v)%以下,优选为20(w/v)%以下,更优选为15(w/v)%以下,进一步优选为10%(w/v)%以下,最优选为6.0(w/v)%以下。因此,作为本技术哺乳动物细胞保存用液中的海藻糖类的浓度,例如,以海藻糖换算计在0.1~40(w/v)%的范围内,优选为0.3~20(w/v)%,更优选为0.6~15(w/v)%,进一步优选为1.0~10%(w/v)%,最优选为2.0~6.0(w/v)%。
[0059]
本技术哺乳动物细胞保存用液是为了在含哺乳动物细胞的本技术哺乳动物细胞保存用液以液体状态存在的温度条件下,将哺乳动物细胞保存任意的时间而使用的。就本技术哺乳动物细胞保存用液而言,其具有有效地抑制在液体中保存哺乳动物细胞时产生的细胞生存率降低、在液体中保存哺乳动物干细胞时产生的自复制能力降低的作用,并且本技术哺乳动物细胞保存用液是在施予至哺乳动物的生物体内时,对哺乳动物的生存状态产生不良影响的可能性低的液体。因此,本技术哺乳动物细胞保存用液进一步优选特定于“用于抑制哺乳动物细胞的生存率降低”这样的用途;“用于抑制哺乳动物细胞的自复制能力降低”这样的用途;及/或“用于移植哺乳动物细胞”这样的用途。
[0060]
本技术哺乳动物细胞保存用液可以是单独含海藻糖类的液体,也可以是包含选自海藻糖类中的2种以上的液体、除海藻糖类以外还含任意成分的液体。
[0061]
在本说明书中作为“任意成分”,例如可以举出:等渗剂(例如,葡萄糖、山梨糖醇、甘露糖醇、乳糖、氯化钠)、螯合剂(例如,edta、egta、柠檬酸、水杨酸盐)、助溶剂、保存剂、抗氧化剂、氨基酸(例如,脯氨酸、谷氨酰胺)、聚合物(例如,聚醚)、磷脂(例如,溶血磷脂酸[lpa;lysophosphatidic acid])、碳酸氢盐以外的ph调节剂(例如,氢氧化物、乙酸盐、碳酸盐等碱;柠檬酸、琥珀酸、乙酸、乳酸、冰乙酸、盐酸等酸)。在本说明书中“任意成分”是指可以包含也可以不包含的成分。
[0062]
另外,本发明中包括:包含海藻糖类的、用于制备本技术哺乳动物细胞保存用液的粉末制剂。该粉末制剂中可以含有上述的任意成分。
[0063]
作为本技术哺乳动物细胞保存用液,由于仅含有海藻糖类时也可发挥出抑制哺乳动物细胞的生存率降低的效果,因此除海藻糖类以外,也可以不含具有抑制哺乳动物细胞的生存率降低作用的成分(例如,阿卡糖、水苏糖、葡聚糖、羟乙基淀粉[hydroxyethyl starch;hes]等多糖类或其衍生物或者它们的盐;葡萄糖等单糖类或其衍生物或者它们的盐),但为了进一步提高抑制哺乳动物细胞的生存率降低的效果,优选进一步包含上述成分,具体而言,优选进一步包含多糖类或其衍生物或者它们的盐;由于在后述的本实施例中证实了其效果,因此可以优选例示出进一步包含葡聚糖或其衍生物或者它们的盐(以下,有时将它们统称为“葡聚糖类”)。
[0064]
作为上述葡聚糖类中的葡聚糖,只要是由d
‑
葡萄糖形成的多糖(c6h
10
o5)
n
、且以α1
→
6键为主链,则不受特别制限,作为葡聚糖的重均分子量(mw),例如可以举出葡聚糖40(mw=40000)、葡聚糖70(mw=70000)等。上述葡聚糖可以通过化学合成、利用微生物的生产、利用酶的生产等任意已知的方法来制造,也可以使用市售品。例如,可以举出葡聚糖40(东京化成工业公司制)、葡聚糖70(东京化成工业公司制)、低分子葡聚糖l注(含10[w/v]%葡聚糖的乳酸林格液)(otsuka pharmaceutical factory,inc.)等市售品。
[0065]
作为上述葡聚糖类中的葡聚糖衍生物,包含硫酸葡聚糖、羧基化葡聚糖、二乙基氨基乙基(deae)
‑
葡聚糖等。
[0066]
作为上述葡聚糖类中的葡聚糖、其衍生物的盐,例如可以举出:盐酸盐、氢溴酸盐、氢碘酸盐、磷酸盐、硝酸盐、硫酸盐、乙酸盐、丙酸盐、甲苯磺酸盐、琥珀酸盐、草酸盐、乳酸盐、酒石酸盐、乙醇酸盐、甲磺酸盐、丁酸盐、戊酸盐、柠檬酸盐、富马酸盐、马来酸盐、苹果酸盐等酸加成盐,钠盐、钾盐、钙盐等金属盐,铵盐、烷基铵盐等。需要说明的是,上述盐在使用时制成溶液来使用,其作用优选与使用葡聚糖的情况效果相同。上述盐类也可以形成水合物或溶剂合物,此外,可以单独使用任一种或适当地组合使用2种以上。
[0067]
作为本技术哺乳动物细胞保存用液中的葡聚糖类的浓度,只要为基于葡聚糖类的细胞生存率降低的抑制效果得以发挥的浓度即可,例如,以葡聚糖换算计为0.1(w/v)%以上,优选为0.3(w/v)%以上,更优选为0.6(w/v)%以上,进一步优选为1.0(w/v)%以上,更进一步优选为2.0(w/v)%以上,最优选为4.0(w/v)%以上。另外,从避免对细胞的不良影响的观点考虑,例如,以葡聚糖换算计为50(w/v)%以下,优选为20(w/v)%以下,更优选为15(w/v)%以下,进一步优选为12%(w/v)%以下,更进一步优选9.0%(w/v)%以下,最优选为7.0(w/v)%以下。因此,作为本技术哺乳动物细胞保存用液中的葡聚糖类的浓度,例如,以葡聚糖换算计为0.1~50(w/v)%的范围内,优选为0.3~20(w/v)%,更优选为0.6~15(w/v)%,进一步优选为1.0~12%(w/v)%,更进一步优选为2.0~9.0%(w/v)%,最优选为4.0~7.0(w/v)%。
[0068]
作为本技术哺乳动物细胞保存用液,在将含哺乳动物细胞的本技术哺乳动物细胞保存用液直接用于移植时,优选适于哺乳动物细胞移植的液体,所述适于哺乳动物细胞移植的液体优选不含不适于哺乳动物细胞移植的物质,例如生物体来源的成分(例如,血清或血清来源的成分[例如,白蛋白]);冷冻保存或冷冻干燥保存哺乳动物细胞时具有抑制哺乳动物细胞的生存率降低作用的成分,例如,二甲基亚砜[dimethyl sulfoxide;dmso]、丙三
醇、乙二醇、三亚甲基二醇、二甲基乙酰胺、聚乙二醇[peg]、聚乙烯吡咯烷酮、血清或血清来源的成分(例如,白蛋白)等冷冻保护剂或冷冻干燥保护剂。
[0069]
本发明的哺乳动物细胞的保存方法包括在含海藻糖类且ph为6.5~8.5的液体中,将哺乳动物细胞保存任意时间的工序(以下,有时称为“本技术保存方法”)。本技术保存方法通常是将含哺乳动物细胞的本技术哺乳动物细胞保存用液在该保存用液以液体状态存在的温度条件下进行保存的方法,不包括在该保存用液以固体状态存在的温度条件下进行保存的工序(例如,冷冻保存的工序、冷冻干燥保存的工序等在休眠状态下保存哺乳动物细胞的工序),另外,本技术哺乳动物细胞保存用液中的哺乳动物细胞的密度例如在103~10
10
个/ml的范围内。
[0070]
作为本技术保存方法,还可以包括:通过在含海藻糖类的液体、或添加了粉状的含海藻糖类的物质的液体中,添加作为上述ph调节剂的碳酸氢盐,而将ph调节至6.5~8.5,从而制备本技术哺乳动物细胞保存用液的工序;在本技术哺乳动物细胞保存用液中保存哺乳动物细胞之前,通过在含海藻糖类的液体(优选等渗液)中添加哺乳动物细胞,或者在含哺乳动物细胞的液体(优选等渗液)中添加海藻糖类,由此制备含海藻糖类的液体的工序。
[0071]
在本发明中,作为保存哺乳动物细胞的任意时间,在以液体状态保存含哺乳动物细胞的本技术哺乳动物细胞保存用液时,优选能够抑制该保存用液中的哺乳动物细胞的细胞生存率降低,并能够提高活细胞比例的时间,例如为6小时以上、12小时以上、1天(24小时)以上、1.5天(36小时)以上、2天(48小时)以上、3天(72小时)以上、4天(96小时)以上、7天(168小时)以上,另外,由于若哺乳动物细胞的保存时期过长则存在对细胞的生存产生不良影响的可能性,因此从避免对细胞的生存率的不良影响的观点考虑,例如为21天以下、16天以下、14天以下、10天以下、7天以下、4天以下。因此,作为上述保存时期,例如可以举出:6小时~21天;12小时~21天;1~21天;1.5~21天;2~21天;3~21天;4~21天;7~21天;6小时~16天;6小时~14天;6小时~10天;6小时~7天;6小时~4天;12小时~16天;12小时~14天;12小时~10天;12小时~7天;12小时~4天;1~16天;1~14天;1~10天;1~7天;1~4天;1.5~16天;1.5~14天;1.5~10天;1.5~7天;1.5~4天;2~16天;2~14天;2~10天;2~7天;2~4天;3~16天;3~14天;3~10天;3~7天;3~4天;4~16天;4~14天;4~10天;4~7天;7~16天;7~14天;7~10天;等等,由于在后述的本实施例中证实了其效果,因此可以优选例示出6小时~14天。针对保存在本技术哺乳动物细胞保存用液中的哺乳动物细胞,可以使用台盼蓝(trypan blue)染色法、tunel法、nexin法、flica法等能够检测出细胞死亡的已知方法来确认细胞死亡被抑制。
[0072]
在本发明中,作为“含哺乳动物细胞的本技术哺乳动物细胞保存用液以液体状态存在的温度”,只要是含哺乳动物细胞的本技术哺乳动物细胞保存用液不冷冻而以液体状态存在、并且该保存用液中的哺乳动物细胞能够增殖的温度即可,通常为0~40℃的范围内,优选为0~30℃(室温)的范围内。
[0073]
在本发明中,作为哺乳动物细胞,例如,在面向需要哺乳动物细胞移植治疗的疾病(癌症;i型糖尿病;肝疾病等内脏疾病;等等)的再生医疗中,可以例示出经由血管施予的哺乳动物细胞,具体而言,干细胞;胰岛细胞;肝细胞;树突状细胞;等等,优选为干细胞、肝细胞。上述细胞可以通过已知的一般性方法分离。例如,可以利用下述仪器进行:荧光激活细胞分选仪(facs),其使用了对应于各种细胞表面标志物的抗体;自动磁性细胞分离装置
(automacs),其使用了针对经荧光物质、生物素、亲和素等标记物质标记的上述细胞表面标志物的抗体、和针对上述标记物质的抗体与macs珠(磁性微珠)的缀合抗体。作为上述荧光物质,可以举出别藻蓝蛋白(allophycocyanin)(apc)、藻红蛋白(phycoerythrin)(pe)、fitc(fluorescein isothiocyanate,异硫氰酸荧光素)、alexa fluor 488、alexa fluor 647、alexa fluor 700、pe
‑
texas red、pe
‑
cy5、pe
‑
cy7等。
[0074]
此外,上述“干细胞”是指具有自复制能力及分化
·
增殖能力的未成熟的细胞。干细胞根据分化能力包括亚全能干细胞(pluripotent stemcell)、多能干细胞(multipotent stem cell)、单能干细胞(unipotent stemcell)等亚群。所谓亚全能干细胞,是指虽然其自身不能形成为个体、但具有能分化成构成生物体的所有组织和细胞的能力的细胞。所谓多能干细胞,是指虽不能分化成所有种类的组织和细胞,但具有能分化成多种组织和细胞的能力的细胞。所谓单能干细胞,是指具有能分化成特定的组织和细胞的能力的细胞。
[0075]
作为上述亚全能干细胞,可以举出胚性干细胞(embryonic stem cell;es细胞)、eg细胞(embryonic germ cell)、诱导亚全能干细胞(induced pluripotent stem cell;ips细胞)等。es细胞可以通过将内部细胞块于饲养细胞(feeder cell)上或含有lif的培养基中进行培养来制造。es细胞的制造方法已记载在例如wo96/22362、wo02/101057、us5、843、780、us6、200、806、us6、280、718等中。eg细胞可以通过将原始生殖细胞在含有mscf、lif及bfgf的培养基中进行培养来制造(cell,70:841
‑
847,1992)。ips细胞可以通过向体细胞(例如成纤维细胞、皮肤细胞等)中导入oct3/4、sox2及klf4(根据需要还可导入c
‑
myc或n
‑
myc)等重编程因子(reprogramming factor)来制造(cell,126:p.663
‑
676,2006;nature,448:p.313
‑
317,2007;nat biotechno1,26;p,101
‑
106,2008;cel1 131:p.861
‑
872,2007;science,318:p.1917
‑
1920,2007;cell stem cells 1:p.55
‑
70,2007;nat biotechnol,25:p.1177
‑
1181,2007;nature,448:p.318
‑
324,2007;cell stem cells 2:p.10
‑
12,2008;nature 451:p.141
‑
146,2008;science,318:p.1917
‑
1920,2007)。此外,通过对体细胞的细胞核进行核移植而制作获得的早期胚胎进行培养而建立的干细胞也优选用作为亚全能干细胞(nature,385,810(1997);science,280,1256(1998);nature biotechnology,17,456(1999);nature,394,369(1998);nature genetics,22,127(1999);proc.nat1.acad.sci.usa,96,14984(1999)、rideout iii等人(nature genetics,24,109(2000))。
[0076]
作为上述多能干细胞,可以举出能分化成脂肪细胞、骨细胞、软骨细胞、脂肪细胞等细胞的间充质干细胞,能分化成神经元、星形胶质细胞、少突胶质细胞等细胞的神经干细胞,骨髓干细胞、生殖干细胞等成体干细胞等。多能干细胞优选为间充质干细胞。所谓间充质干细胞,是指能分化为成骨细胞、成软骨细胞及成脂肪细胞中的全部或几种的干细胞。多能干细胞可以通过本身已知的方法从生物体分离得到。例如,间充质干细胞可以采用已知的一般性方法从哺乳动物的骨髓、脂肪组织、末梢血、脐带血等中采集。例如,可以通过骨髓穿刺后的造血干细胞等的培养、传代来分离人间充质干细胞(journal of autoimmunity,30(2008)163
‑
171)。多能干细胞也可以通过将上述亚全能干细胞于合适的诱导条件下进行培养来获得。
[0077]
在本发明中,作为哺乳动物,可以例示出小鼠、大鼠、仓鼠、豚鼠等啮齿类,兔等兔目,猪、牛、山羊、马、绵羊等有蹄目,狗,猫等猫目,人、猴、恒河猴、食蟹猴、狨、猩猩、黑猩猩
等灵长类等,其中,可以优选例示出小鼠、猪、人。
[0078]
在本发明中,作为哺乳动物细胞,可以例示出黏附性(也称为“粘接性”)的细胞。本说明书中,“黏附性”细胞是指可以通过粘接于支持物上来进行生存、增殖、物质生产的支持物依赖性细胞。作为黏附性干细胞,例如可以举出亚全能干细胞、间充质干细胞、神经系干细胞、骨髓干细胞、生殖干细胞等,可以优选例示出间充质干细胞。
[0079]
在本发明中,哺乳动物细胞(群)可以是从生物体内分离而得的,也可以是在体外进行传代培养而得的,优选是经分离或纯化而得的。本说明书中,所谓“分离或纯化”,是指实施了除去目标成分以外的成分的操作。经分离或纯化而得的哺乳动物细胞的纯度(相对于总细胞数而言的、哺乳动物干细胞数等目标细胞的比例)通常为30%以上,优选为50%以上,更优选为70%以上,进一步优选为90%以上(例如100%)。
[0080]
在本技术哺乳动物细胞保存用液中保存的哺乳动物细胞(群)可以为单一细胞(单个细胞)的状态。在本说明书中,所谓“单一细胞状态”,是指未与其他细胞聚集成块(即,未凝集的状态)。单一细胞状态的哺乳动物细胞可以通过用胰蛋白酶/edta等对经体外培养的哺乳动物细胞进行酶处理来制备。哺乳动物细胞中所含的单一细胞状态的哺乳动物细胞的比例例如为70%以上,优选为90%以上,更优选为95%以上,进一步优选为99%以上(例如100%)。单一细胞状态的细胞的比例可以如下确定:将哺乳动物细胞分散于pbs中,在显微镜下对其进行观察,调查随机选择的多个(例如,1000个)细胞是否有凝集。
[0081]
在本技术哺乳动物细胞保存用液中保存的哺乳动物细胞(群)可以处于游离状态。在本说明书中,所谓“游离”,是指哺乳动物细胞以不与收容有保存用液的容器内壁接触的方式被保持在液体中。
[0082]
在本技术哺乳动物细胞保存用液中保存后的哺乳动物细胞发生凝集或沉淀时,优选在移植前通过吹吸、轻拍等该技术领域中的已知方法使哺乳动物细胞悬浮。
[0083]
实施例
[0084]
以下,通过实施例对本发明进行更具体地说明,但本发明的技术范围并不限定于这些示例。需要说明的是,在以下的实施例中,为了方便,有时将含3(w/v)%海藻糖及5(w/v)%葡聚糖40的乳酸林格液称为“csp
‑
01液”,另外,为了方便,有时将含3(w/v)%海藻糖的乳酸林格液称为“csp
‑
11液”。
[0085]
i合适的ph的研究
[0086]
1.材料及方法
[0087]
[哺乳动物细胞]
[0088]
在以下实验1~4中,使用以下的表1中记载的源自人脂肪的间充质干细胞(had
‑
msc)。
[0089]
[表1]
[0090]
供体年龄、性别、来源38岁、女性、脂肪供体数1批次编号0000421627获得时的传代次数1次保存方法在液氮中保存来源lonza walkersville公司
代理商lonza japan公司
[0091]
[csp
‑
01液]
[0092]
csp
‑
01液如下制备:将α,α
‑
海藻糖(株式会社林原公司制或fujifilm wako pure chemical corporation制)和低分子葡聚糖l注(含10[w/v]%葡聚糖的乳酸林格液)(otsuka pharmaceutical factory,inc.)添加到乳酸林格液(lactec输注液;otsuka pharmaceutical factory,inc.),以使海藻糖及葡聚糖的最终浓度分别达到3(w/v)%及5(w/v)%(参见专利文献2)。
[0093]
[csp
‑
11液]
[0094]
csp
‑
11液如下制备:将α,α
‑
海藻糖(株式会社林原公司制或fujifilm wako pure chemical corporation制)添加到乳酸林格液(lactec输注液;otsuka pharmaceutical factory,inc.),以使海藻糖的最终浓度达到3(w/v)%(参见专利文献2)。csp
‑
01液及csp
‑
11液的组成示于以下的表2。
[0095]
[表2]
[0096][0097]
[had
‑
msc的培养]
[0098]
had
‑
msc按照常规方法进行培养。即,将had
‑
msc置于添加有包含源自人脂肪的干细胞添加因子套装(lonza walkersville公司制,pt
‑
4503)的adsc
‑
bm(adipose derived stem cell basal medium)(lonza walkersville公司制,pt
‑
3273)(以下,简称为“培养液”)的75cm2烧瓶,并在co2培养箱(37℃条件下)内进行传代培养。另外,每隔3天进行培养液的更换。
[0099]
[含had
‑
msc液体的制备]
[0100]
按照以下〔1〕~〔10〕的步骤制备含had
‑
msc液体。
[0101]
〔1〕将小型培养箱(personal incubator)加热至37
±
2℃。
[0102]
〔2〕将培养有had
‑
msc的75cm2烧瓶从co2培养箱中取出。
[0103]
〔3〕在倒置显微镜下观察细胞状态,使用约80%汇合的细胞。
[0104]
〔4〕吸移培养液,向各75cm2烧瓶中分别添加8ml pbs(
‑
)。
[0105]
〔5〕吸移pbs(
‑
)后,向烧瓶中分别添加4ml胰蛋白酶/edta(cc
‑
5012,lonza walkersville公司制),在小型培养箱中于37
±
2℃条件下孵育5分钟。
[0106]
〔6〕一边在倒置显微镜下观察,一边缓慢地摇动,直至90%左右的细胞剥离。
[0107]
〔7〕为了终止胰蛋白酶反应,分别加入8ml胰蛋白酶中和液(tns;cc
‑
5002、lonza walkersville公司制),利用吹吸将细胞剥离并转移至50ml的离心管。
[0108]
〔8〕离心处理(210
×
g,5分钟,20℃)后,除去上清液,添加一定量(每75cm2烧瓶各
1.5ml)的pbs(
‑
),使细胞悬浮。
[0109]
〔9〕从细胞悬浮液中分取一部分(20μl),与20μl的台盼蓝染色液(gibco公司制)混合,并用one cell计数盘(细胞计数盘;bio medical science inc.制)计测总细胞数(活细胞数及死细胞数)。需要说明的是,将处于one cell计数盘中的9个区域中的4个角的区域内的细胞计测为细胞数,以后的计测也同样地进行。
[0110]
〔10〕添加pbs(
‑
),以使总细胞数为5.0
×
105细胞/ml,进行冰冷而制备含哺乳动物细胞的液体。
[0111]
[细胞生存率及活细胞回收率的测定]
[0112]
按照以下〔1〕~〔4〕的步骤测定在受试液中保存哺乳动物细胞时的细胞生存率及活细胞回收率。
[0113]
〔1〕使用finnpipette移液器(100
‑
1000μl)将制备的含哺乳动物细胞的液体以1ml分别分注至15ml透明聚丙烯离心管中,离心处理(210
×
g,5分钟,25℃),然后进行冰冷。
[0114]
〔2〕除去上清液,使用finnpipette移液器(100
‑
1000μl),将细胞悬浮于1ml的各受试液中,然后将其一部分(20μl)分取至预先添加了台盼蓝染色液(gibco公司制)20μl的1.5ml微量离心管(microtube)。将与台盼蓝染色液混和而成的细胞悬浮液分取至one cell计数盘中,使用光学显微镜(eclipse ts100,nikon公司制)测量总细胞数及台盼蓝阳性细胞(死细胞)数,由此算出保存刚开始之后的细胞生存率。
[0115]
〔3〕残留的细胞悬浮液在药用冷藏陈列柜(设定为5℃)静置保存至各保存时期。
[0116]
〔4〕在经过各保存时期的时刻,将吸头的前端插入至目视距加入了含细胞的液体的管的底部5mm左右的位置,缓慢地搅拌(以500μl液量吹吸5次),由此在细胞悬浮的状态下将其一部分(20μl)采集至1.5ml微量离心管,与台盼蓝染色液(gibco公司制)20μl混和后分取至one cell计数盘,并使用光学显微镜(eclipse ts100,nikon公司制)测量总细胞数及台盼蓝阳性细胞(死细胞)数,由此算出各保存时期中的细胞生存率及活细胞回收率。需要说明的是,细胞生存率使用式“(总活细胞数/总细胞数)
×
100=([总细胞数
‑
死细胞数]/总细胞数)
×
100=细胞生存率(%)”而算出,另外,活细胞回收率使用式“(各保存时期的总活细胞数/保存刚开始之后的总活细胞数)
×
100=([各保存时期的总细胞数
‑
各保存时期的死细胞数]/[保存刚开始之后的总细胞数
‑
保存刚开始之后的死细胞数])
×
100=活细胞回收率(%)”而算出。
[0117]
[cfu测定法]
[0118]
按照以下〔1〕~〔4〕的步骤测定将哺乳动物间充质干细胞保存在受试液中时的群落形成能力。
[0119]
〔1〕使用finnpipette移液器(100
‑
1000μl)将制备的含哺乳动物细胞的液体以1ml分别分注至15ml透明聚丙烯离心管中,离心处理(210
×
g,5分钟,25℃),然后进行冰冷。
[0120]
〔2〕除去上清液,使用finnpipette移液器(100
‑
1000μl),将细胞悬浮于1ml的各受试液,然后将其一部分(20μl)在60mm盘(面积为21cm2)上、以成为15细胞/cm2的方式进行接种,在约8天后测定所形成的群落数,并算出在保存刚开始之后的群落形成单位(cfu)、即群落数与接种的细胞数的比率。
[0121]
〔3〕残留的细胞悬浮液在药用冷藏陈列柜(设定为5℃)中静置保存至各保存时期。
[0122]
〔4〕在经过了各保存时期的时刻,将吸头的前端插入至目视距加入了含细胞的液
体的管的底部5mm左右的位置、缓慢地搅拌(以500μl液量吹吸5次),由此在细胞悬浮的状态下,在60mm盘(面积为21cm2)上以成为15细胞/cm2的方式进行接种,在约8天后测定所形成的群落数,并算出保存刚开始之后的cfu。
[0123]
2.结果
[0124]
[实验1]
[0125]
对在以下的表3中所示的6种受试液中将had
‑
msc保存了各保存时期(1天、2天、4天、7天、及14天)时的细胞生存率(参见表4及图1的a)及活细胞回收率(参见表5及图1的b),按照上述[细胞生存率及活细胞回收率的测定]的项目中记载的方法进行测定。
[0126]
[表3]
[0127] 受试液ph调节剂(添加量[g/l])比较例1乳酸林格
‑
比较例2csp
‑
01液(ph5.65)盐酸(0.0350)比较例3csp
‑
01液(ph6.15)
‑
实施例1csp
‑
01液(ph6.60)碳酸氢钠(0.0125)实施例2csp
‑
01液(ph6.95)碳酸氢钠(0.0250)实施例3csp
‑
01液(ph7.29)碳酸氢钠(0.0350)
[0128]
结果,在比较例1(乳酸林格)及比较例2(csp
‑
01液[ph5.65])中,细胞保存开始后第2天的细胞生存率均降低至约65%,在第4天均降低至30%以下(参见表4及图1的a)。另一方面,在实施例1~3(csp
‑
01液[ph6.60~7.29])中,在细胞保存开始后第2天,细胞生存率均超过96%,在第4天均超过了70%(参见表4及图1的a)。另外,若在实施例1~3之间比较在细胞保存开始后第4天以后的细胞生存率,则实施例2(csp
‑
01液[ph6.95])比实施例1(csp
‑
01液[ph6.60])高,另外实施例3(csp
‑
01液[ph7.29])比实施例2(csp
‑
01液[ph6.95])高(参见表4及图1的a)。另外,认识到针对活细胞回收率也有同样的倾向(参见表5及图1的b)。
[0129]
该结果显示,若将csp
‑
01液、即含海藻糖及葡聚糖的乳酸林格液的ph调节至约6.6以上(优选为约7.29左右),并将哺乳动物细胞保存在该液体中,则与将哺乳动物细胞保存在不含海藻糖及葡聚糖的乳酸林格液、含海藻糖及葡聚糖且ph为6.15以下的乳酸林格液时相比,能够有效地抑制细胞死亡,并能够提高活细胞的比例。
[0130]
[表4]
[0131][0132]
表中的数值表示细胞生存率(平均值
±
标准偏差[sd];n=3)。
[0133]
[表5]
[0134][0135]
表中的数值表示活细胞回收率(平均值
±
标准偏差[sd];n=3)。
[0136]
[实验2]
[0137]
对在以下的表6中所示的4种受试液中将had
‑
msc保存了各保存时期(6小时、24小时、48小时、及96小时)时的细胞生存率(参见表7)及活细胞回收率(参见表8),按照上述[细胞生存率及活细胞回收率的测定]的项目中记载的方法进行测定。
[0138]
[表6]
[0139] 受试液ph调节剂(添加量[g/l])实施例4csp
‑
01液(ph7.29)碳酸氢钠(0.0350)比较例4csp
‑
01液(ph6.16)
‑
实施例5csp
‑
11液(ph7.04)碳酸氢钠(0.0150)比较例5csp
‑
11液(ph6.35)
‑
[0140]
结果,在比较例4(csp
‑
01液[ph6.16])中,细胞保存开始后第48小时(2天),细胞生存率降低至约50%,在第96小时(4天),降低至37%(参见表7)。另一方面,在实施例4(csp
‑
01液[ph7.29])中,细胞保存开始后第48小时(2天),细胞生存率超过90%,在第96小时(4天)超过70%(参见表7)。另外,认识到针对活细胞回收率也有同样的倾向(参见表8)。
[0141]
另外,在比较例5(csp
‑
11液[ph6.35])中,细胞保存开始后第48小时(2天)的细胞生存率降低至约45%,在第96小时(4天)降低至约15%(参见表7)。另一方面,在实施例5(csp
‑
11液[ph7.04])中,细胞保存开始后第48小时(2天),细胞生存率超过75%,在第96小时(4天)超过45%(参见表7)。另外,认识到针对活细胞回收率也有同样的倾向(参见表8)。
[0142]
上述结果支持上述[实验1]的结果,并且显示出针对csp
‑
11液、即(不含葡聚糖的)含海藻糖的乳酸林格液也同样地将ph调节至约7.04以上,并且将哺乳动物细胞保存在该液体中时,与将哺乳动物细胞保存在含海藻糖且ph为6.35以下的乳酸林格液的情况相比,能够有效地抑制细胞死亡,并能够提高活细胞的比例。
[0143]
[表7]
[0144][0145]
表中的数值表示细胞生存率(平均值
±
标准偏差[sd];n=4)。实施例4中的“*”及
“
***”表示与相同保存时期的比较例4之间,分别存在统计学上的显著差异(p<0.05及p<0.001)。另外,实施例5中的“*”及“***”表示与相同保存时期的比较例5之间,分别存在统计学上的显著差异(p<0.05及p<0.001)。
[0146]
[表8]
[0147][0148]
表中的数值表示活细胞回收率(平均值
±
标准偏差[sd];n=4)。实施例4中的“*”及“***”表示与相同保存时期的比较例4之间,分别存在统计学上的显著差异(p<0.05及p<0.001)。另外,实施例5中的“*”及“***”表示与相同保存时期的比较例5之间,分别存在统计学上的显著差异(p<0.05及p<0.001)。
[0149]
[实验3]
[0150]
对在以下的表9所示的11种受试液中将had
‑
msc保存了各保存时期(24小时、48小时、96小时、及168小时)时的细胞生存率(参见表10及12)及活细胞回收率(参见表11及13),按照上述[细胞生存率及活细胞回收率的测定]的项目中记载的方法进行测定。
[0151]
[表9]
[0152] 受试液ph调节剂(添加量[g/l])比较例6乳酸林格
‑
实施例6csp
‑
01液(ph6.69)碳酸氢钠(0.0125)实施例7csp
‑
01液(ph7.03)碳酸氢钠(0.0250)实施例8csp
‑
01液(ph7.35)碳酸氢钠(0.0350)实施例9csp
‑
01液(ph7.68)碳酸氢钠(0.100)实施例10csp
‑
01液(ph8.02)碳酸氢钠(0.300)比较例7csp
‑
11液(ph6.44)
‑
实施例11csp
‑
11液(ph7.04)碳酸氢钠(0.0100)实施例12csp
‑
11液(ph7.16)碳酸氢钠(0.0150)实施例13csp
‑
11液(ph7.69)碳酸氢钠(0.0500)实施例14csp
‑
11液(ph8.00)碳酸氢钠(0.100)
[0153]
结果,与比较例6(乳酸林格)相比,实施例6~10(csp
‑
01液[ph6.69~8.02])在任意的保存时期下,细胞生存率及活细胞回收率均提高,特别是实施例8(csp
‑
01液[ph7.35])及实施例9(csp
‑
01液[ph7.68])的细胞生存率及活细胞回收率有最高的倾向(参见表10和11、以及图2)。
[0154]
该结果支持上述[实验1]及[实验2]的结果,并且显示出将csp
‑
01液、即含海藻糖及葡聚糖的乳酸林格液的ph调节至6.69以上,并且将哺乳动物细胞保存在该液体中时,与将哺乳动物细胞保存在乳酸林格液的情况相比,能够有效地抑制细胞死亡,并能够提高活细胞的比例。
[0155]
另外,与比较例6(乳酸林格)、比较例7(csp
‑
11液[ph6.44])相比,实施例11~14(csp
‑
11液[ph7.04~8.00])在任意的保存时期下,细胞生存率及活细胞回收率均较高,特别是实施例12~14(csp
‑
11液[ph7.16~8.00])的细胞生存率及活细胞回收率有最高的倾向(参见表12和13、以及图3)。
[0156]
该结果支持上述[实验2]的结果,并且显示出将csp
‑
11液、即(不含葡聚糖的)含海藻糖的乳酸林格液的ph调节至7.04以上,并且将哺乳动物细胞保存在该液体中时,与将哺乳动物细胞保存在不含海藻糖的乳酸林格液、含海藻糖且ph为6.44以下的乳酸林格液的情况相比,能够有效地抑制细胞死亡,并能够提高活细胞的比例。
[0157]
[表10]
[0158][0159]
表中的数值表示细胞生存率(平均值
±
标准偏差[sd];n=3)。
[0160]
[表11]
[0161][0162]
表中的数值表示活细胞回收率(平均值
±
标准偏差[sd];n=3)。
[0163]
[表12]
[0164][0165]
表中的数值表示细胞生存率(平均值
±
标准偏差[sd];n=3)。
[0166]
[表13]
[0167][0168]
表中的数值表示活细胞回收率(平均值
±
标准偏差[sd];n=3)。
[0169]
[实验4]
[0170]
对在以下的表14中所示的4种受试液中将had
‑
msc保存了各保存时期(6小时、24小时、及48小时)时的群落形成能力(参照表15),按照上述[cfu测定法]的项目中记载的方法进行测定。
[0171]
[表14]
[0172] 受试液ph调节剂(添加量[g/l])实施例15csp
‑
01液(ph7.29)碳酸氢钠(0.0350)比较例8csp
‑
01液(ph6.16)
‑
实施例16csp
‑
11液(ph7.04)碳酸氢钠(0.0150)比较例9csp
‑
11液(ph6.35)
‑
[0173]
结果,在比较例8(csp
‑
01液[ph6.16])中,had
‑
msc的群落形成能力随着保存时期变长而降低,与此相对,在实施例15(csp
‑
01液[ph7.29])中上述群落形成能力的降低得到抑制(参见表15)。
[0174]
结果显示,将csp
‑
01液、即含海藻糖及葡聚糖的乳酸林格液的ph调节至7.29左右,并将哺乳动物间充质干细胞保存在该液体中时,与将哺乳动物间充质干细胞保存在含海藻糖及葡聚糖且ph为6.16左右的乳酸林格液的情况相比,能够抑制群落形成能力的降低。
[0175]
另外,在比较例9(csp
‑
11液[ph6.35])中,had
‑
msc的群落形成能力随着保存时期变长而降低,与此相对,在实施例16(csp
‑
11液[ph7.04])中,上述群落形成能力的降低得到抑制(参见表15)。
[0176]
结果显示,将csp
‑
11液、即(不含葡聚糖的)含海藻糖的乳酸林格液的ph调节至7.04左右,并且将哺乳动物干细胞保存在该液体中时,与将哺乳动物干细胞保存在含海藻糖且ph为6.35左右的乳酸林格液的情况相比,能够抑制群落形成能力(即,自复制能力)的降低。
[0177]
[表15]
[0178][0179]
表中的数值表示相对于接种的细胞数而言的群落数的比率(平均值
±
标准偏差[sd];n=4)。实施例15中的“**”及“***”表示与相同保存时期的比较例8之间,分别存在统计学上的显著差异(p<0.01及p<0.001)。另外,实施例16中的“*”表示与相同保存时期的比较例9之间,存在统计学上的显著差异(p<0.05)。
[0180]
ii ph调节剂的研究
[0181]
1.材料及方法
[0182]
[哺乳动物细胞]
[0183]
以下实验中,使用以下的表16中记载的人骨髓来源的间充质干细胞(hbm
‑
msc)。
[0184]
[表16]
[0185][0186]
[试验液的制备]
[0187]
就csp
‑
01液而言,与实施例1同样地,将α,α
‑
海藻糖(株式会社林原公司制或fujifilm wako pure chemical corporation制)和低分子葡聚糖l注(含10[w/v]%葡聚糖的乳酸林格液)(otsuka pharmaceutical factory,inc.)添加到乳酸林格液(lactec输注液;otsuka pharmaceutical factory,inc.),以使海藻糖及葡聚糖的最终浓度分别达到3(w/v)%及5(w/v)%,从而得到csp
‑
01液(5.6未调节)。以ph成为7.300的方式添加0.5mol/l的氢氧化钠溶液,从而得到csp
‑
01液(7.3naoh)。添加碳酸氢钠溶液作为ph调节剂,从而制备csp
‑
01液(7.2nahco3)。csp
‑
01液(7.2nahco3)的ph为7.158。需要说明的是,各受试液中的ph是在室温(21.2~24.0℃)进行测定时的值。
[0188]
[含hbm
‑
msc的乳酸林格液的制备]
[0189]
含hbm
‑
msc的乳酸林格液按照以下的步骤〔1〕~〔8〕进行制备。
[0190]
〔1〕将4
×
105个hbm
‑
msc加入75cm2烧瓶,在人间充质干细胞专用培养基试剂盒(lonza公司制)(以下,称为“msc培养基”)存在下,于37℃、5%co2培养箱中进行培养。在显微镜下观察细胞状态,培养至汇合达到约80%左右。
[0191]
〔2〕除去msc培养基,以10ml的pbs(
‑
)来漂洗hbm
‑
msc。
[0192]
〔3〕除去pbs(
‑
),加入4ml的胰蛋白酶
‑
edta(cc
‑
3232、lonza公司制),并于室温静置5分钟。
[0193]
〔4〕一边在显微镜下观察一边缓慢地摇动,直至90%左右的hbm
‑
msc剥离。
[0194]
〔5〕加入5ml的msc培养基,使胰蛋白酶反应终止,通过吹吸回收hbm
‑
msc,移至50ml离心管中。
[0195]
〔6〕在600
×
g,5分钟,室温进行离心分离。
[0196]
〔7〕除去上清液(msc培养基),加入9ml的乳酸林格液,使沉淀(hbm
‑
msc)悬浮。
[0197]
〔8〕测量细胞数,以成为5
×
105个细胞/ml的方式利用乳酸林格液进行调节,制备含hbm
‑
msc的乳酸林格液。
[0198]
[在各种受试用等渗液中的hbm
‑
msc的保存方法]
[0199]
在各种受试用等渗液中的hbm
‑
msc的保存按照以下步骤〔1〕~〔2〕进行。
[0200]
〔1〕将制备的含hbm
‑
msc的乳酸林格液以0.5ml分别分注至各管,进行离心分离(600
×
g,5分钟)。
[0201]
〔2〕除去上清液(乳酸林格液),将沉淀(hbm
‑
msc)用0.5ml的各种受试用等渗液悬浮,于5℃保存3天。
[0202]
[利用台盼蓝染色法的hbm
‑
msc细胞生存率的解析]
[0203]
利用台盼蓝染色法的hbm
‑
msc细胞生存率的解析按照以下步骤〔1〕~〔2〕进行。
[0204]
〔1〕从在5℃保存3天后的含hbm
‑
msc的各种受试用等渗液的各自中采集20μl,移至管中,然后混合台盼蓝染色液(gibco公司制)20μl。需要说明的是,作为比较对照,从在悬浮于各种受试用等渗液之前(于5℃保存前)的含hbm
‑
msc的乳酸林格液的各自采集20μl,移至管中,然后混合台盼蓝染色液20μl。
[0205]
〔2〕通过在显微镜下使用one cell计数盘(bio medical science inc.制)而进行总细胞数与台盼蓝阳性细胞(死细胞)数的测定,算出相对于总细胞数而言的台盼蓝阴性细胞的比例、即细胞生存率。使用以下的式1来算出细胞生存率(%)。
[0206]
[式1]
[0207]
细胞生存率(%)=(总细胞数
‑
死细胞数)/总细胞数
×
100
[0208]
2.结果
[0209]
[实验]
[0210]
按照上述[细胞生存率的测定]的项目中记载的方法来测定将hbm
‑
msc在以下的表17中所示的3种受试中,于5℃保存3天时的细胞生存率(图4参照)。将结果示于表18及图4。
[0211]
[表17]
[0212]
供体年龄、性别、由来31岁、男性、骨髓供体数1批次编号0000527428获得时的传代次数2次保存方法在液氮中保存来源lonza walkersville公司代理商片山化学工业株式会社
[0213]
[表18]
[0214]
组(n=4)ph(实测值)温度(℃)csp
‑
01(5.6未调节)5.59923.7csp
‑
01(7.3naoh)7.30024.0csp
‑
01(7.2nahco3)7.15821.2
[0215]
结果,将hbm
‑
msc于5℃保存3天时,与保存于csp
‑
01(5.6未调节)的情况相比,在保存于csp
‑
01(7.3naoh)的情况下细胞生存率显著地降低。但是,保存于csp
‑
01(7.2nahco3)与保存于csp
‑
01(5.6未调节)及csp
‑
01(7.3naoh)的情况相比,细胞生存率显示出高值倾向。
[0216]
上述结果显示,将csp
‑
01的ph调节至7.2~7.3时,由ph调节剂对细胞生存率带来影响,并显示与氢氧化钠相比,使用碳酸氢钠时能够将细胞生存率维持在高水平。
[0217]
产业上的可利用性
[0218]
根据本发明,通过在液体中添加海藻糖类,能够有效地抑制在液体中保存哺乳动物细胞时产生的细胞生存率降低、在液体中保存哺乳动物干细胞时产生的自复制能力降低。此外,由于海藻糖类是在施予至哺乳动物的生物体内时,对哺乳动物的生存状态产生不良影响的可能性低的二糖类,因此将哺乳动物细胞保存在本技术哺乳动物细胞保存用液中后,可以不置换为新的移植用液,而直接向哺乳动物的生物体内施予。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1