具有增强的生物活性的多聚体寡核苷酸的皮下递送的制作方法
具有增强的生物活性的多聚体寡核苷酸的皮下递送
1.相关申请信息
2.本技术要求于2019年7月30日提交的美国临时专利申请号62/880,591的优先权,在此通过引用将其整体并入本文。
技术领域
3.本公开涉及当多聚体寡核苷酸经由皮下施用递送时在受试者中具有增加的生物活性的多聚体寡核苷酸。
背景技术:
4.寡核苷酸现在是得到确认的治疗物类别,其具有多种应用(例如,rna干扰或rnai)和正在进行的临床试验。然而,许多因素仍然限制寡核苷酸治疗物,例如将寡核苷酸递送至靶细胞以及随后将足够量的寡核苷酸内化到靶细胞中以实现期望的治疗效果。
5.为了解决这些递送和内化限制,多方已经调查了脂质纳米颗粒(lnp,例如脂质球体,包含带正电荷的脂质以中和寡核苷酸的负电荷并促进靶细胞结合和内化)。虽然lnp在某些情况下可以促进递送和内化,但它们存在主要缺点,例如靶向性差和毒性,导致治疗窗口变窄。
6.还调查了与靶向特定细胞表面受体的配体缀合的寡核苷酸。使用一种此类的配体n-乙酰半乳糖胺(galnac)已成为将寡核苷酸递送至肝细胞的选择方法。然而,虽然galnac缀合物的毒理学概况(profile)可优于lnp,但递送效率不一样有效。这种限制需要增加剂量,通常增加一个数量级或更多。由于毒性、副作用和/或成本,增加的剂量可能是不合需要的。
7.尽管如此,与lnp相比,配体缀合的寡核苷酸治疗物具有一些主要优势,因为它们可以通过皮下(sc)施用来递送。与静脉内(iv)注射相比,实行sc施用更简单且成本更低,并且可以由患者自己实行。其次,sc施用本质上是缓释系统,因为活性寡核苷酸需要时间渗透组织并到达血流。这种效应通过使受体能够内化第一个“货物”,然后再循环第二轮来显著增加目标受体的摄取。这些效应已经使得使用三触角型galnac配体靶向肝脏中肝细胞的寡核苷酸成为靶向这些细胞类型的选择方法。
8.尽管有这些优势,但galnac定向的寡核苷酸的sc施用仍然导致只有大约20%的施用的寡核苷酸被靶肝细胞吸收,因为它们足够小而容易地经由肾滤过和排泄。
9.为了使寡核苷酸经由肾的排泄最小化,一种方法是使分子中硫代磷酸酯核苷酸间连接的数量最大化。最初引入硫代磷酸酯基团是为了降低核酸酶的切割,但发现它会促进与蛋白质的结合。因为硫代磷酸酯寡核苷酸对蛋白质的亲和力是长度依赖性的,但很大程度上与序列无关(stein ca,et al.biochemistry.1993;32:4855
–
4861),所以含有大部分此类基团的寡核苷酸与血液中循环的蛋白质结合,从而增加寡核苷酸的有效分子大小并降低经由肾的排泄率。然而,使用大量硫代磷酸酯基团具有许多缺点。例如,适当长度的硫代磷酸酯寡核苷酸可以阻断生物学相关蛋白质与其天然受体的结合,从而导致毒副作用
(stein,ca.j clin invest.2001sep 1;108(5):641
–
644)。因此,促进蛋白质结合是高水平硫代磷酸化的优点,同时也是主要缺点。当硫代磷酸应用于sirna时,还观察到毒性增加和基因沉默降低(lam et al.,mol ther nucleic acids,2015,4(9):e252;chiu et al.,rna,2003,9:1034
–
1048;amarzguioui et al.,nucleic acids res,2003,31:589
–
595;choung et al.,biochem biophys res commun,2006,342:919
–
927)。因此,使用高水平的硫代磷酸酯基团来最大限度地降低寡核苷酸经由肾滤过的损失不适用于sirna和类似的双链分子,如mirna,并且仅限于反义寡核苷酸的子集。
10.另一种方法是制备多聚体形式的寡核苷酸(“多聚体”或“多聚体寡核苷酸”),其中一种或多种类型的寡核苷酸与可切割的接头连接在一起,并制成足够大以降低通过肾的清除。发现六种或更多种sirna的多聚体(即六聚体、七聚体等)在血清中具有最长的半衰期,而异六聚体在经由iv施用时具有高活性。
11.因此,需要增加通过sc施用递送的所有类型的寡核苷酸治疗物的生物活性的方法。
12.发明概述
13.本公开涉及组合物和方法,以(1)增加通过皮下(sc)施用递送的寡核苷酸试剂在受试者中的生物活性,和/或(2)降低通过sc施用递送至受试者的寡核苷酸试剂从sc组织释放到血液循环系统中的速率。
14.本公开进一步提供了用于增加通过sc施用递送的寡核苷酸试剂在受试者中的生物活性的组合物和相关方法,其中生物活性的增加由三种单独的协同效应产生,即i)来自sc组织中降低的试剂释放速率;ii)经由肾,来自血清中降低的试剂排泄速率;iii)每个内化事件增加的试剂吸收。
15.本公开适用于所有类型的寡核苷酸试剂,双链和单链,包含例如sirna、sarna、mirna、适体和反义寡核苷酸。
16.本公开提供了由经由共价接头连接在一起的两个或更多个寡核苷酸试剂(即,“亚基”;每个单个的是“亚基”)组成的多聚体寡核苷酸(“多聚体”),其中所述亚基可以是相同亚基或不同亚基的多个拷贝,并且其中当以单体形式施用时,多聚体中至少一个亚基的生物活性相对于该亚基的活性增加。在另实施方案中,多聚体中所有亚基的生物活性相对于它们各自的一种或多种单体形式的活性增加。在实施方案中,多聚体中一个或多个亚基的生物活性的增加与多聚体中的任何硫代磷酸酯含量无关。在其他实施方案中,多聚体可以总共含有三个、四个或五个亚基,或者可以总共含有六个或更多个亚基,或者可以具有至少约45千道尔顿(kd)的分子量,或者可以具有在约45-60kd范围内的分子量。
17.根据本公开的多聚体的改善的和有利的特性可以用增加的体内生物活性来描述。,多聚体中至少一个亚基的体内生物活性与其相应的单体相比的相对增加可以在大于或等于2-10倍的范围内;例如,相对增加可以是相应单体的2、5、10或更多倍。
18.本公开还涉及新合成的中间物和使用合成的中间物合成多聚体寡核苷酸的方法。本公开还涉及使用多聚体寡核苷酸的方法,例如用于降低基因表达、生物学研究、治疗或预防医学病况和/或产生新的或改变的表型。
19.在一个方面,本公开提供了包含亚基的多聚体寡核苷酸,其中:亚基中的每个包含单链或双链寡核苷酸,并且其中亚基中的每个通过共价接头
●
连接到
另一个亚基;多聚体寡核苷酸具有配置为相对于以单体形式施用时相同亚基的体内活性增加的多聚体寡核苷酸内的一个或多个亚基的体内活性的分子量和/或大小;多聚体寡核苷酸包含两个亚基至五个亚基;多聚体寡核苷酸被配制用于皮下施用。
20.在实施方案中,多聚体寡核苷酸具有配置为降低其由于肾小球滤过引起的清除的分子量和/或大小。
21.在实施方案中,多聚体寡核苷酸的分子量为至少约45kd,或多聚体寡核苷酸的分子量在约45-60kd的范围内。
22.在实施方案中,多聚体寡核苷酸内一个或多个亚基的活性增加不依赖于多聚体寡核苷酸中的硫代磷酸酯含量。
23.在实施方案中,多聚体寡核苷酸包含两个亚基、三个亚基、四个亚基或五个亚基。
24.在实施方案中,至少两个亚基是基本不同的。在实施方案中,所有的亚基是基本不同的。
25.在实施方案中,至少两个亚基是基本相同或同一的。在实施方案中,所有亚基是基本相同或同一的。
26.在实施方案中,亚基中的每个的长度独立地为10-30、17-27、19-26或20-25个核苷酸。
27.在实施方案中,一个或多个亚基是双链的。在实施方案中,一个或多个亚基是单链的。
28.在实施方案中,亚基包含单链和双链寡核苷酸的组合。
29.在实施方案中,寡核苷酸中的一个或多个核苷酸是rna、dna或人工或非天然核酸类似物。
30.在实施方案中,至少一个亚基包含rna。
31.在实施方案中,至少一个亚基包含sirna、sarna或mirna。
32.在实施方案中,至少一个亚基包含sirna。
33.在实施方案中,至少一个亚基包含mirna。
34.在实施方案中,至少一个亚基包含sarna。
35.在实施方案中,至少一个亚基包含反义寡核苷酸。
36.在实施方案中,至少一个亚基包含双链sirna。
37.在实施方案中,两个或多个sirna亚基通过附接到sirna有义链上的共价接头连接起来。
38.在实施方案中,两个或多个sirna亚基通过附接到sirna反义链上的共价接头连接起来。
39.在实施方案中,两个或多个sirna亚基通过附接到第一sirna的有义链和第二sirna的反义链上的共价接头连接起来。
40.在实施方案中,一个或多个共价接头
●
包含可切割的共价接头。
41.在实施方案中,可切割的共价接头包含酸可切割键、还原剂可切割键、生物可切割键或酶可切割键。
42.在实施方案中,可切割的共价接头在细胞内条件下是可切割的。
43.在实施方案中,至少一个共价接头包含二硫键或式(i)的化合物:
其中:s通过共价键或通过接头连接到亚基的3'或5'端;每个r1独立地为c
2-c
10
烷基、烷氧基或芳基基团;r2是硫代丙酸酯基或二硫基团;并且每个x选自
44.在实施方案中,式(i)化合物包含并且其中s通过共价键或通过接头连接到亚基的3'或5'端。
45.在实施方案中,式(i)化合物包含
46.并且其中s通过共价键或通过接头连接到亚基的3'或5端。
47.在实施方案中,式(i)化合物包含
48.并且其中s通过共价键或通过接头连接到亚基的3'或5'端。
49.在实施方案中,式(i)的共价接头由式(ii)的共价连接前体形成:
50.其中:每个r1独立地为c
2-c
10
烷基、烷氧基或芳基基团;r2是硫代丙酸酯基或二硫基团。
51.在实施方案中,一个或多个共价接头
●
包含核苷酸接头。在实施方案中,核苷酸接头包含2-6个核苷酸。在实施方案中,核苷酸接头包含二核苷酸接头。在实施方案中,核苷酸接头包含四核苷酸接头。
52.在实施方案中,每个共价接头
●
是相同的。
53.在实施方案中,共价接头
●
包含两个或更多个不同的共价接头。
54.在实施方案中,至少两个亚基在第一亚基的3'末端和第二亚基的3'末端之间通过共价接头
●
连接。
55.在实施方案中,至少两个亚基在第一亚基的3'末端和第二亚基的5'末端之间通过共价接头
●
连接。
56.在实施方案中,至少两个亚基在第一亚基的5'末端和第二亚基的3'末端之间通过共价接头
●
连接。
57.在实施方案中,至少两个亚基在第一亚基的5'末端和第二亚基的5'末端之间通过共价接头
●
连接。
58.在实施方案中,多聚体寡核苷酸进一步包含一个或多个靶向配体。在实施方案中,至少一个亚基是靶向配体。在实施方案中,靶向配体是适体。
59.在实施方案中,多聚体寡核苷酸的末端与靶向配体共价结合。在实施方案中,内部亚基与靶向配体共价结合。在实施方案中,多聚体寡核苷酸的至少一端与靶向配体共价结合,并且多聚体寡核苷酸的至少一个内部亚基与靶向配体共价结合。在实施方案中,多聚体寡核苷酸的每端分别与靶向配体共价结合,并且多聚体寡核苷酸的每个内部亚基分别与靶向配体共价结合。
60.在实施方案中,靶向配体是蛋白质、抗原结合蛋白、肽、氨基酸、核酸(包含例如dna、rna和人工或非天然核酸类似物)、适体、脂质、磷脂、碳水化合物、多糖、n-乙酰半乳糖胺(galnac)、甘露糖、其他甘露糖受体结合配体、叶酸、其他叶酸受体结合配体、免疫刺激剂、其他有机化合物和/或无机化学化合物。
61.在实施方案中,靶向配体包含n-乙酰半乳糖胺(galnac)。
62.在实施方案中,靶向配体是肽,并且肽是aprpg、cngr(cngrcvsgcagrc)、f3(kdepqrrsarlsakpappkpepkpkkapakk)、cgkrk和/或irgd(crgdkgpdc)。
63.在实施方案中,靶向配体是抗原结合蛋白,并且抗原结合蛋白是scfv或vhh。
64.在实施方案中,亚基和/或靶向配体是免疫刺激剂,并且免疫刺激剂包含cpg寡核苷酸。
65.在实施方案中,cpg寡核苷酸包含序列tcgtcgttttgtcgttttgtcgtt(seq id no:162)。
66.在实施方案中,cpg寡核苷酸包含序列ggtgcatcgatgcaggggg(seq id no:163)。
67.在实施方案中,多聚体寡核苷酸至少为75%、80%、85%、90%、95%、96%、97%、98%、99%或100%纯。
68.在实施方案中,至少一个亚基包含与转甲状腺素蛋白(ttr)mrna互补的寡核苷酸。
69.在实施方案中,每个亚基包含与ttr mrna互补的寡核苷酸。
70.在实施方案中,与ttr mrna互补的亚基包含相对于与ttr mrna互补的单体寡核苷酸增加的体内活性。
71.在实施方案中,与ttr mrna互补的亚基包含相对于与ttr mrna互补的六聚体或更大的寡核苷酸增加的体内活性。
72.在实施方案中,与ttr mrna互补的寡核苷酸包含uuauagagcaagaacacuguuuu(seq id no:164)。
73.在实施方案中,多聚体寡体核苷酸通过皮下注射在体内施用,并且具有配置为相对于以单体形式皮下施用时相同亚基的体内活性增加的多聚体寡核苷酸内的一个或多个亚基的体内活性的分子量和/或大小。
74.在实施方案中,相对于以单体形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少2倍增加。
75.在实施方案中,相对于以单体形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少5倍增加。
76.在实施方案中,相对于以单体形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少10倍增加。
77.在实施方案中,相对于以六聚体形式或更大形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少2倍增加。
78.在实施方案中,多聚体寡核苷酸进一步包含一个或多个内体逃逸部分。
79.在另一个方面,本公开提供了包含亚基的多聚体寡核苷酸,其中:亚基中的每个包含单链或双链寡核苷酸,并且其中亚基中的每个通过共价接头
●
与另一个亚基连接;多聚体寡核苷酸具有配置为相对于以单体形式施用时相同亚基的体内活性增加的多聚体寡核苷酸内的一个或多个亚基的体内活性的分子量和/或大小;多聚体寡核苷酸包含六个或更多个亚基;和多聚体寡核苷酸被配制用于皮下施用。
80.在实施方案中,相对于皮下施用时的单体寡核苷酸,当皮下施用时多聚体寡核苷酸更缓慢地释放到受试者的血清中。
81.在实施方案中,相对于静脉内施用时的多聚体寡核苷酸,当皮下施用时多聚体寡核苷酸的细胞摄取增加。
82.在实施方案中,相对于静脉内施用的多聚体寡核苷酸,当皮下施用时多聚体寡核苷酸具有与靶受体增加的结合。
83.在另一个方面,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法,该方法包括向受试者皮下施用有效量的多聚体寡核苷酸,该多聚体寡核苷酸包含亚基其中:亚基中的每个包含单链或双链寡核苷酸,并且亚基中的每个通过共价接头
●
与另一个亚基连接;多聚体寡核苷酸具有配置为相对于以单体形式施用时相同亚基的体内活性增加的多聚体寡核苷酸内的一个或多个亚基的体内活性的分子量和/或大小;多聚体寡核苷酸包含两个亚基至五个亚基。
84.在实施方案中,多聚体寡核苷酸具有配置为降低其由于肾小球滤过引起的清除的分子量和/或大小。
85.在实施方案中,多聚体寡核苷酸的分子量为至少约45kd,或多聚体寡核苷酸的分子量在约45-60kd的范围内。
86.在实施方案中,多聚体寡核苷酸内一个或多个亚基的活性增加与多聚体寡核苷酸中的硫代磷酸酯含量无关。
87.在实施方案中,多聚体寡核苷酸包含两个亚基、三个亚基、四个亚基或五个亚基。
88.在实施方案中,至少两个亚基是基本不同的。在实施方案中,所有的亚基是基本不同的。
89.在实施方案中,至少两个亚基是基本相同或同一的。在实施方案中,所有亚基是基本相同或同一的。
90.在实施方案中,亚基中的每个的长度独立地为10-30、17-27、19-26或20-25个核苷酸。
91.在实施方案中,一个或多个亚基是双链的。在实施方案中,一个或多个亚基是单链的。
92.在实施方案中,亚基包含单链和双链寡核苷酸的组合。
93.在实施方案中,寡核苷酸中的一个或多个核苷酸是rna、dna或人工或非天然核酸类似物。
94.在实施方案中,亚基的至少一个包含rna。
95.在实施方案中,亚基的至少一个包含sirna、sarna或mirna。
96.在实施方案中,亚基的至少一个包含反义寡核苷酸。
97.在实施方案中,亚基的至少一个包含双链sirna。
98.在实施方案中,两个或多个sirna亚基通过附接到sirna有义链上的共价接头连接起来。
99.在实施方案中,两个或多个sirna亚基通过附接到sirna反义链上的共价接头连接起来。
100.在实施方案中,两个或多个sirna亚基通过附接到第一sirna的有义链和第二sirna的反义链上的共价接头连接起来。
101.在实施方案中,一个或多个共价接头
●
包含可切割的共价接头。
102.在实施方案中,可切割的共价接头包含酸可切割键、还原剂可切割键、生物可切割键或酶可切割键。
103.在实施方案中,可切割的共价接头在细胞内条件下是可切割的。
104.在实施方案中,至少一个共价接头包含二硫键或式(i)的化合物:其中:s通过共价键或通过接头连接到亚基的3'或5'端;每个r1独立地为c
2-c
10
烷基、烷氧基或芳基基团;r2是硫代丙酸酯基或二硫基团;并且每个x选自
105.在实施方案中,式(i)化合物包含并且其中s通过共价键或通过接头连接到亚基的3'或5'端。
106.在实施方案中,式(i)化合物包含
107.并且其中s通过共价键或通过接头连接到亚基的3'或5端。
108.在实施方案中,式(i)化合物包含
109.并且其中s通过共价键或通过接头连接到亚基的3'或5'端。
110.在实施方案中,式(i)的共价接头由式(ii)的共价连接前体形成:
111.其中:每个r1独立地为c
2-c
10
烷基、烷氧基或芳基基团;并且r2是硫代丙酸酯基或二硫基团。
112.在实施方案中,一个或多个共价接头
●
包含核苷酸接头。
113.在实施方案中,核苷酸接头包含2-6个核苷酸。
114.在实施方案中,核苷酸接头包含二核苷酸接头。在实施方案中,核苷酸接头包含四核苷酸接头。
115.在实施方案中,每个共价接头
●
是相同的。
116.在实施方案中,共价接头
●
包含两个或更多个不同的共价接头。
117.在实施方案中,至少两个亚基在第一亚基的3'末端和第二亚基的3'末端之间通过共价接头
●
连接。
118.在实施方案中,至少两个亚基在第一亚基的3'末端和第二亚基的5'末端之间通过共价接头
●
连接。
119.在实施方案中,至少两个亚基在第一亚基的5'末端和第二亚基的3'末端之间通过共价接头
●
连接。
120.在实施方案中,至少两个亚基在第一亚基的5'末端和第二亚基的5'末端之间通过共价接头
●
连接。
121.在实施方案中,多聚体寡核苷酸进一步包含一个或多个靶向配体。在实施方案中,至少一个亚基是靶向配体。在实施方案中,靶向配体是适体。
122.在实施方案中,多聚体寡核苷酸的末端与靶向配体共价结合。在实施方案中,内部亚基与靶向配体共价结合。在实施方案中,多聚体寡核苷酸的至少一个末端与靶向配体共价结合,并且多聚体寡核苷酸的至少一个内部亚基与靶向配体共价结合。在实施方案中,多聚体寡核苷酸的每个末端分别与靶向配体共价结合,并且多聚体寡核苷酸的每个内部亚基分别与靶向配体共价结合。
123.在实施方案中,靶向配体是蛋白质、抗原结合蛋白、肽、氨基酸、核酸(包含例如dna、rna和人工或非天然核酸类似物)、适体、脂质、磷脂、碳水化合物、多糖、n-乙酰半乳糖胺(galnac)、甘露糖、其他甘露糖受体结合配体、叶酸、其他叶酸受体结合配体、免疫刺激剂、其他有机化合物和/或无机化学化合物。
124.在实施方案中,靶向配体包含n-乙酰半乳糖胺(galnac)。
125.在实施方案中,靶向配体是肽,并且肽是aprpg、cngr(cngrcvsgcagrc)、f3(kdepqrrsarlsakpappkpepkpkkapakk)、cgkrk和/或irgd(crgdkgpdc)。
126.在实施方案中,靶向配体是抗原结合蛋白,并且抗原结合蛋白是scfv或vhh。
127.在实施方案中,亚基和/或靶向配体是免疫刺激剂,并且免疫刺激剂包含cpg寡核苷酸。
128.在实施方案中,cpg寡核苷酸包含序列tcgtcgttttgtcgttttgtcgtt(seq id no:162)。
129.在实施方案中,cpg寡核苷酸包含序列ggtgcatcgatgcaggggg(seq id no:163)。
130.在实施方案中,多聚体寡核苷酸是至少为75%、80%、85%、90%、95%、96%、97%、98%、99%或100%纯的。
131.在实施方案中,至少一个亚基包含与转甲状腺素蛋白(ttr)mrna互补的寡核苷酸。
132.在实施方案中,每个亚基包含与ttr mrna互补的寡核苷酸。
133.在实施方案中,与ttr mrna互补的亚基包含相对于与ttr mrna互补的单体寡核苷酸增加的体内活性。
134.在实施方案中,与ttr mrna互补的亚基包含相对于与ttr mrna互补的六聚体或更大的寡核苷酸增加的体内活性。
135.在实施方案中,与ttr mrna互补的寡核苷酸包含uuauagagcaagaacacuguuuu(seq id no:164)。
136.在实施方案中,相对于以单体形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少2倍增加。
137.在实施方案中,相对于以单体形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少5倍增加。
138.在实施方案中,相对于以单体形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少10倍增加。
139.在实施方案中,相对于以六聚体形式或更大形式施用时相同亚基的体内活性,多聚体寡核苷酸内的一个或多个亚基的体内活性的增加是至少2倍增加。
140.在实施方案中,多聚体寡核苷酸进一步包含一个或多个内体逃逸部分。
141.在另一个方面,本公开提供了包含亚基的多聚体寡核苷酸,其中:亚基中的每个包含单链或双链寡核苷酸,并且其中亚基中的每个通过共价接头
●
与另一个亚基连接;多聚体寡核苷酸具有配置为相对于以单体形式施用时相同亚基的体内活性增加多聚体寡核苷酸内的一个或多个亚基的体内活性的分子量和/或大小;多聚体寡核苷酸包含六个或更多个亚基;和多聚体寡核苷酸被配制用于皮下施用。
142.在实施方案中,相对于皮下施用时的单体寡核苷酸,当皮下施用时多聚体寡核苷酸更缓慢地释放到受试者的血清中。
143.在实施方案中,相对于静脉内施用时的多聚体寡核苷酸,当皮下施用时多聚体寡核苷酸的细胞摄取增加。
144.在实施方案中,相对于静脉内施用的多聚体寡核苷酸,当皮下施用时多聚体寡核苷酸具有与靶受体增加的结合。
145.在一个方面,本公开提供合成包含结构92、结构93、结构94或结构95的多聚体寡核
苷酸的方法:苷酸的方法:
146.其中每个是单链寡核苷酸,每个是双链寡核苷酸,每个
●
是连接相邻寡核苷酸的共价接头,并且m=0或1和n=0或1,该方法包括以下步骤:(i)将通过以下方式形成:(a)第一单链寡核苷酸和第二单链寡核苷酸退火,从而形成并且使与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应形成共价接头
●
的化学部分,从而形成或(b)使第二单链寡核苷酸和第三单链寡核苷酸反应,从而形成并且第一单链寡核苷酸和退火,从而形成(ii)任选地退火和单链二聚体从而形成(iii)任选地使一个或多个额外的单链二聚体退火,从而形成结构92、结构93、结构94或结构95。
147.在一个方面,本公开提供合成包含结构92、结构93、结构94或结构95的多聚体寡核苷酸的方法:苷酸的方法:苷酸的方法:其中每个是单链寡核苷酸,每个是双链寡核苷酸,每个
●
是连接相邻寡核苷酸的共价接头,并且m=0或1和n=0或1,该方法包括以下步骤:(i)使第一单链寡核苷酸和第一单链二聚体退火,从而形成(ii)任选地使与第二单链二聚体退火,从而形成和任选地使一个或多个额外的单链二聚体退火,从而形成其中m=0或1且n=0或1。
148.在一个方面,本公开提供合成多聚体寡核苷酸的方法,该多聚体核苷酸包含:
[0149][0150]
其中每个是单链寡核苷酸,每个是双链寡核苷酸,每个
●
是连接相邻寡核苷酸的共价接头,p为≥0的整数,q为≥0的整数,r为≥0的整数,该方法包括:(i)使结构92和结构93退火:构92和结构93退火:或(ii)使第一结构92与第二结构92退火,或(iii)使第一结构93和第二结构93退火,从而形成结构94、结构95或结构96,其中m为≥0的整数,n为≥0的整数≥0双链的。
[0151]
在实施方案中,多聚体寡核苷酸的至少一个末端与靶向配体共价结合。
[0152]
在实施方案中,多聚体寡核苷酸的至少一个内部亚基与靶向配体共价结合。
[0153]
在实施方案中,多聚体寡核苷酸的至少一个末端与靶向配体共价结合,并且多聚体寡核苷酸的至少一个内部亚基与靶向配体共价结合。
[0154]
在实施方案中,多聚体寡核苷酸的每个末端分别与靶向配体共价结合,并且多聚体寡核苷酸的每个内部亚基分别与靶向配体共价结合。
[0155]
在实施方案中,每个和的长度为10-30、17-27、19-26或20-25个核苷酸。
[0156]
在实施方案中,和的一个或多个核苷酸是rna、dna或人工或非天然核酸类似物。
[0157]
在实施方案中,和中的至少一个是rna。
[0158]
在实施方案中,和中的至少一个是sirna、sarna或mirna。在实施方案中,和中的至少一个是sirna。在实施方案中,至少一个和是mirna。在实施方案中,和中的至少一个是sarna。在实施方案中,至少一个和是mirna。在实施方案中,的至少一个是反义寡核苷酸。
[0159]
在实施方案中,两个或更多个sirna通过附接到sirna有义链的共价接头连接。在实施方案中,两个或更多个sirna通过共价接头连接,所述共价接头附接到sirna的反义链上。在实施方案中,两个或更多个sirna通过共价接头连接,所述共价接头附接到第一sirna的有义链和第二sirna的反义链上。
[0160]
在实施方案中,一个或多个共价接头
●
包含可切割的共价接头。在实施方案中,可切割的共价接头含有酸可切割键、还原剂可切割键、生物可切割键或酶可切割键。在实施方案中,可切割的共价接头在细胞内条件下是可切割的。
[0161]
在实施方案中,共价接头各自独立地包含二硫键或式(i)的化合物:其中:s通过共价键或通过接头连接到或的3'或5'端;每个r1独立地为c
2-c
10
烷基、烷氧基或芳基基团;r2为硫代丙酸酯基或二硫基团;每个x独立
地选自:
[0162]
在实施方案中,式(i)的化合物是并且其中s通过共价键或通过接头连接到或的3'或5'端。
[0163]
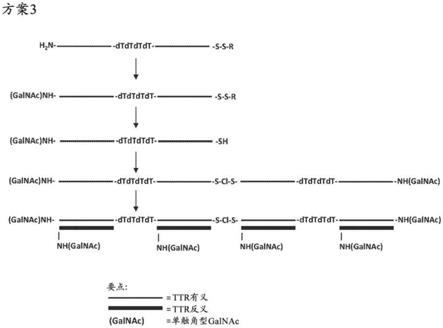
在实施方案中,式(i)的化合物是并且其中s通过共价键或通过接头连接到或的3'或5'端。
[0164]
在实施方案中,式(i)的化合物是并且其中s通过共价键或通过接头连接到或的3'或5'端。
[0165]
在实施方案中,式(i)的共价接头由式(ii)的共价连接前体形成:
[0166][0167]
其中:每个r1独立地是c
2-c
10
烷基、烷氧基或芳基基团;r2为硫代丙酸酯基或二硫基团。
[0168]
在实施方案中,一个或多个共价接头
●
包含核苷酸接头。在实施方案中,核苷酸接头的长度在2-6个核苷酸之间。在实施方案中,核苷酸接头是二核苷酸接头。在实施方案中,核苷酸接头是四核苷酸接头。
[0169]
在实施方案中,每个共价接头
●
是相同的。在实施方案中,共价接头
●
包含两个或更多个不同的共价接头。
[0170]
在实施方案中,两个或更多个相邻的寡核苷酸亚基通过第一亚基的3'末端和第二亚基的3'末端之间的共价接头
●
连接。在实施方案中,两个或更多个相邻的寡核苷酸亚基通过第一亚基的3'末端和第二亚基的5'末端之间的共价接头
●
连接。在实施方案中,两个或更多个相邻的寡核苷酸亚基通过第一亚基的5'末端和亚基的3'末端之间的共价接头
●
连接。在实施方案中,两个或更多个相邻的寡核苷酸亚基通过第一亚基的5'末端和第二亚基的5'末端之间的共价接头
●
连接。
[0171]
在实施方案中,靶向配体是蛋白质、抗原结合蛋白、肽、氨基酸、核酸(包括例如
dna、rna和人工或非天然核酸类似物)、适体、脂质、磷脂、碳水化合物、多糖、n-乙酰半乳糖胺(galnac)、甘露糖、其他甘露糖受体结合配体、叶酸、其他叶酸受体结合配体、免疫刺激剂、其他有机化合物和/或无机化学化合物。
[0172]
在实施方案中,靶向配体包含n-乙酰半乳糖胺(galnac)。
[0173]
在实施方案中,靶向配体是肽,并且该肽是aprpg、cngr(cngrcvsgcagrc)、f3(kdepqrrsarlsakpappkpepkpkkapakk)、cgkrk和/或irgd(crgdkgpdc)。
[0174]
在实施方案中,靶向配体为抗原结合蛋白,抗原结合蛋白为scfv或vhh。
[0175]
在实施方案中,亚基和/或靶向配体是免疫刺激剂,并且该免疫刺激剂包含cpg寡核苷酸。
[0176]
在实施方案中,cpg寡核苷酸包含序列tcgtcgttttgtcgttttgtcgtt(seq id no:162)。
[0177]
在实施方案中,cpg寡核苷酸包含序列ggtgcatcgatgcaggggg(seq id no:163)。
[0178]
在实施方案中,多聚体寡核苷酸至少为75、80、85、90、95、96、97、98、99或100%纯的。
[0179]
在实施方案中,至少一个寡核苷酸亚基包含与转甲状腺素蛋白(ttr)mrna互补的寡核苷酸。
[0180]
在实施方案中,与ttr mrna互补的寡核苷酸包含uuauagagcaagaacacuguuuu(seq id no:x)。
[0181]
在实施方案中,一个或多个亚基包含一个或多个硫代磷酸酯修饰。在实施方案中,一个或多个亚基在5'和/或3'末端包含1-3个硫代磷酸酯修饰。在实施方案中,每个亚基包含1-10个硫代磷酸酯修饰。
[0182]
当参考附图和以下描述时,本技术的这些和其他优点将显而易见。
附图说明
[0183]
图1a表示了三触角型n-乙酰半乳糖胺配体的化学结构。
[0184]
图1b表示了二硫代双马来酰亚胺乙烷的化学结构。
[0185]
图2表示了5'-galnac-sifvii典型对照,其结合实施例9进行了讨论。
[0186]
图3表示了galnac-同二聚体(xd-06330),其结合实施例10进行了讨论。
[0187]
图4表示了galnac-同二聚体(xd-06360)的合成示意图,其结合实施例11进行了讨论。
[0188]
图5表示了galnac-同二聚体(xd-06329)的合成示意图,其结合实施例12进行了讨论。
[0189]
图6表示了显示小鼠血清中fvii活性的数据(被fvii同二聚体galnac缀合物敲低(knockdown)),其结合实施例13进行了讨论。
[0190]
图7a、7b和7c表示的数据显示了小鼠血清中的fvii活性(通过对galnac含量标准化的fvii同二聚体galnac缀合物的敲低),其结合实施例13进行了讨论。
[0191]
图8表示了独立靶向fvii、apob和ttr的典型galnac-sirna,其结合实施例14进行了讨论。
[0192]
图9表示了galnac-异三聚体(xd-06726),其结合实施例15进行了讨论。关键:在该
实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。
[0193]
图10表示了galnac缀合异三聚体(xd-06726)的合成策略的示意图,其结合实施例15进行了讨论。关键:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。
[0194]
图11表示了galnac-异三聚体缀合物(xd-06727),其结合实施例16进行了讨论。关键:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。
[0195]
图12表示了galnac缀合异三聚体(xd-06727)的合成策略的示意图,其结合实施例16进行了讨论。关键:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。
[0196]
图13表示了x20336添加至x20366的hplc分析数据,其结合实施例16进行了讨论。
[0197]
图14表示了进一步添加x19580到x20336和x20366的反应产物中的hplc分析数据,其结合实施例16进行了讨论。
[0198]
图15表示了进一步添加x18795(5'-sifvii反义-3')至x20336、x20366和x19580的反应产物以产生xd-06727的hplc分析数据,其结合实施例16进行了讨论。
[0199]
图16a和16b表示了血清样品中ttr蛋白水平的数据(通过elisa测量),其结合实施例18进行了讨论。
[0200]
图17a和17b表示了血清样品中fvii酶活性的数据,其结合实施例18进行了讨论。
[0201]
图18a和18b表示了血清样品中apob蛋白水平的数据(通过elisa测量),其结合实施例18进行了讨论。
[0202]
图19a和19b表示了肝脏数据中的靶敲低,其结合实施例18进行了讨论。
[0203]
图20表示了galnac-异四聚体缀合物(xd-07140),其结合实施例19进行了讨论。关键:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。
[0204]
图21表示了galnac-异四聚体缀合物(xd-07140)的合成示意图,其结合实施例19进行了讨论。关键:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。
[0205]
图22表示了galnac-sifvii-siapob-sittr-sifvii异四聚体(xd-07140)的hplc结果,其结合实施例19进行了讨论。
[0206]
图23表示阐明用于合成同六聚体的步骤的示意图,其结合实施例23进行了讨论。
[0207]
图24a和24b表示了显示单链rna x30835的产率和纯度的rp-hplc结果,其结合实施例24进行了讨论。
[0208]
图24c和24d表示了显示单链rna x30837的产出和纯度的rp-hplc结果,其结合实施例24进行了讨论。
[0209]
图24e表示了x30838的rp-hplc结果,其结合实施例24进行了讨论。
[0210]
图24f表示了x30838、x18795和xd-09795的rp-hplc结果,其结合实施例24进行了讨论。
[0211]
图25表示了显示在注射xd-09795或xd-09794后不同时间的小鼠中fvii反义rna的血清浓度的数据,其结合实施例25进行了讨论。
[0212]
图26a-j表示了显示在注射xd-09795或xd-09794后不同时间的小鼠中各种细胞因子的血清水平的数据,其结合实施例26进行了讨论。
[0213]
图27a表示了fvii sirna单体的合成策略的示意图,其结合实施例28进行了讨论。
[0214]
图27b表示了xd-09794的rp-hplc结果,其结合实施例28进行了讨论。
[0215]
图28a表示了fvii sirna同二聚体的合成策略的示意图,其结合实施例29进行了讨论。
[0216]
图28b表示了xd-10635的rp-hplc结果,其结合实施例29进行了讨论。
[0217]
图29a表示了fvii sirna同型三聚体的合成策略的示意图,其结合实施例30进行了讨论。
[0218]
图29b表示了xd-10636的rp-hplc结果,其结合实施例30进行了讨论。
[0219]
图30a表示了fvii sirna的同四聚体的合成策略的示意图,其结合实施例31进行了讨论。
[0220]
图30b表示了xd-10637的rp-hplc结果,其结合实施例31进行了讨论。
[0221]
图31a表示了fvii sirna的同五聚体的合成策略的示意图,其结合实施例32进行了讨论。
[0222]
图31b表示了xd-10638的rp-hplc结果,其结合实施例32进行了讨论。
[0223]
图32a表示了fvii sirna的同六聚体的合成策略的示意图,其结合实施例33进行了讨论。
[0224]
图32b表示了xd-10639的rp-hplc结果,其结合实施例33进行了讨论。
[0225]
图33a表示了经由单-dtme缀合物用于fvii sirna的同六聚体的合成策略的示意图,其结合实施例34进行了讨论。
[0226]
图33b表示了xd-09795的rp-hplc结果,其结合实施例34进行了讨论。
[0227]
图34a表示了经由单-dtme缀合物用于fvii sirna的同七聚体的合成策略的示意图,其结合实施例35进行了讨论。
[0228]
图34b表示了xd-10640的rp-hplc结果,其结合实施例35进行了讨论。
[0229]
图35a表示了经由单-dtme缀合物用于fvii sirna的同八聚体的合成策略的示意图,其结合实施例36进行了讨论。
[0230]
图35b表示了xd-10641的rp-hplc结果,其结合实施例36进行了讨论。
[0231]
图36a表示了各种fvii sirna多聚体在血清中fvii sirna水平随时间变化的平滑线散点图,其结合实施例37进行了讨论。
[0232]
图36b表示了各种fvii sirna多聚体在血清中fvii sirna水平随时间变化的直标记散点图,其结合实施例37进行了讨论。
[0233]
图37a-d表示了在施用各自的寡核苷酸后在各种时间时fvii sirna多聚体在血清中fvii sirna水平的条形图,其结合实施例37进行了讨论。
[0234]
图38a表示了fvii多聚体在血清中fvii sirna暴露水平(曲线下面积)的条形图,其结合实施例37进行了讨论。
[0235]
图38b表示了针对单体标准化的fvii多聚体的血清中总fvii sirna水平(标准化的曲线下面积)的条形图,其结合实施例37进行了讨论。
[0236]
图39表示了多聚体在5分钟达到与单体相同的fvii sirna血清浓度所用时间的条形图,其结合实施例38进行了讨论。
[0237]
图40表示了同四聚体sirna的合成策略的示意图,其结合实施例20进行了讨论。
[0238]
图41表示了在交替链上具有连接的同四聚体sirna的合成策略的示意图,其结合实施例20进行了讨论。
[0239]
图42表示了显示在4:1:1sifvii:siapob:sittr靶向sirna形式中的异六聚体sirna的合成策略的示意图。
[0240]
图43表示了制备fvii靶向性有义链的示意图。
[0241]
图44描绘了fvii靶向性有义链x39850的rp-hplc和ms数据。
[0242]
图45描绘了fvii靶向性有义链x39851的rp-hplc和ms数据。
[0243]
图46描绘了fvii靶向性反义链x18795的rp-hplc和ms数据。
[0244]
图47描绘了经由二硫键连接与apob靶向反义链连接并命名为x39855的fvii靶向性反义链的rp-hplc和ms数据。
[0245]
图48描绘了x39850和x18795的退火双链体(x39850-x18795)的rp-hplc数据。
[0246]
图49描绘了fvii双链体x39850-x18795和fvii靶向性有义链x39851之间的缀合产物(x39850-x18795-x39851)的rp-hplc数据。
[0247]
图50描绘了x39850-x18795-x39851与二聚体fvii/apob靶向性反义链x39855退火的产物(x39850-x18795-x39851-x39855)的rp-hplc数据。
[0248]
图51描绘了经由二硫键连接与ttr靶向性有义链连接并命名为x39852的fvii靶向性有义链的rp-hplc和ms数据。
[0249]
图52描绘了经由二硫键连接与ttr靶向反义链连接并命名为x39854的fvii靶向性反义链的rp-hplc和ms数据。
[0250]
图53描绘了经由二硫键连接与apob靶向有义链连接并命名为x39853的fvii靶向性有义链的rp-hplc和ms数据。
[0251]
图54描绘了二聚体有义链x39852与fvii靶向性反义链x18795退火的产物(x39852-x18795)的rp-hplc数据。
[0252]
图55描绘了二聚体反义链x39854与x39852-x18795退火的产物(x39852-x18795-x39854)的rp-hplc数据。
[0253]
图56描绘了二聚体有义链x39853与x39852-x18795-x39854退火的产物(x39852-x18795-x39854-x39853)的rp-hplc数据。
[0254]
图57a和57b描绘了图56的x39852-x18795-x39854-x39853与图50的x39850-x18795-x39851-x39855退火以形成最终的异六聚体sirna的产物(x39850-x18795-x39851-x39855-x39852-x18795-x39854-x39853)的rp-hplc(图57a)和ms(图57b)数据。
[0255]
图58描绘了通过6mg/kg的4:1:1fvii:apob:ttr六聚体(相当于1mg/kg ttr单体)对ttr的敲低。
[0256]
图59表示了合成靶向ttr的同四聚体sirna的示意图(方案1),如实施例41中所述。
[0257]
图60表示了合成靶向ttr的同四聚体sirna的示意图(方案2),如实施例42中所述。
[0258]
图61表示了合成靶向ttr的同四聚体sirna的示意图(方案3),如实施例43中所述。
[0259]
图62表示了合成靶向ttr的同四聚体sirna的示意图(方案4),如实施例44中所述。
[0260]
图63描绘了要皮下施用并进行评估的一系列1-到8-聚体的同多聚体,如实施例45中所述。
[0261]
尽管本公开包含许多不同形式的实施方案,但在附图中显示并且将在本文中详细
描述几个特定实施方案,应理解认为本公开是技术原理的示例而非旨在限制本公开到所阐明的实施方案。
[0262]
发明详述
[0263]
本文涉及的任何专利、专利申请和出版物的公开内容通过引用特此以其整体并入本技术中,以便更全面地描述本文描述和要求保护的公开日前本领域技术人员已知的技术状态。
[0264]
本公开涉及组合物和方法,以(1)增加经由sc施用施用于受试者的核苷酸试剂的生物活性,和/或(2)降低通过sc施用递送到受试者的寡核苷酸试剂从sc组织释放的速率。
[0265]
本公开适用于所有类型的寡核苷酸试剂,双链和单链,包括例如sirna、sarna、mirna、适体和反义寡核苷酸。
[0266]
寡核苷酸被制备为具有通过共价接头连接的单体亚基的多聚体,其中亚基可以是相同亚基或不同亚基的多个拷贝。
[0267]
在前述组合物和方法中,多聚体寡核苷酸具有配置为降低多聚体寡核苷酸从皮下组织释放的速率和/或降低多聚体寡核苷酸由肾清除的分子量和/或大小。单个或结合地,相对于在以单体形式施用时相同亚基的体内生物活性的每种情况下,多聚体的分子量和/或大小的这些方面可导致多聚体寡核苷酸增加的生物利用度、每次内化事件试剂增加的摄取和多聚体寡核苷酸内的一个或多个亚基的体内增加的生物活性。
[0268]
在前述组合物和方法的一个方面,多聚体寡核苷酸在施用于受试者时可具有增加的血清半衰期,从而随着时间增加细胞递送和内化的潜力,且从而相对于相应单体,增加多聚体寡核苷酸中至少一个亚基的体内生物活性。例如,经由iv施用施用于受试者的sirna同四聚体具有经由肾降低的排泄率,导致血清半衰期大约为相应单体的10倍(参见图38b),从而随着时间增加四聚体的细胞递送和内化的潜力,所述四聚体当内化时相对于单体递送四倍的治疗有效载荷,从而增加四聚体相对于单体的体内生物活性。使用sirna同五聚体观察到更大的效果,所述sirna同五聚体当经由iv施用时,导致血清半衰期大约为相应单体的15倍(参见图38b),并且相对于单体递送5倍治疗有效载荷。
[0269]
在进一步方面,多聚体寡核苷酸当经由sc施用给予于受试者时,相对于单体,多聚体可具有降低的从sc组织释放的速率,从而相对于单体随着时间增加多聚体细胞递送和内化的潜力,并从而相对于相应单体增加多聚体中至少一个亚基的体内生物活性。
[0270]
当增加的血清半衰期和多聚体寡核苷酸的皮下施用方面结合时,由于多聚体从sc组织的降低的释放速率结合经由肾减少的排泄,可能对生物利用度和/或生物活性产生协同效应,从而相对于单体随着时间进一步增加多聚体细胞递送和内化的潜力,并从而相对于单体进一步增加多聚体中至少一个亚基的体内生物活性。
[0271]
相对于单体,多聚体从sc组织释放的速率可以通过没有靶向配体的多聚体的sc施用和随时间变化确定的血清中多聚体的浓度来确定。血清中多聚体的浓度是多聚体从sc组织释放到循环系统和经由肾排泄的函数,其根据以下等式:sc施用后在时间t的sirna浓度=函数(释放速率)-函数(从肾的排泄率)。循环半衰期可用作肾排泄率的代表。
[0272]
多聚体寡核苷酸可具有至少约45kd的分子量,或可具有约45-60kd范围内的分子量。
[0273]
根据本公开的多聚体的改善的和有利的性质可以是在增加的体内生物活性方面。
在sirna的情况下,增加的生物活性可能表现为在施用多聚体寡核苷酸后降低的靶蛋白或mrna水平。相对于相应的单体寡核苷酸,可以观察到这种增加的生物活性。
[0274]
当与靶向配体结合时,包含相同试剂的两个或更多个亚基的多聚体寡核苷酸可以比单体等同物在每个配体/受体结合事件中递送更高的有效载荷。多聚体寡核苷酸也可以与一个或多个靶向配体结合,并且任选地与为其他目的而设计的其他配体或部分结合,以加速细胞内释放。
[0275]
本公开还涉及新的合成中间物和合成多聚体寡核苷酸的方法。本公开还涉及使用多聚体寡核苷酸的方法,例如在降低基因表达、生物学研究、治疗或预防医学病况和/或产生新的或改变的表型中。
[0276]
向受试者施用多聚体寡核苷酸的方法
[0277]
在各个方面,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法,该方法包括向受试者皮下施用有效量的多聚体寡核苷酸,多聚体寡核苷酸包含亚基其中:
[0278]
亚基中的每个独立地是单链或双链寡核苷酸,并且亚基中每个通过共价接头
●
与另一个亚基连接;
[0279]
多聚体寡核苷酸具有配置为降低从皮下组织释放的速率和/或降低多聚体寡核苷酸经由肾的清除的分子量和/或大小。
[0280]
多聚体寡核苷酸经由肾的降低的清除可能是肾小球滤过降低的结果。
[0281]
多聚体寡核苷酸的分子量可以是至少约45kd,或在约45-60kd的范围内。
[0282]
在一个方面,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中多聚体寡核苷酸中含有的亚基的数量是m,m是整数,其被选择以使多聚体寡核苷酸具有配置为降低其从皮下组织的释放速率和/或降低其经由肾的清除的分子量和/或大小(例如,降低其由于肾小球滤过的清除)。在各个方面,m≥2、≥3、≥4、≥4且≤17、≥4且≤8、或4、5、6、7或8。
[0283]
在一个方面,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中多聚体寡核苷酸包含结构21:
[0284]
其中:亚基中的每个独立地是单链或双链寡核苷酸;亚基中的每个通过共价接头
●
连接到另一个亚基;n为≥0的整数。在一个实施方案中,n为0、1或2。
[0285]
在一个实施方案中,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中亚基是单链寡核苷酸。
[0286]
在一个实施方案中,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中n≥1。
[0287]
在一个实施方案中,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中亚基是双链寡核苷酸。
[0288]
在一个实施方案中,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中:
[0289]
当n=0,多聚体寡核苷酸由于肾小球滤过的清除相对于多聚体寡核苷酸的单体亚基和/或二聚体亚基的清除降低;和
[0290]
当n≥1时,多聚体寡核苷酸由于肾小球滤过的清除相对于多聚体寡核苷酸的单体亚基二聚体亚基和/或三聚体亚基的清除减少。
[0291]
测量多聚体寡核苷酸降低的清除的方法
[0292]
在一个方面,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中经由肾(例如,由于肾小球滤过)的多聚体降低的清除,有或没有多聚体从sc组织减少的释放速率导致增加的多聚体寡核苷酸的生物活性。
[0293]
在一个实施方案中,经由肾的多聚体降低的清除通过在向受试者施用多聚体寡核苷酸后测量多聚体寡核苷酸的体内循环半衰期来确定。
[0294]
在一个实施方案中,经由肾的多聚体降低的清除通过测量多聚体寡核苷酸的血清浓度降低至预定值所需的时间来确定。预定值可以是施用剂量的90%、80%、70%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、4%、3%、2%或1%。
[0295]
在一个实施方案中,经由肾的降低的清除通过在向受试者施用多聚体寡核苷酸后的预定时间测量多聚体寡核苷酸的血清浓度来确定。
[0296]
在一个实施方案中,经由肾的降低的清除通过测量图的曲线下面积来确定,该图的曲线表示在向受试者施用多聚体寡核苷酸后随时间变化的多聚体寡核苷酸的血清浓度。
[0297]
施用于受试者的多聚体寡核苷酸降低的清除的影响
[0298]
在一个方面,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中经由肾(例如,由于肾小球滤过)的多聚体降低的清除,有或没有多聚体从sc组织减少的释放速率导致增加的多聚体寡核苷酸的生物体内生物利用度。
[0299]
在一个实施方案中,多聚体寡核苷酸的增加的生物利用度导致多聚体寡核苷酸的体内细胞摄取增加。
[0300]
在一个方面,多聚体寡核苷酸的增加的生物利用度导致多聚体寡核苷酸的体内治疗指数/比率增加。
[0301]
在一个方面,多聚体寡核苷酸增加的生物利用度导致相对于相应单体多聚体寡核苷酸的至少一个亚基的体内生物活性增加。
[0302]
在一个方面,本公开提供了向有需要的受试者皮下施用多聚体寡核苷酸的方法,其中与多聚体经由肾(例如,由于肾小球滤过)降低的清除有关的测量参数,例如多聚体的血清半衰期,和/或与从sc组织多聚体的释放速率有关的测量参数,与单体、二聚体、三聚体和更高数量的多聚体寡核苷酸中的亚基数量呈s型关系,例如,如图37a-37d所示。
[0303]
在一个实施方案中,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法,其中多聚体寡核苷酸及其从单体亚基开始的每个亚基的测量参数在绘制时定义了s形曲线,例如,如图38a-38b所示。
[0304]
多聚体寡核苷酸
[0305]
在各个方面,本公开提供了包含亚基的多聚体寡核苷酸,其中:每个亚基独立地是单链或双链寡核苷酸,并且每个亚基通过共价接头
●
与另一个亚基连接。
[0306]
在一些实施方案中,多聚体寡核苷酸具有配置成降低从皮下组织释放速率和/或
降低多聚体寡核苷酸经由肾的清除的分子量和/或大小。
[0307]
多聚体寡核苷酸经由肾的降低的清除可能是降低的肾小球滤过的结果。
[0308]
多聚体寡核苷酸的分子量可以是至少约45kd或在约45-60kd的范围内。
[0309]
在一个方面,本公开提供了多聚体寡核苷酸,其中该多聚体寡核苷酸中含有的亚基的数量是m,m是整数,该整数被选择为使得多聚体寡核苷酸能够降低其从皮下组织的释放速率和/或降低其经由肾的清除(例如,由于肾小球滤过降低其清除)。在各个方面,m≥2、≥3、≥4、≥4且≤17、≥4且≤8、或4、5、6、7或8。
[0310]
在一个方面,本公开提供了包含结构21的多聚体寡核苷酸:
[0311][0312]
其中:
[0313]
每个亚基独立地是单链或双链寡核苷酸;每个亚基由共价接头连接到另一个亚基;其中至少一个亚基包含单链,该单链的一个共价接头
●
连接到它的3'端,另一个共价接头连接到它的5'端,n为≥0的整数。
[0314]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基的长度为15-30、17-27、19-26或20-25个核苷酸。
[0315]
在一个方面,本公开提供了多聚体寡核苷酸,其中n≥1且n≤17。
[0316]
在一个方面,本公开提供了多聚体寡核苷酸,其中n≥1且n≤5。
[0317]
在一个方面,本公开提供了多聚体寡核苷酸,其中n为1、2、3、4或5。
[0318]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是双链rna并且n≥1。
[0319]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是单链寡核苷酸。
[0320]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是双链寡核苷酸。
[0321]
在一个方面,本公开提供了多聚体寡核苷酸,其中亚基包含单链和双链寡核苷酸的组合。
[0322]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是rna、dna或人工或非天然核酸类似物。
[0323]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是rna。
[0324]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是sirna、sarna或mirna。
[0325]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基是双链sirna并且每个共价接头连接sirna的有义链。
[0326]
在一个方面,本公开提供了多聚体寡核苷酸,其中该多聚体寡核苷酸包含基本相同的亚基的同多聚体。在一些实施方案中,所有寡核苷酸亚基都是相同的。
[0327]
在一个方面,本公开提供了多聚体寡核苷酸,其中该多聚体寡核苷酸包含两个或更多个基本上不同的亚基的异多聚体。在一些实施方案中,至少一个寡核苷酸亚基不同于另一个寡核苷酸亚基在其他实施方案中,所有亚基都是不同的。
[0328]
在一个方面,本公开提供了多聚体寡核苷酸,其中该多聚体寡核苷酸为至少75%、
80%、85%、90%、95%、96%、97%、98%、99%或100%纯的。
[0329]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基独立地是双链寡核苷酸并且其中n为≥1的整数。
[0330]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个亚基独立地是双链寡核苷酸其中n为≥1的整数,并且其中每个共价接头
●
在同一链上:
[0331][0332]
其中d为≥1的整数。
[0333]
在一个方面,本公开提供了多聚体寡核苷酸,其包含结构22或23
[0334][0335]
其中中的每个是双链寡核苷酸,每个
●
是连接相邻双链寡核苷酸的共价接头,f是≥1的整数,g是≥0的整数。
[0336]
在一个方面,本公开提供了多个多聚体寡核苷酸,其中基本上所有的多聚体寡核苷酸都具有预定的n值和/或预定的分子量。
[0337]
靶向配体和其他功能部分
[0338]
在一个方面,本公开提供了多聚体寡核苷酸,其中该多聚体寡核苷酸进一步包含如下文在“缀合物、功能部分、递送媒介物和靶向配体”部分中描述的靶向配体或功能部分(下文统称为“功能部分”或“fm”)。在一些实施方案中,多聚体寡核苷酸可以由结构a表示:
[0339][0340]
其中亚基中的每个独立地是单链或双链寡核苷酸;亚基中的每个通过共价接头
●
连接到另一个亚基,n大于或等于0,并且fm可以独立地是功能部分、靶向配体或不存在。在一些实施方案中,存在至少两个fm。
[0341]
在一个方面,本公开提供了多聚体寡核苷酸,其中n为1、2或3。在另一方面,本公开提供了多聚体寡核苷酸,其中n为4、5、6、7、8、9或10。
[0342]
在一个方面,本公开提供了多聚体寡核苷酸,其中至少一个亚基是功能部分或fm。
[0343]
在一个方面,多聚体寡核苷酸的至少一个末端与功能部分或fm共价结合。
[0344]
在一个方面,多聚体寡核苷酸的至少一个内部亚基与功能部分或fm共价结合。
[0345]
在一个方面,多聚体寡核苷酸的至少一个末端与功能部分或fm共价结合,并且多聚体寡核苷酸的至少一个内部亚基与功能部分或fm共价结合。
[0346]
在一个方面,多聚体寡核苷酸的每个末端分别与功能部分共价结合,并且多聚体寡核苷酸的每个内部亚基分别与功能部分共价结合。
[0347]
在一些实施方案中,存在于多聚体寡核苷酸中的fm的至少一个不同于存在于寡核苷酸中的任何其他fm。
[0348]
在一些实施方案中,存在于多聚体寡核苷酸中的所有fm都是相同的。
[0349]
在一些实施方案中,存在于多聚体寡核苷酸中的每个fm不同于存在于寡核苷酸中的任何其他fm。因此,所有的fm都是不同的。
[0350]
接头
[0351]
在一个方面,本公开提供了多聚体寡核苷酸,其中一个或多个共价接头
●
包含可切割的共价接头并且包括核苷酸接头,例如,如实施例20、22b和27中所讨论的。核苷酸接头是含有一个或多个核苷酸的接头并且可以选择它以使其不进行任何其他指定的功能。
[0352]
在一个方面,本公开提供了多聚体寡核苷酸,其中可切割共价接头含有酸可切割键、还原剂可切割键、生物可切割键或酶可切割键。
[0353]
在一个方面,本公开提供了多聚体寡核苷酸,其中可切割的共价接头在细胞内条件下是可切割的。
[0354]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个共价接头
●
是相同的。
[0355]
在一个方面,本公开提供了多聚体寡核苷酸,其中所有的共价接头
●
是不同的。
[0356]
在一个方面,本公开提供了多聚体寡核苷酸,其中共价接头
●
包含两个或更多个不同的共价接头。换言之,至少一个共价接头
●
不同于另一共价接头。
[0357]
在一个方面,本公开提供了多聚体寡核苷酸,其中每个共价接头
●
连接两个单体亚基
[0358]
在一个方面,本公开提供了多聚体寡核苷酸,其中至少一个共价接头
●
连接三个或更多个单体亚基
[0359]
多聚体寡核苷酸的合成方法
[0360]
在各个方面,本公开提供了合成含有结构51的多聚体寡核苷酸的方法:
[0361][0362]
其中中的每个是单链寡核苷酸,每个
●
是连接相邻单链寡核苷酸的共价接头,并且a是≥1的整数,该方法包括以下步骤:
[0363](i)[0364]
使反应,
[0365]
其中
○
是连接部分,r1是能够与连接部分
○
反应的化学基团,b和c各自独立地为≥0的整数,b和c两者不能同时为零,并且b+c=a,从而形成结构51:并且
[0366]
(ii)可选地使结构51:
[0367]
与互补的单链寡核苷酸退火,从而形成结构54:
[0368][0369]
在各个方面,本公开提供了合成包含结构54的多聚体寡核苷酸的方法:
[0370]
其中中的每个是单链寡核苷酸,每个
●
是连接相邻单链寡核苷酸的共价接头,并且a≥1,该方法包括以下步骤:
[0371]
(i)使结构51:与互补的单链寡核苷酸退火,从而形成结构54:受试者
[0372]
在一个方面,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法。受试者的实例包括但不限于哺乳动物,如灵长类动物、啮齿动物和农业动物。灵长类受试者的实例包括但不限于人、黑猩猩和恒河猴。啮齿动物受试者的例子包括但不限于小鼠和大鼠。农业动物受试者的实例包括但不限于牛、棉羊、羔羊(lamb)、鸡和猪。
[0373]
小鼠肾小球滤过率(gfr)可为约0.15ml/min-0.25ml/min。人gfr可以是大约1.8ml/min/kg(mahmood i:(1998)interspecies scaling of renally secreted drugs.life sci 63:2365
–
2371)。
[0374]
小鼠可以有约1.46ml的血液。因此,小鼠肾小球滤过总血液量的时间可以约为7.3分钟(1.46/0.2)。人可以有约5升血液,重约70kg。因此,人总血液量的肾小球滤过时间可以约为39.7分钟[5000/126(1.8*70)]。
[0375]
本领域普通技术人员将认识到,至少出于上述原因不同物种可具有不同的肾小球滤过清除率。本领域普通技术人员可以推断,肾小球滤过的清除率在人和小鼠之间的倍数比率可以是约1:5或1:6。换言之,人清除某种物质(例如,特定寡核苷酸)的速率可以比小鼠慢5-6倍。
[0376]
在一个方面,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法,其中体内循环半衰期在向受试者施用多聚体寡核苷酸后30分钟至120分钟之间测量。
[0377]
在一个方面,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法,其中预定时间是在向受试者施用多聚体寡核苷酸之后的30分钟至120分钟之间。
[0378]
在一个方面,本公开提供了向有需要的受试者施用多聚体寡核苷酸的方法,其中
曲线下面积是基于在向受试者施用多聚体寡核苷酸后x和y分钟之间多聚体寡核苷酸的血清浓度计算的。在一些实施方案中,x可以是1、2、3、4、5、10、20、30、40、50、60、75、90、120、180、240或300分钟并且y可以是90、120、180、240、300、360、420、480、540、600、720、840、960、1080、1200、1320、1440或1600分钟。例如,时间范围可以是约30分钟-120分钟、约1分钟-1600分钟或约300分钟-600分钟。
[0379]
在一个方面,本公开提供了多聚体寡核苷酸或用于增加该多聚体寡核苷酸体内循环半衰期的方法,其中该多聚体寡核苷酸未配制在纳米颗粒(np)或脂质纳米颗粒(lnp)中。
[0380]
本公开还涉及具有改善的药效学和/或药代动力学的多聚体寡核苷酸。例如,多聚体寡核苷酸(例如,包括2、3、4、5、6、7、8、9、10、11、12或更多个sirna的多聚体寡核苷酸)可以相对于单个单体亚基而言具有增加的体内循环半衰期和/或从sc组织降低的释放速率,从而导致增加的体内生物利用度和/或生物活性。相对于单体等同物,具有两个或更多个相同亚基的多聚体寡核苷酸还可以在每个细胞内化事件中递送更高的寡核苷酸有效载荷,或者,如果多聚体寡核苷酸包含细胞靶向配体,则在每个配体/受体结合事件中递送更高的寡核苷酸有效载荷。本公开还涉及新的合成中间物和合成多聚体寡核苷酸的方法。本公开还涉及使用多聚体寡核苷酸的方法,例如在减少基因表达、生物学研究、治疗或预防医学病症和/或产生新的或改变的表型中。
[0381]
下面依次讨论本公开的各种特点。
[0382]
寡核苷酸
[0383]
在各种实施方案中,寡核苷酸是rna、dna或包含人工或非天然核酸类似物。在各种实施方案中,寡核苷酸是单链的。在各种实施方案中,寡核苷酸是双链的(例如,反平行双链)。
[0384]
在各种实施方案中,寡核苷酸是rna,例如反义rna(arna)、crispr rna(crrna)、长非编码rna(lncrna)、微小rna(mirna)、piwi相互作用rna(pirna)、小干扰rna(sirna)、信使rna(mrna)、短发夹rna(shrna)、小激活(sarna)或核酶。
[0385]
在一个实施方案中,rna是sirna。例如,每个双链寡核苷酸是sirna和/或具有约15-30个碱基对的长度。
[0386]
在各种实施方案中,寡核苷酸是适体。
[0387]
sirna(小干扰rna)是由19-22个核酸组成的短双链rna,它靶向核苷酸序列与其有义链相同的基因的mrna(信使rna),通过分解靶基因来抑制基因的表达(elbashir,s.m.,harborth,j.,lendeckel,w.,yalcin,a.,weber,k.,and tuschl,t.(2001)duplexes of 21-nucleotide rnas mediate rna interference in cultured mammalian cells.nature 411:494-8)。
[0388]
可用于本发明方法的另一类寡核苷酸是mirna。mirna是非编码rna,其在转录后基因调控中起关键作用。mirna可以调节30%的哺乳动物蛋白质编码基因的表达。发现了通过双链rna(rnai)以及额外的小非编码rna进行的特异性和强有力的基因沉默(canver,m.c.et al.,nature(2015))。pre-mirna是长约70个核苷酸的短茎环,其有2个核苷酸的3'-突出端,可输出为成熟的19-25个核苷酸双链体。有较低碱基配对稳定性的mirna链(引导链)可以加载到rna诱导的沉默复合物(risc)上。乘客引导链可以起作用,但通常会被分解。成熟的mirna将risc与主要发现于3'非翻译区(utr)内的靶mrna中的部分互补序列基序联
系在一起,并诱导转录后基因沉默(bartel,d.p.cell,136:215-233(2009);saj,a.&lai,e.c.curr opin genet dev,21:504-510(2011))。例如,在美国专利号8,765,709中描述了mirna模拟物。
[0389]
在一些实施方案中,rna可以是短发夹rna(shrna),例如,如美国专利号8,202,846和8,383,599中所述。
[0390]
在一些实施方案中,多聚体寡核苷酸的一个或多个核酸亚基可以是crispr引导rna,或与cas核酸酶在体内、体外或离体形成核糖核复合物(rnp)相关或必不可少的其他rna,或与使用cas核酸酶(该cas核酸酶包括例如野生型cas核酸酶或野生型cas的任何已知修饰,如切口酶和dead cas(dcas))进行基因组编辑或工程化功能相关或必不可少的其他rna。crispr-cas系统描述于例如美国专利号8,771,945;jinek et al.,science,337(6096):816-821(2012)和国际专利申请公开号wo 2013/176772。
[0391]
在各种实施方案中,寡核苷酸的长度为15-30、17-27、19-26、20-25、40-50、40-150、100-300、1000-2000或多达10000个核苷酸。
[0392]
在各种实施方案中,寡核苷酸是双链且互补的。互补性可以是100%互补或小于100%互补,其中寡核苷酸在相关条件(例如,生理相关条件)下仍然杂交并保持双链。例如,双链寡核苷酸可以具有至少约80%、85%、90%或95%的互补性。
[0393]
在一些实施方案中,rna是长非编码rna(lncrna),lncrna是一大类不同类型的转录rna分子,其长度超过200个核苷酸,该核苷酸不编码蛋白质(或缺少》100个氨基酸的开放阅读框)。lncrna被认为在人中包含近30,000种不同的转录本,因此lncrna转录本占非编码转录组的主要部分(参见,例如derrien et al.,the gencode v7 catalog of human long noncoding rnas:analysis of their gene structure,evolution,and expression.genome res,22(9):1775-89(2012))。
[0394]
在其他实施方案中,rna是信使rna(mrna)。例如,在国际专利申请公开号wo 2013/151736中描述了mrna及其作为用于体内蛋白质生产的递送方法的应用。
[0395]
在其他实施方案中,rna可以是小激活(sarna)(例如,如chappell et al.,nature chemical biology,11:214-220(2015)中所述),或核酶(doherty et al.,ann rev biophys biomo struct,30:457-475(2001))。
[0396]
在一些实施方案中,寡核苷酸是dna,例如反义dna(adna)(例如antagomir)或反义gapmer。adna的实例,包括gapmers和多聚体,其描述于例如subramanian et al.,nucleic acids res,43(19):9123
–
9132(2015)和国际专利申请公开号wo 2013/040429中。例如,在美国专利号7,232,806中描述了antagomir的实例。
[0397]
在各种实施方案中,寡核苷酸具有特定序列,例如本文公开的任何一种序列。
[0398]
以下实施例提供了寡核苷酸合成的一般程序。可以适用于本公开的其他方法在本领域中是已知的。
[0399]
对寡核苷酸的修饰
[0400]
在多个实施方案中,根据本公开的寡核苷酸进一步包含化学修饰。化学修饰可以包含修饰的核苷、修饰的主链、修饰的糖和/或修饰的端。
[0401]
修饰包括含磷连接,其包括但不限于硫代磷酸酯、对映体富集的硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、包含3'亚烷基膦酸酯和对映体富集的膦酸酯的甲
基和其他烷基膦酸酯、亚膦酸酯、包含3'氨基氨基磷酸酯和氨基烷基氨基磷酸酯的氨基磷酸酯、硫代氨基磷酸酯、硫代烷基膦酸酯、硫代烷基磷酸三酯和具有正常3'-5'连接的硼代磷酸酯、这些的2'-5'连接的类似物以及具有反向的相邻核苷单元的那些,所述核苷单元是3'-5'至5'-3'或2'-5'至5'-2'连接的。
[0402]
在各种实施方案中,多缀合物中含有的寡核苷酸可包含一个或多个硫代磷酸酯基团。寡核苷酸可以在5'末端包含一到三个硫代磷酸酯基团。寡核苷酸可以在3'末端包含一到三个硫代磷酸酯基团。寡核苷酸可以在5'末端和3'末端包含一到三个硫代磷酸酯基团。在各种实施方案中,多缀合物中含有的每个寡核苷酸可包含1-10个总硫代磷酸酯基团。在某些实施方案中,每个寡核苷酸可包含少于10个、少于9个、少于8个、少于7个、少于6个、少于5个、少于4个或少于3个总硫代磷酸酯基团。在某些实施方案中,相对于有更多硫代磷酸酯基团的单体形式的相同寡核苷酸,多缀合物中含有的有更少硫代磷酸酯基团的寡核苷酸可以拥有增加的体内活性。
[0403]
可以使用本领域已知的各种方案修饰含有在本公开的多缀合物中的寡核苷酸以产生多种效果,该效果包括例如提高体外和体内的效力和稳定性。这些策略包括:人工核酸,例如2'-o-甲基取代的rna;2'-氟-2'脱氧rna,肽核酸(pna);吗啉代;锁核酸(lna);解锁核酸(una);桥接核酸(bna);乙二醇核酸(gna);和苏糖核酸(tna);或更一般地,核酸类似物,例如双环和三环核苷类似物,其在结构上与天然存在的rna和dna相似,但在天然存在的分子的磷酸骨架、糖或核碱基部分中的一个或多个中具有改变。通常,类似核碱基赋予不同的碱基配对和碱基堆叠特性等。实例包括通用碱基,它可以与所有四个经典碱基配对。磷酸糖骨架类似物的实例包括但不限于pna。braasch et al.,biochemistry,41(14):4503-4510(2002)和美国专利号5,539,082;5,714,331;5,719,262;和5,034,506中描述了吗啉基寡聚化合物。
[0404]
在本文所述的制造方法中,一些寡核苷酸在末端通过用化学官能团取代而被修饰。取代可以在寡核苷酸的3'或5'末端进行,并且可以在单体的有义链和反义链二者的3'末端进行,但并不总是限于此。化学官能团可以包括,例如,巯基基团(-sh)、羧基基团(-cooh)、胺基基团(-nh2)、羟基基团(-oh)、甲酰基基团(-cho)、羰基基团(-co-)、醚基基团(-o-)、酯基基团(-coo-)、硝基基团(-no2)、叠氮基基团(-n3)或磺酸基基团(-so3h)。
[0405]
含有在本公开的多缀合物中的寡核苷酸可以被修饰以额外地或替代地包括核碱基(在本领域中简称为“碱基”)修饰或取代。修饰的核碱基包括在天然核酸中仅偶尔或短暂发现的核碱基,例如次黄嘌呤、6-甲基腺嘌呤、5-me嘧啶、5-甲基胞嘧啶(也称为5-甲基-2'脱氧胞嘧啶并在本领域中经常作为5-me-c提到)、5-羟甲基胞嘧啶(hmc)、糖基hmc和龙胆二糖基hmc,以及合成的核碱基,例如2-氨基腺嘌呤、2-(甲基氨基)腺嘌呤、2-(咪唑烷基)腺嘌呤、2-(氨基烷基氨基)腺嘌呤或其他杂取代烷基腺嘌呤、2-硫尿嘧啶、2-硫胸腺嘧啶、5-溴尿嘧啶、5-羟甲基尿嘧啶、8-氮鸟嘌呤、7-脱氮鸟嘌呤、n6(6-氨基己基)腺嘌呤和2,6-二氨基嘌呤。kornberg,a.,dna replication,w.h.freeman&co.,san francisco,pp 75-77(1980);gebeyehu et al.,nucl.acids res,15:4513(1997)。也可以包括本领域已知的“通用”碱,例如肌苷或假尿苷。5-me-c取代可以将核酸双链体稳定性提高0.6-1.2℃。(sanghvi,y.s.,in crooke,s.t.and lebleu,b.,eds.,antisense research and applications,crc press,boca raton,pp 276-278(1993)并且是碱基取代方面。修饰的核
碱基可以包括其他合成的和天然核碱基,如5-甲基胞嘧啶(5-me-c)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物、2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶、5-卤尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶、8-卤代、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤、5-卤代、如5-溴、5-三氟甲基和其他5-取代尿嘧啶和胞嘧啶、7-甲基奎宁和7-甲基腺嘌呤、8-氮鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤和7-脱氮杂腺嘌呤、3-脱氮鸟嘌呤和3-脱氮杂腺嘌呤。核酸末端的羟基基团(-oh)可以被如巯基基团(-sh)、羧基基团(-cooh)或胺基基团(-nh2)等官能团取代。可以在3'末端或5'末端进行取代。
[0406]
接头
[0407]
在本公开的各个方面和实施方案中,寡核苷酸共价连接。接头可以是可切割的(例如,在细胞内条件下,以促进寡核苷酸递送和/或作用)或不可切割的。尽管在下文和实施例中在使用亲核-亲电化学的接头的上下文中进行了一般性描述,但其他化学和配置也是可能的。并且,如普通技术人员将理解的,各种接头,包括它们的组成、合成和用途在本领域中是已知的并且可以适用于本公开。
[0408]
在各种实施方案中,共价接头可以包含亲核基团和亲电子基团的反应产物。例如,共价接头可以包含硫醇和马来酰亚胺、硫醇和乙烯基砜、硫醇和二硫化吡啶、硫醇和碘乙酰胺、硫醇和丙烯酸酯、叠氮化物和炔烃或胺和羧基基团的反应产物。如本文所述,这些基团中的一个与寡核苷酸连接(例如,3'或5'末端的硫醇(-sh)官能化),而另一个基团被最终连接两个寡核苷酸(例如,dtme中的马来酰亚胺)的第二分子(例如,连接剂)所涵盖。
[0409]
在各种实施方案中,共价接头可以包含未修饰的二核苷酸连接或硫醇和马来酰亚胺的反应产物。
[0410]
在各种实施方案中,共价接头可以包含长度为2-6个核苷酸的核苷酸接头。
[0411]
在各种实施方案中,共价接头可以包含二硫键或式(i)的化合物:
[0412][0413]
其中:
[0414]
s通过共价键或通过接头连接到亚基的3'或5'端;
[0415]
每个r1独立地是c2-c10烷基、烷氧基或芳基基团;
[0416]
r2是硫代丙酸基或二硫基团;和
[0417]
每个x独立地选自:
[0418][0419]
在某些实施方案中,式(i)化合物是并且其中s
phosphoramidite chemistry”rna.1997nov;3(11):1352-63。在各种实施方案中,连接剂可以是非离子亲水聚合物,如聚乙二醇(peg)、聚乙烯吡咯烷酮和聚恶唑啉,或疏水聚合物,如plga和pla。
[0431]
用作共价键中间物的聚合物连接剂可以是非离子亲水聚合物,其包括但不限于peg、pluronic、聚乙烯吡咯烷酮、聚恶唑啉或其共聚物;或一种或多种生物可切割聚酯聚合物,其包括聚-l-乳酸、聚-d-乳酸、聚-d,l-乳酸、聚-乙醇酸、聚-d-乳酸-共-乙醇酸、聚-l-乳酸-共-乙醇酸、聚-d,l-乳酸-共-乙醇酸、聚己内酯、聚戊内酯、聚羟基丁酸酯、聚羟基戊酸酯或它们的共聚体,但并不总是限于此。
[0432]
连接剂可以具有约100道尔顿-10,000道尔顿的分子量。此类连接剂的实例包括但不限于二硫代-双-马来酰亚胺乙烷(dtme)、1,8-双-马来酰亚胺二甘醇(bm(peg)2)、三-(2-马来酰亚胺乙基)-胺(tmea)、三-琥珀酰亚胺基氨基三乙酸酯(tsat)、3-臂-聚(乙二醇)(3-臂peg)、马来酰亚胺、n-羟基琥珀酰亚胺(nhs)、乙烯基砜、碘乙酰基、叠氮硝基苯酯、异氰酸酯、吡啶基二硫化物、酰肼和羟基苯基叠氮化物。
[0433]
在本文可以使用具有可切割键的连接剂(如被胞质溶胶的化学环境切割的还原键)或具有不可切割键的连接剂。例如,本公开前述方面的连接剂可以具有不可切割的键,如酰胺键或氨基甲酸酯键。或者,本公开的前述方面的连接剂可具有可切割键,如酸可切割键(例如,酯、腙或缩醛的共价键)、还原剂可切割键(例如,二硫键)、生物可切割键或酶可切割键。在一个实施方案中,可切割的共价接头在细胞内条件下是可切割的。此外,任何可用于药物修饰的连接剂都可用于本公开的上述方面而不受限制。
[0434]
进一步,官能团和连接剂的组合可以包括:(a)在官能团是氨基和硫醇的情况下,连接剂可以是琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯或琥珀酰亚胺基6-([3(2-吡啶基二硫代)丙酰胺基]己酸酯;(b)在官能团是氨基的情况下,连接剂可以是3,3'二硫代二丙酸二-(n-琥珀酰亚胺酯)、二硫代-双(乙烷基1h-咪唑-1-羧酸乙酯),或二硫代-双(乙烷基1h-咪唑-1-羧酸乙酯);(c)当官能团为氨基和炔烃时,连接剂可以是磺基-n-琥珀酰亚胺基3-[[2-(p-叠氮基水杨基氨基)乙烷基]-1,3'-二硫代]丙酸酯;和(d)在官能团y是硫醇的情况下,连接剂是二硫代-双-马来酰亚胺乙烷(dtme);1,8-双-马来酰亚胺二甘醇(bm(peg)2);或二硫代双(磺基琥珀酰亚胺丙酸酯)(dtssp)。
[0435]
在上述制备化合物的方法中,可以包括活化官能团的额外步骤。可用于活化官能团的化合物包括但不限于1-乙基-3,3-二甲基氨基丙基碳二亚胺、咪唑、n-羟基琥珀酰亚胺、二氯己基碳二亚胺、n-β-马来酰亚胺基丙酸、n-β-马来酰亚胺丙基琥珀酰亚胺酯或n-琥珀酰亚胺3-(2-吡啶基二硫代)丙酸酯。
[0436]
单体中间物化合物
[0437]
在各个方面,本公开提供了与共价接头偶联的寡核苷酸,其可用于例如合成具有预定大小和组成的定义的多缀合物寡核苷酸。
[0438]
在一个方面,本公开提供了根据结构1的化合物:
[0439]
x-r1-r2-a-r3-b(结构1)
[0440]
其中:
[0441]
x是通过其3'或5'端与r1键合的核酸;
[0442]
r1为磷酸衍生物、硫代磷酸衍生物、硫酸酯、酰胺、乙二醇或不存在;
[0443]
r2是c2-c10烷基、烷氧基或芳基基团或不存在;
[0444]
a是亲核体和亲电体的反应产物;
[0445]
r3是c2-c10烷基、烷氧基、芳基、烷基二硫基团、醚、硫醚、硫代丙酸酯或二硫化物;和
[0446]
b是用于形成a的亲核体或亲电体(例如硫醇、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基基团)。
[0447]
在一个方面,本公开提供了根据结构2的化合物:
[0448][0449]
其中:
[0450]
x是经由磷酸酯或其衍生物,或硫代磷酸酯或其衍生物在其3'或5'端与r1键合的核酸;
[0451]
每个r1独立地是c2-c10烷基、烷氧基或芳基基团;和
[0452]
r2是硫代丙酸酯或二硫基团。
[0453]
在一个方面,本公开提供了根据结构3的化合物:
[0454]
x-r1-r2-a-r3-b(结构3)
[0455]
其中:
[0456]
x是通过其3'或5'端与r1键合的核酸;
[0457]
r1是磷酸的衍生物如磷酸酯、磷酸二酯、磷酸三酯、膦酸酯、氨基磷酸酯等,硫代磷酸的衍生物如硫代磷酸酯、硫代磷酸二酯、硫代磷酸三酯、硫代氨基磷酸酯等,硫酸酯、酰胺、二醇或不存在;
[0458]
r2是c2-c10烷基、烷氧基或芳基基团或不存在;
[0459]
a是第一和第二反应部分的反应产物;
[0460]
r3是c2-c10烷基、烷氧基、芳基、烷基二硫基团、醚、硫醚、硫代丙酸酯或二硫化物;和
[0461]
b是第三反应部分。
[0462]
在各个方面,本公开还提供了合成与共价接头偶联的寡核苷酸的方法。
[0463]
在一个方面,本公开提供了合成根据结构1的化合物(或适用于合成根据结构2或3的化合物)的方法,该方法包括:
[0464]
使官能化核酸x-r1-r2-a'与共价接头a
”‑
r3-b(其中a'和a”包含亲核体和亲电体)在x-r1-r2-a'的稀溶液中且在化学计量过量的a
”‑
r3-b的情况下反应,从而形成化合物x-r1-r2-a-r3-b(结构1),其中:
[0465]
x是通过其3'或5'端与r1键合的核酸;
[0466]
r1是磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇或不存在;
[0467]
r2是c2-c10烷基、烷氧基或芳基基团或不存在;
[0468]
a是亲核体和亲电体的反应产物;
[0469]
r3是c2-c10烷基、烷氧基、芳基、烷基二硫基团、醚、硫醚、硫代丙酸酯或二硫化物;和
[0470]
b是亲核体或亲电体(例如,硫醇、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基基团)。
[0471]
该方法可以进一步包括如下合成官能化核酸x-r1-r2-a'的步骤,其中a'包含硫醇(-sh):(i)在使用亚磷酰胺寡聚化化学的核酸固相合成期间引入硫醇或(ii)在固相合成期间引入的二硫化物的还原。
[0472]
在多个实施方案中,合成结构1的化合物的方法进一步包括合成结构2的化合物。
[0473]
与共价接头偶联的寡核苷酸可以包括本文所述的任何一种或多种特点,其包括在实施例中的。例如,化合物可以包括本文所述的任何一种或多种核酸(有或没有有修饰)、靶向配体和/或接头,或概述、描述或实施例中所示的任何特定结构或化学。实施例1提供了用于产生硫醇封端的寡核苷酸的实例方法。实施例2提供了用于制备与接头偶联的寡核苷酸的实例方法。
[0474]
在各种实施方案中,结构1、2或3的化合物的合成方法在基本上有利于结构1、2或3的形成和基本上防止x的二聚化的条件下进行。该条件可以提高反应的产量(例如,提高产物的纯度)。
[0475]
在各种实施方案中,结构1、2或3的化合物的合成方法,使官能化核酸x-r1-r2-a'和共价接头a
”‑
r3-b反应的步骤在以下条件下进行:x-r1-r2-a'浓度低于约1mm、500μm、250μm、100μm或50μm。或者,x-r1-r2-a'浓度可以是约1mm、500μm、250μm、100μm或50μm。
[0476]
在各种实施方案中,结构1、2或3的化合物的合成方法,使官能化核酸x-r1-r2-a'和共价接头a
”‑
r3-b反应的步骤在以下条件下进行:a
”‑
r3-b的摩尔过量至少约5、10、15、20、25、30、35、40、45、50或100。或者,a
”‑
r3-b的摩尔过量可以是约5、10、15、20、25、30、35、40、45、50或100。
[0477]
在各种实施方案中,结构1、2或3的化合物的合成方法,使官能化核酸x-r1-r2-a'和共价接头a
”‑
r3-b反应的步骤在以下条件下进行:ph低于约7、6、5或4。或者,ph可以是约7、6、5或4。
[0478]
在各种实施方案中,结构1、2或3的化合物的合成方法,使官能化核酸x-r1-r2-a'和共价接头a
”‑
r3-b反应的步骤在以下条件下进行:在包含水和与水混溶的有机共溶剂的溶液中。与水混溶的有机共溶剂可以包含dmf(二甲基甲酰胺)、nmp(n-甲基-2-吡咯烷酮)、dmso(二甲基亚砜)或乙腈。与水混溶的有机共溶剂可以构成溶液的约10%、15%、20%、25%、30%、40%或50%v(v/v)。
[0479]
在各种实施方案中,寡核苷酸化合物是分离的或基本上纯的。例如,该化合物的纯度可以是至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。在一个实施方案中,寡核苷酸化合物的纯度约为85%-95%。同样,根据本公开的用于合成寡核苷酸化合物和组合物的方法可以产生纯度为至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的产物。在一个实施方案中,寡核苷酸产物的纯度约为85%-95%。制剂纯度可大于或等于50%;纯度大于或等于75%;纯度大于或等于85%;和纯度大于或等于95%。
[0480]
如本文所用,术语“约”根据其简单和普通的含义来使用。例如,“约x”涵盖大约所陈述的x值,其包括在x值的测量误差内的相似量或与x大约相同且具有与x基本相同特性的量。
[0481]
如本文所用,术语“分离的”包括与其他不想要的物质分离的寡核苷酸化合物。分离的寡核苷酸化合物可以以基本上纯的状态合成或与粗反应混合物的其他组分分离,除了可能残留一些量的杂质,其包括粗反应混合物的其他组分的残余量。类似地,纯或基本上纯是指充分地不含杂质以允许其预期用途(例如,在药物制剂中或作为随后化学反应的材料)。x%纯度是指通过相关测量,这可以例如通过分析方法如hplc,该化合物占整个组合物的x%。
[0482]
二聚体化合物和中间体
[0483]
在各个方面,本公开提供了二聚体寡核苷酸。这些化合物包括同二聚体(例如,两个基本上相同的寡核苷酸,例如在体内靶向相同的基因)和异二聚体(例如,两个基本上不同的寡核苷酸,例如不同的序列或在体内靶向不同的基因)
[0484]
在一个方面,本公开提供了根据结构4的分离的化合物:
[0485][0486]
其中:
[0487]
每个都是双链寡核苷酸,其设计为在体内与相同的分子靶物反应,并且
[0488]
●
是共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,并且具有结构-r1-r2-a-r3-a-r2-r1-,其中:
[0489]
每个r1是磷酸的衍生物,如磷酸酯、磷酸二酯、磷酸三酯、膦酸酯、氨基磷酸酯等,硫代磷酸的衍生物,如硫代磷酸酯、硫代磷酸二酯、硫代磷酸三酯、硫代氨基磷酸酯等,
[0490]
硫酸酯、酰胺、乙二醇或不存在;
[0491]
每个r2独立地为c2-c10烷基、烷氧基或芳基基团或不存在;
[0492]
每个a独立地是亲核体和亲电体的反应产物,并且
[0493]
r3是c2-c10烷基、烷氧基、芳基、烷基二硫基团、醚、硫醚、硫代丙酸酯或二硫化物。
[0494]
在一个方面,本公开提供了根据结构5的分离的化合物:
[0495][0496]
其中:
[0497]
是第一单链寡核苷酸
[0498]
是第二单链寡核苷酸,具有与第一不同的序列,并且
[0499]
●
是共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,并且具有结构-r1-r2-a-r3-a-r2-r1-,其中:
[0500]
每个r1是磷酸的衍生物,如磷酸酯、磷酸二酯、磷酸三酯、膦酸酯、氨基磷酸酯等,硫代磷酸的衍生物,如硫代磷酸酯、硫代磷酸二酯、硫代磷酸三酯、硫代氨基磷酸酯等,
[0501]
硫酸酯、酰胺、乙二醇或不存在;
[0502]
每个r2独立地为c2-c10烷基、烷氧基或芳基基团或不存在;
[0503]
每个a独立地是硫醇和马来酰亚胺、硫醇和乙烯基砜、硫醇和吡啶基二硫化物、硫醇和碘乙酰胺、硫醇和丙烯酸酯、叠氮化物和炔烃或胺和羧基的反应产物,和
[0504]
r3是c2-c10烷基、烷氧基、芳基、烷基二硫基团、醚、硫醚、硫代丙酸酯或二硫化物。
[0505]
在一个方面,本公开提供了根据结构6的分离的化合物:
[0506][0507]
其中:
[0508]
是第一双链寡核苷酸
[0509]
是第二双链寡核苷酸,具有与第一不同的序列,并且
[0510]
●
是共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,并且具有结构-r1-r2-a-r3-a-r2-r1-,其中:
[0511]
每个r1是磷酸的衍生物,如磷酸酯、磷酸二酯、磷酸三酯、膦酸酯、氨基磷酸酯等,硫代磷酸的衍生物,如硫代磷酸酯、硫代磷酸二酯、硫代磷酸三酯、硫代氨基磷酸酯等,硫酸酯、酰胺、乙二醇;
[0512]
每个r2独立地为c2-c10烷基、烷氧基或芳基基团或不存在;
[0513]
每个a独立地是硫醇和马来酰亚胺、硫醇和乙烯基砜、硫醇和吡啶基二硫化物、硫醇和碘乙酰胺、硫醇和丙烯酸酯、叠氮化物和炔烃或胺和羧基的反应产物,和
[0514]
r3是c2-c10烷基、烷氧基、芳基、烷基二硫基团、醚、硫醚、硫代丙酸酯或二硫化物。
[0515]
在一个方面,本公开提供了根据结构11的分离的化合物:
[0516][0517]
其中:
[0518]
是双链寡核苷酸,
[0519]
是单链寡核苷酸,并且
[0520]
●
是共价接头,其连接相邻单链寡核苷酸的单链。
[0521]
在各个方面,本公开提供了合成二聚体寡核苷酸的方法。
[0522]
在一个方面,本公开提供了合成结构5的化合物的方法:
[0523][0524]
其中是第一单链寡核苷酸,是与第一单链寡核苷酸具有不同序列的第二单链寡核苷酸,并且
●
共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,该方法包括以下步骤:
[0525]
(i)反应第一单链寡核苷酸与双功能连接部分
○
,其中r1是能够在产生单取代产物的条件下与
○
反应的化学基团;
[0526]
(ii)反应与第二单链寡核苷酸其中r2是能够与
○
反应从而形成的化学基团。
[0527]
该方法可以进一步包括退火互补和以产生结构6的步骤:
[0528][0529]
在一个方面,本公开提供了合成结构4的分离的化合物的方法:
[0530][0531]
其中每个是双链寡核苷酸并且
●
是共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,该方法包括以下步骤:
[0532]
(i)反应第一单链寡核苷酸与双功能连接部分
○
,其中r1是能够与
○
反应的化学基团,从而形成单取代产物
[0533]
(ii)反应与第二单链寡核苷酸其中r2是能够与
○
反应的化学基团,从而形成单链二聚体
[0534]
(iii)同时或顺序地退火单链寡核苷酸,从而形成
[0535]
在一个方面,本公开提供了合成结构4的分离化合物的方法:其中每个是双链寡核苷酸并且
●
是共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,该方法包括以下步骤:
[0536]
(i)通过以下步骤形成
[0537]
(a)退火第一单链寡核苷酸和第二单链寡核苷酸从而形成且与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头
●
的化学部分,从而形成或者
[0538]
(b)反应第二单链寡核苷酸和第三单链寡核苷酸从而形成并且退火第一单链寡核苷酸和从而形成
[0539]
(ii)退火和第四单链寡核苷酸从而形成
[0540]
该方法可适用于根据合成分离的化合物,例如通过省略步骤(ii)。
[0541]
在一个方面,本公开提供了合成结构4的分离化合物的方法:
[0542]
其中每个是双链寡核苷酸并且
●
是共价接头,其在其3'或5'端连接相邻单链寡核苷酸的单链,该方法包括以下步骤,该方法包括以下步骤:
[0543]
(a)退火第一单链寡核苷酸和第二单链寡核苷酸从而形成
[0544]
(b)退火第三单链寡核苷酸和第四单链寡核苷酸从而形成
[0545]
(c)反应和其中r1和r2是能够直接或间接反应形成共价接头
●
的化学部分,从而形成
[0546]
与根据本公开的其他化合物和组合物一样,二聚体化合物和中间物可以包括本文描述的任何一种或多种特点,包括实施例中的特征。例如,化合物可以包括本文所述的任何一种或多种核酸(有或没有修饰)、靶向配体和/或接头,或概述、描述或实施例中所示的任何特定结构或化学。
[0547]
实施例3提供了用于制备二聚化寡核苷酸的实例方法,并且实施例4提供了用于使单链寡核苷酸退火以形成双链寡核苷酸的实例方法。实施例7提供了用于制备可用于上述合成的各种寡核苷酸前体的实例方法。实施例8提供了用于制备各种寡核苷酸多聚体的实例方法,其也可用于上述合成。
[0548]
实施例9和10提供了异二聚体的实例。
[0549]
实施例12-15中提供了同二聚体的实例。
[0550]
在各种实施方案中,r1、r2和双功能连接部分
○
可以形成如本文所述和所示的共价接头
●
。例如,在各种实施方案中,r1和r2可以各自独立地包含反应部分,例如亲电体或亲核体。在一个实施方案中,r1和r2可以各自独立地为硫醇、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基基团。在各种实施方案中,双功能连接部分
○
包含可以根据上述步骤(i)和(ii)顺序反应的两个反应部分,例如可以与r1和r2中的亲电体/亲核体反应的第二亲电体/亲核体。双功能连接部分
○
的实例包括但不限于dtme、bm(peg)2、bm(peg)3、bmoe、bmh或bmb。
[0551]
这些以及本公开的所有其他合成方法可以进一步包括将靶向配体添加至分子的步骤。实施例6提供了用于添加靶向配体(例如,galnac)的实例方法。用于添加靶向配体的其他方法在本领域中是已知的并且可以由本领域技术人员适用于本公开。
[0552]
多聚体化合物和中间物
[0553]
在各个方面,本公开提供了多聚体(n》2)定义的多缀合物寡核苷酸,包括定义的三缀合物和定义的四缀合物。
[0554]
在一个方面,本公开提供了根据结构7或8的化合物:
[0555][0556]
其中:
[0557]
每个都是双链寡核苷酸,
[0558]
每个
●
是共价接头,其连接相邻单链寡核苷酸的单链,并且
[0559]
m是≥1的整数,n为≥0的整数。
[0560]
在一个方面,本公开提供了根据结构9的化合物并且其中n=0:(、在一个方面,本公开提供了根据结构10的化合物并且其中m=1:
[0561]
在一个方面,本公开提供了根据结构12、13、14或15的化合物:
[0562]
[0563]
其中:
[0564]
每个都是双链寡核苷酸,
[0565]
每个都是单链寡核苷酸,
[0566]
每个
●
是共价接头,其连接相邻单链寡核苷酸的单链,并且m是≥1的整数,
[0567]
n为≥0的整数。
[0568]
在各个方面,本公开提供了合成多聚体(n>2)寡核苷酸的方法,包括例如三聚体和四聚体。
[0569]
在一个方面,本公开提供了合成根据结构7或8的化合物的方法:
[0570][0571]
其中:每个是双链寡核苷酸,每个
●
共价接头,其连接相邻单链寡核苷酸的单链,m是≥1的整数,n为≥0的整数,该方法包括以下步骤:
[0572]
(i)通过以下步骤形成
[0573]
(a)退火第一单链寡核苷酸和第二单链寡核苷酸从而形成且反应与第三单链寡核苷酸其中r1和r2是能够直接或间接反应形成共价接头
●
的化学部分,从而形成或者
[0574]
(b)反应第二单链寡核苷酸和第三单链寡核苷酸,从而形成并且退火第一单链寡核苷酸和从而形成
[0575]
(ii)退火和第二单链二聚体从而形成和任选地退火一个或多个额外的单链二聚体至从而形成,
[0576]
或者其中m是≥1的整数,n为≥0的整数;和
[0577]
(iii)退火第四个单链寡核苷酸至步骤(ii)的产物,从而形成结构7或8。
[0578]
在一个方面,本公开提供了合成根据结构7或8的化合物的方法:
[0579][0580]
其中:每个是双链寡核苷酸,每个
●
是共价接头,其连接相邻单链寡核苷酸的单链,m是≥1的整数,n为≥0的整数,该方法包括以下步骤:
[0581]
(i)退火第一单链寡核苷酸和第一单链二聚体从而形成
[0582]
(ii)退火和第二单链二聚体从而形成和任选地退火一个或多个额外的单链二聚体至从而形成,
[0583]
或者其中m是≥1的整数,n为≥0的整数;和
[0584]
(iii)退火第二单链寡核苷酸至步骤(ii)的产物,从而形成结构7或8。
[0585]
在一个方面,本发明提供了合成结构9的化合物的方法:
[0586]
其中每个是双链寡核苷酸,每个
●
是共价接头,其连接相邻单链寡核苷酸的单链,该方法包括以下步骤:
[0587]
(i)通过以下步骤形成
[0588]
(a)退火第一单链寡核苷酸和第二单链寡核苷酸从而形成且反应和第三单链寡核苷酸其中r1和r2是能够直接或间接反应形成共价接头
●
的化学部分,从而形成或者
[0589]
(b)反应第二单链寡核苷酸和第三单链寡核苷酸从而形成并且退火第一单链寡核苷酸和从而形成
[0590]
(ii)退火和单链二聚体从而形成以及
[0591]
(iii)退火和第四单链寡核苷酸从而形成
[0592]
在一个方面,本公开提供了合成结构10的化合物的方法:其中每个是双链寡核苷酸,每个
●
是共价接头,其连接相邻单链寡核苷酸的单链,该方法包括以下步骤的:
[0593]
(i)通过以下步骤形成
[0594]
(a)退火第一单链寡核苷酸和第二单链寡核苷酸从而形成且反应与第三单链寡核苷酸其中r1和r2是能够直接或间接反应形成共价接头
●
的化学部分,从而形成或者
[0595]
(b)反应第二单链寡核苷酸和第三单链寡核苷酸从而形成并且退火第一单链寡核苷酸和从而形成
[0596]
(ii)退火和单链二聚体从而形成
[0597]
(iii)退火和第二单链二聚体从而形成和
[0598]
(iv)退火和第四单链寡核苷酸从而形成
[0599]
与根据本公开的其他化合物和组合物一样,多聚体化合物及其中间物可以包括本文描述的任何一种或多种特点,其包括实施例中的特点。例如,化合物可以包括本文所述的任何一种或多种核酸(有或没有修饰)、靶向配体和/或接头,或概述、描述或实施例中所示的任何特定结构或化学。
[0600]
实施例7提供了用于制备可用于上述合成的各种寡核苷酸前体的实例方法。实施例8提供了用于制备各种寡核苷酸多聚体的实例方法,其也可用于上述合成。
[0601]
在各种实施方案中,r1、r2和双功能连接部分
○
可以形成如本文所述和所示的共价接头
●
。例如,在各种实施方案中,r1和r2可以各自独立地包含反应部分,例如亲电体或亲核体。在一个实施方案中,r1和r2可以各自独立地为硫醇、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基。在各种实施方案中,双功能连接部分
○
包含可以根据上述步骤(i)和(ii)顺序反应的两个反应部分,例如可以与r1和r2中的亲电体/亲核体反应的第二亲电体/亲核体。双功能连接部分
○
的实例包括但不限于dtme、bm(peg)2、bm(peg)3、bmoe、bmh或bmb。
[0602]
在包含两个或更多个共价接头
●
的各种实施方案中(例如,在结构7-16中),接头都是相同的。或者,化合物或组合物可包含两种或更多种不同的共价接头
●
。
[0603]
在各种实施方案中,每个可以独立地包含两个有义或两个反义寡核苷酸。例如,在sirna的情况下,可以包含两条活性链或两条随从链。
[0604]
在各种实施方案中,每个可以独立地包含一种有义和一种反义寡核苷酸。例如,在sirna的情况下,可以包含一条活性链和一条随从链。
[0605]
在各种实施方案中,化合物或组合物包含基本相同的双链寡核苷酸的同多聚体。基本上相同的双链寡核苷酸可各自包含在体内靶向相同分子靶物的sirna。
[0606]
在各种实施方案中,化合物或组合物包含两个或更多个显著不同的双链寡核苷酸的异多聚体。基本上不同的双链寡核苷酸可以各自包含靶向不同基因的sirna。
[0607]
在各种实施方案中,该化合物包含结构9和n=0:在各种实施方案中,该化合物包含结构9和n=0:该化合物可以进一步包含靶向配体。该化合物可以进一步包含2或3个基本上不同的双链寡核苷酸每个包含在体内靶向不同分子靶物的sirna。该化合物可以进一步包含靶向配体,一个其包含靶向因子vii的第一sirna引导链和与引导链杂交的第一随从链,一个其包含靶向载脂蛋白b的第二sirna引导链和杂交到第二引导链的第二随从链,和一个其包含靶向ttr的第三sirna引导链和与第三引导链杂交的第三随从链。靶向配体可以包含n-乙酰半乳糖胺(galnac)。
[0608]
实施例17、18和20中提供了三聚体寡核苷酸的实例。
[0609]
在各种实施方案中,该化合物包含结构10和m=1:
该化合物可以进一步包含靶向配体。该化合物可以进一步包含2、3或4个基本上不同的双链寡核苷酸每一个都包含在体内靶向不同分子靶物的sirna。该化合物可以进一步包含靶向配体,一个其包含靶向因子vii的第一sirna引导链和与引导链杂交的第一随从链,一个其包含靶向载脂蛋白b的第二sirna引导链和杂交到第二引导链的第二随从链,和一个其包含靶向ttr的第三sirna引导链和与第三引导链杂交的第三随从链。靶向配体可以包含n-乙酰半乳糖胺(galnac)。
[0610]
实施例21中提供了四聚体寡核苷酸的实例。
[0611]
在各种实施方案中,每个双链寡核苷酸(例如,例如在结构4中)包含靶向因子vii的sirna引导链和与引导链杂交的随从链。
[0612]
在各种实施方案中(例如,在结构4中),该化合物进一步包含靶向配体,每个双链寡核苷酸(例如,)包含sirna引导链和与该引导链杂交的随从链,并且该化合物的纯度为至少75、80、85、90、95、96、97、98、99或100%。
[0613]
在各种实施方案中,至少一个双链寡核苷酸(例如,例如在结构6中)包含靶向因子vii的第一sirna引导链和与引导链杂交的第一随从链,以及至少一个双链寡核苷酸(例如,例如结构6)包含靶向载脂蛋白b的第二sirna引导链和与第二引导链杂交的第二随从链。
[0614]
具有增加的体内循环半衰期和/或活性的寡核苷酸
[0615]
本公开提供了具有增加的体内循环半衰期和/或活性的多聚体寡核苷酸,以及包括多聚体寡核苷酸的组合物以及它们的合成和使用方法。
[0616]
在各个方面,本公开提供了包含结构21的多聚体寡核苷酸:
[0617][0618]
其中每个单体亚基独立地是单链或双链寡核苷酸,m是≥1的整数,每个
●
是连接相邻单体亚基的共价接头,并且至少一个单体亚基包含单链,该单链具有连接至其3'末端的一个共价接头
●
和连接至其5'末端的另一个共价接头。
[0619]
在各个方面,本公开提供了包含结构21的多聚体寡核苷酸:
[0620][0621]
其中每个单体亚基独立地是单链或双链寡核苷酸,每个
●
是连接相邻单体亚基的共价接头,并且m是≥0的整数,选择m以(a)相对于单个单体亚基增加多聚体寡核苷酸的体内循环半衰期和/或(b)相对于单个单体亚基增加多聚体寡核苷酸的体内活性。
[0622]
在各个方面,本公开提供了一种包含结构21的多聚体寡核苷酸:
[0623][0624]
其中每个单体亚基独立地是单链或双链寡核苷酸,每个
●
都是连接相邻单体亚基的共价接头,m是≥0的整数,并且其中多聚体寡核苷酸具有被配置来(a)相对于单个单体亚基增加多聚体寡核苷酸的体内循环半衰期和/或(b)相对于单个单体亚基增加多聚体寡核苷酸的体内活性的分子大小和/或重量。
[0625]
在各个方面,本公开提供了用于增加一种或多种寡核苷酸的体内循环半衰期和/或体内活性的方法,该方法包括以包含结构21的多聚体寡核苷酸的形式向受试者施用一种或多种寡核苷酸:
[0626][0627]
其中每个单体亚基独立地是单链或双链寡核苷酸,每个
●
是连接相邻单体亚基的共价接头,并且m是≥0的整数,选择m以(a)相对于单个单体亚基增加多聚体寡核苷酸的体内循环半衰期和/或(b)相对于单个单体亚基增加多聚体寡核苷酸的体内活性。
[0628]
在各个方面,本公开提供了用于增加一种或多种寡核苷酸的体内循环半衰期和/或体内活性的方法,该方法包括以包含结构21的多聚体寡核苷酸的形式向受试者施用一种或多种寡核苷酸:
[0629][0630]
其中每个单体亚基独立地是单链或双链寡核苷酸,每个
●
都是连接相邻单体亚基的共价接头,m是≥0的整数,并且其中多聚体寡核苷酸具有被配置来(a)相对于单个单体亚基增加多聚体寡核苷酸的体内循环半衰期和/或(b)相对于单个单体亚基增加多聚体寡核苷酸的体内活性的分子大小和/或重量。
[0631]
在各个方面,本公开提供了多聚体寡核苷酸,其包含m个单体亚基其中每个单体亚基独立地是单链或双链寡核苷酸,每个单体亚基经由共价接头
●
与另一个单体亚基连接,并且m是≥3的整数,选择m以(a)相对于单个单体亚基增加多聚体寡核苷酸的体内循环半衰期和/或(b)相对于单个单体亚基增加多聚体寡核苷酸的体内活性。
[0632]
在各个方面,本公开提供了多聚体寡核苷酸,其包含m个单体亚基其中每个单体亚基独立地是单链或双链寡核苷酸,每个单体亚基经由共价接头
●
与另一个单体亚基连接,并且m是≥3的整数,并且多聚体寡核苷酸具有被配置来(a)相对于单个单体亚基增加多聚体寡核苷酸的体内循环半衰期和/或(b)相对于单个单体亚基增加多聚体寡核苷酸的体内活性的分子大小和/或重量。
[0633]
在各种实施方案中,该增加与多聚体寡核苷酸的单体亚基的循环半衰期和/或活性有关。循环半衰期(及其与其他特性如肾小球滤过的关系)在寡核苷酸摄取和清除部分以及下文实施例25和37中进一步详细讨论。在各种实施方案中,体内循环半衰期增加至少2、
3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、500或1,000倍。体内循环半衰期可以增加至少2倍。体内循环半衰期可以增加至少10倍。在各种实施方案中,体内活性的增加被测量为t
max
时的体内活性比率。在各种实施方案中,体内活性增加至少2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、500或1,000倍。体内活性可以增加至少2倍。体内活性可以增加至少10倍。在一个实施方案中,增加是在小鼠中。在一个实施方案中,增加是在人中。
[0634]
在各种实施方案中,m是1、2、3、4、5、6、7、8、9、10、11或12。
[0635]
在各种实施方案中,m是0、1、2、3、4、5、6、7、8、9、10、11或12。
[0636]
在各种实施方案中,每个单体亚基包含sirna并且每个共价接头连接sirna的有义链。
[0637]
在各种实施方案中,每个共价接头
●
连接两个单体亚基
[0638]
在各种实施方案中,至少一个共价接头
●
连接三个或更多单体亚基
[0639]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸且m为1:
[0640][0641]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸m是1,并且每个共价接头
●
都在同一链上:
[0642][0643]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸m为2:
[0644][0645][0646]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸并且m为2,并且每个共价接头
●
位于同一链上:
[0647][0648]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸m为3、4、5、6、7、8、9、10、11或12。
[0649]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸m是3、4、5、6、7、8、9、10、11或12,并且每个共价接头
●
都在同一链上。
[0650]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸m≥13。
[0651]
在各种实施方案中,每个单体亚基独立地是双链寡核苷酸m≥13,并且每个共价接头
●
在同一链上。在各种实施方案中,结构21是结构22或23:
[0652][0653]
其中每个是双链寡核苷酸,每个
●
是连接相邻双链寡核苷酸的共价接头,m是≥1的整数,n为≥0的整数。
[0654]
在各种实施例中,结构21不是pct/us2016/037685中公开的结构。
[0655]
在各种实施方案中,每个寡核苷酸是单链寡核苷酸。
[0656]
在各种实施方案中,每个寡核苷酸是双链寡核苷酸。
[0657]
在各种实施方案中,寡核苷酸包含单链和双链寡核苷酸的组合。
[0658]
在各种实施方案中,多聚体寡核苷酸包含线性结构,其中在每个共价接头
●
连接两个单体亚基
[0659]
在各种实施方案中,多聚体寡核苷酸包含分支结构,其中至少一个共价接头
●
连接三个或更多单体亚基例如,结构21可能是
[0660]
在各种实施方案中,每个单体亚基独立地是单链寡核苷酸在一些此类实施方案中,m是1个m是2个m是3个m是4个或m是5个在一些此类的实施方案中,m是6、7、8、9、10、11或12。在一些此类实施方案中,m是≥13的整数。在一个此类实施方案中,至少一个单链寡核苷酸是反义寡核苷酸。在一个此类实施方案中,每个单链寡核苷酸独立地是反义寡核苷酸。
[0661]
在各种实施方案中,多聚体寡核苷酸包含基本上相同的寡核苷酸的同多聚体。基本上相同的寡核苷酸可以是体内靶向相同分子靶物的sirna。基本上相同的寡核苷酸可以是体内靶向相同分子靶物的mirna。基本上相同的寡核苷酸可以是体内靶向相同分子靶物的反义rna。基本上相同的寡核苷酸可以是在体内靶向相同的分子靶物的sirna、mirna和/或反义rna的组合。
[0662]
在各种实施方案中,多聚体寡核苷酸包含两种或更多种显著不同的寡核苷酸的异
多聚体。实质上不同的寡核苷酸可以是在体内靶向不同分子靶物的sirna。显著不同的寡核苷酸可以是在体内靶向不同分子靶物的mirna。基本上不同的寡核苷酸可以是在体内靶向不同分子靶物的反义rna。基本上不同的寡核苷酸可以是在靶向体内不同的分子靶物的sirna、mirna和/或反义rna的组合。
[0663]
聚乙二醇(peg)等聚合物接头可用于增加某些药物的循环半衰期。此类途径可能具有缺点,包括“稀释”治疗剂(例如,每单位质量的活性剂较少)。本公开可以区别于此类方法。例如,在各种实施方案中,多聚体寡核苷酸不包含peg。在各种实施方案中,多聚体寡核苷酸不包含聚醚化合物。在各种实施方案中,多聚体寡核苷酸不包含除寡核苷酸之外的聚合物。
[0664]
纳米颗粒(np),如脂质纳米颗粒(lnp),已被用于尝试增加某些药物的循环半衰期。此类方法可能具有缺点,包括增加的毒性(例如,来自阳离子脂质)。本公开可以区别于此类方法。例如,在各种实施方案中,多聚体寡核苷酸未配制在np或lnp中。
[0665]
此外,硫代磷酸酯基团已被用于增加某些药物的循环半衰期。此类方法可能具有缺点,包括较低的活性(例如,由于寡核苷酸/血浆蛋白聚集)。本公开可以区别于此类方法。例如,在各种实施方案中,多聚体寡核苷酸不包含硫代磷酸酯。
[0666]
在各种实施方案中,多聚体寡核苷酸进一步包含靶向配体。在各种实施方案中,多聚体寡核苷酸基本上由结构21和任选的靶向配体组成。多聚体寡核苷酸可包含本文讨论的任何靶向配体(参见例如下文的靶向配体部分)。在各种实施方案中,靶向配体缀合至寡核苷酸,例如,靶向配体可以通过其3'或5'端与寡核苷酸缀合。
[0667]
多聚体寡核苷酸可以包含本文讨论的任何接头(参见例如上面的接头部分)。在各种实施方案中,每个共价接头
●
是相同的。在各种实施方案中,多聚体寡核苷酸包含两个或更多个不同的共价接头
●
。在各种实施方案中,一种或多种共价接头
●
包含可切割的共价接头。在某些情况下,可切割接头可能特别有利。例如,细胞内切割可以在细胞靶向和进入后将单个多聚体寡核苷酸转化为多个生物活性寡核苷酸(例如,单个sirna构建体可以递送四种或更多种活性sirna),从而提高效力并减少不希望的副作用。
[0668]
在各种实施方案中,一种或多种共价接头
●
包含核苷酸接头(例如,可切割的核苷酸接头,例如uuu)。或者,在一些实施方案中,多聚体寡核苷酸明确地排除核苷酸接头。
[0669]
在各种实施方案中,该化合物是分离的或基本上纯的。例如,该化合物的纯度可以是至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。在一个实施方案中,该化合物的纯度约为85%-95%。同样地,用于合成根据本公开的化合物和组合物的方法可以产生至少产物的纯度为至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。在一种实施方式中,产物的纯度为约85-95%。制剂纯度可大于或等于50%;纯度大于或等于75%;纯度大于或等于85%;和纯度大于或等于95%。
[0670]
在各种实施方案中,每个寡核苷酸是rna、dna或包含人工或非天然核酸类似物。在各种实施方案中,至少一种寡核苷酸是sirna、mirna或反义寡核苷酸。例如,在上面的核酸部分中讨论了各种其他可能的寡核苷酸和取代。
[0671]
在各种实施方案中,每个寡核苷酸的长度为15-30、17-27、19-26或20-25个核苷酸。在各种实施方案中,寡核苷酸的长度为15-30、17-27、19-26、20-25、40-50、40-150、100-300、1000-2000或多达10000个核苷酸。
[0672]
在各种实施方案中,包含结构21的多聚体寡核苷酸具有分子量为至少约40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64或65kd。在各种实施方案中,包含结构21的多聚体寡核苷酸具有分子量为至少约40-45、45-50、50-55、55-60、60-65、65-70或70-75kd。分子量可以包括与多聚体寡核苷酸共价结合的所有,例如靶向配体和接头。
[0673]
尽管包含结构21的多聚体寡核苷酸可以通过各种方法合成(例如,本文描述的用于制备四聚体或更大多聚体的方法),但某些结果可能需要特定的方法。例如,以下方法(以及实施例22中所示的方法)旨在有效地产生在同一链上具有每个共价接头
●
的多聚体。
[0674]
例如,在一个方面,本公开提供了合成包含结构34的多聚体寡核苷酸的方法:
[0675][0676]
其中每个是单链寡核苷酸并且每个
●
是连接相邻单链寡核苷酸的共价接头,该方法包括以下步骤:
[0677]
(i)反应和其中
○
是连接部分并且r1是能够与连接部分
○
反应从而形成的化学基团,并且
[0678]
(ii)任选地退火与互补单链寡核苷酸,从而形成
[0679]
例如,在一个方面,本公开提供了合成包含结构35的多聚体寡核苷酸的方法:
[0680][0681]
其中每个是单链寡核苷酸并且每个
●
是连接相邻单链寡核苷酸的共价接头,该方法包括以下步骤:
[0682]
(i)反应和其中
○
是连接部分并且r1是能够与连接部分反应的化学基团
○
,从而形成和
[0683]
(ii)任选地退火与互补的单链寡核苷酸,从而形成
[0684]
例如,在一个方面,本公开提供了一种合成包含结构37的多聚体寡核苷酸的方法:
[0685][0686]
其中每个是单链寡核苷酸并且每个
●
是连接相邻单链寡核苷酸的共价接头,该方法包括以下步骤:
[0687]
(i)反应和其中
○
是连接部分,r1是能够与连接部分
○
反应的化学基团,从而形成和
[0688]
(ii)任选地退火
与互补的单链寡核苷酸,从而形成
[0689]
本公开还提供了用于合成单链多聚体寡核苷酸的方法,例如其中m是2米是4m是6、7、8、9、10、11或12;或m≥13(参见下面的实施例22)。
[0690]
多聚体化合物可以包括本文公开的任何一种或多种特征。例如,化合物可以包括本文所述的任何一种或多种核酸(具有或不具有修饰)、靶向配体和/或接头,或概述、描述或实施例中所示的任何特定结构或化学。同样,化合物可以制备成概述、描述或实施例中所示的组合物(例如,用于实验或医学用途)。下面的药物组合物部分提供了说明性实施例。
[0691]
寡核苷酸摄取和清除
[0692]
药物在血流中的生物利用度可以表征为靶细胞摄取与肾清除之间的平衡。从实践的角度来看,体内循环半衰期和/或体内活性是肾清除/肾小球滤过的良好代表,因为它们可以很容易地量化和测量,并且因为它们的改善(例如,增加)可以与改善的药效学和/或药代动力学相关联。
[0693]
血液中治疗剂如寡核苷酸(ont)的摄取率是多种因素的函数,其可表示为:摄取率=f{(ont浓度)x(血流速率)x(受体拷贝数/细胞)x(细胞数)x(平衡解离常数kd)x(内化率)}。对于给定的配体/受体对、拷贝数、kd、细胞数和内化率将是恒定的。这可以解释为什么galnac配体系统对肝细胞如此有效——它靶向以高拷贝数存在的asgp受体。一些asgp/galnac变体的kd在纳摩尔范围内,且内化率非常高。
[0694]
然而,有效的靶向也取决于ont浓度,由于从血流中清除,该浓度会随着时间迅速降低。治疗剂的清除率可以表示为:清除率=f{(血液流速)x(肾滤过率)x(其他清除机制)}。在时间t得到的ont浓度可以表示为:(ont浓度)t=f{(初始浓度)-(清除率x t)}。
[0695]
在人类中,清除主要是由于肾中的肾小球滤过。通常,小于约45kd的分子具有约30分钟的半衰期。在小鼠中,清除率甚至更快,循环半衰期约为5分钟。不希望受任何特定理论的束缚,相信本公开可以使用特定配置的多聚体寡核苷酸(例如,特定的组成、大小、重量等)来减少肾小球滤过,从而导致较低的清除率,从而导致在给定时间t循环中更高的ont浓度(例如,增加的血清半衰期、更高的总体摄取和更高的活性)。
[0696]
同样,不希望受任何特定理论的束缚,实际肾小球滤过率可能难以直接测量。例如,通过肾小球毛细血管的化合物很容易被如肾小管上皮细胞的细胞吸收,这些细胞可以在很长一段时间内保留如sirna之类的化合物(参见,例如,henry,s.p.et al;toxicology,301,13-20(2012)和van de water,f.m et al;drug metabolism and disposition,34,no 8,1393-1397(2006))。此外,吸收的化合物可以代谢为分解产物,然后从尿液中排出。因此,治疗剂例如sirna在特定时间点的浓度(例如,在尿液中)可能不一定代表肾小球滤过率。然而,与肾小球滤过有关且可直接测量的血清半衰期可被认为是肾小球滤过的合适代表。
[0697]
下面的表1显示了增加组分的循环半衰期(t
1/2
)可能对在时间t时组分的最终浓度产生的显著影响:
[0698]
表1
–
增加循环半衰期(t
1/2
)在时间t对浓度的影响。
and practice of pharmacy,eds.gennado et al.21th ed.,lippincott,williams&wilkins,2005)。
[0709]
药物组合物包括有效量的根据本公开的寡核苷酸化合物或组合物。如本文所用,“有效量”可以是导致实现特定陈述目的的浓度或量,或更多量是指足以引起变化的量,例如与安慰剂相比。在有效量是“治疗有效量”的情况下,它可以是足以用于治疗用途的量,例如足以预防、诊断、缓解、治疗或治愈疾病的量。有效量可以通过本领域已知的方法确定。有效量可以根据经验确定,例如通过人临床试验。使用本领域已知的转换因子,还可以从一种动物(例如小鼠、大鼠、猴、猪、狗)推断有效量以用于另一种动物(例如人)。参见,例如,freireich et al.,cancer chemother reports 50(4):219-244(1966)。
[0710]
缀合物、功能部分、递送媒介物和靶向配体
[0711]
在各个方面,多聚体寡核苷酸可以包含一种或多种缀合物、功能部分、递送媒介物和靶向配体。设计各种缀合部分以增加或增强多聚体寡核苷酸的活性或功能。
[0712]
在各个方面,本公开提供了在递送媒介物中配制的任何一种或多种上述寡核苷酸化合物或组合物。例如,递送媒介物可以是脂质纳米颗粒(lnp)、外泌体、微泡或病毒载体。
[0713]
在各个方面,本公开提供了上述任何一种或多种寡核苷酸化合物或组合物,并且进一步包含靶向配体或功能部分。例如,靶向配体包含亲脂部分,如磷脂、适体、肽、抗原结合蛋白、小分子、维生素、n-乙酰半乳糖胺(galnac)、胆固醇、生育酚、叶酸和其他叶酸受体结合配体,甘露糖和其他甘露糖受体结合配体、2-[3-(1,3-二羧丙基)-脲基]戊二酸(dupa)、茴香酰胺、内体逃逸部分(eem)或免疫刺激剂。在一些实施方案中,galnac部分可以是单触角型galnac、双触角型galnac或三触角型galnac。
[0714]
肽靶向配体可以包含肿瘤靶向肽,如aprpg、cngr(cngrcvsgcagrc)、f3(kdepqrrsarlsakpappkpepkpkkapakk)、cgkrk和irgd(crgdkgpdc)。
[0715]
免疫刺激剂可以是cpg寡核苷酸,例如
[0716]
tcgtcgttttgtcgttttgtcgtt(seq id no:x)或
[0717]
ggtgcatcgatgcaggggg(seq id no:y)的cpg寡核苷酸。
[0718]
抗原结合蛋白可以包含单链可变片段(scfv)或vhh抗原结合蛋白。
[0719]
亲脂部分可以是包括阳离子基团的配体。在某些实施方案中,亲脂部分是胆固醇、维生素e、维生素k、维生素a、叶酸或阳离子染料(例如cy3)。其他亲脂性部分包括胆酸、金刚烷乙酸、1-芘丁酸、二氢睾酮、1,3-双-o(十六烷基)甘油、牻牛儿基氧基己基基团、十六烷基甘油、冰片、薄荷醇、1,3-丙二醇、十七烷基基团、棕榈酸酸、肉豆蔻酸、o3-(油酰基)石胆酸、o3-(油酰基)胆酸、二甲氧基三苯甲基或吩恶嗪。
[0720]
在各个方面,靶向配体或功能部分是脂肪酸,如胆固醇、石胆酸(lca)、二十碳五烯酸(epa)、二十二碳六烯酸(dha)和二十二酸(dca)、类固醇、开环甾类化合物、脂质、神经节苷脂或核苷类似物、内源性大麻素和/或维生素如胆碱、维生素a、维生素e及其衍生物或代谢物,或维生素如视黄酸和α-生育酚琥珀酸酯。
[0721]
内体逃逸部分(eem)可用于促进已被细胞内吞的多聚体寡核苷酸的内体逃逸。内体逃逸部分通常是基于脂质或氨基酸的,但可以包含破坏内体以释放多聚体寡核苷酸的其他化学实体。eem的实例包括但不限于氯喹、具有含有疏水氨基酸r基团的基序的肽和蛋白质以及流感病毒血凝素(ha2)。lonn et al.,scientific reports,6:32301,2016中描述了
138(2009);kanasty,r.,dorkin,j.r.,vegas,a.&anderson,d.delivery materials for sirna therapeutics.nature materials,12:967-977(2013);tibbitt,m.w.,dahlman,j.e.&langer,r.emerging frontiers in drug delivery.j am chem soc,138:704-717(2016);akinc,a.,et al.targeted delivery of rnai therapeutics with endogenous and exogenous ligand-based mechanisms.molecular therapy:the journal of the american society of gene therapy 18,1357-1364(2010);nair,j.k.,et al.multivalent n-acetylgalactosamine-conjugated sirna localizes in hepatocytes and elicits robust rnai-mediated gene silencing.j am chem soc,136:16958-16961(2014);ostergaard,m.e.,et al.efficient synthesis and biological evaluation of 5
’‑
galnac conjugated antisense oligonucleotides.bioconjugate chemistry(2015);sehgal,a.,et al.an rnai therapeutic targeting antithrombin to rebalance the coagulation system and promote hemostasis in hemophilia.nature medicine,21:492-497(2015);semple,s.c.,et al.rational design of cationic lipids for sirna delivery.nat biotechnol,28:172-176(2010);maier,m.a.,et al.biodegradable lipids enabling rapidly eliminated lipid nanoparticles for systemic delivery of rnai therapeutics.molecular therapy:the journal of the american society of gene therapy,21:1570-1578(2013);love,k.t.,et al.lipid-like materials for low-dose,in vivo gene silencing.proc nat acad usa,107:1864-1869(2010);akinc,a.,et al.a combinatorial library of lipid-like materials for delivery of rnai therapeutics.nat biotechnol,26:561-569(2008);eguchi,a.,et al.efficient sirna delivery into primary cells by a peptide transduction domain-dsrna binding domain fusion protein.nat biotechnol,27:567-571(2009);zuckerman,j.e.,et al.correlating animal and human phase ia/ib clinical data with calaa-01,a targeted,polymer-based nanoparticle containing sirna.proc nat acad usa,111:11449-11454(2014);zuckerman,j.e.&davis,m.e.clinical experiences with systemically administered sirna-based therapeutics in cancer.nature reviews.drug discovery,14:843-856(2015);hao,j.,et al.rapid synthesis of a lipocationic polyester library via ring-opening polymerization of functional valerolactones for efficacious sirna delivery.j am chem soc,29:9206-9209(2015);siegwart,d.j.,et al.combinatorial synthesis of chemically diverse core-shell nanoparticles for intracellular delivery.proc nat acad usa,108:12996-13001(2011);dahlman,j.e.,et al.in vivo endothelial sirna delivery using polymeric nanoparticles with low molecular weight.nat nano 9,648-655(2014);soppimath,k.s.,aminabhavi,t.m.,kulkarni,a.r.&rudzinski,w.e.biodegradable polymeric nanoparticles as drug delivery devices.journal of controlled release:official journal of the controlled release society 70,1-20(2001);kim,h.j.,et al.precise engineering of sirna delivery vehicles to tumors using polyion complexes and gold nanoparticles.acs nano,8:8979-8991(2014);krebs,
m.d.,jeon,o.&alsberg,e.localized and sustained delivery of silencing rna from macroscopic biopolymer hydrogels.j am chem soc 131,9204-9206(2009);zimmermann,t.s.,et al.rnai-mediated gene silencing in non-human primates.nature,441:111-114(2006);dong,y.,et al.lipopeptide nanoparticles for potent and selective sirna delivery in rodents and nonhuman primates.proc nat acad usa,111:3955-3960(2014);zhang,y.,et al.lipid-modified aminoglycoside derivatives for in vivo sirna delivery.advanced materials,25:4641-4645(2013);molinaro,r.,et al.biomimetic proteolipid vesicles for targeting inflamed tissues.nat mater(2016);hu,c.m.,et al.nanoparticle biointerfacing by platelet membrane cloaking.nature,526:118-121(2015);cheng,r.,meng,f.,deng,c.,klok,h.-a.&zhong,z.dual and multi-stimuli responsive polymeric nanoparticles for programmed site-specific drug delivery.biomaterials,34:3647-3657(2013);qiu,y.&park,k.environment-sensitive hydrogels for drug delivery.advanced drug delivery reviews,64,supplement,49-60(2012);mui,b.l.,et al.influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of sirna lipid nanoparticles.mol ther nucleic acids 2,e139(2013);draz,m.s.,et al.nanoparticle-mediated systemic delivery of sirna for treatment of cancers and viral infections.theranostics,4:872-892(2014);otsuka,h.,nagasaki,y.&kataoka,k.pegylated nanoparticles for biological and pharmaceutical applications.advanced drug delivery reviews,55:403-419(2003);kauffman,k.j.,et al.optimization of lipid nanoparticle formulations for mrna delivery in vivo with fractional factorial and definitive screening designs.nano letters,15:7300-7306(2015);zhang,s.,zhao,b.,jiang,h.,wang,b.&ma,b.cationic lipids and polymers mediated vectors for delivery of sirna.journal of controlled release 123,1-10(2007);illum,l.&davis,s.s.the organ uptake of intravenously administered colloidal particles can be altered using a non-ionic surfactant(poloxamer 338).febs letters,167:79-82(1984);felgner,p.l.,et al.improved cationic lipid formulations for in vivo gene therapy.annals of the new york academy of sciences,772:126-139(1995);meade,b.r.&dowdy,s.f.exogenous sirna delivery using peptide transduction domains/cell penetrating peptides.advanced drug delivery reviews,59:134-140(2007);endoh,t.&ohtsuki,t.cellular sirna delivery using cell-penetrating peptides modified for endosomal escape.advanced drug delivery reviews,61:704-709(2009);和lee,h.,et al.molecularly self-assembled nucleic acid nanoparticles for targeted in vivo sirna delivery.nat nano,7:389-393(2012)。
[0729]
在各种实施方案中,本公开的化合物和组合物可以与其他化学或生物部分,包括例如生物活性部分缀合或一起递送。生物活性部分是具有生物效应,如可测量的生物效应的任何分子或试剂。化学或生物部分包括例如蛋白质、肽、氨基酸、核酸(包括例如dna、所有类型的rna、rna和dna适体、反义寡核苷酸和反义mirna抑制剂)、靶向配体、碳水化合物、多
糖、脂类、有机化合物和无机化合物。
[0730]
如本文所用,术语靶向配体可包括可在纳米颗粒表面上接近或作为递送缀合物(例如,多缀合物寡核苷酸、多聚体寡核苷酸)的一部分的部分,目的是例如通过使纳米颗粒或递送缀合物能够附着细胞受体来递送该纳米颗粒的有效载荷或递送缀合物到特定靶,如特定的身体组织或细胞类型。合适的靶向配体的实例包括但不限于细胞特异性肽或蛋白质(例如转铁蛋白和单克隆抗体)、适体、细胞生长因子、维生素(例如叶酸)、单糖(例如半乳糖和甘露糖)、多糖、精氨酸-甘氨酸-天冬氨酸(rgd)和衍生自n-乙酰半乳糖胺(galnac)的去唾液酸糖蛋白受体配体。可以使用本领域已知的多种技术将配体结合到本公开的前述化合物中,如经由共价键如二硫键、酰胺键或酯键或经由非共价键如生物素-链霉亲和素或金属-配体复合物。
[0731]
本公开范围内的额外生物活性部分是任何已知的基因编辑材料,其包括材料例如涉及crispr/cas系统、tales、talen和锌指核酸酶(zfn)的寡核苷酸、多肽和蛋白质。
[0732]
在各种实施方案中,本公开的化合物和组合物可以封装在载体材料中以形成用于细胞内递送的纳米颗粒。已知的载体材料包括阳离子聚合物、脂质或肽或其化学类似物。jeong et al.,bioconjugate chem.,vol.20,no.1,pp.5-14(2009)。阳离子脂质的实例包括二油基磷脂酰乙醇胺、胆固醇二油基磷脂酰胆碱、n-[1-(2,3-二油酰氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、1,2-二油酰氧基-3-(三甲基铵基))丙烷(dotap)、1,2-二油酰基-3-(4'-三甲基-铵基)丁酰基-sn-甘油(dotb)、1,2-二酰基-3-二甲基铵基-丙烷(dap)、1,2-二酰基-3-三甲基铵基-丙烷(tap)、1,2-二酰基-sn-甘油-3-乙基磷酸胆碱、3beta-[n-(n',n'-二甲基氨基乙烷)-氨基甲酰基]胆固醇(dc-胆固醇)、二甲基二十八烷基溴化铵(ddab)及其共聚物。阳离子聚合物的实例包括聚乙烯亚胺、多胺、聚乙烯胺、聚(烷基胺盐酸盐)、聚乙二胺树枝状聚合物、二乙基氨基乙基-葡聚糖、聚乙烯吡咯烷酮、甲壳质、壳聚糖和聚(2-二甲基氨基)甲基丙烯酸乙酯。在一个实施方案中,载体含有一种或多种酰化胺,与其他已知的载体材料相比,其性质可能更适合于体内使用。
[0733]
在一个实施方案中,载体是阳离子肽,例如kala(阳离子促融合肽)、聚赖氨酸、聚谷氨酸或鱼精蛋白。在一个实施方案中,载体是阳离子脂质,例如二油基磷脂酰乙醇胺或胆固醇二油基磷脂酰胆碱。在一个实施方案中,载体是阳离子聚合物,例如聚乙烯亚胺、聚胺或聚乙烯胺。
[0734]
在各种实施方案中,本公开的化合物和组合物可以封装在外泌体中。外泌体是直径在30到100nm之间的细胞衍生囊泡,存在于生物体液中,包括血液、尿液和细胞培养物的培养基。根据本领域技术人员,包括合成的外泌体和外泌体模拟物的外泌体可适用于药物递送。参见,例如“a comprehensive overview of exosomes as drug delivery vehicles-endogenous nanocarriers for targeted cancer therapy”biochim biophys acta.1846(1):75-87(2014);“exosomes as therapeutic drug carriers and delivery vehicles across biological membranes:current perspectives and future challenges”acta pharmaceutica sinica b,2016年3月8日在线可获得(印刷中);和“exosome mimetics:a novel class of drug delivery systems”international journal of nanomedicine,7:1525-1541(2012)。
[0735]
在各种实施方案中,本公开的化合物和组合物可以封装在微泡中。微泡(有时称为
循环微泡或微粒)是从几乎所有细胞类型脱落的范围为100nm至1000nm的质膜片段,与称为外泌体的较小的细胞内产生的细胞外囊泡不同。微泡在细胞间通信中发挥作用,可以在细胞之间运输mrna、mirna和蛋白质。根据本领域的技术,微泡,包括合成的微泡和微泡模拟物可以适用于药物递送。参见,例如,“microvesicle-and exosome-mediated drug delivery enhances the cytotoxicity of paclitaxel in autologous prostate cancer cells”journal of controlled release,220:727-737(2015);“therapeutic uses of exosomes”j circ biomark,1:0(2013)。
[0736]
在各种实施方案中,本公开的化合物和组合物可以使用病毒载体递送。病毒载体是分子生物学家常用的将遗传物质递送到细胞中的工具。这个过程可以在活的生物体内(体内)或细胞培养物(体外)中进行。根据本领域的技术,病毒载体可以适用于药物递送。参见例如“viruses as nanomaterials for drug delivery”methods mol biol,26:207-21(2011);“viral and nonviral delivery systems for gene delivery”adv biomed res,1:27(2012);和“biological gene delivery vehicles:beyond viral vectors”molecular therapy,17(5):767-777(2009)。
[0737]
lnp制剂和表征的一般程序在以下实施例中提供,lnp制剂和其他体外和体内试验的工作实施例也是如此。其他方法在本领域中是已知的并且可以由普通技术人员适用于本公开。
[0738]
治疗方法或减少基因表达的方法
[0739]
在各个方面,本公开提供了多聚体寡核苷酸在例如医学治疗、研究中的使用方法或在动物和植物中产生新的或改变的表型的方法。
[0740]
在一个方面,本公开提供了用于治疗受试者的方法,其包括向有需要的受试者根据本公开施用有效量的化合物或组合物。在此类治疗性实施方案中,寡核苷酸将是治疗性寡核苷酸,例如sirna、sarna、mirna、适体或反义寡核苷酸。
[0741]
在该实施方案和其他实施方案中,本公开的组合物和化合物可以以药物组合物的形式、在递送媒介物中或与靶向配体偶联施用。
[0742]
在一个方面,本公开提供了用于沉默或降低基因表达的方法,该方法包括向有需要的受试者根据本公开施用有效量的化合物或组合物。在此类治疗实施方案中,寡核苷酸将是沉默或降低基因表达的寡核苷酸,例如sirna或反义寡核苷酸。
[0743]
类似地,本公开提供了用于沉默或减少两种或更多种基因的表达的方法,该方法包括向有需要的受试者施用根据本公开有效量的化合物或组合物,其中化合物或组合物包含靶向两种或更多种基因的寡核苷酸。化合物或组合物可以包含靶向两个、三个、四个或更多个基因的寡核苷酸。
[0744]
在一个方面,本公开提供了用于每次靶向配体结合事件将两种或更多种寡核苷酸递送至细胞的方法,该方法包括向有需要的受试者根据本公开施用有效量的化合物或组合物,其中化合物或组合物包含靶向配体。
[0745]
在一个方面,本公开提供了用于将预定化学计量比的两种或更多种寡核苷酸递送至细胞的方法,该方法包括向有需要的受试者根据本公开施用有效量的化合物或组合物,其中化合物或组合物包含预定化学计量比的两个或多个寡核苷酸。
[0746]
如本文所用,受试者包括接受治疗或施用的细胞或生物体。受试者可以是动物,例
如哺乳动物如实验室动物(小鼠、猴)或兽医患者或灵长类动物如人。非限制性地,需要治疗或施用的受试者可以包括患有疾病(例如,可以使用本公开的化合物和组合物治疗的疾病)的受试者或患有病况(例如,可以使用本公开的化合物和组合物处理的病况,例如一种或多种要被沉默或表达降低的基因)。
[0747]
wo2016/205410和wo2018/145086中详细描述了用于合成和配制多聚体寡核苷酸、将缀合物连接到所述多聚体寡核苷酸上、进行动物实验和测量基因敲低的一般程序,其各自通过引用并入本文。
[0748]
下面的实施例提供了测量基因敲低和动物实验的一般程序,以及其他体外和体内试验的工作实施例。其他方法在本领域中是已知的并且可以由普通技术人员适用于本公开。
[0749]
以下实施例是说明性的而非限制性的。在阅读本公开内容后,本领域技术人员将清楚该技术的许多变化。因此,本技术的范围不应参照实施例来确定,而应参照所附权利要求及其全部等同范围来确定。
实施例
[0750]
一般程序1:单链寡核苷酸合成
[0751]
使用亚磷酰胺化学,在abi 394和3900合成器(applied biosystems)上以10μmol规模组装,或在oligopilot 10合成器上以28μmol规模组装寡核糖核苷酸。固体支持物是载有2'-脱氧胸苷的聚苯乙烯(glen research,sterling,virginia,usa)或受控孔玻璃(cpg,载量为75μmol/g,获取自prime synthesis,aston,pa,usa)。辅助合成试剂、dna-、2'-o-甲基rna-和2'-脱氧-2'-氟-rna亚磷酰胺获取自safc proligo(hamburg,germany)。具体来说,2'-o-甲基-尿苷(2'-ome-u)的5'-o-(4,4'-二甲氧基三苯甲基)-3'-o-(2-氰乙基-n,n-二异丙基)亚磷酰胺单体、4-n-乙酰基-2'-o-甲基-胞苷(2'-ome-c
ac
)、6-n-苯甲酰基-2'-o-甲基-腺苷(2'-ome-a
bz
)和2-n-异丁基鸟苷(2'-ome-g
ibu
)用于构建寡聚体序列。使用携带与2'-ome rna结构单元相同的核碱基保护基团的相应亚磷酰胺引入2'-氟修饰。所有亚磷酰胺(乙腈中70mm)使用5-乙硫基-1h-四唑(ett,乙腈中0.5m)作为活化剂的偶联时间为3分钟。在吡啶和乙腈1:1(v/v)的混合物中使用50mm 3-((二甲氨基-亚甲基)氨基)-3h-1,2,4-二噻唑-3-硫酮(ddtt,am chemicals,oceanside,california,usa)引入硫代磷酸酯连接。
[0752]
完成包括去除dmt基团的固相合成(“dmt脱去合成”)后,将寡核苷酸从固体支持物上切割下来,并使用由甲胺水溶液(41%)和浓氨水(32%)组成的1:1混合物根据公开的方法(wincott,f.et al:synthesis,deprotection,analysis and purification of rna and ribozymes.nucleic acids res,23:2677-2684(1995)在25℃下3小时脱保护寡核苷酸。
[0753]
随后,使用装有source q15(ge healthcare)和akta explorer系统(ge healthcare)的柱,通过阴离子交换hplc纯化粗寡聚体。缓冲液a是在20%乙腈水溶液中的10mm高氯酸钠、20mm tris、1mm edta,ph 7.4(fluka,buchs,switzerland),缓冲液b与含有500mm高氯酸钠的缓冲液a相同。在32个柱体积(cv)内采用22%b至42%b的梯度。记录280nm处的uv迹线。合并适当的级分并用3m naoac、ph=5.2和70%乙醇沉淀。通过离心收集团粒。
或者,使用sephadex hiprep柱(ge healthcare)根据制造商的建议进行脱盐。
[0754]
寡核苷酸在水中重构,并且寡核苷酸的身份通过电喷雾电离质谱(esi-ms)确认。通过分析阴离子交换hplc评估纯度。
[0755]
一般程序2:脂质纳米颗粒制剂
[0756]
1,2-二硬脂酰-3-磷脂酰胆碱(dspc)购自avanti polar lipids(alabaster,alabama,usa)。α-[3'-(1,2-二肉豆蔻酰基-3-丙氧基)-甲酰胺-丙基]-ω-甲氧基-聚氧乙烯(peg-c-domg)获取自nof(bouwelven,belgium)。胆固醇购自sigma-aldrich(taufkirchen,germany)。
[0757]
专利文献(constien et al.“novel lipids and compositions for intracellular delivery of biologically active compounds”us 2012/0295832 a1)中公开了专有的氨基脂质kl22和kl52。kl52和kl22脂质、dspc、胆固醇和peg-c-domg的储备溶液在乙醇中以50mm的浓度制备并储存在-20℃。将脂质混合以产生各种摩尔比(参见下面的单个实施例)并用乙醇稀释至25mm的最终脂质浓度。在h2o中浓度为10mg/ml的sirna储备溶液在50mm柠檬酸钠缓冲液(ph 3)中稀释。kl22和kl52在以下实施例中有时分别称为xl 7和xl 10。
[0758]
通过将脂质溶液与sirna溶液以7:1的总脂质与sirna重量比组合来制备脂质纳米颗粒(lnp)制剂。将脂质乙醇溶液快速注射到sirna水溶液中以提供含有33%乙醇的悬浮液。借助注射泵(harvard pump 33dual syringe pump harvard apparatus holliston,ma)注射溶液。
[0759]
随后,将制剂对磷酸盐缓冲盐水(pbs)、ph 7.4,以主产物200倍的体积进行透析两次,该透析使用slide-a-lyzer盒(thermo fisher scientific inc.rockford,il)与10kd的mwco(rc膜)以除去乙醇并实现缓冲液交换。第一次透析在室温下进行3小时,然后将制剂在4℃透析过夜。将所得纳米颗粒悬浮液通过0.2μm无菌过滤器(sarstedt,n
ü
mbrecht,germany)过滤到玻璃小瓶中,并用卷边封口(crimp closure)密封。
[0760]
一般程序3:lnp表征
[0761]
使用zetasizer nano zs(malvern instruments ltd,malvern,worcestershire,uk)分别在1x pbs和15mm pbs中测定制剂的颗粒大小和zeta电位。
[0762]
通过uv-vis测量脂质体制剂中的sirna浓度。简而言之,将100μl在1x pbs中稀释的制剂添加到900μl的4:1(v/v)甲醇和氯仿混合物中。混合后,在du 800分光光度计(beckman coulter,beckman coulter,inc.,brea,ca)上记录230nm和330nm之间的溶液吸收光谱。脂质体制剂中的sirna浓度是基于制剂中使用的sirna的消光系数和260nm波长处的吸光度与330nm波长处的基线值之间的差异计算的。
[0763]
通过quant-it
tm
rna测定法(invitrogen corporation carlsbad,ca)评估纳米颗粒对sirna的封装。简而言之,将样品在te缓冲液(10mm tris-hcl、1mm edta、ph 7.5)中稀释至大约5μg/ml的浓度。将50μl稀释样品转移到聚苯乙烯96孔板中,然后加入50μl的te缓冲液或50μl的2%triton x-100溶液。将板在37℃的温度下温育15分钟。ribogreen试剂在te缓冲液中按1:100稀释,每孔加入100μl该溶液。使用荧光板读数器(wallac victor 1420multilabel counter;perkin elmer,waltham,ma)在~480nm的激发波长和约520nm的发射波长下测量荧光强度。从每个样品的荧光值中减去试剂空白的荧光
值,并通过将完整样品(不添加triton x-100)的荧光强度除以破碎样品的荧光值来确定游离sirna的百分比(由加入triton x-100引起)。
[0764]
一般程序4:动物实验
[0765]
小鼠品系c57bl/6n用于所有体内实验。动物获取自charles river(sulzfeld,germany),在实验时年龄在6至8周之间。静脉内施用制剂通过将200μl输注到尾静脉中来注射。皮下施用的化合物以100-200μl的体积注射。在注射前一天(“预出血”)和注射后实验期间在指定的时间通过下颌下静脉采血收集血液。用血清分离管(greiner bio-one,frickenhausen,germany)分离血清并保持冷冻直至分析。化合物施用后7天,通过co2吸入麻醉小鼠并通过颈椎脱臼处死。通过心脏穿刺收集血液并如上所述分离血清。收获用于mrna定量的组织并立即在液氮中快速冷冻。
[0766]
一般程序5:基因敲低的测量
[0767]
使用以下方法确定血清蛋白水平:按照制造商的建议,使用显色酶活性测定法biophen fvii(#221304,hyphen biomed,mariaenzersdorf,austria)分析因子vii。分析前将小鼠血清按1:3000稀释。使用victor 3多标记计数器(perkin elmer,wiesbaden,germany)测量405nm处的比色显影的吸光度。
[0768]
通过elisa (cloudclone corp./hoelzel diagnostics,cologne,germany,#sec003mu)测量血清中的apob蛋白。根据制造商的指导处理1:5000稀释的小鼠血清,并使用victor 3多标记计数器(perkin elmer,wiesbaden,germany)测量450nm处的吸光度。
[0769]
通过elisa (#ka2070,novus biologicals,/biotechne,wiesbaden,germany)测量血清中的转甲状腺素蛋白(ttr,也称为前白蛋白)蛋白。根据制造商的指导处理1:4000稀释的小鼠血清,并使用victor 3多标记计数器(perkin elmer,wiesbaden,germany)测量450nm处的吸光度。
[0770]
为了量化mrna水平,将冷冻组织块(30-50mg)转移到冷冻的1.5ml反应管中。添加含有3.3μl/ml蛋白酶k(50μg/μl)(epicenter biotechnologies,madison,usa)的1ml lysis mixture(epicenter biotechnologies,madison,usa),并使用超声波仪(hd2070,bandelin,berlin,germany)通过超声几秒钟裂解组织并在65℃的温度混合器中用蛋白酶k消化30分钟(thermomixer comfort,eppendorf,hamburg,germany)。裂解物在-80℃下储存直至分析。对于mrna分析,根据制造商的建议,将裂解物解冻并使用quantigene 1.0(fvii,apob and gapdh)或quantigene 2.0(ttr)支链dna(bdna)检测试剂盒(panomics,fremont,calif.,usa,cat-no:qg0004)。作为测定读数,化学发光信号在victor 2light发光计数器(perkin elmer,wiesbaden,germany)中测量为相对光单位(rlu)。相应mrna的信号除以来自相同裂解物的gapdh mrna信号。值报告为对gapdh标准化的mrna表达。
[0771]
附加一般程序1:单链寡核苷酸合成
[0772]
寡核糖核苷酸在abi 394和3900合成器(applied biosystems)上以10μmol规模组装,或在oligopilot 10合成器上以28μmol规模组装,使用亚磷酰胺化学。固体支持物是载有2'-脱氧胸苷的聚苯乙烯(glen research,sterling,virginia,usa)或受控孔玻璃(cpg,载量为75μmol/g,获取自prime synthesis,aston,pa,usa)。辅助合成试剂、dna-、2'-o-甲基rna-和2'-脱氧-2'-氟-rna亚磷酰胺获取自safc proligo(hamburg,germany)。具体来说,2'-o-甲基-尿苷(2'-ome-u)的5'-o-(4,4'-二甲氧基三苯甲基)-3'-o-(2-氰乙
基-n,n-二异丙基)亚磷酰胺单体)、4-n-乙酰基-2'-o-甲基-胞苷(2'-ome-cac)、6-n-苯甲酰基-2'-o-甲基-腺苷(2'-ome-a
bz
)和2-n-异丁基鸟苷(2'-ome-gibu)用于构建寡聚体序列。使用携带与2'-ome rna结构单元相同的核碱基保护基团的相应亚磷酰胺引入2'-氟修饰。所有亚磷酰胺(乙腈中70mm)使用5-乙硫基-1h-四唑(ett,乙腈中0.5m)作为活化剂的偶联时间为3分钟。在吡啶和乙腈1:1(v/v)的混合物中使用50mm 3-((二甲氨基-亚甲基)氨基)-3h-1,2,4-二噻唑-3-硫酮(ddtt,am chemicals,oceanside,california,usa)引入硫代磷酸酯连接。
[0773]
在包括去除dmt基团的完成固相合成(“dmt脱去合成”)后,将寡核苷酸从固体支持物上切割下来,并使用由甲胺水溶液(41%)和浓氨水(32%)组成的1:1混合物根据公开的方法在25℃下3小时脱保护寡核苷酸(wincott,f.et al:synthesis,deprotection,analysis and purification of rna and ribozymes.nucleic acids res,23:2677-2684(1995)。
[0774]
随后,使用装有source q15(ge healthcare)和akta explorer系统(ge healthcare)的柱,通过阴离子交换hplc纯化粗寡聚体。缓冲液a是ph 7.4在20%乙腈水溶液中的10mm高氯酸钠、20mm tris、1mm edta(fluka,buchs,switzerland),缓冲液b与含有500mm高氯酸钠的缓冲液a相同。在32个柱体积(cv)内采用22%b至42%b的梯度。记录280nm处的uv迹线。合并适当的级分并用3m naoac、ph=5.2和70%乙醇沉淀。通过离心收集颗粒。或者,根据制造商的建议,使用sephadex hiprep柱(ge healthcare)进行脱盐。
[0775]
在水中重构寡核苷酸,并且寡核苷酸的身份通过电喷雾电离质谱(esi-ms)确认。通过分析阴离子交换hplc评估纯度。
[0776]
使用tfa保护的己氨基接头亚磷酰胺(sigma-aldrich,safc,hamburg,germany)引入5'-氨基己基接头。使用固定在cpg(prime synthesis,aston,pa,usa)上的邻苯二甲酰亚胺保护的己氨基接头引入3'-己氨基接头。如上进行脱保护和纯化。
[0777]
附加通用程序2:硫醇封端的sirna的产生
[0778]
3'-或5'-端硫醇基团经由1-o-二甲氧基三苯甲基-己基二硫化物、1'-[(2-氰乙基)-(n,n-二异丙基)]-亚磷酰胺接头(nucleosyn,olivet cedex,france)。如上所述脱保护和纯化后,使用二硫苏糖醇(dtt)(0.1m dtt储备溶液(sigma-aldrich chemie gmbh,munich,germany,#646563)在三乙基碳酸氢铵缓冲液(teabc,0.1m,ph 8.5,sigma,#90360)中还原每个含有二硫化物的寡聚体。将寡核苷酸溶解在teabc缓冲液(100mm,ph 8.5)中以产生1mm溶液。为了完成二硫键还原,将50-100倍摩尔dtt过量添加到寡核苷酸溶液中。通过分析型aex hplc在从thermo fisher获得的dionex dna pac 200柱(4x250 mm)上监测还原过程。还原的材料,即相应的硫醇(c6sh),在起始材料之前洗脱。反应完成后,使用ge healthcare的hiprep柱和水作为洗脱物通过尺寸排阻色谱法去除多余的试剂。随后,使用3m naoac(ph 5.2)和乙醇沉淀寡核苷酸,并在-20℃下储存。
[0779]
附加一般程序3:单链rna(ssrna)退火形成双链rna(dsrna)的一般程序
[0780]
dsrna是从rna单链产生的,其通过混合相对于有义链略微过量的所需互补反义链,并在20mm nacl/4mm磷酸钠ph 6.8的缓冲液中退火形成。使用ge healthcare的superdex75柱(10x300mm)通过天然尺寸排阻hplc确认成功的双链体形成。样品冷冻保存直至使用。
[0781]
在本文所述的序列中,大写字母“a”、“c”、“g”和“u”代表rna核苷酸。小写字母“c”、“g”、“a”和“u”代表2'-o-甲基修饰的核苷酸;“s”代表硫代磷酸酯;和“dt”代表脱氧胸苷残基。大写字母a、c、g、u后跟“f”表示2'-氟核苷酸。“(shc6)”表示硫己基接头。“(dtme)”代表可切割的同双功能交联剂二硫代双马来酰亚胺乙烷,“c6nh2”和“c6nh”可互换使用以代表氨基己基接头。“c6ssc6”代表二己基二硫化物接头。“invdt”是指反向的胸苷。
[0782]
附加一般程序4:通过顺序退火产生多聚体sirna的一般程序
[0783]
在水中进行经由逐步退火制备多聚体sirna,并利用互补链的逐步添加。不需要加热/冷却溶液。每次添加后,取出退火溶液的等分试样,并使用分析型rp hplc在自然条件(20℃)下监测双链体的形成。根据最近邻法计算的单个单链的消光系数计算组合等摩尔量的互补单链所需的量。如果分析型rp hplc迹线显示过量的单链,则添加额外量的相应互补链以强制形成双链体(“双链体滴定”)。
[0784]
使用配备平衡至20℃的xbride c18 oligo beh(2.5μm;2.1x50mm,waters)柱的dionex ultimate 3000hplc系统监测双链体滴定。诊断波长为260nm。缓冲液a是含有1%甲醇的100mm六氟异丙醇(hfip)、16.3mm三乙胺(tea)。缓冲液b具有相同的组成,但meoh为95%。以250μl/min的流速在30分钟内应用从5%到70%的缓冲液b的梯度。两条互补链独立运行以确定保留时间。然后分析含有双链体溶液的等分试样,并与组成单链的保留时间进行比较。如果双链体溶液显示出大量的单链,则将相应的互补链添加到双链体溶液中。
[0785]
实施例1:硫醇封端的sirna的产生
[0786]
必要时经由1-o-二甲氧基三苯甲基-己基-二硫化物、1'-[(2-氰乙基)-(n,n-二异丙基)]-亚磷酰胺接头(nucleosyn,olivet cedex,france)引入3'-或5'-端硫醇基团。在完成固相合成并最终去除dmt基团(“dmt脱去合成”)后,将寡核苷酸从固体支持物上切割下来,并使用由甲胺水溶液(41%)和浓氨水(32%)组成的1:1混合物在10℃下6小时脱保护寡核苷酸。随后,在akta explorer系统(ge healthcare,freiburg,germany)上通过阴离子交换高效液相色谱(hplc)纯化粗寡核苷酸。通过加入乙醇并在冰箱中储存过夜来沉淀纯化的(c6ssc6)-寡核苷酸。通过离心收集颗粒。寡核苷酸在水中重构,寡核苷酸的身份通过电喷雾电离质谱(esi-ms)确认。通过分析阴离子交换和rp hplc评估纯度。
[0787]
然后使用100mm dl-二硫苏糖醇(dtt)溶液还原每种含有二硫化物的寡聚体。用三乙基碳酸氢铵缓冲液(teabc,1m,ph 8.5,sigma,#90360)和水稀释1.0m dtt储备溶液(sigma-aldrich chemie gmbh,munich,germany,#646563)以在dtt和teabc中分别提供100mm的溶液。将寡核苷酸溶解在teabc缓冲液(100mm,ph 8.5)中以产生1mm溶液。为了完成二硫化物还原,将50-100倍摩尔dtt过量添加到寡核苷酸溶液中。通过分析aex hplc在获得自thermo fisher的dionex dna pac 200柱(4x250mm)上监测还原的进程。还原的材料,即相应的硫醇(c6sh),在起始材料之前洗脱。反应完成后,使用来自ge healthcare的hiprep柱和水作为洗脱剂,通过尺寸排阻色谱法去除过量试剂。随后,使用3m naoac(ph 5.2)和乙醇沉淀寡核苷酸,并在负20℃下储存。
[0788]
实施例2:制备单-dtme寡聚体的一般程序
[0789]
将硫醇修饰的寡核苷酸溶解在含有25%乙腈的300mm naoac(ph 5.2)中,得到20od/ml溶液。将40当量的二硫代双马来酰亚胺乙烷(dtme,thermo fisher,#22335)溶解在乙腈中以提供15.6mm溶液。将dtme溶液添加到含有寡核苷酸的溶液中,并在thermomixer
(eppendorf,hamburg,germany)上在25℃下搅拌。使用dionex dna pac200柱(4x250 mm)通过分析型aex hplc监测反应进程。根据所需的纯度水平,过量的dtme或者通过尺寸排阻hplc使用hiprep柱(ge healthcare)去除,或者粗反应混合物通过制备型aex hplc使用填充有source 15q树脂的柱进行纯化,该柱可购自ge healthcare。
[0790]
实施例3:经由dtme功能性制备二聚体的一般程序
[0791]
根据实施例2中的程序制备的dtme修饰的寡核苷酸与另一种配备有硫醇接头的寡核苷酸反应。该反应可以在单链序列上进行,也可以在反应配偶体之一的互补寡核苷酸预先退火之后进行。因此,如果需要,dtme修饰的寡核苷酸直接与硫醇修饰的寡核苷酸反应,或与其互补链退火,且得到的双链体与硫醇修饰的寡核苷酸反应。或者,硫醇修饰的寡核苷酸与其互补链退火,该双链体与dtme修饰的单链反应。在所有情况下,在存在300mm naoac(ph 5.2)的情况下在水溶液中进行反应。
[0792]
实施例4:单链rna(ssrna)退火形成双链rna(dsrna)的一般程序
[0793]
通过混合等摩尔量的互补有义链和反义链并在20mm nacl/4mm磷酸钠,ph 6.8的缓冲液中退火以从rna单链产生dsrna。使用ge healthcare的superdex 75柱(10x300mm)通过天然尺寸排阻hplc确认成功的双链体形成。样品冷冻保存直至使用。
[0794]
实施例5:制备3'-或5'-nh2衍生化的寡核苷酸的一般程序
[0795]
使用oligopilot 100(ge healthcare,freiburg,germany)和受控孔玻璃(cpg)作为固体支持物(prime synthesis,aston,pa,usa),通过标准亚磷酰胺化学在固相上以140μmol的规模产生在有义链的5'末端配备有c-6-氨基接头的rna。使用相应的2'-ome-亚磷酰胺、2'-f-甲基亚磷酰胺产生含有2'-o-甲基和2'-f核苷酸的寡聚体。使用tfa保护的己基氨基接头亚磷酰胺(sigma-aldrich,safc,hamburg,germany)引入有义链5'末端的5'-氨基己基接头。如果在3'-位需要己氨基接头的情况下,使用固定在cpg(prime synthesis,aston,pa,usa)上的邻苯二甲酰亚胺基(phtalimido)保护的己氨基接头。使用41%甲胺的水溶液和浓氨水(1:1v/v)的混合物完成切割和脱保护。使用阴离子交换hplc和填充有获得自ge healthcare的source 15q树脂的柱(2.5x18 cm)纯化粗寡核苷酸。
[0796]
实施例6:galnac配体缀合的一般方法
[0797]
三价galnac配体如hadwiger et al.,专利申请us2012/0157509a1中所述制备。根据以下程序,使用nhs化学活化相应的羧酸衍生物:
[0798]
将3galnac-cooh(90μmol,206mg)溶解在2.06ml dmf中。在0℃向该溶液中加入n-羟基琥珀酰亚胺(nhs,14.3mg(99μmol,1.1eq.)和二异丙基碳二亚胺(dic,18.29μl,1.05eq.,94μmol)。该溶液在环境温度下搅拌过夜。通过tlc(dcm:meoh=9:1)监测反应的完成。
[0799]
将配备有氨基己基接头的前体寡核苷酸溶解在碳酸钠缓冲液(ph 9.6):dmso 2:3v/v中,得到4.4mm溶液。向该溶液中加入nhs活化的galnac溶液的等份试样(1.25eq,116μl)。在25℃下摇动1小时后,加入另一份(116μl)nhs活化的galnac。一旦rp hplc分析显示至少超过85%的缀合材料,通过添加乙醇沉淀粗缀合物并在冰箱中储存过夜。通过离心收集团粒。将团粒溶解在1ml浓氨水中并在室温下搅拌4小时以从galnac糖残留物中除去o-乙酸酯。在通过rp hplc esi ms确认定量去除o-乙酸酯后,用100mm三乙基乙酸铵(teaa)稀释该
材料,并使用xbridge prep c18(5μm,10x50 mm,waters)柱在60℃下在explorer hplc系统上通过rp hplc纯化粗反应混合物。溶剂a为100mm teaa水溶液,溶剂b为95%can中的100mm teaa,均通过缓冲液预热器的方法加热至60℃。采用在60分钟内从5%到25%b的梯度,流速为3.5ml/min。在260和280nm处观察到化合物的洗脱。收集体积为1.0ml的级分并通过分析型rp hplc/esi-ms进行分析。合并含有纯度超过85%的靶缀合物的级分。通过esi/ms确认正确的分子量。
[0800]
实施例7:寡核苷酸前体
[0801]
使用上述实施例中描述的方法,下表2-7描述了制备的单链单体、二聚体和galnac标记的单体和二聚体:
[0802]
表2:寡核苷酸前体——单链(“x”)
[0803][0804]
表3:寡核苷酸单链有义和反义对;和退火后产生的双链体(“xd
‑”
)。
[0805][0806]
表4:衍生化寡核苷酸单链有义和反义对;和退火后产生的双链体。
[0807][0808][0809]
表5:由dtme连接的单链寡核苷酸二聚体
[0810][0811]
表6:单链dtme二聚体和相应的单体;和退火后产生的双链体
[0812][0813]
表7:化学合成的二硫化物连接的二聚体和三聚体
[0814][0815][0816]
要点:在上述表1-6的序列部分(以及随后的表)中:大写字母“a”、“c”、“g”和“u”代表rna核苷酸。小写字母“c”、“g”、“a”和“u”代表2'-o-甲基修饰的核苷酸;“s”代表硫代磷酸酯;“dt”代表脱氧胸苷残基。大写字母a、c、g、u后跟“f”表示2'-氟核苷酸。“(shc6)”表示硫己基接头。“(dtme)”表示可切割的同双功能交联剂二硫代双马来酰亚胺乙烷(dithiobismaleimidoethane),其结构在图1b中显示,“(bmpeg2)”代表不可切割的同双功能交联剂1,8-双马来酰亚胺-二甘醇(1,8-bismaleimido-diethyleneglycol)。“c6nh2”和“c6nh”可互换使用以表示氨基己基接头。“c6ssc6”代表二己基二硫化物接头。“galnac3”和“galnac”可互换使用以表示三触角型n-乙酰半乳糖胺配体,其化学结构如图1a中显示,“spdp”代表琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯与配备氨基接头的rna反应的反应产物。“invdt”是指反向的胸苷。
[0817]
在图表的靶物/链部分:“f7”或“fvii”表示靶向因子vii转录物(mrna)的sirna序列。“apob”表示靶向载脂蛋白b转录物的sirna序列。“ttr”表示靶向转甲状腺素蛋白转录物
的sirna序列。有义链被指定为“s”;反义链被指定为“as”。
[0818]
实施例8:通过顺序退火产生二聚体、三聚体和四聚体sirna的一般程序
[0819]
为了制备二聚体、三聚体和四聚体sirna,进行了逐步退火程序。退火在水中进行,并利用互补链的逐步添加。不需要加热/冷却溶液。每次添加后,取出退火溶液的等分试样,并使用分析型rp hplc在自然条件(20℃)下监测双链体的形成。根据最近邻法计算的单个单链的消光系数计算组合等摩尔量的互补单链所需的量。如果分析型rp hplc迹线显示过量的单链,则添加额外量的相应互补链以强制形成双链体(“双链体滴定”)。
[0820]
使用配备平衡至20℃的xbride c18 oligo beh(2.5μm;2.1x50 mm,waters)柱的dionex ultimate 3000hplc系统监测双链体滴定。诊断波长为260nm。缓冲液a是含有1%甲醇的100mm六氟异丙醇(hfip)、16.3mm三乙胺(tea)。缓冲液b具有相同的组分,除了meoh为95%。以250μl/min的流速在30分钟内应用从5%到70%的缓冲液b的梯度。两条互补链独立运行以确定保留时间。然后分析含有双链体溶液的等分试样,并与组成单链的保留时间进行比较。如果双链体溶液显示出大量的单链,则将相应的互补链添加到双链体溶液中。
[0821]
实施例9:5'-galnac-fvii典型对照(xd-06328)的制备
[0822]
通过实施例4中描述的方法使ssrna链x18790和x18795退火以制备5'-galnac-fvii典型对照(xd-06328)(参见图2)。如通过hplc分析确定,获得的产物纯度为91.6%。
[0823]
实施例10:制备3'-galnac-fvii-dtme-fvii同二聚体,其具有连接3'反义链的可切割接头和与有义链外部3'末端缀合的galnac(xd-06330)
[0824]
根据实施例8中描述的双链体滴定方法,通过将单链二聚体x19819与x18788和x19571逐步组合来制备(10mg,323nmol)缀合有galnac的靶向fvii的同二聚体sirna xd-06330(图3)。通过hplc分析,分离的材料是基本纯的。
[0825]
表9:用于合成galnac-fvii-dtme-fvii同二聚体(xd-06330)的寡聚体的化学计量
[0826][0827]
实施例11:制备3'-galnac-fvii-dtme-fvii同二聚体,其具有连接5'有义链的可切割接头和与有义链外部3'末端缀合的galnac(xd-06360)
[0828]
靶向fvii的缀合有galnac的同二聚体sirna xd-06360通过使用图4中描绘的合成方案和实施例8中描述的方法逐步组合单链来制备(11mg,323nmol)。
[0829]
所有反应步骤都产生高质量的材料,通过离子交换和反相色谱法测定寡聚体x19575的纯度分别为91.7%和93.4%,并通过非变性反相hplc测定寡聚体xd-06360分离的纯度为86.8%。合成中使用的各种寡聚体的化学计量如表10所示。
[0830]
表10:用于合成galnac-fvii-fvii同二聚体(xd-06360)的寡聚体的化学计量
[0831][0832]
实施例12:制备5'-galnac-fvii-dtme-fvii同二聚体,其具有连接3'反义链的可切割接头和与有义链内部5'末端缀合的galnac(xd-06329)
[0833]
缀合有galnac的靶向fvii的同二聚体sirna xd-06329如图5所示通过退火1150nmol x18788和1150nmol x18798来制备。单个链的od总和为450od,而组合溶液,即双链体,由于增色性而具有394od(394ods=1150nmol双链体)。该dtme修饰的双链体与1150nmol x18797(3'-sh修饰的fvii反义)(224ods)反应。在hplc纯化后,分离出364od的“半二聚体”sirna。然后将“半二聚体”fvii sirna(10mg,323nmol,174od)与5'galnac-fvii有义(x18790)(323nmol,62.3od)退火以产生最终产物xd-06329。
[0834]
实施例13:测定由fvii同二聚体galnac缀合物(xd-06329、xd-06330和xd-06360)体内敲低fvii基因。
[0835]
在如上所述的动物实验中测试了同二聚体、缀合有galnac的靶向因子vii的sirna的三种不同变体(xd-06329、d-06330和d-06360)和缀合有galnac的单体fvii-sirna(xd-06328)的体内效率(一般程序:动物实验)。组大小是治疗组的n=4只小鼠,并且盐水对照组为n=5只小鼠。所有化合物均以不同剂量(25mg/kg或50mg/kg)皮下注射,体积为0.2ml。在治疗前1天和治疗后1、3和7天收集血液,并分析fvii酶活性。结果示于图6。
[0836]
同二聚体galnac缀合物(xd-06329、xd-06330和xd-06360)的沉默活性、起效和效力在每单位重量的敲低基础上与单体典型对照(xd-06328)相当。没有观察到毒性迹象(例如,体重减轻、异常行为)。然而,在对galnac含量的数据进行标准化后,同二聚体galnac缀合物在fvii敲低方面都比galnac单体更有效,从而展示每个配体/受体结合事件的sirna摄取效率更高。这些结果示于图7a和7b中。
[0837]
图7a.将每个时间点的因子vii血清值对注射1x pbs的对照小鼠标准化。每个数据点的条从左到右分别对应于盐水、xd-06328、xd-06329、xd-06330和xd-06360。
[0838]
图7b.将每个时间点的因子vii血清值对于每个单个组的预出血值标准化。每个数据点的条形从左到右分别对应于盐水、xd-06328、xd-06329、xd-06330和xd-06360。
[0839]
实施例14:制备独立靶向fvii(xd-06328)、apob(xd-06728)和ttr(xd-06386)的典型galnac-sirna。
[0840]
通过固相合成独立地制备三种独立靶向fvii(xd-06328)、apob(xd-06728)和ttr(xd-06386)的典型sirna(参见图8)。用5'-己胺接头分别制备三个有义链(分别为x18790、x20124、x20216)。在寡核苷酸的切割和脱保护以及粗材料的hplc纯化之后,使用nhs化学实现了全乙酰化的galnac簇与每个寡核苷酸的缀合。通过皂化去除o-乙酸酯是由氨水介导的。通过上面提供的标准程序合成互补反义链(分别为x18795、x19583和x19584),然后与缀合有galnac的单链退火以产生靶向fvii(xd-06328)、apob(xd-06728)和ttr(xd-06386),纯度分别为99.7、93.1和93.8%的sirna。
[0841]
表11:galnac-sirna缀合物
[0842][0843][0844]
实施例15:在有义链上具有可切割连接的galnac-fvii-apob-ttr三聚体的制备(xd-06726)
[0845]
使用固相和溶液相的混合方案合成与galnac缀合的靶向fvii、apob和ttr的sirna的异三聚体,如图10所示。使用相应的市售tfa保护的亚磷酰胺(safc proligo,hamburg,germany),使用固相化学制备在5'末端具有氨基己基接头的二聚体x19581。根据上述条件将序列从固体支持物上切割、脱保护和纯化。为了安装额外的二硫键接头,寡核苷酸的5'-氨基己基接头与可从sigma(#p3415)获得的spdp(琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯)反应。将928nmol(400od)寡核苷酸溶解在4.7ml的100mm teab,ph 8.5中,其含有20%二甲基甲酰胺(dmf)。向该溶液中加入在100μl dmf中的1.4mg(4.6μmol,5eq)spdp溶液。一旦分析型rp hplc表明起始材料消耗,粗反应混合物在购自waters的c18 xbridge柱(10x50 mm)上纯化。rp纯化在explorer hplc系统上进行。溶剂a是100mm teaa水溶液,溶剂b是95%can中的100mm teaa。通过缓冲液预热器将溶剂加热至60℃,将柱保持在相同温度的烘箱中。采用在45分钟内从0%到35%b的梯度,流速为4ml/min。在260和280nm处观察到化合物的洗脱。收集体积为1.5ml的级分并通过分析型rp hplc/esi-ms进行分析。合并合适的级分,在加入乙醇和3m naoac(ph 5.2)后,寡核苷酸x19582在负20℃下沉淀。通过rp-hplc esi-ms确认身份。为了制备单链三聚体,将上述寡核苷酸x19582(255nmol)溶解在1.3ml的水中。向该溶液中加入306nmol(1.2eq)硫醇修饰的寡核苷酸x18793。反应混合物含有200mm teaa和20%乙腈。通过rp hplc跟踪反应进程。一旦起始材料耗尽,则使用与上一段中所述相同的条件纯化反应混合物,不同之处在于梯度在45分钟内从0%b运行至30%b。获得了高纯度的单链异三聚体x20256(含有连接的sifvii、siapob和sittr有义链)。x20256的序列如表12所示。
[0846]
表12:单链异三聚体
[0847][0848]
注意:原则上,上述序列可通过单一固相合成获得。在这种情况下,spdp和c6nh2将被c6ssc6亚磷酰胺替换。然而,由于整个构建体的序列长度,此类的合成将具有挑战性。
[0849]
此后,根据实施例8中描述的双链体滴定方法,通过将反义单链逐步顺序添加到有义链异三聚体中间物(x20256)中以制备7mg(150nmol)的同时靶向fvii、apob和ttr的异三聚体双链体构建体(xd-06726)。获取7mg的材料,根据hplc,其基本上是纯的。
[0850]
表13:用于合成galnac-fvii-apob-ttr三聚体(xd-06726)的寡聚体的化学计量。
[0851][0852]
实施例16:在交替的有义和反义链上具有可切割连接的galnac-fvii-apob-ttr三聚体(xd-06727)的制备。
[0853]
如图12所示,使用实施例8中描述的方法通过逐步组合单链以高纯度制备9mg(192nmol)同时靶向fvii、apob和ttr的三聚体sirna xd-06727(参见图11)。
[0854]
表14:用于合成galnac-sifvii-siapob-sittr三聚体(xd-06727)的寡聚体的化学计量
[0855][0856]
产生异三聚体(xd-06727)的合成是高效的。在本实施例中,在每个步骤中取得的反应物的转化率接近100%。参见图13、14和15。
[0857]
实施例17:个别靶向fvii、apob和ttr的合并sirna的lnp制剂的制备
[0858]
在脂质纳米颗粒中配制靶向fvii(xd-00030)、apob(xd-01078)和ttr(xd-06729)
的单体sirna,并使用一般程序:脂质纳米颗粒制剂和一般程序:lnp表征中描述的方法进行表征。脂质组合物为xl10:dspc:胆固醇:peg-domg/50:10:38.5:1.5的摩尔百分比。实现了88%的封装,并且得到的颗粒大小为83nm,zeta电位为2.2mv且pdi为0.04。
[0859]
表15:靶向ttr的单体sirna(xd-06729)
[0860][0861]
实施例18:评估缀合有galnac的异三聚体sirna敲低mrna
[0862]
为了确定缀合有galnac的异三聚体sirna(靶向fvii、apob和ttr)的体内效率,如上所述进行动物实验(一般程序:动物实验),使用组大小是治疗组为n=4只小鼠,盐水对照组为n=5只小鼠。将异三聚体xd-06726和xd-06727以及3个缀合有galnac的单体sirna(靶向fvii的xd-06328;靶向ttr的xd-06386和靶向apob的xd-06728)以三聚体的总rna浓度为50mg/kg,每个单体缀合物的总rna浓度为17mg/kg皮下注射(0.1ml体积)。为了比较,np配制的针对相同靶物(fvii(xd-00030)、apob(xd-01078)和ttr(xd-06729))的sirna(npa-741-1)合并物以0.5mg/kg每sirna静脉内注射。在治疗前1天和治疗后1、3和7天如上文所述(一般程序:动物实验)收集血液,并根据一般程序:基因敲低的测量测量fvii、apob和ttr的血清水平。结果显示于图16a和16b、17a和17b以及18a和18b中。在注射后第7天测量肝裂解物中的mrna水平(图19a和19b)。
[0863]
a组中的一只动物(xd-06726)对ttr血清水平没有显示任何影响。两个ttr蛋白质图中的第一个显示了非响应动物的省略值的数据。
[0864]
为了比较,第二张fvii图中省略了来自显示不良ttr响应的动物的值。
[0865]
apob血清水平在一组动物内和盐水对照的不同时间点之间显示出高度变化。
[0866]
根据上述一般程序:基因敲低的测量,还使用来自肝组织的mrna的bdna测定来测量所有三个基因的敲低。靶基因水平相对于管家gapdh标准化。
[0867]
实施例19:制备galnac-fvii-apob-ttr-fvii四聚体(xd-07140)
[0868]
通过如图21所示,逐步组合单链,并根据实施例8中所述的双链体滴定法制备12.4nmol的同时靶向fvii、apob和ttr的四聚体sirna xd-07140(参见图20)。hplc分析显示获得高纯度的产物。
[0869]
表16:用于合成galnac-fvii-apob-ttr-fvii四聚体(xd-07140)的寡聚体的化学计量
[0870][0871]
实施例20:同四聚体的合成
[0872]
根据本公开的多聚体寡核苷酸可以通过本文公开的任何方法合成。下面提供了两种用于同四聚体的实例方法。这些实施例可以很容易地用于合成更长的多聚体(例如,五聚体、六聚体等)
[0873]
在单链上具有连接的同四聚体sirna可以通过如下合成:在合成器上制备有义链的四聚体,每条有义链经由可切割的接头连接,然后添加靶向配体并退火反义链,如图40所示。有义链的可切割接头可以是二硫化物(如图所示)或其他不稳定的连接(例如,化学上未修饰的核酸序列,如uuu/尿苷-尿苷-尿苷)。
[0874]
图40所示方案的变体可以包括使用替代接头、连接反义链和退火有义链、合成更长的多聚体,或者在达到基于机器的合成的技术限制的情况下,合成一种或多种多聚体,然后使用一种或多种溶液相化学反应将所述多聚体连接在一起(例如,根据方案1合成两个四聚体,一个有配体,另一个没有配体,一条或两条链适当地用官能团修饰以促进连接,然后经由共价键的形成将两个四聚体连接在一起,添加或不添加连接部分,如例如dtme)。
[0875]
或者,可以如图41所示在交替链上具有连接的情况下组装同四聚体。
[0876]
在图41中,
“‑
sh”代表巯基基团,“mal”代表dtme,
“‑
cl
‑”
代表可切割的接头。图41所示方案的变体可以包括使用替代接头和合成更长的多聚体。
[0877]
实施例21:配体缀合物的合成
[0878]
图41中所示的配体缀合物可以如下合成:
[0879]
合成单体的有义链和反义链的3'-巯基衍生物:
[0880][0881]
每者的各部分都转化为相应的单马来酰亚胺衍生物:
[0882][0883]
然后用所选靶向配体的巯基衍生物处理由此获得的一部分有义链马来酰亚胺衍生物:
[0884][0885]
(结构65)
[0886]
然后加入稍微摩尔过量的反义马来酰亚胺衍生物,并通过制备色谱分离所需的配体-ds-sirna-马来酰亚胺产物:
[0887][0888]
然后按图41中概述的,顺序添加略微摩尔过量的同四聚体的有义和反义组分中的每一种,每一步的产物在需要时通过制备色谱进行纯化。
[0889]
实施例22:多聚体寡核苷酸的合成
[0890]
根据本公开的多聚体寡核苷酸可以通过本文公开的或改编自本领域的任何方法合成。下面提供了用于同多聚体的实例方法,但本合成也可以容易地适用于合成异多聚体。
[0891]
这些实施例也可适用于合成不同长度的多聚体。例如,可以使用基本相同的合成和连接化学来组合四聚体和单体(或三聚体和二聚体)以产生五聚体。同样,可以将四聚体和三聚体组合以产生七聚体等。互补的连接化学(例如,点击化学)可以用于组装更大的多聚体。
[0892]
实施例22a:经由预合成的同二聚体合成sirna的同四聚体
[0893]
步骤1:合成有义链同二聚体,其中两条有义链通过核酸酶可切割的寡核苷酸(na)连接,并以氨基官能团和二硫化物部分封端。
[0894][0895]
如上通用程序:单链寡核苷酸合成部分中概述的,合成个别链(用于该步骤和其他步骤)。用于寡核苷酸链合成、连接和化学修饰的其他方法可以改编自本领域。
[0896]
步骤2:然后经由与酰基活化的三触角型galnac配体反应将三触角型galnac配体添加到有义链同二聚体的一部分的末端氨基官能团。
[0897][0898]
步骤3:剩余的有义链同二聚体用摩尔过量的二硫苏糖醇处理,以切割二硫基团以产生硫醇封端的有义链同二聚体。
[0899][0900]
步骤4:根据用于制备异多聚体的程序(见上文),用二硫代双马来酰亚胺乙烷(dtme)对该材料进行单衍生化。
[0901][0902]
步骤5:galnac衍生化的同二聚体的二硫基团也通过用摩尔过量的二硫苏糖醇处理而切割。
[0903][0904]
步骤6:galnac封端的同二聚体然后经由末端硫醇基团反应连接到单dtme衍生化的同二聚体以产生单链同四聚体。
“‑
s-cl-s
‑”
代表dtme中的可切割二硫基团,例如可切割接头(cl)。
[0905][0906]
步骤7:然后将该材料与4分子当量的反义单体退火以产生所需的双链同四聚体(该退火步骤是可选的并且可以省略,例如以制备单链多聚体,如反义寡核苷酸)。
[0907][0908][0909]
实施例22b:经由预合成的同二聚体和同四聚体合成sirna的同六聚体
[0910]
步骤1:合成有义链同四聚体,其中四个有义链通过核酸酶可切割的寡核苷酸连接,并以氨基官能团和二硫键部分封端。
[0911][0912]
步骤2:该材料用摩尔过量的二硫苏糖醇处理,以切割二硫基团
[0913][0914]
步骤3:根据用于制备异多聚体的程序(见上文),用二硫代双马来酰亚胺乙烷(dtme)对该材料进行单衍生化。
[0915][0916]
步骤4:该材料与硫醇封端的galnac同二聚体反应产生单链同六聚体。
[0917][0918]
注意:在结构77、78、81、82、89和91中,单个连续结构被符号分成两部分。
[0919]
步骤5:然后将该材料与6分子当量的反义单体退火以产生所需的双链同六聚体(该退火步骤是可选的并且可以省略,例如制备单链多聚体如反义寡核苷酸)。
[0920][0921]
实施例22c:经由预合成的同四聚体合成sirna的同八聚体
[0922]
步骤1:上面合成的氨基端同四聚体的一部分通过与酰基活化的三触角型galnac配体反应转化为相应的galnac衍生物。
[0923][0924]
步骤2:该材料用摩尔过量的二硫苏糖醇处理以切割二硫基团
[0925][0926]
步骤3:该材料与单dtme衍生化的四聚体反应产生末端的galnac衍生单链八聚体。
[0927][0928]
步骤4:然后将该材料与8个分子当量的反义单体退火以产生所需的双链同八聚体(该退火步骤是可选的并且可以省略,例如制备单链多聚体如反义寡核苷酸)。
[0929][0930]
实施例22d:使用硫醇/马来酰亚胺和叠氮化物/乙炔(“点击”)接头的组合经由预合成的同四聚体合成反义寡核苷酸的同十二聚体
[0931]
步骤1:合成反义寡核苷酸的同四聚体,其含有3个核酸酶可切割的寡核苷酸接头以及末端的二硫基团和氨基基团。
[0932][0933]
步骤2:该材料通过与酰基活化的三触角型galnac配体反应转化为相应的galnac衍生物。
[0934][0935]
步骤3:该材料用摩尔过量的二硫苏糖醇处理以切割二硫基团
[0936][0937]
步骤4:单独地,合成含有3个核酸酶可切割的寡核苷酸接头和末端的二硫集团和叠氮基集团的反义寡核苷酸的同四聚体。
[0938][0939]
步骤5:该材料用摩尔过量的二硫苏糖醇处理以切割二硫基团
[0940][0941]
步骤6:根据用于制备sirna异多聚体的程序(见上文),用二硫代双马来酰亚胺乙烷(dtme)对该材料进行单衍生化。
[0942][0943]
步骤7:该材料与硫醇封端的galnac衍生化四聚体反应以产生末端的galnac衍生化的单链反义八聚体。
[0944][0945]
步骤8:单独地,合成含有3个核酸酶可切割的寡核苷酸接头和末端的乙炔基团的反义寡核苷酸的第三同四聚体。后者可以是非衍生化的或空间应变的衍生物,如二苯并环辛炔(dbco,glen research,va,usa)
[0946]
(ex合成器)
[0947][0948]
步骤9:该材料然后与步骤7中制备的叠氮化物封端的八聚体反应,以生产所需的反义同十二聚体。如果四聚体上的末端的乙炔未衍生化,则需要金属盐催化剂如1氯化铜来实现连接。相反,如果末端的乙炔是dbco,则偶联反应将是自发的。
[0949][0950]
这种方法,或使用替代连接化学的方法,也可用于制造其他长度的多聚体(例如,9、10、11、13、14、15...个寡核苷酸)。此类多聚体可以通过将单链多聚体与互补寡核苷酸退火而制成双链。
[0951]
实施例23:同六聚体sirna的合成
[0952]
构建了fvii sirna的同六聚体,其含有两种正交类型的生物可切割连接,i)易于在合成器上引入的未修饰的二核苷酸连接,和ii)在合成后引入的硫醇/马来酰亚胺衍生物。fvii同六聚体(xd-09795)通过组合同二聚体(x30835)和同四聚体(x30837)进行组装,如图23所示。同二聚体和同四聚体均经由标准技术在固体支持物上合成,每个末端有氨基和二硫基团。在解封和纯化后,同二聚体和同四聚体经由硫醇/马来酰亚胺反应连接在一起,并与反义链x18795退火以得到fvii同六聚体(xd-09795)。
[0953]
单链同二聚体x30835、单链同四聚体x30837、所得单链同六聚体x30838以及双链六聚体xd-09795和双链单体xd-09794的序列如表17所示。
[0954]
表17:实施例23中的寡核苷酸序列
[0955][0956]
实施例24:同六聚体sirna合成中的纯度和产率
[0957]
实施例23中描述的合成步骤导致中间产物、同二聚体(x30835)、同四聚体(x30837)和同六聚体(x30878)以及所得dsrna同六聚体(xd-09795)的高产率和纯度,分别如图24a-24b、24c-24d、24e和24f中的hplc迹线数据所示。
[0958]
实施例25:同六聚体sirna和相应单体之间的体内循环半衰期的比较
[0959]
在小鼠中测定fvii同六聚体xd-09795和相应的fvii单体xd-09794的血清半衰期。简而言之,同六聚体或相应的单体经由静脉内(iv)推注施用到4只c57/bl6n雌性小鼠的3组中,每组约11周龄。fvii单体和fvii六聚体的剂量均为20mg/kg,并且在iv推注后5、30、60和120分钟抽取血液样品。经由与反义链互补的荧光pna探针在不同的时间点测定fvii反义的浓度,结果显示在图25中。
[0960]
如图25所示,5分钟后仅大约10%的施用的fvii单体保留在循环中,并且在30分钟后全部基本消失。相比之下,几乎所有施用的fvii六聚体在5分钟后仍保留在循环中,30分钟后剩余初始剂量的三分之一。数据显示六聚体的体内循环半衰期比单体大大约30倍。
[0961]
实施例26:使用msd u-plex平台确定在t=5、30、60和120分钟时采集的血液样品中的细胞因子水平
[0962]
为了评估对六聚体的任何不良毒理学反应,使用msd u-plex平台对血液样品中的细胞因子水平进行了分析。分析来自单体xd-09794和同六聚体xd-09795治疗组的血液样品在不同时间点的细胞因子水平。测定了十种细胞因子(ifn-γ、il-1β、il-2、il-4、il-6、il-10、il-12p70、kc-gro、tnf-α和gm-csf)的血清水平,并如图26a-j所示。在测定的10种细胞因子中,4种细胞因子的血清水平在单体和六聚体之间没有变化,剩余6种中的血清水平几乎相同。
[0963]
实施例27:合成同多聚体
[0964]
使用以下序列经由上述方法制备针对fvii mrna的sirna的同多聚体:fvii有义:5
‘‑
gcafaafggfcgfugfccfaafcufcaf(invdt)-3
‘
(seq id no:35)fvii反义:5
‘‑
ufsgfagfuufggfcafcgfccfuufugfcusu-3
‘
(seq id no:26),所述序列经由如下的核酸内切酶可切割接头dcda和还原性可切割接头dtme连接:
[0965]
表18:实施例28-36中的寡核苷酸
[0966]
[0967][0968]
表19:fvii sirna同多聚体xd-10635、xd-10636、xd-06386、xd-10635
[0969]
[0970][0971]
实施例28:fvii单体xd-09794的合成
[0972]
合成并纯化在有义链上的5'-端有氨基官能的fvii sirna的单体有义链x18789,如图27a和27b所示。产量48.3mg,6.694mmol,18.6%。同样合成相应的反义链x18795,得到46.3mg,6.35mmol,31.9%。然后将5.35mg(747.3nmol)有义链和5.45mg(747.3nmol)反义链退火以产生10.8mg(747.4nmol)相应的双链fvii单体(xd-09794)。
[0973]
实施例29:fvii二聚体xd-10635的合成
[0974]
合成并纯化在3'-和5'-端分别有氨基和二硫基团并含有dcda可切割接头的fvii sirna x30833的同二聚体有义链,如图28a和28b所示。产量,35.8mg,6.694mmol,18.6%。
[0975]
然后将5.51mg(362.6nmol)有义链x30833和5.29mg(725.2nmol)反义链x18795退火以产生10.8mg(362.6nmol)的相应双链fvii同二聚体(xd-10635)。
[0976]
实施例30:fvii三聚体xd-10636的合成
[0977]
合成并纯化fvii sirna x34003的同三聚体有义链,分别在3'-和5'-端有氨基和二硫基团,并含有两个dcda可切割接头,如图29a和29b所示。产量,19.6mg(857.9nmol,19.3%)。
[0978]
然后将5.16mg(225.5nmol)的有义链x34003和4.93mg(676.5nmol)的反义链x18795退火以产生10.1mg(225.5nmol)的相应双链fvii同型三聚体(xd-10636)。
[0979]
实施例31:fvii四聚体xd-10637的合成
[0980]
合成并纯化fvii sirna x30836的同四聚体有义链,分别在3'-和5'-端有氨基和二硫基团,并含有三个dcda可切割接头,如图30a和30b所示。产量,53.1mg(1734.5nmol,13%)。
[0981]
然后将5.53mg(180.8nmol)有义链x30836和5.27mg(723.2nmol)反义链x18795退火以产生10.8mg(180.8nmol)的相应双链fvii同四聚体(xd-10637)。
[0982]
实施例32:fvii五聚体xd-10638的合成
[0983]
合成并纯化fvii sirna x34004的同五聚体有义链,分别在3'-和5'-端有氨基和
二硫基团,并含有四个dcda可切割接头,如图31a和31b所示。产量,35.9mg(938nmol,10.6%)。
[0984]
然后将5.53mg(144.5nmol)有义链x34004和5.27mg(723.2nmol)反义链x18795退火以产生10.8mg(144.5nmol)的相应双链fvii同五聚体(xd-10638)。
[0985]
实施例33:fvii六聚体xd-10639的合成
[0986]
合成并纯化fvii sirna x34005的同六聚体有义链,分别在3'-和5'-端有氨基和二硫基团,并含有五个dcda可切割接头,如图32a和32b所示。产量,21.4mg(466.1nmol,5.3%)。
[0987]
然后将5.15mg(144.5nmol)的有义链x34005和4.89mg(723.2nmol)的反义链x18795退火以产生10.04mg(111.9nmol)的相应双链fvii同六聚体(xd-10639)。
[0988]
实施例34:fvii六聚体xd-09795的合成
[0989]
如图33a-33b所示,经由在实施例28和30中制备的fvii sirna x30833的同二聚体有义链和fvii sirna x30836的同四聚体有义链合成和纯化在两个3'端都有氨基并含有四个dcda可切割接头和一个可还原切割的dtme接头的fvii sirna x30838的同六聚体有义链。使用dtt从x30833和x30836切割二硫基团,分别以97.6%和91.9%的产率得到相应的5-硫醇衍生物x30834和x30837。使用上述程序,然后将14.9mg(986.7nmol)x30834转化为10.6mg(700.5nmol,71.0%)相应的单dtme衍生物x30835,其与1当量的x30837反应得到4.2mg(90.7nmol,64%)的单链同六聚体x30838。然后将3.8mg(83nmol)有义链x30838和3.7mg(502nmol,6mol.equiv)反义链x18795退火以产生7.5mg(83.7nmol)的相应双链fvii同六聚体(xd-09795)。
[0990]
实施例35:fvii七聚体xd-10640的合成
[0991]
如图34a-34b所示,经由fvii sirna x30833的同二聚有义链和fvii sirna x34004的同五聚体有义链合成和纯化在两个3'端均具有氨基并含有五个dcda可切割接头的fvii sirna x34009的同七聚体有义链。使用dtt从x30833和x34004切割二硫基团,分别得到相应的5-硫醇衍生物x30834(28.3mg,1877.9nmol,86.7%)和x34006(21.8mg,572.2nmol)。然后使用上述程序将x30834转化为相应的单dtme衍生物x30835(22.6mg,1465.2nmol,78.1%)。8.8mg(572.2nmol)的x30835与x34006(21.8mg,572.2nmol)反应得到单链同七聚体x34009(8.96mg,167.3nmol,29.2%)。5.53mg(103.3nmol)有义链x34009和5.27mg(723.1nmol)反义链x18795然后退火以产生10.8mg(103.3nmol)的相应双链fvii同七聚体(xd-10640)。
[0992]
实施例36:fvii八聚体xd-10641的合成
[0993]
如图35a-35b所示,经由fvii sirna x30833的同二聚体有义链和fvii sirna x34005的同二聚体有义链合成和纯化在两个3'端均具有氨基并含有六个dcda可切割接头的fvii sirna x34010的同八聚体有义链。使用dtt从x34005上切割二硫基团以得到相应的5-硫醇衍生物x34007(11.5mg,251nmol,99.7%),将其与先前获得的单dtme同二聚体衍生物x30835(3.85mg,250.2nmol)反应得到单链同八聚体x34010(5.2mg,85.0nmol,34.0%)。然后将4.92mg(80.33nmol)有义链x34010和4.68mg(642.4nmol)反义链x18795退火以产生9.6mg(80.3nmol)的相应双链fvii同八聚体(xd-10641)。
[0994]
实施例37:动物实验
[0995]
同多聚体xd-10635、xd-10636、xd-10637、xd-10638、xd-10639、xd-10640和xd-10641以及相应的单体xd-09794的血清半衰期通过经由尾静脉对3组4只每组约11周龄c57/bl6n雌性小鼠iv推注浓度在x1 pbs中1ng/ml的测试材料来确定。fvii单体和fvii多聚体的剂量均为20mg/kg,并在5、30、60、120和360分钟抽取血液样品。血清样品用蛋白酶k消化,特异性互补atto425-肽核酸荧光探针与反义链杂交。随后的aex-hplc分析能够将完整的反义链与代谢物区分开来,从而致使该方法的高特异性。仅完整母体化合物的值显示在下表17中,并在下面图36a和36b中分别作为fvii多聚体的血清中fvii sirna水平随时间变化的平滑线散点图和直标记散点图来显示。
[0996]
表20:fvii同多聚体在血清中随时间变化的fvii sirna水平。
[0997]
[0998]
[0999]
[1000]
[1001]
[1002]
[1003]
[1004]
[1005]
[1006]
[1007]
[1008][1009]
图37a、37b、37c和37d分别显示fvii多聚体在5分钟、30分钟、60分钟和120分钟时血清中fvii sirna水平的条形图。
[1010]
图38a和38b显示fvii多聚体的血清中总fvii sirna水平,如曲线下面积所示,以ng*min/ml为单位,并相对于单体auc值标准化。
[1011]
表21:fvii sirna单体和多聚体的曲线下面积值。
[1012][1013]
多聚体的血清半衰期由fvii浓度数据根据以下等式使用非线性一相衰减计算:
[1014]
y=(y0
–
平台期(plateau))*exp(-k*x)+平台期
[1015]
其中y是时间x的浓度,半衰期是2/k的自然对数。关于初始和最终条件的4种不同假设应用如下:
[1016]
1:没有对数据做任何假设
[1017]
2:所有sirna都以相同的初始浓度注射(即t=0时的浓度对所有都相同)。
[1018]
3:所有sirna浓度在t=无穷大时都衰减到0。
[1019]
4:所有sirna均以相同的初始浓度注射(即,t=0时的浓度对所有都相同),所有
sirna浓度在t=无穷大时均衰减到0。
[1020]
表22:fvii sirna同多聚体的计算的血清半衰期。
[1021][1022]
实施例38:计算fvii sirna同多聚体在5分钟达到与单体相同的fvii sirna浓度所需的时间
[1023]
因为单体的fvii浓度已经显著低于在第一个样品时间(5分钟)注射的浓度的50%,所以多聚体的血清fvii水平在5分钟时等于单体的血清水平所用的时间也使用以下等式计算:
[1024]
y=(y0-平台期)*exp(-k*x)+平台期
[1025]
其中平台期设定为在5分钟的单体浓度(34,245ng/ml),如图39所示。
[1026]
进行以下计算以确定fvii sirna同多聚体在5分钟时达到fvii sirna单体浓度的时间(以分钟为单位):
[1027]
y=(y0-平台期)*exp(-k*x)+平台期,其中x是以分钟为单位的时间34245=(231173-0)*e^(-kx)+0,其中x是分钟
[1028]
34245=231173*^e(-kx)
[1029]
0.14813453=e^-kx
[1030]
in(0.14813453)=kx
[1031]-1.909625779=kx
[1032]
表23:fvii sirna同多聚体在5分钟达到fvii sirna单体浓度的计算时间。
[1033][1034]
实施例39:sirna的galnac 4:1:1fvii:apob:ttr异六聚体的制备
[1035]
galnac 4:1:1fvii:apob:ttr异六聚体经由图42所示的反应顺序制备。灰色框中的寡核苷酸是根据上面“附加的一般程序1:单链寡核苷酸合成”中的方法在合成器上制备的,剩余的寡核苷酸根据实施例1-6中的程序制备。制备的序列如要点中所示,其中“x”、“x”和“xf”分别代表核糖核苷酸、2'-o-甲基核糖核苷酸和2'-氟-2'-脱氧核糖核苷酸。“invdt”代表反向脱氧胸苷残基,“s”代表硫代磷酸酯连接。“(shc6)”和“(c6ssc6)”分别代表硫己基和二己基二硫化物接头。“c6nh
2”和“c6nh”可互换使用以表示氨基己基接头。“(dtme)”代表二硫代双马来酰亚胺乙烷。具体的sirna序列在下表24中列出。
[1036]
表24:实施例39中的寡核苷酸序列
[1037][1038]
如上所述,用于产生x39850、galnac缀合的fvii有义链和x39851、有游离5'-氨基和3'硫醇基团的fvii有义链的一般反应方案显示在图43中。反相hplc(rp-hplc)和质谱(ms)用于确认x39850、x39851、x18795和x39855的纯度(图44-图47)。
[1039]
进行逐步退火以获得具有apob反义突出端的所需异二聚体双链体。首先,将缀合有galnac的fvii有义链x39850与1摩尔当量的反义x18795退火形成双链体x39850-x18795。rp-hplc确定双链体纯度为78.2%(图48)。然后将fvii双链体x39850-x18795与fvii有义链x39851缀合,然后进行离子交换纯化以形成x39850-x18795-x39851。rp-hplc确定双链体纯度为87.0%(图49)。接下来,将1摩尔当量的二聚体反义链x39855添加到x39850-x18795-x39851双链体中以形成x39850-x18795-x39851-x39855。rp-hplc确定双链体纯度为97.6%(图50)。
[1040]
生成x39852(fvii有义链经由二硫连接连接到ttr有义链)、x39854(fvii反义链经由二硫连接连接到ttr反义链)和x39853(经由二硫连接连接到apob有义链)。rp-hplc和ms用于确认x39852、x39854和x39853的纯度(图51-53)。
[1041]
进行逐步退火以获得具有apob有义突出端的所需异三聚体双链体。首先,二聚体有义链x39852与1摩尔当量的反义x18795退火形成双链体x39852-x18795。rp-hplc确定双链体纯度为99.5%(图54)。接下来,将1摩尔当量的二聚体反义链x39854添加到x39852-x18795双链体中以形成x39852-x18795-x39854。rp-hplc确定双链体纯度为94.9%(图55)。最后,将1摩尔当量的二聚体有义链x39853添加到x39852-x18795-x39854双链体中,然后进行离子交换纯化以形成x39852-x18795-x39854-x39853。rp-hplc确定双链体纯度为98.3%(图56)。
[1042]
通过退火等摩尔量的上述双链体中的每一个形成最终的缀合有galnac的异六聚体sirna。rp-hplc确定双链体纯度为96.7%(图57a),ms确定正确的种类的存在(图57b)。
[1043]
实施例40:确定通过4:1:1fvii:apob:ttr异六聚体敲低靶物
[1044]
先前已经表明,当静脉内施用时发生包括galnac定向寡核苷酸的单体sirna的快速排泄和低生物活性,并且为了避免这种损失,有必要皮下施用寡核苷酸(subramanian,rr et al,nucleic acids research,vol 43,no 19,9123-9132,2015)。本公开的特征是,当静脉内施用时,本公开的多聚体相对于皮下施用的相应单体具有优异的生物活性。
[1045]
这展示如下:根据上述“一般程序4:动物实验”中的方法,以6mg/kg的剂量静脉内施用4:1:1fvii:apob:ttr异六聚体(相当于4mg/kg的sifvii、1mg/kg的siapob和1mg/kg的sittr)到每组5只小鼠的组中。在第-1、1、3和7天采集血液样品,并根据上文“一般程序5:基因敲低的测量”中描述的方法和程序进行分析。
[1046]
通过皮下和静脉内途径施用的六聚体在不同时间点的ttr蛋白的敲低显示在图58中。
[1047]
可以看出,经由静脉内施用的1mg/kg敲低ttr为大约60%。这超过皮下施用的1mg/kg单体galnac ttr的约50%敲低(subramanian,rr et al,同上),并且远远优于静脉内施用的相同单体材料的基本零敲低(nair,j.k.,et al;j.am.chem.soc.,2014,136(49),pp 16958
–
16961)。因此,与皮下递送的相同剂量水平的galnac缀合的sittr单体相比,静脉内递送的galnac缀合的异六聚体sirna内的sittr的一个亚基展示出相同或甚至增加的体内活性。
[1048]
不同时间点时,fvii水平也展示了galnac 4:1:1六聚体的这种有效敲低。因此,以4mg/kg fvii等同的剂量静脉内施用galnac六聚体提供了与皮下施用3mg/kg galnac fvii单体所提供的等同或更好的敲低。
[1049]
实施例41:靶向ttr的同四聚体的合成——方案1
[1050]
根据方案1(图59),通过在合成器外(ex synthesizer)连接两个双链同二聚体来合成靶向ttr的sirna的同四聚体。以通过核酸酶可切割的接头dtdtdtdt连接的单链制备二聚体,所述接头在任一末端具有末端烷基氨基和二硫基团。在将三触角型galnac配体添加到氨基端并切割二硫化物以产生相应的硫醇后,经由添加dtme制备四聚体单链有义链。添加4当量的ttr反义链得到双(三触角型galnac)同四聚体sittr。
[1051]
这种材料的生物活性是通过sc施用到小鼠来评估的,并在不同的时间点采集血液样品。确定这些时间点的ttr蛋白水平。
[1052]
作为对照,经由sc施用靶向ttr的单体sirna,并与同四聚体的结果进行比较。来自施用多聚体sirna的小鼠的血液样品中的ttr蛋白水平当与来自施用单体sirna的小鼠的血液样品中的ttr蛋白水平相比时可以是低约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。
[1053]
本文所述的方法可用于制备由结构b表示的多聚体寡核苷酸:
[1054]
其中(galnac)3是三触角型galnac;nh是仲胺;dt是脱氧胸苷残基;和-s-cl-s-是
[1055]
[1056]
实施例42:靶向ttr的同四聚体的合成——方案2
[1057]
根据方案2(图60),通过在合成器外连接两个ds同二聚体来合成靶向ttr的sirna同四聚体。以通过核酸酶可切割的接头dtdtdtdt连接的单链制备二聚体,所述接头在任一末端出具有末端烷基氨基和二硫基团。将三触角型galnac配体添加到链的一部分的氨基端,并在切割二硫化物以产生相应的硫醇后,如前所述将其转化为相应的单dtme衍生物。加入衍生自单链材料的硫醇化二聚体(在合成器外),随后用4当量退火得到单-(三触角型galnac))同四聚体sittr。
[1058]
这种材料的生物活性是通过sc施用给小鼠来评估的,并在不同的时间点采集血液样品。确定这些时间点的ttr蛋白水平。作为对照,皮下施用靶向ttr的单体sirna,并与同四聚体的结果进行比较。来自施用多聚体sirna的小鼠的血液样品中的ttr蛋白水平当与来自施用单体sirna的小鼠的血液样品中的ttr蛋白水平相比时可以低约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。
[1059]
本文所述的方法可用于制备由结构c表示的多聚体寡核苷酸:
[1060]-nh2;其中(galnac)3是三触角型galnac;nh2是伯胺;nh是仲胺;dt是脱氧胸苷残基;和-s-cl-s-是
[1061][1062]
实施例43:靶向ttr的同四聚体的合成——方案3
[1063]
根据方案3(图61),通过在合成器外连接两个ds同二聚体来合成靶向ttr的sirna同四聚体。以通过核酸酶可切割的接头dtdtdtdt连接的单链制备二聚体,所述接头在任一末端具有末端烷基氨基和二硫基团。将单触角型galnac配体添加到氨基端并切割二硫化物以产生相应的硫醇后,经由添加dtme制备四聚体单链有义链。添加4当量的ttr反义链(每个与单体galnac配体缀合)得到与六个单体galnac配体连接的同四聚体sittr。
[1064]
这种材料的生物活性是通过sc施用给小鼠来评估的,并在不同的时间点采集血液样品。确定这些时间点的ttr蛋白水平。作为对照,皮下施用靶向ttr的单体sirna,并与同四聚体的结果进行比较。来自施用多聚体sirna的小鼠的血液样品中的ttr蛋白水平当与来自施用单体sirna的小鼠的血液样品中的ttr蛋白水平相比时可以低约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。
[1065]
本文所述的方法可用于制备由结构e表示的多聚体寡核苷酸:
[1066][1067]
其中(galnac)3是单触角型galnac;nh是仲胺;dt是脱氧胸苷残基;和-s-cl-s-是
[1068][1069]
实施例44:靶向ttr的同四聚体的合成——方案4
[1070]
根据方案4(图62),通过在合成器外连接两个ds同二聚体来合成靶向ttr的sirna同四聚体。以通过核酸酶可切割的接头dtdtdtdt连接的单链制备二聚体,所述接头在任一末端具有末端的烷基氨基和二硫基团。将三触角型galnac配体添加到链的一部分的氨基端,并在切割二硫化物以产生相应的硫醇后,如前所述将其转化为相应的单dtme衍生物。将内体逃逸配体添加到链的剩余部分的氨基端,并在二硫化物切割以产生相应的硫醇,其与先前获得的单dtme衍生物反应。随后用4当量的ttr反义链退火得到与内体逃逸配体缀合的单-(三触角型galnac)同四聚体sittr。
[1071]
这种材料的生物活性是通过sc施用给小鼠来评估的,并在不同的时间点采集血液样品。确定这些时间点的ttr蛋白水平。作为对照,皮下施用靶向ttr的单体sirna,并与同四聚体的结果进行比较。来自施用多聚体sirna的小鼠的血液样品中的ttr蛋白水平当与来自施用单体sirna的小鼠的血液样品中的ttr蛋白水平相比时可以低约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。
[1072]
本文所述的方法可用于制备由结构d表示的多聚体寡核苷酸:
[1073]
其中(galnac)3是三触角型galnac;nh是仲胺;eem是内体逃逸部分;dt是脱氧胸苷残基;和-s-cl-s-是
[1074][1075]
实施例45:确定多聚体大小对从皮下组织的释放速率的影响
[1076]
制备从单体到八聚体的一系列fvii sirna寡聚体。1聚体-6聚体直接从合成器获得,并且7聚体和8聚体分别经由五聚体和六聚体,经由单dtme衍生物连接到二聚体以得到二硫化物连接的产物,如前所述(图63).
[1077]
1聚体至8聚体中的每一个经由sc施用以20mg/kg分别施用于c57bl/6n小鼠,并在5、30、60、240、600和1440分钟时采集血液样品。用蛋白酶k消化样品并添加特异性互补atto425-肽核酸荧光探针并与fvii sirna反义链杂交。通过随后的aex-hplc分析确定各个时间点的sifvii浓度。根据实施例37中的方法绘制和分析结果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1