一株可高效降解氨氮的嗜盐亚麻短杆菌及其应用
本发明涉及污水处理领域,尤其涉及一株可高效降解氨氮的嗜盐亚麻短杆菌及其应用。
背景技术:
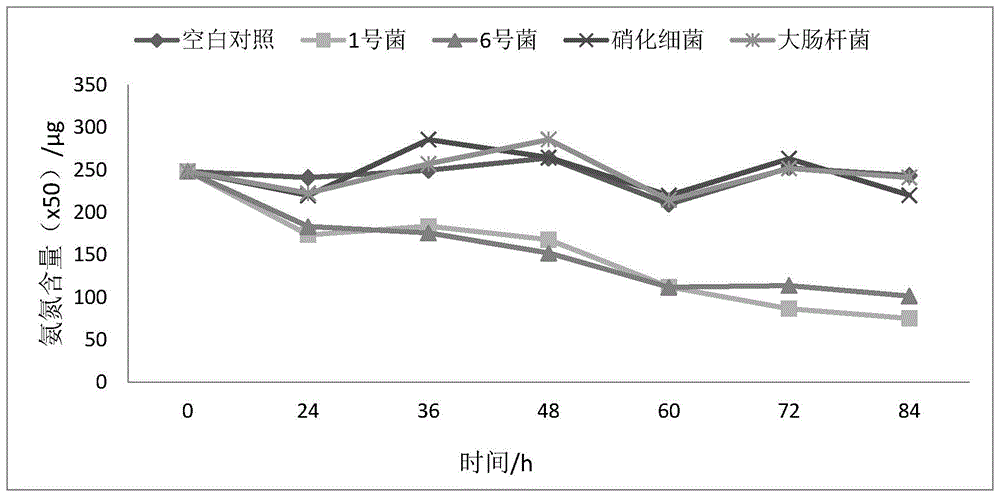
:化工、食品、皮革、水产养殖及其他行业产生大量的高盐度废水,约占全球废水排放量的5%。高盐度废水通常富含高浓度的氮、可溶性无机盐和有机化合物。由于高盐废水在污水处理和海洋环境保护中的重要部分,高盐废水的处理引起了社会的广泛关注。在污水脱氮处理中,物理化学方法成本高昂,并且可能产生其他有害的二次污染物。生物方法与物理和化学方法相比,具有良好的处理性能,相对较低的能耗和较低的投资/运营成本。但当应用于高盐废水的脱氮处理时,由于盐度会改变微生物的渗透压,进而降低酶活性,包括与脱氮相关的代谢活性,导致细胞生长受阻甚至菌体死亡,限制了微生物脱氮方法在高盐污水处理中的应用。亚麻短杆菌(brevibacteriumlinens)是干酪加工时使用的表面成熟菌种,将其活化菌液喷在干酪表面后,能通过水解蛋白质促进干酪成熟,产生甲醇改善干酪的风味。目前尚未有文献报道亚麻短杆菌具有耐盐以及高效降解氨氮的能力。技术实现要素:为了解决上述技术问题,本发明提供了一株可高效降解氨氮的嗜盐亚麻短杆菌及其应用。该亚麻短杆菌能在高盐环境下生长繁殖,并保持较强的氨氮降解能力,可应用于高盐污水的氨氮降解处理,且具有处理时间短的优点。本发明的具体技术方案为:第一方面,本发明提供了一株可高效降解氨氮的嗜盐亚麻短杆菌,所述亚麻短杆菌命名为b1,已在2019年7月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno.18298,微生物分类命名为亚麻短杆菌brevibacteriumlines。本发明的亚麻短杆菌b1筛选自丽水某工厂的高盐污水,具有较强的氨氮降解能力,并能耐受高盐环境,在1%-10%的盐度条件下能够生长并保持较高的氨氮去除效率,当应用于高盐污水氨氮降解处理时,具有处理时间短的优点。经测试,在4%盐度条件下,亚麻短杆菌b1在2天时的氨氮去除率可达57%-67%,4天时的氨氮去除率可达94%;在高盐(10%盐度)条件下,亚麻短杆菌b1在4天时的氨氮去除率可达63.78%,在6天时的氨氮去除率可达82.94%。运用亚麻短杆菌b1对高盐污水进行处理,发现在高盐污水中投入菌株培养3天后,氨氮去除率可达到80%以上;将亚麻短杆菌b1运用于外置式膜生物反应器,投放菌株7d时,经过膜生物反应器的污水氨氮去除率可达96.30%,且比不添加菌剂的氨氮去除率高66.67%。第二方面,本发明提供了一种可高效降解氨氮的嗜盐亚麻短杆菌的突变体,其特征在于,所述突变体为对所述亚麻短杆菌进行诱变、驯化、基因重组或者经自然突变而获得的突变体。第三方面,本发明提供了一种含有所述亚麻短杆菌或含有所述突变体的菌体培养物。作为优选,所述菌体培养物为菌液或菌剂。第四方面,本发明提供了所述亚麻短杆菌或所述突变体或所述菌体培养物在高盐污水氨氮降解处理中的应用。作为优选,高盐污水中添加有碳源。作为优选,所述碳源为柠檬酸钠和/或乙酸钠。在污水中加入碳源能为亚麻短杆菌b1提供能量,以促进其生长繁殖和对氨氮的降解。碳源种类会影响氨氮降解效率,对于本发明的亚麻短杆菌b1而言,当以柠檬酸钠和乙酸钠作为碳源时,菌株的氨氮降解效率较高;特别是采用柠檬酸钠时,2天时氨氮去除率达到87.58%,2.5天时可达93.55%。作为优选,所述应用包括以下步骤:将所述亚麻短杆菌或突变体或菌体培养物投放到膜生物反应器中,运用膜生物反应器进行高盐污水氨氮降解处理。作为优选,所述膜生物反应器为外置式膜生物反应器。在实际应用中,向水体中投放游离菌株的脱氮效果往往不佳,故目前在污水的微生物脱氮处理中应用较多的是活性污泥法和膜生物反应器。但是活性污泥工艺占地面积大,工艺设计复杂,且应用于高盐污水处理时,含盐废水产生的较大浮力会导致普通絮状污泥上浮流失;而膜结垢则是膜生物反应器运行的主要挑战。本发明采用外置式膜生物反应器进行高盐污水脱氮处理,能克服活性污泥法絮状污泥上浮流失的问题,且清洗方便,能克服内置式膜生物反应器膜结垢的问题。与现有技术相比,本发明具有以下优点:(1)本发明的亚麻短杆菌b1具有较强的氨氮降解能力,且对高盐环境的耐受性较好,能应用于高盐污水的氨氮降解处理,且处理时间短;(2)本发明在亚麻短杆菌b1处理高盐污水的过程中,采用柠檬酸钠、乙酸钠作为碳源,能有效提高氨氮降解效率。附图说明图1为1号菌株、6号菌株、大肠杆菌和硝化细菌在6%盐度下的氨氮含量变化曲线;图2为氨氮标准曲线;图3为1号菌株、6号菌株、大肠杆菌和硝化细菌在1%盐度下的氨氮降解曲线;图4为1号菌株和6号菌株在不同盐度下的生长曲线;其中,图(a)为1号菌株和6号菌株在1%盐度下的生长曲线,图(b)为1号菌株和6号菌株在4%盐度下的生长曲线,图(c)为1号菌株和6号菌株在7%盐度下的生长曲线,图(d)为1号菌株和6号菌株在10%盐度下的生长曲线;图(a)-图(d)中,“c”表示空白对照,“g1”表示1号菌株,g6表示6号菌株;图5为1号菌株和6号菌株在不同盐度下的氨氮降解曲线;其中,图(a)为1号菌株和6号菌株在1%盐度下的吸光度变化曲线,图(b)为1号菌株和6号菌株在4%盐度下的吸光度变化曲线,图(c)为1号菌株和6号菌株在7%盐度下的吸光度变化曲线,图(d)为1号菌株和6号菌株在10%盐度下的吸光度变化曲线;图(a)-图(d)中,“c”表示空白对照,“g1”表示1号菌株,g6表示6号菌株。具体实施方式下面结合实施例对本发明作进一步的描述。实施例1:筛选分离菌株选择性固体培养基:胰蛋白胨5.00g/l;酵母提取物1.00g/l;氯化钠19.45g/l;无水mgcl5.90g/l;na2so4·10h2o3.24g/l;cacl1.80g/l;kcl0.55g/l;nahco30.16g/l;h3bo322mg/l;na2hpo48mg/l;琼脂15g/l。菌株筛选自丽水某工厂的高盐污水,取50ml污水,12000rpm,10min离心,弃上清,加水至1ml混匀。加入9ml水,形成10-1的稀释液。从10-1的稀释液中取1ml加入9ml的无菌水中,制成10-2稀释液,以此类推,对最终获得的菌液做一系列梯度稀释,并取0.1ml涂布于分离培养基,30℃恒温培养至得长出单菌落。对颜色、形态不同的单菌落进行划线分离纯化,挑取了6个单菌落,纯化后分别接入6个lb培养基中,220rpm,30℃恒温培养,收集菌体于30%甘油中,置于-80℃冰箱保存,将6个菌株依次编号。实施例2:菌株氨氮降解能力测试1氨氮标准曲线在8个50ml容量瓶中,分别加入0.00ml、0.50ml、1.00ml、2.00ml、4.00ml、8.00ml、和10.00ml氨氮标准工作溶液,其所对应的氨氮含量分别为0.0μg、5.0μg、10.0μg、20.0μg、40.0μg、60.0μg、80.0μg和100μg,加水至标线。加入1.0ml酒石酸钾钠溶液,摇匀,再加入1.0ml纳氏试剂,摇匀。放置10min后,在波长420nm下,用10mm比色皿,以水作参比,测量吸光度以空白校正后的吸光度为纵坐标,以其对应的氨氮含量(μg)为横坐标,绘制校准曲线,获得的标准曲线如图2所示。2菌株的氨氮降解能力从平板上挑取单菌落接种到液体lb试管内,30℃摇床220rpm转速培养1天。取1ml菌液12000rpm离心1min,加入1ml去离子水重悬,12000rpm离心1min弃上清,重复做2组。取0.05g沉淀用人工水样重悬后投入100ml的人工水样,30℃摇床培养2天。空白对照不加菌液。上述人工水样的配方如下:(nh4)2so40.5g/l;氯化钠40g/l;naac3.6g/l;k2hpo41g/l;feso4·7h2o30mg/l;mgso4·7h2o30mg/l。按照以下方法检测培养2天后的氨氮去除率:取5ml去离子水于试管,加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂,涡旋混匀,用于调零。取1ml培养液于ep管,12000rpm离心1min。取0.5ml上清取于试管,加入4.5ml去离子水(稀释10倍)。取1ml稀释液于试管,加入4ml去离子水(稀释50倍),加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂涡旋混匀。静置10min。420nm测紫外吸光度值,并结合标准曲线(图2)获得氨氮去除率,结果见表1。表1培养2d后6个菌株的氨氮去除率菌株编号氨氮去除率154.59%26.25%311.94%4-1.15%5-1.72%667.01%通过比较不同菌株的氨氮降解能力,发现6号菌株具有最高的氨氮降解效率,达67.01%;其次是1号菌株,达54.59%。3重复实验按照“2检测菌株的氨氮降解能力”中的方法,对1号菌株和6号菌株进行重复实验,分别在2天、4天后检测吸光度值,结合标准曲线(图2)获得氨氮含量,计算氨氮去除率,结果见表2。表2培养2d和4d后1、6号菌株的氨氮去除率从表2可以看出,在2天时,6号菌株的氨氮去除率明显高于1号菌株;在4天时,6号菌株和4号菌株的氨氮去除率相近,均达到90%以上。4低盐和高盐条件下的氨氮降解能力将1、6号菌株和大肠杆菌、购买的prodibio科迪硝化细菌(mesorhizobiumsp.jg04)接种到液体lb培养基内,30℃摇床220rpm转速培养1天。取2ml菌液12000rpm离心1min,加入1ml去离子水重悬,12000rpm离心1min弃上清,重复做4组。取0.1g沉淀用盐度分别为1%和6%的人工水样重悬后投入100ml相应的人工水样,30℃摇床220rpm转速培养。空白对照不加菌液。1天后每隔12h测一次氨氮含量。上述盐度为1%的人工水样的配方如下:(nh4)2so40.5g/l;氯化钠10g/l;naac3.6g/l;k2hpo41g/l;feso4·7h2o30mg/l;mgso4·7h2o30mg/l。盐度为6%的人工水样的配方如下:(nh4)2so40.5g/l;氯化钠60g/l;naac3.6g/l;k2hpo41g/l;feso4·7h2o30mg/l;mgso4·7h2o30mg/l。按照以下方法检测氨氮去除率:取5ml去离子水于试管,加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂,涡旋混匀,用于调零。取1ml培养液于ep管,12000rpm离心1min。取0.5ml上清于试管,加入4.5ml去离子水(稀释10倍)。取1ml稀释液于试管,加入4ml水(稀释50倍),加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂涡旋混匀。静置10min。420nm测紫外吸光度值,并结合标准曲线(图2)获得氨氮含量,1%和6%盐度下的氨氮含量变化曲线分别如图3和图1所示。从图3和图1可以看出,1、6号菌株的氨氮降解能力相近;在低盐条件下,硝化细菌的氨氮降解效率高于1、6号菌株;但在高盐条件下,硝化细菌和大肠杆菌无法发挥降解氨氮的作用,而1、6号菌株仍能保持较高的氨氮降解能力。实施例3:1、6号菌株耐盐性能测试1不同盐度下的生长曲线分别检测盐度为1%、4%、7%、10%下1号菌株和6号菌株的生长曲线,结果如图4所示。从图4可以看出,1号菌株和6号菌株均能在1%-10%的盐度下生长繁殖。2不同盐度下的氨氮降解能力将1、6号菌株接种到液体lb培养基内,30℃摇床220rpm转速培养1天。取2ml菌液12000rpm离心1min,加入1ml去离子水重悬,12000rpm离心1min弃上清,重复做4组。沉淀用盐度分别为1%、4%、7%和10%的人工水样重悬后投入100ml相应的人工水样,30℃摇床220rpm转速培养。空白对照不加菌液。每隔12h测一次吸光度。上述盐度为1%的人工水样的配方如下:(nh4)2so40.5g/l;氯化钠10g/l;naac3.6g/l;k2hpo41g/l;feso4·7h2o30mg/l;mgso4·7h2o30mg/l。盐度为4%、7%、10%的人工水样分别将氯化钠浓度换成40g/l、70g/l、100g/l,其余成分与盐度为1%的人工水样相同。按照以下方法检测吸光度:取5ml去离子水于试管,加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂,涡旋混匀,用于调零。取1ml培养液于ep管,12000rpm离心1min。取0.5ml上清于试管,加入4.5ml去离子水(稀释10倍)。取1ml稀释液于试管,加入4ml水(稀释50倍),加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂涡旋混匀。静置10min。420nm测紫外吸光度值,各盐度下的吸光度变化曲线如图5所示。从图5可以看出,1号菌株和6号菌株在1%-10%盐度下均能保持较高的氨氮降解能力,具有较高的耐盐能力。在10%盐度下,1号菌株在4天时的氨氮去除率可达63.24%,在6天时的氨氮去除率可达78.24%,6号菌株在4天时的氨氮去除率可达63.78%,在6天时的氨氮去除率可达82.94%。实施例4:1、6号菌株对高盐废水的氨氮降解能力测试从1、6号平板上挑取单菌落接种到液体lb试管内,30℃摇床220rpm转速培养1天。取1ml菌液12000rpm离心1min,加入1ml去离子水重悬,12000rpm离心1min弃上清,重复做4组。取0.05g沉淀,用生活垃圾填埋场垃圾渗滤液(高盐废水)重悬后,投入加了0.8g乙酸钠的30ml废水水样,一组用250ml锥形瓶,另一组用500ml锥形瓶。30℃摇床,转速220rpm培养3天。空白对照不加菌液。按照以下方法检测氨氮去除率:取5ml去离子水于试管,加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂,涡旋混匀,用于调零。取1ml培养液于ep管,12000rpm离心1min。取0.5ml上清于试管,加入4.5ml水(稀释10倍)。取1ml稀释液于试管,加入4ml水(稀释50倍),加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂涡旋混匀。静置10min。420nm测紫外吸光度值,结合标准曲线(图2)获得氨氮含量,计算氨氮去除率,结果见表3。表3培养3d后1、6号菌株对废水的氨氮去除率从表3可以看出,相较于1号菌株而言,6号菌株对废水中的氨氮降解效率更高,且在250ml锥形瓶和500ml锥形瓶中的氨氮去除率均在80%以上,受空间的限制较小。实施例5:6号菌株的鉴定根据实施例2-4的测试结果,1号菌株和6号菌株均能耐受1%-10%的盐度,在短时间内,6号菌株的氨氮去除率显著高于1号菌株,且受空间的限制较小,故选择6号菌株作为本发明的可高效降解氨氮的嗜盐菌株。提取6号菌株的dna,pcr扩增其16srrna基因,用少量pcr产物进行琼脂糖凝胶电泳验证,其余pcr产物送与擎科生物公司纯化并进行测序,测序结果用blast软件进行序列分析,并与genbank中的已知的16srrna基因进行最高同源性比对。经鉴定发现,6号菌株属于亚麻短杆菌(brevibacteriumlinens)。将该亚麻短杆菌命名为b1。实施例6:不同碳源对亚麻短杆菌b1氨氮降解能力的影响从平板上挑取亚麻短杆菌b1单菌落接种到液体lb试管内,30℃摇床220rpm转速培养1天。取1ml菌液12000rpm离心1min,加入1ml去离子水重悬,12000rpm离心1min弃上清,重复做2组。取0.05g沉淀用人工水样重悬后投入100ml的人工水样,30℃摇床培养1天后,每隔12h检测氨氮去除率。空白对照不加菌液。上述人工水样的配方如下:(nh4)2so40.5g/l;氯化钠40g/l;碳源3.6g/l;k2hpo41g/l;feso4·7h2o30mg/l;mgso4·7h2o30mg/l。碳源分别为柠檬酸钠、乙酸钠、葡萄糖、甲醇。按照以下方法检测氨氮去除率:取5ml去离子水于试管,加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂,涡旋混匀,用于调零。取1ml培养液于ep管,12000rpm离心1min。取0.5ml上清取于试管,加入4.5ml去离子水(稀释10倍)。取1ml稀释液于试管,加入4ml去离子水(稀释50倍),加0.1ml酒石酸钾钠(0.5g/ml)涡旋混匀,加0.1ml纳氏试剂涡旋混匀。静置10min。420nm测紫外吸光度值,并结合标准曲线(图2)获得氨氮去除率,结果见表4。表4不同碳源下亚麻短杆菌b1的氨氮去除率碳源24h氨氮去除率36h氨氮去除率48h氨氮去除率60h氨氮去除率柠檬酸钠32.11%64.39%87.58%93.55%乙酸钠10.90%19.04%54.96%68.88%葡萄糖7.85%21.68%26.07%20.98%甲醇-0.33%1.57%5.22%9.01%通过比较不同碳源下亚麻短杆菌b1的氨氮降解效率,发现在以柠檬酸钠作为碳源时,亚麻短杆菌b1具有最高的氨氮降解能力,60h氨氮去除率达到了93.55%,其次是乙酸钠,在60h时氨氮去除率可达68.88%。实施例7:亚麻短杆菌b1对高盐污水中的氨氮降解效果1案例1用移液枪取10μl亚麻短杆菌b1的冻存菌,将它们分别接种于5ml液体lb培养基中,于220rpm、30℃恒温振荡过夜培养,将菌株活化。取某生活垃圾填埋场垃圾渗滤液(高盐污水)0.1l,加入3.6g/l乙酸钠作为碳源,将亚麻短杆菌b1按1%的接种量加入该污水,空白对照不加菌液,于220rpm、30℃恒温振荡培养,3天后测氨氮含量。空白对照氨氮含量为362.87mg/ml,实验组氨氮含量为48.98mg/ml,氨氮去除效率为86.52%。2案例2用移液枪取10μl亚麻短杆菌b1的冻存菌,将它们分别接种于5ml液体lb培养基中,于220rpm、30℃恒温振荡过夜培养,将菌株活化。取某生活垃圾填埋场垃圾渗滤液(高盐污水)0.2l,加入3.6g/l乙酸钠作为碳源,将亚麻短杆菌b1按1%的接种量加入该污水,空白对照不加菌液,于220rpm、30℃恒温振荡培养,3天后测氨氮含量。空白对照氨氮含量为324.9mg/l,实验组氨氮含量为52.68mg/l,氨氮去除效率为83.79%。实施例8:亚麻短杆菌b1与膜生物反应器结合进行高盐污水的脱氮处理通过以下步骤对高盐污水进行脱氮处理:(1)将某生活垃圾填埋场垃圾渗滤液(氨氮含量650-700ppm,电导率26000-32000us/cm)通入调节池中,混合均匀;(2)将步骤(1)处理后的污水通入混凝沉淀池,向混凝沉淀池中加入硫酸亚铁、片碱和聚合氯化铝,混合均匀后,再加入聚丙烯酰胺,混合均匀;(3)将步骤(2)处理后获得的上清液通入中间水池,混凝沉淀池中剩余的污泥经污泥浓缩池浓缩后,上清液回流至调节池;(4)将中间水池中的污水通入反硝化池中进行反硝化,再通入硝化池中进行硝化;污水在硝化池中的停留时间为2.5d,在反硝化池中的停留时间为3.5d;(5)将步骤(4)处理后的污水通入外置式超滤系统进行超滤,超滤获得的滤液进行纳滤/反渗透膜处理,超滤后被截留的污泥回流至反硝化池和硝化池。在上述步骤中,硝化池的体积为700m3和960m3;污水的水温为28℃,日处理水量为280t,乙酸钠、柠檬酸钠、硫酸亚铁、片碱、聚合氯化铝、聚丙烯酰胺的每日添加量分别为25kg、25kg、1kg、50kg、25kg、1kg;污水从进入调节池到经纳滤/反渗透膜排出的总停留时间为5天。在24h时,向调节池中加入亚麻短杆菌b1菌剂(其中,亚麻短杆菌b1的含量为108cfu/ml),在0-192h内,每隔24h对纳滤/反渗透膜处理后出水中的氨氮含量进行检测,结果见表5。表5加入菌剂后不同时间纳滤/反渗透膜处理后出水中的氨氮含量时间/h氨氮含量/(mg·l-1)0476244224831072172966512028144311682519227从表5可以看出,将亚麻短杆菌b1与膜生物反应器结合后,能有效降低污水中的氨氮含量,在投放亚麻短杆菌b17天时,膜生物反应器的氨氮去除率可达94.32%,比不添加菌剂的氨氮去除率高66.67%。本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1