一种角蛋白肽修饰的壳聚糖衍生物及其制备方法、应用和药物组合物
1.本发明属于生物医药材料技术领域,具体讲,涉及一种角蛋白肽修饰的壳聚糖衍生物及其制备方法、应用和药物组合物。
背景技术:
2.角蛋白广泛存在于毛发、指甲及动物组织中,是自然界中最为丰富的蛋白质资源之一。角蛋白作为天然聚合物,具有良好的生物可降解性和生物相容性。角蛋白结构中富含半胱氨酸残基,这些半胱氨酸残基可以通过二硫键在分子链内和链间相互作用,形成具有三维网状的紧凑空间结构,使角蛋白的稳定性和机械性能由于其它蛋白类生物材料。因此,角蛋白材料已经越来越多地应用于生物医学、药学、食品、护肤和纺织等行业。但是目前角蛋白原料因开发利用不足,而被纺织工业或屠宰场作为废物通过焚化或掩埋处理,这种处理方式不但会引起巨大的经济损失,还会造成严重的环境污染。
3.角蛋白肽作为角蛋白的水解产物,除了具有良好的生物可降解性、生物相容性、无免疫反应等优点外,还因其结构中含有细胞黏附序列亮氨酸-天冬氨酸-缬氨酸(ldv)、谷氨酸-天冬氨酸-丝氨酸(eds)和精氨酸-甘氨酸-天冬氨酸(rgd),可与细胞表面的蛋白、脂质等成分相互作用,而被应用于生物医药材料领域。角蛋白肽作为天然黏附性材料,虽然具有诸多优点,但是其本身还存在重现性差、理化性能有限等缺点。因此,需要经过适当的修饰以增强其适用性能。
4.天然多糖广泛存在与植物、动物和微生物组织中,具有多种重要的功能,其包括纤维素、淀粉、甲壳素、壳聚糖等。壳聚糖是一种典型的来源丰源的天然多糖,结构中具有大量的正电基团,具有弱碱性,因此具有良好的生物可降解性和生物相容性、生物黏附性而被广泛应用于生物医药材料领域。壳聚糖的生物黏附性仅靠其携带的正电荷与细胞膜之间的负电相互作用,具有一定的局限性,因此需要经过具有生物黏附作用的活性肽修饰以进一步增强其生物黏附性和适用性。
5.目前尚没有关于利用天然角蛋白肽修饰的壳聚糖衍生物及其应用和药物组合物的相关报道。
技术实现要素:
6.本发明的首要发明目的在于提出一种角蛋白肽修饰的天然多糖衍生物,尤其涉及角蛋白肽修饰的壳聚糖衍生物。
7.本发明的第二发明目的在于提出上述衍生物的制备方法。
8.本发明的第三发明目的在于提出上述衍生物的应用。
9.本发明的第四发明目的在于提出含有上述衍生物的药物组合物。
10.为了完成本发明的发明目的,采用的技术方案如下:
11.一种角蛋白肽修饰的天然多糖衍生物,其特征在于,该天然多糖衍生物优选为壳
聚糖衍生物。
12.上述角蛋白肽修饰的天然多糖衍生物,其在水性介质中可溶胀形成三维网状结构,并作为载体使用。
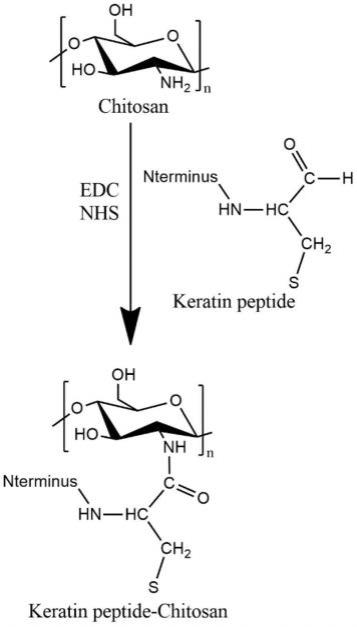
13.上述角蛋白肽修饰的天然多糖衍生物,其结构可以如式ⅰ所示:
[0014][0015]
其中,nterminus表示角蛋白肽的n末端,n为重复单元个数。
[0016]
可选的,所述角蛋白肽的分子量为200~9000da。
[0017]
可选的,所述壳聚糖的分子量为3.0
×
104~30.0
×
104,n为40~650的自然数,例如n的值可取298等。壳聚糖的种类包括但不局限于脱乙酰化壳聚糖、乙酰化壳聚糖、羧基化壳聚糖、聚乙二醇化壳聚糖。
[0018]
本发明还涉及上述角蛋白肽修饰的壳聚糖衍生物的制备方法,至少包括以下步骤:
[0019]
s1、将角蛋白肽溶解于反应溶剂中,加入edc和nhs活化羧基;
[0020]
s2、加入壳聚糖缓冲溶液,与胶蛋白结构中活化后的羧基进行酰胺反应;
[0021]
s3、用酸碱度调节剂调节ph值后透析,干燥,即得所述的角蛋白肽修饰的壳聚糖衍生物;
[0022]
可选的,角蛋白肽的分子量为800~1500da,优选壳聚糖的分子量为5.0
×
104~10.0
×
104。
[0023]
可选的,在步骤s1中,角蛋白肽与反应溶剂的重量比为1:5~60;所述反应溶剂优选无水二甲亚砜、无水乙醇、无水n,n-二甲基甲酰胺中的至少一种;进一步优选的,所述羧基活化的反应温度为0~25℃、反应时间为2~18小时,反应条件为磁力搅拌、真空、避光反应;更进一步优选的,角蛋白肽、edc和nhs的重量比为8:1~60:1~50。
[0024]
可选的,在步骤s2中,所述壳聚糖缓冲溶液为壳聚糖醋酸缓冲液、壳聚糖磷酸缓冲液、壳聚糖盐酸缓冲液中的一种;
[0025]
进一步优选的,所述壳聚糖缓冲溶液为壳聚糖醋酸缓冲溶液。
[0026]
可选的,酰胺反应的反应温度为0~26℃,反应时间为2~48小时,反应条件为磁力搅拌、真空、避光反应。
[0027]
可选的,在步骤s3中,所述酸碱度调节剂为氢氧化钠、氢氧化钾、碳酸氢钠、氨水中的一种。
[0028]
优选的,ph值调节为7~9。
[0029]
可选的,所述透析干燥步骤包括:将所述反应后的产物置于截留分子量为300~
14000da的透析袋中,于去离子水中0~26℃透析2~7天,干燥,得所述角蛋白肽修饰的壳聚糖衍生物;所述干燥优选冷冻干燥、喷雾干燥或真空减压干燥中的一种。
[0030]
本发明还涉及上述角蛋白肽修饰的壳聚糖衍生物或对应制备方法制得的角蛋白肽修饰的壳聚糖衍生物作为药物载体的应用;优选的,所述药物载体包括经皮给药、粘膜给药、口服给药、眼部给药、皮直肠或阴道等腔道给药的药物载体。
[0031]
本发明还涉及一种采用上述角蛋白肽修饰的壳聚糖衍生物或对应制备方法制得的角蛋白肽修饰的壳聚糖衍生物制备得到的药物载体,所述药物载体的制备方法为:将所述角蛋白肽修饰的壳聚糖衍生物加水溶胀后与药物溶液混合均匀,得到所述的药物载体;优选的,所述的水为去离子水、蒸馏水或缓冲溶液,角蛋白肽修饰的壳聚糖衍生物溶胀温度为10~26℃,溶胀时间为1~24h;更优选的,所述药物溶液是将药物溶解或混悬于药学上可接受的溶剂;进一步优选的,所述药物的混悬液包含但不局限于胶束、脂质体、柔性脂质体、囊泡、固体脂质纳米粒中的一中。
[0032]
本发明还涉及一种药物组合物,所述药物组合物包括药物和药物载体,所述药物载体包括所述的角蛋白肽修饰的壳聚糖衍生物;优选的,所述药物包括抗炎药、镇痛药、解热药、化疗药、中枢神经系统药物、消化系统药物、循环系统药物、激素类药物中的至少一种;所述抗炎药物包括抗生素类、激素类、非甾体类、甾体类药物;所述药物组合物的剂型选自半固体剂型、液体剂型、固体剂型,所述半固体剂型为凝胶剂、软膏剂或栓剂,所述液体型为乳液、混悬液或胶体液,所述固体剂型为片剂、颗粒剂、胶囊剂或丸剂。
[0033]
本发明的技术方案至少具有以下技术效果:
[0034]
本发明的角蛋白肽修饰的壳聚糖衍生物是在壳聚糖的结构上引入角蛋白肽而制备的功能性衍生物载体,本发明的角蛋白肽修饰的壳聚糖衍生物在水性介质中可溶胀形成三维网状结构,用作药物或活性物质的递送载体,其中含有细胞黏附序列亮氨酸-天冬氨酸-缬氨酸(ldv)、谷氨酸-天冬氨酸-丝氨酸(eds)和精氨酸-甘氨酸-天冬氨酸(rgd),可与细胞表面的蛋白、脂质等成分相互作用,具有良好的生物粘附性,延长载体在生物膜表面的滞留时间,促进药物的吸收;还可以作为药物储库,增加药物的缓释作用,延长药物的作用时间,减少给药次数。
[0035]
本发明的角蛋白肽修饰的壳聚糖衍生物可在水性介质中可以形成三维空间结构,其对药学活性分子具有较好的包载。
[0036]
本发明的角蛋白肽修饰的壳聚糖衍生物作为药物载体用于经皮给药、粘膜给药、口服给药、眼部给药、皮直肠或阴道等腔道给药,可提高局部药物浓度,具有局部靶向性。
附图说明
[0037]
图1为角蛋白肽修饰的壳聚糖衍生物的扫描电镜;
[0038]
图2为角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体的扫描电镜;
[0039]
图3为角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体体外释放曲线;
[0040]
图4为角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体在生物膜上的荧光显微镜图。
具体实施方式
[0041]
应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
[0042]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0043]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0044]
一种角蛋白肽修饰的天然多糖衍生物,其特征在于,该天然多糖衍生物优选为壳聚糖衍生物。
[0045]
上述角蛋白肽修饰的天然多糖衍生物,其在水性介质中可溶胀形成三维网状结构,并作为载体使用。
[0046]
上述角蛋白肽修饰的天然多糖衍生物,其结构可以如式ⅰ所示:
[0047][0048]
其中,nterminus表示角蛋白肽的n末端,n为重复单元个数。
[0049]
可选的,所述角蛋白肽的分子量为200~9000da。
[0050]
可选的,所述壳聚糖的分子量为3.0
×
104~30.0
×
104,n为40~650的自然数,例如n的值可取298等。壳聚糖的种类包括但不局限于脱乙酰化壳聚糖、乙酰化壳聚糖、羧基化壳聚糖、聚乙二醇化壳聚糖。
[0051]
本发明还涉及上述角蛋白肽修饰的壳聚糖衍生物的制备方法,至少包括以下步骤:
[0052]
s1、将角蛋白肽溶解于反应溶剂中,加入edc和nhs活化羧基;
[0053]
s2、加入壳聚糖缓冲溶液,与胶蛋白结构中活化后的羧基进行酰胺反应;
[0054]
s3、用酸碱度调节剂调节ph值后透析,干燥,即得所述的角蛋白肽修饰的壳聚糖衍生物;
[0055]
可选的,角蛋白肽的分子量为800~1500da,优选壳聚糖的分子量为5.0
×
104~10.0
×
104。
[0056]
可选的,在步骤s1中,角蛋白肽与反应溶剂的重量比为1:5~60;所述反应溶剂优选无水二甲亚砜、无水乙醇、无水n,n-二甲基甲酰胺中的至少一种;进一步优选的,所述羧基活化的反应温度为0~25℃、反应时间为2~18小时,反应条件为磁力搅拌、真空、避光反应;更进一步优选的,角蛋白肽、edc和nhs的重量比为8:1~60:1~50。
[0057]
可选的,在步骤s2中,所述壳聚糖缓冲溶液为壳聚糖醋酸缓冲液、壳聚糖磷酸缓冲液、壳聚糖盐酸缓冲液中的一种;
[0058]
进一步优选的,所述壳聚糖缓冲溶液为壳聚糖醋酸缓冲溶液。
[0059]
可选的,酰胺反应的反应温度为0~26℃,反应时间为2~48小时,反应条件为磁力搅拌、真空、避光反应。
[0060]
可选的,在步骤s3中,所述酸碱度调节剂为氢氧化钠、氢氧化钾、碳酸氢钠、氨水中的一种。
[0061]
优选的,ph值调节为7~9。
[0062]
可选的,所述透析干燥步骤包括:将所述反应后的产物置于截留分子量为300~14000da的透析袋中,于去离子水中0~26℃透析2~7天,干燥,得所述角蛋白肽修饰的壳聚糖衍生物;所述干燥优选冷冻干燥、喷雾干燥或真空减压干燥中的一种。
[0063]
下面以角蛋白肽修饰壳聚糖的反应进一步说明本发明实施例的制备方法:
[0064]
将角蛋白肽溶于反应溶剂中,0~25℃磁力搅拌2~18小时后加入edc及nhs进行活化。将活化的角蛋白肽逐滴加入壳聚糖中,0~26℃避光反应2~48小时,用酸碱度调节剂调节ph值至7~9。置于截留分子量为300~14000da的透析袋中,于去离子水中0~26℃透析2~7天,干燥,得所述角蛋白肽修饰的壳聚糖衍生物。
[0065]
下面以角蛋白肽修饰脱乙酰化壳聚糖的反应进一步说明本发明实施例的制备方法:
[0066]
将角蛋白肽溶于反应溶剂中,0~25℃磁力搅拌2~18小时后加入edc及nhs进行活化。将活化的角蛋白肽逐滴加入脱乙酰化壳聚糖中,0~26℃避光反应2~48小时,用酸碱度调节剂调节ph值至7~9。置于截留分子量为300~14000da的透析袋中,于去离子水中0~26℃透析2~7天,干燥,得所述角蛋白肽修饰的脱乙酰化壳聚糖衍生物。
[0067]
本发明还涉及上述角蛋白肽修饰的壳聚糖衍生物作为药物载体的应用;优选的,所述药物载体包括经皮给药、粘膜给药、口服给药、眼部给药、皮直肠或阴道等腔道给药的药物载体。本发明的角蛋白肽修饰的壳聚糖衍生物在水性介质中可溶胀形成三维网状结构,可用作药物或活性物质的递送载体,具有良好的生物粘附性,延长载体在生物膜表面的滞留时间,促进药物的吸收;还可以作为药物储库,增加药物的缓释作用,延长药物的作用时间,减少给药次数。
[0068]
本发明还涉及一种采用上述角蛋白肽修饰的壳聚糖衍生物制备的药物载体,所述药物载体的制备方法为:将所述角蛋白肽修饰的壳聚糖衍生物加水溶胀后与药物溶液混合均匀,得到所述的药物载体;
[0069]
优选的,所述的水为去离子水、蒸馏水或缓冲溶液,角蛋白肽修饰的壳聚糖衍生物溶胀温度为10~26℃,溶胀时间为1~24h;
[0070]
更优选的,所述药物溶液是将药物溶解或混悬于药学上可接受的溶剂;
[0071]
进一步优选的,所述药物的混悬液包含但不局限于胶束、脂质体、柔性脂质体、囊
泡、固体脂质纳米粒中的一中。
[0072]
本发明还涉及一种药物组合物,所述药物组合物包括药物和药物载体,所述药物组合物包括药物和药物载体,所述药物载体包括所述的角蛋白肽修饰的壳聚糖衍生物或为所述的药物载体。
[0073]
具体的,药物包括抗炎药、镇痛药、解热药、化疗药、中枢神经系统药物、消化系统药物、循环系统药物、激素类药物中的至少一种;抗炎药物包括抗生素类、激素类、非甾体类、甾体类药物;具体药物可选自:姜黄素、槲皮素、鬼臼毒素、阿霉素、吲哚美辛、盐酸芦氟沙星、橙皮苷、芬太尼、丁丙诺啡、可乐定、双氯芬酸钠、苦参碱等,但并不局限于这些药物。
[0074]
本发明实施例的药物组合物的剂型选自半固体剂型、液体剂型、固体剂型,所述半固体剂型为凝胶剂、软膏剂或栓剂,所述液体型为乳液、混悬液或胶体液,所述固体剂型为片剂、颗粒剂、胶囊剂或丸剂。
[0075]
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0076]
实施例1:角蛋白肽修饰的壳聚糖衍生物的制备
[0077]
s1、称取角蛋白肽3.5g,溶于20ml无水二甲亚砜,25℃避光条件下磁力搅拌3h,然后分别加入0.45g edc及0.32g nhs加入进行活化,25℃避光条件下磁力搅拌5h,得到羧基末端活化的角蛋白肽溶液。
[0078]
s2、称壳聚糖0.55g,溶于35ml ph5.0醋酸缓冲液。
[0079]
s3、将活化的角蛋白肽溶液逐滴加入壳聚糖中,25℃避光反应16小时,用0.1mol/l氢氧化钠溶液逐滴调节ph至8.0。用pbs(ph7.4)缓冲液透析3天,去离子水透析4天。冷冻干燥48小时,即得角蛋白肽修饰的壳聚糖衍生物。该步骤的化学反应方程式如下所示。
[0080][0081]
实施例2:角蛋白肽修饰的壳聚糖衍生物的扫描电镜观察
[0082]
采用扫描电子显微镜(sigma 500,蔡司,德国)观察角蛋白肽修饰的壳聚糖衍生物的外观结构。取适量的角蛋白肽修饰的壳聚糖衍生物置于双面导电性胶,在真空条件下喷金,通过施加3.0kv的加速电压和5.5mm的工作距离,于扫描电子显微镜下观察角蛋白肽修饰的壳聚糖衍生物的外观结构。
[0083]
从图1可以看出,角蛋白肽修饰的壳聚糖衍生物具有三维网络的空间结构。
[0084]
实施例3:角蛋白肽修饰的壳聚糖衍生物的生物黏附性考察:
[0085]
将两块大鼠皮肤中的一块表皮朝上用双面胶粘到天平的称物托盘下,将另一块大鼠皮肤用双面胶固定于实验台上,将溶胀后的角蛋白肽修饰的壳聚糖衍生物0.5g均匀地涂抹在大鼠表皮上,并将两块鼠皮压紧,随后在在天平的另一托盘上断施加砝码,直至两块大鼠皮肤的接触层完全脱离,生物黏附力即为使其分开的最小砝码的重量。
[0086]
角蛋白肽修饰的壳聚糖衍生物的生物粘附力为0.1529n,说明角蛋白肽修饰的壳聚糖衍生物载体材料中的细胞黏附序列亮氨酸-天冬氨酸-缬氨酸(ldv)、谷氨酸-天冬氨酸-丝氨酸(eds)和精氨酸-甘氨酸-天冬氨酸(rgd),可与大鼠皮肤细胞表面的蛋白、脂质等成分相互作用,有利于载体材料的生物粘附性;同时壳聚糖的结构上带正电荷的氨基也可以和皮肤细胞膜上带负电的磷脂相互作用,从而进一步增加了角蛋白肽修饰的壳聚糖衍生物载体材料的生物粘附性。
[0087]
实施例4:角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体制备:
[0088]
取泊洛沙姆f68 2.05g、聚乙二醇400 3.48g、辛癸酸甘油酯0.45g在55℃条件下加热熔融,磁力搅拌下滴加0.12g水,于35℃加入姜黄素0.08g,使其完全溶解即得姜黄素载药微乳;用去离子水将角蛋白肽修饰的壳聚糖衍生物溶胀完全后,再与微乳液混匀,得角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体。
[0089]
实施例5:角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体的扫描电镜观察:
[0090]
将角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体用双面导电性胶带粘于观察台上,在真空条件下喷金,通过施加3.0kv的加速电压和5.6mm的工作距离获得样品的扫描电子显微照片。
[0091]
从图2中可以看出角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体形成了交织网络支撑的三维空间结构,三维结构中可见大量的姜黄素微乳颗粒。
[0092]
实施例6:角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体的体外释放考察:
[0093]
采用动态透析袋法,对角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体进行体外释放考察。将药物载体放入预先处理好的透析袋中,置于50ml释放介质(ph 7.4pbs溶液:95%乙醇=6:4)的烧杯中,温度为37
±
0.5℃,振荡转速200r/min,按时间点0.5、1、2、4、6、8、16、24、36、48小时依次取样10ml,补充等温、等体积的空白释放介质。于425nm波长处用紫外-可见分光光度计测定吸光度a,根据标准曲线计算不同时间点释放介质中姜黄素的含量,根据累积释放率公式计算姜黄素累积释放百分率(q),绘制释放曲线。
[0094]
[0095]
角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体体外释放曲线如图3所示。结果表明姜黄素溶液48小释放率达到100%,姜黄素微乳和角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体48小时累积释放率分别为88.37%和85.31%,释药速率缓慢,表明姜黄素微乳包载在角蛋白肽修饰的壳聚糖衍生物后具有一定的缓释作用。
[0096]
实施例7:角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体在生物膜上的荧光显微镜观察:
[0097]
实验前24h剔除小鼠背部皮肤剃毛,分别给予姜黄素微乳和角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体,并于给药后1、6h处死小鼠,取用药部位皮肤1cm2,移除残留药物,将切片置于载物片盒中吹干10min,水洗5min,滤纸吸干,用含dapi的封片剂封片。切片于共聚焦荧光显微镜下观察并采集图像。
[0098]
从图4可以看出,随着用药时间的延长,皮肤深处荧光逐渐增强;角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体在6h时表皮荧光较弱,真皮荧光较强,角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体在6h时表皮和真皮均有较强的绿色荧光,说明角蛋白肽修饰的壳聚糖衍生物包载姜黄素微乳的药物载体可以在生物膜上形成药物储库,缓慢地释放姜黄素微乳,可以使药物长时间在皮肤内保持高的滞留量,有利于保证药物局部治疗的有效性。
[0099]
实施例8:角蛋白肽修饰的壳聚糖衍生物包载盐酸小檗碱的药物载体制备:
[0100]
取盐酸小檗碱0.1g,加入磷酸盐缓冲溶液(ph=7.4),搅拌使药物完全溶解;用去离子水将角蛋白肽修饰的壳聚糖衍生物溶胀完全后,再与盐酸小檗碱混匀,得角蛋白肽修饰的壳聚糖衍生物包载盐酸小檗碱的药物载体。
[0101]
实施例9:角蛋白肽修饰的壳聚糖衍生物包载盐酸小檗碱的药物载体的透皮吸收研究
[0102]
采用franz试验扩散装置进行体外透皮吸收。将制备好的离体大鼠皮肤固定于franz扩散池的供给室与接受室之间。有效渗透面积为2.8cm2,接受室容积约6.5ml,释放介质为pbs(ph7.4)缓冲溶液,水浴温度37℃,搅拌速度设置为300r/min。在大鼠皮肤角质层面加入含有1.0mg盐酸小檗碱的角蛋白肽修饰的壳聚糖衍生物包载盐酸小檗碱的药物载体,小檗碱溶液作为对照。透皮24小时后计算盐酸小檗碱的累积透皮量和皮内滞留量。角蛋白肽修饰的壳聚糖衍生物包载盐酸小檗碱的药物载体透皮24小时后,累积透皮量为3.68μg/cm2,而盐酸小檗碱溶液的透皮量仅为0.79μg/cm2。说明角蛋白肽修饰的壳聚糖可以促进小檗碱的透皮吸收。角蛋白肽修饰的壳聚糖衍生物包载盐酸小檗碱的药物载体透皮24小时后,大鼠皮肤内盐酸小檗碱的滞留量为1.82μg/cm2,而盐酸小檗碱溶液的透皮量仅为0.46μg/cm2。说明利用角蛋白肽修饰的壳聚糖凝胶材料作为盐酸小檗碱的载体可以使药物在皮肤表面形成药物储库,具有一定的缓释作用,在增加药皮肤滞留量的同时增加了药物的透皮吸收,因此该药物载体有助于药物在皮肤局部发挥药效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1