钌基三唑碳烯络合物的制作方法
本发明涉及新颖的、包含特定配体的钌基三唑碳烯配位化合物、其制备及其在氢化过程中作为催化剂的用途。
发明背景
在工业和工程化学研究(Ind.Eng.Chem.Res.)1991,30,1086-1092;大分子(Macromolecules)1992,25,883-886;分子催化杂志A:化学(J.Mol.Catal.A Chem.)1998,135,121-132,以及橡胶化学和技术(Rubber Chem.Technol.)2008,81,227-243中,披露了具有式(1)的铑基催化剂三(三苯基膦)铑(I)氯化物用于橡胶的氢化和氢化硅烷化反应。然而,与这种催化剂相关联的是高成本,这种催化剂另外要求使用三苯基膦作为助催化剂。该催化剂在145℃降解。
在化学通讯(Chem.Comm.)1967,305-306;欧洲化学杂志(Chem.Eur.J.)2010,16,12214-12220和四面体快报(Tetrahedron Lett.)1966,4871-4875中,披露了具有式(2)的络合物三(三苯基膦)氢化钌氯化物(tris(triphenylphosphine)hydrido ruthenium chloride)可以用于将炔烃转化为链烯烃的转移氢化。然而,此类催化剂不会有效率地氢化腈橡胶并且它仅仅对于烯烃不是选择性的。
在美国化学会志(J.Am.Chem.Soc.)1961,83,1262-1263;欧洲化学杂志2010,16,12214-12220;美国化学会志(Am.Chem.Soc.)2010,132,16756-16758和分子催化杂志A:化学2003,206,13-21中,具有如以下所示的式(3)的催化剂被用作用于炔烃到链烯烃的转移氢化催化剂并且用于在H2下将酰胺氢化成醇和胺。然而,这样一种催化剂对于烯烃不是选择性的并且包含CO基团。
在有机金属(Organometallics)2006,25,99–110;道尔顿汇刊(Dalton Trans.)2008,2603-2614;有机金属2009,28,1758–1775;无机化学学报(Inorg.Chim Acta.)2010,363,625-632以及有机金属,2010,29,5450-5455中,具有如下所示的式(4)的催化剂是由RuHCl(CO)(AsPh3)3和IMes2来制备的。然而,由于AsPh3的存在,此种制备方法并非是有利的。该催化剂进一步包括CO基团。描述了用于将芳香酮与醇进行转移氢化的此类催化剂。它还使用H2氢化烯烃和酮,然而,它对于烯烃不是选择性的。
根据有机金属2004,23,86-94,具有如下所示式(5)的催化剂可以由RuHCl(PPh3)3以及两当量的SIMes2制备,其中作为副产物形成了SIMes2·HCl。然而,并未报道氢化数据。不可能在没有这些甲基基团的CH活化的情况下用SIMes2替代PPh3。
在道尔顿汇刊2013,42,2362–2365中,具有如下所示式(6)的催化剂从[(对-甲异丙苯)RuCl2]2和三唑鎓盐制备,随后使用在THF中的K2CO3在回流下进行处理。然而,并未报道氢化数据。在该文章中并未披露这些1,2,3-三唑-5-亚基(tzNHC)钌络合物的具体用途。
在过去已经披露了具有不同的金属和不同配体的类似络合物。
在道尔顿汇刊2012,41,13074-13080中,具有如下所示式(7)的催化剂在氮气下从IrCl2(Cp*)(trz)(trz=三唑亚基)和乙酸钠制备。这种铱络合物展示了作为水氧化催化剂的高度可能性。没有披露作为氢化催化剂的用途。也没有建议使用其他金属(像钌)。
在德国应用化学国际版(Angew.Chem.Int.Ed.)2010,49,9765-9768中,具有如下所示式(8)的催化剂从[(Cp*IrCl2)2](Cp*=C5Me5)、Ag2O和吡啶鎓官能化的三唑鎓盐来制备。铱(III)环戊二烯基络合物被描述为表现出优异的电化学诱导的水氧化的活性。然而,并未报道氢化数据。钌基络合物既未被披露也未被建议。
在有机金属2011,30,1689-1694中,具有如下所示式(9)的催化剂从Pd(OAc)2和反式单核银碳烯络合物[(Tz)2Ag](Tz=1,4-二苯基-3-甲基-1,2,3-三唑-5-亚基)制备。然而,并未报道氢化数据。
总之,用作催化剂的不同络合物已经可供用于氢化反应。然而,它们中许多包含不利的或昂贵的配体(像PPh3),形成凝胶,难以制备,不足够活性和/或选择性。
因此,本发明的目的是提供价廉的、热稳健的、抑制凝胶形成以及有烯烃选择性的新颖的用于氢化反应、特别是用于氢化聚合物、并且甚至更特别地用于氢化腈橡胶的催化剂。
发明概述
上述目的现在已经通过提供新颖的根据通式(I)的钌基络合物得到解决
其中
R彼此独立地是氢,羟基,硫醇,硫醚,酮,醛,酯,醚,胺,亚胺,酰胺,硝基,羧酸,二硫化物,碳酸酯,异氰酸酯,碳二亚胺,烷氧羰基,氨基甲酸酯,卤素,直链或支链的C1-C10-烷基,优选甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,C6-C24-芳基,优选苯基,或连同它们结合到其上的碳原子形成C6-C10-环烷基或C6-C10-芳基取代基,烷基硫醇盐,芳基硫醇盐,B(R3)2或B(R3)3,而R3是烷基、芳基、烷氧基或芳氧基或CF3,
n是0到4、优选0到2、更优选0到1
R1是直链或支链的C1-C10-烷基,优选甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或新戊基;C3-C10-环烷基,优选环己基或金刚烷基;C6-C24-芳基,优选苯基;C1-C10-烷基磺酸酯,优选甲磺酸酯;C6-C10-芳基磺酸酯,优选对甲苯磺酸酯,2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip),
R2是氢,直链或支链的C1-C10-烷基,优选甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或新戊基;C3-C10-环烷基,优选环己基或金刚烷基;C6-C24-芳基,优选苯基;C1-C10-烷基磺酸酯,优选甲磺酸酯;C6-C10-芳基磺酸酯,优选对甲苯磺酸酯,2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip),
X是阴离子配体,并且
Y1和Y2是相同或不同的并且各自是C1-C10-烷基膦或C3-C20-环烷基膦配体,优选三环已基膦(PCy3),磺化的C1-C10-烷基膦配体,C1-C10-烷基次亚磷酸酯配体、C1-C10-烷基亚膦酸酯配体、C1-C10-烷基亚磷酸酯配体、C1-C10-烷基胂配体、C1-C10-烷基胺配体、取代或未取代的吡啶配体、C1-C10-烷基亚砜配体、C1-C10-烷氧基配体或C1-C10-烷基酰胺配体,它们各自可以被苯基取代,该苯基进而可以被卤素、C1-C5-烷基或C1-C5-烷氧基团取代。
发明详细说明
这些新颖的钌基三唑碳烯催化剂极适合于氢化反应,是热稳健的,抑制凝胶形成的、使用不太昂贵的钌作为过渡金属并且对于烯烃的氢化是选择性的。
配体的定义:
在具有通式(I)的催化剂中,R彼此独立地是氢,羟基,硫醇,硫醚,酮,醛,酯,醚,胺,亚胺,酰胺,硝基,羧酸,二硫化物,碳酸酯,异氰酸酯,碳二亚胺,烷氧羰基,氨基甲酸酯,卤素,直链或支链的C1-C10-烷基,优选甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,C6-C24-芳基,优选苯基,或连同它们结合到其上的碳原子形成C6-C10-环烷基或C6-C10-芳基取代基,烷基硫醇盐,芳基硫醇盐,B(R3)2或B(R3)3,而R3是烷基、芳基、烷氧基或芳氧基或CF3。
所有作为R含义的上述这些取代基可以被选自由直链或支链的C1-C10-烷基,C3-C8-环烷基、C1-C10-烷氧基、C6-C24-芳基以及以下官能团组成的组的一个或多个另外的取代基取代,该官能团选自由以下各项组成的组:羟基、硫醇、硫醚、酮、醛、酯、醚、胺、亚胺、酰胺、硝基、羧酸、二硫化物、碳酸酯、异氰酸酯、碳二亚胺、烷氧羰基、氨基甲酸酯和卤素。
在具有通式(I)的催化剂中,n是0至4,优选地0至2并且更优选0至1。
在具有通式(I)的催化剂中,R1是直链或支链的C1-C10-烷基,优选甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或新戊基;C3-C10-环烷基,优选环己基或金刚烷基;C6-C24-芳基,优选苯基;C1-C10-烷基磺酸酯,优选甲磺酸酯;C6-C10-芳基磺酸酯,优选对甲苯磺酸酯,2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip)。
在具有通式(I)的催化剂中,R2是氢,直链或支链的C1-C10-烷基,优选甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或新戊基;C3-C10-环烷基,优选环己基或金刚烷基;C6-C24-芳基,优选苯基;C1-C10-烷基磺酸酯,优选甲磺酸酯;C6-C10-芳基磺酸酯,优选对甲苯磺酸酯,2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip)。
所有作为R1和R2含义的上述这些取代基可以被选自由直链或支链的C1-C10-烷基(特别是甲基),C3-C8-环烷基、C1-C5-烷氧基、C6-C24-芳基以及以下官能团组成的组的一个或多个另外的取代基取代,该官能团选自由以下各项组成的组:羟基、硫醇、硫醚、酮、醛、酯、醚、胺、亚胺、酰胺、硝基、羧酸、二硫化物、碳酸酯、异氰酸酯、碳二亚胺、烷氧羰基、氨基甲酸酯和卤素。
在优选的实施例中,R1和R2是相同或不同的并且各自是甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或新戊基、环己基、金刚烷基、苯基、C1-甲磺酸酯、对甲苯磺酸酯、2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip)。
在更优选的实施例中,R1和R2是相同或不同的并且各自是甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或环己基、苯基、2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip)。
在特别优选的实施例中,R1是甲基。
在特别优选的实施例中,R2为苯基、2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip)。
在具有该通式(I)的催化剂中,X是一个阴离子配体。
在优选的实施例中,X是氢根(hydride)、卤离子、拟卤离子、烷氧根(alkoxide)、酰胺、三氟甲磺酸根、磷酸根、硼酸根、直链或支链的C1-C30-烷基或C6-C24-芳基、羧酸根、乙酸根、卤化的乙酸根、卤化的烷基磺酸根、甲苯磺酸根或者任何弱配位的阴离子配体。
在更优选的实施例中,X是氢根或卤离子,优选氟离子、氯离子、溴离子或碘离子。
在特别优选的实施例中,X是氯离子。
在具有通式(I)的催化剂中,Y1和Y2是相同或不同的并且各自是C1-C10-烷基膦配体,C3-C20-环烷基膦配体,优选三环已基膦(PCy3),磺化的C1-C10-烷基膦配体,C1-C10-烷基次亚磷酸酯配体、C1-C10-烷基亚膦酸酯配体、C1-C10-烷基亚磷酸酯配体、C1-C10-烷基胂配体、C1-C10-烷基胺配体、取代或未取代的吡啶配体、C1-C10-烷基亚砜配体、C1-C10-烷氧基配体或C1-C10-烷基酰胺配体,它们各自可以被苯基取代,该苯基进而可以被卤素、C1-C5-烷基或C1-C5-烷氧基团取代。
术语“膦”包括例如P(CF3)3、P(异丙基)3、P(CHCH3(CH2CH3))3、P(环戊基)3、P(环己基)3和P(新戊基)3。
术语“次亚磷酸酯”包括例如二环己基次亚磷酸环己酯以及二异丙基次亚磷酸异丙酯。
术语“亚磷酸酯”包括例如亚磷酸三环己基酯、亚磷酸三叔丁酯以及亚磷酸三异丙酯。
术语“磺酸酯”包括例如三氟甲磺酸酯、甲苯磺酸酯以及甲磺酸酯。
术语“亚砜”包括例如(CH3)2S(=O)以及(C6H5)2S=O。
术语“硫醚”包括例如CH3SCH3、C6H5SCH3、CH3OCH2CH2SCH3以及四氢噻吩。
优选的催化剂的定义:
优选的催化剂具有通式(I),在该通式中
R彼此独立地是氢、卤素、硝基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基、苯基,或连同它们结合到其上的碳原子形成C6-C10-环烷基或C6-C10-芳基取代基,烷基硫醇盐,芳基硫醇盐,B(R3)2或B(R3)3,而R3是烷基、芳基、烷氧基或芳氧基或CF3,
n是0到4、优选0到2、更优选0到1
R1和R2是相同或不同的并且各自是甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或新戊基、环己基、金刚烷基、苯基、C1-甲磺酸酯、对甲苯磺酸酯、2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip),
X是氢根、卤离子、拟卤离子、烷氧根、酰胺、三氟甲磺酸根、磷酸根、硼酸根、直链或支链的C1-C30-烷基或C6-C24-芳基、羧酸根、乙酸根、卤化的乙酸根、卤化的烷基磺酸根、甲苯磺酸根或者任何弱配位的阴离子配体,并且
Y1和Y2是相同或不同的并且各自是C1-C10-烷基膦或C3-C20-环烷基膦配体,优选三环已基膦(PCy3),磺化的C1-C10-烷基膦配体,C1-C10-烷基次亚磷酸酯配体、C1-C10-烷基亚膦酸酯配体、C1-C10-烷基亚磷酸酯配体、C1-C10-烷基胂配体、C1-C10-烷基胺配体、取代或未取代的吡啶配体、C1-C10-烷基亚砜配体、C1-C10-烷氧基配体或C1-C10-烷基酰胺配体,它们各自可以被苯基取代,该苯基进而可以被卤素、C1-C5-烷基或C1-C5-烷氧基团取代。
更优选的催化剂具有通式(I),在该通式中
R彼此独立地是氢、卤素、甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基、苯基,或连同它们结合到其上的碳原子形成C6-C10-环烷基或C6-C10-芳基取代基、或CF3,
n是0到4、优选0到2、更优选0到1
R1和R2是相同或不同的并且各自是甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或环己基、苯基、2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip),
X是氢根或卤离子,优选氟离子、氯离子、溴离子或碘离子,并且
Y1和Y2是相同或不同的并且各自是C1-C10-烷基膦或C3-C20-环烷基膦配体,优选三环已基膦(PCy3),磺化的C1-C10-烷基膦配体,C1-C10-烷基次亚磷酸酯配体、C1-C10-烷基亚膦酸酯配体、C1-C10-烷基亚磷酸酯配体、C1-C10-烷基胂配体、C1-C10-烷基胺配体、取代或未取代的吡啶配体、C1-C10-烷基亚砜配体、C1-C10-烷氧基配体或C1-C10-烷基酰胺配体,它们各自可以被苯基取代,该苯基进而可以被卤素、C1-C5-烷基或C1-C5-烷氧基团取代。
甚至更优选的催化剂具有通式(I),在该通式中
R彼此独立地是氢、甲基或CF3,
n是0到4、优选0到2、更优选0到1
R1为甲基,
R2为苯基、2,4,6-三甲基苯基(Mes)或2,4,6-三异丙基苯基(Trip),
X是氯离子,并且
Y1和Y2各自是三环已基膦(PCy3)。
催化剂的合成:
为了制备根据通式(I)的催化剂以及所有优选的、更优选的、甚至更优选的以及特别优选的催化剂,本领域普通技术人员可以使用如在本申请实验部分关于不同的催化剂来概述的和举例说明的多步骤程序,并且可以应用、泛化、并且修改到的程度是必须使这样描述的程序制备出落在通式(I)下的催化剂。这些制备方法典型地包括施伦克(schlenk)技术或者手套箱技术。如本申请的实验部分所概述的例如通过1H-、13C-、19F-、31P-、或11B-NMR、元素分析、以及ESI-MS对这些催化剂、基底和化合物的表征对于合成化学领域的普通技术人员为惯例。
典型地,根据式(I)的催化剂可以通过将溶剂(例如苯或甲苯)加入到取代的银(I)三唑亚基和钌络合物(如RuHCl(H2)(PCy3)2或RuHCl(PPh3)3)的混合物中制备,该络合物可以根据修改的文献程序(M.Viciano,M.Feliz,R.Corberan,J.A.Mata,E.Clot和E.Peris,有机金属,2007,26,5304-5314)合成。随后典型地在室温下将该反应混合物搅拌约40至50小时。该催化剂典型地可以通过过滤、倾析或结晶纯化。
本发明进一步涉及氢化具有至少一个碳碳双键的基底的方法,该方法包括使所述基底在根据通式(I)的催化剂的存在下经受氢化反应。
有待氢化的基底:
本发明的方法广泛地适用于多种基底的氢化,这些基底包括:末端烯烃、内烯烃、环烯烃、共轭烯烃、以及任何另外的具有至少一个碳碳双键以及额外地至少一个另外的极性的不饱和的双键或三键的烯烃。该方法还适用于氢化具有碳碳双键的聚合物。此类聚合物可以表示均、共或三聚物。
作为末端烯烃或者链烯,有可能的是对具有末端不饱和的碳碳双键的、具有通式CnH2n的烃化合物进行氢化。该末端烯烃可以是任何长度的直链或支链的烃化合物,优选1-己烯。
作为内烯烃或者链烯,有可能的是对具有内部不饱和的碳碳双键的、具有通式CnH2n的烃化合物进行氢化。该内烯烃可以是任何长度的直链或支链的烃。
作为环烯烃或者环烯,有可能的是对具有环状不饱和的碳碳双键的、具有通式CnH2n-2的烃化合物进行氢化。该环状烯烃可以是任何大小的环。
作为共轭烯烃或者二烯,有可能的是对具有共轭的碳碳不饱和双键的烃化合物进行氢化。该共轭可以是任何长度的直链或支链的烃,优选苯乙烯。
作为烯烃,还有可能的是对具有至少一个不饱和的碳碳双键和至少一个其他的不饱和的极性的双键或者三键的烃化合物进行选择性氢化。此类不饱和极性键出人意料地被留下未被改变。在此类烯烃中的碳碳双键可以是任何性质的,包括末端烯烃、内烯烃、环烯烃以及共轭烯烃。这种附加的不饱和极性键可以是任何性质的,其中给予优选的是碳-氮、碳-磷、碳-氧、以及碳-硫不饱和极性键。
还可以使具有碳碳双键的聚合物经受本发明的方法。此类聚合物优选包括基于至少一种共轭二烯单体的重复单元。
该共轭二烯可以是具有任何性质的。在一个实施例中,使用了C4-C6-共轭二烯。给予优选的是1,3-丁二烯、异戊二烯、1-甲基丁二烯、2,3-二甲基丁二烯、戊间二烯、氯丁二烯、或它们的混合物。给予更优选的是1,3-丁二烯、异戊二烯或它们的混合物。给予特别优选的是1,3-丁二烯。
在另外一个实施例中,可以使具有碳-碳双键的聚合物经受本发明的方法,这些聚合物包含了不仅是作为单体(a)的至少一种共轭二烯的而且附加地至少一种另外的可共聚单体(b)的多个重复单元。
适合的单体(b)的实例是烯烃类,例如乙烯或丙烯。
适合的单体(b)的另一些实例是乙烯基芳香族的单体,如苯乙烯、α-甲基苯乙烯、邻氯苯乙烯或乙烯基甲苯类、脂肪族的或支链的C1-C18一元羧酸的乙烯基酯类,如乙酸乙烯酯、丙酸乙烯酯、丁酸乙烯酯、戊酸乙烯酯、己酸乙烯酯、2-乙基己酸乙烯酯、癸酸乙烯酯、月桂酸乙烯酯以及硬脂酸乙烯酯。
在本发明中使用的优选的聚合物是1,3-丁二烯与苯乙烯或α-甲基苯乙烯的一种共聚物。所述共聚物可以具有一种无规或嵌段型结构。
合适的单体(b)的另外实例是烯键式不饱和一元羧酸的酯类或者二羧酸与通常C1-C12烷醇的单酯或二酯类,如丙烯酸、甲基丙烯酸、马来酸、富马酸和衣康酸与例如甲醇、乙醇、正丙醇、异丙醇、1-丁醇、2-丁醇、异丁醇、叔丁醇、正己醇、2-乙基己醇、或C5-C10环烷醇(如环戊醇或环己醇)的酯类,并且在这些之中,优选丙烯酸和/或甲基丙烯酸的酯,实例是甲基丙烯酸甲酯、甲基丙烯酸正丁酯、甲基丙烯酸叔丁酯、丙烯酸正丁酯、丙烯酸叔丁酯和丙烯酸2-乙基己酯。
本发明的方法可以进一步用于对所谓的腈橡胶进行氢化。腈橡胶(“NBR”)代表包含至少一种共轭二烯和至少一种α,β-不饱和腈单体的重复单元的共聚物或三聚物,或包含至少一种共轭二烯和至少一种α,β-不饱和腈单体以及一种或多种另外的可共聚单体的重复单元的共聚物或三聚物。
此类腈橡胶中的共轭二烯可以是任何性质的。优选使用C4-C6-共轭二烯。特别优选的是1,3-丁二烯、异戊二烯、2,3-二甲基丁二烯、戊间二烯、或它们的混合物。特别地,优选使用的是1,3-丁二烯或异戊二烯或它们的混合物。给予非常特别优选的是1,3-丁二烯。
作为α,β-不饱和的腈单体,有可能的是使用任何已知的α,β-不饱和的腈,其中给予优选的是C3-C5-α,β-不饱和腈,诸如丙烯腈、甲基丙烯腈、乙基丙烯腈、或者它们的混合物。特别优选丙烯腈。
根据本发明的特别优选的有待经受氢化的腈橡胶因此是丙烯腈和1,3-丁二烯的共聚物。
除了共轭二烯和α,β-不饱和腈以外,有可能的是使用本领域普通技术人员已知的一种或多种另外的可共聚的单体,例如含羧基基团的三单体,像α,β-不饱和的一元羧酸,其酯或者酰胺,α,β-不饱和的二羧酸,其单酯或二酯,或者其相应的酸酐或者酰胺。
作为α,β-不饱和一元羧酸类,有可能的是使用丙烯酸和甲基丙烯酸。
还有可能使用这些α,β-不饱和一元羧酸的酯类,优选它们的烷基酯类和烷氧基烷基酯类。优选的是烷基酯类,尤其是α,β-不饱和一元羧酸的C1-C18烷基酯类。特别优选丙烯酸或甲基丙烯酸的烷基酯,尤其是C1-C18烷基酯,更具体的是丙烯酸甲酯、丙烯酸乙酯、丙烯酸丙酯、丙烯酸正丁酯、丙烯酸叔丁酯、丙烯酸2-乙基己基酯、丙烯酸正十二烷酯、甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸丁酯以及甲基丙烯酸2-乙基己基酯。还优选α,β-不饱和一元羧酸的烷氧基烷基酯,更优选丙烯酸或甲基丙烯酸的烷氧基烷基酯,更具体的是丙烯酸或甲基丙烯酸的C2-C12烷氧基烷基酯,非常优选丙烯酸甲氧基甲酯、(甲基)丙烯酸甲氧基乙酯、(甲基)丙烯酸乙氧基乙酯以及(甲基)丙烯酸甲氧基乙酯。还可以使用烷基酯(例如以上提到的那些)例如与烷氧基烷基酯(像处于以上提及的那些形式的)的混合物。还可以使用丙烯酸氰基烷基酯以及甲基丙烯酸氰基烷基酯,其中氰基烷基基团中的C原子数是2-12,优选丙烯酸α-氰基乙酯、丙烯酸β-氰基乙酯以及甲基丙烯酸氰基丁酯。还可以使用丙烯酸羟烷基酯类以及甲基丙烯酸羟烷基酯类,其中羟烷基基团的C原子数目是1-12,优选丙烯酸-2-羟乙酯、甲基丙烯酸-2-羟乙酯以及丙烯酸-3-羟丙酯;还可以使用氟取代的含苄基的丙烯酸酯或甲基丙烯酸酯,优选丙烯酸氟苄基酯以及甲基丙烯酸氟苄基酯。还可以使用含氟烷基的丙烯酸酯以及甲基丙烯酸酯,优选丙烯酸三氟乙酯以及甲基丙烯酸四氟丙酯。还可以使用含氨基的,α,β-不饱和的羧酸酯,例如丙烯酸二甲氨基甲酯以及丙烯酸二乙氨基乙酯。
作为可共聚单体,此外,还有可能使用α,β-不饱和二羧酸,优选马来酸、富马酸、巴豆酸、衣康酸、柠康酸以及中康酸。
此外可以使用α,β-不饱和二羧酸酐,优选是马来酸酐、衣康酸酐、柠康酸酐、以及中康酸酐。
此外,有可能使用α,β-不饱和二羧酸的单酯类或二酯类。
这些α,β-不饱和二羧酸单酯或二酯可以是例如,烷基酯,优选C1-C10烷基,更具体地是乙基、正丙基、异丙基、正丁基、叔丁基、正戊基或正己基酯;烷氧基烷基酯,优选是C2-C12烷氧基烷基,更优选是C3-C8烷氧基烷基;羟烷基,优选C1-C12羟烷基,更优选C2-C8羟烷基;环烷基酯,优选C5-C12环烷基,更具体地是C6-C12环烷基;烷基环烷基酯,优选C6-C12烷基环烷基,更优选是C7-C10烷基环烷基;芳基酯,优选C6-C14芳基酯,这些酯是单酯或二酯,并且在二酯的情况下还有可能的是这些酯是混合的酯。
特别优选的α,β-不饱和一元羧酸的烷基酯类是(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、(甲基)丙烯酸丙酯、(甲基)丙烯酸正丁酯、(甲基)丙烯酸叔丁酯、(甲基)丙烯酸己酯、(甲基)丙烯酸2-乙基己酯、(甲基)丙烯酸辛酯、丙烯酸2-丙基-庚酯以及(甲基)丙烯酸月桂酯。更特别的是,使用丙烯酸正丁酯。
特别优选的α,β-不饱和一元羧酸的烷氧基烷基酯类是(甲基)丙烯酸甲氧基乙酯、(甲基)丙烯酸乙氧基乙酯以及(甲基)丙烯酸甲氧基乙酯。更特别的是,使用丙烯酸甲氧基乙酯。
特别优选的α,β-不饱和一元羧酸的羟烷基酯是(甲基)丙烯酸羟乙酯、(甲基)丙烯酸羟丙酯、以及(甲基)丙烯酸羟丁酯。
使用的α,β-不饱和一元羧酸的其他酯类附加地是,例如,聚乙二醇(甲基)丙烯酸酯、聚丙二醇(甲基)丙烯酸酯、(甲基)丙烯酸缩水甘油酯、(甲基)丙烯酸环氧酯、N-(2-羟乙基)丙烯酰胺、N-(2-羟基-甲基)丙烯酰胺以及氨基甲酸乙酯(甲基)丙烯酸酯。
α,β-不饱和二羧酸单酯类的实例包括
·马来酸单烷基酯类,优选地马来酸单甲酯、马来酸单乙酯、马来酸单丙酯以及马来酸单正丁酯;
·马来酸单环烷基酯类,优选地马来酸单环戊酯、马来酸单环己酯以及马来酸单环庚酯;
·马来酸单烷基环烷基酯类,优选马来酸单甲基环戊基酯、以及马来酸单乙基环己酯;
·马来酸单芳基酯类,优选马来酸单苯基酯;
·马来酸单苄基酯类,优选马来酸单苄基酯;
·富马酸单烷基酯类,优选富马酸单甲酯、富马酸单乙酯、富马酸单丙酯以及富马酸单正丁酯;
·富马酸单环烷基酯类,优选富马酸单环戊酯、富马酸单环己酯以及富马酸单环庚酯;
·富马酸单烷基环烷基酯类,优选富马酸单甲基环戊基酯、以及富马酸单乙基环己基酯;
·富马酸单芳基酯类,优选富马酸单苯基酯;
·富马酸单苄基酯类,优选富马酸单苄基酯;
·柠康酸单烷基酯类,优选柠康酸单甲酯、柠康酸单乙酯、柠康酸单丙酯以及柠康酸单正丁酯;
·柠康酸单环烷基酯类,优选柠康酸单环戊酯、柠康酸单环己酯以及柠康酸单环庚酯;
·柠康酸单烷基环烷基酯类,优选柠康酸单甲基环戊基酯、以及柠康酸单乙基环己基酯;
·柠康酸单芳基酯类,优选柠康酸单苯基酯;
·柠康酸单苄基酯类,优选柠康酸单苄基酯;
·衣康酸单烷基酯类,优选衣康酸单甲酯、衣康酸单乙酯、衣康酸单丙酯以及衣康酸单正丁酯;
·衣康酸单环烷基酯类,优选衣康酸单环戊酯、衣康酸单环己酯以及衣康酸单环庚酯;
·衣康酸单烷基环烷基酯类,优选衣康酸单甲基环戊基酯、以及衣康酸单乙基环己基酯;
·衣康酸单芳基酯类,优选衣康酸单苯基酯;
·衣康酸单苄基酯类,优选地衣康酸单苄基酯;
·中康酸单烷基酯类,优选中康酸单乙基酯类。
作为α,β-不饱和二羧酸二酯类,有可能使用基于上述单酯基团的类似二酯,并且这些酯基团还可以是化学上不同的基团。
优选地,该有待氢化的基底是包括至少一种共轭二烯以及至少一种α,β-不饱和腈单体的重复单元的腈橡胶、或包括至少一种共轭二烯以及至少一种α,β-不饱和腈单体以及一种或多种另外的可共聚单体的腈橡胶,优选包括以下项的重复单元的腈橡胶:至少一种选自由1,3-丁二烯、异戊二烯、2,3-二甲基丁二烯、戊间二烯以及它们的混合物组成的组的共轭二烯,至少一种选自由丙烯腈、甲基丙烯腈、乙基丙烯腈以及它们的混合物组成的组的α,β-不饱和腈,以及没有或具有选自由α,β-不饱和一元羧酸、二羧酸、其酯或酰胺组成的组的一种或多种另外的可共聚单体。
在有待使用的NBR聚合物中的共轭二烯与α,β-不饱和腈单体的比例可以在宽的范围内变化。基于总的聚合物,共轭二烯或共轭二烯的总和的比例通常是在按重量计从40%至90%的范围内,优选在按重量计从50%至85%的范围内。基于总的聚合物,α,β-不饱和腈或α,β-不饱和腈的总和的比例通常为按重量计从10%至60%,优选为按重量计从15%至50%。这些单体的比例在各自情况下总计为按重量计100%。附加的单体可以基于总的聚合物以按重量计从0至40%、优选按重量计从0.1%至40%、特别优选按重量计从1%至30%的量值存在。在这种情况下,该一种或多种共轭二烯和/或该一种或多种α,β-不饱和腈的相应的比例被附加的单体的比例所替代,其中在各自的情况下所有单体的比例总计为按重量计100%。
通过聚合以上提及的单体制备此类腈橡胶是本领域技术人员充分已知的并且在文献中进行了全面描述(例如,Houben-Weyl,Methoden der Organischen Chemie Bd.14/1,30Georg Thieme Verlag Stuttgart 1961); Lexikon der Chemie,Band 2,10.Auflage 1997;P.A.Lovell,M.S.El-Aasser,乳液聚合以及乳液聚合物(Emulsion Polymerization and Emulsion Polymers),威利父与子(John Wiley&Sons),ISBN:0471 967467;H.Gerrens,Fortschr.Hochpolym.Forsch.1,234(1959))。
可以用于本发明目的的腈橡胶也是可商购的,例如像朗盛德国公司(Lanxess Deutschland GmbH)在商标和下出售的产品。
可以用于氢化的腈橡胶具有在从30至70、优选从30至50范围内的门尼粘度(在100℃下,ML 1+4)。这对应于在从150,000到500,000范围内,优选在从180,000到400,000范围内的重均分子量Mw。所使用的腈橡胶典型地具有在2.0-6.0范围内,并且优选在2.0-4.0范围内的多分散性PDI=Mw/Mn(Mn是数均分子量)。
门尼粘度的确定是根据ASTM标准D 1646进行的。
依照本发明所获得的氢化的腈橡胶可以具有在大于0一直至150范围内的门尼粘度(在100℃下,ML 1+4),典型地该门尼粘度位于从5到150、优选从10到120、更优选从30到110、甚至更优选从35到100、并且特别优选从50到100并且最优选从60到90的范围内。
这些腈橡胶典型地具有的多分散性PDI=Mw/Mn是在1.5到6的范围内,并且优选在1.8到4的范围内,其中Mw是重均分子量并且Mn是数均分子量。
氢化条件:
本发明的方法总体上是在从0℃到200℃范围内、优选从15℃到150℃范围内的温度下进行的。这意味着该方法可以在温和的条件下进行。在使低分子量烯烃像末端烯烃、内烯烃、环烯烃、共轭烯烃、或者任何其他具有至少一个碳碳双键以及附加地至少一种另外的极性的不饱和双键的烯烃经受氢化的情况下,该温度典型地位于从20℃到100℃的范围内。在聚合物主链中具有双键的聚合物用作基底的情况下,氢化温度典型地位于从40℃到200℃的范围内、优选地位于从70℃到150℃的范围内。
本发明的氢化方法优选是用氢气在从0.1MPa至20MPa的压力下、优选在从1MPa至16MPa的压力下进行的。在本发明方法的实施例中,所述氢气是基本上纯净的。
优选地,该氢化方法是在从0℃到200℃范围内的温度下用氢气在从0.1MPa到20MPa的压力下,优选地在从15℃到150℃范围内的温度下用氢气在从1MPa到16MPa的压力下进行的。
根据通式(I)的催化剂的量可以在宽范围内改变。典型地,根据通式(I)的催化剂是以基于有待氢化的基底从(0.01-0.20):1、优选从(0.01-0.05):1的摩尔比来使用的。
在橡胶聚合物的氢化中,根据式(I)的催化剂的量还可以在宽的范围内改变。然后在基础重量的比上以“phr”(每百份橡胶的分数)计算催化剂的量。基于该橡胶使用了典型地0.005phr到2.5phr的催化剂。基于该橡胶使用了优选0.01phr到2phr并且更优选0.025phr到2phr的催化剂。
氢化可以在合适的溶剂中进行,该溶剂不会使所使用的催化剂失活,并且也不会以任何其他的方式不利地影响该反应。优选的溶剂包括但不限于甲醇、氯苯、溴苯、二氯甲烷、苯、甲苯、甲基乙基酮、丙酮、四氢呋喃、四氢吡喃、二噁烷以及环己烷。特别优选的溶剂为氯苯。在某些情况下,当有待氢化的基底本身可以起溶剂的作用时,例如,在1-己烯的情况下,还可以省略加入另外的附加溶剂。
根据本发明,可以通过任何可能的方式将催化剂引入聚合物中,例如像机械混合,优选通过使用以下程序,该程序可以导致该催化剂和聚合物的均匀分布。
在本发明的一个实施例中,通过以下方式使根据式(I)的催化剂与待氢化的基底进行接触:向基底溶液中添加该催化剂或催化剂溶液并进行混合直至该催化剂的有效分布以及溶解已经发生。
本发明的方法可以在任何另外的助催化剂或者其他添加剂存在或者不存在的情况下进行。没有必要添加此类另外的助催化剂或者其他添加剂。这特别适用于典型地例如与从现有技术已知的其他氢化催化剂(像威尔金森催化剂)结合来使用的助催化剂。在本发明的一个实施例中,该方法是在具有式R1mZ的助催化剂存在或者不存在的情况下进行的,其中R1是相同的或不同的并且各自是C1-C8-烷基基团、C4-C8-环烷基基团、C6-C15-芳基基团、或者C7-C15-芳烷基基团,Z是磷、砷、硫、或者亚砜基团S=O,优选是磷,并且m是2或3,优选是3。在另外一个实施例中,本发明的方法是在三苯基膦存在或者不存在的情况下进行的。
本发明的氢化方法可在装配有调温和搅拌装置的合适的反应器中进行。有可能的是或者分批地或者连续地进行该方法。
在本发明的氢化反应的过程中,将氢气加入该反应器中。反应时间典型地为从约一刻钟(15分钟)至约100小时,取决于操作条件。因为这些新颖的催化剂是稳健的,没有必要使用专门的气体干燥器来干燥氢气。
根据本发明,在该氢化反应完成到希望的程度时,该反应器可进行冷却(如果适用的话)并且排气,并且可以通过任何技术人员所熟知的常规方法来分离出该氢化的基底。
在根据本发明的方法中,可能发生的是氢化反应和复分解反应同时出现。在聚合物基底并且特别是腈橡胶在根据本发明的方法中用作基底的情况下,此类复分解反应导致了该基底分子量的降低。
新颖的钌基三唑碳烯络合物可以作为用于含有碳-碳双键的不饱和化合物(优选腈橡胶)的氢化的催化剂使用。
此类络合催化剂是价廉的、热稳健的、抑制凝胶形成的并且是烯烃选择性的。
实例:
在下文中,“PPh3”用作三苯基膦的缩写,“Ph”在每种情况下是指苯基,“Mes”在每种情况下代表2,4,6-三甲基苯基,“Trip”用作2,4,6-三异丙基苯基的缩写,“iPr3”用作三异丙基的缩写,并且“PCy3”用作三环己基膦的缩写。
一般程序:
使用标准的施伦克和手套箱技术来完成操作(O2水平<0.1 ppm;N2作为惰性气体),除非有区别地指出。溶剂,即,CH2Cl2、Et2O、THF、甲苯、和己烷以干燥形式来使用并且在N2下储存。RuHCl(PPh3)3和RuHCl(H2)(PCy3)2根据修改的文献程序(M.Viciano,M.Feliz,R.Corberan,J.A.Mata,E.Clot和E.Peris,有机金属,2007,26,5304-5314.)制备。
A配体和催化剂的合成
1的合成.将苯(10 mL)加入到[(C6H2iPr3)CH2C2N2(NMe)Ph)2Ag][AgCl2](0.261 g,0.25 mmol)和RuHCl(H2)(PCy3)2(0.350 g,0.50 mmol)的混合物中。将该反应混合物在室温下搅拌48小时,从而产生具有棕色沉淀的红色溶液。过滤出该棕色固体。从该红色溶液中移除所有挥发物,从而产生红色固体,将其用己烷(3×10 mL)洗涤。将该固体在高真空下干燥,以给出1,作为纯产物(0.351 g)。使该己烷相静置48小时,在该时间期间形成了红色晶体(0.058 g),作为纯产物1。将这些固体合并并且完全干燥以给出1(0.409 g,76%)。
化合物1:
1H-NMR(CD2Cl2):δ0.92-2.16(m,84H,PCy3和iPr的CH3),2.97(sept,J=6.9 Hz,1H,iPr的CH),3.07(sept,J=6.9 Hz,2H,iPr的CH),4.11(s,3H,N-CH3),5.58(s,2H,CH2),6.51(t,J=7.7 Hz,1H,C6H4),6.60(t,J=7.2 Hz,1H,C6H4),7.08(d,J=7.5Hz,1H,C6H4),7.18(s,2H,C6H2),8.25(d,J=8.0Hz,1H,C6H4)。
13C-NMR(CD2Cl2):δ24.12,26.99,28.05,28.33,28.59,30.69,30.97,31.53,34.70,37.09,38.20(PCy3,iPr的CH和CH3),49.28(N-CH3),66.06(CH2),117.52,118.91,122.03,122.34,125.50,139.91,143.65,149.44,150.04,154.62(Ar-C),181.59(Ru-C)。
31P-NMR(CD2Cl2):δ24.49。
C61H98ClN3P2Ru(1071.92)的计算分析:C,68.35;H,9.22;N,3.92。
发现:C,68.22;H,9.21;N,3.87。
2和3的合成.将苯(10mL)加入到[(C6H5)CH2C2N2(NMe)Ph)2Ag][AgCl2](0.197g,0.25mmol)和RuHCl(H2)(PCy3)2(0.350g,0.50mmol)的混合物中。将该反应混合物在室温下搅拌48小时,从而产生具有棕色沉淀的红色溶液。过滤出该棕色固体。将该红色溶液浓缩到约2-3mL并且滴加到己烷(15mL)中同时剧烈搅拌。这产生了具有橙色沉淀的红色溶液。将该固体过滤出来并且在高真空下干燥,以给出2(0.291g,约60%)(化合物2包含杂质并且不能以纯的形式分离出来)。使该红色溶液在室温下静置18小时,从而产生橙色半晶体沉淀和红色溶液。将该红色溶液置于-35℃下48小时,从而产生红色晶体。将这些晶体干燥,以给出纯的3(0.038g,8%)。
4和5的合成.将苯(10mL)加入到[(C6H2Me3)CH2C2N2(NMe)Ph)2Ag][AgCl2](0.230g,0.25mmol)和RuHCl(H2)(PCy3)2(0.350g,0.50mmol)的混合物中。将该反应混合物在室温下搅拌48小时,从而产生具有棕色沉淀的红色溶液。过滤出该棕色固体。将该红色溶液浓缩到约2-3mL并且滴加到己烷(15mL)中同时剧烈搅拌。这产生了具有橙色沉淀的红色溶液。将该固体过滤出来并且在高真空下干燥以给出4(0.281g,56%),作为粗产品。从甲苯中结晶给出纯的4(0.202g,40%),作为红色晶体。将该红色溶液在室温下静置18小时,从而产生橙色半晶体沉淀和红色溶液。将该红色溶液置于-35℃下48小时,从而产生红色晶体。将这些晶体干燥,以给出纯的5(0.038g,8%)。
化合物4:
1H-NMR(CD2Cl2):δ1.08-2.23(m,66H,PCy3),2.30(s,3H,CH3),2.41(s,6H,CH3),4.23(s,3H,N-CH3),5.96(s,2H,CH2),6.98(m,1H,C6H4),7.52-7.79(m,4H,C6H2和C6H4),9.01(m,1H,C6H4)。
13C-NMR(CD2Cl2):δ20.15,21.18,24.35,27.14,28.28,29.42,30.24,30.64,32.32,33.22,38.19,39.26(PCy3和CH3),49.04(N-CH3),62.86(CH2),122.37,125.36,128.64,129.35,129.81,130.04,132.28,139.16,140.65,143.54(Ar-C),178.51(Ru-C)。
31P-NMR(CD2Cl2):δ23.96。
C55H86ClN3P2Ru(987.76)的计算分析:C,66.88;H,8.78;N,4.25。
发现:C,66.81;H,8.91;N,4.26。
6和7的合成.将苯(10mL)加入到[((C6H2Me3)CH2C2N2(NMe)(C6H4Me))2Ag][AgCl2](0.216g,0.26mmol)和RuHCl(H2)(PCy3)2(0.350g,0.50mmol)的混合物中。将该反应混合物在室温下搅拌48小时,从而产生具有棕色沉淀的红色溶液。过滤出该棕色固体。将该红色溶液浓缩到约2-3mL并且滴加到己烷(15mL)中同时剧烈搅拌。这产生了具有橙红色沉淀的红色溶液。将该固体过滤出来并且在高真空下干燥以给出6,作为粗产品。将该粗产品溶解在甲苯中并且结晶给出红色晶体,作为纯的6(0.213g,42%)。使该红色溶液在室温下静置48小时,从而产生红色晶体。将这些晶体干燥并且1H-NMR测量表明了这些红色晶体是6和7的混合物。化合物7不能以纯的形式分离。
化合物6:
1H-NMR(CD2Cl2):δ0.89-2.05(m,66H,PCy3),2.24(s,3H,CH3),4.17(s,3H,N-CH3),5.81(s,2H,CH2),6.48(d,J=7.6Hz,1H,C6H3),7.06(d,J=7.6Hz,1H,C6H3),7.31-7.42(m,5H,C6H5),7.96(s,1H,C6H3)。
13C-NMR(CD2Cl2):δ21.78,22.75,27.08,28.44,30.31,30.44,30.63,33.28,34.54,36.84,37.12(PCy3,CH3和N-CH3),56.20(CH2),118.82,118.94,127.84,127.98,128.69,132.61,136.51,137.11,143.38,154.31(Ar-C),183.11,183.96(Ru-C)。
31P-NMR(CD2Cl2):δ24.17。
C53H82ClN3P2Ru(959.71)的计算分析:C,66.33;H,8.61;N,4.38。
发现:C,66.25;H,8.56;N,4.42。
8和9的合成.将苯(10mL)加入到[((C6H2Me3)CH2C2N2(NMe)(C6H4CF3))2Ag][AgCl2](0.244g,0.26mmol)和RuHCl(H2)(PCy3)2(0.350g,0.50mmol)的混合物中。将该反应混合物在室温下搅拌48小时,从而产生具有棕色沉淀的红色溶液。过滤出该棕色固体。将该红色溶液浓缩到约2-3mL并且滴加到己烷(15mL)中同时剧烈搅拌。这产生了具有橙红色沉淀的红色溶液。将该固体过滤出来并且在高真空下干燥以给出8,作为粗产品。将该粗产品溶解在甲苯中并且结晶给出红色晶体,作为纯的8(0.193g,38%)。使该红色溶液在室温下静置48小时,从而产生红色晶体。将这些晶体干燥并且1H-NMR测量表明了这些红色晶体是8和9的混合物。化合物9不能以纯的形式分离。
化合物8:
1H-NMR(CD2Cl2):δ0.83-2.04(m,66H,PCy3),4.25(s,3H,N-CH3),5.85(s,2H,CH2),6.91(d,J=7.5Hz,1H,C6H3),7.23(d,J=7.5Hz,1H,C6H3),7.31-7.44(m,5H,C6H5),8.43(s,1H,C6H3)。
13C-NMR(CD2Cl2):δ26.98,28.28,28.31,28.36,30.48,30.53,36.70,36.76,36.82,37.54(PCy3和N-CH3),56.37(CH2),114.08,118.42,127.95,128.81,129.67,130.34,136.04,138.53,143.40,153.15(Ar-C和CF3),184.81,186.88(Ru-C)。
31P-NMR(CD2Cl2):δ23.58。
C53H79ClN3P2Ru(1013.68)的计算分析:C,62.80;H,7.86;N,4.15。
发现:C,62.87;H,7.83;N,4.18。
10的合成将甲苯(30 mL)加入到[(C6H2iPr3)CH2C2N2(NMe)Ph)2Ag][AgCl2](0.520 g,0.50 mmol)和RuHCl(PPh3)3(0.926 g,1.00 mmol)的混合物中。将该反应混合物在室温下搅拌40小时,从而产生具有棕色沉淀的深红色溶液。将该沉淀过滤出来并且将溶液浓缩到其初始体积的约四分之一。将该浓缩的溶液滴加到充分搅拌的己烷(30 mL)中,从而产生红色沉淀与浅红色溶液。将该液体抽出(syringed off)并且用己烷(3×10 mL)洗涤该固体。在静置时从该浅红色溶液中沉淀出作为深红色晶体的纯产品。将该红色固体干燥以给出粗产品。将该粗产品溶解在甲苯中并且结晶给出第二批次的深红色晶体,作为纯的10(0.383 g,37%)。偶尔也会结晶出无色的AgCl(PPh3)晶体并且将其与深红色晶体机械地分离。
化合物10:
1H-NMR(CD2Cl2):δ0.93(d,J=6.3 Hz,12H,iPr的CH3),1.26(d,J=6.5 Hz,6H,iPr的CH3),2.28(sept,J=6.3 Hz,1H,iPr的CH),2.89(sept,J=6.3 Hz,2H,iPr的CH),3.30(s,3H,Me),5.22(s,2H,CH2),6.17(d,J=8.6 Hz,1H,Ar-H),6.40-6.45(m,2H,Ar-H),7.01(s,2H,Ar-H),7.05-7.42(m,30H,PPh3),7.91(d,J=8.6 Hz,1H,Ar-H)。
13C-NMR(CD2Cl2):δ24.04(iPr的CH3),24.98(iPr的CH),30.30(iPr的CH3),34.60(iPr的CH),36.49(N-CH3),48.98(CH2),118.75,120.46,121.85,122.94,124.38,127.66,128.70,140.07,149.56,149.91,154.64(Ar-C),174.27,175.45(Ru-C)。
31P-NMR(CD2Cl2):δ39.95。
C61H62ClN3P2Ru(1035.64)的计算分析:C,70.74;H,6.03;N,4.06。
发现:C,71.01;H,5.99;N,4.09。
11和12的合成.将甲苯(30mL)加入到[(C6H5)CH2C2N2(NMe)Ph)2Ag][AgCl2](0.396g,0.50mmol)和RuHCl(PPh3)3(0.926g,1.00mmol)的混合物中。将该反应混合物在室温下搅拌40小时,从而产生具有棕色沉淀的深红色溶液。将该沉淀过滤出来并且将溶液浓缩到其初始体积的约四分之一。将该浓缩的溶液滴加到充分搅拌的己烷(30mL)中,从而产生橙红色沉淀与浅红色溶液。将该红色溶液抽出并且静置2天得到深红色晶体。将这些晶体在高真空下干燥,以给出纯的12(0.046g,5%)。用己烷(3×10mL)洗涤该橙红色固体并且干燥以给出粗产品11。将该粗产品溶解在CH2Cl2(3mL)中并且在10天内缓慢扩散Et2O给出深红色晶体,作为纯11(0.191g,21%)。
化合物11:
1H-NMR(CD2Cl2):δ3.34(s,3H,Me),4.86(s,2H,CH2),6.29-6.36(m,1H,Ar-H),6.41-6.49(m,2H,Ar-H),6.80(d,J=7.6Hz,2H,Ar-H),6.95-7.03(m,3H,Ar-H),7.09-7.45(m,30H,PPh3),8.08(d,J=7.5Hz,1H,Ar-H)。
13C-NMR(CD2Cl2):δ36.59(N-CH3),55.99(CH2),118.83,120.08,122.96,124.38,127.73,128.70,129.35,134.48,134.79,135.09,136.01,139.77,141.09,153.53(Ar-C),173.39,180.64(Ru-C)。
31P-NMR(CD2Cl2):δ37.70。
C52H44ClN3P2Ru(909.40)的计算分析:C,68.68;H,4.88;N,4.62。
发现:C,68.73;H,4.85;N,4.60。
B.1 NBR的氢化
在P2O5上蒸馏C6H5Cl。通过穿过一个马西森(Matheson)气体干燥器型号450B来纯化H2。
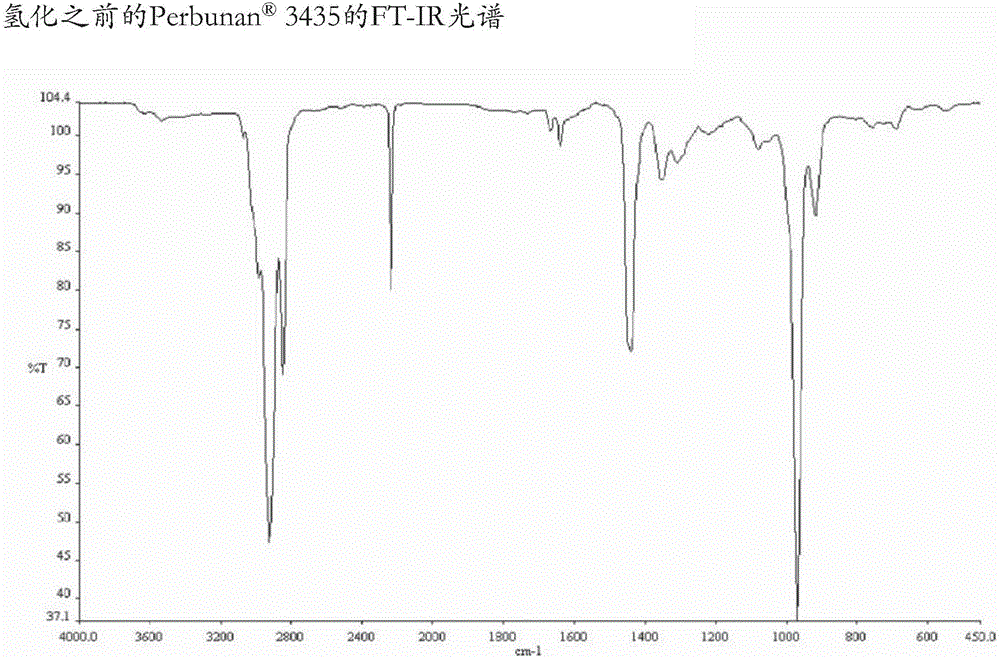
在系列1和2中,可商购的 T 3435被用作腈橡胶:
T 3435:34wt%ACN;门尼粘度(ML 1+4,在100℃下):35+/-3MU;Mn=80,000g/mol;Mw=260,000g/mol。
在该手套箱中,向帕尔(Parr)反应器中分别加入5.0mL的NBR溶液(在C6H5Cl中5wt.-%)和催化剂1、3、4、5、6、8、10、11或12(2.5mg,约2.5μmol和1.0mg,约1.0μmol)。将该反应器从该手套箱中取出,并且用20巴H2吹扫(四次)。将温度设置在80℃并且将压力设置在40巴的H2。在该温度平衡到80℃之后,将该压力增加到50巴,并且在强力搅拌之下进行该反应持续20小时。通过将该反应器冷却到室温并且排出H2来停止该氢化。聚合物通过FT-IR(在KBr板上的薄膜)表征。
B.2 1-己烯的氢化
在手套箱中,将金属络合物10(0.005g,5μmol)或11(0.005g,5μmol)或12(0.005g,5μmol)的样品、氘化溶剂(0.5mL)(对于12,C6D6,并且对于10和11,CD2Cl2)以及基底,即1-己烯(0.1mmol)在小瓶中合并。将该混合物转移到杰杨(J.Young)管中并且将该杰杨管密封。在施伦克生产线上,使用冷冻-泵-解冻法来将该反应混合物脱气四次。然后将该样品再一次在液氮中冷冻,并且添加4.053巴的H2。将该杰杨管再次密封并且加温到室温并且然后置于预加热到45℃的油浴中。在适当的时间间隔测量了1H-NMR光谱,并且基底和产品峰的相对积分被用于确定该混合物的组成。
B.3苯乙烯的氢化
遵循与B.2中相同的程序。
B.4苯乙炔的氢化
遵循与B.2中相同的程序。
B.5丙烯醛的氢化
遵循与B.2中相同的程序。
B.6丙烯腈的氢化
遵循与B.2中相同的程序。
B.7 3-丁烯-2-酮的氢化
遵循与B.2中相同的程序。
B.8烯丙基胺的氢化
遵循与B.2中相同的程序。
B.9 1-乙烯基咪唑的氢化
遵循与B.2中相同的程序。
表1:NBR( T3435)的氢化(80℃;50巴;20h)。
nd=不可确定的;IE=本发明的实例;CE=对比实例
包含芳基膦配体(如三苯基膦配体)的具有通式(I)的络合物的使用防止了不饱和的聚合物(像NBR)的氢化。
表2.使用催化剂10、11和12氢化链烯烃a
a条件:在45℃下、在4巴H2下0.10mmol的基底和5mol%的在CD2Cl2或C6D6中的催化剂。
b产率通过1H-NMR光谱确定。
c观察到4%的产品是苯乙烯。
络合物10、11和12示出小分子(像,1-己烷、苯乙烯、苯乙炔、丙烯醛、丙烯腈、3-丁烯-2-酮、烯丙基胺和1-乙烯基咪唑)的氢化。
- 还没有人留言评论。精彩留言会获得点赞!