聚集装置及聚集方法、微小物体聚集结构体的制造装置、微生物的聚集除去装置、被检测物质的检测装置、被分离物质的分离装置以及被导入物质的导入装置与流程
本发明涉及聚集装置及聚集方法、微小物体聚集结构体的制造装置、微生物的聚集除去装置、被检测物质的检测装置、被分离物质的分离装置以及被导入物质的导入装置。更具体而言,本发明涉及将多种微小物体聚集的聚集装置、具备该聚集装置的微小物体聚集结构体的制造装置、微生物的聚集除去装置、被检测物质的检测装置、被分离物质的分离装置及被导入物质的导入装置以及将多种微小物体聚集的聚集方法。
背景技术:
近年来,提出了通过光照射将微小粒子在目标位置聚集的技术。例如国际公开第2006/104048号(专利文献1)公开了一种液相中配置微小粒子的方法。其准备在微小粒子固定面将微小粒子固定化而成的原始基板和具有微小粒子配置面的目标基板。将原始基板和目标基板以微小粒子固定面和微小粒子配置面彼此相对的状态介由液相而配置。在该状态下,利用因激光照射而诱发的物理力和化学力中的至少一方,将微小粒子从微小粒子固定面分离。分离的微小粒子通过重力在液相中下落并配置于微小粒子配置面。
现有技术文献
专利文献
专利文献1:国际公开第2006/104048号
技术实现要素:
国际公开第2006/104048号(专利文献1)所公开的配置方法是以固定于原始基板的微小粒子固定面的微小粒子作为光照射的对象的技术。从扩大基于光照射的微小物体聚集技术的适用范围的观点考虑,迫切期望能够将在液体中或气体中分散的状态的微小物体聚集的技术。
本发明为了解决上述课题而完成,其目的在于提供一种通过光照射能够将在液体中或气体中分散的状态的微小物体聚集的技术。
根据本发明的一个方面的聚集装置,将物理特性、化学特性以及生物学特性中的至少一个特性互不相同的多种微小物体进行聚集。聚集装置具备保持部件和光源。保持部件以能够保持分散了多种微小物体的空间的方式构成。光源向保持部件或上述空间照射光并在上述空间内产生温度差。
优选上述空间包含能够分散多种微小物体的液体。保持部件包含以能够保持分散了多种微小物体的液体的方式构成的基板。
优选上述基板包含保持液体的保持区域。保持区域由将来自光源的光转换成热的材料形成。
优选保持区域包含通过蒸镀或溅射而形成的膜。优选保持区域包含通过多个金属纳米粒子的自组织化而形成的膜。
优选光源发出包含于上述材料的光吸收区域的波长的激光。
优选保持区域具有沿激光的照射方向的厚度。上述厚度基于激光的强度和上述材料的光吸收性而确定。
优选光源向保持区域照射光而在保持区域的附近产生温度差,以产生对流和气泡的方式对保持区域进行加热。
优选多种微小物体包含粒径互不相同的多个第1粒子和多个第2粒子。多个第1粒子和多个第2粒子中的至少一方为各自将来自光源的光转换成热的多个光热转换粒子。光源通过向液体照射光,从而使多个光热转换粒子在上述液体的光的照射位置发热并在液体内产生温度差而在液体内引起对流,多个第1粒子和多个第2粒子因对流而移动,由此将多个第1粒子和多个第2粒子在照射位置(以及其周边中的至少一方)聚集。
优选聚集装置进一步具备物镜。物镜将来自光源的光会聚,将会聚的光向保持区域或上述空间导入。
优选聚集装置进一步具备调整机构。调整机构以使物镜的焦点在液体中且位于液体的周围的气体与液体的界面即气液界面的附近的方式,调整物镜和气液界面之间的距离。
优选多种微小物体包含作为物理特性粒径和形状的至少一方彼此不同的两种以上的微小物体。
根据本发明的另一方面的聚集方法,将物理特性、化学特性以及生物学特性中的至少一个特性互不相同的多种微小物体聚集。聚集方法具备:使多种微小物体分散于由保持部件规定的空间内的步骤、将用于在上述空间内产生温度差的光照射于保持部件或上述空间的步骤。
优选上述空间包含能够分散多种微小物体的液体。保持部件包含以能够保持液体的方式构成的基板。分散步骤包括在进行照射的步骤之前准备分散了多种微小物体的液体的步骤。
优选上述基板包含可保持液体的保持区域。在进行照射的步骤中,照射于保持区域的光转换成热。
优选在进行照射的步骤中,照射包含于保持区域的材料的光吸收区域的波长的激光。
优选在进行照射的步骤中,向保持区域照射光,以在保持区域的附近产生对流和气泡的方式对保持区域进行加热。
优选聚集方法进一步具备在对保持区域进行加热后使保持区域真空干燥的步骤。
优选多种微小物体包含粒径互不相同的多个第1粒子和多个第2粒子。多个第1粒子和多个第2粒子中的至少一方为各自将来自光源的光转换成热的多个光热转换粒子。在上述进行照射的步骤中,多个光热转换粒子在上述液体的光的照射位置发热并在液体内产生温度差而在液体内引起对流。多个第1粒子和多个第2粒子因对流而移动,由此在照射位置(以及其周边中的至少一方)聚集。
优选多种微小物体包含作为上述物理特性粒径和形状的至少一方彼此不同的两种以上的微小物体。
根据本发明的另一方面的微小物体聚集结构体的制造装置,具备上述的聚集装置。
根据本发明的另一方面的微生物的聚集除去装置,具备上述聚集装置。多种微小物体含有微生物。光源以向保持部件或上述空间照射光而除去上述空间内的微生物的方式对保持部件进行加热。
根据本发明的另一方面的检测装置,对多种微小物体可能含有的被检测物质进行检测。检测装置具备上述聚集装置、拍摄设备和检测器。拍摄设备对照射有来自光源的光的上述空间进行拍摄。检测器基于通过拍摄设备拍摄的图像,检测出被检测物质。
根据本发明的另一方面的分离装置,对多种微小物体可能含有的被分离物质进行分离。分离装置具备:将多种微小物体聚集而形成聚集体的上述聚集装置、分光用光源、分光器、分离部。分光用光源发出用于测定通过聚集装置而聚集的聚集体的光谱的光。分光器测定聚集体的光谱。分离部根据基于分光器的光谱的测定结果,对被分离物质进行分离。
根据本发明的另一方面的被导入物质的导入装置,具备上述聚集装置。多种微小物体包含细胞和通过细胞的内吞作用被导入细胞内的被导入物质。光源通过向保持部件或空间照射光,对保持部件进行加热而使被导入物质聚集,从而促进被导入物质向细胞内的导入。
优选被导入物质的导入装置进一步具备附着于保持部件的细胞。
根据本发明,可将分散于液体中或气体中的状态的微小物体通过光照射而聚集。
附图说明
图1是表示本发明的实施方式1的聚集装置简要构成的图。
图2是图1中示出的聚集装置的基板附近的构成的放大立体图。
图3是用于说明分散于第1~第3样品中的微珠的图。
图4是用于说明本发明的实施方式1的微珠的聚集方法的流程图。
图5是表示第3样品中的光照射开始后的激光斑点附近区域的随时间变化的连续照片。
图6是用于说明第3样品中形成微珠聚集体的机理的示意图。
图7是用于说明在图8~图17中使用的微珠的聚集条件的图。
图8是表示在第1样品中使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图9是表示在第2样品中使用使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图10是表示在第3样品中使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图11是表示在第1样品中使用10倍透镜而形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图12是表示在第2样品中使用10倍透镜而形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图13是表示在第3样品中使用10倍透镜而形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图14是表示微珠1与微珠2的个数比为1:43时使用100倍透镜形成的聚集体的SEM照片和聚集体的三维形状的图。
图15是表示微珠1与微珠2的个数比为1:9时使用100倍透镜形成的聚集体的SEM照片和聚集体的三维形状的图。
图16是表示微珠1与微珠2的个数比为1:43时使用10倍透镜而形成的聚集体的SEM照片和聚集体的三维形状的图。
图17是表示微珠1与微珠2的个数比为1:9时使用10倍透镜而形成的聚集体的SEM照片和聚集体的三维形状的图。
图18是表示本发明的实施方式1的变形例的聚集装置的简要构成的图。
图19是在第4~第6样品的气液界面的聚集体的光学照片。
图20是将第4样品的聚集体放大表示的SEM照片。
图21是使第3样品真空干燥时形成的聚集体的SEM照片。
图22是表示图21中示出的聚集体的三维形状和截面形状的图。
图23是表示对第3样品不进行光照射而自然干燥的情况下的消光光谱和在光照射后进行真空干燥的情况下的消光光谱的图。
图24是用于比较在光照射后进行自然干燥时的机理和在光照射后进行真空干燥时的机理的示意图。
图25是表示微泡的直径的测定结果的图。
图26是形成于第1样品的液滴的边缘的区域的聚集体的SEM照片。
图27是形成于第2样品的液滴的边缘的区域的聚集体的SEM照片。
图28是形成于第3样品的液滴的边缘的区域的聚集体的SEM照片。
图29是表示第1~第3样品的消光光谱的图。
图30是表示第7样品的光照射开始后的激光斑点附近区域的随时间变化的连续照片。
图31是用于在第3样品与第7样品之间进行光照射停止后的变化的连续照片。
图32是表示在第7样品中使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图33是表示在第7样品中使用10倍透镜而形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。
图34是表示本发明的实施方式4的微生物的聚集除去装置的简要构成的图。
图35是表示图34中示出的捕集部的构成的一个例子的图。
图36是表示本发明的实施方式5的检测装置的简要构成的图。
图37是图36中示出的检测装置的基板附近的构成的放大立体图。
图38是用于说明本发明的实施方式5的PM2.5的检测方法的流程图。
图39是表示本发明的实施方式6的分离装置的简要构成的图。
图40是用于说明本发明的实施方式6所涉及的作为被分离物质的细胞的分离方法的流程图。
图41是用于说明捕捉多个微珠的机理的示意图。
图42微珠的双粒子模型的图。
图43是表示本发明的实施方式7的聚集装置的简要构成的图。
图44是图43中示出的聚集装置的基板附近的构成的放大立体图。
图45是用于说明在图46~图49中使用的样品的图。
图46是表示第8样品中的因光照射产生的激光斑点附近区域的随时间变化的连续照片。
图47是在光照射停止后进行自然干燥的第10样品中形成的聚集体的光学照片。
图48是图47所示的区域A(激光斑点的附近区域)的SEM照片。
图49是用于说明在实施方式7中形成聚集体的机理的示意图。
图50是表示第10样品中的因光照射引起的激光斑点附近的随时间变化的连续照片。
图51是在第8~第10样品之间比较光照射开始后的聚集体尺寸随时间变化的图。
图52是表示第8和第11的样品的在光照射开始前的气液界面附近的消光光谱的图。
图53是表示第12样品的利用光照射产生的激光斑点附近的随时间变化的连续照片。
图54是在光照射后进行自然干燥的第12样品中形成的聚集体的光学照片。
图55是第12样品的激光斑点的区域(图54所示的区域R2)的SEM照片。
图56是第12的样品的远离激光斑点的区域的区域(图54所示的区域R3)的SEM照片。
图57是用于说明利用细胞的内吞作用导入肽的的概念图。
图58是基板附近的构成的放大立体图。
图59是图57所示的基板的俯视图。
图60是表示实施方式8中使用的肽的图。
图61是用于说明本发明的实施方式8的肽的导入方法的流程图。
图62是用于说明实施方式8中的肽的聚集机理的示意图。
图63是第13样品在光照射后的共焦点显微镜照片。
图64是第14样品的利用光照射产生的激光斑点附近的光学照片和荧光图。
具体实施方式
以下,参照附图对本发明的实施方式进行详细说明。应予说明,对图中相同或相当的部分标记同一符号,不进行重复说明。
在本发明和其实施方式中,通过对基板的保持区域照射光而在保持区域的附近产生温度差,从而以产生对流和气泡的方式对保持区域进行加热。“附近”是优选指位于例如小于气泡的2倍直径的距离的空间。另外,“在保持区域的附近产生气泡”包括气泡与保持区域接触而产生的情况。
在本发明和其实施方式中,“微小物体”这一用语的意思是具有从亚纳米级至微米的尺寸的物体。微小物体的形状没有特别限定,例如为球形、椭圆球形、杆形等。微小物体为椭圆球形时,只要椭圆球的短轴向和长轴方向的长度的至少一方为从亚纳米级至微米级即可。微小物体为杆形状时,只要杆的宽度和长度的至少一方为从亚纳米级至微米级即可。
作为微小物体的例子,可举出金属纳米粒子、金属纳米粒子聚集体、金属纳米粒子聚集结构体、半导体纳米粒子、有机纳米粒子、树脂微珠等。“金属纳米粒子”是具有纳米级的尺寸的金属粒子。“金属纳米粒子聚集体”是多个金属纳米粒子凝聚而形成的聚集体。“金属纳米粒子聚集结构体”是例如多个金属纳米粒子介由相互作用部位而固定在微珠的表面并彼此留有缝隙而以金属纳米粒子的直径以下的间隔配置的结构体。“半导体纳米粒子”是具有纳米级尺寸的半导体粒子。“有机纳米粒子”是具有由纳米级尺寸的有机化合物构成的粒子。“树脂微珠”是由具有纳米级至微米级尺寸的树脂构成的粒子。
此外,微小物体可以是来自生物体(例如细胞、组织、器官等)的物体、或者与生物体相互作用的物体,例如可包括细胞、生物体物质。生物体物质可包括核酸、蛋白质、多糖类等生物体高分子。另外,微小物体可包括微生物(例如细菌、真菌)、变应原等抗原、病毒。
在本发明和其实施方式中,“被导入物质”只要是可导入细胞内的物质,则可以是生物体物质,也可以是不限定于生物体物质的无机分子或有机分子(例如药品等)。另外,“被导入物质”可含有微生物、抗原、病毒、离子等。
在本发明和其实施方式中,“微小物体聚集结构体”这一用语的意思是多个微小物体通过聚集而形成的结构体。
在本发明和其实施方式中,“PM(Particulate Matter)”是具有微米级尺寸的粒子状物质。作为PM的例子,可举出PM2.5、PM10、SPM(Suspended Particulate Matter)。PM2.5是粒径为2.5μm以下的粒子。PM10和SPM都是粒径为10μm以下的粒子。但是,PM10也可以包括粒径超过10μm的粒子,在该点上,两者不同。
在本发明和其实施方式中,“微泡”是微米级的气泡。
在本发明和其实施方式中,“亚纳米级”包括0.1nm至1nm的范围。“纳米级”包括1nm至1000nm(1μm)的范围。“微米级”包括1μm至1000μm(1mm)的范围。因此,“亚纳米级至微米级”包括0.1nm至1000μm的范围。“亚纳米级至微米级”,典型的是表示数纳米至数百微米的范围,优选表示0.1μm~100μm的范围,更优选表示0.1μm~数十微米。
在本发明和其实施方式中,“种(类)”这一用语的意思是利用共同性质对微小物体进行分类时的微小物体的集合。作为上述共同性质,可使用微小物体的物理特性或化学特性。
在本发明和其实施方式中,“物理特性”这一用语的意思是微小物体的机械特性(力学特性)、电特性、磁特性、光学特性、或者热特性。作为机械特性的具体例,可举出微小物体的尺寸、形状、内部结构、密度。作为电特性的具体例,可举出微小物体的表面电荷、介电常数。作为磁特性的具体例,可举出微小物体的透磁率。作为光学特性的具体例,可举出微小物体的共振吸收波长(激发波长),折射率(高频介电常数的平方根),非线性极化率。作为热特性的具体例,可举出微小物体的比热、导热率、热膨胀率、耐热性。
在本发明和其实施方式中,“化学特性”这一用语的意思是微小物体的材料所涉及的特性和微小物体对分散有微小物体的液体(分散介质)的亲和度。作为微小物体的材料涉及的特性的具体例,例如可举出微小物体的组成、分子结构。作为微小物体对分散介质的亲和度的具体例,可举出微小物体的亲水性或疏水性的程度。
在本发明和其实施方式中,“生物学特性”这一用语的意思是微小物体的作为细胞的特性。作为细胞的特性的具体例,可举出细胞分裂、蛋白质·脂质·糖等的生成和分泌、物质分解、细胞死亡。
在本发明和其实施方式中,“吸收光”或“具有光吸收性”这一用语的意思是物质吸收的光的能量大于零的性质。光的波长区域可以是紫外区域、可视区域和近红外区域中的任一区域;跨越这3个区域中的2个区域的区域;跨越3个区域中的全部区域的区域均可。即,光可以为激光,但并不限定于此,可以是白色光或脉冲光等光谱宽度宽的光。
光吸收性例如可以根据吸收率的范围进行定义。该情况下,吸收率的范围的下限只要大于零即可,没有特别限定。另外,吸收率的范围的上限为100%。
在本发明和其实施方式中,“分散”这一用语的意思是微小物体在液体中悬浮。另外,“单分散”这一用语的意思是粒径和形状的均匀性高。作为一个例子,通过标准偏差与平均粒径之比定义的变异系数(CV:Coefficient of Variation)典型而言为15%以下,优选为10%以下,更优选为5%以下。
[实施方式1]
在以下的实施方式1中,作为微小物体的一个例示的方式,采用由聚苯乙烯构成的树脂微珠。但是,树脂微珠的材料并不限定于此,例如可以为丙烯酸、聚烯烃、聚乙烯、聚丙烯等。
<聚集装置的构成>
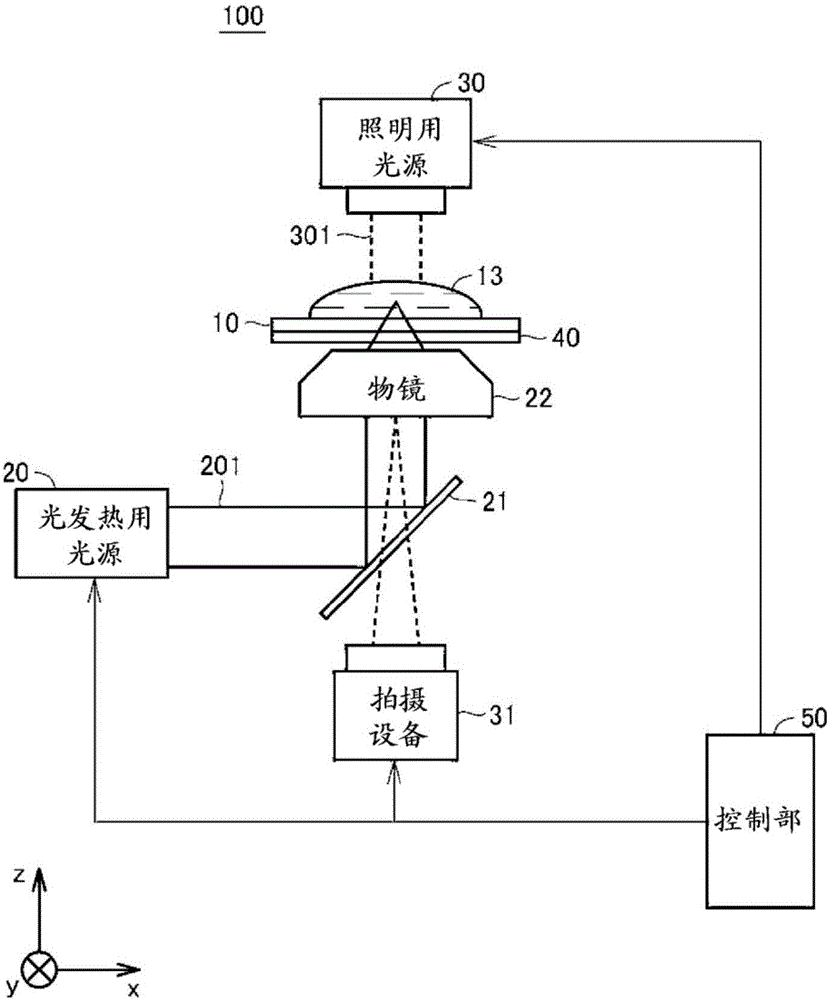
图1是表示本发明的实施方式1的聚集装置的简要构成的图。参照图1,聚集装置100具备:基板10、光发热用光源20、二向色镜21、物镜22、照明用光源30、拍摄设备31、XYZ轴工作台40、控制部50。x方向和y方向表示水平方向。x方向和y方向彼此正交。z方向表示铅直方向。重力的朝向为z方向下方。
基板10配置于XYZ轴工作台40上。基板10保持样品13。本实施方式中,样品13是分散有微珠1和微珠2(参照图3)中的至少一方的液体。样品13的详细内容如后所述。
光发热用光源20产生例如近红外(例如波长1064nm)的激光201。激光201优选为连续光。应予说明,光发热用光源20的具体构成并不限定于此。可使用发出后述薄膜12(参照图2)的材料的光吸收带的光的各种光源作为光发热用光源20。
二向色镜21反射近红外光并使白色光透过。二向色镜21将来自光发热用光源20的近红外的激光201反射而引向物镜22。
物镜22将来自光发热用光源20的激光201会聚。物镜22能在其焦点位置形成与激光201的光轴垂直的方向的截面的直径成为最小的激光斑点(或光束腰)。被物镜22会聚的光照射到基板10或样品13。在此,“照射”包括激光201通过基板10或样品13的情况。即,并不限定于被物镜22会聚的光的激光斑点位于基板10内或样品13内。
在本实施方式中,准备倍率不同的两种物镜22。物镜的倍率为10倍或100倍。应予说明,二向色镜21和物镜22例如组装到倒立型显微镜主体(未图示)。
使用100倍的物镜时,通过物镜22后的激光201的输出为例如从光发热用光源20射出的激光201的输出的约20%。在本实施方式中,激光201的输出为0.5W,通过物镜22和基板10后的激光201的输出在没有薄膜12且没有样品13的情况下为100mW。激光斑点的直径约为1μm。另外,使用10倍物镜时,通过物镜22和基板10后的激光201的输出为从光发热用光源20射出的激光201的输出的约60%。激光斑点的直径约为10μm。在以下说明各实施方式和其变形例中,只要没有特别说明,通过物镜22和基板10后的激光201的输出在没有薄膜12且没有样品13的状态下设定为100mW。
照明用光源30发出用于照射基板10上的样品13的光。照明用光源30是发出例如白色光301的光源。作为一个实施例,在照明用光源30中可使用卤素灯。
物镜22还可以用于捕获来自样品13的白色光301。通过物镜22的白色光301透过二向色镜21而到达拍摄设备31。
拍摄设备31拍摄样品13中的激光201的激光斑点附近区域。拍摄设备31例如可通过具备图像传感器的摄像机而实现。用拍摄设备31拍摄的图像可以为动画,也可以为静止画面。
控制部50对光发热用光源20、照明用光源30和拍摄设备31进行控制。控制部50例如通过微型计算机或个人计算机等实现。
应予说明,聚集装置100的光学系只要能够将光发热用的激光201照射到基板10,并且能够将来自样品13的白色光301捕捉到拍摄设备31,就不限定于使用二向色镜。聚集装置100的光学系除了二向色镜或者代替二向色镜,可以含有光纤等光学部件。另外,聚集装置100中,照明用光源30和拍摄设备31不是必要的构成要素。
图2是图1中示出的聚集装置100的基板10附近的构成的放大立体图。参照图1和图2,基板10包括:玻璃罩11、形成于玻璃罩11上的薄膜12。
薄膜12为了吸收来自光发热用光源20的激光201而将光能转换为热能而形成。薄膜12的材料优选为对激光201的波长带(在本实施方式中为近红外)的光吸收性(例如光热转换效率)高的材料。另外,优选考虑激光201的强度和薄膜12的材料的光吸收性,通过设计或实验而确定薄膜12的厚度。
在本实施方式中,可形成厚度为纳米级的金薄膜作为薄膜12。金薄膜的表面的自由电子形成表面等离子体,通过激光201而振动。由此,产生极化。其结果,金薄膜生成热。将该效果称为“光发热效果”。
应予说明,在本实施方式中使用1064nm的波长的光作为激光201而产生光发热效果,但也可以使用与金薄膜的表面等离子体共振波长(在空气中或水中存在于400nm~800nm的可见光的波长区域的波长)相近的波长的光作为激光201。由此,即使为同一激光器输出,也能够产生更多的热量。
薄膜12可使用蒸镀、溅射或者自组织化等公知的方法形成。在本实施方式中,使用Hitachi High-Technologies株式会社制的离子溅射装置E-1010型而形成薄膜12。薄膜12的厚度设定为10nm。
应予说明,薄膜12的材料并不限定于金,也可以为能够产生光发热效果的金以外的金属元素(例如银)、金属纳米粒子聚集结构体(例如使用金纳米粒子或银纳米粒子的结构体)等。或者,也可以为激光201的波长带的光吸收率高的材料。作为这样的材料,有接近黑体的材料(例如碳纳米管黑体)。
通过调整XYZ轴工作台40的位置,从而调整基板10相对于物镜22的焦点的相对位置。在物镜22的焦点的位置形成激光201的激光斑点。激光201的激光斑点优选调整为位于薄膜12附近。
在基板10上形成保持样品13的保持区域。在图2所示的例子中,在玻璃罩11整体形成薄膜12,但薄膜12中的保持样品13的区域(以虚线表示)与保持区域121相当。应予说明,可以仅在保持区域121形成薄膜。另外,虽在图2中未示出,但可设置表示应滴加样品13的位置的液滴向导。作为液滴向导可以沿保持区域121的外圆周形成环状的阶梯。但是,液滴向导的尺寸和形状可根据应保持的样品13的体积等适当地设定。
样品13为分散有聚苯乙烯微珠的液体。液体(分散介质)的种类没有特别限定,但在本实施方式中为水(具体而言为超纯水)。在本实施方式中准备3种样品。应予说明,以下说明的第1和第2样品是作为第3样品的比较例进行准备的。液体的体积均为10μL。
图3是用于说明分散于第1~第3样品的微珠的图。参照图3(A)~(C),微珠1、2各自为疏水性粒子。微珠1、2的形状大致为球形。为了防止分散于液体中的微珠1、2的凝聚,全部的微珠1、2的表面带有相同符号的电(在本实施方式中带负电)。
第1样品仅为微珠1的单分散性的液体(参照图3(A))。微珠1的粒径为1.0μm。微珠1的个数N1为4.6×106个。
第2样品仅为微珠2的单分散性的液体(参照图3(B))。微珠2的粒径为0.2μm。微珠2的个数N2为3.9×108个。
第3样品为含有微珠1、2双方的液体(参照图3(C))。微珠1的个数N1和微珠2的个数N2分别为4.6×106个和3.9×108个。即,第3样品中的微珠1与微珠2的个数比为N1:N2=1:85。应予说明,后述的第3’的样品和第3”中的微珠1与微珠2的个数比分别为N1:N2=1:43和1:9(参照图7)。
作为在本实施方式中微珠1,使用Polysciences公司制的Fluoresbrite Carboxylate Microspheres(2.5%Solids-Latex)、1.0μm BB。作为微珠2,使用同公司制的Fluoresbrite Carboxylate Microspheres(2.5%Solids-Latex)、0.20μm NYO。
<聚集方法>
图4是用于说明本发明的实施方式1的微珠的聚集方法的流程图。参照图1~图4,步骤S11中,准备分散微珠而成的样品13(第1~第3样品中任一个)。然后,将样品13滴加于基板10上(步骤S12)。应予说明,在滴加样品13后,可以将样品13静置规定时间(例如5~10分钟左右)。这是由于通过静置直至微珠在样品13中移动变少的状态,从而统一微珠的聚集条件。
控制部50以开始拍摄样品13的方式控制拍摄设备31(步骤S13)。另外,控制部50以向基板10照射激光201的方式控制光发热用光源20(步骤S14)。步骤S14中,将用于产生温度差的激光201通过物镜22会聚到样品13,将会聚而成的光导入薄膜12的保持区域121或样品13。由此,将分散于样品13中的微珠聚集。微珠聚集的形态和其机理的详细内容如后所述。
其后,将样品13的液体气化(步骤S15)。由此,可容易地取得形成于基板10上的微珠的聚集体。将液体气化的方法没有特别限定。例如,可以继续照射激光201,利用薄膜12的发热而使液体气化。在本实施方式中,停止激光201的照射,在空气中放置样品13通过自然蒸发直至液体消失。即,将样品13自然干燥。
应予说明,步骤S13、S15的处理是为了观察样品13或取得聚集体的处理,因此,在微珠的聚集中不是必要的处理。即,在执行仅包含步骤S11、S12、S14的处理的流程图的情况下,也能够聚集微珠。
<微珠的聚集的形态和聚集机理>
接着,参照用拍摄设备31拍摄的照片对微珠聚集的形态的一个例子进行说明。在此,显示包含微珠1、2二者的第3样品的照片。
图5是表示第3样品中的光照射开始后的激光斑点附近区域的随时间变化的连续照片。参照图5,各照片是从铅直方向(z方向)的下方朝向上方来拍摄第3样品的照片。各照片所示的时刻(1s、5s等)表示以光照射开始时为基准的经过的时间(单位:秒)。物镜22的倍率为100倍。
开始照射激光201时,以激光斑点为中心产生微泡MB。继续照射激光201时,微泡MB随着时间的经过生长。但是,在图5所示的例子中,在光照射开始后经过25秒左右,微泡MB的尺寸几乎饱和。
照片表示以激光斑点为中心且在微泡MB的铅直方向的下方微珠1、2聚集的形态。光照射开始后,数秒(例如1秒~5秒)左右,可确认微珠1、2的聚集。其后,随着时间的增加,微珠1、2的聚集量增加。
图6是用于说明在第3样品中形成微珠1、2的聚集体的机理的示意图。参照图6,在光照射开始前,微珠1、2分散在样品13的液体中(参照图6(A))。
开始照射激光201时,薄膜12吸收激光201。被吸收到薄膜12的光能因光发热效果转换成热能(图6(B))。由此,薄膜12中的激光斑点附近的区域被局部加热。该加热区域的周围的液体的温度上升而产生微泡MB(参照图6(C))。微泡MB在薄膜12的附近成长。
越接近于激光斑点,液体的温度越高。换言之,通过激光201的照射在液体中产生温度差。由此,在液体内产生对流。此时产生的对流为热对流。对流的方向如箭头AR1所示,一度朝向微泡MB,其后为远离微泡MB的方向(参照图6(D))。
在微泡MB与基板10中的薄膜12之间,形成对流的流速为零的滞流区。因对流而移动的微珠1、2首先被压向微泡MB的表面。大量的微珠1、2滞留在形成于微泡MB与基板10之间的环状的滞流区附近。即,微泡MB作为微米级的流体限位器发挥功能以截流能够利用光照射进行控制的对流。这里,由于微珠2比微珠1小,所以,微珠2容易进入微泡MB与基板10之间的区域RA(参照图6(E)和图6(F))。微珠2的一部分也能进入微泡MB的铅直方向正下方的区域RB。另一方面,由于微珠1难以进入区域RA、RB,所以,容易在与微珠2相比远离激光斑点的位置聚集。
微珠1、2的聚集结束时,停止激光201的照射。在随后的将样品13的液体气化的过程中,微泡MB从薄膜12中解离。伴随与此,堆积于微泡MB的周围的微珠1、2的一部分被卷入液体中(参照图6(G))。进而,被卷入的微珠1、2因重力而在液体中落下从而在基板10上的薄膜12的表面聚集(参照图6(H))。
<微珠的粒径对聚集体的结构的影响>
接下来,对第1~第3样品的各自中的聚集体的结构进行说明。以下,示出聚集体的扫描式电子显微镜(SEM:Scanning Electron Microscope)照片和利用激光显微镜得到的聚集体的截面形状的测定结果。应予说明,以下所示的结果为测定自然干燥后的样品13的结果。
图7是用于说明在图8~图17中使用的微珠的聚集条件的图。参照图7(A),图8~图10表示对第1~第3样品分别使用倍率为100倍的物镜22(以下,也简记为“100倍透镜”)时的微珠的聚集结果的图。图11~图13是表示对第1~第3样品分别使用倍率为10倍的物镜22(以下,也简记为“10倍透镜”)时的微珠的聚集结果的图。参照图7(B),图14~图17是表示对于第3’和第3”样品,变更微珠1与微珠2的个数比(N1:N2)时的微珠的聚集结果的图。
图8和图9是表示对于第1和第2样品,分别使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。图8(A)和图9(A)是聚集体的SEM照片。图8(B)是表示沿VIIIB-VIIIB线的聚集体的截面形状的测定结果的图。图8(B)的横轴表示沿VIIIB-VIIIB线的距离。图8(B)的纵轴表示朝铅直方向(z方向)上的高度。应予说明,对图9(B)所示的测定结果的说明与图8(B)的说明相同。
参照图8(A)和图8(B),对于第1样品,由微珠1构成的聚集体的高度在激光斑点的中心最高,随着远离激光斑点的中心而逐渐降低。这样的形状能以圆拱形状进行表现。
参照图9(A)和图9(B),对于第2样品,由微珠2构成的聚集体与由微珠1构成的聚集体相比,高度和直径均小。但是,由微珠2构成的聚集体的高度在激光斑点的中心最高的这点上,与由微珠1构成的聚集体相同。
图10是表示对第3样品使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。将图10与图8和图9进行对比。
参照图10(B),在激光斑点的中心的聚集体的高度低于激光斑点的周围的聚集体的高度。由此,在包含微珠1和微珠2二者的样品中,形成所谓环状的聚集体。
进而参照图10(A),如左下的放大图所示,可知聚集体的中央部分主要由微珠2构成。以包围该中央部分的方式,形成主要由微珠1构成的结构。
如上所示,对仅含有1种微珠的样品(第1样品)和含有两种微珠的样品(第3样品)进行比较,则在聚集体的结构上存在差异。作为产生这种差异的重要因素,认为是在微泡MB和其周围的液体的气液界面形成的聚集结构(参照图6(E)和图6(F))的结构稳定性的不同。
进行更详细地说明则关于第1样品,在微泡MB的存在下,微珠1沿着微泡MB与其周围的液体的气液界面而滞留,由此,由微珠1构成的聚集体具有环状。对于该聚集体,因微珠1而形成某种结构。认为该结构为六方最密堆积结构。
微泡MB在将样品13的液体气化的过程中消失。因此,由微珠1构成的聚集体变得无法利用气液界面来维持环状。
除此以外,在液体完全气化前,在微珠1之间作用毛细管力。毛细管力在亲水性的微小物体彼此之间或疏水性的微小物体彼此之间作为引力而发挥作用,相反地,在亲水性的微小物体与疏水性的微小物体之间作为斥力发挥作用。由于微珠1为疏水性,所以,毛细管力作为引力发挥作用而使微珠1凝聚。
如上所述,当样品13的液体气化时,无法利用气液界面维持环状,并且,在微珠1彼此凝聚的方向毛细管力发挥作用。由此,在第1样品中,朝向环状的中心方向,聚集体崩塌。崩塌的微珠1在环状的中央部分堆积,结果,认为聚集体的形状从环状变化为圆拱形状。
与此相对,在第3样品中,与第1样品同样地,由微珠1形成六方最密堆积结构。由于第3样品包含微珠2,因此,微珠2进入邻接的微珠1之间的缝隙中。其结果,微珠1与微珠2之间的粒子间距离比仅由微珠1构成的六方最密堆积结构中的微珠1彼此的粒子间距离小。这样,通过含有粒径不同的两种微珠,从而可形成具有高密度且高结构稳定性的聚集结构。因此,在第3样品的聚集体中,在微泡MB的消失后,也维持环状。
<物镜的倍率对聚集体的结构的影响>
接着,对物镜22的倍率给予聚集体的结构的影响进行说明。具体而言,比较使用10倍透镜形成的聚集体和使用100倍透镜形成的聚集体。
图11~图13是表示对各第1~第3样品使用10倍透镜而形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。图11~图13所示的聚集结果中的聚集条件除物镜22的倍率以外,分别与图8~图10所示的聚集结果中聚集条件相同。
参照图8和图11,第1样品中聚集体的直径在使用100倍透镜时为45μm,而使用10倍透镜时为75μm。同样地,参照图9和图12,第2样品中的聚集体的直径在使用100倍透镜时为38μm,而使用10倍透镜时为100μm。参照图10和图13,第3样品中的聚集体的直径在100倍透镜时为35μm,而使用10倍透镜时为70μm。
由此,与使用100倍透镜而形成聚集体的情况相比,使用10倍透镜而形成聚集体的情况的聚集体的尺寸大。即,通过使用倍率不同的物镜,可控制聚集体的尺寸。其理由在以下说明。
与使用100倍透镜使激光201会聚的情况相比,使用10倍透镜使激光201会聚的情况中产生大的微泡MB。举出实测值的一个例子,使用100倍透镜而将光会聚时,第1~第3样品中的微泡MB的直径的最大值分别为93.8μm、91.1μm、61.0μm。另一方面,使用10倍透镜而将光会聚时,第1~第3样品中的微泡MB的直径的最大值分别为213μm、202μm、177μm。如图6中的说明,在微泡MB与其周围的液体的气液界面形成聚集体。因此,微泡MB越大,聚集体变得越大。
作为与使用100倍透镜进行会聚的情况相比使用10倍透镜而进行会聚的情况中微泡MB变大的理由,认为是以下3个重要因素。
作为第1重要因素,认为是激光斑点的面积。使用10倍透镜进行会聚时比使用100倍透镜进行会聚时的激光斑点的面积变大。即,由于产生光发热效果的区域的面积大,因此,与其区域相接的液体的体积也变大。其结果,认为微泡MB变大。
作为第2重要因素,认为是被薄膜12吸收的激光201的比例(=被薄膜12吸收的光能/照射于薄膜12的光能)。激光201的强度([W/m2]相对于薄膜12的厚度,即单位时间的能量密度[J/(m2·s)])相对高时,激光201的一部分有可能不会被薄膜12吸收而直接透过薄膜12。认为其原因在于,激光强度在一定值以上时,由于被称为吸收饱和的非线形光学现象而超过能够吸收物质的光的允许值。使用10倍透镜进行会聚时,即使激光输出等同,与使用100倍透镜进行会聚的情况相比,激光斑点的面积也变大,因此激光斑点中的光的能量密度变低。由此,因吸收饱和而透过薄膜12的光的能量减小,被薄膜12吸收的光的比例增高。因此,使用10倍透镜进行会聚时,薄膜12能够吸收更大的光能,可有助于产生微泡MB。
作为第3重要因素,认为是薄膜12的改性(包括剥离)。激光201的能量密度高时,激光斑点的区域的薄膜发生改性。由于与使用100倍透镜的情况相比,使用10倍透镜的情况的激光斑点中的能量密度低,因此,不易发生薄膜12的改性。
应予说明,如上所述,优选薄膜12的厚度根据激光的强度和薄膜的材料的光吸收性而确定。薄膜12越薄,因光发热效果而产生的热越容易在薄膜12中传导。由此,由于薄膜12中温度上升的区域变大,因此,与其区域相接的液体的体积变大。其结果,能够产生更大的微泡MB。另一方面,相对于激光201的强度,如果薄膜12过薄,则激光201的一部分不会被薄膜12吸收。其结果,因光发热效果而产生的热能变小。由于存在这样的权衡关系,所以薄膜12的厚度中存在最佳值。
在本实施方式中,薄膜12的厚度设定在10nm。这是由于形成3种膜厚(10nm、30nm、50nm)的薄膜并在光照射下测定微泡MB的尺寸的结果,膜厚为10nm时形成的微泡MB的尺寸最大。
应予说明,即使为相同倍率的物镜22,样品不同,微泡MB的直径也不同。微泡MB的直径按第3样品、第2样品、第1样品顺序依次变小。特别是第3样品中的微泡MB的直径比第1和第2样品中的微泡MB的直径小。认为其原因在于,由多种微珠形成的聚集体(第3样品中的聚集体)与由单一种类的微珠形成的聚集体(第1或第2样品中的聚集体)相比,具有高的结构稳定性,因此,容易妨碍微泡MB的成长。由此可知不含微珠的样品(超纯水)中生成的微泡MB的直径最大。
<微珠的个数比对聚集体的结构的影响>
接下来,对微珠1与微珠2的个数比给予聚集体的结构的影响进行说明。以下,对微珠1与微珠2的个数比为N1:N2=1:43时(第3’的样品时)形成的聚集体的结构和N1:N2=1:9时(第3”的样品时)形成的聚集体的结构进行比较。
图14是表示微珠1与微珠2的个数比为N1:N2=1:43时使用100倍透镜形成的聚集体的SEM照片和聚集体的三维形状的图。图15是表示微珠1与微珠2的个数比为N1:N2=1:9时使用100倍透镜形成的聚集体的SEM照片和聚集体的三维形状的图。图14(A)和图15(A)表示聚集体的SEM照片。图14(B)和图15(B)表示聚集体的三维形状的测定结果。
参照图14和图15,微珠1与微珠2的个数比为N1:N2=1:43时(参照图14)与N1:N2=1:9时(参照图15)相比,聚集体的直径小但聚集体的高度高。
图16是表示在微珠1与微珠2的个数比为N1:N2=1:43时使用10倍透镜而形成的聚集体的SEM照片和聚集体的三维形状的图。图17是表示在微珠1与微珠2的个数比为N1:N2=1:9时使用10倍透镜而形成的聚集体的SEM照片和聚集体的三维形状的图。
参照图16和图17,与图14和图15同样地,微珠的个数比为N1:N2=1:43时(参照图16),与N1:N2=1:9时(参照图17)相比聚集体的直径小但聚集体的高度高。
由此,可确认微珠1与微珠2的个数比为N1:N2=1:43时,与N1:N2=1:9时相比,聚集体的环状更显著。这显示出微珠1与微珠2的个数比为N1:N2=1:43时,聚集体的结构稳定性高、在样品13的气化过程中易于维持聚集体的环状。对其理由进行说明。
如上所述,在第3’和第3”的样品中,产生微泡MB时可形成基于微珠1的六方最密堆积结构。而且,在微珠1之间的缝隙进入微珠2。此时,微珠2的总体积(各微珠2的体积×微珠2的个数N2)越接近于微珠1的总体积(各微珠1的体积×微珠1的个数N1),进入微珠1之间的缝隙的微珠2的个数越多。由此,可提高聚集体的结构稳定性。
在图14~图17所示的例子中,微珠1(直径:1.0μm)与微珠2(直径:0.2μm)的直径比为5:1,因此,微珠1与微珠2的体积比为125:1。微珠1与微珠2的个数比为N1:N2=1:43时,总体积比为(125×1):(1×43)=2.9:1。另一方面,个数比为N1:N2=1:9时,总体积比为(125×1):(1×9)=14:1。微珠1与微珠2的个数比为N1:N2=1:43的情况,与N1:N2=1:9的情况相比,微珠2的总体积接近微珠1的总体积,因此,可形成更高结构稳定性的聚集体。
这样,根据本实施方式,准备微小物体分散的状态的液体。通过对保持该液体的基板进行光照射这种非常简易的操作,可迅速地将微小物体聚集。在本实施方式中示出的样品中,能以仅在数秒至数十秒左右的短时间进行聚集。
微小物体在液体中分散即可,所以,不需要如专利文献1所述的将微小物体固定于基板上的处理。即,可减少光照射前的预处理工序,所以,可降低成本。
应予说明,在本实施方式中,对微小物体在液体中分散的例子进行说明,但本发明的“空间”并不限定于被液体充满。对于微小物体在气体中分散的情况,也可通过光照射在气体中产生温度差而利用由此产生的对流将微小物体聚集。
[实施方式1的变形例]
在实施方式1的变形例中,通过荧光微珠吸收激光。另外,在本变形例中,向样品的液体和其周围的气体的气液界面照射激光。
图18表示本发明的实施方式1的变形例的聚集装置的简要构成的图。参照图18,聚集装置101在进一步具备调整机构41和激光位移仪42这点上与图1中示出的聚集装置100不同。另外,在基板10没有形成薄膜12(参照图2)。
在图18中示出的构成中,物镜22的位置固定。调整机构41对搭载有基板10的XYZ轴工作台40的x方向、y方向和z方向的位置进行调整。作为调整机构41,例如可使用显微镜所自带的伺服马达和聚焦手柄等驱动机构。应予说明,调整机构41的具体的构成没有特别限定。另外,调整机构41可以相对于固定基板10来调整物镜22的位置。
激光位移仪42测定激光位移仪42与基板10之间的铅直方向的距离,并且还测定基板10的水平方向的位移。通过使用激光位移仪42的测定结果,可调整激光201的激光斑点的位置。例如,调整机构41可以基于激光位移仪42的测定结果,调整XYZ轴工作台40的位置。但是,激光位移仪42不是必要的构成。
在本变形例中,对激光201显示2种中光子吸收的荧光微珠而形成的聚集体的结构进行比较。本变形例中使用的微珠与实施方式1中使用的微珠1、2相同。准备微珠1与微珠2的个数比不同的3种样品(第4~第6样品)。液体的体积为10μL。
微珠1在内部含有亮蓝的荧光色素(Fluoresbrite公司制BB)。微珠1的最大激发波长为365nm。
微珠2在内部含有橙黄的荧光色素(Fluoresbrite公司制NYO)。微珠2的最大激发波长为530nm。如上所述,光发热用光源20的波长为1064nm,因此,是微珠2的最大激发波长的约2倍。因此,在微珠2中,可通过激光201而产生双光子吸收过程。应予说明,本变形例中对双光子吸收过程的例子进行说明,也可以使用产生3种光子以上的多光子吸收过程的材料。
第4样品中的微珠1与微珠2的个数比为N1:N2=0.64×107:3.3×108=1:51。第5样品中的微珠1与微珠2的个数比为N1:N2=1.2×107:2.9×108=1:25。第6的样品中的微珠1与微珠2的个数比为N1:N2=2.3×107:2.0×108=1:9。
以激光201的激光斑点位于样品13的液体中且位于液体的周围的气体与液体的界面即气液界面的附近的方式调整物镜22和气液界面之间的距离。而且,更优选激光201的激光斑点位于液体中且位于气液界面的附近。由于在液滴的外圆周部分,液滴的厚度小,因此,分散介质的蒸发快,分散的微珠1和微珠2都变成高浓度。双光子吸收过程的产生概率与光强度的平方成正比,所以,光强度高的光被导入存在多个微珠2的高浓度的气液界面,由此,双光子吸收过程的产生概率增高。
本变形例中,使用倍率为100倍的物镜22,以使激光201的激光斑点的位置为距离水平方向(x方向和y方向)气液界面28μm的方式进行调整。另外,关于高度方向(z方向),通过在基板10上距离对焦的位置将XYZ轴工作台40下移2μm而在距离基板上面10μm以下的高度调节为光束腰的位置,从而确定在液滴中的激光斑点的位置。将激光201的输出设定为比实施方式1中的输出高2W。在没有样品13的情况下,通过物镜22和基板10后的激光201的输出约为0.4W。应予说明,调整激光斑点的位置并不是必须的,激光201通过样品13即可。
图19是第4~第6的样品的气液界面中的聚集体的光学照片。图19(A)~(C)分别表示第4~第6样品的聚集体。图像上侧的部分(以A表示)为气体。图像下侧的部分(以L表示)为液体。液体与气体之间的颜色浓的部分(以I表示)为气液界面。
参照图19(A)~(C),图19(A)所示的聚集体最大,图19(C)所示的聚集体最小。即,微珠2的个数越多,或者相对于微珠1的微珠2的个数比越高,聚集体越大。微珠2通过双光子吸收过程吸收激光201,所以,微珠2的个数越多(或者微珠2的个数比越高),微珠2吸收的光的吸收量越大。其结果,微珠2所发出的发热量变大。认为发热量越大,越容易产生对流,因此,可形成大的聚集体。
另外,在样品13的液体中,从总体(远离气液界面的液体的中心附近的区域)越接近于气液界面,微珠1、2的浓度也随之变越高。因此,通过调整在气液界面的物镜22的焦点的位置,从而可形成更大的聚集体。
图20是放大表示第4样品的聚集体的SEM照片。参照图20,示出了在气液界面中液体蒸发的位置微珠1埋设于微珠2中的形态。
[实施方式2]
使用实施方式1中示出的聚集装置可实现微小物体聚集结构体的制造装置。实施方式2中,对制造由树脂微珠构成的2元光子晶体结构的例子进行说明。微小物体聚集结构体的制造装置的构成与图1和图2中示出的聚集装置100的构成等同。另外,微小物体聚集结构体的制造方法与图4中示出的流程图的处理等同。因此,不重复进行微小物体聚集结构体的制造装置的构成和微小物体聚集结构体的制造方法的说明。
回到图10(A),如右上的放大图所示,关于第3样品,使用100倍透镜形成聚集体时,在主要是微珠1高密度聚集而成的结构的周围,形成周期性地配置有微珠1而成的结构。该结构是通过用微珠2填充微珠1和与该微珠1最近的另一微珠1的缝隙,使微珠1周期性地排列而成的结构。微珠1的结构的周期为数百nm,相当于可见光的波长。由此,使用聚集装置100可实现2元光子晶体结构的制造装置。应予说明,如图13(A)的右上的放大图所示,使用10倍透镜来形成聚集体的情况下,也能够确认形成同样的2元光子晶体结构。
这样,根据实施方式2,可在照射有激光的位置制造2元光子晶体结构。光子晶体结构是光的波长等级的尺寸的电介质周期性地排列而成的结构体,通过改变成为构成要素的电介质的尺寸、形状、折射率和周期,而具有将特定波长的光强反射或封闭的性质。2元光子晶体结构意味着由尺寸不同的两种电介质构成的光子晶体结构。在本实施方式中,如图13所示,可制作凹透镜型的2元光子晶体结构。作为这样的凹透镜型2元光子晶体结构的应用例,有具有波长选择性的凹透镜。波长选择性凹透镜可用作例如光通信元件。
进而,通过调整薄膜的材料和厚度、液体的种类、物镜的倍率、激光的强度等,可改变微泡的尺寸,因此,可控制光子晶体结构的尺寸。另外,通过变更微珠的种类(例如粒径、形状等),从而可控制光子晶体结构的周期。由此,可以根据各种波长而制造光子晶体结构。
[实施方式2的变形例1]
在实施方式2中,对可形成由树脂微珠构成的2元光子晶体结构的例子进行了说明。在实施方式2中说明的例子中,光照射停止后,对样品进行干燥(自然干燥)直到液体通过自然蒸发而消失。与此相对,变形例1中,对使样品真空干燥的例子进行说明。变形例1、2的微小物体聚集结构体的制造装置的构成与图1和图2中示出的聚集装置100的构成等同。另外,微小物体聚集结构体的制造方法与图4中示出的流程图的处理等同。因此,不对微小物体聚集结构体的制造装置的构成和微小物体聚集结构体的制造方法进行重复说明。
再次参照图1~图3,在本变形例中,使用含有微珠1、2二者的样品(第3样品)。微珠1与微珠2的个数比为N1:N2=1:85(参照图7(A))。
通过物镜22(10倍透镜)和基板10后的激光201的输出在没有样品13的情况下为0.1W。在光照射停止后将样品13设置于未图示的干燥器内。干燥器内的压力设定为0.02MPa(=152Torr)。进行约40分钟真空干燥后,将样品13从干燥器中取出。
图21是使第3样品真空干燥时形成的聚集体的SEM照片。图22是表示图21中示出的聚集体的三维形状和截面形状的图。图22(A)是表示聚集体的三维形状的测定结果。图22(B)是表示沿图21的XXIIB-XXIIB线的聚集体的截面形状的测定结果。
参照图21和图22,使样品13真空干燥的情况中也与样品13自然干燥(参照图13)同样地形成环状的聚集体。在该聚集体中,因微珠2填充于微珠1和与该微珠1最近的另一微珠1的缝隙,微珠1周期性地排列。微珠1的结构的周期相当于可见光的波长(数百nm)。由此,确认形成2元光子晶体结构。进而,根据截面形状的测定结果可知,该聚集体具有单层结构。
图23是表示对第3样品不进行光照射而自然干燥时的消光光谱和在光照射后真空干燥时的消光光谱的图。图23和后述的图29中,横轴表示波长,纵轴表示消光度。曲线P3表示自然干燥后的消光光谱。曲线Q3表示真空干燥后的消光光谱。
参照图23,自然干燥后的消光光谱和真空干燥后的消光光谱在蓝色~绿色的波长区域均具有峰。因此,自然干燥后的样品13和真空干燥后的样品13各自显示结构色。其原因在于仅反射取决于光子晶体结构的特定波长的光。由此,可确认图21和图22中示出的聚集体具有光子晶体结构。
使第3样品自然干燥时,聚集体的直径约为70μm,聚集体的高度约10μm(参照图13(B))。与此相对,使第3样品真空干燥时,聚集体的直径约100μm,聚集体的高度约2μm。即,与使样品13自然干燥时相比,使样品13真空干燥时,聚集体的直径变大且聚集体的高度变低。其结果,导致聚集体具有单层结构。对该机理进行说明。
图24是用于比较在光照射后进行自然干燥时的机理和在光照射后进行真空干燥时的机理的示意图。如图24(A)所示,使样品13自然干燥时,在光照射停止后微泡MB的直径没有发生大的变化。
另一方面,如图24(B)所示,对样品13进行真空干燥时,微泡MB的直径与真空干燥开始前的直径相比,变大。其原因在于,通过真空干燥,样品13的周围的压力低于大气压(即真空干燥开始前的压力)。
其例如可通过如下所述进行确认。向样品13照射1分钟激光201。将该样品13设置于干燥器内。在干燥器内真空干燥的时间(干燥时间)较短时,样品13内的液体不足以全部蒸发,在液体内可观察到微泡MB。因此,通过使用光学显微镜而取得样品13的图像,从而可测定与干燥时间的长度对应的微泡MB的直径。
图25是表示微泡MB的直径的测定结果的图。图25中,横轴表示样品13的干燥时间。纵轴表示以光照射停止时的微泡MB的直径为基准的直径的增加量。
参照图24和图25,第3样品的情况下,如实施方式1中所说明,激光201的照射中的微泡MB的直径的最大值为61.0μm。与此相对,真空干燥中的微泡MB的直径约150μm~200μm。由此,可确认通过真空干燥使微泡MB的直径变大。
如上所述,在激光201的照射中,微珠1、2在微泡MB与基板10之间的区域聚集而形成环状的聚集体。通过真空干燥使微泡MB的直径变大,伴随与此,该聚集体朝向环状的径向方向崩塌。由此,聚集体的高度变低。其结果,导致聚集体具有单层结构。
另外,在图25所示的例子中,可知从干燥开始时刻约6分钟,微泡MB的直径随着时间经过而变大。因此,通过变更干燥时间可控制光子晶体结构的尺寸(直径)和高度。
[实施方式2的变形例2]
在实施方式2和其变形例1中,说明在激光的照射位置和其周边形成聚集体。但是,在基板上滴加样品的液滴时,在液滴的边缘的区域也有可能形成聚集体。在变形例2中,对使用第1~第3样品(参照图7(A))的情况下在液滴的边缘形成聚集体的构成进行说明。
图26~图28分别为在第1~第3样品的液滴的边缘的区域形成的聚集体的SEM照片。以下,示出了将各样品自然干燥的例子,但也可以真空干燥。
参照图26和图27,在第1样品中,在液体的边缘也可观察到由微珠1构成的聚集体。第2样品也与第1样品同样地可观察到由微珠2构成的聚集体。由微珠1构成的聚集体和由微珠2构成的聚集体均具有六方最密堆积结构。
参照图28,第3样品中,通过用微珠2填充微珠1和与该微珠1最近的另一微珠1的缝隙,从而可形成微珠1周期性地配置而成的结构。微珠1的结构的周期与可见光的波长同程度。因此,可知使用第3样品的情况下,形成于液体的边缘的聚集体也具有2元光子晶体结构。
图29是表示第1~第3样品的消光光谱的图。曲线P1~P3分别表示第1~第3样品的消光光谱。参照图29,可确认自然干燥后的液滴的边缘的区域所形成的聚集体具有光子晶体结构。
由此,对包含微珠1、2二者的样品(第3样品等)照射激光201时,在激光斑点附近区域可形成光子晶体结构(参照图13(A)等)。除此以外,通过使样品自然干燥(或者,在此未示出的真空干燥),从而在样品的液滴的边缘的区域也形成光子晶体结构。
[实施方式3]
微小物体也可以来自生物体。实施方式3中,作为来自生物体的微小物体的一个例示的形态,将细菌聚集。具体而言,可聚集作为杆形的细菌的绿脓杆菌(Pseudomonas aeruginosa)。应予说明,由于实施方式3的聚集装置的构成与图1和图2所示的聚集装置100的构成相同,因此,不进行重复说明。
实施方式3中,代替实施方式1中的微珠1,可使用细菌3(绿脓杆菌)。本实施方式中使用的绿脓杆菌的宽度为0.599±0.09μm。绿脓杆菌的长度为1.72±0.36μm。估计绿脓杆菌与微珠1(直径:1.0μm)的体积比为(0.599×0.599×1.72):(1.0×1.0×1.0)=0.617:1。即,绿脓杆菌具有与微珠1同程度的尺寸。
作为第7样品,准备分散有细菌3和微珠2(直径:0.2μm)的样品13。细菌3的个数N3为1.2×106个。微珠2的个数N2为1.0×108个。即,细菌3与微珠2的个数比为N3:N2=1:82。液体的体积为10μL。
图30表示第7样品中的光照射开始后在激光斑点附近区域的随时间变化的连续照片。图30是与包含微珠1、2的第3样品(参照图5)进行对比。与第3样品同样地,示出了在激光斑点附近聚集细菌3的形态。应予说明,物镜22的倍率为100倍。
在此,示出了在从光照射开始起41秒后停止激光201的照射时,从41秒到45秒,细菌3(用圆圈表示)从微泡MB中分离的形态。
图31是用于比较在第3样品和第7样品之间的光照射停止后的变化的连续照片。参照图31,各照片中示出的时刻(0s、2s等)表示激光201的照射停止后的经过时间(单位:秒)。
图31(A)表示包含微珠1、2的第3样品的样子。在对薄膜12的光照射结束后,微珠1的位置也几乎没有变化。用圆圈表示关注的特定的微珠1,该微珠1因布朗运动而仅不规则运动。图31(A)所示的6秒钟的微珠1的移动距离为数μm左右。
与此相对,图31(B)表示包含绿脓杆菌和微珠2的第7样品的形态。示出了对薄膜12停止光照射后,细菌3的集团沿着远离微泡MB的方向扩散的形态。示出了用圆圈表示关注的特定的细菌3时其细菌3沿远离微泡MB的方向迅速移动的形态。图31(B)所示的6秒钟的细菌3的移动距离为数十μm左右。这样的细菌3的迅速的集团扩散是表示聚集的细菌3中的至少一部分为生存状态的证据。
图32是表示对第7样品使用100倍透镜形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。图33是表示对第7样品使用10倍透镜而形成的聚集体的SEM照片和聚集体的截面形状的测定结果的图。图32和图33分别与图10和图13进行对比。
参照图32和图33,将细菌3和微珠2聚集的情况也与将微珠1和微珠2聚集时同样地可确认形成环状的聚集体。另外,如图32和图33的放大图中虚线所示,可知细菌3以杆形的长轴方向与基板10的主面(与x方向和y方向平行的面)平行的状态聚集。
绿脓杆菌是可能成医院内感染等的原因的对人有害的细菌。然而,对人有用的细菌也可利用相同的方法聚集。
例如,可聚集将二氧化碳转换成甲醇等有用物质的超低营养性细菌(红球菌,Rhodococcus erythropolis)。如上所述,超低营养性细菌能够在存活的状态且杆形的长轴方向与基板10的主面平行的状态被聚集。由此,与超低营养性细菌的杆形的长轴方向与基板10的主面垂直的状态下聚集的情况相比,细菌的集团的表面积(与基板10的主面平行的面的面积)变大。因此,二氧化碳在基板10上流通时,可高效率地将二氧化碳固定化。
[实施方式4]
能够使用实施方式3中说明的聚集装置除去对人有害的微生物。
图34是表示本发明的实施方式4的微生物的聚集除去装置的简要构成的图。参照图34,微生物的聚集除去装置200具备捕集部210和除去部220。
捕集部210对在空气中悬浮的微生物进行捕集。除去部220将通过捕集部210捕集的微生物利用光照射聚集并除去。由于除去部220的构成与图1所示的聚集装置100的构成相同,所以,不重复详细说明。
图35是表示图34中示出的捕集部210的构成的一个例子的图。参照图34和图35,利用未图示的马达使风扇211旋转时,从捕集部210的吸引口212吸引一定量的空气。吸引该空气的同时,在空气中悬浮的微生物4也被吸引,从而被吹到设置于捕集部210内的基板102。在基板102上保持有样品13的液体。由此,在空气中悬浮的微生物4被捕集到样品13的液体中。应予说明,微生物4的捕集方法不限定于上述方法,可采用公知的各种方法。
在样品13的液体中捕集微生物4时,基板102设置于除去部220的XYZ轴工作台40上的规定的位置。除去部220将激光201照射到基板102。激光斑点附近的液体形成高温。更具体而言,白蛋白在液体(在本实施方式中水)内分散时,可确认白蛋白通过光照射而凝固。白蛋白的凝固温度为75~78℃,因此,可知激光斑点附近的一部分液体的温度约为80℃以上。由此,通过光照射,可得到微生物4在气泡表面的附近聚集的同时,基于激光斑点附近的高温处理除去微生物的效果。
[实施方式5]
作为环境污染粒子的PM2.5被人体吸入而侵入肺的深处,可能对呼吸系统和循环器官系统带来影响。为了掌握PM2.5的扩散状况,寻求一种简易且迅速地测定大气中的PM2.5的质量浓度(单位:μg/m3)的技术。实施方式5中,对使用实施方式1的聚集装置来检测PM2.5的检测装置进行说明。
在空气中不仅含有PM2.5,还含有粒径不同的PM(例如PM10)。因此,一般的PM2.5的检测装置具备用于从粒径不同的PM中分离PM2.5的分粒器。例如在具备旋风方式的分粒器的检测装置中,需要将空气的吸引口设置于距离装置的设置面数米左右的高度。因此,有时很难确保设置场所。
与此相对,在本实施方式所示的检测装置中,可以利用光照射将PM10和PM2.5以彼此分离的状态聚集。由此,即使不设置分粒器也能够计算PM2.5的质量浓度。因此,可将检测装置小型化。
图36是表示本发明的实施方式5的检测装置的简要构成的图。参照图36,检测装置300具备空气采样器310和检测部320。
空气采样器310包括:吸引口311、过滤器312、流量计313、泵314。泵314工作时,从吸引口311吸引空气。流量计313测定被吸引的空气量。在从吸引口311至泵314的流路中设置过滤器312。过滤器312捕集所吸引的空气中含有的PM。被过滤器312捕集的PM分散于检测部320的基板103上的液体中。应予说明,检测部320的构成与图1中示出的聚集装置100的构成相同,所以,不重复其详细说明。
图37是图36中示出的检测装置300的基板103附近的构成的放大立体图。参照图37,基板103中,在其表面上形成微流路14。作为基板103,例如,可使用住友电木株式会社制的S-BIO SUMILON BS-21102。在微流路14的至少一部分形成薄膜12。被物镜22会聚的激光201照射到形成于微流路14的薄膜12。
图38是用于说明本发明的实施方式5的PM2.5的检测方法的流程图。参照图36~图38,在步骤S31中,空气采样器310吸引例如数升(1L~10L)左右的空气。由此,被吸引的空气中含有的PM被过滤器312捕集。被过滤器312捕集的PM从过滤器312中分离而分散于液体中(步骤S32)。作为从过滤器312中分离PM的方法,可以使用公知的各种提取方法,也可以振动过滤器312使PM振落。
步骤S33中,分散有PM的分散液在微流路14中流通。对形成于微流路14的薄膜12照射激光201时,因光发热效果而产生微泡MB。由此,形成PM的聚集体(步骤S34)。
应予说明,微流路14的宽度大于激光斑点的尺寸(直径)时,分散在液体中的PM可能不通过激光斑点而在微流路14中流通。因此,微流路14的宽度与激光斑点的直径的大小关系优选以微流路14的宽度小于激光斑点的尺寸的方式进行确定。由此,不通过激光斑点而在微流路14中流通的PM变少,可高效率聚集PM。
接下来,控制部50以拍摄PM的聚集体的方式对拍摄设备31进行控制(步骤S35)。利用拍摄设备31拍摄的图像输出到运算部60。运算部60例如由微型计算机等构成。运算部60根据由拍摄设备31拍摄的图像的处理结果,对大气中的PM的质量浓度进行运算(步骤S36)。应予说明,在利用拍摄设备31进行拍摄时,可以继续照射激光201,也可以在激光201的照射停止后进行拍摄。
对运算部60中的PM的质量浓度的运算例进行说明。例如在图10所示的图像中,在激光斑点附近的中央部分主要聚集尺寸小的微珠2(直径:0.2μm),在其周围主要聚集尺寸大的微珠1(直径:1.0μm)。利用光照射聚集PM时,与聚集微珠的情况同样地在激光斑点的中央部分形成PM2.5的区域并以包围其中央部分的方式形成PM10的区域。由此,通过对PM2.5和PM10进行了分离的聚集体的图像执行图像处理,从而可确定PM2.5的区域。例如,基于PM2.5的区域和PM10的区域的亮度差异,可以提取这些区域间的边界。
PM2.5的聚集量越大,照明用的白色光301的透过光减少而图像的色彩越浓。在运算部60的存储器(未图示)中预先保持有图像的亮度与PM2.5个数之间的对应关系。因此,对于将PM2.5的区域分割而成的各微小区域,基于其区域中的图像的亮度,可算出其区域所含的PM2.5的个数。通过将各微小区域的PM2.5的个数进行积分,从而可算出区域全体的PM2.5的总数。由于PM2.5的平均质量已知,所以,将PM2.5的总数乘以平均质量,从而可求得PM2.5的总质量(单位:μg)。而且,通过将PM2.5的总质量除以吸引的空气量(单位:m3),从而可算出PM2.5的质量浓度(单位:μg/m3)。
这样,根据本实施方式,利用光照射将分散于液体中的PM进行聚集。在该聚集体中,PM2.5和PM10发生了分离。因此,不必使用旋风方式的分粒器对PM2.5进行分离,所以可实现检测装置的大幅小型化。另外,由于不需要利用分粒器分离PM2.5的时间,可缩短检测时间。
[实施方式6]
实施方式6中,在分离被分离物质的分离装置中使用聚集装置。这里作为分离装置的一个例示的形态,对流式细胞仪进行说明。本实施方式中的微小物体为细胞。
图39是表示本发明的实施方式6的流式细胞仪的简要构成的图。参照图39,流式细胞仪400具备:流动池410、鞘液导入部411、样品导入部412、物镜422、光源430、分光器431、细胞分选仪440、控制部450。
光源430发出例如红色(例如波长635nm)的激光201。光源430兼作光发热用的光源和分光用的光源。即,光源430相当于本发明的“光源”和“分光用光源”二者。但是,流式细胞仪可以分别具备光发热用的光源和分光用的光源。
鞘液导入部411将鞘液导入流动池410。鞘液的流动以形成保持规定的流速的层流的方式进行控制。样品导入部412将分散有细胞1A、1B、1C的样品液导入流动池410。在此,将细胞1C作为被分离物质。
在流动池410的流路配置物镜422。物镜422将来自光源430的激光201会聚。在流动池410的流路的侧面的一部分形成薄膜12。被物镜422会聚的光照射到薄膜12和样品液。照射的光将样品液内的细胞聚集,并且如虚线所示,作为透过光或散射光入射到分光器431。
在流动池410的出口端设置用于分离被分离物质的细胞分选仪440。细胞分选仪440使从流动池410的出口端滴下的液滴带电。控制部450对鞘液导入部411、样品导入部412、光源430、分光器431和细胞分选仪440进行控制。
图40是用于说明本发明的实施方式6的作为被分离物质的细胞的分离方法的流程图。参照图39和图40,首先,准备细胞1A、1B、1C(步骤S41)。进而,将细胞1A、1B、1C分散于样品液中(步骤S42)。样品液内的细胞1A、1B、1C在形成有层流的流动池410的中依次流通(步骤S43)。
被物镜422会聚的激光201导入在薄膜12和流动池410的流路中流动的样品液时,样品液内的细胞(细胞1A、1B、1C中任1种的细胞)聚集而形成细胞的聚集体(步骤S44)。
分光器431将来自聚集体的透射光或散射光分光而将其分光结果输出到控制部450内的解析部460(步骤S45)。在解析部460的存储器(未图示)预先保持有细胞1A、1B、1C各自的分光数据(光谱)。关于各聚集体,解析部460通过与将来自分光器431的分光结果保持于存储器的分光数据进行比较,对其聚集体是否由被分离物质(细胞1C)构成进行解析。
得到聚集体由被分离物质构成的的解析结果时,控制部450以将包含其聚集体的液滴落下时将电场外加于液滴的方式对细胞分选仪440进行控制。由此,改变液滴的落下方向,其液滴在容器442中落下。因此,由细胞1C构成的聚集体分配到容器442。
另一方面,得到聚集体并不是由被分离物质构成的解析结果的情况下,控制部450以不对包含其聚集体的液滴外加电场的方式对细胞分选仪440进行控制。由此,其液滴在容器443中自由落下,因此,由细胞1A或细胞1B构成的聚集体被收集于容器443中(步骤S46)。
这样,将实施方式1的聚集装置用于流式细胞仪时,可以利用光照射将在流动池流通的细胞聚集。细胞聚集且分光对象增加,从而可提高分光结果的解析精度。因此,可提高被分离物质的分离精度。
[实施方式7]
在实施方式1~6中,对使用形成于玻璃罩11上的薄膜12(金薄膜)的光发热效果对液体进行加热的情况进行说明(参照图2)。但是,液体的加热方法并不限定于此。实施方式7中,通过基于分散于液体中的金属纳米粒子的光发热效果来对液体进行加热。
在本实施方式中,作为金属纳米粒子,可采用金纳米粒子。金纳米粒子的平均粒径为亚纳米级~纳米级(约2nm~1000nm),例如为2nm~500nm,优选为2nm~100nm,更优选为5nm~50nm。本实施方式中,金纳米粒子的粒径为30nm。
应予说明,用于利用光发热效果加热液体的粒子(光热转换粒子)并不限定于金纳米粒子。作为其他的金属纳米粒子的例子,可举出银纳米粒子和铜纳米粒子。另外,光热转换粒子并不限定于金属纳米粒子,例如可以为碳黑。
实施方式1中,对随着对流移动的微珠1、2滞留在因微泡MB生成的滞流区附近进行说明。实施方式7中,如以下详细说明所述,多个微珠1因激光201的光诱导力而被捕捉。因捕捉的微珠1而产生滞流区。
<微珠和金纳米粒子的光阱>
对使用激光201的光诱导力的光阱进行说明。在本发明和其实施方式中,“光诱导力”可作为耗散力、梯度力和物质间光诱导力的通称使用。耗散力是在光散射或光吸收这种耗散的过程中,给予物质的光的运动量而产生的力。梯度力是将发生光激发极化的物质置于非均匀的电场中的情况下,使物质移动到电磁学的电势的稳定点的力。物质间光诱导力是基于由光激发的多个物质中的激发极化产生的纵电场的力和基于横电场(辐射场)的力的加和。
图41是用于说明捕捉多个微珠1的机理的示意图。图42是用于说明微珠1的双粒子模型的图。参照图41和图42,多个微珠1被分散于液体中。
多个微珠1各自接受激光201。激光201的偏振方向为y方向。即,激光201的偏振方向与连结微珠1的中心的轴Ax大致为平行的方向。该情况下,微珠1各自沿着与激光201的偏振方向平行的方向发生电极化。由此,各微珠1在属于电磁学的电势的稳定点即激光201的激光斑点的附近被捕捉。另外,全部微珠1中的电极化的朝向相同。因此,如图42所示,相近的微珠1之间产生引力。
由于微珠1为球状,所以,响应光电场(response electric field)能以Maxwell方程式的积分形表现。响应电场Ei根据以下的式(1)表示。
i、j为球形细胞(spherical cells)的粒子编号。Vj=V为球形细胞的体积。M、L为涉及自相互作用的量。各个微珠的内部的极化率和电场分布设为平坦。激发极化Pi根据以下的式(2)进行表示。
Pi=χi(ω)Ei…(2)
极化率χ使用Drude模型。极化率χ根据以下的式(3)进行表示。
χb表示背景的极化率,ωp表示等离子体能量,γ表示非辐射缓和定数,vf表示费米面上的电子速度。a表示球形细胞的半径。非辐射缓和常量γ表示从光激发出的电子向光以外的状态(例如介由声子转换成热的状态)缓和的值。
另一方面,光诱导力通常由以下的式(4)表示(T.Iida and H.Ishihara,Phys.Rev.B77,245319(2008))。
根据上述式(2)和式(3),将各自表示的激发极化Pi和响应电场Ei代入式(4)。由此,光诱导力根据以下的式(5)进行表示。
E(0)表示入射光的电场,G表示Green函数。式(5)的右边的第1项表示基于入射光得到的耗散力和梯度力的和,第2项表示物质间光诱导力。由于基于入射光的梯度力与光强度梯度成正比,因此,通过将入射光强会聚而形成梯度力超越耗散力的状况,成为光阱。另一方面,物质间光诱导力与光强度成正比。因此,通过控制入射光的光强度角度和光强度,从而能够调整梯度力和物质间光诱导力。
图43是表示本发明的实施方式7的聚集装置的简要构成的图。参照图43,聚集装置500在代替基板10而具备基板105这点上,与图1所示的聚集装置100不同。从光发热用光源20发出的激光201的输出为0.1W。通过物镜22后的激光201的输出为0.019W。使用100倍透镜作为物镜22。其以外的构成与聚集装置100的对应的构成相同,因此,不重复其详细的说明。另外,聚集方法与图4中示出的流程图的处理相同。
图44是图43中示出的聚集装置500的基板105附近的构成的放大立体图。参照图44,基板105不在玻璃罩11上形成薄膜12(金薄膜),在这点上与图2所示的基板10不同。
基板105保持样品135。样品135是分散有微珠1和金纳米粒子5的液体。液体(分散介质)的种类没有特别限定,但在本实施方式中为水(超纯水)。在本实施方式中,准备4种样品(第8~第11的样品)作为样品135。液体的体积均为10μL。激光照射于液滴的边缘附近的区域。
图45是用于说明图46~图49中使用的样品135的图。参照图45,在第8~第11样品中,微珠1的浓度是通用的,为1.14×109(个/mL)。另一方面,金纳米粒子5的浓度(以下,简记为“金纳米粒子浓度”)按第8~第11样品的顺序降低。
<微珠的聚集的样子和聚集机理>
图46是表示第8样品中的基于光照射的激光斑点附近区域的随时间变化的连续照片。参照图43和图46,将激光201的照射开始时刻设为0秒,示出了使用拍摄设备31进行拍摄的气液界面的形态。为了防止变得繁琐而仅示出光照射开始前的照片,各照片的上侧的颜色浓的部分(以L表示)为液体。各照片的下侧的颜色淡的部分(以A表示)为气体。液体与气体之间的白色部分(以I表示)为气液界面。
激光斑点在液体的气液界面附近(例如距离气液界面数μm以内),调整为仅距离基板105表面10μm的铅直方向(z方向)上方(参照图43)。在从光照射开始起经过110秒的时刻停止光照射。
在图46所示的例子中,可清楚地观察到从光照射开始时刻经过6秒后,以激光斑点为中心形成聚集体6。进一步继续光照射时,可观察到聚集体6随时间成长的形态。但是,光照射开始后经过40秒左右时,聚集体6的生长速度变缓慢。应予说明,在各照片的下侧,与气液界面相比还在气体侧被观察的颜色浓的圆形部分为气泡。
图47是在光照射停止后自然干燥的第10样品所形成的聚集体6的光学照片。图48是图47所示的区域R1(激光斑点的附近区域)的SEM照片。参照图47和图48,可知微珠1在激光斑点附近聚集而形成六方最密堆积结构。进而,可观察到金纳米粒子5在微珠1的缝隙堆积。
图49是用于说明实施方式7中形成聚集体6的机理的示意图。图49(A)表示激光201的激光斑点附近的状态,图49(B)表示液体整体的状态。
参照图49(A),通过激光201的照射在激光斑点的位置捕捉到微珠1。被捕捉的微珠1成为所谓的“核”,聚集体6成长。
作为聚集体6成长的重要因素,认为是微珠1为疏水性的粒子。对于疏水性的粒子而言,与粒子彼此在水中分散的状态相比,粒子彼此在水中接触的状态的与水接触的表面积小,因而稳定。因此,与聚集体6暂时接触的微珠1很难从聚集体6中分离,所以,聚集体6容易成长。
粒径越小,越难以捕捉光诱导力所使用的粒子。相对于微珠1的粒径为1.0μm,金纳米粒子5的粒径为30nm。因此,金纳米粒子5与微珠1相比,很难捕捉。但是,根据本实施方式,金纳米粒子5进入由捕捉的微珠1构成的聚集体6的缝隙。由此,可稳定地捕捉金纳米粒子5。
如此捕捉的金纳米粒子5因光发热效果而生成热,由此对激光斑点和其周边的液体进行加热。对由聚集体6引起的光发热效果进行更详细地说明。多个金纳米粒子5的各自表面的自由电子由于激光201而振动,由此产生极化。多个金纳米粒子5彼此接近直至激光201的波长(1064nm)以下的尺度,所以,局部表面等离子体共振的吸收光谱的峰波长偏移。因此,即使相对于单一的金纳米粒子5的局部表面等离子体为非共振的波长区域的激光201,也能够高效率地吸收。其结果,产生激光201的强吸收,因此,能够在聚集体6中高效率地生成热。聚集体6通过高效率地将激光201转换成热,从而对周围的液体进行局部加热。由此,在液体内产生温度差(或温度梯度),因此,由于其温度差而在朝向聚集体6的方向引起对流。
参照图49(B),对流的方向如以箭头AR2、AR3所示,暂时是朝向聚集体6,其后,为远离聚集体6的方向。因此,在聚集体6附近生成对流的滞流区。微珠1和金纳米粒子5随着对流朝向滞流区移动,由此,可促进聚集体6的生长。由此,微珠1占据体积的大部分的聚集体6还作为将通过光照射进行控制的对流截流的微米级的流体限位器发挥功能。
在本实施方式中,在气液界面附近照射激光201。与激光斑点相比在堆积侧的区域和与激光斑点相比在气液界面侧的区域中,基于液滴的表面形状的空间具有非对称性,因此,液体的温度易于变得不均匀。由此,容易引起对流。
进而,气液界面附近被加热,所以,与总体被加热的情况相比,液体容易从气液界面蒸发(参照箭头AR4)。随着液体由液滴蒸发,液滴中的液体发生流动。微珠1和金纳米粒子5也因该流动效果而朝向聚集体6移动。
<金纳米粒子浓度对聚集体的结构的影响>
图50是表示第10样品中的因光照射带来的激光斑点附近随时间变化的连续照片。参照图50,在第10样品中,与第8样品(参照图46)同样地,可观察到在光照射开始后,聚集体6随着时间的成长的形态。可知各时刻的第10样品的聚集体6的尺寸(以下,简记为“聚集体尺寸”)比第8样品的聚集体尺寸小。
图51是用于在第8~第10的样品之间比较光照射开始后的聚集体尺寸随时间变化的图。图10中,横轴表示光照射开始后的经过时间(照射时间)。纵轴表示聚集体尺寸。曲线L8~L10分别表示第8~第10样品的聚集体尺寸随时间变化的形态。应予说明,聚集体尺寸可根据连续照片(参照图46和图50)中的聚集体6的外接圆(未图示)的直径进行计算。
参照图51,可确认聚集体6随着时间成长并变大。另外,可知金纳米粒子浓度越高,聚集体6能够以短时间变大。
如图46中所示,观察到在第8样品中在光照射开始之后发生对流。虽未图示,但第9样品也同样。认为其原因在于,在第8和第9样品中,激光斑点所形成的聚集体6内的金纳米粒子5的聚集量在光照射开始之后立即为一定程度大小,因此,产生引起对流所充分的发热。
与此相对,第10样品中,在光照射开始之后立即几乎观察不到对流,在光照射开始经过约40秒后可观察到对流变大的样子。认为其原因在于,第10样品的金纳米粒子浓度比第8和第9样品的金纳米粒子浓度低,因此,在光照射开始立即之后,来自聚集体6内的金纳米粒子5的发热量相对小。继续光照射,金纳米粒子5的聚集量随时间而增加。金纳米粒子5的聚集量达到某一值时,能够得到充足的发热量而发生对流。
另外,聚集体6成为一定程度的大小(在图51所示的例中约12μm)时,与聚集体6的形成初期相比,可知聚集体6的成长变迟缓。认为这是基于以下2个理由。
第1,由于继续光照射而使系统趋近于热平衡状态,因此,聚集体6的温度与聚集体6的周围的分散介质的温度相近。因此,液体内的温度差相对变小而难以引起对流。其结果,聚集体6的尺寸在一定程度时饱和。
第2,液体内的金纳米粒子5的量越多,单位时间的发热量越大,所以,聚集体6迅速成长。第8~第10中的任一样品中,在液体内包含充足量的金纳米粒子5,因此,聚集体6的成长难以放缓。然而,在第10样品中,与第8和第9样品相比,金纳米粒子5的量少,因此,聚集体6的形成需要时间,并且,聚集体6的尺寸较小的状态下就饱和。
应予说明,在本实施方式中,激光201照射到气液界面附近(液滴的边缘的区域)。金纳米粒子5在开始光照射前就易于聚集在气液界面附近。关于其原因,基于光照射前的第8和第11样品的消光光谱的测定结果进行以下说明。在第8和第11样品中,微珠1的浓度为通用的。另一方面,第11样品的金纳米粒子浓度为第8样品的金纳米粒子浓度的10分之1(参照图45)。
图52是表示对第8和第11样品在光照射开始前的气液界面附近的消光光谱的图。图52(A)表示第8样品的消光光谱,图52(B)表示第11的样品的消光光谱。横轴表示波长,纵轴表示消光度。
参照图52(A)和图52(B),在第8样品中在530nm附近测到峰,相反地,在第11样品中,没有测到这样的峰。由此,可知金纳米粒子浓度较高的情况下,即使在光照射开始前,金纳米粒子5也高密度存在于气液界面附近。由此,向气液界面附近照射激光201时,与向总体照射激光201时相比,金纳米粒子5进入由微珠1构成的聚集体6的缝隙中的量增加。由此,来自金纳米粒子5的发热量增多,所以,能够以更短时间在液体内产生温度差而发生对流。
如上所述,根据实施方式7,利用金纳米粒子5的光发热效果可聚集微珠1和金纳米粒子5。另外,在本实施方式中,不必通过蒸镀或溅射在玻璃罩11上形成薄膜12,因此,能够实现更简易的聚集方法。
应予说明,在本实施方式中,金纳米粒子5和微珠1中任一方与本发明的“第1粒子”对应,另一方与本发明的“第2粒子”对应。另外,金纳米粒子5与本发明的“光热转换粒子”对应。对于金纳米粒子5和微珠1而言,例如,机械特性(尺寸、形状,、密度等)、光学特性(共振吸收波长等)、热特性(比热、导热率、热膨胀率、耐热性等)、和对水的亲和度(亲水性或疏水性的程度)彼此不同。
应予说明,在本实施方式中,对使用含有作为光热转换粒子的金属纳米粒子和具有粒径大于光热转换粒子的粒径的树脂微珠的样品的例子进行了说明。但是,光热转换粒子的粒径和树脂微珠的粒径的大小关系也可以相反。作为一个例子,可以准备含有作为光热转换粒子的碳系粒子或有机粒子(例如直径数为100nm左右的粒子)和具有粒径小于光热转换粒子的粒径的树脂微珠(例如直径数为10nm的聚苯乙烯微珠)的样品。应予说明,光热转换粒子相对大的情况下,光热转换粒子优选为不强反射光的粒子。
对这样的样品照射激光时,尺寸相对大的光热转换粒子在激光斑点的位置被光阱,并且由于光热转换粒子的光发热效果而引起对流。树脂微珠因对流朝向被光阱的光热转换粒子移动,从而被捕捉到光热转换粒子的缝隙。由此,光热转换粒子作为引起光发热效果的热源发挥功能,并且还作为从纳米至微米级的流体限位器发挥功能。
另外,作为本发明的“第1和第2粒子”,可以采用例如粒径不同的两种金属纳米粒子的组合、或金属纳米粒子与碳系粒子(碳黑等)的组合。此时二者粒子与本发明的“光热转换粒子”对应。
此外,除光热转换粒子(光吸收性的微小物体)以外的粒子在样品内的含量和浓度相同的情况下,因光热转换粒子的含量,最终形成的聚集体的尺寸不同。因此,通过在预先确定光热转换粒子以外的粒子的含量和浓度的状态下进行一定时间的相同条件的光照射,从而可根据聚集体的尺寸推定光热转换粒子的含量(或者检测有无含有光热转换粒子)。
[实施方式7的变形例]
实施方式7中,对使用包含直径1.0μm的微珠1和金纳米粒子5的样品的例子进行说明。在实施方式7的变形例中,采用直径0.2μm的微珠2和金纳米粒子5的样品(第12样品)。
微珠2的浓度为1.42×1011(个/mL)。金纳米粒子浓度为3.19×1011(个/mL)。应予说明,变形例中使用的聚集装置与聚集装置500(参照图43)等同,因此不重复说明。从光发热用光源20发出的激光201的输出为0.8W。通过物镜22后的激光201的输出为0.16W。使用100倍透镜作为物镜22。
图53是表示第12样品的基于光照射的激光斑点附近随时间变化的连续照片。参照图53,可观察到因光照射而从激光斑点涌出物质地生成的样子。该物质是通过因光照射引起的发热而熔融有微珠2的物质。
图54是在光照射后自然干燥的第12样品中形成的聚集体6的光学照片。图55是第12样品的激光斑点的区域(图53所示的区域R2)的SEM照片。图56是远离第12样品的激光斑点的区域(图53所示的区域R3)的SEM照片。激光的照射时间为110秒钟。
参照图55,可观察到在激光斑点的区域R2中,多个微珠2中的一部分熔融而一体化。用作微珠2的聚苯乙烯微珠的熔点为240℃,因此,可知在光照射时,聚集体6的温度高于240℃。应予说明,金纳米粒子5的熔点为1000℃以上,因此,认为金纳米粒子5没有熔融。
参照图56,在远离激光斑点的区域R3中,由微珠2形成六方最密堆积结构。进而,如右侧的放大图所示,可知金纳米粒子5进入邻接的微珠2间的缝隙。
如上所述,根据本变形例,通过因金纳米粒子5的发热引起的对流而将微珠2聚集,并且,所聚集的微珠2高温熔融。根据这种聚集方法,通过准备例如微小模具(所谓的模具),在其模具的内部将微珠2聚集,从而能够将微珠2成型成模具的形状。即,可实现微小的成型加工。
[实施方式8]
已知细胞有在细胞表面对存在其周围的物质进行分子识别而选择性结合,或者将存在于细胞的周围的物质在细胞内捕获的作用(内吞作用)。在实施方式8中,代替树脂微珠,使用细胞和由于细胞的内吞作用而可导入细胞内的物质(被导入物质)。作为内吞作用的例子,可举出基于细胞的内吞作用等饮食作用、介由膜通道蛋白质(贯通细胞膜的通道蛋白质)的离子等的传送作用、或者细胞膜的直接传送作用。
图57是用于说明基于细胞7的内吞作用的肽8的导入的示意图。参照图57,细胞7表面的糖链(未图示)和存在于细胞7的周围的肽的类型相对应的情况下,该肽通过内吞作用在细胞内被捕获。一般而言,液体中的肽8的浓度(以下,也简记为“肽浓度”)为均匀的的情况下,为了引起内吞作用而需要10μM以上的肽浓度。随着肽浓度增加,肽8向细胞7的导入量也增加。利用光照射将细胞7和肽8聚集时,细胞7的周围的肽浓度局部增加。由此,可促进基于内吞作用的向细胞7内导入肽8。
应予说明,对于实施方式8的肽的导入装置的构成,代替基板10而具备基板106,在该点上与图1所示的聚集装置100不同。除了肽的导入装置以外的构成与聚集装置100的对应的构成等同,因此,不重复其详细说明。
图58是基板106附近的构成的放大立体图。图59是基板106的俯视图。
参照图58和图59,使用例如玻璃底盘(Glass bottom dish)作为基板106。在基板106的底面,代替通过溅射形成的金薄膜而通过金纳米粒子5的自组织化而形成膜(以下,也称为“自组织化膜”)122。应予说明,作为自组织化膜122的形成方法,可采用公知的方法。在本实施方式中,具体而言,按以下的顺序形成自组织化膜。准备浓度6.38×1011(个/mL)的金纳米粒子5的分散液。将该分散液15μL滴加于基板106的底面后,使分散液真空干燥。
使用10倍透镜作为物镜22。激光201照射于金纳米粒子5的自组织化膜122。自组织化膜122具有疏密性。在本实施方式中,自组织化膜122中在金纳米粒子5变为高密度的位置调整激光斑点的位置。从光发热用光源20发出的激光201的输出为0.1W。通过物镜22后的激光201的输出为0.068W。激光斑点的直径约为10μm。
基板106保持样品136。样品136含有细胞7和肽8。在本实施方式中,作为细胞7,可使用来源于人的宫颈癌的细胞即海拉((HeLa)细胞。
对准备样品136的方法进行说明。使用α-MEM(+)作为细胞7培养时的培养基。α-MEM(+)是在α-MEM(-)中添加胎牛血清(10%FBS:Fetal Bovine Serum)(Life Technologies公司制Gibco)而成的培养基。
通常在海拉细胞的培养中,将在培养基中悬浮的状态(悬浮状态)的海拉细胞移送至培养皿(未图示)后,以附着于培养皿的底面的状态(附着状态)进行培养。因此,为了将大量细胞7再次成为悬浮状态之后在基板106进行光照射,需要将细胞7从培养皿中剥离而进行回收。多数情况下,不限于细胞7全部从培养皿中剥离,而成为悬浮状态的细胞(以下,也称为“悬浮细胞”)和附着状态的细胞(以下,也称为“附着细胞”)混合的状态。在本实施方式中,首先,将培养皿内的细胞7用Dulbecco氏磷酸盐缓冲盐水(D-PBS)(NACALAI TESQUE公司制)进行清洗。
进而,将胰蛋白酶溶液(0.5g/L的胰蛋白酶和0.53mM的EDTA(乙二胺四乙酸)的混合溶液)添加到培养皿中。其后,在设定为37℃的恒温箱内将培养皿静置5分钟,从而从培养皿的底面将海拉细胞剥离。
接下来,将含有抗生素的溶液(青霉素-链霉素溶液)(Sigma-Aldrich公司制)用α-MEM(+)稀释50倍,使用由此形成的溶液,回收培养皿内的细胞7。应予说明,抗生素是为了防止感染而添加的。
由此,将含有从培养皿回收的细胞7的培养基滴加到基板106上。在样品136中含有约5万个的细胞7。该数值通过使用血球计数板测量细胞数而求得。通过将基板106在37℃的恒温箱内静置一晚而培养细胞7。
其后,在进行光照射之前,将培养基从α-MEM(+)换为α-MEM(-)。这是因为使用肽α-MEM(+)时,其中含有的胎牛血清阻碍向细胞7内导入肽8。进而,在培养基中添加肽8。
图60是表示在实施方式8中使用的肽8的图。参照图60,肽8为八精氨酸肽。已知精氨酸肽主要通过内吞作用(更详细而言,为胞饮作用(macropinocytosis))而导入细胞内。
在肽8的C末端结合半胱氨酸残基(以Cys表示)。进而,在半胱氨酸侧链结合荧光色素。作为荧光色素,使用Alexa488C5-maleimide(Life Technologies公司制Invitrogen)。该荧光色素的激发波长为488nm,最大荧光波长为519nm。其中,肽8与荧光色素结合是为了后述的荧光测定(参照图63和图64),不是必须的。
在本实施方式中,作为样品136,准备第13样品。第13样品的肽浓度为1μM,比通常易于引起内吞作用的肽浓度(10μM以上)更低。
图61是用于说明本发明的实施方式8的肽8的导入方法的流程图。参照图61,肽的导入方法是在使细胞7和肽8分散于样品136内的步骤S11之前,进一步具备形成金纳米粒子5的自组织化膜的步骤S10。另一方面,肽的导入方法可以不具备对样品136进行干燥的步骤S15。除此以外的处理与图4中示出的流程图的对应的处理等同。
图62是用于说明实施方式8中的肽8的聚集机理的示意图。在本实施方式中,代替金薄膜而使用自组织化膜、代替微珠1、2而分别使用细胞7和肽8,上述两点与实施方式1不同。本实施方式中的聚集机理与在实施方式1中说明的机理(参照图6)基本等同。
参照图62,激光201向金纳米粒子5的自组织化膜照射时,由于金纳米粒子5的光发热效果,自组织化膜的周围的液体(培养基)局部加热。由此,发生培养基气化,或者溶解于培养基中的气体(空气等)热膨胀,从而产生微泡MB。进而,由于利用加热在培养基内产生温度差,因此,发生对流(以箭头AR6表示)。由于细胞7中的悬浮细胞和肽8因对流而朝向微泡MB运动,因此,在激光斑点附近肽8成为相对高的浓度。其结果,可促进向激光斑点附近的细胞7内的内吞作用。
如上所述,肽8分别与荧光色素结合。因此,通过测定从荧光色素发出的荧光,可测定样品136内的肽的分布。在本实施方式中,使用共焦点激光显微镜取得各样品的透射图像和荧光图像。
图63是第13样品的光照射后的共焦点显微镜照片。图63(A)表示透射图像,图63(B)表示荧光图像。
如图63(A)的透射图像所示,各细胞7具有大致椭圆球形。对于生存状态的细胞,核与细胞质的边界并不清楚,与此相对,对于死亡状态的细胞,可清楚观察到核收缩,因此,可区分生存状态的细胞和死亡状态的细胞。由图62(A)可知,在光照射后绝大多数的细胞7为生存状态。
接着,参照图63(B),图中,显示明亮的区域是基于从荧光色素发出的荧光的区域。观察到来自细胞7的内部的荧光。因此,可知肽8通过内吞作用被导入细胞7内。更详细而言,在细胞7内的细胞质和核内可观察到荧光。因此,认为肽8在内吞作用的过程中,在与溶酶体融合前从内吞体中逃离而到达细胞质和核。
另外,细胞7的荧光越接近激光斑点,变得越亮。由此,可知越接近激光斑点,肽8越高密度聚集。应予说明,由于激光斑点的位置最为明亮,所以,肽8的聚集量在激光斑点的位置最多。
这样,根据本实施方式,即使为通常难以引起内吞作用的低的肽浓度(小于10μM),也能够积极引起内吞作用。虽未图示,但可确认肽浓度为50nM的情况下也能够高效地引起内吞作用。认为其原因在于,如图62中说明所示,通过因光照射产生的对流而在激光斑点附近区域聚集肽8,结果,细胞7的周围的肽浓度局部高于10μM。
应予说明,如上所述,细胞7中的一部分附着于基板106的底面,剩余部分在培养基中悬浮(参照图62)。细胞7与激光斑点之间的距离相等时,观察到悬浮细胞比附着细胞更亮。即,肽8向悬浮细胞的导入量比肽8向附着细胞的导入量大。其理由如以下所述。
悬浮细胞通过由光照射产生的对流与肽8一同在液体中移动。另一方面,附着细胞即使在产生对流的情况下也固定于基板106的底面。因此,悬浮细胞与肽8的相对速度小于附着细胞与肽8的相对速度。因此,对于悬浮细胞而言,在其周围存在肽8的时间相对变长,因此,肽8的导入量增加。
另外,本实施方式中为了引起肽8的聚集,需要设定一定程度增加激光201的输出。但是,过度增加激光201的输出时,因发热而细胞7死亡,所以,不会发生内吞作用。因此,为了通过光照射促进内吞作用,优选适当设定激光201的输出以能够聚集肽8的同时抑制过度发热。
从其它观点进行说明时,在本实施方式中,自组织化膜中,将激光斑点的位置调整到金纳米粒子5为高密度的位置。因此,与在金纳米粒子5为低密度的位置照射激光201的情况相比,发热量增大。由此,发热量可以根据激光斑点的位置而不同。因此,优选激光斑点的位置(换言之,激光斑点的位置的自组织化膜的厚度)基于激光输出和金纳米粒子5的光吸收性而确定。
应予说明,实施方式8中,细胞7(更特定为悬浮细胞)和肽8与本发明的“微小物体”对应。对于细胞7和肽8而言,机械特性(尺寸、形状、内部结构、密度等)互不相同。另外,肽8对应于本发明的“被导入物质”。
应予说明,在本实施方式中,对基于内吞作用促进向细胞内导入肽的构成进行说明,但因被导入物质的聚集而可促进的作用并不限定于向细胞内导入。在内吞作用的前阶段中,引起被导入物质基于分子识别而向细胞表面选择结合,也有仅引起选择性结合而不被导入物质在细胞内捕获的情况。根据本实施方式,通过在细胞膜表面聚集可引起与细胞膜表面进行分子识别的相互作用的物质,还可促进细胞表面的分子识别(或选择性结合)。
[实施方式8的变形例]
实施方式8中,对在培养基中混合悬浮细胞和附着细胞的例子进行说明。本变形例中,对培养基中的细胞7的绝大多数为悬浮细胞的例子进行说明。
在变形例中使用的第14样品中,代替金纳米粒子5的自组织化膜,通过溅射在基板(未图示的玻璃底盘)上形成金薄膜。金薄膜的形成方法与实施方式1中的方法等同,因此,不进行重复说明。金薄膜的厚度为10nm。从光发热用光源20输出的激光201的输出为0.1W。
回收在培养皿中培养的细胞7的方法与实施方式8的方法几乎等同。但是,本变形例中,将含有从培养皿中回收的细胞7的培养基滴加到基板106之后照射激光。由此,几乎全部的细胞7为悬浮细胞。第14的样品的肽浓度为1μM。
图64是第14样品中的利用光照射的激光斑点附近的光学照片和荧光图。图64(A)表示光学照片。图64(B)是表示使用共焦点显微镜而取得的荧光图。
参照图64(A),可确认在激光斑点的位置产生微泡MB。在微泡MB的周围存在大量的细胞7。
参照图64(B),微泡MB的位置中的肽浓度比微泡MB周围的肽浓度高。由此,可确认肽8因光照射而聚集。进而,从微泡MB附近的细胞7(悬浮细胞)的内部也可观察到荧光。因此,可制在细胞7内导入肽8。
应予说明,将激光201的输出过高设定时,细胞7因发热而受损。但是,从光照射经过1天~2天后,还能确认微泡MB的周围的细胞7为细胞7生存状态。因此,可知根据本变形例,不对细胞7给予损伤而在细胞7内导入肽8。
这次公开的实施方式在各方面为例示的例子,并不进行限定。本发明的范围并不是上述的说明,而是包括由权利要求示出并与权利要求等同的含义和范围内的所有的变更。
产业上的可利用性
本发明可作为将微小物体聚集的聚集装置加以利用。例如,可将对人类有用的细菌(超低营养性细菌等)聚集。
另外,本发明可作为制造微小结构的微小物体聚集结构体的制造装置加以利用。由此,可实现例如2元光子晶体结构的制造。
另外,本发明准备微小的模具,在其模具的内部将微小物体聚集,由此可将微小物体成型成模具的形状。由此,可实现微小成型加工。
另外,本发明利用根据光吸收性的微小物体(光热转换粒子)的含量的不同而最终形成的聚集体的尺寸不同,推断在样品内含有的光吸收性的微小物体(被检测物质)的含量(或浓度)
另外,本发明可作为微小物体的检测装置加以利用。例如可检测大气中的PM(PM2.5等)的质量浓度。将PM2.5和PM10根据大小而进行分离,因此,无需另设分离机构。因此,可将检测装置小型化。
另外,本发明可作为除去对人体有害的微生物的装置而实现。这是由于在将微生物聚集的同时能够将聚集的微生物通过基于光发热效果的高温处理而除去。
另外,本发明可从多个微小物体中将被分离物质分离。例如用于流式细胞仪时,通过将作为被分离物质的细胞高密度聚集,从而可提高测量灵敏度。
另外,本发明可促进被导入物质向细胞内部导入和被导入物质向细胞膜聚集。例如在新药的研究开发中,作为临床研究的前阶段,有评价其新药对细胞(或者,由其细胞构成的组织)的影响的情况。该情况下,根据本发明,可减少评价所需要的新药的量。
符号说明
1、2微珠,1A、1B、1C、7细胞,3细菌,4微生物,5金纳米粒子,6聚集体,8肽,10、102、103、105、106基板,11玻璃罩,12薄膜,122自组织化膜,13、135、136样品,14微流路,20光发热用光源,21二向色镜,22、422物镜,30照明用光源,31拍摄设备,40XYZ轴工作台,50、450控制部,60运算部,460解析部,100、101、500聚集装置,200微生物的聚集除去装置,210捕集部,211风扇,212、311吸引口,220除去部,300检测装置,310空气采样器,312过滤器,313流量计,314泵,400流式细胞仪,410流动池,411鞘液导入部,412样品导入部,430光源,431分光器,440细胞分选仪,442、443容器,MB微泡。
- 还没有人留言评论。精彩留言会获得点赞!