一种核-壳结构的制备方法与流程
本发明涉及生物医学、材料学、生物打印(例如3d生物打印)、组织工程学等技术领域。特别地,本发明涉及一种核-壳结构的制备方法,该核-壳结构可用于递送活性物质、或用于生物打印(例如3d生物打印)和组织工程。
背景技术:
核-壳结构是指利用成膜材料将固体、液体或气体包囊于其中,形成直径几十微米至上千微米的微小容器,其用于形成核层的物料称为芯材(或称为囊心物质),用于形成外部包囊的壳层(壁膜)的物料称为壁材(或称为包囊材料)。
目前核-壳结构的主要制备方法按照造粒原理可以分为化学法、物理法和物理化学法。化学法建立在化学反应基础上,主要利用单体小分子发生聚合反应生成高分子或膜材料并将芯材包覆,其主要包括界面聚合法、原位聚合法、锐孔法等。物理法指通过机械力将高分子包覆在芯材物质上,主要包括喷雾干燥法、喷雾凝冻法、空气悬浮法、静电结合法、挤压法等。物理化学法是通过改变温度、ph值、加入电解质等,使溶解状态的成膜材料从溶液中聚沉,并将芯材包覆形成核-壳结构,其主要包括水相分离法、油相分离法、熔化分散冷凝法等。
现有技术中最常使用的是锐孔法。锐孔法通常将芯材物质和高聚物壁材溶解在同一溶液中;然后,借助于滴管或注射器等微孔装置,将此溶液滴到固化剂中;高聚物在固化剂中迅速固化从而形成核-壳结构。最常见的制备核-壳结构的自动化仪器一般基于振动原理和锐孔法,其在液滴喷射阶段通过施加一定频率、一定振幅的正弦波于喷嘴或射流,使射流破碎成液滴,滴入固化剂中,形成核-壳结构。
现有的设备制备核-壳结构时,通常需要借助单独的振动装置进行分液、以将核材料制成预设的粒径大小。对于自身不易成球型的核材料,则需要将分液后的核材料人工倒入至盛装有固化剂的容器内,借助固化剂将核材料良好、均匀地固化成球状,再将固化成球状后的核材料人工倒入至壳溶液中进行包裹形成核-壳结构。整个制备过程复杂繁琐,并且通过振动法对核材料进行分液的过程难以兼顾细胞粒径和活性,尤其体现在制备微小粒径的核材料时,通常需要施加更高的振动频率和振幅,而这样的方式会大大影响细胞活性。
具体地,现有技术还存在以下不足之处:
(1)现有的制备核-壳结构的方法通常需要借助固化剂使得液滴凝固成型。这种方式制备的壳层形成情况不可预期。由于有些固化剂具有一定的毒性,若采用上述方式制备包含细胞的核-壳结构,含有毒性的物质对细胞活性的影响较大,这样就限制了核-壳结构的材料选择范围。
(2)现有的基于锐孔法的制备仪器,通常是采用振动法或电压脉冲法来进行分液。为使得液滴直径更小,通常需要施加更高的振动频率和振幅,这同时也会大大影响细胞活性,从而难以兼顾细胞液滴粒径和细胞活性。
(3)核、壳的尺寸控制不精确。现有的制备方法及其装置只能依靠核、壳自发的化学反应制备成型,不能精确控制最终制得的核壳结构尺寸,不能控制核、壳各自的厚度,重复性差,即难以实现核、壳的尺寸的按需单独控制和调整。
(4)在采用温敏性材料制备核-壳结构的过程中,由于通常采用手动滴液的方式,难以保证多次、重复分量滴定过程的精准性,所制得的核-壳结构制备精度低,尺寸误差大,并且难以制得多层壳、尤其是具有多层厚度不同的壳的核-壳结构。
(6)采用锐孔法制备核-壳结构时,对于一些主要含极性分子的温敏材料,在制备时对于液滴的成型过程和分次滴定的包裹效率不能 保证,限制了自动化高效率的制备。
(7)对于包含有细胞的核-壳结构,核结构内的细胞由外部的壳结构进行包裹和保护,壳结构的包裹效果会严重影响裹于其内部的细胞的存活率。若外部的壳结构包裹得不充分和/或不完整,核结构内的细胞容易从壳结构的缺口或缝隙中脱离壳结构的保护,即,若壳结构包裹得不完整,核-壳结构内的细胞仍然非常容易受到损伤。
发明概述
为了解决上述一个或更多个问题,本申请的发明人开发了一种核-壳结构的制备方法,其适用于制备包含各种芯材的核-壳结构。本发明的方法不涉及复杂步骤和仪器,容易实现,应用性强,并且准确性和重复性高,能够有效控制核-壳结构的尺寸、核壳层数以及壳层厚度。
此外,本发明的方法获得的核-壳结构能够作为生物3d打印的基础单元,即生物砖。本发明的生物砖所包裹的细胞类型和细胞数目是可控的,并且生物砖本身的尺寸也是可控的(例如粒径低至约100μm的核-壳结构),从而其可用于制备标准化、可控化的生物墨汁。在一些方面,本发明的生物砖能够为细胞提供了有效的力学保护,从而确保了细胞在打印过程中的存活率(例如达到90%以上)。
因此,在一个方面,本发明提供了一种核-壳结构的制备方法,包括以下步骤:a)提供疏水表面,优选超疏水表面;b)将芯材溶液滴至步骤a)的疏水表面,形成液滴,以获得最内侧的核层结构;c)任选地,将芯材溶液滴至形成的液滴表面,以获得另一核层结构;d)任选地,将壁材溶液滴至形成的液滴表面,以获得壳层结构;e)任选地,重复步骤c)和/或步骤d)一次或更多次或者交替进行步骤c)和步骤d)一次或更多次;f)将壁材溶液滴至形成的液滴表面,以获得最外侧的壳层结构;其中,每一核层或壳层包含的芯材或壁材的选择是各自独立的。在本发明的某些优选实施方案中,本发明的超疏水表面可以是超疏水涂层。在本发明的某些优选实施方案中,本发明的方法-进一步包括使芯材和/或壁材成型的步骤,该成型步骤可以在步骤b)或步骤c) 或步骤d)或步骤e)或步骤f)之后进行。在本发明的某些优选实施方案中,所述核层包裹细胞和/或活性物质。
在另一个方面,本发明的方法获得的核-壳结构的核层包裹期望的活性物质。在本发明的某些实施方案中,所述核-壳结构的核层包裹一种或多种细胞。
在另一个方面,本发明提供了一种通过本发明的方法获得的生物砖,其,包括:细胞,包裹所述细胞的核层,和,封装所述细胞和核层的壳层,其中所述核层和壳层各自由生物可降解材料制成。在本发明的某些优选实施方案中,所述核层和壳层中的生物可降解材料能够减少或避免生物砖内的细胞在操作(例如生物打印)过程中遭受机械损伤,并且能够提供物质(例如营养物质,细胞外基质,细胞因子,药物活性成分等)的可控释放,以促进细胞活性和功能(增殖、分化、迁移、分泌或新陈代谢)。
下面将结合附图和发明详述来对本发明的实施方案进行详细阐释。但是,本领域技术人员将理解,下列附图和发明详述仅用于说明本发明,而不是对本发明的范围的限定。根据附图和发明详述的详细公开内容,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1示意性描述了在未处理的玻璃表面和经处理的玻璃表面(即超疏水表面)滴注待反应液。
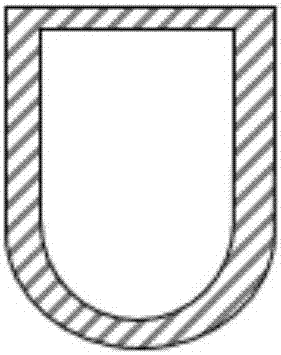
图2示意性描述了可用于本发明的方法中的u型底孔板结构。
图3示意性描述了在u型底孔板滴注不同容量待反应液、形成不同预设粒径的核层。
图4示意性描述了在平底孔板滴注不同容量待反应液、形成不同预设粒径的核层。
图5示意性描述了可用于本发明的方法的装置。
图6显示了根据实施例3-4制备的核-壳结构的显微照片。
图7示意性描述了本发明的生物砖的结构,其包括:细胞,其能够进行生长、增殖、分化或迁移;包裹所述细胞的核层,其由生物可降解材料制成,并且为细胞的生命活动提供所需的物质;和,封装所述细胞和核层的壳层,其位于最外侧,由生物可降解材料制成,并且为内部的核层和细胞提供力学保护。
发明详述
术语定义
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。然而,为了更好地理解本发明,下面提供本说明书中的相关术语的定义和解释。当本说明书中给出的定义与本领域技术人员所通常理解的含义相冲突时,以本说明书中的定义为准。
如本说明书和所附权利要求书中使用的,单数形式“一个”、“一种”和“该/所述”包括复数的指示物,除非上下文另有明确规定。此外,本文中任何提及的“或”意在包括“和/或”,除非另有说明。
如本文中所使用的,术语“疏水表面”具有本领域通常理解的含义,其通常而言显示大于或等于120°的水接触角。
如本文中所使用的,术语“超疏水表面”具有本领域通常理解的含义,其是高度疏水的,即难以浸润。通常而言,“超疏水表面”显示大于或等于150°的水接触角和小于10°的滚动接触角。
如本文中所使用的,术语“核-壳结构”是指利用成膜材料将固体、液体或气体包囊于其中,形成直径几十微米至上千微米例如20-2000微米的微小容器,其用于形成核层的物料称为芯材(或称囊心物质),用于形成外部包囊的壳层(壁膜)的物料称为壁材(或称为包囊材料)。
如本文中所使用的,术语“生物砖”用于指通过本发明的方法构建的一种基本单元,其可用于多个领域,例如生物打印(如3d生物打印)、组织工程、再生医学等领域。特别地,本发明的生物砖具有特定 的结构和组成,即,其包括:细胞,包裹所述细胞的核层,和,封装所述细胞和核层的壳层,其中所述核层和壳层各自由生物可降解材料制成。本发明的生物砖的示意性结构可参见图7。
如本文中使用的,术语“生物打印”是指:利用生物材料(包括但不限于,生物分子例如蛋白质,脂质,核酸和代谢产物;细胞例如细胞溶液、含细胞的凝胶、细胞悬浮液、细胞浓缩物、多细胞聚集体和多细胞体;亚细胞结构例如细胞器和细胞膜;与生物分子相关的分子例如合成的生物分子或生物分子的类似物)的打印。如本文中使用的,术语“打印”是指,按照预定的模式沉积材料的过程。在本发明中,生物打印优选地通过与自动的或半自动的、计算机辅助的三维原型装置(例如生物打印机)相匹配的方法来实现。然而,在本发明中,“打印”(例如生物打印)可通过各种方法来进行,包括但不限于,使用打印机(例如3d打印机或生物打印机)进行打印;使用自动化或非自动化机械过程(而非打印机)进行打印;通过手工放置或手工沉积(例如使用移液器)进行打印。
如本文中使用的,“生物相容性材料”是指这样的材料,其(以及其降解产物)对于细胞是无毒性的,并且在植入宿主(例如人体)后与宿主相容,不会造成显著的或者严重的副作用,例如,不会对宿主(例如人体组织)造成毒害作用,不会引起宿主的免疫排斥反应、过敏反应或炎症反应等等。
如本文中使用的,“生物可降解材料”是指这样的材料,其能够被细胞或生物体降解和吸收,并且其降解产物是生物相容性的。此类材料可以是天然来源的(例如来源于动植物),也可以是人工合成的。
如本文中所使用的,术语“力学保护”是指,壳层具有一定的硬度和弹性模量,从而能够减少或避免其封装的细胞遭受外界的机械损伤/力学损伤(例如,3d生物打印过程中可能产生的剪切力,挤压力等引起的损伤)。
如本文中使用的,“生物墨汁”是指,包含一种或多种本发明的生物砖的液体,半固体(例如凝胶)或固体组合物。例如,本发明的生 物墨汁可以是包含生物砖的溶液,悬浮液,凝胶,或浓缩物。在优选的实施方案中,本发明的生物墨汁包含生物砖以及生物粘合剂。在本发明中,生物墨汁能够被用于生物打印,以产生特定的平面和/或层状几何形状;并且优选地,所产生的平面和/或层状几何形状能够进一步堆叠,从而形成具有特定形状和结构的三维构建体。此外,在生物打印之前,期间和/或之后,生物墨汁中的生物砖内的细胞能够进行各种期望的生命活动。在优选的实施方案中,生物砖内的细胞在生物打印之前处于休眠状态,而在生物打印之后进行生长和增殖,从而形成稳固的三维构建体。在优选的实施方案中,生物墨汁是可挤出的组合物。如本文中所使用的,“可挤出的”是指,组合物能够通过被迫(例如在压力下)穿过喷嘴或孔口而成形。
如本文中使用的,“生物粘合剂”是指,起粘合作用的、与细胞和生物体相容的、可降解的材料。其具体实例可包括,但不限于胶原、纤维蛋白、壳聚糖、海藻酸盐、淀粉、透明质酸、层粘连蛋白、弹性蛋白、明胶、聚氨基酸、琼脂、葡聚糖、甲基纤维素、聚乙烯醇、聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),或其任何组合。
如本文中使用的,“试剂”是指化学试剂、生化试剂或药物,包括但不限于,小分子化合物,激素,肽(例如寡肽或蛋白质),核酸(寡核苷酸,dna,rna或化学修饰的核酸)等,其对细胞活性,功能和/或行为具有作用或影响。试剂可以是天然来源的,重组产生的,或化学合成的。“刺激”是指,化学因素(例如试剂,酸,碱,氧浓度等)或物理因素(例如温度,辐照,机械力等),其对细胞活性,功能和/或行为具有作用或影响。
如本文中使用的,“受试者”是指动物,例如脊椎动物。优选地,受试者为哺乳动物,例如人,牛科动物,马科动物,猫科动物,犬科动物,啮齿类动物或灵长类动物。特别优选地,受试者为人。在本文中,该术语可以与“患者”、“受体”和“供体”互换使用。
因此,在一个方面,本发明提供了一种核-壳结构的制备方法,包括以下步骤:a)提供疏水表面,优选超疏水表面;b)将芯材溶液滴至步骤a)的疏水表面,形成液滴,以获得最内侧的核层结构;c)任选地,将芯材溶液滴至形成的液滴表面,以获得另一核层结构;d)任选地,将壁材溶液滴至形成的液滴表面,以获得壳层结构;e)任选地,重复步骤c)和/或步骤d)一次或更多次或者交替进行步骤c)和步骤d)一次或更多次;f)将壁材溶液滴至形成的液滴表面,以获得最外侧的壳层结构;其中,每一核层或壳层包含的芯材或壁材的选择是各自独立的。
本发明的疏水表面例如超疏水表面的示意图可参见图1,其显示所滴注的待反应液在超疏水处理前后的玻璃表面上的接触角。可用于本发明的表面可以是任何表面,只要其是疏水性的,优选超疏水性的。疏水表面例如超疏水表面可以是固体表面,也可以是薄膜表面。疏水表面例如超疏水表面还可以是涂覆于表面上的疏水涂层诸如超疏水涂层。例如,疏水表面例如超疏水表面可以是容器的疏水表面例如超疏水表面;优选地,容器为平板诸如玻璃平板,孔板诸如96、384或1536孔标准孔板、或者烧杯,优选孔板,例如底部呈u型的孔板(参见图2)。在滴入液体体积远小于孔板底部直径时,u型底的弧面构型更加有利于核壳溶液汇聚于中心,从而提高包裹效率。
疏水表面例如超疏水表面可通过本领域的常规方法产生,例如选自刻蚀法、相分离与自组装法、化学沉积与电沉积法、溶胶-凝胶法、静电纺丝法、碳纳米管法、模板法、纳米二氧化硅法、腐蚀法、全氟化处理法、硅烷化处理法和纳米疏水涂层法。疏水表面使得型材溶液滴在其表面后能够成型,其中当接触角大于或等于150°时,能够成基本上规则的圆形,而接触角大于120°但小于150°时,能够成椭圆形。
在某些优选的实施方案中,其中在步骤b)中使用移液装置,优选能够准确定量控制吸入和排出体积的移液装置,更优选能够分次定量排出液体的移液装置,进一步优选电子式移液装置,进一步优选能够吸取和排出纳升级液体的电子式移液装置吸取芯材溶液,并将其滴 至所述疏水表面诸如超疏水表面,形成液滴。采用能够准确定量控制吸入和排出体积的移液装置,能够精确吸取小量核层和壳层溶液,且重复性、稳定性、精密度好。图3显示了在未经超疏水化处理和经超疏水化处理的u型底孔板上滴注不同容量的芯材溶液,以形成不同预设粒径的核层。图4显示了在未经超疏水化处理和经超疏水化处理的平板底孔板上滴注不同容量的芯材溶液,以形成不同预设粒径的核层。
在本发明的某些优选实施方案中,本发明的方法进一步包括根据芯材的性质使芯材和/或壁材成型的步骤。该成型步骤可以在步骤b)或步骤c)或步骤d)或步骤e)或步骤f)之后进行。在一个实施方案中,该成型步骤包括向步骤b)或步骤c)或步骤d)或步骤e)或步骤f)中形成的液滴表面滴入固化剂使其成型。本领域技术人员能够根据所使用的芯材和壁材的性质选择适合的固化剂,例如氯化钙。不受特别的固化作用机理的限制,能够与芯材或壁材发生反应而使液滴固化成型的固化剂均可用于本发明。在一个实施方案中,该成型步骤包括向步骤b)或步骤c)或步骤d)或步骤e)或步骤f)中形成的液滴施加外部作用例如升高的温度,使其成型。本领域技术人员能够根据所使用的芯材和壁材的性质选择合适的外部作用,例如温度控制,诸如对于温敏材料(如胶原,优选i型胶原)采用温度控制的方式进行成型。例如,当使用i型胶原作为芯材时,外部作用为在37℃恒温保持,优选保持20-40min,优选30min。值得注意的是,本发明的方法也可以不包括额外的成型步骤,而是通过超疏水表面的形状而呈一定的形状,例如圆形或椭圆形。
在本发明的某些优选实施方案中,步骤c)-f)任一项中的芯材或壁材溶液通过选自静电吸附、氢键相互作用、共价键作用、电荷转移相互作用、配位键相互作用、疏水相互作用、生物分子间特异性生物作用和卤键的一种或多种方式结合到液滴表面,优选通过静电吸附的方式。例如,在一个芯材为胶原而壁材为聚赖氨酸的实施方案中,带正电荷的聚赖氨酸通过静电吸附的方式吸附到带负电荷的胶原表面。
在本发明的某些优选实施方案中,所述方法还包括在步骤c)-f) 任一项中的芯材或壁材溶液滴入后,手动或通过微振动装置轻微振动疏水表面使得溶液中的芯材或壁材完全结合。
在本发明的某些优选实施方案中,当制备多层壳结构时,在一层壁材溶液吸附完全后、在滴加下一层壁材溶液之前,还包括清洗步骤。优选地,所述清洗步骤包括滴加清洗溶液,清洗1次或更多次例如2次,以去除多余的壁材溶液;优选地,所述清洗溶液为细胞培养基溶液。清洗步骤可以去除容器内多余的壁材溶液,避免其吸附在包裹了一层壁材溶液的微球表面,或者与后面添加的壁材溶液反应,导致后续壳层包裹不均匀,从而核-壳结构出现凸起或其它不规则结构。
图5是可用于实施本发明的方法的装置的结构示意图。该装置包括数字滴液器,其能够准确定量控制吸入和排出体积,优选能够吸取和排出纳升级液体的数字滴液器。该数字滴液器与控制器连接,从而通过控制器准确定量控制吸入和排出的液体体积。该控制器还与二维运动平台连接并操纵该平台在水平方式上的运动,由此控制布置于该平台上的微孔板的运动。以这种方式,控制器能够控制数字滴液器以期望的体积将芯材溶液滴注至微孔板中,以形成核层。任选地,微孔板置于恒温板上,以向微孔板中的芯材溶液提供期望的温度,从而使滴注的核层成型。任选地,在通过更换吸头模块更换吸头后,通过数字滴液器从待反应液培养皿吸取固化剂溶液,将其滴注至芯材液滴表面,使其固化成型。然后,通过更换吸头模块更换吸头后,通过数字滴液器从待反应液培养皿吸取壁材溶液,并滴至核层表面,以形成壳层。壳层的厚度也可根据与控制器连接的数字滴液器加以调整和控制,例如,可以通过控制和调整数字滴液器吸取和滴加的壳层材料的量来控制和调整壳层厚度。通过本发明的方法制备的核-壳结构或生物砖的核层尺寸和壳层厚度是可控的,可根据需要进行选择。
在本发明的某些优选实施方案中,本发明的方法获得的核-壳结构为微胶囊或生物砖。
在本发明的某些实施方案中,微胶囊的核层包裹期望的活性物质。取决于微胶囊的具体应用,活性物质可以为化合物、蛋白质、核苷酸等 具有期望活性的物质,例如氨基酸、多肽、核苷酸载体、小分子化合物、碳水化合物、生物酶等。
在本发明的某些实施方案中,生物砖的核层包裹一种或多种细胞,诸如一个或多个细胞,例如1-106个细胞,例如1-105、1-104、1-5000、1-2000、10-900、20-800、30-700、40-600、50-500、60-400、70-300、80-200、10-100个细胞。
在本发明的某些优选实施方案中,细胞为细菌、酵母、植物细胞或动物细胞,例如哺乳动物细胞,优选人细胞;优选地,所述细胞为粘附细胞,例如分化的粘附细胞或未分化的粘附细胞;优选地,所述细胞为多能干细胞。
在本发明的某些优选实施方案中,细胞来源于选自下述的组织:结缔组织(例如,疏松结缔组织、致密结缔组织、弹性组织、网状结缔组织和脂肪组织)、肌肉组织(例如,骨骼肌、平滑肌和心肌)、泌尿生殖组织、胃肠组织、肺组织、骨组织、神经组织和上皮组织(例如,单层上皮和复层上皮)、内胚层来源的组织、中胚层来源的组织和外胚层来源的组织;
在本发明的某些优选实施方案中,细胞选自肌肉细胞(例如,骨骼肌细胞、心肌细胞、平滑肌细胞和成肌细胞)、结缔组织细胞(例如,骨细胞、软骨细胞、成纤维细胞以及分化为成骨细胞、软骨细胞或淋巴组织的细胞)、骨髓细胞、内皮细胞、皮肤细胞、上皮细胞、乳腺细胞、血管细胞、血细胞、淋巴细胞、神经细胞、许旺细胞、胃肠细胞、肝细胞、胰细胞、肺细胞、气管细胞、角膜细胞、泌尿生殖细胞、肾细胞、脂肪细胞、实质细胞、周细胞、间皮细胞、基质细胞、未分化的细胞(如干细胞和祖细胞)、内胚层来源的细胞、中胚层来源的细胞、外胚层来源的细胞、癌来源的细胞,细胞系、诱导的多能干细胞(ips)、或其任何组合。
在本发明的某些优选实施方案中,芯材材料为温敏材料或非温敏材料;优选地,所述温敏材料为明胶或胶原或其组合;优选地,非温敏材料为海藻酸盐、可降解聚氨酯或其组合;优选地,当芯材为胶原时,所 述第一溶液的液滴在37℃成型,优选在ph7.6的条件下成型,优选成型约20-40min,更优选约30min。
在本发明的某些优选实施方案中,芯材能够为细胞的生命活动提供所需的物质;优选地,所述芯材为生物可降解材料,并且所述生物可降解材料是生物相容性的;优选地,所述生物可降解材料是适合细胞生长和/或迁移的材料;优选地,所述生物可降解材料是天然存在的(例如来源于动植物的天然存在的生物可降解材料),人工合成的,重组产生的,或者其任何组合;优选地,所述生物可降解材料包含天然存在的可降解聚合物,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合;和/或合成的可降解聚合物,例如聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸,可降解性聚氨酯,以及其任何组合;优选地,所述生物可降解材料能够被酶(例如细胞分泌的酶)所降解;优选地,所述核层的降解能够提供维持或促进所述细胞的生命活动的物质;优选地,所述生物可降解材料选自胶原蛋白(例如i型,ii型,iii型胶原蛋白)、纤维蛋白、壳聚糖、海藻酸盐(例如海藻酸钠)、淀粉、透明质酸,层粘连蛋白,弹性蛋白,明胶、葡聚糖、聚氨基酸、琼脂,或其任何组合;优选地,所述核层包含i型胶原蛋白和/或海藻酸盐,例如包含i型胶原蛋白和海藻酸钠;
在本发明的某些优选实施方案中,最内侧核层的尺寸为20-2000μm,例如30-1900μm、40-1800μm、50-1700μm、60-1600μm、70-1500μm、80-1400μm、90-1300μm、100-1200μm、200-1000μm、300-800μm、400-600μm或100-500μm。在某些优选实施方案中,本发明的核-壳结构包含一个或更多个额外的核层,优选地,所述额外的核层的厚度独立地为20-1000μm,例如30-900μm、40-800μm、50-700μm、60-600μm、70-500μm、80-400μm、90-300μm、100-200μm、110-190μm、120-180μm、130-160μm或140-150μm。
在本发明的某些优选实施方案中,壁材能够为细胞的生命活动提供微环境((例如,促进细胞的生命活动的物理、生物或化学因素);优选地,壁材为生物可降解材料,并且所述生物可降解材料是生物相容性的;优选地,所述生物可降解材料是天然存在的(例如来源于动植物的天然存在的生物可降解材料),人工合成的,重组产生的,或者其任何组合;优选地,所述生物可降解材料包含天然存在的可降解聚合物,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合;和/或,合成的可降解聚合物,例如聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸,可降解性聚氨酯,以及其任何组合;优选地,所述生物可降解材料能够被酶(例如细胞分泌的酶)所降解;优选地,所述壳层的降解能够提供维持或促进所述细胞的生命活动的物质;优选地,所述生物可降解材料选自胶原蛋白(例如i型,ii型,iii型胶原蛋白)、纤维蛋白、壳聚糖、海藻酸盐(例如海藻酸钠或海藻酸钙)、淀粉、透明质酸,层粘连蛋白,弹性蛋白,明胶、葡聚糖、聚氨基酸、琼脂,或其任何组合;优选地,所述壳层包含海藻酸盐(例如海藻酸钠或海藻酸钙),例如包含海藻酸钙和明胶,任选地还包含弹性蛋白。
在本发明的某些优选实施方案中,壳层为通透性的;例如,所述壳层对于水,氧气,和营养物质(糖类例如葡萄糖,脂肪,蛋白质,氨基酸,短肽,矿物质,维生素、细胞因子、核苷酸)是通透性的;优选地,所述壳层具有用于生物砖内外物质交换的通道或孔;优选地,通道的直径为至少10、20、50、100、150、200、250、300、350、400、或500nm;优选地,所述孔的直径为至少100、200、400、600、800、1000、1500、2000、4000、或5000nm。
在本发明的某些优选实施方案中,壳层的厚度为0.1-50μm,例如0.1-0.5、0.5-1、1-2、2-5、5-10、10-15、15-20、20-25、25-30、30-50、0.1-1、1-5、1-10、5-10、10-20、10-30、5-20、或1-20μm。
在本发明的某些优选实施方案中,核层和/或壳层还包含额外的试剂,例如,营养物质、细胞外基质、细胞因子和/或药物活性成分;优选地,所述额外的试剂能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢;优选地,所述营养物质包括但不限于,微量元素,核苷酸,氨基酸,多肽,碳水化合物(例如单糖,寡糖,多糖),脂质,维生素;优选地,细胞外基质选自多糖,例如糖胺聚糖、蛋白聚糖;结构蛋白,例如胶原和弹性蛋白;粘着蛋白,例如纤粘连蛋白和层粘连蛋白;优选地,所述细胞因子可以是用于调控细胞的增殖、分化、迁移、分泌和/或新陈代谢的细胞因子,包括但不限于:
-与细胞生长相关的细胞因子,例如胰岛素、类胰岛素生长因子(如igf-ⅰ、igf-ⅱ)、转化生长因子(如tgfα和tgfβ)、血管内皮生长因子、表皮生长因子、成纤细胞生长因子、血小板来源生长因子、骨肉瘤来源生长因子、生长激素释放抑制因子、神经生长因子、白细胞介素(如il-1、il-1、il-3)、红细胞生长素、集落刺激因子、皮质醇、甲状腺素,或其任何组合;
-与细胞分化相关的细胞因子,例如oct3/4,sox2,klf4,c-myc,gata4,tsp1,β-甘油磷酸钠,地塞米松,维生素c,胰岛素,ibmx,吲哚美锌,血小板衍生生长因子bb(pdgf-bb),5-氮杂胞苷,或其任何组合;
-与细胞迁移相关的细胞因子,例如环磷酸腺苷,三磷酸磷脂酰肌醇,基质细胞衍生因子-1、n-钙粘蛋白,核因子κb,骨连接素,血栓素a2,ras,或其任何组合;和/或
-与细胞新陈代谢相关的细胞因子,例如胰岛素生长因子1、trip-br2、dkk-1、srankl、opg、tracp-5b、alp、sirt1(2-7)、pgc-1α,pgc-1β、opg、il-3、il-4、il-6、tgf-β、pge2、g-csf、tnf-α,或其任何组合;
优选地,所述药物活性成分为能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢的试剂;优选地,所述药物活性成分选自rhil-2、rhil-11、rhepo、ifn-α、ifn-β、ifn-γ、g-csf、 gm-csf、rhuepo、stnf-r1、和rhtnf-α。
在本发明的某些优选实施方案中,核-壳结构为球形或椭圆形。
在本发明的某些优选实施方案中,所述核-壳结构为固体或半固体,例如凝胶态。
在本发明的某些优选实施方案中,步骤c)和上述的任选的成型步骤可以交替重复进行,以制备一层或多层核层结构,例如2、3、4、5、6、7、8、9或10层核层结构。
在本发明的某些优选实施方案中,步骤d)也可重复进行,以制备得到一层或多层壳层结构,例如2、3、4、5、6、7、8、9或10层壳层结构。
在本发明的某些优选实施方案中,重复步骤c)和/或步骤d)一次或更多次或者交替进行步骤c)和步骤d)一次或更多次,从而制备两层或更多层的核层结构和/或壳层结构。
在本发明的某些优选实施方案中,本发明提供了一种通过本发明的方法制备的生物砖,其包括:细胞,包裹所述细胞的核层,和,封装所述细胞和核层的壳层,其中所述核层和壳层各自由生物可降解材料制成。在本发明的某些优选实施方案中,所述核层和壳层中的生物可降解材料能够减少或避免生物砖内的细胞在操作(例如生物打印)过程中遭受机械损伤,并且能够提供物质(例如营养物质,细胞外基质,细胞因子或药物活性成分等)的可控释放,以促进细胞活性和功能(增殖、分化、迁移、分泌或新陈代谢)。
生物砖的核层提供了适合细胞粘附和伸展的空间结构,从而细胞在该结构内能够正常进行增殖、分化、迁移、分泌或新陈代谢。在某些实施方案中,所述核层能够为细胞的生命活动提供微环境(例如,促进细胞的生命活动的物理、生物或化学因素)。优选地,所述核层由生物可降解材料制成,并且所述生物可降解材料是生物相容性的。在本发明的实施方案中,用于制备核层的生物可降解材料可以是天然存在的(例如来源于动植物的天然存在的生物可降解材料,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白, 琼脂糖,明胶,葡聚糖,以及其任意组合),人工合成的,重组产生的,或者其任何组合。
在某些优选的实施方案中,用于制备核层的所述生物可降解材料是天然存在的可降解聚合物。优选地,所述可降解聚合物选自胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合。
在某些优选的实施方案中,用于制备核层的所述生物可降解材料是合成的可降解聚合物。此类可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸(polyaminoacid),可降解性聚氨酯,以及其任何组合。
在某些优选的实施方案中,用于制备核层的所述生物可降解材料包含天然存在的可降解聚合物和合成的可降解聚合物。
在某些优选的实施方案中,用于制备核层的所述生物可降解材料能够被酶(例如细胞分泌的酶)所降解。不同的生物可降解材料的降解速率差异很大,其范围可以为一个月到数年。然而在本发明中,特别优选地,用于制备核层的生物可降解材料在不超过2个月的时间内降解,例如在不超过1个月的时间内降解,例如在不超过30天、不超过25天、不超过20天、不超过15天、不超过10天、不超过5天、不超过4天、不超过3天、不超过2天、或不超过1天的时间内降解。例如,用于制备核层的生物可降解材料可以在1-2天,2-3天,3-4天,4-5天,5-10天,10-15天,15-20天,20-25天,25-30天,或30-60天的时间内降解。降解速率与生物可降解材料的分子组成、分子量大小和分子排列(例如,直链或支链)密切相关。一般情况下,分子量越高、分子排列越紧密,降解时间越长。因此,核层的降解速率可通过对核层的组分和/或含量的配置来控制。例如,为了获得更快的降解速率,可使用低含量(例如低于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、低分子量(例如低于500da、1kda、2kda、3kda、 5kda、或10kda)的生物可降解材料,和/或具有疏松分子排布的生物可降解材料。为了获得更慢的降解速率,可使用高含量(例如高于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、高分子量(例如高于500da、1kda、2kda、3kda、5kda、或10kda)的生物可降解材料,和/或具有紧密分子排布的生物可降解材料。另外,还可通过改变生物砖的结构(如:多层包裹、表面多孔、孔隙率大小、比表面积等)来调节生物可降解材料的降解速率。此外,生物可降解材料的降解速率还可以通过改变合成该材料的聚合方式和共聚物比例来进行调节;或者,可通过对该材料的交联来进行调节。
各种生物可降解材料是本领域技术人员已知的,并且其降解性能已被进行了广泛研究(参见例如,alexanderd.augst,hyunjoonkong,davidj.mooney,alginatehydrogelsasbiomaterials,macromol.biosci.2006,6,623-633)。本领域技术人员可根据实际需要,选择合适的生物可降解材料来制备核层。
在某些优选的实施方案中,所述核层的降解能够提供维持或促进所述细胞的生命活动的物质。在某些优选的实施方案中,核层的降解产物为小分子化合物,例如有机酸、单糖(例如葡萄糖)、寡糖、氨基酸、脂质等。此类降解产物可参与到细胞的新陈代谢活动中,用于合成细胞外基质或转化为活动所需的能量。
在某些优选的实施方案中,用于制备核层的生物可降解材料及其降解产物对于细胞是无毒的,和/或对于宿主是非免疫原性的。
在某些优选的实施方案中,用于制备核层的生物可降解材料选自胶原蛋白(例如i型,ii型,iii型胶原蛋白)、纤维蛋白、壳聚糖、海藻酸盐(例如海藻酸钠)、淀粉、透明质酸,层粘连蛋白,弹性蛋白,明胶、葡聚糖、聚氨基酸、琼脂,或其任何组合。
在某些优选的实施方案中,所述核层包含i型胶原蛋白和/或海藻酸盐,例如包含i型胶原蛋白和海藻酸钠。在某些优选的实施方案中,i型胶原蛋白和海藻酸钠在核层中的重量比为约1:1、1:2、1:4、1:6、1:8、3:25、1:9、1:10、1:20、1:30、或1:50。在某些优选的实施方 案中,i型胶原蛋白和海藻酸钠在核层中的重量比为1:1-1:2、1:2-1:4、1:4-1:6、1:6-1:8、1:8-1:9、1:9-1:10、1:10-1:20、1:20-1:30、1:30-1:50、1:1-1:5、1:5-1:10、1:7-1:10、或1:8-1:9。在某些优选的实施方案中,i型胶原蛋白在核层中的重量百分比为约0.01%、0.05%、0.1%、0.125%、0.15%、0.175%、0.2%、0.25%、0.3%、0.4%、0.5%、1%、2%、3%、4%、或5%。在某些优选的实施方案中,i型胶原蛋白在核层中的重量百分比为0.01%-0.05%、0.05%-0.1%、0.1%-0.125%、0.125%-0.15%、0.15%-0.175%、0.175%-0.2%、0.2%-0.25%、0.25%-0.3%、0.3%-0.4%、0.4%-0.5%、0.5%-1%、1%-2%、2%-3%、3%-4%、4%-5%、0.01%-0.1%、0.1%-0.2%、0.125%-0.175%、0.2%-0.5%、0.1%-0.5%、0.1%-1%、或0.05%-5%。在某些优选的实施方案中,海藻酸钠在核层中的重量百分比为约0.1%、0.5%、1%、1.25%、1.5%、2%、3%、4%、5%、7.5%、或10%。在某些优选的实施方案中,海藻酸钠在核层中的重量百分比为0.1%-0.5%、0.5%-1%、1%-1.25%、1.25%-1.5%、1.5%-2%、2%-3%、3%-4%、4%-5%、5%-7.5%、7.5%-10%、0.1%-1%、1%-1.5%、1%-2%、0.5-2.5%、1%-3%、5-10%、或0.5-5%。
在某些优选的实施方案中,所述核层为凝胶状。
在某些优选的实施方案中,所述壳层也能够为细胞的生命活动提供所需的物质。优选地,所述壳层由生物可降解材料制成,并且所述生物可降解材料是生物相容性的。在本发明的实施方案中,用于制备壳层的生物可降解材料可以是天然存在的(例如来源于动植物的天然存在的生物可降解材料,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合),人工合成的,重组产生的,或者其任何组合。
在某些优选的实施方案中,用于制备壳层的所述生物可降解材料是天然存在的可降解聚合物。优选地,所述可降解聚合物选自胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合。
在某些优选的实施方案中,用于制备壳层的所述生物可降解材料是合成的可降解聚合物。此类可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸(polyaminoacid),可降解性聚氨酯,以及其任何组合。
在某些优选的实施方案中,用于制备壳层的所述生物可降解材料包含天然存在的可降解聚合物和合成的可降解聚合物。
在某些优选的实施方案中,用于制备核层和壳层的生物可降解材料是相同的或不同的。在某些优选的实施方案中,核层和壳层分别以不同的重量比包含相同的生物可降解材料。
在某些优选的实施方案中,用于制备壳层的所述生物可降解材料能够被酶(例如细胞分泌的酶)所降解。不同的生物可降解材料的降解速率差异很大,其范围可以为一个月到数年。在某些优选的实施方案中,生物可降解材料在1天、2天、3天、5天、10天或更长的时间内降解。降解速率与生物可降解材料的分子组成、分子量大小和分子排列(例如,直链或支链)密切相关。一般情况下,分子量越高、分子排列越紧密,降解时间越长。因此,壳层的降解速率可通过对壳层的组分和/或含量的配置来控制。例如,为了获得更快的降解速率,可使用低含量(例如低于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、低分子量(例如低于500da、1kda、2kda、3kda、5kda、或10kda)的生物可降解材料,和/或具有疏松分子排布的生物可降解材料。为了获得更慢的降解速率,可使用高含量(例如高于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、高分子量(例如高于500da、1kda、2kda、3kda、5kda、或10kda)的生物可降解材料,和/或具有紧密分子排布的生物可降解材料。另外,还可通过改变生物砖的结构(如:多层包裹、表面多孔、孔隙率大小、比表面积等)来调节生物可降解材料的降解速率。此外,生物可降解材料的降解速率还可以通过改变合成该材料的聚合方式和共聚物比例来进行调节;或者,可通过对该材 料的交联来进行调节。
各种生物可降解材料是本领域技术人员已知的,并且其降解性能已被进行了广泛研究(参见例如,alexanderd.augst,hyunjoonkong,davidj.mooney,alginatehydrogelsasbiomaterials,macromol.biosci.2006,6,623-633)。本领域技术人员可根据实际需要,选择合适的生物可降解材料来制备壳层。
在某些优选的实施方案中,所述壳层的降解能够提供维持或促进所述细胞的生命活动的物质。在某些优选的实施方案中,壳层的降解产物为小分子化合物,例如有机酸、单糖(例如葡萄糖)、寡糖、氨基酸、脂质等。此类降解产物可参与到细胞的新陈代谢活动中,用于合成细胞外基质或转化为活动所需的能量。
在某些优选的实施方案中,用于制备壳层的生物可降解材料及其降解产物对于细胞是无毒的,和/或对于宿主是非免疫原性的。
在某些优选的实施方案中,用于制备壳层的生物可降解材料选自胶原蛋白(例如i型,ii型,iii型胶原蛋白)、纤维蛋白、壳聚糖、海藻酸盐(例如海藻酸钠或海藻酸钙)、淀粉、透明质酸,层粘连蛋白,弹性蛋白,明胶、葡聚糖、聚氨基酸、琼脂,或其任何组合。
在某些优选的实施方案中,所述壳层包含海藻酸盐(例如海藻酸钠或海藻酸钙),例如包含海藻酸钙和明胶,任选地还包含弹性蛋白。
在某些优选的实施方案中,所述壳层包含海藻酸盐(例如海藻酸钠或海藻酸钙)和明胶。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)和明胶在壳层中的重量比为约10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、或1:10。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)和明胶在壳层中的重量比为10:1-9:1、9:1-8:1、8:1-7:1、7:1-6:1、6:1-5:1、5:1-4:1、4:1-3:1、3:1-2:1、2:1-1:1、1:1-1:2、1:2-1:3、1:3-1:4、1:4-1:5、1:5-1:6、1:6-1:7、1:7-1:8、1:8-1:9、1:9-1:10、10:1-5:1、5:1-1:1、1:1-1:5、1:5-1:10、2:1-1:2、4:1-1:4、或10:1-1:10。在某些优选的实施方案中,所述壳层还包含 弹性蛋白。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)和弹性蛋白在壳层中的重量比为约1000:1、500:1、400:1、300:1、250:1、200:1、100:1、50:1或10:1。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)和弹性蛋白在壳层中的重量比为10:1-50:1、50:1-100:1、100:1-200:1、200:1-250:1、250:1-300:1、300:1-400:1、400:1-500:1、500:1-1000:1、10:1-100:1、100:1-200:1、200:1-300:1、300:1-400:1、400:1-1000:1、或100:1-500:1。在某些优选的实施方案中,明胶和弹性蛋白在壳层中的重量比为约1000:1、500:1、400:1、300:1、250:1、200:1、100:1、50:1或10:1。在某些优选的实施方案中,明胶和弹性蛋白在壳层中的重量比为10:1-50:1、50:1-100:1、100:1-200:1、200:1-250:1、250:1-300:1、300:1-400:1、400:1-500:1、500:1-1000:1、10:1-100:1、100:1-200:1、200:1-300:1、300:1-400:1、400:1-1000:1、或100:1-500:1。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)、明胶和弹性蛋白在壳层中的重量比为约250:250:1。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)在壳层中的重量百分比为约0.1%、0.5%、1%、1.25%、1.5%、2%、3%、4%、5%、7.5%、或10%。在某些优选的实施方案中,海藻酸盐(例如海藻酸钠或海藻酸钙)在壳层中的重量百分比为0.1%-0.5%、0.5%-1%、1%-1.25%、1.25%-1.5%、1.5%-2%、2%-3%、3%-4%、4%-5%、5%-7.5%、7.5%-10%、0.1%-1%、1%-1.5%、1%-2%、0.5-2.5%、1%-3%、5-10%、或0.5%-5%。在某些优选的实施方案中,明胶在壳层中的重量百分比为约0.1%、0.5%、1%、1.25%、1.5%、2%、3%、4%、5%、7.5%、或10%。在某些优选的实施方案中,明胶在壳层中的重量百分比为0.1%-0.5%、0.5%-1%、1%-1.25%、1.25%-1.5%、1.5%-2%、2%-3%、3%-4%、4%-5%、5%-7.5%、7.5%-10%、0.1%-1%、1%-1.5%、1%-2%、0.5-2.5%、1%-3%、5-10%、或0.5%-5%。在某些优选的实施方案中,弹性蛋白在壳层中的重量百分比为约0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.1%、0.15%、0.2%、或0.5%。在某些优选的实施方案中,弹性蛋白在壳层中的重量百分比为 0.01%-0.02%、0.02%-0.03%、0.03%-0.04%、0.04%-0.05%、0.05%-0.06%、0.06%-0.07%、0.07%-0.08%、0.08%-0.1%、0.1%-0.15%、0.15%-0.2%、0.2%、0.2%-0.5%、0.01%-0.03%、0.03%-0.05%、0.05%-0.08%、0.08%-0.15%、0.01%-0.05%、0.05%-0.1%、0.03%-0.07%、0.04%-0.06%、0.01%-0.1%、0.1%-0.5%、或0.01%-0.5%。
在某些优选的实施方案中,所述壳层为包裹的细胞提供了力学保护。在某些优选的实施方案中,所述生物砖(壳层)具有约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0.3、或0.4gpa的硬度。在某些优选的实施方案中,所述生物砖(壳层)具有0.01-0.02、0.02-0.03、0.03-0.04、0.04-0.05、0.05-0.06、0.06-0.07、0.07-0.08、0.08-0.09、0.09-0.1、0.1-0.15、0.15-0.2、0.2-0.3、0.3-0.4、0.01-0.4、0.01-0.05、0.05-0.1、0.1-0.2、0.2-0.4、0.05-0.15、或0.06-0.1gpa的硬度。在某些优选的实施方案中,所述生物砖(壳层)具有约0.083gpa的硬度。在某些优选的实施方案中,所述生物砖(壳层)具有约0.01、0.05、0.1、0.5、0.8、1、1.2、1.4、1.6、1.8、2、2.4、2.8、3.2、4、10、20、30、40、50、80、或100mpa的弹性模量。在某些优选的实施方案中,所述生物砖(壳层)具有0.01-0.05、0.05-0.1、0.1-0.5、0.5-0.8、0.8-1、1-1.2、1.2-1.4、1.4-1.6、1.6-1.8、1.8-2、2-2.4、2.4-2.8、2.8-3.2、3.2-4、4-10、10-20、20-30、30-40、40-50、50-80、80-100、0.5-4、0.5-1、1-1.5、1.5-2、2-3、0.8-1.6、1.4-2.4、0.8-3.2、0.01-100、1-100、10-100、或0.5-50mpa的弹性模量。在某些优选的实施方案中,所述壳层具有约1.683mpa的弹性模量。壳层的力学保护作用(例如,硬度和弹性模量)可通过对壳层的组分和/或含量的配置来控制。
在某些优选的实施方案中,所述壳层是通透性的。例如,所述壳层对于水,氧气,和营养物质(糖类例如葡萄糖,脂肪,蛋白质,氨基酸,短肽,矿物质,维生素、细胞因子、核苷酸等)是通透性的。在某些优选的实施方案中,所述壳层具有用于生物砖内外物质交换的通道或孔。 在某些优选的实施方案中,营养物质(糖类例如葡萄糖,脂肪,蛋白质,氨基酸,短肽,矿物质,维生素、细胞因子、核苷酸等)通过所述通道或孔扩散进入所述生物砖内。在某些优选的实施方案中,所述通道的直径为至少10、20、50、100、150、200、250、300、350、400、或500nm。在某些优选的实施方案中,所述通道的直径为例如1nm-5μm;10nm-2μm;100nm-1μm;200-800nm等。在某些优选的实施方案中,所述孔的直径为至少100、200、400、600、800、1000、1500、2000、4000、或5000nm。
本发明的生物砖的壳层的厚度可以根据实际需要进行选择,而不受特别限制。例如,本发明生物砖的壳层的厚度可以为0.1-50μm,例如1-20μm,例如5-15μm,例如8-12μm。在某些优选的实施方案中,本发明的生物砖的壳层的厚度可以为约0.1、0.5、1、2、5、10、15、20、25、30、或50μm。在某些优选的实施方案中,本发明的生物砖的壳层的厚度可以为0.1-0.5、0.5-1、1-2、2-5、5-10、10-15、15-20、20-25、25-30、30-50、0.1-1、1-5、1-10、5-10、10-20、10-30、5-20、或1-20μm。
在某些优选的实施方案中,所述核层和/或壳层还包含额外的试剂,例如,营养物质、细胞外基质、细胞因子和/或药物活性成分。优选地,所述额外的试剂能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢。在某些优选的实施方案中,所述核层包含至少一种(例如1、2、3、4、5或更多种)能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢的额外的试剂。在某些优选的实施方案中,所述核层能够以受控的方式释放所述额外的试剂。
在某些优选的实施方案中,所述营养物质包括但不限于,微量元素,核苷酸,氨基酸,多肽,碳水化合物(例如单糖,寡糖,多糖),脂质,维生素等。
在某些优选的实施方案中,细胞外基质选自多糖,例如糖胺聚糖、蛋白聚糖;结构蛋白,例如胶原和弹性蛋白;粘着蛋白,例如纤粘连 蛋白和层粘连蛋白。
在某些优选的实施方案中,所述细胞因子可以是用于调控细胞的增殖、分化、迁移、分泌和/或新陈代谢的细胞因子,包括但不限于:
-与细胞生长相关的细胞因子,例如胰岛素、类胰岛素生长因子(如igf-ⅰ、igf-ⅱ)、转化生长因子(如tgfα和tgfβ)、血管内皮生长因子、表皮生长因子、成纤细胞生长因子、血小板来源生长因子、骨肉瘤来源生长因子、生长激素释放抑制因子、神经生长因子、白细胞介素(如il-1、il-11、il-3)、红细胞生长素、集落刺激因子、皮质醇、甲状腺素,或其任何组合;
-与细胞分化相关的细胞因子,例如oct3/4,sox2,klf4,c-myc,gata4,tsp1,β-甘油磷酸钠,地塞米松,维生素c,胰岛素,ibmx,吲哚美锌,血小板衍生生长因子bb(pdgf-bb),5-氮杂胞苷,或其任何组合;
-与细胞迁移相关的细胞因子,例如环磷酸腺苷,三磷酸磷脂酰肌醇,基质细胞衍生因子-1、n-钙粘蛋白,核因子κb,骨连接素,血栓素a2,ras,或其任何组合;和/或
-与细胞新陈代谢相关的细胞因子,例如胰岛素生长因子1、trip-br2、dkk-1、srankl、opg、tracp-5b、alp、sirt1(2-7)、pgc-1α,pgc-1β、opg、il-3、il-4、il-6、tgf-β、pge2、g-csf、tnf-α,或其任何组合。
在某些优选的实施方案中,所述药物活性成分为能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢的试剂。在某些优选的实施方案中,所述药物活性成分选自rhil-2、rhil-11、rhepo、ifn-α、ifn-β、ifn-γ、g-csf、gm-csf、rhuepo、stnf-r1、和rhtnf-α。
本发明的方法所制备的核-壳结构或生物砖包含的细胞的数量可以根据实际需要进行选择,而不受特别限制。例如,核-壳结构或生物砖可以包含1-106个细胞,例如1-105、1-104、1-5000、1-2000、1-1000、10-900、20-800、30-700、40-600、50-500、60-400、70-300、80-200、 10-100个细胞。在某些优选的实施方案中,核-壳结构或生物砖包含至少1、2、4、6、8、10、15、20、25、30、40、50、60、70、80、90、100、150、200、300、400、500、1000、或2000个细胞。在某些优选的实施方案中,核-壳结构或生物砖可以包含1-2、2-4、4-6、6-8、8-10、10-15、15-20、20-25、25-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-150、150-200、200-300、300-400、400-500、500-1000、1000-2000、1-10、2-10、2-5、5-10、10-20、20-30、30-50、2-25、25-50、2-50、50-100、100-200、50-250、250-500、500-2000、2-100、2-500、或2-2000个细胞。
不受理论限制,本发明的方法所制备的核-壳结构或生物砖可以包含任何种类和类型的细胞。在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖可以包含1、2、3、4、5、6、7、8、9、10、15、20、或更多种类型的细胞。例如,所述细胞可以为细菌、酵母、植物细胞或动物细胞,例如哺乳动物细胞,优选人细胞。优选地,所述细胞为粘附细胞,例如分化的粘附细胞或未分化的粘附细胞。优选地,所述细胞为多能干细胞。在某些优选的实施方案中,所述粘附细胞来源于选自下述的组织:结缔组织(例如,疏松结缔组织、致密结缔组织、弹性组织、网状结缔组织和脂肪组织)、肌肉组织(例如,骨骼肌、平滑肌和心肌)、泌尿生殖组织、胃肠组织、肺组织、骨组织、神经组织和上皮组织(例如,单层上皮和复层上皮)、内胚层来源的组织、中胚层来源的组织和外胚层来源的组织。
在某些优选的实施方案中,所述粘附细胞选自肌肉细胞(例如,骨骼肌细胞、心肌细胞、平滑肌细胞和成肌细胞)、结缔组织细胞(例如,骨细胞、软骨细胞、成纤维细胞以及分化为成骨细胞、软骨细胞或淋巴组织的细胞)、骨髓细胞、内皮细胞、皮肤细胞、上皮细胞、乳腺细胞、血管细胞、血细胞、淋巴细胞、神经细胞、许旺细胞、胃肠细胞、肝细胞、胰细胞、肺细胞、气管细胞、角膜细胞、泌尿生殖细胞、肾细胞、脂肪细胞、实质细胞、周细胞、间皮细胞、基质细胞、未分化的细胞(如干细胞和祖细胞)、内胚层来源的细胞、中胚层来源的细胞、外胚层来 源的细胞、癌来源的细胞,细胞系、诱导的多能干细胞(ips)、或其任何组合。
可根据实际需要来选择合适的细胞。例如,在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖包含心肌细胞,并且其用于产生心脏组织。在某些优选的实施方案中,所述核-壳结构或生物砖包含内皮细胞、平滑肌细胞和成纤维细胞,并且其用于产生血管。在某些优选的实施方案中,所述核-壳结构或生物砖包含内皮细胞,并且其用于产生皮肤组织。
本发明的方法所制备的核-壳结构或生物砖的尺寸可以根据实际需要进行选择,而不受特别限制。球形生物砖的尺寸通常可以通过其直径来进行明确定义。在严格定义的情况下,术语“直径”不能用于描述非球形的结构。然而,在本发明中,也使用术语“直径”来描述非球形的生物砖的尺寸。在此情况下,术语“直径”表示,与非球形的生物砖具有相同体积的球形核-壳结构或生物砖生物砖的直径。换言之,在本发明中,使用球形核-壳结构或生物砖的直径来描述具有相同体积的非球形的核-壳结构或生物砖的尺寸。因此,在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖的尺寸(即,本文所定义的直径)可以为20-2500μm,例如20-2300μm,25-2100μm,30-1900μm,40-1800μm,50-1700μm,60-1600μm,70-1500μm,80-1400μm,90-1300μm,100-1200μm,200-1000μm,300-800μm,400-600μm,100-500μm。在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖的尺寸(即,本文所定义的直径)可以为20-30、30-50、50-100、100-150、150-200、200-250、250-300、300-350、350-400、400-450、450-500、500-600、600-700、700-800、800-900、900-1000、1000-1500、1500-2000、20-50、20-100、100-200、200-400、500-600、600-800、800-1000、或1000-2000μm。在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖的尺寸(即,本文所定义的直径)为至少20、30、50、100、120、150、200、250、300、350、400、450、500、600、700、800、900、1000、1500、或2000μm。
在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖为固体或半固体。在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖为凝胶态。例如,本发明的方法所制备的核-壳结构或生物砖的核层和/或壳层可以为凝胶态。在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖包含水凝胶。在某些优选的实施方案中,所述水凝胶包含海藻酸盐,琼脂糖,明胶,壳聚糖,或其它水溶性或亲水性聚合物。
在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖能够减少细胞在生物打印过程中受到的机械损伤。例如,在某些优选的实施方案中,在使用相同生物打印机和相同打印条件的情况下,与将细胞直接用于生物打印相比,本发明的方法所制备的核-壳结构或生物砖能够减少细胞受到的机械损伤至少5%、10%、15%、20%、25%、30%、40%、50%、70%、80%、或90%。在某些优选的实施方案中,本发明的方法所制备的核-壳结构或生物砖能够在生物打印过程中保留核-壳结构或生物砖内的细胞的生物活性(例如,增殖、分化、迁移、分泌和/或新陈代谢)。在某些优选的实施方案中,核-壳结构或生物砖内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印后存活至少24小时。在某些优选的实施方案中,核-壳结构或生物砖内至少90%的细胞在生物打印后存活至少3小时、6小时、12小时、1天、2天、4天、或7天。在某些优选的实施方案中,核-壳结构或生物砖内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后能够增殖和/或分化。在某些优选的实施方案中,核-壳结构或生物砖内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后具有正常的新陈代谢。在某些优选的实施方案中,核-壳结构或生物砖内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后能够迁移。在某些优选的实施方案中,核-壳结构或生物砖内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后能够分泌。
本发明的生物砖的示意性结构示于图7中。如图1所示,本发明的 生物砖包括:细胞,其能够进行生长、增殖、分化或迁移;包裹所述细胞的核层,其由生物可降解材料制成,并且为细胞的生命活动提供所需的物质;和,封装所述细胞和核层的壳层,其位于最外侧,由生物可降解材料制成,并且为内部的核层和细胞提供力学保护。在优选的实施方案中,细胞可均匀分散于核层中,或者可以聚集在一起,位于核层内部。
在另一个方面,本发明提供了一种组合物,其包含本发明的生物砖。在某些优选的实施方案中,本发明的组合物包含生物砖和载体(所述载体优选包含生物粘合剂)。特别优选地,此类组合物可用作生物墨汁,用于生物打印。因此,在某些优选的实施方案中,本发明提供了一种生物墨汁,其包含本发明的生物砖,以及任选的载体(所述载体优选包含生物粘合剂)。在某些优选的实施方案中,所述载体包含生物粘合剂,或者由生物粘合剂组成。
在某些优选的实施方案中,所述载体(例如生物粘合剂)及其降解产物对于细胞是无毒的,和/或对于宿主是非免疫原性的。在某些优选的实施方案中,所述载体(例如生物粘合剂)包含生物可降解材料。在某些优选的实施方案中,所述载体(例如生物粘合剂)中的生物可降解材料是生物相容性的。
在某些优选的实施方案中,所述载体(例如生物粘合剂)中的生物可降解材料的降解能够提供维持或促进生物砖内的细胞的生命活动的物质。在某些优选的实施方案中,降解产物为小分子化合物,例如有机酸、单糖(例如葡萄糖)、寡糖、氨基酸、脂质等。此类降解产物可参与到细胞的新陈代谢活动中(例如用于合成细胞外基质),用于合成细胞外基质或转化为活动所需的能量。
在某些优选的实施方案中,所述载体(例如生物粘合剂)中的生物可降解材料是天然存在的(例如来源于动植物的天然存在的生物可降解材料,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合),人工合成的,重组产生的,或者其任何组合。
在某些优选的实施方案中,所述载体(例如生物粘合剂)中的生物可降解材料是天然存在的可降解聚合物。优选地,所述可降解聚合物选自胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,明胶,葡聚糖,弹性蛋白,以及其任意组合。
在某些优选的实施方案中,所述载体(例如生物粘合剂)中的生物可降解材料是合成的可降解聚合物。此类可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸(polyaminoacid),可降解性聚氨酯,以及其任何组合。
在某些优选的实施方案中,所述载体(例如生物粘合剂)中的生物可降解材料选自胶原、纤维蛋白、壳聚糖、海藻酸盐、淀粉、透明质酸、层粘连蛋白、弹性蛋白、明胶、聚氨基酸、琼脂、葡聚糖、甲基纤维素、聚乙烯醇、聚丙烯酸及其衍生物(例如聚丙烯酸或其酯、聚甲基丙烯酸或其酯)、聚丙烯酰胺、聚n-取代丙烯酰胺或其任何组合。在某些优选的实施方案中,所述载体(例如生物粘合剂)包含海藻酸钠。
在某些优选的实施方案中,与生物砖的核层或壳层相比,所述载体(例如生物粘合剂)以不同的浓度包含相同的生物可降解材料,或者以不同的重量比包含相同的生物可降解材料的组合。在某些优选的实施方案中,与生物砖的核层或壳层相比,所述载体(例如生物粘合剂)包含不同的生物可降解材料。
在某些优选的实施方案中,所述载体还包含水,无机盐,ph缓冲剂,稳定剂,防腐剂,或其任何组合。
在某些优选的实施方案中,所述载体(例如生物粘合剂)促进生物砖在构建体(例如三维构建体,组织前体,或组织)上的安置,和/或将生物砖固定在构建体(例如三维构建体,组织前体,或组织)上。
在某些优选的实施方案中,载体(例如生物粘合剂)为液体或半液体(例如凝胶)。在某些优选的实施方案中,所述载体(例如生物粘合剂)的粘度为1-1000pas,例如30-160pas。在某些优选的实施方案中,所述 载体(例如生物粘合剂)的粘度为约1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、50、80、100、200、300、400、500、800、或1000pas。在某些优选的实施方案中,所述载体(例如生物粘合剂)的粘度为1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、10-12、12-14、14-16、16-18、18-20、20-25、25-30、30-50、50-80、80-100、100-200、200-300、300-400、400-500、500-800、或800-1000、1-3、3-8、8-16、3-10、10-20、20-50、50-160pas、或30-160pas。
发明的有益效果
与现有技术相比,本发明的技术方案具有以下有益效果:
(1)本发明的方法不涉及复杂步骤和仪器、操作性和应用性强,可适用于由各种芯材制备的核-壳结构。
(2)本发明的方法可以在不使用固化剂的情况下利用疏水作用使液滴成型。
(3)通过本发明的方法制备的核-壳结构,产品的制备效率高。当所制备的核-壳结构用于包裹细胞时,充分和完整包裹的壳结构给细胞提供了有效的力学保护,有效地减少或避免细胞遭受外界的机械损伤/力学损伤(例如,在生物打印过程中),从而确保了细胞在打印过程中存活率。
(4)本发明的方法可通过精确调节和控制所吸取的芯材和壁材的量,有效控制核-壳结构的尺寸、核壳层数以及壳层厚度。因为这种方法的准确性和重复性较好,所以可以批量化制备产品。
(5)本发明的方法由于无需施加振动或电压脉冲即可实现小的液滴尺寸,从而可以兼顾细胞液滴尺寸和细胞活性,例如能够制备粒径低至约100μm的核-壳结构。
具体实施方式
现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
实施例中未指明其来源的试剂、试剂盒或仪器均为市场上商购可 得的常规产品。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。
实施例1超疏水表面的制备
在本发明的方法中使用的超疏水表面可以采用下列方法制备:
在超净室内将u型底孔板用酒精、丙酮浸泡或擦洗进行清洁除尘后,用浸泡、喷枪喷涂等方式将超疏水涂料涂布至孔板内壁以形成超疏水涂层,然后在恒温箱加热烘干。
在本发明的方法中使用的超疏水表面也可以采用下列方法制备:
在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置于过氧化氢/浓硫酸溶液(30%(v/v)h2o2:h2so4=1:3)中,于80℃反应1小时,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%(v/v)的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(sigma)溶液中12h,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
在本发明的方法中使用的超疏水表面也可以采用其它本领域技术人员所熟知的制备超疏水表面的方法制备得到,或者也可通过商业购买得到。
实施例2.细胞生存率/活力检测方法
在本实验中,通过染色法检测了核-壳结构或生物砖内的细胞活性。所使用的试剂如下:
钙黄绿素caam(公司:invitrogen,货号:c3100mp),其用于活细胞染色,能够对细胞浆进行标记,显示绿色荧光。使用方法:用10uldmso溶解50ug钙黄绿素,然后添加10mlpbs并混匀。所获得的溶液中钙黄绿素的终浓度为5mmol/l。
碘化丙啶核酸染料(公司:invitrogen,货号:p1304mp),其用于死细胞染色,能够对细胞核进行标记,显示红色荧光。使用方法:用双蒸水将碘化丙啶核酸染料稀释至1mg/ml,用作储存液;然后用pbs 将储存液以1:3000的比例稀释至终浓度500nm,用作工作液。
染色方法如下:
将所制备的核-壳结构或生物砖置于1mlcaam中,于37℃孵育1h;然后加入1ml碘化丙啶核酸染料,染色15min。之后,使用激光共聚焦显微镜观察生物砖的染色结果。高亮点为红色荧光(代表死细胞),低亮点为绿色荧光(代表活细胞)。使用imageproplus软件,对红色和绿色荧光进行颜色聚类统计,并计算红光斑和绿光斑的数量、面积、平均光密度、直径、累计光密度,由此确定红、绿像素点的个数,并计算细胞生存率。细胞生存率=活细胞数量/(活细胞数+死细胞数)。
实施例3.400μm胶原-聚赖氨酸核壳结构的制备
本实施例通过本发明的方法制备尺寸约为400μm、包裹细胞的核-壳结构,其步骤如下:
1、制备u型底超疏水孔板:在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置入过氧化氢/浓硫酸溶液(30%(v/v),h2o2:h2so4=1:3)中,80℃反应1小时,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(sigma)溶液中12h,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
2、制备含细胞的胶原溶液:将120μlnaoh溶液(1mol/l)与750μli型胶原(4mg/ml)混合,然后向其中加入130μl经trackercm-dil标记的大鼠msc细胞悬液(细胞浓度为1x105个/ml,悬浮于pbs中),获得混合了细胞的胶原溶液。
3、制备聚赖氨酸-fitc溶液:将经fitc(绿色荧光)标记的聚赖氨酸(sigma,数均分子量mn为150,000-300,000)溶于ph7.2的dmem高糖培养基,得到浓度为0.05wt%的聚赖氨酸溶液。
4、胶原滴加(形成核层结构):采用能够吸取和排出纳升级液体的电子式吸取装置(例如eppendorfxplorer0.5-10ul或transferpetteelectronic0.5-10ul,借助他们的分液功能,每分液量最低可达到0.1μ l;或者采用sge自动进样器1μl或0.5μl,可分别实现10次和5次的0.1μl液体滴定,特殊地,可选用锥形特质针头进行滴定,提高精确度。)精密吸取0.1μl步骤2制备的i型胶原溶液,滴入步骤1制备的u型底超疏水孔板中,形成液滴,在37℃恒温保持30min,使其成型。
5、滴加聚赖氨酸-fitc溶液(壳层结构):更换吸头后,精密吸取0.5μl步骤3制备的聚赖氨酸-fitc溶液,在超疏水孔板中央位置将其滴入步骤4中成型的核层表面,反应10min,以形成核-壳结构。
6、从孔板中收集所制备的核-壳结构,并使用激光共聚焦显微镜来观察所制备的核-壳结构以及通过实施例2描述的方法测试细胞的生存率。
结果:
使用该方法得到的核-壳结构具有单层壳结构,其中核层结构通过温度控制的方式使核层材料胶原成型。所制备得到的核-壳粒径为约400μm(图6a,标尺为100μm)。在图6a中,绿色部分代表该核-壳结构的壳层。从图中可以看出,壁材(壳层)能够均匀包裹在芯材(核层)表面。所制备得到的核-壳结构中细胞的细胞生存率为97%以上。
实施例4.800μm聚氨酯-海藻酸钠核壳结构的制备
本实施例通过本发明的方法制备尺寸约为800μm、包裹细胞的核-壳结构,其步骤如下:
1、制备u型底超疏水孔板:在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置入过氧化氢/浓硫酸溶液(30%(v/v),h2o2:h2so4=1:3)中,80℃反应1小时,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%(v/v)的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(sigma)溶液中12h,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
2、制备含细胞的聚氨酯溶液:
在装有机械搅拌、温度计的三口烧瓶中,加入20g聚己内酯(pcl2000,sigma)和7.5g聚乙二醇(peg1450,sigma)。脱水2h后, 冷却到70℃。在n2保护下,将9.99g异氟尔酮二异氰酸酯(ipdi,sigma)和占原料总量0.5wt‰的催化剂辛酸亚锡(sigma)加入反应瓶,70-75℃反应1h。接着,将1.01g扩链剂(1,4-丁二醇,bdo)加入反应体系,60-65℃反应2h。然后,将所获得的预聚物倒入高速搅拌的l-赖氨酸(1.64g)水溶液中乳化,同时,将稀释的氢氧化钠(0.45g)溶液逐滴滴入乳化物中以中和l-赖氨酸中的羧基。最后,在室温下高速搅拌乳化2h,得到聚氨酯水乳液。
取850μl聚氨酯水乳液与150μl血管内皮细胞悬液(细胞浓度为1x105个/ml,悬浮于pbs中)混合,使细胞均匀分散,得到1ml混合了细胞的聚氨酯水乳液。
3、制备海藻酸钠溶液:将海藻酸钠溶于去离子水中,得到浓度为2wt%的海藻酸钠溶液。
4、聚氨酯水乳液滴加(形成核层结构):采用能够吸取和排出纳升级液体的电子式吸取装置(例如eppendorfxplorer0.5-10ul或transferpetteelectronic0.5-10ul,借助他们的分液功能,每分液量0.25μl;或者采用sge自动进样器1μl,可实现4次液体滴定,特殊地,可选用锥形特质针头进行滴定,提高精确度。)精密吸取0.25μl步骤2制备的聚氨酯水乳液,滴入步骤1制备的u型底超疏水孔板中,形成液滴。
5、滴加海藻酸钠溶液(壳层结构):更换吸头后,精密吸取0.5μl步骤3制备的海藻酸钠溶液,在超疏水孔板中央位置将其滴入步骤4中液滴表面,反应10min,以形成核-壳结构。
6、氯化钙滴加:向步骤5中反应后的核-壳结构表面滴入0.5μlcacl2溶液(0.1mol/l),反应5min。
7、从孔板中收集所制备的核-壳结构,并使用显微镜来观察所制备的核-壳结构以及通过实施例2描述的方法测试细胞的生存率。
结果:
使用该方法制备得到的核-壳结构具有单层壳结构,其中核层材料聚氨酯溶液在超疏水板上以液滴形式存在,其无需恒温或其它额外成 型步骤。直接在该液滴表面滴加壳层材料海藻酸钠溶液后,在壳层材料表面再滴加氯化钙溶液(0.1m)使得该核-壳结构成型。制备得到的核-壳粒径为约800μm(图6b,标尺为100μm)。在图6b中,高亮部分代表核-壳结构的壳层。从图中可以看出,壁材(壳层)均匀包裹在芯材(核层)表面。所制备得到的核-壳结构中细胞的生存率为98%以上。
实施例5.100μm胶原-聚赖氨酸-海藻酸钠多层核壳结构的制备
本实施例通过本发明的方法制备尺寸约为100μm、包裹细胞的多层核-壳结构,其步骤如下:
1、制备u型底超疏水孔板:在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置入过氧化氢/浓硫酸溶液(30%(v/v),h2o2:h2so4=1:3)中,80℃反应1小时,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(sigma)溶液中12h,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
2、制备含细胞的胶原溶液:将120μlnaoh溶液(0.1m)与750μli型胶原(4mg/ml)混合,然后向其中加入130μl血管内皮细胞悬液(细胞浓度为1x105个/ml,悬浮于pbs中),获得混合了细胞的胶原溶液。
3、制备海藻酸钠溶液:将海藻酸钠溶于dmem高糖培养基中,得到浓度为0.03wt%的海藻酸钠溶液。
4、制备聚赖氨酸溶液:将聚赖氨酸(sigma,数均分子量mn为150,000-300,000)溶于ph7.2的dmem高糖培养基,得到浓度为0.05wt%的聚赖氨酸溶液。
5、胶原滴加(形成核层结构):采用能够吸取和排出纳升级液体的电子式吸取装置(例如微流控芯片装置)精密吸取2nl步骤2制备的i型胶原溶液,滴入步骤1制备的u型底超疏水孔板中,形成液滴,在37℃恒温保持30min,使其成型。
6、滴加聚赖氨酸溶液(第一壳层结构):更换吸头后,精密吸取0.1μl步骤4制备的聚赖氨酸溶液,在超疏水孔板中央位置将其滴入步骤5中成型的核层表面,反应10min,以形成核-壳结构。
7、清洗步骤:滴加入1μl无血清dmem培养基清洗2遍,去掉多余的聚赖氨酸溶液溶液。
8、滴加海藻酸钠溶液(第二壳层结构):吸取1μl步骤3制备的海藻酸钠溶液,在超疏水孔板中央位置将其滴至步骤7中经清洗的核-壳结构的表面,然后反应10min。
9、从孔板中收集所制备的核-壳结构,并使用显微镜来观察所制备的核-壳结构以及通过实施例2描述的方法测试细胞的生存率。
结果:
使用该方法得到的核-壳结构具有双层壳结构,其中核层结构通过温度控制的方式使核层材料成型,所获得的核-壳结构的粒径为约100μm。
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!
- 磁性胶体核壳结构γ‑Fe2O3及Fe3O4的制备方法与流程
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含椰子油的抗氧化核壳结构纳米改性变压器油及其制备方法与制造工艺
- 磁性胶体核壳结构γ‑Fe2O3及Fe3O4的制备方法与流程
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺